Электрохимия, 2019, T. 55, № 9, стр. 1147-1152
Определение скорости коррозии стали AISI 304 в растворах HCl методом измерения омического сопротивления исследуемого образца
К. В. Рыбалка a, *, Л. А. Бекетаева a, А. Д. Давыдов a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
11907 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: mamaison2000@yandex.ru
Поступила в редакцию 26.09.2018
После доработки 24.12.2018
Принята к публикации 07.02.2019
Аннотация
Методом измерения омического сопротивления исследуемых образцов стали AISI 304 определена зависимость скорости ее коррозии от времени в 0.1–2 М растворах HCl в условиях свободного доступа воздуха. В 0.5 М растворе HCl рассмотрено влияние ингибиторов: тиомочевины и полиэтиленполиамина на скорость коррозии стали AISI 304. Показано, что ингибирующее воздействие тиомочевины на скорость коррозии стали AISI 304 меняется в зависимости от времени ее пребывания в растворе.
ВВЕДЕНИЕ
Нержавеющая сталь AISI 304 широко применяется в самых разных областях промышленности и в различных условиях [1, 2]. Нержавеющие стали стойки во многих средах. Среди небольшого количества исключений находится соляная кислота [2]. Для снижения скорости коррозии нержавеющей стали в кислых средах, в частности в HCl, применяются ингибиторы, например [3, 4]. Тиомочевина используется в электрохимических исследованиях как эффективный ингибитор металлов в кислой среде [5–9].
В настоящей работе для измерения скорости коррозии стали AISI 304, в том числе в присутствии ингибиторов, был применен метод измерения омического сопротивления исследуемых образцов при их экспозиции в коррозионной среде. Этот метод известен давно, используется в промышленности, однако публикаций по применению этого метода в научной литературе очень немного.
Определение скорости коррозии этим методом основано на измерении изменения электрического сопротивления исследуемого образца, имеющего вид тонкой металлической ленты или проволоки, погруженной в агрессивную среду. Изменение сопротивления пересчитывается в изменение характерного размера исследуемого образца (диаметра проволочного образца). При этом скорость коррозии может рассчитываться непосредственно в мкм/сут и нет необходимости определять ее пересчетом, например из мкА/см2. При анализе электрического сопротивления исследуемых образцов в случае образования на их поверхности пассивирующих слоев следует учитывать возможный вклад их проводимости в результаты измерений. Взвешивание образца до начала и в конце опыта позволяет проконтролировать достоверность полученных результатов и дает дополнительные сведения о массе прокородировавшего за время эксперимента металла.
В [10] метод измерения омического сопротивления был использован для мониторинга скорости коррозии стальной арматуры в различных условиях эксплуатации. Сенсоры коррозии, основанные на использовании тонких металлических пленок, позволяют согласно [11] определять изменение толщины образца, составляющее одну миллионную дюйма. Методом измерения электрического сопротивления была оценена скорость коррозии малоуглеродистой стали, меди, бронзы, алюминия в водных растворах этиленгликоля с несколькими ингибиторами [12].
Этим же методом была определена скорость коррозии титана и исследован процесс его депассивации в растворах серной и соляной кислоты [13] и проведен мониторинг процесса коррозии медных контактов под влиянием смазывающих жидкостей [14]. Метод измерения электрического сопротивления позволяет осуществлять непрерывное наблюдение за коррозионным поведением одного и того же исследуемого образца в течение длительного промежутка времени, не оказывая на него воздействия, например, поляризацией образца от внешнего источника тока, как это делается при использовании многих электрохимических методов, например, широко используемого метода тафелевской экстраполяции. Существенно, что применение этого метода не связано с необходимостью использования каких-либо представлений о механизме, протекающих на поверхности образца электрохимических реакций.
Цель настоящей работы – исследование коррозионного поведения стали AISI 304 в растворах HCl в течение продолжительного времени, оценка корректности прогнозирования скорости коррозии на отрезке времени, существенно превышающем время измерения, оценка эффективности действия ингибиторов коррозии в течение всего времени экспозиции исследуемых образцов.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
В настоящей работе измерена скорость коррозии стали AISI 304 (08Х18Н10) в растворах HCl, в том числе в присутствии добавок тиомочевины и полиэтиленполиамина в раствор. Для определения скорости коррозии были использованы два метода: метод определения омического сопротивления образца в процессе коррозии и весовой метод. Измерение сопротивления образца в процессе его коррозии позволяет наблюдать за растворением образца и влиянием на него ингибиторов в режиме реального времени.
На рис. 1 приведена схема установки для измерения сопротивления исследуемых образцов металлов. От генератора постоянного тока типа БП‑49 ток заранее заданной величины через одинаковые резисторы 4 (омическое сопротивление которых, по крайней мере, на три порядка превышает сопротивление исследованных нами образцов) поступает на исследуемый образец 3 (стальная проволока диаметром 500 мкм) и на вспомогательный резистор 1. Исследуемый образец 3 находится в стеклянном сосуде, заполненном электролитом. Элементы 2 – это изолированные концы исследуемого образца, обеспечивающие его электрический контакт с другими элементами схемы. Резистор 1 полностью аналогичен исследуемому образцу, но расположен на внешней стороне сосуда с электролитом. Как видно из рисунка, токи, проходящие через элементы 1 и 3, протекают в противоположных направлениях, благодаря чему разности потенциалов на них компенсируют друг друга. Это обстоятельство позволяет измерять небольшие изменения в сопротивлении исследуемого образца, обусловленные уменьшением его диаметра в процессе коррозии. Разность потенциалов измерялась с помощью универсального вольтметра В7-21А. Зная изменение разности потенциалов Δu(t) и ток i, легко определить изменение сопротивления образца ΔR(t) = Δu(t)/i, находящегося в электролите.
Пусть L – длина исследуемого образца, r0 – его исходный радиус, ρ – удельное сопротивление металла, r(t) – радиус в процессе растворения. Сопротивление исследуемого образца $R = \frac{{\rho L}}{{\pi r{{{(t)}}^{2}}}}.$ Процесс коррозии приводит к уменьшению радиуса исследуемого образца, росту его сопротивления и, соответственно, к увеличению измеряемой разности потенциалов.
Изменение сопротивления образца, обусловленное коррозией, равно
Отсюда легко получить выражение для радиуса образца от времени:
Все измерения проведены в растворе соляной кислоты марки “ос. ч.” в дистиллированной воде в открытом сосуде при свободном доступе воздуха при температуре 25°С. В качестве ингибиторов использованы тиомочевина и полэтиленполиамин (ПЭПА). Проволоку из нержавеющей стали AISI 304, на которой были проведены измерения, перед опытом обезжиривали этиловым спиртом и промывали дистиллированной водой, после чего погружали в электролит.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 приведена зависимость толщины растворенного слоя стали AISI 304 от времени ее нахождения в растворах HCl при свободном доступе воздуха для четырех концентраций кислоты.
Рис. 2.
Зависимость толщины растворенного слоя стали AISI 304 от времени нахождения образцов в растворе HCl: 1 – 0.1; 2 – 0.5; 3 – 1; 4 – 2 М.

Как следует из рисунка, при концентрации HCl, равной 0.1 моль/л, сталь AISI 304 практически не растворяется. Это подтверждают проведенные нами одновременно измерения скорости коррозии образца в этих условиях методом взвешивания. В более концентрированных растворах HCl для всех концентраций кислоты наблюдается активное увеличение толщины слоя растворенного металла во времени. Некоторое увеличение наклона кривых при увеличении длительности нахождения образцов в растворе кислоты свидетельствует о возрастании скорости их коррозии во времени. Дифференцирование данных, приведенных на рис. 2, по времени позволяет получить величину скорости коррозии (рис. 3).
Рис. 3.
Зависимость скорости коррозии образцов от времени их выдержки в растворе HCl: 1 – 0.1; 2 – 0.5; 3 – 1; 4 – 2 М.
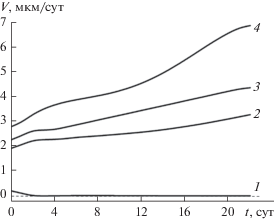
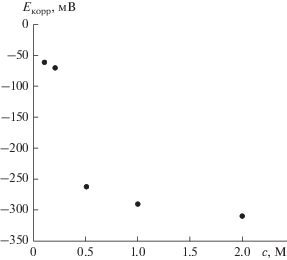
Как следует из рис. 3 и 4, увеличение концентрации HCl приводит к сдвигу потенциала коррозии образцов AISI 304 в сторону отрицательных значений и к росту скорости коррозии образцов.
Рис. 4.
Зависимость коррозионного потенциала стали AISI 304 от концентрации раствора HCl после 24 ч выдержки образцов в растворе.
Как следует из рис. 5, зависимость скорости коррозии AISI 304 в растворах HCl от концентрация кислоты линейна. Вместе с тем эта зависимость не прямопропорциональна. При увеличении концентрации кислоты в 4 раза скорость коррозии увеличивается в зависимости от времени пребывания образца в растворе, в пределах 1.5–2 раз. Такое влияние концентрации кислоты на скорость коррозии стали AISI 304 в условиях проведения опыта со свободным доступом воздуха обусловлено, очевидно, тем, что коррозия исследуемой стали происходит с участием двух деполяризаторов – растворенного кислорода и ионов водорода. В [15] нами было показано, что в 0.5 М растворе HCl существенный вклад в скорость коррозии AISI 304 в аналогичных условиях вносит восстановление кислорода.
Рис. 5.
Зависимость скорости растворения образцов стали AISI 304 от концентрации раствора HCl для разного времени их выдержки в растворе: 1 – 5; 2 – 10; 3 – 15; 4 – 20 суток.

Толщина растворенного слоя и масса растворенного металла на единицу поверхности связаны простым соотношением $\Delta m = 0.1\rho h,$ где h – толщина растворенного слоя в мкм, ρ – плотность металла в г/см3, Δm – масса растворенного металла в мг/см2.
Исследуемый образец стали AISI 304 был взвешен до и после опыта. Уменьшение массы образца за время его нахождения в течение 30 дней в 0.5 M растворе HCl, полученное взвешиванием на аналитических весах ACCULAB ALC-210d4, составило 430.9 мг. Изменение его массы, рассчитанное из данных, полученных методом измерения сопротивления, составило 431.4 мг. Сопоставление этих данных свидетельствует о достоверности результатов, полученных методом определения омического сопротивления образца. Аналогичные проверки были выполнены для других растворов кислоты, расхождение не превышало 5%.
Массу растворенного металла за год обычно используют в качестве критерия его коррозионной устойчивости. Для этого часто используют результаты экспериментов, выполненных в течение нескольких часов или даже минут, как, например, при использовании экстраполяции тафелевских кривых. Данные, приведенные на рис. 3, показывают, что в случае стали AISI 304 такие оценки, полученные на основании измерений, проведенных после пребывания образца в электролите в течение одного дня и 20 дней, существенно отличаются. Это важно, так как при прогнозировании времени достижения допустимой величины коррозии часто используется экстраполяция коррозионных данных, полученных в течение некоторого, довольно короткого периода времени, на более длительные промежутки времени, значительно превышающие время проведения испытаний.
На рис. 6 показано влияние тиомочевины на скорость растворения стали AISI 304.
Рис. 6.
Зависимость скорости растворения стали AISI 304 от времени нахождения образца в 0.5 М растворе HCl: 1 – чистый раствор, 2 – 0.5 М раствор HCl + + 0.2% тиомочевины.

Как следует из рис. 6, введение тиомочевины приводит к снижению скорости растворения образца. Ингибирующее действие тиомочевины на стали AISI 304 проявляется лишь через несколько дней после нахождения образца в электролите. Скорость растворения снижается по сравнению с чистым раствором HCl, и в течение нескольких дней практически не зависит от времени. Последующий рост скорости растворения образца, по-видимому, обусловлен выработкой ингибитора-тиомочевины.
В электрохимических исследованиях, особенно прикладных, для изоляции токоподводов, ведущих к исследуемым электродам, часто используют эпоксидный клей. При этом исследуемый электрод вместе с покрытым клеем токоподводом погружают в электролит. При приготовлении клея в качестве отвердителя обычно применяют полиэтиленполиамин. Известно, что ПЭПА входит в состав многих коммерческих ингибиторов коррозии, которые демонстрируют высокую эффективность в подавлении растворения сталей в агрессивных средах [16–18].
Для оценки возможного влияния эпоксидного клея на результаты электрохимических исследований нами было рассмотрено влияние ПЭПА на коррозию стали AISI 304 в 0.5 М HCl. Исследования, проведенные методом взвешивания, показали, что жидкая эпоксидная смола, введенная в электролит, практически не оказывает влияния на скорость растворения стали. Введение ПЭПА, оказывает ингибирующее влияние на скорость коррозии. Коэффициент эффективности ингибирования kи отвердителем ПЭПА
На рис. 7 приведены зависимости скорости растворения стали от времени в 0.5 М растворе HCl (кривая 1) и в том же растворе, в который через 7 дней после выдержки в нем образца был добавлен ПЭПА в концентрации 0.01% (кривая 2).
Рис. 7.
Зависимость скорости растворения стали AISI 304 от времени нахождения образца в 0.5 М растворе HCl: 1 – чистый раствор, 2 – добавка полиэтиленполиамина 0.01%.

Как видно из рис. 7, даже небольшая добавка полиэтиленполиамина приводит к уменьшению скорости коррозии стали в 0.5 М растворе HCl. Снижение скорости коррозии наступило сразу же после введения в раствор ПЭПА, и он сохранял свое действие, в отличие от тиомочевины, в течение всего времени проведения эксперимента. Полученные результаты показывают, что использование эпоксидного клея для герметизации неработающих частей исследуемых образцов может привести к искажению результатов.
ЗАКЛЮЧЕНИЕ
Методом измерения омического сопротивления определена скорость коррозии стали AISI 304 в растворах HCl в условиях свободного доступа воздуха. Она растет при увеличении концентрации растворов кислоты и времени нахождения образцов в растворе. Вид зависимости скорости коррозии образцов AISI 304 от времени их пребывания в электролите изменяется при введении в электролит ингибитора – тиомочевины. После первоначального снижения скорости коррозии при введении тиомочевины наблюдается ее последующий рост, что свидетельствует о выработке ингибитора. В разбавленных растворах HCl сталь AISI 304 практически не корродирует. Характер зависимости скорости коррозии образца от времени его нахождения в электролите важен для оценки корректности ее прогнозирования на отрезке времени, превышающем время проведения эксперимента. Результаты исследования влияния тиомочевины на скорость коррозии стали AISI 304 показывают, что метод измерения омического сопротивления может служить простым и эффективным способом тестирования ингибиторов и оценки длительности их ингибирующего воздействия.
Список литературы
Пахомов, В.С., Шевченко, А.А. Химическое сопротивление материалов и защита от коррозии. СПб.: ЦОП “Профессия”, 2016. С. 153. [Pakchomov, V.S. and Shevchenko, A.A. Materials chemical resistance and corrosion protection, SPb “Professiya”(in Russian), 2016. p. 153.]
Улиг, Г.Г., Реви, Р.У. Коррозия и борьба с ней. Введение в коррозионную науку и технику. Л.: Химия. 1989. С. 326. [Uhlig, H.H. and Revie, R.W. Corrosion and corrosion control. An introduction to corrosion science and engineering. N.Y., John Wiley & Sons, 1985].
Albrimi, Y.A., Addi, A.A., Douch, J., Souto, R.M., and Hamdani, M., Inhibition of the pitting corrosion of 304 stainless steel in 0.5 M hydrochloric acid solution by heptamolybdate ions, Corrosion Science, 2015, vol. 90, p. 522.
Kumar, A., Kumar, N., Kumar Singh, A. and Das, G., Corrosion Behaviour of Stainless Steel Grade 304 in 1 M HCl, Intern. J. Innovative Research and Development, 2014, vol. 3, p. 340.
Yasair, Suliman Al-Faiyaz, Inhibitory effect of thiourea on corrosion of BSK46 microalloyed steel, J. Appl. Sciences, 2007, vol. 7, p. 3242.
Singh, I., Inhibition of Steel Corrosion by Thiourea Derivatives, Corrosion, 1993, vol. 49, no. 6, p. 473.
Chandrasekhara Pillai, K. and Nasaryan, R., Inhibition of corrosion of iron in acids by thiourea and derivatives, J. Electrochem. Soc., 1978, vol. 125, no. 9, p. 1393.
Kuang Fei, Shi Taihe, Wang Jia, and Fang Jia, Microencapsulation technology for thiourea corrosion inhibitor, J. Solid State Electrochem, 2009, vol. 13, p. 1729.
Donnely, B., Downie, T.C., and Grzeskourak, R., A study of inhibiting properties of some derivatives of thiourea, Corros. Sci., 1974, vol. 14, no. 10, p. 597.
Suganya, S., Jeyalakshmi, R., and Rajamane, N.P., Corrosion Rate Monitoring of Mild Steel in Underground Soil at Different Depths Using Electrical Resistance (ER) Probe Technique, Orient. J. Chem., 2017, vol. 33, no. 2, p. 937.
Roller, D. and Scott, W.R., Detecting and measuring corrosion using electrical resistance techniques, Corrosion Technology, March 1961, p. 71.
Cessna, J.C., Electrical resistance method for studying corrosion inhibitors in automo- tive anti-freezes, Corrosion. 1959, vol. 15, no. 11, p. 67.
Azumi, K., Nakajima, M., Okamoto, K., and Seo, M., Dissolution of Ti wires in sulphuric acid and hydrochloric acid solutions, Corrosion Science 2007, vol. 49, p. 469.
Hunt, G.J., Gahagan, M.P., and Peplow, M.A., Wire resistance method for measuring the corrosion of copper by lubricating fluids, Lubrication Sci., 2017, vol. 29, p. 279.
Рыбалка, К.В., Бекетаева, Л.А., Давыдов, А.Д. Катодная составляющая коррозион- ного процесса: поляризационная кривая с двумя тафелевскими участками. Электрохимия. 2018. Т. 54. С. 523. [Rybalka, K.V., Beketaev, L.A., and Davydov, A.D., Cathodic component of corrosion process: polarization curve with two Tafel portion, Russ. J. Electrochem, 2016, vol. 52, p. 456].
Загидуллин, Р.Н., Муратов, М.М., Адаменко, А.А., Семёнова, Л.Г. Способ получения ингибитора коррозии, Патент RU 2326990 C2, Бюл. № 17, 2008 [Zagidulin, R.N, Muratov, M.M., Adamenko, A.A., and Semenova, L.G., A method of producing corrosion inhibitor. Patent RU 2326990 C2. Bul.17. 2008.]
Даминев, Р.Р., Исламутдинова, А.А., Иванов, А.Н., Хамзин, И.Р. Синтез ингибирующего состава для предотвращения коррозии нефтепромыслового оборудования, Международный научный форум “Бутлеровское наследие-2015”. Казань 7–22 мая 2015. [Daminev, R.R., Islamutdinova, A.A., Ivanov, A.N., and Khamzin, I.R., Synthesis of the inhibitory composition to prevent corrosion of oilfield equipment. International scientific forum “Butlerov heritage-2015”, Kazan 7–22 may 2015.]
Брынза, А.П., Герасютина, Л.Н., Федаш, В.П., Байбарова, Е.Я. Полиэтиленполиамин – ингибитор коррозии стали в соляной кислоте. Защита металлов. 1983. Т. 19. С. 961. [Brinza, A.P., Geraciytina, L.N., Fedash, V.P., and Baybarova, E.Ya., Polyethylene polyamine – inhibitor of steel corrosion in hydrochloric acid, Metal Protection, 1983, vol. 19, p. 961].
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия



