Электрохимия, 2019, T. 55, № 9, стр. 1099-1110
Кислородная реакция на углеродных материалах различной структуры в электролитах на основе перхлората лития и апротонных растворителей
В. А. Богдановская a, *, Н. В. Панченко b, М. В. Радина a, В. Н. Андреев a, О. В. Корчагин a, О. В. Трипачев a, В. Т. Новиков b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
Москва, Миусская пл., 9, Россия
* E-mail: bogd@elchem.ac.ru
Поступила в редакцию 27.08.2018
После доработки 29.01.2019
Принята к публикации 30.03.2019
Аннотация
Необходимость исследования углеродных материалов, отличающихся по величине поверхности и структуре, обусловлена тем, что эти материалы вплоть до настоящего времени используются при создании положительного электрода литий-кислородных источников тока (ЛКИТ). В модельных условиях проведено исследование влияния ряда факторов, определяющих эффективность кислородной реакции на положительном электроде. Среди них: свойства электролита на основе диметилсульфоксида (ДМСО) и ацетонитрила (АН), структура углеродного материала(УМ): ХС72, Super P и углеродные нанотрубки (УНТ) и связанные с ней транспортные процессы, которые зависят от массы (толщины) активного слоя (АС) на электроде и плотности тока поляризации, которая определяет эффективность кислородной реакции на данном углеродном материале. Показано, что величина электрохимически активной поверхности (SЭАП) увеличивается с ростом удельной поверхности, которая определяется пористой структурой УМ, его массой на электроде, свойствами растворителя и скоростью проведения реакции. Толщина АС и величина плотности тока должны быть выбраны для каждого УМ в зависимости от его структуры. При этом, вся поверхность АС должна быть электрохимически доступна и обеспечивать образование и последующее разложение пероксида лития. Более высокая обратимость кислородной реакции наблюдается в электролите на основе ДМСО (высокое донорное число), где реакция образования пероксида лития протекает через диспропорционирование в объеме раствора c образованием частиц Li2O2 неупорядоченной (вероятно, тороидальной) структуры, что облегчает обратный процесс его анодного разложения и согласуется с литературными данными [1]. В АН (низкое донорное число) реакция восстановления кислорода протекает в адсорбированном состоянии с образованием LiО2, который диспропорционирует на поверхности электрода с образованием изолирующей пленки пероксида лития, которая окисляется с большим перенапряжением. По совокупности параметров наиболее эффективны для реализации кислородной реакции в электролите на основе ДМСО УНТ, имеющие большой объем мезопор для транспорта реагентов, большую величину электрохимически активной поверхности для накопления Li2O2 и обеспечения высоких габаритных характеристик.
ВВЕДЕНИЕ
Углеродные материалы широко используются при изготовлении положительного электрода в апротонных Li–O2-системах благодаря таким свойствам, как хорошая электропроводность, коррозионная стабильность, возможность целенаправленно изменять пористую структуру и величину поверхности при относительно низкой стоимости [2–14]. Круг таких материалов достаточно широк и включает: нанотрубки [3, 4], графены [5, 6], нановолокна [7], сажи [8], стеклоуглерод [9, 10] и другие. Кроме того, каталитическая активность УМ может быть увеличена за счет обработки и модифицирования их поверхности, включая допирование адатомами (N, B, S, P и др.) и нанесение частиц металлической фазы [2, 10–14]. Важная роль пористой структуры УМ в кислородной реакции в апротонных Li+-содержащих электролитах подтверждена в работах [15, 16].
Отличительной особенностью положительного электрода Li–O2-источника тока является то, что на нем протекают обе составляющие кислородной реакции (КР). В режиме разряда – это катодное восстановление кислорода, а при заряде – анодное выделение кислорода. В результате реакции восстановления кислорода в Li+-содержащем электролите на основе апротонного растворителя происходит формирование пероксида лития. В наиболее общем виде реакция описывается уравнением [16–19]: $2{\text{Li}} + {{{\text{O}}}_{{\text{2}}}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}.$
Образующийся пероксид лития, как правило, не растворяется в апротонных электролитах, а осаждается и накапливается на катоде, блокируя доступ кислорода и ионов Li+ к поверхности электрода [16–22]. Низкая электропроводность Li2O2 препятствует дальнейшему протеканию кислородной реакции. Для снижения этого негативного эффекта, а также обеспечения диффузии кислорода к активным центрам необходимы материалы с развитой поверхностью и значительным объемом мезопор [23]. К их числу относятся углеродные нанотрубки (УНТ) и некоторые типы саж. В работе [23] исследовано влияние плотности тока на электрохимические характеристики УНТ, которые включают микропоры и значительное количество мезопор. Показано, что при высокой плотности тока в реакции восстановления кислорода на процесс образования Li2O2 в большей степени оказывают влияние мезопоры, при низких значениях плотности тока проявляется влияние микропор [22]. Вклад мезопористой структуры положительного электрода весьма важен при использовании электролитов на основе неводных растворителей с крупными катионами. Мезопоры позволяют диффундировать в них крупным катионам, способствуя тем самым получению более высоких электрохимических характеристик [23]. С другой стороны, микропоры благоприятны в случае использования растворителя со слабой сольватирующей способностью и, вследствие этого, электролита с меньшим размером сольватированного катиона Li+.
Исследования механизма реакции (1), выполненные на гладких углеродных материалах, показывают, что в апротонном Li+-содержащем электролите кислородная реакция является многостадийным процессом, включающим ряд химических и электрохимических стадий [14–16]. Предполагается, что образование Li2O2 (катодная реакция) возможно по двум путям. В одном случае пероксид лития формируется в результате диспропорционирования промежуточной частицы LiO2:
(1)
${\text{Электрохимическая стадия восстановления:}}\,\,\,{{{\text{О}}}_{{\text{2}}}}\xrightarrow{{ + {\text{e}}}}{\text{O}}_{2}^{ - },$(2)
${\text{Химическая стадия:}}\,\,{\text{О}}_{{\text{2}}}^{ - }~\,\, + \,\,~{\text{L}}{{{\text{i}}}^{ + }} \to {\text{Li}}{{{\text{O}}}_{2}},$(3)
${\text{Диспропорционирование:}}\,\,\,2{\text{Li}}{{{\text{O}}}_{2}} \to {\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}}.$Второй путь называется прямым, так как здесь реакция восстановления кислорода протекает в одну стадию, с присоединением 2 электронов и катионов лития:
(4)
$2{\text{L}}{{{\text{i}}}^{ + }} + {{{\text{O}}}_{{\text{2}}}}\xrightarrow{{ + 2{\text{e}}}}{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}.$Реакция выделения кислорода (анодная составляющая кислородной реакции):
(5)
${\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{{2~}}}\xrightarrow{{ - 2{\text{e}}}}2{\text{L}}{{{\text{i}}}^{ + }} + {{{\text{O}}}_{2}}.$В работе [23] исследовали продукты анодного окисления различных промежуточных частиц, которые могут образовываться при восстановлении кислорода в апротонных электролитах содержащих литий. Показано, что природа электролита оказывает существенное влияние на путь, обратимость и кинетику кислородной реакции. Одним из свойств апротонного растворителя при рассмотрении механизма кислородной реакции в электролитах, содержащих Li+, является сольватационное взаимодействие, которое характеризуется величиной донорного числа растворителя (DN). Растворитель с высоким DN (сильная сольватация) обеспечивает стабилизацию комплекса [Li+ (растворитель) n–${\text{O}}_{2}^{ - }$] и замедляет диспропорционирование LiO2 [24–26]. Образовавшийся ${\text{O}}_{2}^{ - }$ в растворителе с низким DN, вероятно, остается на электроде в адсорбированном состоянии, взаимодействует со слабо сольватированным катионом лития и образует LiO2. Супероксид лития диспропорционирует в адсорбированном состоянии или быстро электрохимически восстанавливается до ${\text{O}}_{2}^{{2 - }}$ с образованием пероксида лития (второй путь). Второй путь реализуется преимущественно при высоких плотностях тока [22].
Выбранные для исследований растворители: ацетонитрил и диметилсульфоксид, как показано в [26–28], весьма стабильны и устойчивы к атаке супероксид-иона, образующегося по реакции (1). Кроме того, эти два растворителя существенно различаются по своим физико-химическим и термодинамическим свойствам [24, 25].
Анализ литературных данных показывает, что оптимальные условия для осуществления кислородной реакции в апротонных растворителях, содержащих ионы лития, в настоящее время не найдены. Основными факторами, сдерживающими развитие литий-кислородных (воздушных) источников тока, являются высокое перенапряжение кислородной реакции (особенно анодного процесса), что в свою очередь требует создания бифункциональных катализаторов с развитой поверхностью мезопор для активного слоя положительного электрода. Целью данной работы является исследование влияния на эффективность и механизм кислородной реакции (катодной и анодной составляющих) ряда факторов: природы дисперсных УМ, отличающихся по структуре и физико-химическим свойствам; состава апротонного электролита; массы УМ на электроде и скорости проведения реакции в модельных условиях в атмосфере аргона и кислорода.
МЕТОДИКА ЭКСПЕРИМЕНТА
Для приготовления электролитов использовали ДМСО (“TH. GEYER”) и АН (“Криохим”). В качестве источника ионов Li+ была выбрана безводная соль (LiClO4), которую сушили в вакуумном шкафу при температуре 80°С перед приготовлением электролитов. Эта соль обладает хорошей растворимостью в выбранных растворителях.
Исследования проводили в герметичной электрохимической трехэлектродной ячейке. Перед проведением измерений ячейку тщательно сушили, продували аргоном и заполняли электролитом в сухом боксе, после чего проводили измерения на воздухе. Содержание воды в электролитах, определенное методом Фишера, не превышало 100 ppm, что как показано в работах [1, 29], не оказывает заметного влияния на кислородную реакцию. Только после добавления 500 ppm (и до 4000) воды образующиеся наночастицы пероксида лития имеют преимущественно тороидальную форму. Частицы такой формы обеспечивают снижение перенапряжения выделения кислорода, поскольку не образуется сплошной изолирующей пленки. Рабочий электрод представляет собой дисковый электрод из стеклоуглерода, впрессованного в тефлоновый корпус. Величина площади поверхности рабочего электрода составляет 0.125 см2. Перед началом эксперимента поверхность дискового электрода обрабатывали пастой оксида алюминия с последующим удалением ее при погружении в стакан с водой, помещенный в ультразвуковую ванну. В качестве вспомогательного электрода использовали платиновую сетку. Электродом сравнения служила серебряная проволока, погруженная в раствор 0.01 М AgNO3. Как правило, при работе с апротонными Li+-содержащими электролитами потенциал рабочего электрода определяют относительно литиевого электрода сравнения в зависимости от типа растворителя. Для определения потенциала рабочего электрода относительно пары Li/Li+, в соответствии с требованиями IUPAC [30], электрод сравнения калибровали в различных растворителях относительно редокс-пары, в качестве которой была выбрана Ag+/Ag, где источником ионов Ag+ является нитрат серебра, система металл–ион металла стабильна в условиях эксперимента и обеспечивает надежные значения стандартного потенциала. Эта соль растворяется в ацетонитриле и ДМСО, что позволяет получить концентрацию соли 0.01 М. Калибровку электрода проводили, используя серебряную проволоку, помещенную в раствор 0.01 М AgNO3, и литий, находящийся в ДМСО или в АН-содержащем 0.25 М LiClO4, электроды соединяли при помощи электролитического мостика, заполненного раствором, содержащим соль лития. Измерения проводили в сухом боксе. Величина потенциала, установившаяся между литиевым и серебряным электродами, в зависимости от типа растворителя составляет: 0.01 М AgNO3/ДМСО (ЕAg/Ag+ = 3.58 В (Li/Li+)), 0.01 М AgNO3/АН (ЕAg/Ag+ = 3.30 В (Li/Li+)). Эти значения использовали в дальнейшем для пересчета измеренного потенциала рабочего электрода относительно Li/Li+-электрода сравнения.
При проведении исследований использовали метод циклической вольтамперометрии (ЦВА). По ЦВА, полученным в атмосфере аргона, оценивали состояние поверхности исследуемого материала электрода и выбирали диапазон потенциалов, соответствующий устойчивости электролита. Поляризационные кривые, характеризующие катодную и анодную составляющие кислородной реакции, записывали в атмосфере кислорода, который барботировали через раствор электролита. Исследования проводили при различных скоростях наложения потенциала: от 0.005 до 0.10 В/с при комнатной температуре.
Выбор оптимального количества дисперсного материала, который наносили на диск. Дисперсный УМ наносили на рабочий электрод (диск) в виде предельно тонкого слоя, что обеспечивает равнодоступность поверхности дисперсного слоя по толщине и полностью закрывает поверхность электрода. Для выполнения этих условий было исследовано влияние количества материала на электроде (от 0.05 до 0.20 мг/см2) в атмосфере аргона и кислорода на величину электрохимически активной поверхности SЭАП и активность.
Для исследований были выбраны УМ: сажи (ХС72 и Super P) и углеродные нанотрубки, отличающиеся по величине удельной поверхности и пористой структуре (приведены ниже). Нанотрубки предварительно обрабатывали в растворе 1 М NaOH. Материалы наносили на поверхность дискового электрода в виде суспензии. Суспензию готовили путем диспергирования в ультразвуковой ванне 2 мг УМ в 0. 47 мл изопропилового спирта с добавлением 0.03 мл разбавленного в 10 раз 5%-ного раствора Нафиона в смеси низкомолекулярных алифатических спиртов (Aldrich). Обработку ультразвуком осуществляли в течение 30–40 мин.
Электрохимические характеристики УМ и влияние условий проведения измерений на кислородную реакцию определяли по ЦВА и поляризационным кривым. Характеристические параметры рассчитывали, как показано на рис. 1. Общее количество электричества (Q, Кл/${\text{см}}_{{{\text{геом}}}}^{{\text{2}}}{\text{,}}$ Кл/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$ или Кл/мгУМ), а также QК и QА, пошедшее на разряд/заряд, определяли из ЦВА (рис. 1) по формуле:
где v – скорость наложения потенциала (В/с). Из полученной величины рассчитывали QК и QА.Рис. 1.
(а) Схема расчета величин QК и QА на ЦВА, записанной на ХС72 в атмосфере Ar при скорости наложения потенциала 0.10В/с. (б) Пример определения параметров кислородной реакции из поляризационной кривой, записанной на Super P в атмосфере О2 при скорости наложения потенциала 0.005 В/с. Электролит ДМСО + 0.25 М LiClO4.
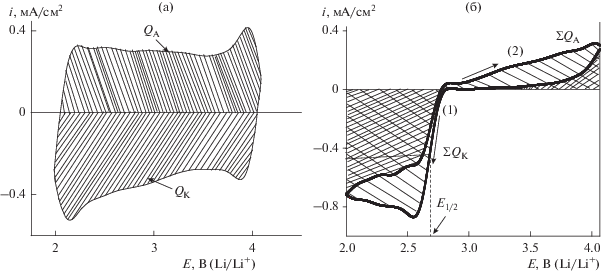
При расчете Q на основании поляризационных кривых, полученных в атмосфере кислорода, катодную и анодную области разбивали на два участка, характеризующих катодную и анодную составляющие реакции (рис. 1б), стрелками указано направление развертки потенциала). Для расчета количества электричества, пошедшего на восстановление и окисление, участки под кривыми (прямой и обратный ход) интегрировали отдельно, а затем суммировали Q и получали величины ∑QК, ∑QА. Степень обратимости кислородной реакции оценивали по отношению величин (∑QА/∑QК, %). Потенциал полуволны, характеризующий активность реакции восстановления кислорода Е1/2(К), определяли как показано на рис. 1б. Кроме того, было определено условное число слоев пероксида лития (N(Li2O2)), накопившихся на поверхности электрода в процессе восстановления кислорода, которое рассчитывали по формуле:
Пористую структуру УМ определяли по изотермам адсорбции паров азота. Изотермы адсорбции при температуре 77 К получали на объемной высоковакуумной адсорбционной установке ASAP-2020 MPMicromeriticsUSA в интервале относительных давлений от 10–6 до 0.99 объемным методом. Общую удельную поверхность (SБЭТ) определяли из изотерм адсорбции. Наружную (внешнюю) поверхность (Sнаруж) мезопор и соотношение мезопор и микропор рассчитывали с применением сравнительного метода по определению объема и поверхности микропор, при использовании методов расчета BJH (Barrett–Joyner–Halenda) и t-plot [32–34].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Область потенциалов электрохимической устойчивости исследованных растворителей составила 2.0–4.0 В отн. Li/Li+. В этой области потенциалов на ЦВА не наблюдается выраженных максимумов (рис. 1а), связанных с разложением электролита или загрязнением поверхности углеродного материала. Можно только отметить некоторый рост тока в области потенциалов, близких к 4.0 В, как в ДМСО, так и АН, который может указывать на окисление УМ или разложение растворителя. Выяснению этих вопросов будет посвящено специальное исследование.
Характеристики УМ при исследованиях в инертной атмосфере
Величины поляризационной емкости электрода Q (мКл/см2УМ), в качестве критерия оценки оптимального количества материала на электроде, определены по ЦВА, полученным при измерениях в инертной атмосфере. Показано, хотя и с небольшими погрешностями, что при нанесении до 0.10 мгУМ/см2 геометрической поверхности электрода практически вся поверхность УМ доступна для протекания реакции при соответствующей скорости развертки потенциала, как будет показано ниже. Следует отметить, что величина Q, характеризующая поляризационную емкость и, соответственно, величину электрохимически активной поверхности, для всех УМ больше при измерениях в АН. Вероятно, это обусловлено его слабой сольватирующей способностью и малыми размерами молекулы. В результате этого, электролит на основе АН способен проникать в достаточно узкие поры, что согласуется с данными работы [22]. Величины поляризационной емкости в электролите на основе ДМСО (табл. 1), скорости изменения потенциала 0.10 В/с и расчете на величину наружной поверхности УМ не слишком сильно отличаются друг от друга. Это связано с тем, что при такой скорости изменения потенциала электрохимически активен только верхний слой УМ, нанесенного на дисковый электрод. При этом толщины слоя заметно отличаются друг от друга из-за различной структуры УМ (табл. 1). Чем больше масса (толщина), тем меньшая часть УМ участвует в электрохимической реакции при увеличении скорости развертки потенциала. ЦВА, полученные на различных УМ в инертной атмосфере в электролитах на основе ДМСО и АН, качественно совпадают между собой (рис. 1) и с ЦВА, полученными в водных электролитах [35]. Это выражается в том, что на них нет выраженных максимумов, характеризующих реакции редокс-превращений на поверхности или разложения электролита. В табл. 2 представлены данные по зависимости величины количества электричества на ЦВА, характеризующей электрохимически доступную поверхность. Наибольшее влияние скорости изменения потенциала наблюдается в случае сажи ХС72, которая имеет, наряду со значительной величиной наружной поверхности, вклад в суммарную поверхность за счет пор с малым диаметром – 4.4 нм (табл. 3). При изменении скорости наложения потенциала от 0.01 до 0.10 В/с уменьшение величины Q на ЦВА составляет около 17% для сажи ХС72. Для мезопористых материалов (Super P и УНТ) эта величина практически не изменяется (табл. 2). Полученные данные подтверждают влияние пористой структуры материалов на их электрохимические характеристики (величину электрохимически активной поверхности в данном случае).
Таблица 1.
Величины количества электричества (∑Q, мКл/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$), полученные на электроде с различным количеством нанесенного УМ. Скорость изменения потенциала 0.10 В/с; комнатная температура. В скобках QК в мКл на см2 геометрической поверхности электрода с нанесенным количеством УМ
| УМ, мг/см2 | Тип углеродного материала | |||||
|---|---|---|---|---|---|---|
| Super P (Sнаруж = 50 м2/г) | ХС72 (Sнаруж = 150 м2/г) | УНТ (Sнаруж = 240 м2/г) | ||||
| ∑Q, мКл/см2УМ, 0.25 М раствор LiClO4 в АН и ДМСО, атмосфера Ar | ||||||
| ДМСО | АН | ДМСО | АН | ДМСО | АН | |
| 0.05 | 0.07 (1.7) | 0.40 (10.0) | 0.07 (5.2) | 0.41 (30.7) | 0.08 (9.6) | 0.40 (48.0) |
| 0.10 | 0.07 (3.5) | 0.26 (13.0) | 0.06 (9.0) | 0.12 (18.0) | 0.06 (14.4) | 0.21 (50.4) |
| 0.20 | 0.03 (3.0) | 0.15 (15.0) | 0.06 (18.0) | 0.06 (18.0) | 0.04 (19.2) | 0.07 (33.6) |
Таблица 2.
Зависимость величины ЭАП УМ (в скобках указана величина наружной поверхности) в виде Q, мКл/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$ от скорости наложения потенциала. На электроде 0.10 мг/см2; электролиты: 0.25 М LiClO4 в АН и ДМСО; атмосфера Ar; 20°С. В скобках QК в мКл на см2 геометрической поверхности электрода – габаритная характеристика
| Скорость изменения потенциала, В/с | Углеродный материал | |||||
|---|---|---|---|---|---|---|
| Super P (50 м2/г) | ХС72 (150 м2/г) | УНТ (240 м2/г) | ||||
| ∑Q, мКл/см2УМ, атмосфера Ar | ||||||
| Li+/ДМСО | Li+/АН | Li+/ДМСО | Li+/АН | Li+/ДМСО | Li+/АН | |
| 0.005 | 0.07 (3.5) | 0.40 (20.0) | 0.06 (9.0) | 0.22 (33.0) | 0.06 (14.4) | 0.39 (93.6) |
| 0.010 | 0.07 (3.5) | 0.26 (13.0) | 0.06 (9.0) | 0.12 (18.0) | 0.06 (14.4) | 0.21 (50.4) |
| 0.100 | 0.07 (3.5) | 0.26 (13.0) | 0.05 (7.5) | 0.12 (18.0) | 0.06 (14.4) | 0.21 (50.4) |
Таблица 3.
Структурные характеристики углеродных материалов
| Углеродный материал | SБЭТ/Sнаруж,* м2/гУМ | Vпор, см3/гУМ (суммарный) | dпор, нм |
|---|---|---|---|
| ХС-72 | 228/150 | 0.39 | 4.4 |
| SuperP | 62/50 | 0.32 | 11.9–40 |
| УНТ-Т | 250/240 | 4.07 | 10.0–50.0 |
Таким образом, структура УМ, включающая величину удельной поверхности, диаметр, объем, и поверхность пор непосредственно влияют на величину ЭАП, а затем на обратимость и кинетику кислородной реакции [24, 36]. Сравнение величин Q, поверхности по БЭТ(SБЭТ) и наружной поверхности, а также ЦВА, полученных на исследуемых материалах в неводных растворах, показывает связь между электрохимическими и структурными характеристиками. Чем больше величины поверхности по БЭТ и наружная поверхность, тем больше поляризационная емкость и соответственно величина ЭАП в двух типах электролитов. Наблюдаемый эффект в большей степени выражен в электролите на основе АН. Это связано со свойствами растворителя: меньшие по размеру и массе молекулы АН (Мм – 41) по сравнению с ДМСО (Мм – 78) способны проникать в поры с малым диаметром, что обеспечивает большую величину ЭАП в АН, особенно выраженную при малых скоростях изменения потенциала. При этом в случае ХС72 снижение величины поляризационной емкости на 50% при переходе от 5 до 100 мВ/с обусловлено наличием микропор, а в случае УНТ – это связано со значительным увеличением толщины АС, в связи с чем только часть АС электрохимически активна и участвует в реакции.
Таким образом, исследование УМ в апротонных растворителях в инертной атмосфере показало, что ДМСО и АН относительно устойчивы в широкой области потенциалов, а величина ЭАП зависит от свойств растворителя, пористой структуры и массы УМ на электроде. При оптимальном количестве УМ на поверхности рабочего электрода ~0.10 мг/см2, скорость наложения потенциала для обеспечения участия в реакции всей поверхности УМ должна быть не более 0.10 В/с. По мере увеличения скорости развертки потенциала, особенно в случае ХС 72 и электролита на основе АН, поляризационная емкость снижается (табл. 2). Это связано со вкладом в поляризационную емкость при скорости изменения потенциала в 10 мВ/с и выше только наружной поверхности сажи, которая электрохимически активна, в отличие от поверхности микропор. Для УНТ, имеющих большую наружную поверхность за счет большого объема мезопор, величина Q практически не зависит от скорости наложения потенциала при ее изменении от 0.005 до 0.10 В/с в электролите на основе ДМСО и уменьшается в АН. Вероятно, в ДМСО только внешняя поверхность УМ в активном слое участвует в электрохимической реакции, даже при малых скоростях изменения потенциала. При этом величина ЭАП на всех УМ в АН значительно больше, благодаря меньшим размерам молекулы этого растворителя. Кроме того, в АН даже на УНТ поляризационная емкость снижается при увеличении скорости развертки, что связано со значительной толщиной слоя нанотрубок (их объем на порядок больше, чем у сажи (табл. 3) при одинаковой массе УМ) на поверхности электрода. Следует отметить, что габаритная характеристика (QК, мКл/${\text{см}}_{{{\text{геом}}}}^{{\text{2}}}$) всегда выше при использовании УНТ. Таким образом, величина поляризационной емкости, характеризующая ЭАП, определяется пористой структурой УМ, его массой на электроде, свойствами растворителя и скоростью развертки потенциала, при которой проводят измерения. Наиболее высокие величины ЭАП получены на УНТ при массе УМ на электроде 0.10 мг/см2. При выборе УМ для создания АС положительного электрода необходимо учитывать все эти факторы.
Влияние количества УМ на параметры кислородной реакции
Прежде всего следует отметить принципиальные различия, наблюдаемые на ЦВА, измеренные в атмосфере аргона и в атмосфере кислорода. В последнем случае (рис. 2) на поляризационных кривых наблюдаются катодный и анодный процессы, связанные с восстановлением кислорода и его выделением в соответствие с реакциями (1)–(3) или (4) и (5). Качественно кривые совпадают на всех УМ. При этом, величины токов и, соответственно, количества электричества, пошедшие на восстановление/выделение кислорода в электролите на основе АН, выше, чем в электролите на основе ДМСО. Вид поляризационных кривых сохраняется при нанесении на электрод 0.05 и 0.10 мг/см2 поверхности электрода. Различия в величинах измеряемых токов обусловлены, в первую очередь, такими параметрами, как концентрация растворенного кислорода и коэффициент его диффузии. В табл. 4 представлены основные физико-химические характеристики исследованных растворителей. Как видно, при более низкой растворимости кислорода в ДМСО коэффициент диффузии его практически на порядок выше, чем в АН. Кроме того, как было показано выше, при исследовании УМ в электролитах в отсутствие кислорода величина ЭАП выше для всех УМ в электролите на основе АН, который благодаря низкой вязкости (табл. 4) обеспечивает высокую ионную проводимость этого электролита. В совокупности эти параметры приводят к различиям в характеристиках кислородной реакции при использовании различных растворителей для приготовления электролита. Основные характеристики кислородной реакции на УМ в атмосфере кислорода представлены в табл. 5.
Рис. 2.
Поляризационные кривые, характеризующие катодный и анодный процесс на углеродных материалах: Super P − 1; ХС72 – 2; и УНТ − 3. На электрод нанесен УМ – 0.10 мг/см2; скорость наложения потенциала 0.005 В/с; атмосфера O2; 20°С. Вставки – анодные участки поляризационных кривых: а − электролит 0.25М LiClO4/АН; б − электролит 0.25 М LiClO4/ДМСО.

Таблица 4.
Физико-химические и термодинамические свойства апротонных растворителей
| Растворитель | Динамическая вязкость (20°С) η, мПа с | Диэлектрическ. проницаемость ε (25°С) | Коэффициент диффузии O2, см2/с | Концентрация O2, мM/см3 | Донорное число, ккал/моль | Акцепторное число |
|---|---|---|---|---|---|---|
| ДMСO | 1.996 | 48 | 1.67 × 10–5 | 2.10 | 29.8 | 19.8 |
| АН | 0.35 | 36 | 4.64 × 10–6 | 8.1 | 14.1 | 18.9 |
Таблица 5.
Влияние массы УМ и скорости развертки потенциала на электрохимические параметры кислородной реакции. Электролит 0.25 М LiClO4 для ДМСО и АН; на электроде 0.10 мгУМ/см2; комнатная температура. В скобках величина (∑QК в мКл/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$)
| Параметр | Скорость развертки, В/с | Углеродные материалы | |||||
|---|---|---|---|---|---|---|---|
| Super P | ХС72 | УНТ | |||||
| Li+/ДМСО | Li+/АН | Li+/ДМСО | Li+/АН | Li+/ДМСО | Li+/АН | ||
| ∑QА/∑QК, % | 0.005 | 17 (1.50) | 23 (9.43) | 32 (0.66) | 33 (3.53) | 50 (0.76) | 29 (5.40) |
| 0.10 | 55 (0.13) | 25 (0.30) | 88 (0.08) | 34 (0.48) | 70 (0.09) | 53 (0.26) | |
| Е1/2, В (катод) | 0.005 | 2.68 | 2.48 | 2.60 | 2.60 | 2.70 | 2.64 |
| 0.10 | 2.65 | 2.46 | 2.62 | 2.56 | 2.67 | 2.58 | |
| ЕOx, В (анод) | 0.005 | 2.75 | 2.75 | 2.77 | 2.77 | 2.75 | 2.75 |
| 0.10 | 2.65 | 2.66 | 2.65 | 2.71 | 2.62 | 2.66 | |
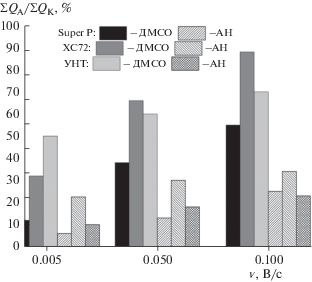
Для установления механизма кислородной реакции важно определить степень ее обратимости (∑QА/∑QК). При оценке обратимости мы принимаем, что количество электричества, пошедшее на образование Li2O2 на катодном участке поляризационной кривой, должно быть равно количеству электричества, пошедшему на разложение Li2O2 на анодном участке кривой. Этот параметр зависит от типа растворителя, и наиболее высокая обратимость (от 50 до 70%) кислородной реакции наблюдается на УНТ в электролите на основе ДМСО при увеличении скорости развертки потенциала от 0.005 до 0.10 В/с (рис. 3). По абсолютной величине более высокое значение QК, при расчете на поверхность УМ, наблюдается на Super P, при этом обратимость наименьшая (рис. 3), как в электролите на основе АН, так и ДМСО. Полученные данные подтверждают предположение о том, что степень обратимости тем выше, чем меньше заполнение пероксидом лития электрохимически активной поверхности УМ, которая в свою очередь пропорциональна величине удельной поверхности УМ (табл. 3).
Рис. 3.
Влияние скорости изменения потенциала на степень обратимости кислородной реакции на УМ: Super P, ХС72 и УНТ. Электролит на основе: ДМСО – сплошная заливка; АН – заштриховано.
Величина потенциала полуволны (а также начала окисления) смещается в область меньших значений положительного потенциала во всех случаях при увеличении скорости развертки потенциала. При использовании Super P и УНТ на электроде потенциал полуволны (Е1/2) смещается в сторону более положительных значений на 0.08 и 0.10 В по сравнению с ХС72 при замене электролита на основе АН на ДМСО, соответственно (табл. 5). На всех поляризационных кривых, полученных на исследуемых материалах в атмосфере кислорода, характерно наличие пиков на катодной и анодной ветви (рис. 2). На катодном участке наблюдается, как правило, один пик, значение потенциала которого варьируется в пределах 2.2−2.6 В, в зависимости от типа углеродного материала, растворителя и скорости изменения потенциала. В [15] сообщалось о присутствии пиков в катодной области на углеродных материалах при потенциалах 2.5 и 2.0 В, относительно литиевого электрода, что близко к данным настоящей работы и данным [37], наблюдаемым на золотом электроде. Согласно [15], первый пик на разрядной кривой отвечает реакции образования: O2 + + е + Li+ → LiO2. Второй пик связывают с реакцией образования Li2O2 по реакции (4) с присоединением 2 электронов и образованием пероксида лития. В ДМСО положение катодного максимума и потенциала полуволны находятся при более высоких положительных значениях потенциала (табл. 5).
Анодные кривые характеризуются наличием слабовыраженных пиков при скорости наложения потенциала 0.005 В/с (рис. 2), которые при увеличении скорости развертки потенциала проявляются в большей степени. Вероятно, это связано с тем, что при высокой скорости изменения потенциала на положительном электроде накапливается меньше Li2O2. Перенапряжение окисления пероксида лития при этом снижается и увеличивается обратимость процесса на всех УМ, независимо от типа растворителя (рис. 3). Однако, в зависимости от скорости наложения потенциала обратимость изменяется по-разному на каждом из УМ. При скорости изменения потенциала 0.005 В/с, при которой удельное количество электричества (мКл/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$) максимальное для всех УМ, наибольшая обратимость имеет место на УНТ. По мере увеличения скорости обратимость на нанотрубках увеличивается незначительно за счет снижения удельного заряда, связанного с неравнодоступностью по толщине активного слоя, на электроде. При скорости 0.05 В/с обратимость на ХС72 и УНТ практически совпадает, а при дальнейшем увеличении скорости величина (∑QА/∑QК, % на ХС72) даже превышает наблюдаемую на УНТ. Следует также отметить, что удельное (мКл/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$) количество электричества для Super P значительно превосходит полученное на ХС72 и УНТ. Вероятно, при обсуждении свойств УМ необходимо принимать во внимание не только структурные параметры, но и состав групп на поверхности УМ и, соответственно, каталитическую активность УМ в реакции восстановления кислорода. Кроме того, в ДМСО ∑QК для исследуемых материалов ниже, чем в АН. Это свидетельствует о различном пути и механизме реакции восстановления кислорода, связанные как с типом растворителя, так и структурой УМ. Как было отмечено выше, в ДМСО Li2O2 образуется в результате реакции диспропорционирования промежуточной частицы LiO2, “длительность жизни” которой лимитируется физическими свойствами растворителя, прежде всего DN. Вероятно, стабилизация LiO2 замедляет реакцию диспропорционирования. В результате этого, образуется меньшее количество пероксида лития, который осаждается на электроде. Такой осадок не образует сплошного, блокирующего поверхность покрытия. В случае АН реакция восстановления кислорода может осуществляться по двум путям: 1) при присоединении одного электрона, образовании LiO2 и его диспропорционировании в адсорбированном на поверхности электрода состоянии или 2) через присоединение двух электронов и прямое образование пероксида лития (вследствие слабого сольватационного взаимодействия с растворителем). Накопление пероксида лития на электроде в виде сплошной не электропроводной пленки затрудняет его последующее разложение и высвобождение кислорода в анодной реакции, о чем свидетельствуют величины степени обратимости кислородной реакции (табл. 5, рис. 3), которая выше в ДМСО.
При низкой скорости изменения потенциала влияние структуры УМ, главным образом величины наружной поверхности, проявляется в следующем: увеличение наружной поверхности ведет к меньшей величине заполнения поверхности УМ образовавшимся пероксидом лития, как показывает величина ∑QК, мКл/см2, которая уменьшается в ряду: Super P > УНТ > XC72. При возрастании скорости изменения потенциала характеристики всех УМ, с точки зрения накопления заряда, снижаются, а степень обратимости возрастает: наблюдается снижение ∑QК и увеличение ∑QА/∑QК. Некоторые отклонения от наблюдаемой зависимости в случае сажи ХС72 связаны с наличием в ее структуре пор малого диаметра (табл. 3), на поверхности которых при высоких скоростях наложения потенциала пероксид лития не образуется из-за ограничений по доставке в зону реакции кислорода и катиона лития.
По поляризационным кривым, записанным при скорости изменения потенциала 0.005 В/с и представленным в тафелевских координатах, были определены величины наклонов на катодном участке кривой, которые составили 100–130 мВ/с для всех исследуемых материалов в обоих растворителях в области потенциалов, близких к стационарному. Вероятно, в узкой области потенциалов (2.85–2.75 В), при незначительном заполнении поверхности продуктом реакции –Li2O2, лимитирующей стадией является перенос первого электрона на молекулу кислорода. По мере смещения потенциала происходит накопление продукта, при одновременном увеличении плотности тока из-за блокировки части поверхности. Это приводит к изменению механизма реакции, которое выражается в увеличении наклона тафелевской зависимости до 200–300 мВ на декаду, что указывает на не электрохимическую стадию, лимитирующую реакцию. Наиболее вероятно возникают диффузионные ограничения, связанные с доставкой в зону реакции кислорода и/или катионов лития.
Влияние природы материала и типа растворителя на кислородную реакцию было проанализировано, исходя из расчета величины N(Li2O2), соответствующей условному количеству монослоев пероксида лития, который образуется при восстановлении кислорода (табл. 6). Независимо от скорости изменения потенциала наибольшая величина условных слоев лития N(Li2O2) при расчете на 1 см2 поверхности УМ получена для Super P, имеющего меньшую, по сравнению с другими исследуемыми материалами, наружную поверхность. Для ХС72 и УНТ числа слоев –N(Li2O2)/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$ близки между собой, а при расчете на геометрическую поверхность электрода наиболее высокое значение получено на УНТ (табл. 6) при скорости изменения потенциала 0.005 В/с. С увеличением скорости изменения потенциала в том же растворителе, на всех УМ образуется меньшее количество монослоев. Вероятно, при высокой скорости изменения потенциала, что адекватно использованию более высокой плотности тока и сокращению времени поляризации, доставка реагентов (кислород и катион лития) к активным центрам, где происходит восстановление кислорода с переносом электрона и образованием продукта реакции (Li2O2) в результате присоединения катиона Li+, является скорость определяющей стадией реакции. При этом в АН снижение количества электричества, пошедшего на образование пероксида лития, происходит в большей степени, чем в ДМСО. Вероятной причиной этого является низкий диффузионный коэффициент кислорода в АН (табл. 3), что вызывает быстрое снижение его концентрации в зоне реакции, и тем самым диффузия кислорода становится лимитирующей стадией. Высокие N(Li2O2) в АН можно объяснить способностью проникновения мелких по размеру сольватов, образующихся в АН, а также возможностью быстрого одностадийного процесса образования пероксида лития в этом растворителе, в результате двухэлектронного восстановления кислорода при высоких плотностях тока, как отмечено в работе [15].
Таблица 6.
Влияние скорости изменения потенциала на условное количество монослоев пероксида лития (N(Li2O2)), образовавшихся на поверхности углеродного электрода при восстановлении кислорода в апротонных электролитах на основе АН и ДМСО. На электроде 0.10 мгУМ/см2
| Число слоев | УМ | Электролит | Скорость наложения потенциала, В/с | |||
|---|---|---|---|---|---|---|
| 0.005 | 0.01 | 0.05 | 0.10 | |||
| N(Li2O2)/${\text{см}}_{{{\text{геом}}}}^{{\text{2}}}$N(Li2O2)/${\text{см}}_{{{\text{УМ}}}}^{{\text{2}}}$ | Super P | Li+/ДМСО | 346 (5.8) | 307 (5.2) | 92 (1.50) | 50 (0.83) |
| Li+/АН | 2384 (40) | 962 (16) | 192 (3.2) | 100 (1.7) | ||
| ХС72 | Li+/ДМСО | 500 (2.5) | 230 (1.5) | 57 (0.38) | 31 (0.20) | |
| Li+/АН | 3626 (24) | 1153 (7.7) | 269 (1.8) | 185 (1.2) | ||
| УНТNaOH | Li+/ДМСО | 696 (2.7) | 269 (1.1) | 65 (0.27) | 35 (0.14) | |
| Li+/АН | 5000 (21) | 653 (2.7) | 192 (0.8) | 115 (0.48) | ||
ЗАКЛЮЧЕНИЕ
Таким образом, проведенные исследования и определенные электрохимические характеристики, показали влияние структуры и массы УМ в активном слое положительного электрода, плотности тока проведения реакции и свойств апротонного растворителя на кинетику, путь и обратимость кислородной реакции. Установлено, что активный слой УМ при нагрузке 0.10 мг/см2, обеспечивает высокую ЭАП активного слоя положительного электрода, а значительная величина Sнаруж УМ благоприятна для накопления пероксида лития. Кроме того, наличие мезопор большого диаметра, которые служат каналами подачи кислорода и ионов лития к активным центрам реакции на поверхности, позволяют рекомендовать в первую очередь УНТ для формирования АС положительного электрода ЛКА.
Показано, что в ДМСО, в отличие от АН, образуется меньше Li2O2 на поверхности УМ. При этом образовавшийся пероксид лития осаждается на поверхности электрода в виде неупорядоченной структуры (без образования блокирующей изолирующей пленки), что снижает перенапряжение анодной реакции выделения кислорода для ХС 72 и УНТ (табл. 5), где заполнение поверхности продуктом реакции Li2O2 меньше, чем на Super P. Кроме того, обратимость реакции на всех исследованных УМ выше в ДМСО в силу особенностей этого электролита. Величины потенциалов полуволны в реакции восстановления кислорода выше в ДМСО при использовании в качестве материала активного слоя положительного электрода УНТ.
В АН растворимость О2 выше, однако коэффициент диффузии О2 практически на порядок ниже, чем в ДМСО, и при высоких скоростях изменения потенциала стадия доставки кислорода в зону реакции становится лимитирующей. Диффузия катиона лития, благодаря высокой ионной проводимости АН (имеет низкую динамическую вязкость) не лимитирует реакцию.
Комплексный подход к исследованию влияния ряда факторов на активность УМ в кислородной реакции в апротонных растворителях является новым и обеспечивает получение достоверной информации для рекомендаций по применению того или иного материала в составе активного слоя положительного электрода ЛКА.
По совокупности полученных характеристик наиболее перспективным углеродным материалом для осуществления кислородной реакции являются УНТ при проведении измерений в ДМСО.
Список литературы
Aetukuri, N.B., McCloskey, B.D., García, J.M., Krupp, L.E., Viswanathan, V., and Luntz, A.C., Solvating additives drive solution-mediated electrochemistry and enhance toroid growth in non-aqueous Li–O2 batteries, Nat. Chem., 2015, vol. 7, p. 50.
Xin, Guo, Bing, Sun, Dawei, Su, Xiaoxue, Liu, Hao, Liu, Yong, Wang, and Guoxiu, Wang., Recent developments of aprotic lithium-oxygen batteries: functional materials determine the electrochemical performance, Science Bulletin, 2017, vol. 62, no. 6, p. 442.
Tan, P., Shyy, W., An, L., Wei, Z.H., and Zhao, T.S., A gradient porous cathode for non-aqueous lithiumair batteries leading to a high capacity, Electrochem. Commun., 2014, vol. 46, p. 111.
Ruimin, Yu, Wugang, Fan, Xiangxin, Guo, and Shaoming, Dong., Highly ordered and ultra-long carbon nanotube arrays as air cathodes for high-energy-efficiency Li-oxygen batteries, J. Power Sources, 2016, vol. 306, p. 402.
Jiang, H.R., Zhao, T.S., Shi, L., Tan, P., and An, L., First-Principles Study of Nitrogen-, Boron-Doped Graphene and Co-Doped Graphene as the Potential Catalysts in Nonaqueous Li–O2 Batteries, J. Phys. Chem. C., 2016, vol. 120, no. 12, p. 6612.
Wang, L., Ara, M., Wadumesthrige, K., Salley, S., and Simon, K.Y., Graphene nanosheet supported bifunctional catalyst for high cycle life Li-air batteries, J. Power Sources, 2013, vol. 234, p. 8.
Mitchell, R.R., Gallant, B.M., Thompson, C.V., and Shao-Horn, Y., All-carbon-nanofiber electrodes for high-energy rechargeable Li–O2 batteries, Energy Environ. Sci., 2011, vol. 4, p. 2952.
Zhang, S.S., Kang, Xu, and Read, J., A non-aqueous electrolyte for the operation of Li/air battery in ambient environment, J. Power Sources, 2011, vol. 196, p. 3906.
Galiotea, N.A., Jeong, S., Moraisa, W.G., Passerini, S., and Huguenina, F., The Role of Ionic Liquid in Oxygen Reduction Reaction for Lithium-air Batteries, Electrochim. Acta, 2017, vol. 247, p. 610.
Donghong, D., Xiu, You, Wenjun, Ren, Huikai, Wei, Huihong, Liu, and Shibin, Liu. Oxygen reduction reaction of different electrodes in dimethyl sulfoxide solvent for Li-air batteries, Intern. J. Hydrogen energy, 2015, vol. 40, no. 34, p. 10847.
Feng, Wu, Yi, Xing, Li, L., Ji, Qian, Wenjie, Qu, Jianguo, Wen, Miller, D., Yusheng, Ye, Renjie, Chen, Amine, K., and Jun, Lu., Facile Synthesis of Boron-Doped rGO as Cathode Material for High Energy Li-O2 Batteries, ACS Appl. Mater. Interfaces, 2016, vol. 8, no. 36, p. 23635.
Yue, Shen, Dan, Sun, Ling, Yu, Wang, Zhang, Yuanyuan, Shang, Huiru, Tang, Junfang, Wu, Anyuan, Cao, and Yunhui, Huang, A high-capacity lithium–air battery with Pd modified carbon nanotube sponge cathode working in regular air, Carbon, 2013. vol. 62, p. 288.
Cheng, H. and Scott, K., Carbon-supported manganese oxide nanocatalysts for rechargeable lithium–air batteries, J. Power Sources, 2010, vol. 195, no. 5, p. 1370.
Alaf, M., Tocoglu, U., Kartal, M., and Akbulut, H., Graphene supported heterogeneous catalysts for Li–O2 batteries, Applied Surface Science, 2016, vol. 380, p. 185.
Belova, A.I., Kwabi, D.G., Yashina, L.V., Shao-Horn, Y., and Itkis, D.M., Mechanism of Oxygen Reduction in Aprotic Li−Air Batteries: The Role of Carbon Electrode Surface Structure, J. Phys. Chem. C., 2017, vol. 121, no. 3, 1569.
Jinliang, Y., Jong-Sung, Y., and Sunden, B., Review on mechanisms and continuum models of multi-phase transport phenomena in porous structures of non-aqueous Li-Air batteries, J. Power Sources, 2015, vol. 278, p. 352.
Woo, H., Kang, J., Kim, J., Kim, C., Nam, S., and Park, B., Development of Carbon-Based Cathodes for Li-Air Batteries: Present and Future, Electron. Mater. Lett., 2016, vol. 12, no. 5, p. 551.
Tan, P., Wei, K., Zongping, S., Meilin, L., and Meng, N., Advances in modeling and simulation of Li-air batteries, Progress in Energy and Combustion Science, 2017, vol. 62, p. 155.
Tan, P., Meng, Ni, Zongping, S., Bin, Chen, and Wei, Kong, Numerical investigation of a non-aqueous lithium-oxygen battery based on lithium superoxide as the discharge product, Applied Energy, 2017, vol. 203, p. 254.
Hardwick, L.J. and Bruce, P.G., The pursuit of rechargeable non-aqueous lithium–oxygen battery cathodes, Current Opinion/ Solid State and Materials Science, 2012, vol. 16, no. 4, p. 178.
Ku-Bong, Chung, Ju-Kyung, Shin, Tae-Young, Jang, Dong-Kyun, Noh, Yongsug, Tak, and Sung-Hyeon, Baeck, Preparation and analyses of MnO2/carbon composites for rechargeable lithium-air battery, Rev. Adv. Mater. Sci., 2011, vol. 28, no. 1, p. 54.
Nitin, Kumar, Maxwell, D., Radin, Brandon, C. Wood, Tadashi, Ogitsu, and Donald, J., Siegel, Surface-Mediated Solvent Decomposition in Li–Air Batteries: Impact of Peroxide and Superoxide Surface Terminations, J. Phys. Chem. C., 2015, vol. 119, no. 17, p. 9050.
Yuya, Kado, Yasushi, Soneda, and Noriko, Yoshizawa, Contribution of mesopores in MgO-templated mesoporous carbons to capacitance in non-aqueous electrolytes, J. Power Sources, 2015, vol. 276, p. 176.
Wo, Xu, Kang, Xu, Viswanathan, V.V., Towne S.A., Hardya, J.S., Jie, Xiaoa, Zimin, Niea, Dehong, Huc, Deyu, Wanga, and Ji-Guang, Zhanga, Reaction mechanisms for the limited reversibility of Li–O2 chemistry in organic carbonate electrolytes, J. Power Sources, 2011, vol. 196, p. 9631.
Laoire, C.O., Mukerjee, S., Abraham, K.M., Plichta, E.J., and Hendrickson, M.A., Influence of Nonaqueous Solvents on the Electrochemistry of Oxygen in the Rechargeable Lithium–Air Battery, J. Phys. Chem. C., 2010, vol. 114, p. 9178.
Calvo, E.J. and Mozhzhukhina, N., A rotating ring disk electrode study of the oxygen reduction reaction in lithium containing non aqueous electrolyte, Electrochem. Commun., 2013, vol. 31, p. 56.
Balaish, M., Kraytsberg, A., and Yair, Ein-Eli, A critical review on lithium–air battery electrolytes, Phys. Chem. Chem. Phys., 2014, vol. 16, 2801.
Mozhzhukhina, N., Longinotti, M.P., Corti, H.R., and Calvo, E.J., A conductivity study of preferential solvation of lithium ion in acetonitrile-dimethyl sulfoxide mixtures, Electrochim. Acta, 2015, vol. 154, p. 456.
Bryantsev, V.S., Predicting the stability of aprotic solvents in Li-air batteries: pKa calculations of aliphatic C–H acids in dimethyl sulfoxide, Chem. Phys. Lett., 2013, vol. 558, p. 42.
Gritzner, G. and Kuta, J., Recommendations on reporting electrode potentials in nonaqueous solvents, Pure and Appl.Chem., 1982, vol. 54, no. 8, p. 1527.
Meini, S., Piana, M., Beyer, H., Schwammlein, J., and Gasteiger, H.A., Effect of Carbon Surface Area on First Discharge Capacity of Li–O2 Cathodes and Cycle-Life Behavior in Ether-Based Electrolytes, J. Electrochem. Soc., 2012, vol. 159, p. A2135.
Грегг, С., Синг, К. Адсорбция, удельная поверхность, пористость. М.: Мир, 1982. 306 с. [Gregg S.J. and Sing K.S.W., Adsorption, Specific Area, Porosity. Academic Press. 1982. 306 с.]
Dubinin, M.M., Chemistry and Physics of Carbon. Marcel Dekker. N.Y. 1966. vol. 2, p. 51.
Волощук, А.М., Дубинин, М.М., Московская, Т.А., Ивахнюк, Г.К., Федоров Н.Ф. Изв. АН СССР. Сер. Хим., 1988, № 2, с. 277.
Bogdanovskaya, V.A., Zhutaeva, G.V., Radina, M.V., Kazanskii, L.P., Tarasevich, M.R., Koltsova, E.M., Skichko, E.A., and Gavrilova, N.N., Physico-chemical properties of carbon nanotubes as supports for cathode catalysts of fuel cells. Surface structure and corrosion resistance, Protection of Metals and Physical Chemistry of Surfaces, 2016, V. 52, no. 1, p. 45.
Xin, Guo, Bing, Sun, Dawei, Su, Xiaoxue, Liu, Hao, Liu, Yong, Wang, and Guoxiu, Wang, Recent developments of aprotic lithium-oxygen batteries: functional materials determine the electrochemical performance, Science Bulletin, 2017, vol. 62, p. 442.
Johnson, L., Li, C., Liu, Z., Chen, Y., Freunberger, S.A., Ashok, P.C., Praveen, B.B., Dholakia, K., Tarascon, J.M., and Bruce, P.G., The Role of LiO2 Solubility in O2 Reduction in Aprotic Solvents and Its Consequences for Li–O2 Batteries, Nat. Chem., 2014, vol. 6, no. 12, p. 1091.
Дополнительные материалы отсутствуют.


