Электрохимия, 2019, T. 55, № 9, стр. 1111-1123
Электрохимические особенности медиаторного биоэлектрокаталитического окисления глюкозы новым типом биоэлектрокатализатора
М. В. Дмитриева a, *, Е. В. Герасимова a, А. А. Терентьев a, Ю. А. Добровольский a, Е. В. Золотухина a
a Институт проблем химической физики РАН
142432 Ногинский р-н, Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
* E-mail: angel.maria@mail.ru
Поступила в редакцию 10.12.2018
После доработки 04.03.2019
Принята к публикации 30.03.2019
Аннотация
В качестве биоэлектрокатализатора в реакции окисления глюкозы был изучен белковый экстракт микробных клеток. Микробный белковый экстракт, полученный из культуры Escherichia coli BB, рассматривается в данной работе как модельная система, содержащая все ферменты жизненного цикла бактерий. Данная система продемонстрировала медиаторный механизм взаимодействия с инертным стеклоуглеродным электродом в буферном растворе с глюкозой в качестве субстрата. Эффективность биоэлектрокаталитического процесса зависела от типа медиаторной системы; природы, температуры, рН и ионной силы буферного раствора. Было показано, что белковый экстракт содержит NAD-зависимую Fe-глюкозодегидрогеназу и демонстрирует плотности тока при медиаторном окислении глюкозы, которые хорошо сопоставимы с известными данными для чистых ферментов дегидрогеназ и микробных систем на E. coli. Полученные результаты свидетельствуют о перспективе дальнейших исследований и практического применения нового типа биоэлектрокатализатора.
ВВЕДЕНИЕ
Биоэлектрокаталитические процессы в настоящее время являются интенсивно изучаемыми. Это связано не только с необычностью и сложностью исследуемых объектов, но и большими перспективами их практического применения. Высокая селективность к большому ряду субстратов обуславливает перспективу применения биоэлектрокатализаторов в сенсорных системах, а превосходная каталитическая способность и индифферентность к окиси углерода открывает потенциальные возможности для замены платиновых катализаторов в низкотемпературных топливных элементах. Области применения биологических топливных элементов на данный момент ограничены генерируемой ими мощностью. Но они уже нашли свою нишу в качестве портативных источников энергии для устройств, потребляющих низкие мощности электроэнергии (мобильные телефоны, самопитаемые биосенсоры, устройства для энергоснабжения имплантируемых медицинских приборов) [1].
Биоэлектрокаталитические системы можно условно разделить на 2 группы: ферментативные топливные элементы, работающие на чистых энзимах, и микробные топливные элементы (МТЭ). Однако основной проблемой получения чистых ферментов является очень сложная и длительная процедура их выделения и очистки, что значительно ограничивает их применение в реальных системах из-за экономической нецелесообразности. Производство микробных катализаторов довольно просто по сравнению с ферментативными, но жизненный цикл и стабильность микробного топливного элемента ограничены, и, кроме того, отходы жизнедеятельности бактерий в электролите могут негативно влиять на работу электрохимического элемента. Резюмируя, можно сказать, что сочетание преимуществ чистых ферментов (отсутствие продуктов жизнедеятельности организма, селективность к субстрату) и микробных (простота получения) катализаторов выглядит очень привлекательно для практики. Такого сочетания можно добиться, используя сырые, т.е. не прошедшие очистку, экстракты микроорганизмов – микробные белковые экстракты.
В нашей предыдущей работе [2] идея использования белкового экстракта в биоэлектрокаталитической реакции окисления глюкозы уже проверялась на целесообразность. В данной работе микробные белковые экстракты, полученные из культуры E. coli, изучались как модельная система. Выбор пал на культуру E. coli, поскольку эта культура широко используется для биоэлектрокаталитических исследований, например, [3‒9] (табл. 1).
Таблица 1.
Биоэлектрокаталитические системы на основе чистых ферментов, полученных из E. coli. Плотности тока указаны относительно геометрической поверхности электродов (анода)
| Система | Плотность тока, мкA/см2 | Ссылка |
|---|---|---|
| МТЭ с E. coli (стеклоуглеродный анод, кислородный газодиффузионный катод, 2-гидрокси-1,4-нафтохинон в качестве медиатора) | 180 | [3] |
| МТЭ с E. coli (анод, катод: платинированный титан, мембрана: Nafion 117) | 138 | [4] |
| МТЭ с E. coli (катод: MnO2, анод: углерод, мембрана, медиатор: метиленовый синий) | 39 | [5] |
| 3-Электродная жидкостная ячейка (анод: иммобилизованная глюкозооксидаза с ферроцен-модифицированным линейным полиэтиленимином, электрод сравнения: насыщ. каломельный) | 153 ± 26 | [6] |
| МТЭ с E. coli (анод: графит/ПТФЭ, катод: 40 мас. % Pt/C, мембрана: Nafion 117) | 0.123 | [7] |
| 3-Электродная жидкостная ячейка (анод: ФАД-глюкозодегидрогеназа/FcMe2–C3–полиэтиленимин, противоэлектрод: платиновая сетка, электрод сравнения: насыщ. каломельный) | 285 | [8] |
| Ферментативный ТЭ (анод: сажа Ketjenblack EC-600JD, НАД-зависимая глюкозодегидрогеназа, катод: сажа Ketjenblack EC-600JD, билирубиноксидаза) | 0.17 | [9] |
В работе [2] было показано, что дегидрогеназная активность белковых экстрактов, оцениваемая по реакции с 2,3,5-трифенилтетразолием хлоридом (ТТХ), зависит от стадии роста культуры и природы субстрата. В отношении субстратов глюкоза и цитрат калия белковые экстракты продемонстрировали высокую биокаталитическую активность, а наиболее высокая биоэлектрокаталитическая активность в электрохимической ячейке наблюдалась при использовании феррицианида калия и метиленового синего как медиаторов. Однако оптимальные условия для функционирования белковых экстрактов в предыдущей работе так и не были найдены. Кроме того для ферментов и микробных систем известны многочисленные типы медиаторов: азиновые производные (феназин [10], метиленовый синий [11, 12], тионин [13], нейтральный красный [14, 15], метиленовый зеленый [16], рибофлавин [17, 18]), ферроцен и его производные (1,1'-дикарбоксиферроцен [19], ферроценкарбоновая кислота [20], 4-ферроценилфенол [21]), редокс- полимеры осмия [22–24], производные хинона (бензохинон [25, 26], 2,5-дибромо-1,4-бензохинон [27]. Такое большое разнообразие медиаторов обусловлено особенностью структуры молекул ферментов, поскольку необходима совместимость медиатора с редокс-центром энзима [28]. Таким образом, выбор медиаторной системы очень важен для эффективного осуществления медиаторного биоэлектрокатализа.
Целью настоящего исследования являлось изучение влияния природы редокс-медиатора и некоторых экспериментальных условий (рН, температура, тип буферного раствора, введение кофермента) на биоэлектрокаталитическую активность микробных белковых экстрактов, полученных из культуры E. coli BB, в реакции окисления глюкозы.
МЕТОДИКА ЭКСПЕРИМЕНТА
Реагенты
KH2PO4, K2HPO4, KOH, H3PO4, NaH2PO4, Na2HPO4,TRIS, MOPS and HEPES (Sigma Aldrich, p.a.) были использованы для приготовлении буферных растворов в тридистиллированной воде (SZ97A Automatic third pure-water distillator, Shanghai Yarong Biochemistry instrument factory). Метиленовый синий, нейтральный красный, рибофлавин, феррицианид калия, бензохинон, 2,4‑динитрофенол и нитрат железа(III) (Alfa Aesar, >98%, p.a.) были использованы в качестве редокс-медиаторных систем. Глюкоза (Avogadro, ultrapure) была использована в качестве субстрата.
Получение белкового экстракта из E. coli
Бактерии выращивали в среде LB, содержащей 1% (в/о) пептона Bacto™ (“BD”, США), 0.5% (в/о) дрожжевого экстракта Bacto™ (“BD”, США), 1% (в/о) NaCl и 0.1% (в/о) глюкозу. Колонию E. coli BB, выращенную на твердой среде (LB, 2% агар) инокулировали в 10 мл LB для получения ночной культуры. Ночную культуру (1 мл) вносили в 100 мл LB в 500-мл колбах и выращивали при 37°С при интенсивной аэрации. Через 4, 6 или 8 ч после начала выращивания бактерии осаждали центрифугированием при 1700 g и использовали для получения экстракта.
Осажденные бактерии ресуспендировали в буферном растворе PB (0.1 M Na2HPO4, 0.1 M NaH2PO4, pH 7.1) из расчета 1 мл на 100 мл выращенной культуры. Клетки разрушали на льду на ультразвуковом дезинтеграторе УЗДН-2Т при частоте 22 кГц в ходе пяти серий по 10 с, охлаждая образцы между сериями. Экстракты осветляли центрифугированием при 15 000 g в течение 15 мин. Экстракты хранили при температуре ‒20°С. Дегидрогеназную активность полученных экстрактов определяли при помощи ТТХ, который под действием дегидрогеназ восстанавливается до окрашенного ТТХ-формазана [2]. В качестве субстрата – источника электронов и протонов, для восстановления ТТХ использовали глюкозу. Реакционная смесь готовилась на калий-фосфатном буферном растворе и содержала 10 мг/мл белка, 33.3 мМ субстрата, 0.17% ТТХ. Реакцию проводили при температуре 37°С в течение часа, для остановки реакции в образцы добавляли 4.2 объема смеси этиловый спирт: уксусная кислота (19 : 1). Денатурированный белок осаждали центрифугированием, супернатант отбирали для измерения количества ТТХ-формазана. Интенсивность окрашивания образцов определяли фотометрией при длине волны 532 нм на планшетном фотометре “Эфос-9305” (“МЗ Сапфир”, Россия), неспецифичное поглощение света определяли при длине волны 620 нм. Количество формазана в образцах определяли по калибровочной кривой, полученной с использованием чистого ТТХ-формазана.
Для определения содержания ионов в активном окислительно-восстановительном центре ферментов в экстракте полученные экстракты изучали при помощи атомно-абсорбционной спектроскопии. Было выявлено, что даже после диализа (мембрана 3.5 кДа) в белковом экстракте представлены только ионы Fe (0.01 мкмоль/мг) и Mg (0.01 мкмоль/мг). Установить природу активных центров дегидрогеназ, содержащих эти ионы, на данном этапе работы не представляется возможным без дополнительных процедур высаливания и электрофореза.
С учетом проблемы лизиса полезных ферментов, обусловленной наличием протеаз в белковом экстракте, дегидрогеназная активность экстракта проверялась в течение длительного периода времени (табл. 2). Тем не менее, полученный экстракт, хранившийся при –20°С между измерениями, сохранял свою активность в течение нескольких недель.
Таблица 2.
Изменения дегидрогеназной активности белкового экстракта в зависимости от времени хранения
| Продолжительность хранения | Температура | Удельная активность, мгформ${\text{мг}}_{{{\text{белка}}}}^{{ - 1}}$ |
|---|---|---|
| Начальный образец | 0.018 | |
| Комнатная | ||
| 2 дня | 0.017 | |
| Неделя | 0.012 | |
| –20°C | ||
| 2 дня | 0.018 | |
| Неделя | 0.018 | |
| 3 недели | 0.006 | |
| 10 недель | 0.006 | |
Электрохимические измерения
Электрохимические эксперименты проводились на потенциостате Autolab PGSTAT 101 (“Metrohm”, Нидерланды) в стандартной стеклянной трехэлектродной ячейке с разделенными пространствами, содержащей 15 мл буферного раствора в качестве фонового электролита. В качестве рабочего электрода использовался стеклоуглеродный дисковый электрод площадью 0.07 см2. Потенциометрические измерения проводились относительно насыщенного хлоридсеребряного электрода сравнения, отделенного от рабочего отделения ячейки стеклянной фриттой. Вспомогательным электродом (противоэлектрод) служила платиновая фольга, также отделенная от рабочего отделения ячейки стеклянной фриттой (для исключения влияния процессов на противоэлектроде). Большинство экспериментов проводилось в инертной атмосфере, дегазирование осуществляли посредством линии Шленка. Активные вещества (медиатор, глюкоза, экстракт биомассы) вводились непосредственно в ячейку, находящуюся под давлением аргона (20 мбар). Все измерения проводились в двух режимах поляризации: 1) потенциодинамический (циклическая вольтамперометрия со скоростью развертки потенциала 20 и 100 мВ/с); 2) потенциостатический (потенциал поляризации выбирался индивидуально для каждой медиаторной системы; для феррицианида калия он составил 0.5 В). Токовые кривые снимались с перемешиванием раствора. Перемешивание выполнялось магнитной мешалкой со скоростью 150 об/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выбор редокс-медиатора
Осуществление эффективного биоэлектрокатализа требует сопряжения ферментативного катализа и электрохимической реакции на электроде. Существуют два принципиально различных пути для достижения этой цели – прямой (безмедиаторный) биоэлектрокатализ и медиаторный биоэлектрокатализ [10]. В случае прямого биоэлектрокатализа (1) реализуется перенос электронов, образующихся в результате окисления субстрата, непосредственно с активного центра энзима на электрод (анод):
(1)
$\begin{gathered} {\text{Substrate}} + {\text{Enzyme}}\xrightarrow{{{\text{Electrode}}}} \\ \to {\text{Product}} + {\text{Enzyme}} + n{\text{e}}. \\ \end{gathered} $Однако, лишь ограниченное число редокс-ферментов способно к осуществлению прямого биоэлектрокатализа [29]. В случае же медиаторного биоэлектрокатализа сам белок не претерпевает редокс-превращений на электроде (не электроактивен), (белок, включающий активный центр, – это, как правило, фермент), а электроны к электроду переносит взаимодействующая с ним медиаторная система, находящаяся на поверхности электрода (твердый медиатор) или в растворе (растворенный медиатор). При взаимодействии субстрата, фермента и медиатора в растворе медиатор восстанавливается и может быть просто окислен на поверхности электрода:
(2)
$\begin{gathered} {\text{Substrate}} + {\text{Enzyme}} + {{{\text{M}}}_{{{\text{Ox}}}}} \to \\ \to {\text{Product}} + {\text{Enzyme}} + {{{\text{M}}}_{{{\text{Red}}}}}, \\ \end{gathered} $(3)
${{{\text{M}}}_{{{\text{Red}}}}}\xrightarrow{{{\text{Electrode}}}}{{{\text{M}}}_{{{\text{Ox}}}}} + n{\text{e}},$Полученные по выше описанной методике белковые экстракты были изучены в реакции окисления глюкозы сначала без добавления медиатора. На стеклоуглеродном электроде, погруженном в раствор, содержащий экстракт и глюкозу, не проявлялись никакие токовые отклики по сравнению с емкостным током в фоновом растворе (рис. 1).
Рис. 1.
Циклические вольтамперограммы (ЦВА) стеклоуглеродного электрода в 0.1 М калий-фосфатном буферном растворе (рН 7.2), содержащем 4.6 мМ глюкозы (1) и в том же растворе с добавлением 0.3 мл белкового экстракта, полученного из 8-часовой культуры E. coli BB (2). Скорость развертки – 100 мВ/с.
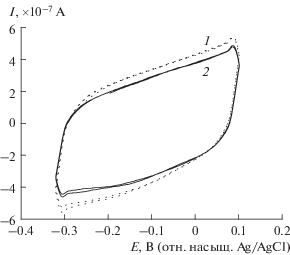
Хроноамперограммы, снятые при различных потенциалах, входящих в окно стабильности данного электролита, не показывают никакого роста токовых откликов при введении в раствор экстрактов белка (рис. 1, кривые 1 и 2). Следовательно, прямой биоэлектрокатализ (прямой перенос электронов) не реализуется в исследуемой системе. Таким образом, для осуществления сопряжения биохимической и электрохимической реакций необходима редокс-медиаторная система.
Рис. 2.
Токовые отклики, полученные при 0.5 В (потенциостатический режим) на стеклоуглеродном электроде в 0.1 М калий-фосфатном буферном растворе рН 7.2, содержащем (1) 4.6 мМ глюкозы и 0.3 мл экстракта; (2) 4.6 мМ глюкозы и 0.5 мМ феррицианида калия; (3) в растворе (2) с добавлением 0.3 мл экстракта.

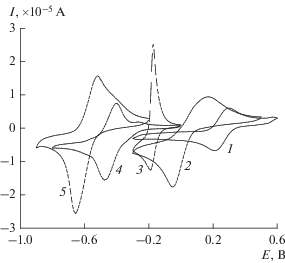
Для выбора редокс-медиаторной системы, которая позволила бы получить токовые отклики на электроде, был протестирован целый ряд водорастворимых медиаторов, применяемых для биологических ферментативных систем: метиленовый синий, нейтральный красный, рибофлавин, 2,4-динитрофенол, феррицианид калия, бензохинон и нитрат железа(III). Их редокс-отклики измеряли в буферном растворе рН 7.2 без каких-либо дополнительных реагентов в потенциодинамическом режиме. Как и ожидалось, из всех редокс-медиаторов нитрат железа оказался неактивным из-за гидролиза соли при исследуемом рН. 2,4-Динитрофенол также оказался неактивным в качестве редокс-системы. На ЦВА-зависимостях, полученных в растворах остальных медиаторов, наблюдаются пары редокс-пиков, соответствующих их превращению из окисленной в восстановленную форму (рис. 3). Для бензохинона этот переход носит необратимый характер.
Рис. 3.
Редокс-отклики медиаторных систем, полученные в 0.1 М калий-фосфатном буферном растворе рН 7.2: 1 – феррицианид калия, 2 – бензохинон, 3 – метиленовый синий, 4 – рибофлавин, 5 – нейтральный красный. Скорость развертки – 100 мВ/с.
Измерения электрохимической активности экстракта, полученного из культуры E. coli BB, в присутствии субстрата (глюкоза), в присутствии этих медиаторных систем проводили в потенциостатическом режиме поляризации. Потенциал выбирали в анодной области за потенциалом анодного пика так, чтобы катодный процесс не оказывал влияния на измеряемые токовые отклики. Медиатор в исходном растворе глюкозы (без добавления ферментного экстракта) находится в окисленном состоянии. Введение в раствор микробного белкового экстракта приводит к окислению глюкозы и восстановлению медиатора в соответствии с уравнением (2) в том случае, когда медиатор может взаимодействовать с ферментом. При высоком анодном потенциале окисление медиатора на поверхности электрода происходит мгновенно (в тот самый момент, когда медиатор в восстановленном виде достиг поверхности электрода). В перемешиваемом растворе концентрация медиатора вблизи поверхности электрода мгновенно обновляется. Таким образом, измеряемый ток пропорционален концентрации образующегося в реакции (2) продукта. В табл. 3 представлены плотности тока, полученные в холостых экспериментах (в буферном растворе медиатора (А), в этом же растворе с добавлением глюкозы (Б)) и также эксперименты с введением белкового экстракта в раствор с глюкозой и медиатором (С).
Таблица 3.
Плотности тока i, полученные на стеклоуглеродном электроде в 0.1 М калий-фосфатном буферном растворе, рН 7.2, при потенциостатическом режиме на 30 мин измерения при потенциале E с добавлением медиатора (А), медиатора и глюкозы (Б), медиатора, глюкозы и белкового экстракта, полученного из 8-часовой культуры E. coli BB (С)
| Медиатор | Концентрация медиатора, мM | E, В | Плотность тока i, мA см–2 | iC/iБ | ||
|---|---|---|---|---|---|---|
| А | Б | С | ||||
| Рибофлавин | 0.18* | –0.200 | 0.90 ± 0.01 | 0.90 ± 0.01 | 2.40 ± 0.01 | 2.6 |
| Нейтральный красный | 0.56 | –0.350 | –0.10 ± 0.01 | –0.10 ± 0.01 | –0.07 ± 0.01 | Не активен |
| 2,4-Динитрофенол | 0.56 | 0.534 | 0.20 ± 0.01 | 0.10 ± 0.01 | 0.050 ± 0.001 | Не активен |
| Бензохинон | 0.56 | 0.534 | 12.4 ± 0.1 | 19.1 ± 0.1 | 62.3 ± 0.1 | 3.3 |
| Метиленовый синий | 0.56 | –0.030 | 0.020 ± 0.001 | 0.02 ± 0.01 | 8.30 ± 0.02 | 415 |
| Феррицианид калия | 0.56 | 0.534 | 0.10 ± 0.01 | 0.10 ± 0.01 | 16.50 ± 0.03 | 165 |
При сравнении фоновых плотностей тока (табл. 3, А) и плотностей тока в растворе медиатора и глюкозы (табл. 3, Б) можно сделать вывод, что практически все медиаторные системы инертны к глюкозе. Достаточно высокий фоновый ток в системе с бензохиноном является результатом наличия восстановленной формы медиатора в образце бензохинона. Кроме того, добавление глюкозы в раствор бензохинона приводит к увеличению плотности тока. Этот результат хорошо воспроизводим (табл. 4, I и II). Увеличение в два раза содержания бензохинона и глюкозы в растворе приводит к соответствующему увеличению плотности тока (табл. 4, III). Этот эффект можно объяснить прямым окислением глюкозы бензохиноном в растворе [30, 31]. После добавления ферментного экстракта в раствор плотность тока заметно увеличилась (табл. 4, IV). Таким образом, происходят два параллельных процесса в системе бензохинон–глюкоза–экстракт: прямое окисление глюкозы бензохиноном и окисление глюкозы белковым экстрактом с последующей передачей электронов на электрод через бензохиноном. Следовательно, бензохинон не может быть использован в качестве медиатора в биоэлектрокаталитических системах, работающих на глюкозе, несмотря на результаты, приведенные в [25, 27].
Таблица 4.
Плотности тока, полученные при 0.5 В на стеклоуглеродном электроде в потенциостатическом режиме на 30 мин измерения в системе “бензохинон–глюкоза–экстракт” при различных содержаниях компонентов. Фоновый раствор: 0.1 М калий-фосфатный буферный раствор, рН 7.2
| № | Система | i, мA см–2 |
|---|---|---|
| I | 0.5 мМ бензохинон | 11 ± 1 |
| II | I + 4.6 мМ глюкоза | 16 ± 1 |
| III | II + 0.5 мМ бензохинон + 4.6 мМ глюкоза | 30 ± 1 |
| IV | III + 0.6 мл экстракта | 44 ± 1 |
Из других медиаторных систем только метиленовый синий и феррицианид калия продемонстрировали высокую плотность тока в присутствии белкового экстракта в растворе (табл. 3, С). Все остальные медиаторы не могут обратимо взаимодействовать с ферментом в наших экспериментальных условиях, вероятно, из-за стерических или зарядовых ограничений.
Для практического применения в биотопливных элементах метиленовый синий кажется более привлекательным, поскольку он обладает низким окислительным потенциалом. Однако восстановленная форма метиленового синего (лейкометиленовый синий) имеет низкую растворимость в воде и необратимо взаимодействует с экстрактом с образованием неэлектроактивных коллоидных продуктов. Более того, в присутствии молекулярного кислорода (воздушной атмосферы) эта восстановленная форма самопроизвольно окисляется без взаимодействия с электродом (химическая окислительно-восстановительная реакция в объеме раствора) [2, 32]. Таким образом, эта медиаторная система, которая обычно используется в биоэлектрокаталитических реакциях [5, 33], не может быть применена на практике, так как способна работать только в инертной атмосфере. Напротив, феррицианид калия обладает гораздо более высоким окислительным потенциалом, тем не менее этот медиатор не чувствителен к присутствию кислорода в системе, как это было показано в нашей предыдущей работе [2], поэтому феррицианид калия подходит для модельных экспериментов с белковыми экстрактами.
Высокие токовые отклики в системе с феррицианидом можно объяснить тем, что белковый экстракт содержит Fe-глюкозодегидрогеназу (см. раздел “Получение белкового экстракта из E. coli”). Возможно, феррицианид образует комплекс с дегидрогеназой, способствующий эффективному переносу электронов.
Так как белковый экстракт, полученный в различных синтезах, может различаться по содержанию белка, необходимо использовать какую-либо удельную характеристику для сравнения. Однако расчет удельных плотностей тока в случае использования белковых экстрактов не является тривиальной задачей, поскольку содержание белка в экстракте включает не только ферменты группы глюкозодегидрогеназ (которые активны в реакции окисления глюкозы), но и все другие белки, образующиеся во время распада клеток. Это означает, что для расчета удельных плотностей тока нужна информация о присутствии глюкозодегидрогеназы в экстракте. В предположении, что TTХ и фермент реагируют в эквивалентных количествах, можно оценить удельную плотность тока на 1 моль формазана (мА см–2 на моль формазана). Мы ясно осознаем, что это всего лишь приближение, однако этого достаточно для сравнения разных экспериментов с белковыми экстрактами, полученными из культуры различного времени жизни и для различных синтезов. Результаты как удельных плотностей тока на 1 мг всего содержания белка, так и на моль формазана (рассчитанные, как описано выше) представлены в табл. 5. Как можно увидеть, удельная плотность тока на 1 мг общего белка j для системы с феррицианидом в 4 раза выше, чем для системы с метиленовым синим, тогда как та же характеристика, рассчитанная на 1 моль формазана только в 3 раза выше из-за различия в активности дегидрогеназы, поэтому молярная удельная плотность тока является более правильной характеристикой для сравнения, чем весовая удельная плотность тока.
Таблица 5.
Удельные плотности тока для медиаторного окисления глюкозы белковым экстрактом, полученным из 8-часовой культуры E. coli BB
| Медиатор | Содержание белка в экстракте, мг мл–1 | j, мA см–2/мг белка | Дегидрогеназная активность, (мг формазана/мг белка, инкубационный период реакции – 60 мин) | j, мА см–2/моль формазана |
|---|---|---|---|---|
| Метиленовый синий | 16.3 | 1.1 ± 0.06 | 0.03 | 37 ± 2 |
| K3[Fe(CN)6] | 23.1 | 4.3 ± 0.2 | 0.04 | 107 ± 6 |
Измеренная удельная плотность тока пропорциональна концентрации медиатора в восстановленной форме. Окисление восстановленной формы медиатора на поверхности электрода в потенциостатических условиях при потенциале 0.5 В отн. Ag/AgCl ограничивается только диффузией электроактивных частиц к поверхности электрода. В перемешиваемом растворе измеряемый ток равен концентрации восстановленной формы медиатора в объеме раствора и концентрации образующегося продукта в соответствии с реакцией (2). Таким образом, с помощью феррицианидной системы можно исследовать влияние различных факторов на биокаталитическую активность полученного белкового экстракта (стадии роста культуры, тип буферного раствора, рН, ионная сила, температура).
Стадии роста культуры
Как сообщалось ранее [2], дегидрогеназная активность экстракта E. coli зависит не только от природы используемого субстрата, но и также от стадии роста культуры, из которой его получают. На различных стадиях роста культуры образуются разные ферменты (глюкозодегидрогеназы, лактатдегидрогеназы, изоцитратдегидрогеназы, малатдегидрогеназы, алкогольдегидрогеназы и др.), количество которых зависит от продолжительности жизни культуры. Плотности тока и удельные плотности тока (рассчитанные на моль формазана в экстракте) для белкового экстракта E. coli, синтезированного на 4, 6 и 8-м часах жизни культуры, показаны в табл. 6.
Таблица 6.
Зависимость удельной плотности тока от содержания белка в белковом экстракте E. coli, полученном на различных стадиях роста культуры. Состав раствора: 0.5 мМ K3[Fe(CN)6], 4.6 мМ глюкозы, 0.5 M калий-фосфатный буферный раствор pH 7.6 и 0.6 мл экстракта
| Время роста E. coli, ч | Содержание белка, мг/мл экстракта | Дегидрогеназная активность, (мг формазана/мг белка, инкубационный период реакции – 60 мин) | Плотность тока i, мA см–2 | j, мA см–2/моль формазана |
|---|---|---|---|---|
| 4 | 10.6 | 0.02 | 18 ± 2 | 42 ± 5 |
| 6 | 20.1 | 0.04 | 50 ± 1 | 31 ± 1 |
| 8 | 23.1 | 0.04 | 59 ± 2 | 32 ± 1 |
Содержание белка в экстракте возрастает при увеличении продолжительности жизни культуры. Удельная плотность тока практически одинакова для экстрактов, полученных из 6- и 8-часовых культур; для экстрактов из 4-часовой культуры этот параметр немного выше, однако воспроизводимость активности для 4-часовой культуры не так достаточна, как для 6- и 8-часовых культур. Таким образом, 6-часовой экстракт можно использовать для электрохимических экспериментов практически с той же эффективностью, что и 8-часовой.
Влияние природы буферного раствора
Состав раствора (тип катионов и анионов) играет важную роль для ферментативной активности, стабильности белка [35–40], и, как было показано в работе [41], природа буферного раствора важна для оптимального интервала рН, для обеспечения стабильности ферментов. Для ферментов используется ряд стандартных буферных систем, однако до сих пор не было проведено исследование по сравнению влияния буферных систем, в которых ферменты обладают заметной биологической активностью, на их электрокаталитическую активность.
Мы попытались сравнить несколько органических буферных систем с pH 7.2 при 32°C: 0.1 M OPS, 0.1 M HEPES, 0.1 M TRIS (табл. 7). Среди органических буферных растворов плотность тока, генерируемого в результате биэлектрокаталитической реакции, возрастает согласно ряду MOPS < HEPES < TRIS. Возможно, что присутствие ОН-групп в их структуре положительно влияет на ферментативную активность. Значения плотности тока, полученные в калий-фосфатном буферном растворе, близки к значениям, полученным при использовании буфера TRIS. Однако реакция, запущенная в натрий-фосфатном буферном растворе, демонстрирует уже более низкие значения плотности тока. Данный результат соответствует порядку ионов K+ и Na+ в рядах Гофмейстера [42]. Таким образом, полученные результаты позволяют предположить, что выбор буферной системы может иметь важное значение для получения высоких токовых откликов в таких системах.
Таблица 7.
Влияние природы буферного раствора на биоэлектрокаталитическую активность белковых экстрактов, полученных из культуры E. coli BB
| Буферный раствор | Структура | Аббревиатура | pKa, 25°C | Ионная сила | Плотность тока, мA см–2 |
|---|---|---|---|---|---|
| 3-Морфолинопропан-1-сульфоновая кислота | 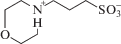 |
MOPS | 7.31 | 0.07 | 27 ± 4 |
| 2-[4-(2-гидроксиэтил) пиперазин-1-ил] этансульфоновая кислота |  |
HEPES | 7.66 | 0.05 | 32 ± 7 |
| 2-Амино-2-(гидроксиметил) пропан-1,3-диол | 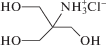 |
TRIS | 8.02 | 0.07 | 50 ± 9 |
| ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }$, ${\text{HPO}}_{4}^{{2 - }}$, ${\text{PO}}_{4}^{{3 - }}$ | PPB (K+) | 7.21* | 0.26 | 41 ± 5 | |
| ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }$, ${\text{HPO}}_{4}^{{2 - }}$, ${\text{PO}}_{4}^{{3 - }}$ | SPB (Na+) | 7.21* | 0.26 | 35 ± 4 |
Влияние рН
Другим немалозначительным фактором, оказывающим влияние на активность ферментов, является значение рН буферного раствора. Исследование рН оптимума проводили в 0.1 М TRIS и 0.5 М калий-фосфатном буферном растворе (концентрация 0.5 М была выбрана после исследования влияния ионной силы, см. ниже).
Для буферной системы TRIS в диапазоне рН 7.2–7.8 был найден только один экстремум при рН 7.2. В то время как для калий-фосфатного буферного раствора при этих значениях было найдено 2 экстремума: 7.2 и 7.6. Мы предположили, что второй экстремум для буферной системы TRIS будет найден при более низком значении рН (однако буферные свойства TRIS (pKa = 8.02) при рН ниже 7.2 не проявляются). Тем не менее мы приготовили два раствора TRIS с рН 6.6 и 7.0. Как видно из табл. 8, действительно, при рН 6.6 плотность тока возрастает. Таким образом, для белкового экстракта, полученного из E. coli, максимальная плотность тока может быть достигнута при рН 7.6 в калий-фосфатном буферном растворе и рН 7.2 в буфере TRIS.
Таблица 8.
Влияние рН буферной системы на биоэлектрокаталитическую активность белковых экстрактов в различных буферных растворах
| pH | 0.1 M TRIS | 0.5 M калий-фосфатный буферный раствор | ||||
|---|---|---|---|---|---|---|
| i, мA см–2 | j, мA см–2 моль–1 | ионная сила, M | i, мA см–2 | j, мA см–2 моль–1 | ионная сила, M | |
| 6.6 | 45 ± 4 | 98 ± 10 | – | – | – | |
| 7.0 | 40 ± 4 | 87 ± 9 | – | – | – | |
| 7.2 | 60 ± 6 | 130 ± 13 | 0.09 | 41 ± 4 | 89 ± 9 | 1.25 |
| 7.4 | 39 ± 4 | 85 ± 9 | 0.08 | 31 ± 3 | 67 ± 7 | 1.32 |
| 7.6 | 36 ± 4 | 78 ± 8 | 0.07 | 55 ± 5 | 120 ± 12 | 1.38 |
| 7.8 | 36 ± 4 | 78 ± 8 | 0.06 | 44 ± 4 | 96 ± 10 | 1.42 |
| 8.0 | – | – | 38 ± 4 | 83 ± 8 | 1.44 | |
Влияние ионной силы буферного раствора
В литературе для ферментов, стабильных в диапазоне рН 7.0–8.0, известно много буферных систем [43–45]. Следует отметить, что эти буферные системы отличаются не только химическим составом, но и ионной силой. Таким образом, оптимальное значение ионной силы для активности ферментов может быть очень важным [46–49].
Для электрокаталитической активности ферментов в системе экстракт E. Coli/Fe(CN6)3–зависимость плотности тока от ионной силы имеет также экстремальный характер, что видно из сравнения результатов, представленных в табл. 9 для буферных систем TRIS (pH 7.2, 32°C) и калий-фосфатного буферного раствора (pH 7.6, 32°C) с различной ионной силой. Более того, для каждой буферной системы существует свое оптимальное значение ионной силы. Для буферной системы TRIS наибольшая плотность тока соответствует 0.1 М буферному раствору, для калий-фосфатного буферного раствора – 0.5 М буферному раствору. Это объясняется тем, что абсорбция буферных ионов на молекуле белка зависит от размера, заряда ионов и их специфического взаимодействия с функциональными группами белков. Таким образом, наибольшая электрохимическая активность ферментов будет зависеть не только от природы буферного раствора или его рН, но и от концентрации буферного раствора. Обычно для таких экспериментов используется 50 мМ буферный раствор, однако для электрохимических измерений такой раствор имеет недостаточную проводимость и, как можно заключить из полученных данных, его концентрация может быть недостаточна для высокой эффективности.
Таблица 9.
Оптимальное значение ионной силы для белкового экстракта E. coli BB, полученного из 6-часовой культуры. Раствор: 0.5 мМ K3[Fe(CN)6] и 4.6 мМ глюкозы
| Концентрация буферной системы, M | Ионная сила, M | Плотность тока i, мA см–2 | Удельная плотность тока j, мA см–2 моль–1 |
|---|---|---|---|
| TRIS, pH 7.2 | |||
| 1.0 | 0.81 | 14 ± 1 | 35 ± 2 |
| 0.5 | 0.40 | 39 ± 1 | 97 ± 3 |
| 0.1 | 0.08 | 60 ± 1 | 146 ± 3 |
| 0.05 | 0.04 | 42 ± 6 | 103 ± 15 |
| Калий-фосфатный буферный раствор, pH 7.6 | |||
| 1.0 | 2.46 | 30 ± 6 | 75 ± 16 |
| 0.5 | 1.38 | 51 ± 6 | 124 ± 14 |
| 0.1 | 0.26 | 30 ± 4 | 74 ± 10 |
| 0.05 | 0.13 | 35 ± 2 | 87 ± 5 |
Влияние температуры
Как было показано для ферментативного катализа, роль температуры раствора очень важна для активности энзимов [50–55]. На рис. 4 представлены результаты, демонстрирующие влияние температуры на удельные плотности тока в системе с белковым экстрактом, полученным из 6-часовой культуры E. coli. Видно, что существует диапазон активации ферментативной активности до 45°С и диапазон инактивации, связанный с началом процесса денатурации. Диапазон активации и оптимальная температура хорошо соответствуют известным данным для чистых дегидрогеназных систем [34].
Рис. 4.
Влияние температуры на электрокаталитическую активность белковых экстрактов: 1 – плотность тока на 30 мин измерения i, 2 – удельная плотность тока j. Рабочий раствор: 1 мМ K3[Fe(CN)6] + 4.6 мМ глюкозы + 0.6 мл экстракта, полученного из 6-часовой культуры E. coli, в 0.5 М калий-фосфатном буферном растворе, рН 7.6.

Влияние добавок кофермента
Низкомолекулярные органические соединения небелковой природы, коферменты, часто необходимы для биоэлектрокаталитических реакций в топливных элементах и сенсорах. Согласно литературным данным, существует более 250 НАД+-зависимых дегидрогеназ и около 150 НАДФ+-зависимых дегидрогеназ [56]. Исследуемый белковый экстракт содержит не только белковые компоненты, но и коферменты, необходимые для активности ферментов. Однако, количество коферментов в белковых экстрактах может быть слишком низкое для того, чтобы обеспечить высокую скорость реакции. Более того, после диализа исследуемого экстракта для удаления фракции с молекулярной массой ниже 3.5 кДа такой экстракт не проявляет никакой активности. Таким образом, добавление коферментов к рабочему раствору может привести к увеличению стационарных плотностей тока. Сначала мы использовали НАД в качестве добавки (в условиях избытка глюкозы и медиатора в растворе), и, как видно из табл. 10, плотность тока увеличилась в 2.5 раза.
Таблица 10.
Влияние концентрации кофермента на активность белковых экстрактов из 6-часовой культуры E. coli BB. Раствор: 5.0 мМ K3[Fe(CN)6] и 4.6 мМ глюкозы, 0.5 M калий-фосфатный буфер, pH 7.6, t = 35°C
| Концентрация (тип) добавляемого кофермента | Плотность тока на 30 мин реакции i, мA см–2 | Удельная плотность тока j, мA см–2 моль–1 |
|---|---|---|
| 0 мкM | 51 ± 6 | 54 ± 7 |
| 4.8 мкM (НАД) | 123 ± 15 | 131 ± 16 |
| 10 мкM (НАД) | 158 ± 19 | 168 ± 20 |
| 10 мкM (НАД) + 10 мкM (НАДФ) | 184 ± 22 | 196 ± 24 |
Введение двойного количества кофермента в раствор приводит к троекратному увеличению токовых откликов. Добавление НАДФ к раствору, содержащему НАД, приводит к увеличению плотности тока только в 1.2 раза. Таким образом, как видно из сравнения электрохимической активности системы белковый экстракт E. coli/Fe(CN6)3–, скорость реакции зависит от содержания кофермента нелинейно. Следует также отметить, что полученные в данной работе результаты по плотности тока (табл. 10) при оптимальных условиях хорошо сопоставимы с имеющимися в литературе данными для систем, работающих на микроорганизмах (табл. 1).
ЗАКЛЮЧЕНИЕ
Микробный белковый экстракт, полученный путем дезинтегрирования культуры Escherichia coli, был изучен в качестве модельной системы для биоэлектрокаталитического окисления глюкозы с целью установления влияния различных условий на его электрохимическую активность. Такой экстракт представляет собой новый тип биоэлектрокатализатора, сочетающий в себе преимущества чистых ферментов и микробных клеток. В результате исследования были найдены некоторые интересные особенности для биоэлектрохимических систем, которые ранее не обсуждались в литературе. В частности, было показано, что бензохинон не может быть использован в биоэлектрокаталитических системах с глюкозой в качестве субстрата, поскольку он сам непосредственно окисляет глюкозу. Также было отмечено существенное влияние природы буферного раствора на электрохимические отклики в системе белковый экстракт E. coli/${\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{\text{3}} - }}.$
Полученные данные наглядно показали, что белковый экстракт можно использовать в качестве электрокатализатора для биоэлектрокаталитических приложений. Наибольший токовый отклик, полученный в такой системе, составил 184 ± 10 мА см–2; влияние рН и температуры на электрохимическую активность в системе, содержащей белковый экстракт, аналогично влиянию этих же факторов на системы с чистыми ферментами или микроорганизмами. Можно заключить, что изученный белковый экстракт, полученный простым способом без какой-либо сложной очистки, привлекателен для дальнейшего практического применения.
Тем не менее, полученный экстракт содержит все необходимые для жизнедеятельности бактерий ферменты и коферменты, в частности лизисные соединения, однако их влияние на активность экстракта проявляется только в течение нескольких недель после его получения. Таким образом, дальнейшее исследование белковых экстрактов в области биоэлектрокатализа может быть очень перспективным для практического применения в биотопливных элементах.
Список литературы
Cosnier, S., Gross, A.J., A. Le Goff, and Holzinger, M., Recent advances on enzymatic glucose/oxygen and hydrogen/oxygen biofuel cells: Achievements and limitations, J. Power Sources, 2016, vol. 325, p. 252.
Dmitrieva, M.V., Zolotukhina, E.V., Gerasimova, E.V., Terent’ev, A.A., and Dobrovol’skii, Y.A., Dehydrogenase and electrochemical activity of Escherichia coli extracts, Appl. Biochem. and Microbiol., 2017, vol. 53, p. 458.
Palmore, G.T.R. and Whitesides, G.M., Microbial and Enzymatic Biofuel Cells, in: Michael E. Himmel, John O. Baker, Ralph P. Overend (Eds.), Enzymatic Conversion of Biomass for Fuels Production, Amer. Chem. Soc., Washington, DC, 1994, p. 271.
Herrero-Hernández, E., Smith, T.J., and Akid, R., Electricity generation from wastewaters with starch as carbon source using a mediatorless microbial fuel cell, Biosens. Bioelectron., 2013, vol. 39, p. 194.
Yong-Jin, Z., Li-Xian, S., Fen, X., and Li-Ni, Y., E. coli Microbial Fuel Cell Using New Methylene Blue as Electron Mediator, Chem. J. Chinese Universities-Chinese, 2007, vol. 28, p. 510.
Neto, S.A., Milton, R.D., Crepaldi, L.B., Hickey, D.P., De Andrade, A.R., and Minteer, S.D., Co-immobilization of gold nanoparticles with glucose oxidase to improve bioelectrocatalytic glucose oxidation, J. Power Sources, 2015, vol. 285, p. 493.
Rahimnejad, M., Adhami, A., Darvari, S., Zirepour, A., and Oh, S.E., Microbial fuel cell as new technology for bioelectricity generation: A review, Alexandria Engineering J., 2015, vol. 54, p. 745.
Milton, R.D., Lim, K., Hickey, D.P., and Minteer, S.D., Employing FAD-dependent glucose dehydrogenase within a glucose/oxygen enzymatic fuel cell operating in human serum, Bioelectrochem., 2015, vol. 106, p. 56.
Miyake, T., Oike, M., Yoshino, S., Yatagawa, Y., Haneda, K., Kaji, H., and Nishizawa, M., Biofuel cell anode: NAD+/glucose dehydrogenase-coimmobilized ketjenblack electrode, Chem. Phys. Lett., 2009, vol. 480, p. 123.
Rabaey, K., Boon, N., Höfte, M., and Verstraete, W., Microbial phenazine production enhances electron transfer in biofuel cells, Environ. Sci. Technol., 2005, vol. 39, p. 3401.
Rahimnejad, M., Najafpour, G.D., Ghoreyshi, A.A., Shakeri, M., and Zare, H., Methylene blue as electron promoters in microbial fuel cell, Intern. J. Hydrogen Energy, 2011, vol. 36, p. 13335.
Rossi, R. and Setti, L., Effect of methylene blue on electron mediated microbial fuel cell by Saccharomyces cerevisiae, Environmental Engineering and Management J. (EEMJ), 2016, vol. 16, p. 2011.
Rahimnejad, M., Najafpour, G.D., Ghoreyshi, A.A., Talebnia, F., Premier, G.C., Bakeri, G., Kim, J.R., and Oh, S., Thionine increases electricity generation from microbial fuel cell using Saccharomyces cerevisiae and exoelectrogenic mixed culture, J. Microbiology, 2012, vol. 50, p. 575.
Park, D.H. and Zeikus, J.G., Electricity generation in microbial fuel cells using neutral red as an electronophore, Appl. and Environmental Microbiol., 2000, vol. 66, p. 1292.
Wang, K., Liu, Y., and Chen, S., Improved microbial electrocatalysis with neutral red immobilized electrode, J. Power Sources, 2011, vol. 196, p. 164.
Li, X., Zhou, H., Yu, P., Su, L., Ohsaka, T., and Mao, L., A Miniature glucose/O2 biofuel cell with single-walled carbon nanotubes-modified carbon fiber microelectrodes as the substrate, Electrochem. Commun., 2008, vol. 10, p. 851.
Sun, J., Li, W., Li, Y., Hu, Y., and Zhang, Y., Redox mediator enhanced simultaneous decolorization of azo dye and bioelectricity generation in air-cathode microbial fuel cell, Bioresour. Technol., 2013, vol. 142, p. 407.
Xu, H. and Quan, X., Anode modification with peptide nanotubes encapsulating riboflavin enhanced power generation in microbial fuel cells, Int. J. Hydrogen Energy, 2016, vol. 41, p. 1966.
Liu, Y. and Dong, S., A biofuel cell harvesting energy from glucose–air and fruit juice–air, Biosens. Bioelectron, 2007, vol. 23, p. 593.
Liu, S.N., Yin, Y.J., and Cai, C.X., Immobilization and characterization of glucose oxidase on single-walled carbon nanotubes and its application to sensing glucose, Chin. J. Chem., 2007, vol. 25, p. 439.
Razumiene, J., Meškys, R., Gureviciene, V., Laurinavicius, V., Reshetova, M.D., and Ryabov, A.D., 4-Ferrocenylphenol as an electron transfer mediator in PQQ-dependent alcohol and glucose dehydrogenase-catalyzed reactions, Electrochem. Commun., 2000, vol. 2, p. 307.
Yuan, Y., Shin, H., Kang, C., and Kim, S., Wiring microbial biofilms to the electrode by osmium redox polymer for the performance enhancement of microbial fuel cells, Bioelectrochem. Bioenerg., 2016, vol. 108, p. 8.
Conghaile, P.Ó., Pöller, S., MacAodha, D., Schuhmann, W., and Leech, D., Coupling osmium complexes to epoxy-functionalised polymers to provide mediated enzyme electrodes for glucose oxidation, Biosens. Bioelectron., 2013, vol. 43, p. 30.
Pankratova, G., Hasan, K., Leech, D., Hederstedt, L., and Gorton, L., Electrochemical wiring of the Gram-positive bacterium Enterococcus faecalis with osmium redox polymer modified electrodes, Electrochem. Commun., 2017, vol. 75, p. 56.
Nien, P.C., Wang, J.Y., Chen, P.Y., Chen, L.C., and Ho, K.C., Encapsulating benzoquinone and glucose oxidase with a PEDOT film: Application to oxygen-independent glucose sensors and glucose/O2 biofuel cells, Bioresour. Technol., 2010, vol. 101, p. 5480.
Harreither, W., Coman, V., Ludwig, R., Haltrich, D., and Gorton, L., Investigation of graphite electrodes modified with cellobiose dehydrogenase from the ascomycete Myriococcumthermophilum, Electroanalysis, 2007, vol. 19, p. 172.
Babkina, E., Chigrinova, E., Ponamoreva, O.G., Alferov, V., and Reshetilov, A., Bioelectrocatalytic oxidation of glucose by immobilized bacteria Gluconobacteroxydans. Evaluation of water-insoluble mediator efficiency, Electroanalysis, 2006, vol. 18, p. 2029.
Ivanov, I., Vidaković-Koch, T., and Sundmacher, K., Recent advances in enzymatic fuel cells: experiments and modeling, Energies, 2010, vol. 3, p. 803.
Stoica, L., Ruzgas, T., Ludwig, R., Haltrich, D., and Gorton, L., Direct electron transfers a favorite electron route for cellobiose dehydrogenase (CDH) from Trametes v illosa. Comparison with CDH from Phanerochaete chrysosporium, Langmuir, 2006, vol. 22, p. 10801.
Hibbert, D.B. and James, A.M., Macmillan Dictionary of Chemistry, Luxembourg: Springer, 1987, 532 p.
Patnaik, P., A Comprehensive Guide to the Hazardous Properties of Chemical Substances, N.Y.: J. Wiley & Sons Ltd, 2007. 1059 p.
Impert, O., Katafias, A., Kita, P., Mills, A., Pietkiewicz-Graczyk, A., and Wrzeszcz, G., Kinetics and mechanism of a fast leuco-Methylene Blue oxidation by copper(II)–halide species in acidic aqueous media, J. Chem. Soc., Dalton Trans., 2003, vol. 3, p. 348.
Zuhri, F., Arbianti, R., Utami, T.S., and Hermansyah, H., Effect of methylene blue addition as a redox mediator on performance of microbial desalination cell by utilizing tempe wastewater, Chem. Eng., 2016, vol. 7, p. 952.
Ghaly, A.E. and Mahmoud, N.S., Optimum conditions for measuring dehydrogenase activity of Aspergillus niger using TTC, Amer. J. Biochem. and Biotechnol., 2006, vol. 2, p. 186.
Zhang, Y. and Cremer, P.S., Interactions between macromolecules and ions: the Hofmeister series, Curr. Opin. Chem. Biol., 2006, vol. 10 (2006), p. 658.
Cacace, M.G., Landau, E.M., and Ramsden, J.J., The Hofmeister series: salt and solvent effects on interfacial phenomena. Quarterly reviews biophys., 1997, vol. 30, p. 241.
Naushad, M., ALOthman, Z.A., Khan, A.B., and Ali, M., Effect of ionic liquid on activity, stability, and structure of enzymes: a review, Int. J. Biol. Macromol., 2012, vol. 51, p. 555.
Keefe, A.J. and Jiang, S., Poly (zwitterionic) protein conjugates offer increased stability without sacrificing binding affinity or bioactivity, Nature chem., 2012, vol. 4, p. 59.
Garajová, K., Balogová, A., Dušeková, E., Sedláková, D., Sedlák, E., and Varhač, R., Correlation of lysozyme activity and stability in the presence of Hofmeister series anions, Biochim. et Biophys. Acta (BBA)-Proteins and Proteomics, 2017, vol. 1865, p. 281.
Okur, H.I., Hladilkova, J., Rembert, K.B., Cho, Y., Heyda, J., Dzubiella, J., Cremer, P.S., and Jungwirth, P., Beyond the Hofmeister Series: Ion-Specific Effects on Proteins and Their Biological Functions, J. Phys. Chem. B, 2017, vol. 121, p. 1997.
Glock, G. E. and McLean, P., Further studies on the properties and assay of glucose 6-phosphate dehydrogenase and 6-phosphogluconate dehydrogenase of rat liver, Biochem. J., 1953, vol. 55, p. 400.
Zhao, H., Olubajo, O., Song, Z., Sims, A.L., Person, T.E., Lawal, R.A., and Holley, L.A., Effect of kosmotropicity of ionic liquids on the enzyme stability in aqueous solutions, Bioorg. Chem., 2006, vol. 34, p. 15.
Shaw, C.R. and Prasad, R., Starch gel electrophoresis of enzymes—a compilation of recipes, Biochem. Genet., 1970, vol. 4, p. 297.
Orr, M.D., Blakley, R.L., and Panagou, D., Discontinuous buffer systems for analytical and preparative electrophoresis of enzymes on polyacrylamide gel, Anal. Biochem., 1972, vol. 45, p. 68.
Selander, R.K., Caugant, D.A., Ochman, H., Musser, J.M., Gilmour, M.N., and Whittam, T.S., Methods of multilocus enzyme electrophoresis for bacterial population genetics and systematic, Appl. Environ. Microbiol., 1986, vol. 51, p. 873.
Cohen, P. and Rosemeyer, M.A., Human glucose-6-phosphate dehydrogenase: purification of the erythrocyte enzyme and the influence of ions on its activity, FEBS J., 1969, vol. 8, p. 1.
Kalnitsky, G., Hummel, J.P., and Dierks, C., Some factors which affect the enzymatic digestion of ribonucleic acid, J. Biol. Chem., 1958, vol. 234, p. 1512.
Leprince, F. and Quiquampoix, H., Extracellular enzyme activity in soil: effect of pH and ionic strength on the interaction with montmorillonite of two acid phosphatases secreted by the ectomycorrhizal fungus Hebeloma cylindrosporum, Europ. J. Soil Science, 1996, vol. 47, p. 511.
Guilbault, G.G., Enzymatic Methods of Analysis: International Series of Monographs in Analytical Chemistry, Amsterdam: Elsevier, 2013. 368 p.
Vroman, H.E. and Brown, J.R.C., Effect of temperature on the activity of succinic dehydrogenase from the livers of rats and frogs, J. Cell. Physiol., 1963, vol. 61, p. 129.
Trevors, J.T., Effect of substrate concentration, inorganic nitrogen, O2 concentration, temperature and pH on dehydrogenase activity in soil, Plant and Soil, 1984, vol. 77, p. 285.
Wolberg, A.S., Meng, Z.H., Monroe, D.M., III, and Hoffman, M., A systematic evaluation of the effect of temperature on coagulation enzyme activity and platelet function, J. Trauma and Acute Care Surgery, 2004, vol. 56, p. 1221.
Immanuel, G., Dhanusha, R., Prema, P., and Palavesam, A., Effect of different growth parameters on endoglucanase enzyme activity by bacteria isolated from coir retting effluents of estuarine environment, Intern. J. Environmental Science & Technology, 2006, vol. 3, p. 25.
Taylor, S., Enzymes in food processing, Amsterdam: Elsevier, 2013. 480 p.
Del Prete, S., De Luca, V., Scozzafava, A., Carginale, V., Supuran, C.T., and Capasso, C., Biochemical properties of a new α-carbonic anhydrase from the human pathogenic bacterium, Vibrio cholera, J. enzyme inhibition and medicinal chemistry, 2014, vol. 29, p. 23.
Lobo, M.J., Miranda, A.J., and Tuñón, P., Amperometric biosensors based on NAD(P) – dependent dehydrogenase enzymes, Electroanalysis, 1997, vol. 9, p. 191.
Дополнительные материалы отсутствуют.


