Электрохимия, 2019, T. 55, № 9, стр. 1080-1090
Регулярная бипористая модель активного слоя положительного электрода литий-кислородного аккумулятора
Ю. Г. Чирков a, *, В. Н. Андреев a, **, В. И. Ростокин b, ***, В. А. Богдановская a, ****
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
b Национальный исследовательский ядерный университет (МИФИ)
115409 Москва, Каширское шоссе, 31, Россия
* E-mail: olga.nedelina@gmail.com
** E-mail: vandr@phyche.ac.ru
*** E-mail: viktor.rostockin@yandex.ru
**** E-mail: bogd@elchem.ac.ru
Поступила в редакцию 27.08.2018
После доработки 12.02.2019
Принята к публикации 30.03.2019
Аннотация
Активный слой положительного электрода литий-кислородного аккумулятора (ЛКА) для обеспечения эффективного протекания кислородной реакции (КР) должен иметь развитую поверхность со сложной структурой пор. При разряде (катодная составляющая КР) в результате ряда электрохимических и химических превращений (соединение ионов лития, молекул кислорода и электронов) на электроде происходит накопление конечного продукта – пероксида лития, который затем окисляется (анодная составляющая КР) при заряде ЛКА. Пероксид лития – нерастворимое и не проводящее электроны вещество, оно осаждается на поверхности, закрывает вход в мелкие поры и препятствует поступлению в них кислорода. Чтобы получить больше пероксида лития при катодном восстановлении кислорода в присутствии ионов лития, в активном слое (АС) создают кластер из крупных практически не закрываемых пероксидом лития пор, они обеспечивают подачу кислорода вглубь АС. Накопление Li2O2 происходит в кластере из более мелких пор с развитой поверхностью. Трудность задачи по созданию оптимальной структуры АС положительного электрода ЛКА заключается в том, что заранее не известны ключевые величины: средние размеры крупных и более мелких пор и доли объема АС, приходящиеся на них. Для решения этой задачи предложено использовать возможности регулярной бипористой модели структуры пор. В этой модели радиусы пор строго фиксированы. Это дает возможность сравнительно просто путем расчета устанавливать связь между параметрами предложенной модели АС катода и габаритными характеристиками ЛКА при разряде. Цель исследования – предложить регулярную бипористую модель активного слоя положительного электрода и разработать методику расчета габаритных характеристик при проведении разряда ЛКА. На конкретных примерах показать, как при варьировании параметров структуры АС положительного электрода и константы процесса расхода кислорода k можно управлять накоплением Li2O2.
ВВЕДЕНИЕ
Концепция литий-кислородных (воздушных) аккумуляторов была предложена еще полвека назад в США [1]. Однако первый успешный литий-воздушный источник тока с неводным электролитом был испытан только в 1996 г. [2], а его приемлемая циклируемость была продемонстрирована еще 10 лет спустя [3].
Использование таких чрезвычайно мощных устройств, предназначенных для хранения энергии (теоретическая оценка – 5200 Вт ч/кг) может привести к значительному прогрессу во многих отраслях экономики (портативная электроника, гибридные средства передвижения, возобновляемые источники энергии) [4–6]. Считается, что удельная энергия новых источников тока будет примерно в 10 раз превышать характеристики ставших уже традиционными и получивших широкое распространение литий-ионных аккумуляторов [7], первая коммерциализация которых началась в 1991 г.
Поскольку литий неустойчив в водной среде, основным направлением развития литий-кислородных аккумуляторов (ЛКА) в настоящее время является разработка систем с апротонными электролитами.
Особенность функционирования положительного электрода ЛКА состоит в том, что в режиме разряда на нем протекает восстановление кислорода (катодная составляющая КР)11, а при заряде – окисление (анодная составляющая КР) образующегося при разряде конечного продукта Li2O2 – нерастворимого в электролите и не электропроводного вещества [8, 9], количество которого должно быть по возможности большим. Этот продукт, образующийся в порах катода, заполняет их, препятствуя поступлению в поры кислорода, что затрудняет наработку новых порций пероксида лития. Таким образом, если не принять специальных мер, то катодный процесс не удастся полноценно реализовать, поэтому итоговая величина емкости положительного электрода в процессе разряда оказывается малой.
Пероксид лития (Li2O2) является конечным продуктом многостадийной реакции катодного восстановления кислорода в присутствии катионов лития [10, 11]:
(1)
$\begin{gathered} {{{\text{О}}}_{{\text{2}}}} + {\text{е}} \to {\text{О}}_{{\text{2}}}^{ - } \\ {\text{О}}_{{\text{2}}}^{ - } + {\text{L}}{{{\text{i}}}^{{\text{ + }}}} \to {\text{Li}}{{{\text{O}}}_{{\text{2}}}}\,\,\,\,\left( {{\text{супероксид}}\,\,{\text{лития}}} \right) \\ {\text{2Li}}{{{\text{O}}}_{{\text{2}}}} \to {{{\text{O}}}_{{\text{2}}}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}\,\,\,\,\left( {{\text{пероксид}}\,\,{\text{лития}}} \right). \\ \end{gathered} $Обратный процесс регенерации кислорода идет на этом же электроде в режиме заряда (анодная составляющая КР):
(2)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{2L}}{{{\text{i}}}^{{\text{ + }}}} + {{{\text{О}}}_{{\text{2}}}} + 2{\text{e}}.$Очевидно, что процесс образования пероксида лития (1) не может полноценно идти, если имеются трудности с осуществлением его первой стадии, получением молекул ${\text{О}}_{{\text{2}}}^{ - }{\text{.}}$ Эта стадия совершается на поверхности пор электропроводного углеродного материала в АС катода, которая служит источником поступления электронов. Помешать протеканию этой стадии могут явления, создающие препятствие для непосредственного контакта диффундирующих из электролита молекул кислорода с поверхностью пор [12]. Существуют, видимо, две главные причины возникающих проблем. Во-первых, на поверхности пор может образоваться тонкий (нанометры) слой из частиц Li2O2 (1), который не электропроводен. Это создает трудности с дальнейшим восстановлением молекул кислорода [13, 14]. Во-вторых, может происходить “закупорка” поры образующимся в ней пероксидом лития и препятствующим поступлению кислорода в пору. Максимальное количество Li2O2 образуется у входа в пору, у ее устья, потому что здесь концентрация кислорода максимальна. Устье поры начинает быстро “зарастать” пероксидом лития, поступление кислорода в пору уменьшается и через определенное время прекращается.
Эти соображения принимали во внимание при моделировании процесса разряда ЛКА в АС катода во многих работах [15–20]. Этих же представлений мы будем придерживаться и в данной статье, при рассмотрении процессов при разряде в АС катода ЛКА.
ЗАДАЧА ИССЛЕДОВАНИЯ
В настоящее время в результате многочисленных экспериментальных и теоретических исследований начало постепенно складываться общее качественное представление о том, какой должна быть оптимальная архитектура пористой структуры АС катода ЛКА. Какие требования надо предъявлять к пористости, удельным поверхностям различных сегментов пор (микропоры, мезопоры, макропоры) и к общей удельной поверхности всех пор. Данная тематика подробно обсуждалась в работах [21–27], было показано, что пористость АС катода, особенности структуры его пор существенно влияют на величину емкости при разряде. В связи с этим, понятно, что в поисках оптимальной пористой структуры положительного электрода экспериментально исследовать огромное количество различных типов пористых материалов затруднительно. Поэтому одновременно с экспериментальными работами проводили компьютерное моделирование пористой структуры электрода и совершающихся в нем процессов [14, 28–31]. Особый интерес представляют здесь теоретические работы [32, 33]. В них развивается новый многоуровневый (multiscale) подход к модельным исследованиям, при котором на характеристики электрода при разряде оказывают влияние уже не отдельные группы пор, но вся совокупность микроструктуры пористого пространства. В [33], например, прямо указывается, что надо стремиться к увеличению общей пористости и что общая удельная поверхность пор должна составлять величину 3.5–4.5 × × 106 см–1. В распределении пор по размерам должны в основном присутствовать два типа пор с размерами 7–8 нм для мелких пор и 33–110 нм для крупных пор.
Анализ имеющихся данных позволяет сформулировать основные требования, предъявляемые к пористой структуре того или иного материала, который может быть использован в качестве АС положительного электрода ЛКА.
1. Наличие макропор с радиусами в сотни нм. Они практически не “зарастают” пероксидом лития и потому могут быть каналами для подачи кислорода вглубь АС.
2. В то же время необходимо и присутствие в катоде мезопор. Они, обладая высокой удельной поверхностью, необходимой для протекания первой стадии электрохимического процесса (1), одновременно имеют значительные объемы, необходимые для запасания в них большого количества образующегося при разряде Li2O2.
3. Дополнительные требования к мезопорам и макропорам. Кластеры этих групп пор, с точки зрения теории перколяции [34], должны быть полностью сформировавшимися, способными обеспечивать транспорт молекул кислорода (кластер из макропор) и ионов лития (кластер из мезопор). Согласно данным, полученным в работах [35, 36] каждый, из этих полноценных кластеров должен занимать в АС не менее 0.35 его объема.
Опираясь на приведенные требования, будем считать, что в бипористом электроде в единице его объема заключены два кластера – с макропорами и мезопорами. Доля объема, приходящегося на макропоры, должна быть, по возможности, выше доли объема, приходящегося на мезопоры. Это связано с тем, что мезопора получает кислород из макропоры в точке их пересечения, и эффективная длина функционирующего участка мезопоры не может быть большой, так как реально мезопоры гофрированы, их сечение может значительно сузиться, что закрывает подачу О2 в мезопоры на большие расстояния. В связи с этим, будем ориентироваться на пористые структуры, в которых среднее расстояние между соседними макропорами невелико. В таком случае, в оптимальном бипористом электроде объем, приходящийся на макропоры, должен превышать объем, отведенный на мезопоры.
Проведем количественные оценки. Удельную поверхность S того или иного сегмента радиусов пор r в катоде можно оценить по формуле:
где v – доля объема катода, приходящегося на поры со средним радиусом r. Предположим, что в условно оптимальном бипористом катоде доля объема макропор v2 = 60%, мезопор – v1 = 40%. Для определенности радиус мезопор r1 = 10 нм, радиус макропор на порядок выше – r2 =100 нм. Тогда для суммарной удельной поверхности такой пористой структуры S* с учетом выражения (3) будем иметь формулу:(4)
$S{\text{*}} = 2\left( {{{v1} \mathord{\left/ {\vphantom {{v1} {r1 + {{v2} \mathord{\left/ {\vphantom {{v2} {r2}}} \right. \kern-0em} {r2}}}}} \right. \kern-0em} {r1 + {{v2} \mathord{\left/ {\vphantom {{v2} {r2}}} \right. \kern-0em} {r2}}}}} \right) \sim {{10}^{6}}\,\,{\text{с}}{{{\text{м}}}^{{{\text{--1}}}}}.$Следует отметить, что хотя исследования типа [32, 33] фундаментальны, чрезвычайно важны и интересны, но они крайне сложны по замыслу и трудоемки при исполнении. В данной работе обсуждаются наиболее общие рекомендации для оптимизации процесса разряда положительного электрода ЛКА и предлагается простая и доступная возможность для оценки того, насколько выбранная конкретная пористая структура перспективна для наработки пероксида лития.
МОДЕЛЬ СТРУКТУРЫ АКТИВНОГО СЛОЯ ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА ЛКА
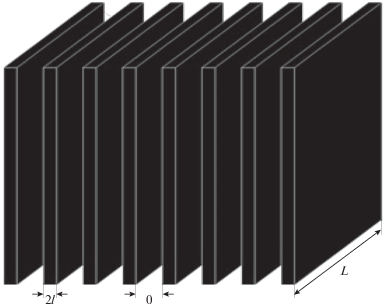
Рассмотрим предлагаемую нами модель структуры АС катода. Она бипориста и регулярна: все макропоры, а также мезопоры имеют свой постоянный радиус. Модель структуры АС электрода ЛКА представлена на рис. 1. Имеется регулярный набор равновеликих крупных щелей шириной δ (эти “макропоры” не “зарастают” пероксидом лития, поэтому являются постоянно действующим каналом для подачи кислорода на большую глубину). Щели разделены между собой монопористыми слоями толщиной 2l, в порах которых и происходит образование нерастворимого и не проводящего осадка Li2O2. С одной из сторон, назовем ее фронтальной, активный пористый слой граничит с газовой фазой, с поступающим из нее в катод кислородом, с противоположной стороны пористая структура граничит с электролитной камерой. Все поры в АС (макро- и мезопоры) заполнены электролитом, содержащим ионы лития. В начальный момент процесса разряда ЛКА концентрация О2 в порах электролита нулевая. Затем начинается диффузионное проникновение молекул кислорода в щели и их последующее поступление в мелкие поры АС. Толщина пористого АС электрода L, его высота H = 1 см (рис. 1).
ДИФФУЗИЯ КИСЛОРОДА В ЩЕЛЯХ
Уравнение, описывающее процесс проникновения кислорода в щели, имеет вид
(5)
${{\delta \partial a{\text{*}}} \mathord{\left/ {\vphantom {{\delta \partial a{\text{*}}} {\partial t{\text{*}}}}} \right. \kern-0em} {\partial t{\text{*}}}} = {{\delta D{{\partial }^{2}}a{\text{*}}} \mathord{\left/ {\vphantom {{\delta D{{\partial }^{2}}a{\text{*}}} {{{\partial }^{2}}x{\text{*}}}}} \right. \kern-0em} {{{\partial }^{2}}x{\text{*}}}} - {{2I\left( {x{\text{*}},t{\text{*}}} \right)} \mathord{\left/ {\vphantom {{2I\left( {x{\text{*}},t{\text{*}}} \right)} F}} \right. \kern-0em} F},$Граничные условия
Принимаем следующие условия: в начальный момент (при t* = 0) все щели в катоде и все поры в пористых слоях свободны от растворенного в электролите кислорода. Обозначим через а = = а*/сО – приведенную концентрацию кислорода в электролите в щелях, где сО – растворимость кислорода в электролите. Тогда в области приведенных координат 0 ≤ х = х*/L ≤ 1, где L – толщина АС катода, в начальный момент в щелях
При этом на фронтальной поверхности катода в любой момент времени имеет место условие А на тыльной стороне АС катода (при х* = L) в щелях(8)
${{\partial a} \mathord{\left/ {\vphantom {{\partial a} {\partial x}}} \right. \kern-0em} {\partial x}} = 0\,\,{\text{при}}\,\,x = 1.$В новых обозначениях для величин уравнение (5) принимает вид:
где t = t*/t** – приведенное время, а t** = L2/D – характерное время для процесса диффузии в щелях.ПРОЦЕСС ОБРАЗОВАНИЯ Li2O2 В ПОРИСТЫХ АКТИВНЫХ СЛОЯХ
Кислород поступает в два пористых полуслоя из зазоров-щелей. Допускаем, что концентрация ионов лития в заполняющем поры катода электролите остается практически постоянной.
Многостадийный процесс образования пероксида лития (1) сложен и недостаточно изучен экспериментально и теоретически. В целом этот процесс обычно характеризуют величиной константы, обозначим ее как k, которая входит в выражение для потока расходуемого кислорода, идущего на образование Li2O2. Константа k – константа процесса расхода кислорода (ее размерность – см/с).
Следует отметить, что отсутствие возможности количественно оценивать константу k, знать ее точную численную величину для выбранного пористого материала АС положительного электрода и типа электролита (апротонный растворитель с солями лития), который обеспечивает ионную проводимость, все это существенно затрудняет проведение теоретических расчетов и практических оценок. Поэтому в дальнейшем величину k будем произвольно варьировать.
Рассмотрим процессы, протекающие в АС. Допускаем, что концентрация ионов лития в порах высока, и будем считать концентрацию кислорода c* в электролите основной величиной, определяющей процесс разряда на катоде. С учетом того, что при заполнении отдельной поры конечным продуктом реакции восстановления кислорода (Li2O2) в каждом сечении поры меняются доли объема свободного пространства g и реального радиуса поры r*, отличного от начального радиуса поры ro, можно сформулировать систему уравнений, которые описывают ход совершающихся в катоде процессов [15, 19, 37]:
(10)
${{\partial \left( {gc{\text{*}}} \right)} \mathord{\left/ {\vphantom {{\partial \left( {gc{\text{*}}} \right)} {\partial t}}} \right. \kern-0em} {\partial t}} = {{\partial \left( {D{\text{*}}{{\partial c{\text{*}}} \mathord{\left/ {\vphantom {{\partial c{\text{*}}} {\partial y}}} \right. \kern-0em} {\partial y}}} \right)} \mathord{\left/ {\vphantom {{\partial \left( {D{\text{*}}{{\partial c{\text{*}}} \mathord{\left/ {\vphantom {{\partial c{\text{*}}} {\partial y}}} \right. \kern-0em} {\partial y}}} \right)} {\partial y}}} \right. \kern-0em} {\partial y}} + R\left( {c{\text{*}},g,t{\text{*}}} \right),$(11)
$R\left( {c{\text{*}},g,r{\text{*}}} \right) = - 2gk{{c{\text{*}}} \mathord{\left/ {\vphantom {{c{\text{*}}} {r{\text{*}}}}} \right. \kern-0em} {r{\text{*}}}},$(12)
${{\partial g} \mathord{\left/ {\vphantom {{\partial g} {\partial t{\text{*}}}}} \right. \kern-0em} {\partial t{\text{*}}}} = R(c*,g,r*){{{{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}.$В уравнениях (10)–(12) y – координата данного сечения поры (в сечении y = 0 мелкая пора в пористых слоях выходит в щель, в сечении y = l пора достигает половины пористого слоя, здесь y = l), t* – данный момент времени.
В системе соотношений (10)–(12) R(c*, g, r*) – убыль кислорода в результате возникновения продукта реакции Li2O2, выделившегося в данном сечении поры. k, см/c – константа процесса расхода кислорода.
Далее, τ – извилистость пор. ${{{{{\text{M}}}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{{\text{M}}}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}$ – молярный объем, приходящийся на пероксид лития. ${{{\text{M}}}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}},$ г/моль – его мольная масса и ${{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}},$ г/см3 – плотность Li2O2, а
эффективный коэффициент диффузии кислорода в электролите, D – коэффициент диффузии кислорода в электролите. Полагаем, что извилистость пор связана с пористостью отношением [38]В процессе разряда из щели в прилегающие к ней два пористых слоя подается кислород. На стенках пор в пористых слоях он принимает электрон и затем вступает во взаимодействие с ионами лития. Образующийся в итоге процесса (1) конечный продукт Li2O2 откладывается в порах, постепенно заполняя их начальный объем (уменьшаются r* и g). Процесс подачи кислорода и образование в поре пероксида лития будем считать законченным, когда на граничащей со щелью фронтальной поверхности пористого слоя остается незаполненными продуктом реакции 10% объема пор. Тогда можно считать, что пора практически “зарастает” пероксидом лития, поступление молекул кислорода в пору прекращается.
Рассмотрим два уравнения с тремя неизвестными – c*, g и r*. Однако, последние две величины связаны соотношением
(15)
${{\left( {{g \mathord{\left/ {\vphantom {g {{{g}_{0}}}}} \right. \kern-0em} {{{g}_{0}}}}} \right)}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}} = {{\left( {{{r{\text{*}}} \mathord{\left/ {\vphantom {{r{\text{*}}} {{{r}_{0}}}}} \right. \kern-0em} {{{r}_{0}}}}} \right)}^{2}},$Введем для пор набор приведенных величин: приведенной координаты z = y/l, при этом координата z находится в пределах 0 ≤ z = y/l ≤ 1. Так как в поры кислород может поступать только из щели, то, если в данном сечении щели, к которому примыкает пора концентрация кислорода a = 0 (кислород отсутствует), во всех сечениях рассматриваемой поры выполняются условия:
(16)
$r = {{r{\text{*}}} \mathord{\left/ {\vphantom {{r{\text{*}}} {{{r}_{0}}}}} \right. \kern-0em} {{{r}_{0}}}} = 1\,\,{\text{и}}\,\,c = {{c{\text{*}}} \mathord{\left/ {\vphantom {{c{\text{*}}} {{{c}_{{\text{O}}}}}}} \right. \kern-0em} {{{c}_{{\text{O}}}}}}\,\,{\text{при}}\,\,0 < z \leqslant 1.$При этом на фронтальной (примыкающей к щели) поверхности поры для концентрации имеем условие
На тыльной стороне активного пористого полуслоя катода принимаем, что
(18)
${{\partial c} \mathord{\left/ {\vphantom {{\partial c} {\partial z}}} \right. \kern-0em} {\partial z}} = 0\,\,{\text{при}}\,\,z = 1,$(19)
$t = {{t{\text{*}}} \mathord{\left/ {\vphantom {{t{\text{*}}} {t{\text{***}}}}} \right. \kern-0em} {t{\text{***}}}},\,\,\,r = {{r{\text{*}}} \mathord{\left/ {\vphantom {{r{\text{*}}} {{{r}_{0}}}}} \right. \kern-0em} {{{r}_{0}}}},\,\,z = {y \mathord{\left/ {\vphantom {y l}} \right. \kern-0em} l},\,\,c = {{c{\text{*}}} \mathord{\left/ {\vphantom {{c{\text{*}}} {{{c}_{{\text{O}}}}}}} \right. \kern-0em} {{{c}_{{\text{O}}}}}},$В системе двух взаимно согласованных процессов – диффузия с оттоком кислорода из щели и притоком кислорода в мелкие поры, ведущие к образованию пероксида лития –имеем два характерных времени: большое для щели t** = L2/D и малое для мелких пор t*** = l 2/D. Однако процессы в щели и в порах идут одновременно, поэтому естественно взять за основу большее по величине характерное время L2/D, полагая процесс образования пероксида лития в пористых слоях более быстрым, нежели диффузия кислорода в щелях.
С учетом всего сказанного можно представить выражения (10)–(12) в виде системы двух уравнений относительно двух главных переменных с и r:
(20)
${{\partial {{r}^{{{4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3}}}}c} \mathord{\left/ {\vphantom {{\partial {{r}^{{{4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3}}}}c} {\partial t}}} \right. \kern-0em} {\partial t}} = \alpha \partial \left( {{{{{r}^{2}}\partial c} \mathord{\left/ {\vphantom {{{{r}^{2}}\partial c} {\partial z}}} \right. \kern-0em} {\partial z}}} \right) - 2\beta {{r}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}c,$(21)
${{\partial r} \mathord{\left/ {\vphantom {{\partial r} {\partial t}}} \right. \kern-0em} {\partial t}} = - \gamma c,$(22)
$\begin{gathered} \alpha = {{({L \mathord{\left/ {\vphantom {L l}} \right. \kern-0em} l})}^{{\text{2}}}}g_{0}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}},\,\,\,\,\beta = {{k{{L}^{{\text{2}}}}} \mathord{\left/ {\vphantom {{k{{L}^{{\text{2}}}}} {D{{r}_{{\text{0}}}}}}} \right. \kern-0em} {D{{r}_{{\text{0}}}}}}, \\ \gamma = k({{{\text{3}}{{L}^{{\text{2}}}}{{с}_{{\text{O}}}}} \mathord{\left/ {\vphantom {{{\text{3}}{{L}^{{\text{2}}}}{{с}_{{\text{O}}}}} {{\text{2}}D{{r}_{0}}}}} \right. \kern-0em} {{\text{2}}D{{r}_{0}}}})({{{{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}). \\ \end{gathered} $Конечный итог расчетов – оценка изменений во времени t в зависимости от концентрации кислорода в щели а(х, t), величины габаритного тока I(х, t), А/см2 ЛКА, его следует рассчитывать согласно формуле:
(23)
$I(х,\,\,t) = k[{{{\text{4}}F{{g}_{0}}{{с}_{{\text{O}}}}l} \mathord{\left/ {\vphantom {{{\text{4}}F{{g}_{0}}{{с}_{{\text{O}}}}l} {{{r}_{{\text{0}}}}}}} \right. \kern-0em} {{{r}_{{\text{0}}}}}}]\int\limits_{z = 0}^{z = 1} {\left[ {{{r}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}{\text{ }}(x,z,\,\,t)c(х,z,\,\,t)} \right]\partial z} .$Зависимость от времени количества накопленного в элементарной ячейке заряда Q, Кл и его конечную величину можно рассчитать по формуле:
(24)
$Q = {\text{2}}LH\int\limits_{t = 0}^T {\int\limits_{x = 0}^{x = 1} {I\left( {х,\tau } \right)\partial \tau \partial х} } ,$Проведенное рассмотрение процессов позволяет рассчитать, как со временем меняется распределение концентрации а(х) по толщине щели и как меняется со временем по толщине щели распределение габаритного тока I(х, t).
ВЫБОР ПАРАМЕТРОВ ДЛЯ РАСЧЕТОВ
Данные о величинах растворимости кислорода сO и коэффициента диффузии D в пяти электролитах приведены в табл. 1 [19]. Остальные параметры для проводимых ниже расчетов представлены в табл. 2. Величину параметра k, который пока точно не удается определить, будем варьировать.
Таблица 1.
Растворители (растворимость кислорода и коэффициент диффузии)
| Растворитель | сО, 10–6 моль см–3 | D, 10–6 см2 с–1 |
|---|---|---|
| Пропиленкарбонат (PC) | 3.20 | 2.24 |
| Тетраглим (TEGDME) | 4.43 | 2.17 |
| Сульфолан (SL) | 1.47 | 12.00 |
| Диметилсульфоксид (DMSO) | 2.10 | 16.70 |
| Диметоксиэтан (DME) | 9.56 | 12.20 |
Таблица 2.
Параметры экспериментальной модели, принятой для расчетов
| Параметр | r0, 10–7 см | L, см | g0 | ${{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$, г моль–1 | ${{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$, г см–3 | δ, 10–4 см | l, 10–4 см |
|---|---|---|---|---|---|---|---|
| Значение | 2.00 | 0.07 | 0.73 | 45.8768 | 2.3 | 1 | 5 |
МЕТОДИКА РАСЧЕТОВ
Описание того, как во времени ведут себя два сопряженных диффузионных процесса (система уравнений (9) и (20), (21)) – сложная задача. Чтобы упростить ее, воспользуемся тем, что характерное время процесса диффузии кислорода в щелях катода t** = L2/D оказалось на порядки больше характерного времени процесса диффузии в пористых слоях t*** = l 2/D[g0]1/2 (табл. 2). В исследуемой задаче возник малый параметр – t***/t** = l 2/L2[g0]1/2. Это обстоятельство дает возможность получить приближенное решение задачи.
Будем полагать, что процесс диффузии кислорода совершается в пористых слоях, в сравнении с диффузией кислорода в щели, практически “мгновенно”. И так как в любом сечении щели совершается по мере заполнения щели кислородом увеличение приведенной концентрации кислорода от 0 и выше, вплоть до 1, то вначале следует создать массив следующих данных. Постепенно увеличивая концентрацию кислорода от 0 до 1, каждый раз фиксировать возникающую при этом величину габаритного тока двух пористых полуслоев (пространство элементарной ячейки катода с регулярной бипористой структурой).
Решение уравнений проводили последовательно дискретными временными шагами. Процессы диффузии кислорода в пористых полуслоях и заполнения кислородом щели можно рассматривать последовательно для каждого интервала времени. С учетом большой разности характерных времен этих процессов. Алгоритм численного решения выполняли следующим образом:
1. Выбирали достаточно малый интервал Δt1 безразмерного времени, ток I = 0 (согласно начальным условиям), численно решали уравнение (9) и определяли распределение концентрации a(x, t1) вдоль щели, удовлетворяющее граничным условиям (7), (8) и начальному условию (6).
2. Пространство щели разделено на N областей, каждое шириной Δx = 1/N, в пределах каждой из которых a(xi, t1), взятое в середине данной области, задает граничное условие (17) на фронтальной поверхности полуслоя.
3. Для каждой цилиндрической поры, имеющей контакт со щелью в точке xi (i = 1,…, N), решаем уравнения (20), (21), предварительно преобразовав их к виду:
(25)
$\begin{gathered} \frac{\partial }{{\partial t}}{{c}_{i}}\left( {z,t} \right) = {{r}_{i}}{{\left( {z,t} \right)}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}\frac{{{{\partial }^{2}}{{c}_{i}}(z,t)}}{{\partial {{z}^{2}}}} + \frac{2}{{{{r}_{i}}{{{\left( {z,t} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}}} \times \\ \times \,\,\frac{{\partial {{r}_{i}}\left( {z,t} \right)}}{{\partial z}}\frac{{\partial {{c}_{i}}\left( {z,t} \right)}}{{\partial z}} + \frac{{{{c}_{i}}\left( {z,t} \right)\left( {\beta - \frac{4}{3}\gamma {{c}_{i}}\left( {z,t} \right)} \right)}}{{{{r}_{i}}\left( {z,t} \right)}}, \\ \frac{\partial }{{\partial t}}{{r}_{i}}\left( {z,t} \right) = - \gamma {{c}_{i}}\left( {z,t} \right),\,\,\,\,\frac{\partial }{{\partial x}}{{r}_{i}}\left( {z,t} \right) = {{v}_{i}}(z,t), \\ \end{gathered} $(26)
$\begin{gathered} {{с}_{i}}(0,t) = a{\text{*}}(x_{i}^{*},t),\,\,\,\,\,\,\frac{\partial }{{\partial z}}{{с}_{i}}(l,t) = 0, \\ \frac{\partial }{{\partial z}}{{v}_{i}}(l,t) = 0,\,\,\,(0 \leqslant t \leqslant {{t}_{1}}) \\ \end{gathered} $4. Рассчитав распределение величин сi(z, t1) и ri(z, t1) в поре, вычисляем значение габаритного тока I(xi, t1) в каждой поре и путем сплайн-интерполяции определяем функцию I(x, t1) согласно формуле (23). На этом 1-й шаг вычислений завершен.
5. Далее, на каждом очередном интервале Δtn = = tn – tn – 1 решаем уравнение (9) уже с учетом габаритного тока, а начальными условиями для амплитуд служат значения a(xi, 0) = a(xi, tn – 1), полученные на предыдущем шаге.
6. Затем находим распределения концентрации сi(z, tn) и радиусов пор ri(z, tn) в момент времени tn, решая систему уравнений (25) для каждой i‑й поры с начальными условиями:
(28)
${{c}_{i}}(z,0) = {{c}_{i}}(z,{{t}_{{n - 1}}});\,\,\,\,{{r}_{i}}(z,0) = {{r}_{i}}(z;\,\,{{t}_{{n - 1}}}).$Вычисляем габаритный ток I(x, tn) и повторяем численное решение для следующего интервала времени. Когда радиус ri(0, t) устья поры становится меньше 0.1, считаем ее не активной, не дающей вклад в габаритный ток, и потому исключаем ее из рассмотрения. Процесс вычисления габаритного тока и остальных параметров заканчивается, когда “закрывается” последняя (N-я) система пор.
Численное решение дифференциальных уравнений в частных производных (9), (25) проводили с помощью математического пакета Maple [39, 40].
РЕЗУЛЬТАТЫ РАСЧЕТОВ
Для катода ЛКА с растворителем РС была проведена оценка порядка величин параметра k. Результат – k = 1.025 × 10–8 см/с. Исходя из этого, для АС катода с регулярной бипористой структурой мы достаточно произвольно выбрали три значения для k: 10–5, 10–6 и 10–7 см/с.
С учетом данных, принятых для расчетов и приведенных в табл. 2, имеем три кривых зависимости роста накопленного в элементарной ячейке (шириной δ + 2l) заряда Q, Кл от времени. В качестве растворителя выберем тетраглим, данные о растворимости кислорода в нем и величина коэффициента диффузии указаны в табл. 1.
На рис. 2 показано, как со временем разряда катода растет заряд Q в отдельной элементарной ячейке регулярной бипористой модели (рис. 1) для трех выбранных нами значений константы процесса расхода кислорода k. Конечные значения зарядов для кривых 1–3, Кл: 0.5915; 0.4375 и 0.2641.
Рис. 2.
Зависимость от времени разряда катода ЛКА количества заряда, накопленного в отдельной элементарной ячейке (щель плюс два примыкающих к ней пористых полуслоя). k, см/с: 1 – 10–5, 2 – 10–6, 3 – 10–7.

Так как на квадратном сантиметре фронтальной поверхности принятой нами регулярной бипористой модели число элементарных ячеек n = = 1/(δ + 2l), соответственно, площадь, приходящаяся на отдельную щель s = (δ + 2l)H, то величины удельной емкости С для трех катодов можно определить по формуле:
(29)
$C = {Q \mathord{\left/ {\vphantom {Q {\left( {\delta + 2l} \right)H}}} \right. \kern-0em} {\left( {\delta + 2l} \right)H}} = Qn,$Удельная масса АС катода (m) рассчитана по формуле:
(30)
$m,\,\,{{\text{г}} \mathord{\left/ {\vphantom {{\text{г}} {{\text{с}}{{{\text{м}}}^{2}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{2}}}} = L\left[ {{{2l} \mathord{\left/ {\vphantom {{2l} {\left( {\delta + 2l} \right)}}} \right. \kern-0em} {\left( {\delta + 2l} \right)}}} \right]\left( {1 - g} \right)\rho ,$(31)
$C,\,\,{{{\text{мА}}\,{\text{ч}}} \mathord{\left/ {\vphantom {{{\text{мА}}\,{\text{ч}}} {\text{г}}}} \right. \kern-0em} {\text{г}}} = {{C \times {{{10}}^{3}}} \mathord{\left/ {\vphantom {{C \times {{{10}}^{3}}} {{{3600} \mathord{\left/ {\vphantom {{3600} {\left( {3.78 \times {{{10}}^{{ - 2}}}} \right)}}} \right. \kern-0em} {\left( {3.78 \times {{{10}}^{{ - 2}}}} \right)}}}}} \right. \kern-0em} {{{3600} \mathord{\left/ {\vphantom {{3600} {\left( {3.78 \times {{{10}}^{{ - 2}}}} \right)}}} \right. \kern-0em} {\left( {3.78 \times {{{10}}^{{ - 2}}}} \right)}}}}.$Окончательно теперь имеем значения для емкостей, мA ч/г: 3951.4; 2922.5 и 1764.4.
Видно, что с уменьшением константы процесса расхода кислорода k время достижения максимального разряда падает, а продолжительность времени разряда растет. Для трех выбранных нами величин параметра k, согласно данным расчета (рис. 2), имеем для времени проведения разряда t три значения, с: 6500; 9900 и 21136 с.
Рассмотрим, как со временем разряда изменяется по толщине модели АС положительного электрода профиль распределения концентрации кислорода в электролите щели. Считаем, что параметр k = 10–5 см/c. Рассмотрим данные рис. 3а. По принятым условиям проведения расчетов после начала разряда, в течение 9 с осуществляется поступление кислорода в электролит, заполняющий щели. Только после этого начинают действовать процессы образования пероксида лития в пористых слоях.
Рис. 3.
Распределение приведенной величины концентрации кислорода в электролите по толщине щели в отдельной элементарной ячейке при k = 10–5 см/с (а) и k = 10–7 см/с (б). Момент приведенного времени (t, с) а: 9 – 1 (время начального поступления растворенного в электролите кислорода в щель); 84.3 – 2; 273 – 3; 1795 – 4, 3675 – 5; 5310 – 6; 6435 – 7; б: 200 – 1, 300 – 2, 700 – 3; 1100 – 4; 1700 – 5; 3000 – 6; 21000 – 7.
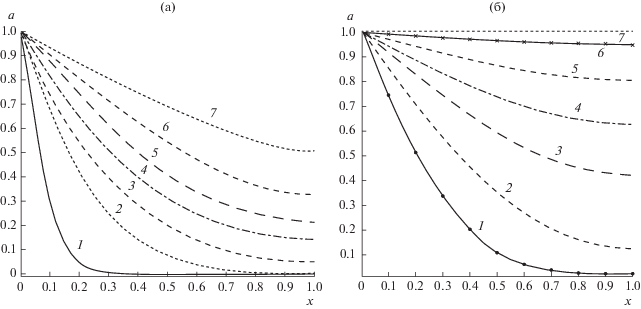
С течением времени профиль изменения концентрации кислорода в электролите щели а(х) постепенно начинает приподниматься, как это показано на рис. 3а. Это связано с тем, что поры, ближайшие к устью щелей (х = 0), “закрываются” (их контактирующее со щелью сечение “зарастает” пероксидом лития, и дальнейший доступ кислорода в пору прекращается).
При этом подъем профиля концентрации кислорода в электролите в щели ограничен некоторым пределом, так как по условиям расчета процесс разряда прекращается, когда “закрывается” последняя пора в пористом слое у тыльной поверхности модели (рис. 1).
Уменьшим теперь константу процесса расхода кислорода на два порядка, до значения k = = 10–7 см/с. При этом, происходит постепенная деформация кривых а(х), как показано на рис. 3б.
При очень малых значениях параметра k уход из щели растворенного в нем кислорода становится малым. Поэтому в момент остановки процесса разряда ЛКА профиль распределения концентрации кислорода в электролите щели становится практически горизонтальным.
С течением времени распределение тока I, А/см2 по толщине пористого слоя модели представлено на рис. 4а. Здесь параметр k велик: k = = 10–5 см/с. Кривая 1 показывает начальное распределение концентрации кислорода в электролите щелей. Кривая 2 показывает уже количество образовавшегося в порах пероксида лития. Его содержание велико у устья щели, где концентрация кислорода в щели максимальна (см. данные рис. 3а), и мало у тыльной стороны модели, ибо здесь мала концентрация кислорода. Кривые 3 и 4 рис. 4а имеют аналогичный характер, при этом у устья щели выработка пероксида лития постепенно снижается, а у тыльной стороны модели растет. На кривых 5–8 у фронтальной поверхности модели (при х = 0) в пористых слоях идет постепенно “закрытие” пор, поступление кислорода в них прекращается. При этом участки, не вносящие вклада в генерируемый ток, постепенно расширяются.
Рис. 4.
Распределение величины габаритного тока по приведенной толщине регулярной бипористой модели при k = = 10–5 см/с (а) и при k = 10–7 см/с (б). Момент времени (t, с) а: 9 – 1; 165 – 2; 570 – 3; 975 – 4; 1683 – 5; 2460 – 6; 3978 – 7; 5310 – 8; б: 100 – 1; 200 – 2; 400 – 3; 800 – 4; 1400 – 5; 2400 – 6; 3900 – 7; 4900 – 8.

Несколько иной характер имеют распределения тока в случае малых значений параметра k. Принимаем величину k равной 10–7 см/с. Тогда при малых временах (кривые 1 и 2 на рис. 4б) распределения токов имеют характерную зависимость постепенного спада тока с увеличением толщины АС. Но (см. рис. 3б), в силу слабости процесса образования пероксида лития в порах, концентрация кислорода в электролите щели по ее толщине быстро выравнивается, и наблюдается выравнивание и распределений токов по толщине модели (см. кривые 3–5 на рис. 4б). Со временем наступает момент “закрывания” пор вблизи фронтальной поверхности модели, и вклад в генерацию тока начинают вносить лишь все более сужающиеся участки пор у тыльной поверхности модели (см. кривые 6–8 на рис. 4б).
Рассмотрим, как во времени изменяются габаритные токи при трех значениях параметра k в каждой отдельной ячейке регулярной бипористой модели (рис. 5). В начальные моменты разряда габаритный ток стремительно растет, так как по мере быстрого проникновения кислорода в щель в образование Li2O2 вовлекается все большее и большее количество пор в активных пористых слоях. Затем габаритный ток достигает своего максимума. А из-за последующего возрастающего “закрывания” пор у фронтальной поверхности катода неизбежно начинается спад габаритного тока до нуля.
ЗАКЛЮЧЕНИЕ
Для создания действующих литий-кислородных (воздушных) источников тока необходимо решить ряд задач для их практической реализации. В данной работе продолжается поиск оптимальной структуры АС положительного электрода, которая смогла бы обеспечить получение необходимого количества пероксида лития на стадии разряда. Обзор имеющейся литературы по вопросам экспериментального и теоретического (моделирование) характера позволяет в настоящее время сформулировать требования, которые предъявляют к особенностям структуры АС положительного электрода. Они дают возможность оценить, насколько пористая структура того или иного материала является перспективной для проведения процесса разряда.
Однако поиски материалов для АС положительного электрода с оптимальной пористой структурой обычно сопряжены с большими трудностями, поскольку в ЛКА на процесс разряда оказывают влияние уже не отдельные группы пор, но вся совокупность пористой микроструктуры. Прежде всего, необходимо иметь достаточно выраженную бипористую структуру катода. Возникает потребность создать адекватную этим требованиям модель, которая к тому же давала бы возможность оперативно путем расчетов устанавливать связь габаритных характеристик катода с особенностями его пористой структуры.
Предложенная в данной работе модель регулярной бипористой структуры АС катода представляет собой набор крупных щелей (эти “макропоры” позволяют кислороду проникать вглубь катода), разделенных между собой однотипными монопористыми слоями (в их мезопорах фиксированного радиуса идет накопление пероксида лития). Для предложенной регулярной бипористой модели АС катода ЛКА предложены алгоритмы, позволяющие вести расчеты основных габаритных характеристик в процессе разряда: изменение профиля концентрации кислорода в щели, изменение со временем величины габаритного тока и емкости. Приведены примеры подобных расчетов и дано их обсуждение. Кроме того, установлена зависимость удельной емкости катода и времени проведения разряда от величины константы процесса расхода кислорода k, которая определяет скорость образования пероксида лития.
СПИСОК ОСНОВНЫХ ОБОЗНАЧЕНИЙ
δ толщина щели в регулярной бипористой модели
2l толщина пористых слоев
L толщина активного слоя катода
r0 начальный радиус пор
g0 начальная пористость пористых слоев
а(х, t) приведенная концентрация кислорода в электролите в щелях
х приведенная координата толщины щели
с(y, t) приведенная концентрация кислорода в электролите в порах
сО растворимость кислорода в электролите
D коэффициент диффузии молекул кислорода в электролите
k, см/c константа процесса расхода кислорода в порах пористого слоя
Q, Кл количества заряда, накопленного в отдельной элементарной ячейке (щель плюс два примыкающих к ней пористых полуслоя)
С, Кл/см2 величина емкости катода
I, А/см2 величина габаритного тока
Список литературы
Toni, J.E.A., McDonald, G.D., and Elliott, W.E., Lithium-moist air battery.1966. Fort Belvoir, Virginia.
Abraham, K.M. and Jiang, Z., A polymer electrolyte-based rechargeable lithium/oxygen battery, J. Electrochem. Soc., 1996, vol. 143, p.1.
Ogasawara, T., Débart, A., Holzapfel, M., Novák, P., and Bruceet, P.G., Rechargeable Li2O2 Electrode for Lithium Batteries, J. Am. Chem. Soc., 2006, vol. 128, p. 1390.
Christensen, J., Albertus, P., Sanchez-Carrera, R. S., Lohmann, T., Kozinsky, B., Litdike, R., Jasim, A., and Kojic, A., A critical review of Li/air batteries, J. Electrochem. Soc., 2011, vol. 159(2), p. R1.
Luntz, A. and Bryan, D., Nonaqueous Li-air batteries: a status report, Chem. Rev., 2014, vol. 114(23), p. 11721.
Imanishi, N., Luntz, A., and Druce, P., The Lithium Air Battery: Fundamentals, Springer, Berlin, 2014.
Bruce, P., Freuriberger, S., Hardwick, L., and Tarascon, J., Li–O2 and Li–S batteries with high energy storage, Nat. Mater., 2012, vol. 11, p. 19.
Yang, X., He, P., and Xia, Y., Preparation of mesocellular carbon foam and its application for Lithium/Air Battery, Electrochem. Commun., 2009, vol. 11(6), p. 1127.
Tran, C., Yang, X., and Qu, D., Investigation of the gas-diffusion-electrode used as lithium/air cathode in non-aqueous electrolyte and the importance of carbon material porosity, The J. Power Sourc., 2010, vol. 195(7), p. 2057.
Laoire, C., Mukerjee, S., Abraham, K., Plichta, E., and Hendrickson, M., Elucidating the mechanism of oxygen reduction for lithium-air battery applications, J. Phys. Chem. C, 2009, vol. 113(46), p. 20127.
Laoire, C., Mukerjee, S., Abraham, K., Plichta, E., and Hendrickson, M., Influence of nonaqueous solvents on the electrochemistry of oxygen in the rechargeable lithium-air battery, J. Phys. Chem. C, 2010, vol. 114(19), p. 9178.
Jones, R., Gittleson, F., Templeton, J., and Ward, D., A simple model for interpreting the reaction-diffusion characteristics of L-air batteries, J. Electrochem. Soc., 2017, vol. 164(1), p. A6422.
Chen, X., Bevara, V., Andrei, P., Hendrickson, M., Plichta, E., and Zheng, J., Combined effects of oxygen diffusion and electronic resistance in Li-air batteries with carbon nanofiber cathodes, J. Electrochem. Soc., 2014, vol. 161(12), p. A1877.
Xue, K., Nguyen, T., and Franco, A., Impact of the cathode microstructure on the discharge performance of lithium air batteries: a multiscale model, J. Electrochem. Soc., 2014, vol. 161(8), p. E3028.
Sandhu, S., Fellner, J., and Brutchen, G., Diffusion-limited model for a lithium/air battery with an organic electrolyte, J. Power Sourc., 2007, vol. 164(1), p. 365.
Petru, A., Zheng, J., Hendrickson, M., and Plichta, E., Some possible approaches for improving the energy density of Li–air batteries, J. Electrochem. Soc., 2010, vol. 157(12), p. A1287.
Albertus, P., Girishkumar, G., VcCloskey, B., Sanchez-Carrera, R., Kozinsky, B., Cristensen, J., and Luntz, A., Identifying capacity limitations in the Li/oxygen battery using experiments and modeling, J. Electrochem. Soc., 2011, vol. 158, no. 3, p. A343.
Xianglin, I. and Faghri, A., Optimization of the cathode structure of Lithium-air batteries based on a two-dimensional, transient, non-isothermal model, J. Electrochem. Soc., 2012, vol. 159(10), p. A1747.
Dabrowski, T., Struck, A., Fenske, D., Maaß, P., and Colombi Ciacchi, L., Optimization of Catalytically Active Sites Positioning in Porous Cathodes of Lithium/Air Batteries Filled with Different Electrolytes, J. Electrochem. Soc., 2015, vol. 162(14), p. A2796.
Wang, Y., Wang, Z., Yuan, H., and Li, T., Discharge oxide storage capacity and voltage loss in Li-air battery, Electrochim. Acta, 2015, vol. 180, p. 382.
Younesi, R., Urbonaite, S., Bjorefors, F., and Edstrom, K., Influence of the cathode porosity on the discharge performance of the lithium-oxygen batatery, J. Power Sourc., 2011, vol. 196, p. 9835.
Meini, S., Piana, M., Beyer, H., Schwammlein, J., and Gasteiger, H., Effect of carbon surface area on first discharge capacity of Li-O2 cathodes and cycle-life behavior in ether–based electrolytes, J. Electrochem. Soc., 2012, vol. 159, p. A2135.
Ma, S., Lee, D., Roev, V., Im, D., and Doo, S., Effect of porosity on electrochemical properties of carbon materials as cathode foe lithium-oxygen battery. J. Power Sources., 2013, vol. 244, p. 494.
Zhang, Y., Zhang, H., Li, J., Wang, M., Nie, H., and Zhang, F., The use of mixed carbon materials with improved oxygen transport in a lithium-air battery, J. Power Sources., 2013, vol. 240, p. 390.
Lin, X., Zhou, L., Huang, T., and Yu, A., Hierarchically porous honeycomb-like carbon as a lithium-oxygen electrode, J. Mater. Chem., A, 2013, vol. 1, p. 1239.
Olivares-Marin, M., Palomino, P., Enciso, E., and Tonti, D., Simple method to relate experimental pore size distribution and discharge capacity in cathodes for Li–O2 batteries, J. Phys. Chem. C, 2014, vol. 118, p. 20772.
Ma, Z., Yuan, X., Li, L., Ma, Z., Wilkinson, D., Zhang, L., and Zhang, J., A review of cathode materials and structures for rechargeable lithium-air batteries. Energy Environ. Sci., 2015, vol. 8, p. 2144.
Li, X., Huang, J., and Faghri, A., A critical review of macroscopic modeling studies on Li–O and Li–air batteries using organic electrolyte: Challenges and opportunities, J. Power Sources., 2016, vol. 332, p. 420.
Wang, Y., Modeling discharge deposit formation and its effect on lithium–air battery performance, Electrochim. Acta, 2012, vol. 75, p. 239.
Bevara, V. and Andrei, P., Changing the cathode microstructure to improve the capacity of Li–air batteries: Theoretical predictions, J. Electrochem. Soc., 2014, vol. 161(14), p.12.
Andersen, C., Hu, H., Qiu, G., Kalra, V., and Sun, Y., Pore-scale transport resolved model incorporating cathode microstructure and peroxide growth in lithium-air batteries, J. Electrochem. Soc., 2015, vol. 162(7), p. A1135.
Bao, J., Hu, W., Bhattacharya, P., Stewart, M., Zhang, J., and Pan, W., Discharge performance of Li-O2 batteries using a multiscale modeling approach, J. Phys. Chem. C, 2015, vol. 119(27), p. 14851.
Pan, W., Yang, X., Bao, J., and Wang, M., Optimizing discharge capacity of Li–O2 Batteries dy design of air-electrode porous structure: Multifidelity modeling and optimization, J. Electrochem. Soc., 2017, vol. 164(11), p. E3499.
Тарасевич, Ю.Ю. Перколяция: теория, приложения, алгоритмы. М.: Эдиториал УРСС, 2011, 112 с.
Чирков, Ю.Г. Теория пористых электродов: перколяция, расчет линий перколяции. Электрохимия. 1999. Т. 35. С. 1449. [Chirkov, Yu.G., Russ. J. Electrochem., 1999, vol. 35, p. 1281.]
Чирков, Ю.Г., Ростокин, В.И., Скундин, А.М. Компьютерное моделирование работы положительного электрода литий-ионного аккумулятора: модель равновеликих зерен, перколяционные расчеты. Электрохимия. 2011. Т. 47. С. 77. [Chirkov, Yu.G., Rostokin, V.I., and Skundin, A.M., Russ. J. Electrochem, 2011, vol. 47, p. 71.]
LaBolle, E., Quastel, J., and Fogg, G., Diffusion theory for transport in porous media: Transition-probability densities of diffusion processes corresponding to advection-dispersion equations, Water Resources Research, 1998, vol. 416(7), p.1685.
Petersen, E., Diffusion in a pore of varying cross section, AIChE Journal, 1958,vol. 4(3), p. 343.
Чарльз Генри Эдвардс, Дэвид Э. Пенни. Дифференциальные уравнения и краевые задачи: моделирование и вычисление с помощью Mathematica, Maple и MATLAB, 3-е издание, Киев: Диалектика-Вильямс, 2007, ISBN 978-5-8459-1166-7.
Голоскоков, Д.П. Уравнения математической физики. Решение задач в системе Maple, СПб: Питер, 2004.
Дополнительные материалы отсутствуют.