Электрохимия, 2019, T. 55, № 9, стр. 1069-1079
Электрохимическое поведение полианилина в присутствии ванадат-аниона
В. В. Абаляева a, *, Н. Н. Дремова a
a Учреждение Российской академии наук, Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
* E-mail: avva@icp.ac.ru
Поступила в редакцию 09.06.2017
После доработки 21.12.2018
Принята к публикации 13.02.2019
Аннотация
В сернокислотном электролите проведены химический и электрохимический синтез полианилина (ПАни) в присутствии ванадат-иона (ВК). Полученные композитные материалы на основе ПАни и ВК (ПАни–ВК) охарактеризованы ИК, рентген, СЭМ и элементным анализом. В ходе электрохимических испытаний обозначены условия, при которых за 50 циклирований полученный композитный материал сохраняет 96% своей электрохимической емкости (С), а циклирование ПАни–ВК в расширенной в анодную и катодную области потенциалов не приводит к деградации полимерного материала.
ВВЕДЕНИЕ
В настоящее время активно ведется разработка методов синтеза и изучения материалов, которые могут быть потенциальными компонентами изделий по сохранению энергии [1–3]. Для их создания широко используются углеродные материалы (углеродные нанотрубки, графены) и оксиды металлов, т.е. такие материалы, которые могут, во-первых, обеспечить высокую удельную поверхность, что приводит к увеличению значения двойнослойной емкости, и, во-вторых, расширить окно потенциалов для зарядно-разрядных процессов. Основными недостатками для их практического применения являются относительно низкие собственные удельная емкость и плотность энергии [4–7]. Для улучшения характеристик создаваемых материалов могут быть использованы несколько способов: применение в качестве компонентов новых композитов, например материалов, обеспечивающих стабильные значения двойнослойной емкости, создающих высокую псевдоемкость и позволяющих расширить окно потенциалов. Перспективными кандидатами для суперконденсаторных электродов являются композитные материалы на основе полианилина (ПАни) и окисных соединений металлов с переменной валентностью, как показывающих достаточно высокие значения удельной емкости [5, 8]. Некоторые оксиды переходных металлов, такие как оксиды индия, ванадия и вольфрама, являются псевдоемкостнымим материалами с большим окном потенциалов, и, таким образом, могут быть использованы в качестве альтернативы электродам на основе углерода. Значительное внимание среди них привлекают окисные соединения ванадия [9]. Предполагается, что ванадаты могут показать высокие значения псевдоемкости вследствие наличия нескольких состояний окисления ванадия [10], что позволяет на его поверхности проводить целый ряд окислительно-восстановительных процессов. Окислительный потенциал системы V+5/V+4 зависит от pH среды и может быть повышен путем увеличения кислотности раствора [11]. Оксиды ванадия хорошо себя зарекомендовали при потенциалах –1…+0.9 В [12, 13]. ПАни в качестве компонента композитного материала хорошо изучен из-за своей простоты синтеза и высокой стабильности на воздухе. Можно предположить, что комбинация этих двух компонентов в одном материале откроет возможность создания нового композитного высокоемкого электродного элемента для суперконденсатора. В настоящей работе обсуждается применение ванадиевой кислоты (ВК) в качестве электроактивного участника химического и электрохимического синтезов (ЭС) ПАни–ВК и обсуждаются свойства и условия эффективной работы полученных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ЭС ПАни проводился в потенциодинамическом режиме в интервале потенциалов –0.2…+0.7 В (относительно Ag/AgCl) в трехкамерной стеклянной электрохимической ячейке (используемый объем электролита 15 мл) при комнатной температуре (21–22°С). Пространства рабочего и вспомогательного электродов были разделены пористой стеклянной перегородкой. Рабочие растворы, используемые в данной работе в качестве электролитов, представлены в табл. 1. Полученный из Э1 образец обозначен ПАни-С, из электролитов с добавлением ВК, соответственно, различные варианты ПАни-ВК с уточнением способа синтеза. Рабочим электродом являлась поверхность стеклоуглеродного (СУ) стержня диаметром 5 мм (S = = 0.2 см2), впаянного в стеклянную трубку. Вспомогательным электродом служила СУ-пластина 1 × 5 см. Наработка продукта в больших количествах для физико-химических исследований проводилась на СУ-пластине размером 1 × 5 см. Все потенциалы приведены относительно Ag/AgCl. Растворы приготовлены на свежеперегнанной дистиллированной воде с рН 6.7. Для измерения рН подготовленных электролитов использовали портативный рН-метр “Cheker” фирмы Hanna (Португалия) с точностью измерения ±0.2 рН. Электрохимические испытания полученных материалов были проведены на потенциостате PS-7 (фирма Элинс, Россия) с компьютерным программированием. Электрохимические данные в цифровой форме обрабатывали на компьютере.
Таблица 1.
Состав электролитов, используемых для синтеза и исследования ПАни–ВК
| Электролит (шифр) | Состав | Количество в смеси | Анилин (Ан) : ВК | рН |
|---|---|---|---|---|
| Э1 | Анилин сульфат (АС) в H2SO4 | 0.2 М АС в 1 М H2SO4 | ||
| Э2 | ВК в H2O (насыщенный р-р) | ВК 0.66 × 10–3 моль | 5.2 | |
| Э3 | 3 мл Ан + 500 мл Э2 | 33 × 10–3 моля Ан 0.33 × 10–3 моля ВК |
100 | 5.3 |
| Э3 (а) | 250 мл Э3 + H2SO4 до рН 4 | |||
| Э3 (б) | 250 мл Э3 + HCl до рН 4 | |||
| Э4 | H2SO4 | 1 М | ||
| Э5 | Э4 + Э2 | Э4 (15 мл) Э2 (15 мл) = 1 × 10–5 моля |
1.2 | |
| Э6 | Э1 + Э2 | Э1 (15 мл) = 3 × 10–3 моля Э2 (3 мл) = 2 × 10–6 моля |
1500 | 1.3 |
Электронномикроскопические исследования проводили на растровом электронном автоэмиссионном микроскопе Supra 25 производства Zeiss с рентгеноспектральной энергодисперсионной приставкой INCA Energy производства Oxford Instruments для определения элементного состава образцов, полученных в химическом синтезе. Разрешение на получаемых изображениях составляет величину 1–2 нм. ИК-спектры снимали на инфракрасном фурье-спектрометре Perkin E-lmer Spectrum 100, оснащенном приставкой многократного нарушенного полного внутреннего отражения с германиевой призмой в диапазоне 4000–675 см–1. Сухие образцы помещали на призму приставки и прижимали с помощью механического прижимного устройства. Сравнительную характеристику структуры полученных препаратов оценивали методом рентгеновской дифрактометрии на приборе ARL X’TRA (Швейцария). Исследуемые образцы в виде порошка растирали в вазелиновом масле и помещали в кювету из плавленого кварца.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
1. Образование ПАни-ВК
Ванадий в степени окисления +5 может образовывать разнообразные ванадиевые соли (ванадаты), как мономерные – мета-, орто-, пиро-, так и полимерные – гекса-, дека-, додека-. Он также способен формировать комплексные соединения с различными ионами и с органическими лигандами. Указанные формы ванадат-ионов в растворе находятся в равновесии, но в каждом интервале рН преобладает та или иная форма [14, 15]. Ванадиевые кислоты по силе близки к уксусной. Потенциал перехода ванадия от высшей степени окисления +5 к следующей +4 и далее сильно зависит от pH среды и может быть повышен путем увеличения кислотности раствора. Восстановление V+5 также наблюдается при взаимодействии раствора ванадата в сернокислой среде с каким-либо восстановителем [11, 14]. В нашем случае таким одноэлектронным восстановителем может выступить молекула Ан, которая при одноэлектронном окислении до катион-радикала становится началом полимеризационной цепочки. На возможность такого каталитическорго эффекта и об особенностях образования связи ПАни–V2O5, следствием чего, например, стала разработка нового перспективного катодного материала, указывают авторы работ [16, 17].). Таким образом, в растворе Ан и ВК при рН ≤ 4 может проходить реакция восстановления V+5 до V+4 с одноэлектронным окислением Ан, дающая начало образованию ПАни, который со временем выпадает из раствора в виде темного осадка (ПАни–ВК(а)1), свойства которого будут обсуждены далее. Отфильтрованный осадок промыт дистиллированной водой и высушен в вакуум-пистолете при 40°С в течение суток. Элементный анализ выделенного осадка позволяет приписать ему формулу [С5.7Н5N(VО3)0.3(SО4)0.3 · 2Н2О].
2. Электрохимический синтез ПАни–ВК
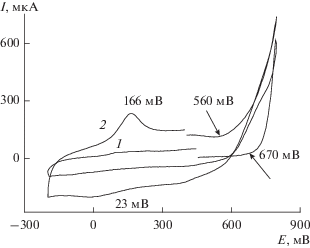
ЭС ПАни из электролита, содержащего ВК (осуществляемый до полного выпадения осадка) проходит в условиях наличия в электролите инициатора ЭС, в качестве которого выступает V+5. Как уже было отмечено, из этого электролита начинается и химический синтез ПАни–ВК, скорость прохождения которого можно замедлить поддержанием значения рН ≤ 4. На рис. 1 приведены примеры первых циклов ЭС, проведенных в потенциодинамическом режиме в Э1 (ЦВА1) и в Э6 (ЦВА2). Из данных рисунка можно сделать вывод, что ход ЭС, обозначенный циклической вольтамперной характеристикой (ЦВА), ЦВА2 в отличие от ЦВА1 уже на первой катодной и далее анодной ветви показывает образование ПАни, что доказывается появлением на этой ЦВА2 на первом же цикле пиков восстановления образующегося продукта 23 мВ и его окисления 166 мВ. На ЦВА1 первые циклы не обнаруживают образования продуктов олигомеризации Ан. К тому же, как видно из этих ЦВА, начальный Еок Ан расположен при 670 мВ в электролите Э1 (ЦВА1), в то время как начальный Еок Ан в электролите Э6 (ЦВА2) на 110 мВ ниже. Также было выяснено, что в серной и соляной кислотах ЭС ПАни в присутствии ВК проходит по-разному.
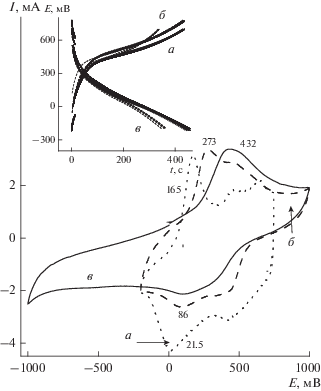
Начало и ход ЭС ПАни в обеих кислотах показаны на рис. 2. Для обеих кислот условия взаимодействия ВК с Ан были соблюдены полностью. 500 мл раствора Э3 стояли на воздухе в течение месяца (Ан : ВК = 100). Раствор все это время оставался прозрачным, желтым и не менял цвет. Через месяц раствор разделили на две части и добавили в одну часть серной кислоты до рН 4 (раствор Э3 (а)), в другую – соляной кислоты до рН 4 (раствор Э3 (б)). Такое значение рН было выбрано, чтобы максимально замедлить скорость выпадения осадка и дать возможность проведения одновременно химического синтеза и ЭС ПАни из одного и того же раствора. Раствор Э3 (а) в течение нескольких минут после добавления серной кислоты начал темнеть, и из него начал медленно выпадать темный осадок (ПАни–ВК (а)1). ЭС проводился из этого раствора параллельно с началом выпадения осадка в потенциодинамическом режиме на СУ-электроде. Ход ЭС показан на рис. 2а, ЦВА1. С первого же цикла начинается активный рост полимерного покрытия электрода, который продолжается до момента остановки ЭС. За 15 циклов было получено покрытие (ПАни–ВК (а)2), итоговая ЦВА которого показана на верхней вкладке рис. 2а. На этом же рисунке пунктирной кривой (ЦВА2) показан ход ЭС ПАни-ВК (а)3 из Э6, где соотношение Ан : ВК = = 1500. ЦВА1 и ЦВА2 показывают первые циклы ЭС. Начало ЭС на обеих ЦВА фиксируется увеличением площади ЦВА, и на первом же цикле появляются пики образующихся продуктов полимеризации. Общее количество ПАни, полученного за 10 циклов из Э6 показано на ЦВА (нижняя вкладка).
Рис. 2.
(а) Ход ЭС из Э3(а) в присутствии H2SO4 при рН 4 (первый цикл ЦВА1). Развитие ЦВА отклика в ходе ЭС ПАни–ВК (а)2 за 15 циклов (верхняя вкладка). Начало ЭС из Э6 (первый цикл ЦВА 2) и развитие ЦВА отклика в ходе ЭС ПАни–ВК (а)3 (нижняя вкладка) за 10 циклов. 50 мВ/с. (б) Ход ЭС из Э3 (б) в присутствии HCl при рН 4 (ЦВА1 и ЦВА2 – первые два цикла ЭС). Развитие ЦВА отклика в ходе ЭС ПАни–ВК (б)2 за 50 циклов (вкладка).

В растворе Э3 (б), в который была добавлена соляная кислота (также до рН 4), в течение нескольких минут не наблюдалось никаких видимых изменений, цвет раствора продолжал оставаться желтым. Когда все-таки раствор начал темнеть, из него медленно начал выпадать осадок (ПАни-ВК (б)1), одновременно был проведен ЭС, ход которого показан на рис. 2б. На 1-м цикле, который показан на основном рис. 2б, присутствует пик окисления при 676 мВ, так же как и в предыдущем опыте, который скорее всего принадлежит окислению V+4 до V+5. Далее, начиная со 2 цикла, нет пиков, соответствующих окислительным превращениям ванадиевой компоненты, возможно вследствие того, что на катодной ветви ЦВА отсутствует пик восстановления V+5. Весь последующий ЭС шел очень медленно. За 50 циклов получено тонкое покрытие (ПАни–ВК (б)2), причем к 50-му циклу ЭС практически прекратился, вероятно вследствие образования полимера с большим сопротивлением. Эта общая картина обозначена на ЦВА рис. 2б на верхней вкладке. ЦВА образовавшегося покрытия напоминает ЦВА полимера, который был подвергнут в анодной области переокислению с образованием многочисленных хиноидных невосстанавливаемых групп и всевозможных сшивок между цепями [18].
В результате в каждом из описанных ЭС получено два (в случае серной кислоты) и одно (в соляной кислоте) полимерных покрытия. О количестве полученных полимеров можно судить по площади ЦВА обоих ЭС. Причем, совершенно очевидно, что более активно окисление Ан и сам ЭС проходят при прочих равных условиях в электролитах с серной кислотой. Возможно, такое разное поведение исследуемых соединений и скорость и количество образующегося ПАни объясняются тем, что при подкислении водного раствора ВК и Ан серной кислотой [19] образуется сульфованадил (VO2)2SO4, для которого, как сообщают авторы, облегчаются переходы ванадия от высшей степени окисления +5 к низшей +2 через все промежуточные степени окисления при взаимодействии раствора ванадата натрия в сернокислой среде с каким-либо восстановителем cоответствующей силы. Восстановителем для перехода V+5/V+4 в нашем случае выступает молекула Ан, а для следующих ступеней восстановления ванадия восстановителем может быть прилагаемый потенциал. Причем, более активно окисление Ан и сам ЭС проходят при прочих равных условиях в электролитах с серной кислотой. Следует также отметить, что был проведен ЭС ПАни из электролита Э3, не содержащего минеральной кислоты с рН 5.2. Такой ЭС практически останавливался в течение первых нескольких циклов, и накопления полимера не наблюдалось.
3. Физико-химическое изучение полученных Пани–ВК
На микрофотографиях морфология полимеров, полученных из Э1 (ПАни-С) (рис. 3, фото а) из Э6 и Э3 (ПАни–ВК (а)3 и ПАни-В (а)1) (рис. 3, фото б, в соответственно) различается. ПАни-С, полученный из Э1 на фото представляет достаточно однородную смесь глобулярных частиц с диаметром 20–50 нм и с четко обозначенными краями, в то время как диаметр частиц ПАни–ВК (а)3, полученных в электролите Э6 (с соотношением Ан : ВК = 1500) (фото б), значительно больше (около 50–100 нм), они более объемны, но также представляют собой достаточно рыхлую массу. Частицы ПАни-ВК (а)2, полученные в электролите Э3(с соотношением Ан : ВК = 100) (фото в) как бы склеены между собой, и этот факт может привести к уменьшению площади поверхности. Интересной является обнаруженная возможность образования ПАни на поверхности ВК просто прикапыванием раствора Э1 на поверхность ВК. В месте контакта Э1 с ВК сразу образуется черное пятно, а вокруг оставшийся материал ВК продолжает оставаться желтым (черно-белая фото-вставка на рис. 3г). Если аккуратно снять образовавшийся полимер, то он покажет на микроснимке картину, которая представлена на рис. 3г. Сам образующийся полимер представляет собой желеобразную массу. Вероятно, в присутствии большого избытка ВК имеет место факт активной агрегации трубок ПАни за счет покрывающих их в избытке оксидных соединений V, как это уже было отмечено в работе [18, 19]. Причем, как замечено авторами этих работ, аналогичная агрегация трубок ПАни в присутствии окисных соединений V приводила к резкому падению электрохимической емкости (С), благодаря чему авторам удалось выявить зависимость количества вводимого соединения оксида V в состав полимера для сохранения его стабильных электрохимических характеристик. Элементный анализ нашего материала, полученного после прикапывания Э1 на ВК, показывал небольшое содержание углеродистого компонента (ПАни), что подтверждает образование олигомеров на поверхности ВК, основную массу которых составляла ВК (так как в данном случае разделить их было очень сложно). На микрофотографиях (рис. 3д, 3е, 3ж) показаны СЭМ-изображения ВК (д, е) и поверхности ВК (ж), частично покрытой образовавшимися на ней частицами полимера. Элемент осадка укрупнен и показан на вставке в верхнем правом углу. Видно, что этот продукт представляет собой малоструктурированную железообразную массу, которая получается при значительном избытке ВК, в то время как сама ванадиевая основа сохраняет свою кристаллическую структуру. Также следует отметить, что в укрупненном масштабе все обсуждаемые материалы (а, б, в) сохраняют губчатую морфологию с возможностью достаточно свободного проникновения электролита вглубь материала.
Рис. 3.
СЭМ-изображения: (а) ПАни-С, (б) ПАни–ВК (а)3, (в) ПАни–ВК (а)2, (д, е) ВК, (ж) ВК с образовавшимся на поверхности элементом ПАни, (г) общий вид ВК с элементом покрытия, показанном на рис. (ж); на вкладыше черно-белое изображение фото ВК, на который капнули раствором Ан.

В ИК-спектре ПАни–ВК (рис. 4, спектры 2–6) присутствуют полосы, отвечающие за колебания бензоидных и хиноидных группировок (по аналогии со спектром ПАни-С на рис. 4, спектр 7) 1485 и 1577 см–1 [20, 21]. Также в области 1100–1300 см–1 отмечены полосы, которые приписаны к различным вариантам колебания связей С–N, N=Q=N и т.д. [21]. ИК ПАни-С (рис. 4, кривая 7) содержит характерную для сульфо-аниона широкую полосу в районе 1000–1100 см–1. Колебания в области 745 и 980 см–1 обозначают наличие в составе полимера окисных соединений ванадия, для которых полоса 745 см-1 обозначает наличие V–О-связи [19], полоса 980 см–1 говорит о наличии V=O-связи [16, 22]. Две последние полосы являются характерными для спектра ВК (рис. 4, спектр 1), и их присутствие в спектрах ПАни–ВК говорит о вхождении этого аниона в состав полимера. При исследовании нанокомпозитов [21], в состав которых заведомо входила V2O5, было сделано предположение, согласно которому по соотношению интенсивностей полос 745 и 980 см–1 можно предположить изменение морфологии композита. Именно уменьшение отношения интенсивностей полос V=O/V–O, как это наблюдается в нашем случае для ПАни–ВК (б)1 (рис. 4, спектр 3), говорит об увеличении аморфности. Кроме того, увеличение интенсивности связи V‒O может говорить об образовании орто-ванадат-анионов с увеличенным количеством V–O-связи (V(О)(ОН)3) по сравнению с мета-ванадат–анионом, в котором более интенсивны V=O-связи (V(O)2(OH)). Наклон ИК-спектров образцов ПАни–ВК (а)1 (спектр 2) и ПАни–ВК (а)3 (спектр 6) говорит о большей электронной проводимости этих полимеров по сравнению с остальными. Элементные анализы также подтверждают, что во всех обсуждаемых образцах обнаружено содержание ванадия, причем в образце ПАни–ВК (б)1 количество ванадия значительно увеличено по сравнению с расчетным. На основе этих анализов для различных вариантов ПАни–ВК были рассчитаны составы полученных продуктов, которые указаны в табл. 2.
Рис. 4.
ИК-спектры ВК (1), ПАни–ВК (а)1 (2), ПАни–ВК (б)1 (3), ПАни–ВК, полученные прикапыванием Э1 на ВК (4, 5 с 5 и 12% С), ПАни-ВК(а)3 (6), ПАни-С (7).

Таблица 2.
Рассчитанные составы композитных материалов
| Обозначение образца | ПАни–ВК (а)1 | ПАни–ВК (а)2 | ПАни–ВК (б)1 |
|---|---|---|---|
| Элементный анализ сожжением | По данным СЭМ | По данным СЭМ | |
| Рассчитанная формула | [С5.7Н5N(VО3)0.3(SО4)0.3 · 2Н2О] | С5.8N(SO4)0.6(VО3)0.22 | C6.05N(VO3)2.65Cl0.12 |
Подтверждение этим наблюдениям было получено при рентгеновском анализе полученных соединений. На рис. 5 приведены дифрактограммы образцов ПАни–ВК. Дифрактограмма ВК (рис. 5, кривая 1) подтверждает СЭМ-изображение ВК (рис. 3д, 3е). Соединение имеет кристаллическую структуру с основным значением угла 11.3° при 2θ, что обозначает практически во всей массе вещества одинаковое расстояние между главными плоскостями кристаллического ВК. Все образцы, полученные на поверхности ВК при его большом избытке также сохраняют кристаллическую структуру (на рис. 5, кривая 3). ПАни–ВК (а)1, полученный из раствора при соотношении компонент Ан : ВК = 100 обнаружил аморфное строение, т.е. практически ни одного пика дифракции, отвечающего за углы между кристаллическими плоскостями не обнаружено (рис. 5, кривая 6). Дифракционная картинка образца ПАни–ВК (б)1 (рис. 5, кривая 2) достаточно интересна в том плане, что образец имеет меньше кристаллических образований, чем ВК, и не столь аморфен, как образец ПАни–ВК (а)1. В электролите с HCl при ЭС в состав образующегося полимера входит достаточно большое количество ванадиевой компоненты, согласно элементному анализу. Возможно, вследствие этого образующийся полимер обладает большим сопротивлением, что в свою очередь замедляет скорость образования композита, о чем уже было сказано выше. При выполнении элементного анализа образец ПАн-и–ВК (б)1 был сожжен, и дифрактограмма после сожжения напоминала дифрактограмму образца V2O5 [21]. На этом же рисунке кривая 5 показывает дифрактограмму стандартного ПАни-С, который показывает на СЭМ-фото однородную сыпучую аморфную массу и не обнаруживает никаких кристаллических образований. Но два эти ПАни (рис. 5, кривые 5 и 6) отличаются между собой. Центр аморфного пика ПАни–ВК (а)1 имеет при 2θ угол 20.6°, хотя ПАни-С показывает значение такого угла 18.2°. Эта разница в межплоскостных расстояниях двух образцов ПАни может означать, что расстояние между цепями в полимере ПАни–ВК (а)1 меньше, чем в ПАни-С. Причиной этого могут быть агрегационные взаимодействия типа ─N∙∙∙H···O=V внутри полимера ПАни–ВК (а)1 [18, 19, 22], которые уже отмечались при рассмотрении морфологии полимерных материалов. В заключение следует еще раз подчеркнуть, что раствор ВК и Ан с рН 5.2 при любом соотношении компонентов может стоять длительное время (несколько месяцев) без изменения окраски раствора (желтой) и выпадения каких-либо продуктов димеризации, олигомеризации и полимеризации Ан. Основной вывод, сделанный из серии предыдущих синтезов, заключался в том, что V+5 в сернокислой среде при определенных значениях рН способен начать полимеризацию ПАни, т.е. он становится окислителем для молекулы Ан, и в ЭС может выступить в качестве его инициатора. Аналогичное облегчение окислительно-восстановительных процессов, улучшение структурных и электрохимических характеристик в присутствии V+5 наблюдалось и в других случаях получения композитных материалов проводящих полимеров с окисными соединениями V+5 [23, 24]. Важно, как уже было отмечено ранее, соотношение Ан : ВК должно быть тщательно выбрано и не должно создавать возможности обозначенной на СЭМ агрегации полимерных цепей для максимального сохранения активной поверхности материала.
4. Электрохимическое изучение полимеров
Таким образом, было проведено три варианта ЭС ПАни–ВК в потенциодинамическом режиме на СУ-электроде: 1) из Э3; 2) из Э3 с добавлением серной кислоты до рН 4; 3) из Э3 с добавлением соляной кислоты до рН 4. Соотношение Ан : ВК во 2 варианте составляло 100 или 1500.
Из обсужденных результатов химического и электросинтеза можно сделать вывод, что второй вариант позволяет получать качественные композитные материалы в химическом синтезе при Ан : ВК=100 (ПАни–ВК (а)1) и в ЭС при Ан : ВК = = 1500 (ПАни–ВК (а)3). Электрохимическое покрытие ПАни–ВК (а)3 было исследовано в различных электролитах: (1) в Э2, (2) в Э4 и (3) в Э5. На рис. 6 показаны результаты испытаний П-Ани–ВК (а)3 в режиме циклирования потенциала и в режиме зарядно-разрядных циклирований. Были исследованы такие характеристики, как сохранение устойчивости при циклировании и значения электрохимических емкостей (С), которые показывает полимер во всех этих трех электролитах. Расчет C производился по формуле С = = it/m∆V, где i – ток разряда (А), t – время разряда (с), m – вес композита (г), ∆V – область используемых потенциалов (В). На рис. 6а показан ход испытаний ПАни–ВК (а)3 в электролите Э2. При этом циклировании, судя по площади ЦВА, полимер быстро теряет свою активность. Расчет С из зарядно-разрядных характеристик показывает, что за 20 зарядно-разрядных циклов С уменьшается на 29% от 138 до 97 Ф/г. Большая потеря С наступает в первые 10 разрядных циклов от 138 до 103 Ф/г (23%), за последующие 10 разрядных циклов С снижается уже на 6%. В электролите Э4 (рис. 6б) на протяжении всех 20 циклов ПАни–ВК (а)3 показывает хорошую электрохимическую активность с сохранением пиков окислительно-восстановительных превращений полимера, но в процессе длительного циклирования происходит увеличение значения ∆Е от 200 до 420 мВ. При зарядно-разрядных испытаниях полимер сохраняет свою активность на 81%. Значение С за 20 зарядно-разрядных процессов уменьшается от 193 до 157 Ф/г. Так же как и в предыдущем случае, основная потеря С происходит в первые 10 зарядно-разрядных циклов (на 13%, от 193 до 168 Ф/г), к концу 20-го цикла значения С практически стабилизируются. Наконец, испытания этого полимера в Э5 при рН 1.2 (рис. 6в, ЦВА1) показали прекрасную устойчивость этого электрода в испытуемой системе. При циклировании и при зарядно-разрядных испытаниях была выявлена незначительная потеря электрохимической активности практически на 4%. ∆Е увеличилась за 50 циклирований всего на 10 мВ. Значения С за 50 проведенных зарядно-разрядных циклов снизились на 2.5%, от 255 до 242 Ф/г. На фоне двух первых электролитов зарядно-разрядные процессы в электролите Э5 на протяжении всех 50 циклов сохраняют и в каждом последующем цикле воспроизводят исходное и самое высокое из всех этих вариантов значение С. Эти факты говорят о том, что испытания полимера в “родной” системе в присутствии “родных” анионов, которые сформировали морфологию полимера, несмотря на более высокие значения рН, чем в Э4, способствуют стабильному электрохимическому функционированию системы и являются важными факторами для его надежной и успешной работы. Для стабильного циклирования ПАни с сохранением его первоначальных электрохимических характеристик без переокисления полимера считается интервал потенциалов –0.2…+0.7 В (Ag/AgCl) [25, 26]. В настоящем исследовании было обнаружено, что увеличение интервала циклирования ПАни–ВК (а)3 в анодную область на 0.3 В (рис. 7, ЦВА (б)) позволяет наблюдать достаточно стабильное поведение композитного материала в течение 50 циклирований. Происходит незначительное увеличение ∆Е на 20 мВ и сдвиг анодного окисления ЛЭ → Э на 80 мВ. И происходит это на первых циклах изменения интервала потенциалов, в дальнейшем наблюдается хорошее воспроизведение ЦВА и полное отсутствие пиков переокисления ПАни. Также стабильно ведет себя этот материал при зарядно-разрядных испытаниях в Э5 (рис. 7, зарядно-разрядные кривые на вставке, которые изображены после ЦВА (а) и ЦВА (б)). Значение С при циклировании в расширенном в анодную область интервале потенциалов после 50 зарядно-разрядных процессов меняется незначительно от 255 до 242 Ф/г. Достаточно стабильно показал себя композитный материал и в еще более расширенном интервале потенциалов –1…+1 В (рис. 7, ЦВА (в)). Как видно из рис. 7, проведенные 20 циклирований в расширенную анодную и катодную области показали хорошую устойчивость композитного материала и воспроизводимость его характеристик. После расчета зарядно-разрядных кривых (рис. 7, вставка) было выяснено, что циклирование ПАни–ВК (а)3 в интервале потенциалов (–0.2…+1 В) и плотности тока 0.5 мА/г незначительно увеличивает значение С до 265 Ф/г. Можно сравнить полученные данные с опубликованными [18] для аналогичной системы значениями С = 443 Ф/г при окне потенциалов 1.6 В и плотности тока 0.5 мА/см2.
Рис. 6.
Результаты электрохимических испытаний: 20 циклирований (50 мВ/с) и 20 зарядно-разрядных процессов при I = 500 мкА композитного материала ПАни–ВК (а) 3: a – в Э2 (m = 0.0014 г); б – в Э4 (m = 0.001 г); в – в Э5 (m = 0.0014 г). Указанные потери 23% (рис. 6а) и 13% (рис. 6б) – за первые 10 циклов, за вторые 10 циклов потери соответственно на обоих рисунках по 6%.

ЗАКЛЮЧЕНИЕ
1. Показано, что в электролитах, содержащих ванадат-анионы (при рН ≤ 4) V+5 окисляет молекулу Ан, способствуя началу химического синтеза ПАни и ускоряет ЭС ПАни.
2. Вхождение ванадат-аниона в состав ПАни меняет структуру полимера, сближая полимерные цепочки за счет их агрегации по связям NH‒O–V, но при большом избытке ванадат-анионов может привести к значительному сокращению площади поверхности.
3. При электрохимическом исследовании композитного материала, полученного в ЭС при соотношении Ан : ВК во время ЭС = 1500 показано достаточно стабильное поведение этого полимера при циклировании в электролите, содержащем ванадат-ионы.
4. При расширении интервала потенциалов в анодную область на 0.3 В и катодно-анодную на 0.8 В при циклировании ПАни–ВК (а)3 стабильная работа композитного электрода сохраняется на протяжении нескольких десятков циклов. После 50 циклирований электрохимическая емкость снизилась на 5%, появления пиков переокисления ПАни не наблюдалось.
Список литературы
Fan, Z., Yan, J., Wei, T., Zhi, L., Ning, G., Liand, T., and Wei, F., Asymmetric Supercapacitors Based on Graphene/MnO2 and Activated Carbon Nanofiber Electrodes with High Power and Energy Density, Adv.Funct.Mater., 2011, vol. 21, p. 2366.
Wu, X.-L., Jiang, L.-Y., Cao, F.-F., Guo, Y.-G., and Wan, L.-J., LiFePO4 Nanoparticles Embedded in a Nanoporous Carbon Matrix: Superior Cathode Material for Electrochemical Energy-Storage Devices, Adv.Mater., 2009, vol. 21, p. 2710.
Peng, C., Zhang, S., Zhou, X., and Chen, G.Z., Unequalisation of electrode capacitances for enhanced energy capacity in asymmetrical supercapacitors, Environ. Sci., 2010, vol. 3, p. 1499.
Lu, X., Yu, M., Zhai, T., Wang, G., Xie, S., Liu, T., Liang, C., Tong, Y., and Li, Y., High Energy Density Asymmetric Quasi-Solid-State Supercapacitor Based on Porous Vanadium Nitride Nanowire Anode, Nano Lett., 2013, vol. 13, p. 2628.
Wang, G., Zhang, L., and Zhang, J., A review of electrode materials for electrochemical supercapacitors, Chem. Soc. Rev., 2012, vol. 41, p. 797.
Yu, G., Hu, L., Vosgueritchian, M., Wang, H., Xie, X., Mc Donough, J.R., Cui, X., Cui, Y., and Bao, Z., Solution-Processed Graphene/MnO2 Nanostructured Textiles for High-Performance Electrochemical Capacitors., Nano Lett., 2011, vol. 11, p. 2905.
Xiao, J. and Yang, S., Sequential crystallization of sea urchin-like bimetallic (Ni, Co) carbonate hydroxide and its morphology conserved conversion to porous NiCo2O4 spinel for pseudocapacitors, RSC Adv., 2011, vol. 1, p. 588.
Wang, G., Lu, X., Lingm, Y., Zhai, T., Wang, H., Tong, Y., and Li, Y., LiCl/PVA Gel Electrolyte Stabilizes Vanadium Oxide Nanowire Electrodes for Pseudocapacitors, ACS Nano, 2012, vol. 11, p. 10296.
Wu, C., Feng, F., and Xie, Y., Design of vanadium oxide structures with controllable electrical properties for energy applications, Chem. Soc. Rev., 2013, vol. 42, p. 5157.
Zhu, J., Cao, L., Wu, Y., Gong, Y., Liu, Z., Hoster, H.E., Zhang, Y., Zhang, S., Yang, S., Yan, Q., Ajayan, P.M., and Vajtai, R., Building 3D Structures of Vanadium Pentoxide Nanosheets and Application as Electrodes in Supercapacitors, Nano Lett., 2013, vol. 13, p. 5408.
Плетнев, Р.Н., Губанов, В.А., Фотиев, А.А. ЯМР в оксидных соединениях ванадия, М., Наука, 1979. [Pletnev, R.N., Gubanov, V.A., and Fotiev, A.A., NMR of oxide compounds of vanadium, M., Nauka, 1979.]
Mak, W.F., Wee, G., Aravindan, V., Gupta, N., Mhaisalkarand, S.G., and Madhavi, S., High-Energy Density Asymmetric Supercapacitor Based on Electrospun Vanadium Pentoxide and Polyaniline Nanofibers in Aqueous Electrolyte, J.Electrochem. Soc., 2012, vol. 159, p. A1481.
Qu, Q., Zhu, Y., Gao, X., and Wu, Y., Core–shell Structure of Polypyrrole Grown on V2O5 Nanoribbon as High Performance Anode Material for Supercapacitors, Adv. Energy Mater., 2012, vol. 2, p. 950.
Фотиев, А.А., Трунов, В.К., Журавлев, В.Д. Ванадаты двухвалентных металлов, М., Наука, 1985. [Fotiev, A.A., Trunov, V.K., and Guravlev, V.D., Vanadates of Bivalent metals, M., Nauka, 1985.]
Pelletier, O., Davidson, P., Bourgaux, C., Coulon, C., Regnault, S., and Livage, J., A Detailed Study of the Synthesis of Aqueous Vanadium Pentoxide Nematic Gels., Langmuir, 2000, vol. 16, p. 5295.
Wu, C.G., De Groot, D.C., Marcy, H.O., Schindler, J.L., Kannewurf, C.R., Liu, Y.-J., Hirpo, W., and Kanatzidis, M.G., Redox Intercalative Polymerization of Aniline in V2O5 Xerogel. The Postintercalative Intralamellar Polymer Growth in Polyaniline/Metal Oxide Nanocomposites Is Facilitated by Molecular Oxygen, Chem. Mater., 1996, vol. 8, p. 1992.
Ferreira, M., Huguenin, F., Zucolotto, V., and Pereira da Silva, J. Ed., Cordoba de Torresi, S.I., Temperini, M.L.A., Torresi, R.M., Oliveira, Os.N., Electroactive Multilayer Films of Polyaniline and Vanadium Pentoxide, J. Phys. Chem. B., 2003, vol. 107, p. 8351.
Hao, Q., Lei, W., Xia, X., Yan, Zh., Yang, X., Lu, L., and Wang, X., Exchange of counterions in electropolymerized PANI film, Electrochimica Acta, 2010, vol. 55, p. 632.
Bai, M.-H., Liu, T.-Yu., Luan, F., Liand, Ya., and Liu, X.-X., Electrodeposition of vanadium oxide–polyaniline composite nanowire electrodes for high energy density supercapacitors, J. Mater. Chem. A., 2014, vol. 2, p. 10882.
Ragupathy, D., Gopalan, A.I., Lee, K.-P., and Manesh, K.M., Electro-assisted fabrication of layer-by-layer assembled poly(2,5-dimethoxyaniline)/phosphotungstic acid modified electrode and electrocatalytic oxidation of ascorbic acid, Electrochem. Commun., 2008, vol. 10, p. 527.
Trchova M., Moravkova Z., Blaha, M., and Stejskal, Ja., Raman spectroscopy of polyaniline and oligoaniline thin films, Electrochimica Acta, 2014, vol. 122, p. 28.
Huguenin, F., Ticianelli, E.A., and Torresi, R.M., XANES study of polyaniline–V2O5 and sulfonated polyaniline–V2O5 nanocomposites, Electrochim. Acta, 2002, vol. 47, p. 3179.
Shouji, E. and Buttry, D.A., New Organic-Inorganic Nanocomposite Materials for Energy Storage Applications, Langmuir, 1999, vol. 15, p. 669.
Huguenin, F., Prado Gambardella, M.T., Torresi, R.M., CordobaTorresi, S.I., and Buttryc, D.A., Chemical and Electrochemical Characterization of a Novel Nanocomposite Formed from V2O5 and Poly(N-propane sulfonic acid aniline), a Self-doped Polyaniline, J. Electrochem. Soc., 2000, vol. 47, p. 2437.
Geniès, E.M., Lapkowski, M., and Penneau, J.F., Cyclic voltammetry of polyaniline: interpretation of the middle peak, J. Electroanal.Chem. Interfac.Electrochem., 1988, vol. 249, p. 97.
Kieffel, Y., Pierre Travers, J., Ermolieff, A., and Rouchon, D, Thermal aging of undoped polyaniline: Effect of chemical degradation on electrical properties, J. Appl. Polymer Sci., 2002, vol. 86, p. 395.
Дополнительные материалы отсутствуют.