Электрохимия, 2020, T. 56, № 1, стр. 3-19
Применение фосфора в натрий-ионных аккумуляторах (обзор)
Т. Л. Кулова a, А. М. Скундин a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: askundin@mail.ru
Поступила в редакцию 11.03.2019
После доработки 08.04.2019
Принята к публикации 10.05.2019
Аннотация
В последние годы проявляется повышенный интерес к фосфору, как активному материалу отрицательных электродов натрий-ионных аккумуляторов, имеющему максимальную теоретическую емкость по внедрению натрия. В обзоре рассмотрены работы по внедрению натрия в красный фосфор, черный фосфор и фосфорены, а также в фосфиды некоторых элементов, опубликованные после 2013 г.
СОДЕРЖАНИЕ
Введение
1. Аллотропия фосфора
2. Композиты красного фосфора с углеродом
3. Черный фосфор и фосфорены
4. Фосфиды
Заключение
Литература
ВВЕДЕНИЕ
В последнее время необычайно вырос интерес к натрий-ионным аккумуляторам [1–11]. Этот интерес определяется потребностью в достаточно крупных установках аккумулирования электроэнергии на электротранспорте, в системах возобновляемой энергетики, в интеллектуальных электросетях и т.п. Литий-ионные аккумуляторы, занимающие доминирующие позиции в обеспечении работы портативной электронной аппаратуры, не могут быть основой крупных электроаккумулирующих установок просто по экономическим соображениям, связанным с ограниченностью запасов лития в земной коре. Известно, что принципы работы и основы конструирования натрий-ионных аккумуляторов не отличаются от таковых для литий-ионных аккумуляторов. В то же время, материалы, способные обратимо внедрять ионы лития, не обязательно обладают такой же способностью по отношению к ионам натрия. Это связано, в частности, с различием в размерах ионов лития и натрия (соответственно, 0.76 и 1.02 Å), и относится к материалам как отрицательного, так и положительного электродов. Именно поэтому, по мнению большинства экспертов, проблема создания эффективных натрий-ионных аккумуляторов сводится, в основном, к разработке электродных материалов [12–15].
Было предложено и исследовано очень много материалов для положительных электродов натрий-ионных аккумуляторов, в том числе, различные слоистые оксиды, фосфаты, сульфаты, фториды, полианионные соединения, органические полимеры и т.п. [16–23]. На электродах из таких материалов достигнуты значения удельной емкости до 200 мА ч/г. Основные усилия по разработке отрицательных электродов были сосредоточены на углеродных материалах (включая “твердый углерод”), а также на некоторых металлах и сплавах, оксидах и сульфидах.
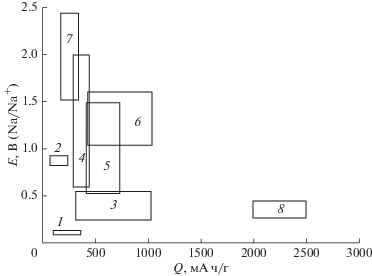
Рисунок 1 дает представление о соотношении удельных емкостей различных материалов отрицательного электрода и рабочих потенциалов при их разряде. Бросается в глаза явное преимущество фосфора перед всеми другими материалами. Именно поэтому к фосфору в последнее время приковано очень пристальное внимание исследователей.
Рис. 1.
Схема удельных емкостей различных потенциальных материалов отрицательного электрода и их рабочих потенциалов: 1 ‒ углеродные материалы, 2 ‒ кремний, 3 ‒ фосфиды, 4 ‒ органические материалы, 5 ‒ металлы и сплавы, 6 ‒ сульфиды, 7 ‒ фториды, 8 ‒ фосфор.
Первое сообщение о возможности использования красного фосфора в качестве функционального материала в натрий-ионных аккумуляторах появилось в 2013 г. [24]. В этой работе была продемонстрирована возможность достижения обратимой емкости по внедрению натрия около 1900 мА ч/г при циклировании в режиме С/20 (143 мА/г) при не слишком большой скорости деградации (0.2% за цикл), и указаны основные проблемы, возникающие при работе с фосфором: его недостаточная электронная проводимость и заметные объемные расширения при внедрении большого количества натрия. Последующие исследования были направлены именно на преодоление этих проблем. Начиная с 2013 г. количество исследований, посвященных электродам на основе фосфора неуклонно растет. К настоящему времени опубликовано несколько обзорных статей [25–30]. Однако в этих обзорах либо не рассматриваются различные соединения фосфора, такие как фосфиды, в качестве отрицательного электрода натрий-ионного аккумулятора [28], либо не обсуждаются статьи, опубликованные в 2018 и 2019 гг. [25, 27]. Кроме того, ряд обзоров посвящен только синтезу и физико-химическим свойствам материалов на основе фосфора, без анализа их электрохимических свойств [28].
1. АЛЛОТРОПИЯ ФОСФОРА
Как известно из курса общей химии, элементарный фосфор существует в четырех основных аллотропных модификациях – белый фосфор, красный фосфор, черный фосфор и фиолетовый фосфор (из неосновных, экзотических аллотропных модификаций следует отметить коричневый, алый, серый и темно-красный фосфор). Белый фосфор очень токсичен, летуч и самовозгорается на воздухе, так что его практическое применение в натрий-ионных аккумуляторах исключено. Красный фосфор вполне стабилен при обычных условиях и именно он обычно исследуется как материал отрицательного электрода. К сожалению, его электронная проводимость ничтожна, около 10–14 См/см (по другим данным 10–10 См/см), что вынуждает использовать его в виде композитов с электронопроводящими компонентами, обычно с углеродом. Редким исключением в этом отношении является работа [31], где красный фосфор был изготовлен в виде полых наносфер диаметром около 300 нм с толщиной стенок около 40 нм, причем эти стенки имели сквозную пористость с размером пор около 10 нм. Такая структура обеспечивала устойчивость при объемных изменениях во время внедрения и экстракции натрия, а электроды из этого материала имели удельную емкость в режиме С/5 около 2200 мА ч/г (в расчете на массу фосфора), а в режиме 1С сохраняли емкость около 1000 мА ч/г фосфора после 60 циклов заряда–разряда.
Черный фосфор имеет слоистую кристаллическую структуру и часто используется в виде отдельных 2D-слоев – фосфоренов (по аналогии с графеном) [32–38]. Электронная проводимость черного фосфора достаточно велика, порядка 1 См/см [39]. Определенную сложность представляет получение черного фосфора. Впервые он был синтезирован в 1914 г. [40] при воздействии на белый фосфор повышенных давлений и температур (1.2 ГПа, 200°С). Позже черный фосфор был синтезирован из красного фосфора при несколько меньшем давлении (1 ГПа), но более высокой температуре (900°С) [41]. Уже в 21-м в. были найдены возможности синтеза черного фосфора при температуре 600°С и обычном давлении [42] из красного фосфора с добавлением небольших количеств золота, олова и иодида олова, из которых образовывался Au3SnP7, изоструктурный с черным фосфором. Недавно удалось модифицировать этот синтез и отказаться от использования золота, ограничившись только смесью олова и его иодида [43]. Примерно в это же время черный фосфор был получен при механохимической обработке красного фосфора в высокоэнергетической шаровой мельнице [44]. Предполагается, что в шаровой мельнице развивалась температура до 200°С, а давление возрастало до 6 ГПа. В этой же работе высокоэнергетическим помолом был приготовлен композит черного фосфора с углеродом специально для использования в литий-ионных аккумуляторах.
Обратимое внедрение натрия как в аморфный красный, так и в кристаллический черный фосфор протекает по уравнению
(1)
${\text{P}} + {\text{3N}}{{{\text{a}}}^{ + }} + 3{\text{e}} \leftrightarrow {\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}}.$Соответствующее этому уравнению значение теоретической удельной емкости по внедрению натрия (т.е. удельной емкости катодного процесса) составляет 2596 мА ч/г. Значение теоретической удельной емкости по экстракции натрия из Na3P составляет 804 мА ч/г. Процесс (1) протекает через ряд последовательных стадий с образованием промежуточных фосфидов натрия, в том числе, Na3P11, Na3P7, NaP, Na5P4 [45]. Такой ступенчатый характер процесса был подтвержден теоретически с применением ab initio метода случайного поиска структур (random structure searching, AIRSS) [46] и расчетами с привлечением теории функционала плотности [47]. Полная экстракция ионов натрия из Na3P заканчивается к потенциалу около 0.4 В относительно натриевого электрода [24, 48].
2. КОМПОЗИТЫ КРАСНОГО ФОСФОРА С УГЛЕРОДОМ
Описано большое разнообразие методов приготовления композитов аморфного красного фосфора с углеродом, из которых наиболее важными являются (а) механохимическая обработка (помол в шаровых мельницах), (б) испарение–конденсация, (в) карботермическое восстановление, (г) золь–гель и другие методы “влажной химии” (wet chemistry routes).
Уже в первой работе, посвященной получению композитов красного фосфора с углеродом помолом в шаровой мельнице [24], было показано, что такой метод приводит к гораздо лучшим результатам, чем простое смешение порошков фосфора и углерода. Композит в этой работе был получен из смеси красного фосфора и сажи Super P в весовом соотношении 7 : 3. Поскольку в работе [24] был использован обычный, а не высокоэнергетический помол в шаровой мельнице, не происходило образования черного фосфора. На основании данных спектроскопии комбинационного рассеяния был сделан вывод, что в данном случае все частицы фосфора были покрыты тонкими углеродными оболочками. Таким образом, шаровой помол приводил как к уменьшению размера частиц, так и к равномерному распределению углерода по объему композита. Уменьшение размера частиц, с одной стороны, обеспечивало хорошие условия твердофазной диффузии (малая диффузионная длина), а с другой стороны предотвращало разрушение (растрескивание) частиц за счет увеличения удельного объема при натрировании. Равномерное распределение углерода обеспечило достаточно высокую электронную проводимость композита – 3.5 × 10–5 См/см. Частицы композита имели довольно широкое распределение по размерам – от долей до единиц микрон.
В работе [48] композиты аморфного фосфора с сажей Super P получали высокоэнергетическим помолом [49]. Оба компонента в этом композите были рентгеноаморфными, и весь композит можно было уподобить кластерам фосфора в углеродной матрице. Электроды из такого композита изготавливали с использованием карбоксиметилцеллюлозы в качестве связующего. При гальваностатическом циклировании током 250 мА/г в 1 М NaPF6 в смеси этиленкарбоната с диэтилкарбонатом с небольшой добавкой фторэтиленкарбоната была достигнута начальная емкость 2015 мА ч/г в катодном и 1764 мА ч/г в анодном процессах, что соответствовало начальной кулоновской эффективности циклирования 87%. Авторы предположили, что именно аморфная структура композита обеспечила столь высокие характеристики при обратимом внедрении натрия. В катодном процессе на первом цикле происходило частичное восстановление электролита в диапазоне потенциалов от 1.2 до 0.5 В с образованием пассивной пленки (SEI – solid electrolyte interphase), а гальваностатическая кривая анодного процесса состояла из нескольких более или менее выраженных ступеней, соответствующих последовательному извлечению натрия. Более четко этот процесс был виден на циклических вольтамперограммах, где на анодной ветви проявлялись довольно острые максимумы при потенциалах 0.53, 0.60 и 0.75 В, и широкий максимум при потенциале 1.4 В. Предполагается, что эти максимумы соответствовали извлечению натрия из Na3P, Na2P, NaP и NaP7.
Близкие результаты приводятся также в [50], где отрицательный электрод, приготовленный так же, как в работе [48], использовался в аккумуляторе с положительным электродом, находящимся в контакте с водным электролитом (морской водой).
Сажа – не единственный углеродный материал, который использовался для приготовления композитов с фосфором простым смешением порошков или методом шарового помола. Большой популярностью пользуются различные углеродные наноматериалы. Так, в работе [51] описан активный материал, полученный смешением (перетиранием в лабораторной ступке) порошка красного фосфора (с частицами микронных размеров) с многостенными углеродными нанотрубками. Характерно, что перетирание порошков даже в течение часа не приводило к изменению кристаллической структуры компонентов: спектры комбинационного рассеяния композита и спектры рентгеноструктурного анализа представляли собой аддитивные суммы спектров исходных компонентов. Электронно-микроскопическое исследование показало, что в композите отдельные частицы фосфора опутаны “паутиной” из углеродных нанотрубок, что и обеспечивало достаточную электронную проводимость всего композита и предохраняло частицы фосфора от разрушения при внедрении и экстракции натрия. Обратимое внедрение натрия в собственно углеродные нанотрубки было незначительным и вносило вклад в емкость около 40 мА ч/г. Обратимая емкость всего композита зависела от соотношения содержания фосфора и углеродных нанотрубок и была максимальна при содержании нанотрубок 30–50%. Эта емкость в расчете на чистый фосфор составляла 2200 мА ч/г на первом цикле и снижалась до 1000 мА ч/г на двадцатом цикле.
В работе [52] описан композит красного фосфора с графеном. Предполагалось, что гибкость графеновых листов и их малая толщина обеспечат их хорошую адгезию к поверхности частиц фосфора, что создаст электропроводную сетку по всему объему композита, а также предотвратит частицы фосфора от агломерации и разрушения при внедрении натрия (аналогично тому, что описано в [53, 54]). Композит в данной работе готовили помолом смеси порошка красного фосфора и графеновых стеков (в соотношении 7 : 3) в шаровой мельнице. При этом происходило расслаивание графеновых стеков на индивидуальные листы, которые образовывали прочные хемосорбционные связи с поверхностью частиц фосфора. Кроме того, происходило измельчение частиц фосфора до субмикронных размеров. Интенсивный шаровой помол приводил к существенному изменению структуры компонентов (в отличие от описанного выше простого перетирания). Полностью изменялись рентгеновская диффракционная картина (композит был рентгеноаморфен) и спектры комбинационного рассеяния (в спектре композита исчезли полосы фосфора и изменилось соотношение полос D и G для графена). При гальваностатическом циклировании электродов из такого композита в режиме С/10 (260 мА/г) разрядная емкость изменилась с 1800 мА ч/г на втором цикле до 1700 мА ч/г на шестидесятом цикле. Таким образом, композит, полученный шаровым помолом смеси фосфора с графеном, показал гораздо лучшие характеристики, чем композит, полученный перетиранием фосфора с углеродными нанотрубками. Даже в режиме 2С композит фосфора с графеном имел емкость более 500 мА ч/г.
Еще лучшие характеристики показал материал, полученный шаровым помолом красного фосфора с аэрогелем восстановленного оксида графена, предварительно обработанного в токе аргона при температуре 1000°С [55]. При циклировании током 100 мА/г электроды с таким композитом демонстрировали емкость около 1800 мА ч/г после 150 циклов.
В работе [56] длительным (40 ч) шаровым помолом смеси красного фосфора с порошком натурального графита (7 : 3) со скоростью 500 об/мин получали композит, состоящий из частиц фосфора с характерным размером 100 нм, покрытых графеновыми листами. Авторы предполагают, что именно длительный шаровой помол привел к расслоению графита на отдельные графеновые листы, которые были стабилизированы хемосорбционными связями с фосфором. Материал обладал весьма скромными характеристиками: в режиме С/10 он имел емкость около 900 мА ч/г и в режиме 1С – около 300 мА ч/г.
Частицы композита красного фосфора с углеродом, покрытые восстановленным оксидом графена описаны также в [57], композит аморфного красного фосфора и нитрида бора с покрытием из графена описан в [58], композиты углерода с очень малым содержанием фосфора – в [59].
В [60] описан электрод, изготовленный шаровым помолом красного фосфора с углеродными нанотрубками, без конструктивной основы (free-standing electrode). Углеродные нанотрубки в данном случае были функционализированы гидроксильными группами, что обеспечивало прочную хемосорбционную связь с поверхностью фосфора. В качестве связующего был применен поперечно-сшитый сополимер карбоксиметилцеллюлозы и лимонной кислоты. Композит фосфора с углеродом был рентгеноаморфен. Введение поперечно-сшитого полимерного связующего привело к повышению стабильности при циклировании, а тесный контакт частиц фосфора с углеродом обеспечил снижение внутреннего сопротивления и позволил заметно увеличить допустимые токовые нагрузки. Электрод в цитируемой работе устойчиво циклировался в режиме С/5 (520 мА/г), его удельная емкость снизилась за 100 циклов с 1700 до 1600 мА ч/г. При токе 5200 мА/г (2С) емкость составила 700 мА ч/г.
Авторы [61] предложили использовать полимерное электропроводное эластичное покрытие для демпфирования объемных расширений при внедрении натрия в фосфор. В этой работе вначале готовили композит красного фосфора с многостенными углеродными нанотрубками (7 : 3) помолом в шаровой мельнице. Этот композит состоял из частиц размером от долей до нескольких единиц микрон. Затем на эти частицы методом поверхностной полимеризации допамина наносили покрытие из полидопамина толщиной в единицы нм с образованием структуры “ядро–оболочка” (core–shell structure). Среднее содержание полидопамина и фосфора в композите составляло 5.6 и 66% соответственно. Электроды с таким композитом обладали очень высокой стабильностью при циклировании. При токе 2.6 А/г их емкость на протяжении 2000 циклов превышала 700 мА ч/г, а при токе 5.2 А/г емкость на протяжении 5000 циклов не была меньше 450 мА ч/г.
Своеобразным аналогом композита красного фосфора с графеном и углеродными нанотрубками можно считать композитный материал, описанный в [62]. Этот материал получали смешением порошка красного фосфора, нанокластеров сурьмы и медных нановолокон в водной суспензии. Как указывалось во Введении, сурьма сама по себе обладает способностью к обратимому внедрению натрия [63–66] с емкостью более 600 мА ч/г. Предполагалось, что в композитах фосфора с сурьмой может проявиться определенный синергизм. Коллоидные нанокластеры сурьмы с характерным размером 20 нм получали восстановлением трихлорида сурьмы боргидридом натрия. Активную массу электродов получали смешением суспензии нанокластеров сурьмы, порошка красного фосфора, медных нановолокон и карбоксиметилцеллюлозы в качестве связующего. В этой массе частицы фосфора размером 200–500 нм были покрыты нанокластерами сурьмы и опутаны нановолокнами меди. При гальваностатическом циклировании падение емкости для композитных P/Sb/Cu электродов было заметно меньше, чем для электродов из чистого фосфора. На композитных электродах при токе 125 мА/г была зарегистрирована емкость более 1300 мА ч/г после тридцатого, и более 1100 мА ч/г после пятидесятого циклов. При токе 2000 мА/г композитный электрод демонстрировал емкость более 900 мА ч/г. Таким образом, емкость тройного композита превышала аддитивную емкость отдельных компонентов.
Подобный эффект от шарового помола красного фосфора с добавлением 17% порошка железа описан в [67]. В этой работе показано, что если электрод, активная масса которого содержала 50% чистого красного фосфора, 25% сажи и 25% полиакриловой кислоты в качестве связующего, циклировался током 0.4 А/г, его емкость за 30 циклов снизилась от 1500 до 100 мА ч/г, то при циклировании такого же электрода, в котором чистый фосфор был заменен на композит с 17% железа, емкость снизилась с 1500 до 1400 мА ч/г. Авторы не объясняют причину такого благотворного действия добавки железа, хотя и отмечают, что эта добавка способствовала заметному росту электронной проводимости композита.
Смешение и шаровой помол являются простыми, но не самыми эффективными методами создания композитов фосфора с углеродом. Гораздо более изящный метод – это метод испарения–конденсации. В этом методе фосфор испаряется в одной части аппарата, пары переносятся в другую часть и конденсируются там на подходящем углеродном носителе. В качестве носителя используются различные углеродные материалы с развитой поверхностью. При синтезе композитов методом испарения–конденсации очень важным является соблюдение правильного температурного режима. Фосфор из паровой фазы осаждается на поверхности углерода в виде белой аллотропной модификации. При охлаждении эта модификация трансформируется в красную при температуре около 260°С, поэтому необходимо достаточно долго выдержать композит при этой температуре, чтобы в готовом продукте не оставалось следов белого фосфора.
Впервые метод испарения–конденсации был применен для получения активного материала для литий-ионных аккумуляторов [68, 69]. Применительно к натрий-ионным аккумуляторам этот метод впервые был использован в 2015 г. в работах [70, 71]. В работе [70] в качестве углеродного материала были выбраны одностенные нанотрубки (обладающие лучшими механическими свойствами, чем многостенные нанотрубки). Смесь красного фосфора и углеродных нанотрубок (4 : 1) запаивали в стеклянную ампулу под вакуумом. Ампулу нагревали до температуры 600°С и выдерживали при этой температуре 2 ч. Затем ампулу охлаждали до температуры 280°С и выдерживали при этой температуре в течение 2 сут для полного перевода белого фосфора в красный. Электроды из такого композита устойчиво циклировались при токе 50 мА/г (в расчете на массу всего композита) в течение 50 циклов практически без снижения емкости, составлявшей около 700 мА ч/г. При токе 1000 мА/г обратимая емкость составила 500 мА ч/г.
В работе [71] углеродным материалом были волокна, допированные азотом. Такие волокна диаметром около 100 нм получали термообработкой волокнистого полипиррола при температуре 600°С в инертной атмосфере. Для получения композитов смесь равных частей красного фосфора и углеродных волокон помещали в герметичную ампулу из нержавеющей стали, заполненную аргоном, нагревали до температуры 450°С и выдерживали при этой температуре 3 ч. Затем ампулу охлаждали до температуры 260°С и выдерживали 18 ч. Хотя содержание фосфора в исходной шихте составляло 50%, его содержание в композите, определенное термогравиметрическим анализом, было всего 27.5%. При циклировании электродов с таким композитом током 100 мА/г их емкость снижалась от 850 мА ч/г на 10‑м цикле до 730 мА ч/г на 55-м цикле.
Вообще метод испарения–конденсации для приготовления композитов красного фосфора с углеродом оказался очень популярным, и был применен для большого разнообразия углеродных материалов. Так, в работе [72] в качестве углеродной матрицы для конденсации паров фосфора были использованы углеродные нанотрубки, покрытые снаружи активированным углем. Для изготовления подобной матрицы суспензию углеродных нанотрубок в водном растворе D‑глюкозы с добавкой додецилсульфата натрия подвергали термообработке в автоклаве при температуре 190°С в течение 15 ч до получения коричневого прекурсора, который затем сушили и карбонизовали при температуре 800°С в атмосфере аргона для получения нанотрубок с углеродным покрытием. Это покрытие затем активировали в смеси с твердым КОН при температуре 800°С также в атмосфере аргона. Для приготовления фосфорно-углеродного композита получившийся материал смешивали с красным фосфором и подвергали термообработке в герметичном стакане из нержавеющей стали в атмосфере аргона. Соотношение количеств фосфора и углерода в шихте менялось от 1.25 : 1 до 4 : 1. Термообработку проводили при температуре 500°С в течение 3 ч и затем при температуре 260°С в течение 15 ч. В результате на нанотрубке диаметром около 20 нм нарастал слой активированного угля толщиной около 50 нм. Микропоры в этом слое были заполнены красным фосфором, а мезопоры оставались пустыми и были предназначены для демпфирования изменений объема при внедрении натрия в фосфор. При циклировании электрода с композитом, приготовленном из шихты с соотношением количество фосфора и углерода 3 : 1, начальная емкость составила около 1500 мА ч/г (в расчете на весь композит) в режиме С/5. За 50 циклов она снизилась до 1300 мА ч/г. При циклировании такого же электрода в режиме 6С емкость композита снизилась с 700 до 500 мА ч/г за 500 циклов.
Так называемый упорядоченный мезопористый углерод СМК-3 был использован в качестве матрицы для изготовления композита с фосфором методом испарения–конденсации в работе [73]. Упорядоченный мезопористый углерод получают темплатным синтезом с использованием темплата, в частности, из диоксида кремния, при карбонизации полимеров [74, 75]. Материал СМК-3 состоит из одинаковых параллельных углеродных стержней, упакованных в гексагональные пучки. Красный фосфор конденсируется в порах между углеродными стержнями. Такая структура обеспечивает достаточную электронную проводимость композита, демпфирование объема при внедрении натрия, доступность жидкого электролита к частицам фосфора. При циклировании подобного электрода в режиме С/5 емкость композита снизилась за 60 циклов с 1000 до 750 мА ч/г или от 2600 до 2100 мА ч/г фосфора, а в режиме 10С она составила 250 мА ч/г композита или 600 мА ч/г фосфора.
В стремлении избежать появления белого фосфора в методе испарения–конденсации авторы [76] модернизировали этот метод, введя ступенчатую термобработку. В качестве углеродной матрицы в этой работе были использованы микропористый углерод YP-80F компании Kuraray Chemicals (Япония), а также многостенные углеродные нанотрубки. Смесь красного фосфора и углеродного материала в запаянной вакуумной ампуле нагревали и выдерживали при температуре 450°С в течение 3 ч, затем ампулу медленно (1°С/мин) охлаждали до температуры 280°С и выдерживали при этой температуре в течение 24 ч. После этого ампулу вновь нагревали до температуры 340°С, выдерживали при этой температуре 2 ч и затем медленно (0.2°С/мин) охлаждали до температуры 190°С. При дальнейшем охлаждении до комнатной температуры скорость изменения температуры уже не контролировали. Исходный порошок фосфора состоял из частиц размером около 50 мкм, размер пористых частиц YP-80F был 10–15 мкм, длина углеродных нанотрубок – от 10 до 30 мкм. Характерный размер микропор в YP-80F составлял менее 2 нм. Фосфор конденсировался внутри этих микропор (что и определяло размер частиц фосфора) или на внешней поверхности углеродных нанотрубок. Размер частиц фосфора в композите с углеродными нанотрубками заметно превосходил размер частиц фосфора в композите с YP-80F. Такое различие в характерном размере частиц фосфора определяло и различие в характеристиках соответствующих электродов. При гальваностатическом циклировании электрода с композитом на основе YP-80F в режиме С/5 начальная емкость составляла 818 мА ч/г композита или 1160 мА ч/г фосфора. После 100 циклов эта величина снизилась до 1060 мА ч/г фосфора. Для композита с углеродными нанотрубками начальные характеристики (в расчете на массу фосфора) были практически такими же, как и для композита с YP-80F, но после 100 циклов его емкость снизилась до 480 мА ч/г фосфора.
Поскольку конденсирующиеся на стенках микропор молекулы Р4 имеют вполне определенный конечный размер, существует также определенный оптимальный диаметр пор в материале углеродной матрицы, при котором концентрация фосфора в единице объема максимальна. Такие расчеты проведены в работе [77]. Показано, что оптимальный диаметр пор составляет 2 нм. Для пор с диаметром 0.5, 1, 1.5, 2 и 3 нм концентрация фосфора в поре составляет 0, 10, 13, 13.5 и 6.5 нм–3.
Гибкий электрод без специальной конструктивной основы (free-standing electrode) описан в работе [78]. Этот электрод представляет из себя сборку из нескольких слоев графена, допированного азотом (каждый слой состоит из нескольких индивидуальных графеновых листов), между которыми находятся слои аморфного красного фосфора. Электрод изготавливается методом испарения–конденсации, при этом происходит расслаивание графена и обеспечивается равномерное распределение фосфора в межслоевых пространствах [79, 80]. Образование связей между атомами фосфора и углерода обеспечивает целостность всей структуры, а графеновые листы обеспечивают высокую электронную проводимость композита. Описываемый электрод показал очень высокую стабильность при циклировании: при разряде током 800 мА/г (примерно С/2) падение емкости в течение 350 циклов составило 0.002% за цикл. Емкость при токах 800 и 1500 мА/г составляла 1100 и 800 мА ч/г.
Оригинальный метод синтеза композитов фосфора с углеродом с использованием глубокого охлаждения предложен в работе [81]. В соответствии с этим методом вначале флотацией суспензии порошка красного фосфора в воде отбирается фракция наночастиц фосфора размером 100–150 нм. Затем готовится водная суспензия смеси этой фракции с оксидом графена. При ультразвуковой обработке этой суспензии происходит расслаивание оксида графена на отдельные листы. Затем эта суспензия обрабатывается жидким азотом, при этом происходит скручивание листов оксида графена, которые захватывают внутрь образующихся свитков наночастицы фосфора. Таким образом получаются частицы композита фосфора с оксидом графена со структурой стручков. Завершающей операцией является восстановление оксида графена парами гидрата гидразина. Электроды с таким композитом, содержащем 52% фосфора, стабильно циклировались при токе 250 мА/г в течение 150 циклов; удельная емкость при этом была 2355 мА ч/г фосфора. Даже при токе 4 А/г емкость была около 1000 мА ч/г фосфора.
В работе [82] подобные композиты из свитков графена, в которые инкапсюлированы частицы красного фосфора, использовались в качестве прекурсора для синтеза основного композита. На этот прекурсор из паровой фазы осаждалось покрытие из полипиррола. Полученный материал запаивали в ампулу с аргоном и выдерживали 20 мин при температуре 400°С, после чего быстро охлаждали (закалка). При такой термообработке происходила карбонизация полипиррола и перераспределение фосфора по объему композита (перенос по газовой фазе). Несмотря на значительное усложнение синтеза по сравнению с работой [81], получившийся результат показал характеристики, близкие к характеристикам материала, полученного в [81].
Близкий подход к созданию композитов красного фосфора с графеном (точнее, с восстановленным оксидом графена) описан в [83]. Здесь смесь красного фосфора с восстановленным оксидом графена (в соотношении 3 : 1) запаивали в вакуумную кварцевую ампулу и выдерживали ее при температуре 600°С в течение 15 мин, а затем при температуре 280°С в течение 10 ч. Такой упрощенной процедуры испарения–конденсации оказалось достаточно, чтобы получить композит с вполне приемлемыми характеристиками. При плотности тока около 1600 мА/г емкость такого электрода снизилась за 300 циклов с 1100 до 900 мА ч/г.
Еще более упрощенная методика изготовления композитов красного фосфора с углеродом за счет испарения–конденсации предложена в работе [84]. В качестве источника углерода в этой работе была использована рисовая шелуха. Весь процесс испарения–конденсации проводили при температуре 450°С в течение 3 ч. В статье [84] не приводится никаких данных о наличии или отсутствии белого фосфора в окончательном продукте.
В [85] использован комбинированный метод изготовления композита красного фосфора с углеродом. Здесь вначале проводили шаровой помол смеси фосфора, сажи и углеродных нанотрубок, а затем подвергали термообработке в запаянной ампуле под вакуумом при температуре 455°С в течение 12 ч. Полученный материал устойчиво циклировался в течение 200 циклов при токе 150 мА/г, но с довольно малой емкостью – около 300 мА ч/г.
Различные варианты синтеза композитов красного фосфора с углеродом методом испарения–конденсации описаны также в [86–88].
Другие методы синтеза композитов красного фосфора с углеродом применительно к электродам натрий-ионных аккумуляторов распространены гораздо меньше. Например, в методе карботермического восстановления проводят термообработку оксида фосфора с органическим веществом, которое карбонизуется и восстанавливает оксид фосфора. Подобный синтез описан, в частности, в [89]. В результате такого синтеза получается композит, состоящий из частиц красного фосфора размером около 10 нм в углеродной матрице. Электроды из такого композита при циклировании в режиме С/5 показали начальную удельную емкость около 1100 и 900 мА ч/г после 150 циклов.
В работе [90] описан довольно сложный гидротермальный метод синтеза композита красного фосфора с углеродом. Здесь водную суспензию красного фосфора выдерживают 24 ч в автоклаве при температуре 200°С. Затем твердую фазу помещают в разбавленный водный раствор полиаллиламинхлорида, где проводят седиментацию. Из верхней части суспензии центрифугированием выделяют “квантовые точки”, а из нижней части – сетку из волокон красного фосфора. Затем готовят композиты из “квантовых точек” с восстановленным оксидом графена и из фосфорных волокон также с восстановленным оксидом графена. Лучший из полученных материалов, т.е. композит квантовых точек с восстановленным оксидом графена показал емкость около 900 мА ч/г после 900 циклов в режиме С/5.
Электрод без конструктивной основы и связующего (free-standing electrode) из углеродных волокон с наночастицами фосфора был изготовлен в работе [91]. Композитные волокна изготавливали методом электроспиннинга. Описанный электрод при циклировании током 2000 мА/г имел емкость около 700 мА ч/г после 1000 циклов, что следует признать весьма хорошим показателем.
3. ЧЕРНЫЙ ФОСФОР И ФОСФОРЕНЫ
Как уже указывалось в разделе 1, электронная проводимость черного фосфора достаточно велика, так что нет необходимости изготавливать его композиты с углеродом ради снижения омических потерь. В то же время слоистая структура черного фосфора (рис. 2) предопределяет его использование в виде фосфоренов, т.е. 2D-структур, аналогичных графенам и силиценам [92]. Структура черного фосфора предопределяет сильную анизотропию транспортных и упругих свойств [93, 94], причем прослеживается двойная анизотропия: ионы натрия диффундируют по туннелям перпендикулярно направлению цепей [95], а упругая деформация распространяется по атомным цепям [96].
Анализ механизма внедрения натрия в черный фосфор, выполненный из первых принципов [97, 98], показывает, что первые порции натрия внедряются за счет интеркаляции, при этом объемные изменения ничтожны, а после достижения состава NaP4 начинается разрыв Р–Р связей, образование соединений NaxP (вплоть до Na3P), и происходит заметное увеличение удельного объема. Именно поэтому приходится прибегать к созданию композитов черного фосфора с углеродом, который должен демпфировать объемные изменения при внедрении натрия. С использованием теории функционала плотности в работе [99] обоснована повышенная скорость диффузии натрия в черном фосфоре.
Применительно к натрий-ионным аккумуляторам черный фосфор используется, в основном, в виде фосфоренов, лишь в единичных работах объектом исследования был не расслоенный черный фосфор. Так, в работе [100] активную массу электрода изготавливали из смеси порошка черного фосфора и ацетиленовой сажи. Эту смесь обрабатывали в шаровой мельнице в инертной атмосфере. В качестве связующего в этой работе был использован полиакрилат натрия. Соотношение черного фосфора, сажи и полиакрилата натрия в активной массе было 46 : 32 : 22. При циклировании такого электрода в 1 М NaPF6 в смеси этиленкарбоната с диэтилкарбонатом током 125 мА/г емкость снизилась с 1500 до 900 мА ч/г за 25 циклов. Столь сильная деградация была связана с восстановлением электролита с образованием объемных продуктов, не защищающих поверхность фосфора от дальнейшего взаимодействия с электролитом. Добавки в электролит 1% виниленкарбоната или 5% фторэтиленкарбоната способствовали образованию более плотных и тонких SEI. В результате циклическая стабильность электрода возросла и в электролитах с обоими типами добавок емкость за первые 25 циклов снижалась с 1600 до 1500 мАч/г.
Композит из смеси черного фосфора с графитом (7 : 3) готовили обработкой в шаровой мельнице в работе [101]. Хотя электроды с таким композитом циклировали в электролите с добавкой фторэтиленкарбоната, деградация емкости при циклировании была очень большой: за первые 20 циклов при токе 100 мА/г емкость снизилась с 1300 до 200 мА ч/г. Основной причиной деградации было механическое разрушение электрода и отслаивание активной массы от токоотвода.
Композит из смеси черного фосфора, сажи Ketjenblack и многостенных углеродных нанотрубок (в весовом соотношении 7 : 2.5 : 0.5) был получен высокоэнергетическим помолом в работе [102]. Предполагалось, что углеродные нанотрубки обеспечат электронную проводимость всего композита и его прочность, сажа обеспечит развитую поверхность контакта с электролитом. Полученный композит обладал лучшими характеристиками, чем в [100]. С использованием 1 М раствора NaPF6 в пропиленкарбонате с добавкой 2% фторэтиленкарбоната при токе 416 мА/г разрядная емкость снизилась с 2000 до 1800 мА ч/г за 50 циклов. На примере этого композита была показана существенная роль природы электролита в стабильности циклирования. В тех же условиях с использованием раствора NaClO4 в пропиленкарбонате с добавкой фторэтиленкарбоната емкость к пятидесятому циклу снизилась до 1400 мА ч/г.
В работе [103] описан композит из модифицированного (поверхностно функционализированного) черного фосфора и восстановленного оксида графена. Для поверхностной модификации черного фосфора вначале готовили суспензию черного фосфора в N-метилпирролидоне, к которой добавляли 4-нитробензол-диазоний и (C4H9)4NPF6. Затем готовили суспензию такого модифицированного продукта в N-метилпирролидоне, добавляли туда оксид графена и помещали в сольвотермический реактор, куда добавляли также КОН для предотвращения окисления фосфора [104]. Синтез композита проводили 6 ч при температуре 140°С, оксид графена при этом восстанавливался. На основании данных спектроскопии комбинационного рассеяния и инфракрасной спектроскопии был сделан вывод, что в композите образовались связи атомов фосфора с атомами углерода как из восстановленного оксида графена, так и из нитробензола. Электроды с таким композитом при токе 100 мА/г имели емкость около 1300 мАч/г после 50 циклов, а при токе 1000 мА/г устойчиво циклировались в течение 200 циклов с емкостью около 700 мА ч/г.
Модификация поверхности черного фосфора полиэтилендиокситиофеном (PEDOT), стабилизирующая тонкопленочную структуру, каждый элемент которой состоял из нескольких слоев фосфорена, описана в [105]. Такая структура является промежуточной между объемным фосфором и фосфореном; в англоязычной литературе она получила название FL-BP (few-layer black phosphorus) [106–111]. Для создания такой структуры кристаллический черный фосфор перетирали в ступке с небольшим количеством диметилформамида. Получившуюся смесь разбавляли диметилформамидом и полученную суспензию обрабатывали ультразвуком на ледяной бане. При этом происходила эксфолиация кристаллов фосфора с образованием тонкослойных элементов. Далее этот продукт подвергали сольвотермической обработке в диметилформамиде при температуре 180°С, и получившийся материал диспергировали в этиловом спирте, куда затем вводили этилендиокситиофен и после его адсорбции на поверхности тонкослойных элементов проводили полимеризацию с образованием нановолокон PEDOT, прочно связанных с поверхностью черного фосфора. Электроды с таким активным материалом имели при плотности тока 100 мА/г начальную емкость около 1500 мА ч/г, которая после 100 циклов снижалась до 1000 мА ч/г, причем основная деградация происходила в начальный период циклирования (20–25 циклов).
Преимущества собственно фосфорена как материала отрицательного электрода натрий-ионных аккумуляторов теоретически обоснованы в [112, 113], где расчетами из первых принципов определены значения энергии адсорбции натрия, теоретическая удельная емкость и диффузионные барьеры. Показано, что при достаточно большом внедрении натрия в фосфорен последний приобретает металлическую проводимость, а энергетический барьер для диффузии натрия составляет всего 0.04 эВ, что обеспечивает высокую удельную мощность таких электродов. В [114] теоретически показано, что адсорбция и диффузия натрия на фосфорене зависят от структурных дефектов последнего.
Композит фосфорена с графеном описан в [115]. Оба компонента готовили из массивных материалов (черного фосфора и графита) методом жидкостной эксфолиации из N-метилпирролидона [109, 116]. Наилучшую стабильность при циклировании имели композиты с атомными соотношениями углерода к фосфору 3.5 : 1 и 2.8 : 1. На электродах с такими композитами была получена обратимая емкость 2440 мА ч/г (в расчете на массу фосфора) при циклировании в режиме С/50, 1450 мА ч/г в режиме 3С и 645 мА ч/г в режиме 10С. При циклировании в режиме С/50 падение емкости составило 0.16% за цикл.
С использованием теории функционала плотности в работе [117] показано, что графен в подобных композитах может быть заменен на гексагональный нитрид бора.
4. ФОСФИДЫ
Фосфиды металлов не менее популярны как материал отрицательных электродов натрий-ионных аккумуляторов, чем композиты фосфора. Первым таким материалом был фосфид олова Sn4P3 [118], имеющий слоистую структуру [119]. В этой работе фосфид олова был получен высокоэнергетическим шаровым помолом порошков олова и красного фосфора в атмосфере аргона. Активная масса электродов здесь состояла из 70% фосфида олова, 10% сажи Super P и 20% полиакриловой кислоты в качестве связующего. На разрядных (анодных) гальваностатических кривых, полученных при плотности тока 100 мА/г в электролите с добавкой фторэтиленкарбоната отмечались площадки при потенциалах около 0.2 и 0.55 В (Na+/Na). Общая разрядная емкость составила около 720 мАч/г и практически не изменялась в течение 100 циклов. Предполагается [120], что при внедрении натрия первоначально происходит распад фосфида с образованием наночастиц Na15Sn4 и Na3P:
(2)
${\text{S}}{{{\text{n}}}_{{\text{4}}}}{{{\text{P}}}_{3}} + 24{\text{N}}{{{\text{a}}}^{ + }} + 24{\text{e}} \to {\text{N}}{{{\text{a}}}_{{{\text{15}}}}}{\text{S}}{{{\text{n}}}_{4}} + 3{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}}.$В дальнейшем происходит обратимое внедрение натрия уже в наночастицы олова и фосфора:
(3)
${\text{N}}{{{\text{a}}}_{{{\text{15}}}}}{\text{S}}{{{\text{n}}}_{4}} \leftrightarrow 4{\text{Sn}} + 15{\text{N}}{{{\text{a}}}^{ + }} + 15{\text{e}},$(1)
${\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}} \leftrightarrow {\text{P}} + 3{\text{N}}{{{\text{a}}}^{ + }} + 3{\text{e}}.$Поскольку Sn4P3 имеет довольно высокую плотность, 5.18 г/см3, волюмометрическая емкость такого фосфидного электрода была намного больше, чем для других материалов (теоретическое значение волюмометрической емкости по данным [118] составляет 6650 мА ч/см3).
В работе [120] изучали композит Sn4P3 с сажей (7 : 3), полученный шаровым помолом. Характеристики полученных электродов были даже лучше, чем в работе [118]: при циклировании с плотностями тока 50, 100, 200, 500 и 1000 мА/г емкость составила 820, 650, 560, 435 и 350 мА ч/г. Аналогичный композит, где сажа была заменена на смесь аморфных фосфора и олова, описан в [121]. Электроды с таким композитом имели при токе 100 мА/г начальную разрядную емкость 890 мА ч/г. Даже в режиме 10 С (5000 мА/г) электроды устойчиво циклировались с емкостью 165 мА ч/г.
В работе [122] фосфид олова Sn4P3 был синтезирован сольвотермическим методом из раствора SnCl2 в смеси этанола и диметилформамида, куда были добавлены борогидрид натрия и белый фосфор. Электроды с таким активным материалом при циклировании с плотностью тока 50 мА/г имели начальную обратимую емкость около 700 мА ч/г, но уже к десятому циклу она снижалась до 300 мА ч/г, так что практического значения подобный метод синтеза не имел.
В [123] описан композит со структурой “ядро–оболочка” (core–shell structure), где ядром служит Sn4P3, а оболочка изготовлена из углерода. Синтез такого композита был довольно сложным. Вначале гидротермическим синтезом из станната калия [124] получали полые наносферы диоксида олова диаметром около 200 нм. На их поверхность наносили глюкозу и подвергали гидротермической обработке в атмосфере смеси аргона с водородом. При пиролизе глюкозы образовывалась углеродная оболочка, и под воздействием этой оболочки и водорода происходило восстановление оксида олова с образованием металлического оловянного ядра в углеродной оболочке [125]. На последней стадии суспензию смеси таких наночастиц (Sn@C) и красного фосфора в этилендиамине подвергали мягкой (200°С) сольвотермической обработке, при которой получались наночастицы Sn4P3@C [126]. Предполагалось, что получившаяся структура “ядро Sn4P3–оболочка углерод” будет обладать существенными преимуществами перед другими структурами. Внутреннее пространство между ядром и оболочкой должно компенсировать объемные изменения при внедрении натрия в ядро. SEI будет образовываться на внешней поверхности углеродной оболочки и не будет претерпевать циклических разрушений и залечиваний. Наконец, углеродная оболочка, обладающая как электронной, так и ионной проводимостью, должна обеспечить хорошие транспортные свойства композита. Частично эти ожидания оправдались. При циклировании в режиме 1.5С электрод с таким композитом демонстрировал начальную емкость более 500 мА ч/г, и емкость после 400 циклов около 360 мА ч/г.
Сходная техника была применена в работе [127] для создания композитов Sn4P3 с восстановленным оксидом графена. Вначале суспензию оксида графена в водном растворе SnCl2 восстанавливали боргидридом натрия с образованием композита наночастиц олова с восстановленным оксидом графена [128], а затем суспензию этого композита и красного фосфора в этилендиамине подвергали сольвотермической обработке. Электроды с таким композитом выдержали 1500 циклов при токе 1000 мА/г с емкостью не менее 360 мА ч/г.
Композит Sn4P3 с аэрогелем графена, демонстрирующий емкость около 650 мА ч/г после 100 циклов при токе 100 мА/г, описан в недавней работе [129].
Sn4P3 – не единственный фосфид олова, предлагавшийся в качестве материала отрицательного электрода натрий-ионных аккумуляторов. В работе [130] впервые предложен фосфид олова состава SnP3, теоретическая емкость которого по внедрению натрия превышает теоретическую емкость Sn4P3 (1616 мА ч/г против 1133 мА ч/г). Композит SnP3 с углеродом готовили шаровым помолом смеси олова, красного фосфора и сажи, при этом на самой ранней стадии помола образовывался хрупкий SnP3, который впоследствии измельчался до нанометрового состояния. Сажа при этом дезинтегрировалась на эластичные нанопластинки, которые покрывали поверхность частиц фосфида олова [131, 132]. Электроды с таким композитом испытывались в несколько необычных условиях: в качестве электролита был использован 1 М раствор NaClO4 в эквиобъемной смеси фторэтиленкарбоната и диметилкарбоната. При циклировании током 150 мА/г в течение 150 циклов емкость сохранялась на уровне 800 мАч/г. Даже при токе 2560 мА/г емкость была около 400 мА ч/г.
Из других фосфидов в качестве активных материалов отрицательных электродов натрий-ионных аккумуляторов исследовались фосфиды никеля, меди, железа, кобальта, германия, селена и кремния.
Первая работа по фосфидам никеля относится к 2014 г. [133]. Объектом исследования здесь был фосфид состава NiP3, как наиболее богатый фосфором, и, следовательно, имеющий максимальную теоретическую емкость по внедрению натрия – 1591 мА ч/г. NiP3 в этой работе синтезировали или спеканием порошков никеля и красного фосфора в вакуумной ампуле при температуре 700°С, или шаровым помолом таких же порошков в атмосфере аргона. Электродные характеристики материала, полученного высокотемпературным синтезом, оказались несколько лучше. При измерениях в 1 М растворе NaClO4 в пропиленкарбонате с добавкой 5% фторэтиленкарбоната его емкость в режиме С/10 на протяжении 20 циклов была не менее 1000 мА ч/г. Описаны также и фосфиды никеля, обедненные фосфором. Например, в [134] приводятся данные о композите Ni2P с графеном со структурой “ядро–оболочка”. Такие соединения имеют довольно низкие значения емкости и не представляют интереса для разработки натрий-ионных аккумуляторов. То же можно сказать и о более поздних работах [135‒138].
Описанные в литературе фосфиды меди также представляют скорее академический интерес, так как они обладают скромной емкостью по внедрению натрия. Так, в [139] описан композит богатого фосфором фосфида меди CuP2 с сажей Super P. Собственно фосфид меди синтезировали высокоэнергетическим шаровым помолом порошков меди и красного фосфора в атмосфере аргона, а композит готовили последующим шаровым помолом смеси CuP2 с сажей (7 : 3). Емкость электродов из такого композита при циклировании в растворе 1 М NaClO4 в смеси этиленкарбоната с диэтилкарбонатом с добавкой фторэтиленкарбоната плотностью тока 150 мА/г снизилась за 30 циклов с 500 до 420 мА ч/г. Близкие результаты получены в [140], где исследовался композит CuP2 с ацетиленовой сажей, также приготовленный шаровым помолом. В [141] описан электрод без конструктивной основы (free-standing electrode), изготовленный из нановолокон Cu3P. Для изготовления такого электрода медную фольгу обрабатывали раствором щелочи с добавкой персульфата аммония, при этом на фольге нарастали нановолокна гидроксида меди. Эти волокна обрабатывали гипофосфитом натрия и переводили в Cu3P. При циклировании током 100 мА/г емкость такого электрода (в расчете на Cu3P) снизилась за 50 циклов с 300 до 250 мА ч/г.
Из фосфидов железа применительно к натрий-ионным аккумуляторам исследован только FeP. Композиты из коммерческого FeP и графита, синтезированные шаровым помолом, описаны в [142, 143]. Предполагается, что при первоначальном внедрении натрия образуются наночастицы Na3P и железа
(4)
${\text{FeP}} + 3{\text{N}}{{{\text{a}}}^{ + }} + 3{\text{e}} \to {\text{Fe}} + {\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}},$(5)
${\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}} + {\text{Fe}} \leftrightarrow {\text{P}} + {\text{Fe}} + 3{\text{N}}{{{\text{a}}}^{ + }} + 3{\text{e}}.$Кроме того, возможно обратимое внедрение натрия в графит, но поскольку емкость графита намного меньше, чем емкость фосфора, в [142] было показано, что емкость чистого фосфида железа превышает емкость его композита с графитом. В [143] показано, что характеристики электродов на основе фосфида железа с графитом в значительной степени зависят от природы связующего: комбинированное связующее из карбоксиметилцеллюлозы и полиакриловой кислоты обеспечивает гораздо более высокую обратимую емкость и меньшую деградацию при циклировании, чем карбоксиметилцеллюлоза, и тем более, поливинилиденфторид.
В [144] описан намного более изощренный композит из FeP и углеродных нанотрубок с углеродным покрытием. Вначале из суспензии многостенных углеродных нанотрубок (CNT) в растворе хлорида железа готовили композит углеродных нанотрубок с FeOOH. Затем с использованием тетраэтилортосиликата натрия на него наносили покрытие из диоксида кремния. Затем на образовавшийся композит CNT@FeOOH@SiO2 наносили покрытие из допамина и после полимеризации последнего подвергали пиролизу, в результате которого проходили дегидратация FeOOH и карбонизация полидопамина. Образовавшийся композит CNT@Fe3O4@SiO2@C обрабатывали гипофосфитом натрия для перевода Fe3O4 в FeP и выщелачивали диоксид кремния. Электроды с таким композитом при плотности тока 100 мА/г демонстрировали емкость около 400 мА ч/г в течение 100 циклов.
Обратимое внедрение натрия в фосфид кобальта СоР, синтезированный шаровым помолом порошков кобальта и красного фосфора, исследовано в работе [145]. Электроды с таким фосфидом в 1 М растворе NaClO4 в смеси этиленкарбоната с диэтилкарбонатом с добавкой фторэтилекарбоната имели начальную емкость около 500 мА ч/г, но после 25 циклов она снизилась до 300 мА ч/г, что делает сомнительными перспективы использования фосфида кобальта в натрий-ионных аккумуляторах. Авторы [146] описали комбинированный композит со структурой “ядро–оболочка”, содержащий фосфиды кобальта и железа. Исходным веществом при синтезе этого композита была берлинская лазурь в виде микрокубиков. Такие микрокубики с ребром около 1 мкм синтезировали из желтой кровяной соли по методике, описанной в [147]. Кубики берлинской лазури диспергировали в растворе ацетата кобальта и после обработки такой суспензии аммиаком получали микрокубики берлинской лазури покрытые слоем Со(ОН)2. Затем на них наносили тонкий слой оксида графена, и полученные трехслойные образования обрабатывали гипофосфитом натрия для восстановления оксида графена и перевода гидроксида кобальта в фосфид СоР и перевода берлинской лазури в фосфид железа FeP. Получался композит, частицы которого состояли из кубических оболочек из СоР, внутри которых находились частицы FeP с тонким углеродным покрытием, и все эти образования находились в “паутине” из графена. Электроды с таким изощренным композитом устойчиво циклировались в 1 М растворе NaClO4 в пропиленкарбонате с добавкой фторэтиленкарбоната. За 200 циклов при плотности тока 100 мА/г их емкость снизилась с 550 до 480 мА ч/г. Близкие характеристики имели электроды, в которых частицы СоР с углеродным покрытием были распределены в пеноникеле с покрытием из графена [148].
Многообещающим материалом оказался фосфид германия GeP5. Исследования композита этого материала с графитом (7 : 2), приготовленного шаровым помолом, описаны в [149]. Сам по себе фосфид германия также был синтезирован шаровым помолом из элементов. Поскольку германий обладает способностью к обратимому внедрению натрия [150], предполагалось, что при первой катодной поляризации фосфида германия будут образовываться соединения натрия с германием и фосфором, а при дальнейшем циклировании оба компонента будут функционировать независимо:
(6)
${\text{Ge}}{{{\text{P}}}_{5}} + {\text{16N}}{{{\text{a}}}^{ + }} + 16{\text{e}} \to 5{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}} + {\text{NaGe}},$(1′)
$5{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}} \leftrightarrow {\text{5P}} + 15{\text{N}}{{{\text{a}}}^{ + }} + 15{\text{e}},$И действительно, электроды с композитом фосфида германия с графитом устойчиво циклировались в течение 60 циклов с емкостью от 1200 до 1000 мА ч/г при плотности тока 100 мА/г. При плотности тока 1500 мА/г емкость была около 800 мА ч/г, что можно считать очень хорошим показателем.
Близкие результаты были получены в работе [151] для композитов GeP3 с сажей Super P, несмотря на различие в составах фосфидов германия.
Определенный интерес представляет также аморфный фосфид селена Se4P4, который может быть синтезирован шаровым помолом из элементов. В [152] показано, что электроды из аморфного фосфида селена имеют емкость около 1000 мА ч/г при плотности тока 50 мА/г и около 300 мА ч/г при плотности тока 3000 мА/г и устойчиво циклируются, по крайней мере, в течение 60 циклов. Работоспособность аморфного фосфида селена P4Se3 подтверждена также в работе [153].
В [154] описаны электроды из наностержней фосфида вольфрама WP, выращенных на углеродной ткани. На таких электродах получена емкость более 500 мА ч/г при токе 100 мА/г и достигнута наработка более 1000 циклов при циклировании током 2 А/г.
В работе [155] была предпринята попытка использовать в качестве отрицательного электрода фосфид кремния SiP2, однако она оказалась неудачной: уже за 15 циклов емкость в режиме С/2 равномерно снизилась с 800 до 400 мА ч/г.
ЗАКЛЮЧЕНИЕ
Работы по использованию фосфора в отрицательных электродах натрий-ионных аккумуляторов начались в 2013 г., но уже стало ясно, что фосфор – это лучший материал для этих целей. Экспериментально показано, что электроды на основе фосфора могут разряжаться с удельной емкостью, близкой к теоретической (около 2600 мА ч/г при внедрении натрия в фосфор и около 800 мА ч/г при его извлечении из Na3P). Есть данные о достигнутом ресурсе электродов на основе фосфора около 5000 циклов. По этим показателям фосфор значительно превосходит твердый углерод, который до последнего времени считался лучшим выбором для натрий-ионных аккумуляторов. Фосфор используется как в виде красной аллотропической модификации, так и в виде черного фосфора (главным образов в виде фосфоренов), а также в виде соединений – фосфидов. Красный фосфор, с учетом низкой электронной проводимости, используется в виде композитов, обычно, с углеродом. В обзорных статьях [38, 40, 111] черный фосфор назван “восходящей звездой” в энергетике, однако как следует из настоящего обзора, характеристики электродов на основе красного фосфора, в целом, не уступают характеристикам электродов из его черного аналога. Характеристики электродов на основе фосфидов несколько скромнее, и перспективы таких материалов пока не ясны. В литературе имеются многочисленные сообщения об использовании фосфора в литий-ионных аккумуляторах. В целом, характеристики электродов по обратимому внедрению лития превосходят характеристики натриевых аналогов, но применительно к литий-ионным аккумуляторам фосфор все же уступает кремнию. Для натрий-ионных аккумуляторов кремний, как материал отрицательного электрода, не представляет особого интереса.
Список литературы
Ellis, B.L. and Nazar, L.F., Sodium and sodium-ion energy storage batteries, Current Opinion in Solid State and Mater. Sci., 2012, vol. 16, p. 168.
Palomares, V., Serras, P., Villaluenga, I., Hueso, K.B., Carretero-Gonzalez, J., and Rojo, T., Na-ion batteries, recent advances and present challenges to become low cost energy storage systems, Energy Environ. Sci., 2012, vol. 5, p. 5884.
Slater, M.D., Kim, D., Lee, E., and Johnson, Ch.S., Sodium-ion batteries, Adv. Funct. Mat., 2013, vol. 23, p. 947.
Pan, H., Hu, Y.-S., and Chen, L., Room-temperature stationary sodium-ion batteries for large-scale electric energy storage, Energy Environ. Sci., 2013, vol. 6, p. 2338.
Yabuuchi, N., Kubota, K., Dahbi, M., and Komaba, S., Research Development on Sodium-Ion Batteries, Chem. Rev., 2014, vol. 114, p. 11636.
Kubota, K. and Komaba, S., Review–Practical Issues and Future Perspective for Na-Ion Batteries, J. Electrochem. Soc., 2015, vol. 162, p. A2538.
Kundu, D., Talaie, E., Duffort, V., and Nazar, L.F., The Emerging Chemistry of Sodium Ion Batteries for Electrochemical Energy Storage, Angew. Chem. Int. Ed., 2015, vol. 54, p. 3431.
Кулова, Т.Л., Скундин, А.М. От литий-ионных к натрий-ионным аккумуляторам, Изв. Академии наук. Сер. хим. 2017. № 8. С. 1329. [Kulova, T.L. and Skundin, A.M., From lithium-ion to sodium-ion battery, Russ. Chem. Bull., Int. Ed., 2017, vol. 66, no. 8, p. 1329.]
Скундин, А.М., Кулова, Т.Л., Ярославцев, А.Б. Натрий-ионные аккумуляторы (Обзор). Электрохимия. 2018. Т. 54. С. 131. [Skundin, A.M., Kulova, T.L., and Yaroslavtsev, A.B., Sodium-ion Batteries (a Review), Russ. J. Electrochem., 2018, v. 54, p. 113.]
Delmas, C., Sodium and Sodium-Ion Batteries: 50 Years of Research, Adv. Energy Mater., 2018, vol. 8, Iss. 17, Article no. 1703137.
Deng, J., Luo, W.-B., Chou, S.-L., Liu, H.-K., and Dou, S.-X., Sodium-Ion Batteries: From Academic Research to Practical Commercialization, Adv. Energy Mater., 2018, vol. 8, Iss. 4, Article no. 1701428.
Sung-Wook, Kim, Dong-Hwa, Seo, Xiaohua, Ma, Ceder, G., and Kisuk, Kang, Electrode Materials for Rechargeable Sodium-Ion Batteries: Potential Alternatives to Current Lithium-Ion Batteries, Adv. Energy Mater., 2012, vol. 2, p. 710.
Ong, S.P., Chevrier, V.L., Hautier, G., Jain, A., Moore, C., Kim, S., Ma, X., and Ceder, G., Voltage, stability and diffusion barrier differences between sodium-ion and lithium-ion intercalation materials, Energy Environ. Sci., 2011, vol. 4, p. 3680.
Hong, S.Y., Kim, Y., Park, Y., Choi, A., Choi, N.-S., and Lee, K.T., Charge carriers in rechargeable batteries: Na ions vs. Li ions, Energy Environ. Sci., 2013, vol. 6, p. 2067.
Li, L., Zheng, Y., Zhang, S., Yang, J., Shao, Z., and Guo, Z., Recent progress on sodium ion batteries: potential high-performance anodes, Energy Environ. Sci., 2018, vol. 11, p. 2310.
Xu, J., Lee, D.H., and Meng, Y.S., Recent advances in sodium intercalation positive electrode materials for sodium ion battreies, Funct. Mater. Lett., 2013, vol. 6, Article no. 1330001.
Xiang, X., Zhang, K., and Chen, J., Recent advances and prospects of cathode materials for sodium-ion batteries, Adv. Mater., 2015, vol. 27, p. 5343.
Kubota, K., Yabuuchi, N., Yoshida, H., Dahbi, M., and Komaba, S., Layered oxides as positive electrode materials for Na-ion batteries, MRS Bulletin, 2014, vol. 39, p. 416.
Han, M.H., Gonzalo, E., Singh, G., and Rojo, T., A comprehensive review of sodium layered oxides: powerful cathodes for Na-ion batteries, Energy Environ. Sci., 2015, vol. 8, p. 81.
Clément, R.J., Bruce, P.G., and Grey, C.P., Review—Manganese-Based P2-Type Transition Metal Oxides as Sodium-Ion Battery Cathode Materials, J. Electrochem. Soc., 2015, vol. 162, p. A2589.
Masquelier, C. and Croguennec, L., Polyanionic (Phosphates, Silicates, Sulfates) Frameworks as Electrode Materials for Rechargeable Li (or Na) Batteries, Chem. Rev., 2013, vol. 113, p. 6552.
Yabuuchi, N. and Komaba, S., Recent research progress on iron- and manganese-based positive electrode materials for rechargeable sodium batteries, Sci. Technol. Adv. Mater., 2014, vol. 15, Article no. 043501.
Toumar, A.J., Ong, S.P., Richards, W.D., Dacek, S., and Ceder, G., Vacancy Ordering in O3-Type Layered Metal Oxide Sodium-Ion Battery Cathodes, Phys. Rev. Appl., 2015, vol. 4, Article no. 064002.
Kim, Y., Park, Y., Choi, A., Choi, N.-S., Kim, J., Lee, J., Ryu, J.H., Oh, S.M., and Lee, K.T., An Amorphous Red Phosphorus/Carbon Composite as a Promising Anode Material for Sodium Ion Batteries, Adv. Mater., 2013, vol. 25, p. 3045.
Fu, Y., Wei, Q., Zhang, G., and Sun, S., Advanced Phosphorus-Based Materials for Lithium/Sodium-Ion Batteries: Recent Developments and Future Perspectives, Adv. Energy Mater., 2018, vol. 8, Iss. 13, Article no. 1702849
Zhao, D., Zhang, L., Fu, C., Zhang, J., and Niu, C., The lithium and sodium storage performances of phosphorus and its hierarchical structure, Nano Research., 2019. vol. 12, Iss. 1, p. 1.
Weili, Liu, Hanqian, Zhi, and Xuebin, Yu., Recent progress in phosphorus based anode materials for lithium/sodium ion batteries, Energy Storage Mater., 2019, vol. 16, p. 290.
Mei, P., Kim, J., Kumar, N.A., Pramanik, M., Kobayashi, N., Sugahara, Y., and Yamauchi, Y., Phosphorus-Based Mesoporous Materials for Energy Storage and Conversion, Joule, 2018, vol. 2, p. 2289.
Han, X., Han, J., Liu, C., and Sun, J., Promise and Challenge of Phosphorus in Science, Technology, and Application, Adv. Funct. Mater. 2018, vol. 28, Article no. 1803471.
Li, Z. and Zhao, H., Recent developments of phosphorus-based anodes for sodium ion batteries, J. Mater. Chem. A, 2018, vol. 6, p. 24013.
Zhou, J., Liu, X., Cai, W., Zhu, Y., Liang, J., Zhang, K., Lan, Y., Jiang, Z., Wang, G., and Qian, Y., Wet-Chemical Synthesis of Hollow Red-Phosphorus Nanospheres with Porous Shells as Anodes for High-Performance Lithium-Ion and Sodium-Ion Batteries, Adv. Mater., 2017, vol. 29, Iss. 29, Article no. 1700214.
Liu, H., Neal, A.T., Zhu, Z., Luo, Z., Xu, X., Tománek D., and Ye, P.D., Phosphorene: An unexplored 2D semiconductor with a high hole mobility, ACS Nano, 2014, vol. 8, p. 4033.
Bagheri, S., Mansouri, N., and Aghaie, E., Phosphorene: A new competitor for graphene (Review), Int. J. Hydrogen Energy, 2016, vol. 41, p. 4085.
Carvalho, A., Wang, M., Zhu, X., Rodin, A.S., Su, H., and Castro Neto H., Phosphorene: From theory to applications (Review), Nature Rev. Mater., 2016, vol. 1, Iss. 11, Article no. 16061.
Liu, H., Du, Y., Deng, Y., and Ye, P.D., Semiconducting black phosphorus: Synthesis, transport properties and electronic applications (Review), Chem. Soc. Rev., 2015, vol. 44, p. 2732.
Guo, Z., Ding, W., Liu, X., Sun, Z., and Wei, L., Two-dimensional black phosphorus: A new star in energy applications and the barrier to stability, Appl. Mater. Today, 2019, vol. 14, p. 51.
Qiu, M., Sun, Z.T., Sang, D.K., Han, X.G., Zhang, H., and Niu, C.M., Current progress in black phosphorus materials and their applications in electrochemical energy storage, Nanoscale, 2017, vol. 9, p. 13384.
Liu, H., Hu, K., Yan, D., Chen, R., Zou, Y., Liu, H., and Wang, S., Recent Advances on Black Phosphorus for Energy Storage, Catalysis, and Sensor Applications, Adv. Mater., 2018, vol. 30, no. 32, Article no. 1800295.
Keyes, R.W., The Electrical Properties of Black Phosphorus, Phys. Rev., 1953, vol. 92, p. 580.
Bridgman, P.W., Two new modifications of phosphorus, J. Am. Chem. Soc., 1914, vol. 36, p. 1344.
Endo, S., Akahama, Y., Terada, S.-i., and Narita, S.-i., Growth of Large Single Crystals of Black Phosphorus under High Pressure, Jap. J. Appl. Phys., 1982, vol. 21, part 2, no. 8, p. L482.
Lange, S., Schmidt, P., and Nilges, T., Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus, Inorg. Chem., 2007, vol. 46, p. 4028.
Köpf, M., Eckstein, N., Pfister, D., Grotz, C., Krüger, I., Greiwe, M., Hansen, T., Kohlmann, H., and Nilges, T., Access and in situ growth of phosphorene-precursor black phosphorus, J. Cryst. Growth, 2014, vol. 405, p. 6.
Park, C.M. and Sohn, H.J., Black Phosphorus and its Composite for Lithium Rechargeable Batteries, Adv. Mater., 2007, vol. 19, p. 2465.
Sangster, J.M., Na–P (Sodium–Phosphorus) System. J. Phase Equilib. Diffus., 2010, vol. 31, p. 62.
Mayo, M., Griffith, K.J., Pickard, C.J., and Morris, A.J., Ab Initio Study of Phosphorus Anodes for Lithium- and Sodium-Ion Batteries, Chem. Mater., 2016, vol. 28, p. 2011.
Mortazavi, M., Ye, Q., Birbilis, N., and Medhekar, N.V., High capacity group-15 alloy anodes for Na-ion batteries: Electrochemical and mechanical insights, J. Power Sources, 2015, vol. 285, p. 29.
Qian, J., Wu, X., Cao, Y., Ai, X., and Yang, H., High Capacity and Rate Capability of Amorphous Phosphorus for Sodium Ion Batteries., Angew. Chem. Int. Ed., 2013, vol. 52, p. 4633.
Qian, J., Qiao, D., Ai, X., Cao, Y., and Yang, H., Reversible 3-Li storage reactions of amorphous phosphorus as high capacity and cycling-stable anodes for Li-ion batteries, Chem. Commun., 2012, vol. 48, p. 8931.
Kim, Y., Hwang, S.M., Yu, H., and Kim, Y., High energy density rechargeable metal-free seawater batteries: a phosphorus/carbon composite as a promising anode material, J. Mater. Chem. A, 2018, vol. 6, p. 3046.
Li, W.-J., Chou, S.-L., Wang, J.-Z., Liu, H.-K., and Dou, S.-X., Simply Mixed Commercial Red Phosphorus and Carbon Nanotube Composite with Exceptionally Reversible Sodium-Ion Storage, Nano Lett., 2013, vol. 13, p. 5480.
Song, J., Yu, Z., Gordin, M.L., Hu, S., Yi, R., Tang, D., Walter, T., Regula, M., Choi, D., Li, X., Manivannan, A., and Wang, D., Chemically Bonded Phosphorus/Graphene Hybrid as a High Performance Anode for Sodium-Ion Batteries, Nano Lett., 2014, vol. 14, p. 6329.
Zhou, X., Yin, Y.-X., Wan, L.-J., and Guo, Y.-G., Facile synthesis of silicon nanoparticles inserted into graphene sheets as improved anode materials for lithium-ion batteries, Chem. Commun., 2012, vol. 48, p. 2198.
Xin, X., Zhou, X., Wang, F., Yao, X., Xu, X., Zhu, Y., and Liu, Z., A 3D porous architecture of Si/graphene nanocomposite as high-performance anode materials for Li-ion batteries, J. Mater. Chem., 2012, vol. 22, p. 7724.
Feng, N., Liang, X., Pu, X., Li, M., Liu, M., Cong, Z., Sun, J., Song, W., and Hu, W., Rational design of red phosphorus/reduced graphene oxide composites for stable sodium ion storage, J. Alloys and Compounds, 2019, vol. 775, p. 1270.
Li, W.-J., Chou, S.-L., Wang, J.-Z., Liu, H.-K., and Dou, S.-X., Significant enhancement of the cycling performance and rate capability of the P/C composite via chemical bonding (P–C), J. Mater. Chem. A, 2016, vol. 4, p. 505.
Lee, G.H., Jo, M.R., Zhang, K., and Kang, Y.M., A reduced graphene oxide-encapsulated phosphorus/carbon composite as a promising anode material for high-performance sodium-ion batteries, J. Mater. Chem. A, 2017, vol. 5, p. 3683.
Ding, X.L., Huang, Y.Y., Li, G.L., Tang, Y., Li, X.C., and Huang, Y.H., Phosphorus nanoparticles combined with cubic boron nitride and graphene as stable sodium ion battery anodes, Electrochim. Acta, 2017, vol. 235, p. 150.
Zhao, Q., Meng, Y., Yang, L., He, X., He, B., Liu, Y., and Xiao, D., Facile synthesis of phosphorus-doped carbon under tuned temperature with high lithium and sodium anodic performances, J. Colloid and Interface Sci., 2019, vol. 551, p. 61.
Song, J., Yu, Z., Gordin, M.L., Li, X., Peng, H. and Wang, D., Advanced Sodium-Ion Battery Anode Constructed via Chemical Bonding between Phosphorus, Carbon Nanotube and Crosslinked Polymer Binder, ACS Nano, 2015, vol. 9, p. 11933.
Liu, W., Yuan, X., and Yu, X., Core–shell structure of polydopamine-coated phosphorus-carbon nanotube composite for high-performance sodium-ion batteries, Nanoscale, 2018, vol. 10. p. 16675.
Walter, M., Erni, R., and Kovalenko, M.V., Inexpensive Antimony Nanocrystals and Their Composites with Red Phosphorus as High-Performance Anode Materials for Na-ion Batteries, Sci. Rep., 2015, vol. 5, p. 8418.
Darwiche, A., Marino, C., Sougrati, M.T., Fraisse, B., Stievano, L., and Monconduit, L., Better cycling performances of bulk Sb in Na-ion batteries compared to Li-ion systems: An unexpected electrochemical mechanism, J. Amer. Chem. Soc., 2012, vol. 134, p. 20805.
Liang, L., Xu, Y., Wang, C., Wen, L., Fang, Y., Mi, Y., Zhou, M., Zhao, H., and Lei, Y., Large-scale highly ordered Sb nanorod array anodes with high capacity and rate capability for sodium-ion batteries, Energy Environ. Sci., 2015, vol. 8, p. 2954.
Saubanère, M., Yahia, M.B., Lemoigno, F., and Doublet, M.-L., Influence of polymorphism on the electrochemical behavior of MxSb negative electrodes in Li/Na batteries, J. Power Sources, 2015, vol. 280, p. 695.
He, M., Kravchyk, K., Walter, M., and Kovalenko, M.V., Monodisperse antimony nanocrystals for high-rate li-ion and na-ion battery anodes: Nano versus bulk, Nano Lett., 2014, vol. 14, p. 1255.
Chin, L.-C., Yi, Y.-H., Chang, W.-C., and Tuan, H.-Y., Significantly improved performance of red phosphorus sodium-ion anodes with the addition of iron, Electrochim. Acta, 2018, vol. 266, p. 178.
Marino, C., Debenedetti, A., Fraisse, B., Favier, F., and Monconduit, L., Activated-phosphorus as new electrode material for Li-ion batteries, Electrochem. Comm., 2011, vol. 13, p. 346.
Wang, L., He, X., Li, J., Sun, W., Gao, J., Guo, J., and Jiang, C., Nano-Structured Phosphorus Composite as High-Capacity Anode Materials for Lithium Batteries, Angew. Chem. Int. Ed., 2012, vol. 51, p. 9034.
Zhu, Y., Wen, Y., Fan, X., Gao, T., Han, F., Luo, C., Liou, S.-C., and Wang C., Red Phosphorus–Single-Walled Carbon Nanotube Composite as a Superior Anode for Sodium Ion Batteries, ACS Nano, 2015, vol. 9, p. 3254.
Ruan, B., Wang, J., Shi, D., Xu, Y., Chou, S., Liu, H., and Wang, J., A phosphorus/N-doped carbon nanofiber composite as an anode material for sodium-ion batteries, J. Mater. Chem. A, 2015, vol. 3, p. 19011.
Xu, J., Ding, J., Zhu, W., Zhou, X., Ge, S., and Yuan, N., Nano-structured red phosphorus/porous carbon as a superior anode for lithium and sodium-ion batteries, Sci. China Mater., 2018, vol. 61, p. 371.
Li, W., Yang, Z., Li, M., Jiang, Y., Wei, X., Zhong, X., Gu, L., and Yu, Y., Amorphous Red Phosphorus Embedded in Highly Ordered Mesoporous Carbon with Superior Lithium and Sodium Storage Capacity, Nano Lett., 2016, vol. 16, p. 1546.
Ryoo, R., Joo, S.H., Kruk, M., and Jaroniec, M., Ordered Mesoporous Carbons, Adv. Mater., 2001, vol. 13, p. 677.
Lee, J., Kim, J., and Hyeon, T., Recent Progress in the Synthesis of Porous Carbon Materials, Adv. Mater., 2006, vol. 18, p. 2073.
Yu, Z., Song, J., Wang, D., and Wang, D., Advanced anode for sodium-ion battery with promising long cycling stability achieved by tuning phosphorus-carbon nanostructures, Nano Energy, 2017, vol. 40, p. 550.
Yao, S., Cui, J., Huang, J., Huang, J.-Q., Chong, W.G., Qin, L., Mai, Y.-W., and Kim, J.-K., Rational Assembly of Hollow Microporous Carbon Spheres as P Hosts for Long-Life Sodium-Ion Batteries, Adv. Energy Mater., 2018, vol. 8, Article no. 1702267.
Zhang, C., Wang, X., Liang, Q., Liu, X., Weng, Q., Liu, J., Yang, Y., Dai, Z., Ding, K., Bando, Y., Tang, J., and Golberg, D., Amorphous Phosphorus/Nitrogen-Doped Graphene Paper for Ultrastable Sodium-Ion Batteries, Nano Lett., 2016, vol. 16, p. 2054.
Nicolosi, V., Chhowalla, M., Kanatzidis, M.G., Strano, M.S., and Coleman, J.N., Liquid Exfoliation of Layered Materials, Science, 2013, vol. 340, p. 1420.
Huang, Y., Sutter, E., Shi, N.N., Zheng, J., Yang, T., Englund, D., Gao, H.-J., and Sutter, P., Reliable Exfoliation of Large-Area High-Quality Flakes of Graphene and Other Two-Dimensional Materials, ACS Nano, 2015, vol. 9, p. 10612.
Pei, L., Zhao, Q., Chen, C., Liang, J., and Chen, J., Phosphorus Nanoparticles Encapsulated in Graphene Scrolls as a High-Performance Anode for Sodium-Ion Batteries, ChemElectroChem, 2015, vol. 2, p. 1652.
Gao, H., Zhou, T., Zheng, Y., Liu, Y., Chen, J., Liu, H., and Guo, Z., Integrated Carbon/Red Phosphorus/Graphene Aerogel 3D Architecture via Advanced Vapor-Redistribution for High-Energy Sodium-Ion Batteries, Adv. Energy Mater., 2016, vol. 6, Article no. 1601037.
Liu, Y., Zhang, A., Shen, C., Liu, Q., Cao, X., Ma, Y., Chen, L., Lau, C., Chen, T.C., Wei, F., and Zhou, C., Red Phosphorus Nanodots on Reduced Graphene Oxide as a Flexible and Ultra-Fast Anode for Sodium-Ion Batteries, ACS Nano, 2017, vol. 11, p. 5530.
Li, J., Wang, L., Wang, Z., Tian, G., and He, X., Economic and High Performance Phosphorus–Carbon Composite for Lithium and Sodium Storage, ACS Omega, 2017, vol. 2, p. 4440.
Wu, N., Yao, H.-R., Yin, Y.-X., and Guo, Y.-G., Improving the electrochemical properties of the red P anode in Na-ion batteries via the space confinement of carbon nanopores, J. Mater. Chem. A, 2015, vol. 3, p. 24221.
Wu, Y., Liu, Z., Zhong, X., Cheng, X., Fan, Z., and Yu, Y., Amorphous Red Phosphorus Embedded in Sandwiched Porous Carbon Enabling Superior Sodium Storage Performances, Small, 2018, vol. 14, Article no. 1703472.
Ma, X., Chen, L., Ren, X., Hou, G., Chen, L., Zhang, L., Liu, B., Ai, Q., Zhang, L., Si, P., Lou, J., Feng, J., and Ci, L., High Performance Red Phosphorus/Carbon Nanofibers/Graphene Free-standing Paper Anode for Sodium Ion Batteries, J. Mater. Chem., A, 2018, vol. 6, p. 1574.
Li, W., Hu, S., Luo, X., Li, Z., Sun, X., Li, M., Liu, F., and Yu, Y., Confined Amorphous Red Phosphorus in MOF-Derived N-Doped Microporous Carbon as a Superior Anode for Sodium-Ion Battery, Adv. Mater., vol. 29, Article no. 1605820.
Sun, J., Lee, H.-W., Pasta, M., Sun, Y., Liu, W., Li, Y., Lee, H.R., Liu, N., and Cui, Y., Carbothermic reduction synthesis of red phosphorus-filled 3D carbon material as a high-capacity anode for sodium ion batteries, Energy Storage Materials, 2016, vol. 4, p. 130.
Zeng, G., Hu, X., Zhou, B., Chen, J., Cao, C., and Wen, Z., Engineering graphene with red phosphorus quantum dots for superior hybrid anodes of sodium-ion batteries, Nanoscale, 2017, vol. 9, Iss. 38, p. 14722.
Liu, Y., Zhang, N., Liu, X., Chen, C., Fan, L.-Z., and Jiao, L., Red phosphorus nanoparticles embedded in porous N-doped carbon nanofibers as high-performance anode for sodium-ion batteries, Energy Storage Materials, 2017, vol. 9, p. 170.
Zhang, Y., Zheng, Y., Rui, K., Hng, H.H., Hippalgaonkar, K., Xu, J., Sun, W., Zhu, J., Yan, Q., and Huang, W., 2D Black Phosphorus for Energy Storage and Thermoelectric Applications, Small, 2017, vol. 13, Iss. 28, Article no. 1700661.
Qiao, J., Kong, X., Hu, Z.-X., Yang, F., and Ji, W., High-mobility transport anisotropy and linear dichroism in few-layer black phosphorus, Nat. Comm., 2014, vol. 5, Article no. 4475.
Xia, F., Wang, H., and Jia, Y., Rediscovering black phosphorus as an anisotropic layered material for optoelectronics and electronics, Nat. Comm., 2014, vol. 5, Article no. 4458.
Nie, A., Cheng, Y., Ning, S., Foroozan, T., Yasaei, P., Li, W., Song, B., Yuan, Y., Chen, L., Salehi-Khojin, A., Mashayek, F., and Shahbazian-Yassar, R., Selective Ionic Transport Pathways in Phosphorene, Nano Lett., 2016, vol. 16, p. 2240.
Chen, T., Zhao, P., Guo, X., and Zhang, S., Two-Fold Anisotropy Governs Morphological Evolution and Stress Generation in Sodiated Black Phosphorus for Sodium Ion Batteries, Nano Lett., 2017, vol. 17, Iss. 4, p. 2299.
Hembram, K.P.S.S., Jung, H., Yeo, B.C., Pai, S.J., Kim, S., Lee, K.-R., and Han, S.S., Unraveling the Atomistic Sodiation Mechanism of Black Phosphorus for Sodium Ion Batteries by First-Principles Calculations, J. Phys. Chem. C, 2015, vol. 119, p. 15041.
Cheng, Y., Zhu, Y., Han, Y., Liu, Z., Yang, B., Nie, A., Huang, W., Shahbazian-Yassar, R., and Mashayek, F., Sodium-Induced Reordering of Atomic Stacks in Black Phosphorus, Chem. Mater., 2017, vol. 29, p. 1350.
Yu, X.-F., Giorgi, G., Ushiyama, H., and Yamashita, K., First-principles study of fast Na diffusion in Na3P, Chem. Phys. Lett. 2014, vol. 612, p. 129.
Dahbi, M., Yabuuchi, N., Fukunishi, M., Kubota, K., Chihara, K., Tokiwa, K., Yu, X.-F., Ushiyama, H., Yamashita, K., Son, J.-Y., Cui, Y.-T., Oji, H., and Komaba, S., Black Phosphorus as a High-Capacity, High-Capability Negative Electrode for Sodium-Ion Batteries: Investigation of the Electrode/Electrolyte Interface, Chem. Mater., 2016, vol. 28, Iss. 6, p. 1625.
Ramireddy, T., Xing, T., Rahman, M.M., Chen, Y., Dutercq, Q., Gunzelmann, D., and Glushenkov, A.M., Phosphorus-carbon nanocomposite anodes for lithium-ion and sodium-ion batteries, J. Mater. Chem. A, 2015, vol. 3, p. 5572.
Xu, G.L., Chen, Z.H., Zhong, G.M., Liu, Y.Z., Yang, Y., Ma, T.Y., Ren, Y., Zuo, X.B., Wu, X.H., Zhang, X.Y., and Amine, K., Nanostructured Black Phosphorus/Ketjenblack–Multiwalled Carbon Nanotubes Composite as High Performance Anode Material for Sodium-Ion Batteries, Nano Lett, 2016, vol. 16, p. 3955.
Liu, H., Tao, L., Zhang, Y., Xie, C., Zhou, P., Chen, R., and Wang, S., Bridging Covalently Functionalized Black Phosphorus on Graphene for High-Performance Sodium-Ion Battery, ACS Applied Materials and Interfaces, 2017, vol. 9, Iss. 42, p. 36849.
Xu, Y., Wang, Z., Guo, Z., Huang, H., Xiao, Q., Zhang, H., and Yu, X.F., Solvothermal Synthesis and Ultrafast Photonics of Black Phosphorus Quantum Dots, Adv. Optical Mater. 2016, vol. 4, p. 1223.
Zhang, Y., Sun, W., Luo, Z.-Z., Zheng, Y., Yu, Z., Zhang, D., Yang, J., Tan, H.T., Zhu, J., Wang, X., Yan, Q., and Dou, S.X., Functionalized few-layer black phosphorus with super-wettability towards enhanced reaction kinetics for rechargeable batteries, Nano Energy, 2017, vol. 40, p. 576.
Castellanos-Gomez, A., Vicarelli, L., Prada, E., Island, J.O., Narasimha-Acharya, K.L., Blanter, S.I., Groenendijk, D.J., Buscema, M., Steele, G.A., Alvarez, J.V., Zandbergen, H.W., Palacios, J.J., and Van Der Zant, H.S.J., Isolation and characterization of few-layer black phosphorus, 2D Materials, 2014, vol. 1, Iss. 2, Article no. A6(025001).
Hanlon, D., Backes, C., Doherty, E., Cucinotta, C.S., Berner, N.C., Boland, C., Lee, K., Harvey, A., Lynch, P., Gholamvand, Z., Zhang, S., Wang, K., Moynihan, G., Pokle, A., Ramasse, Q.M., McEvoy, N., Blau, W.J., Wang, J., Abellan, G., Hauke, F., Hirsch, A., Sanvito, S., O’Regan, D.D., Duesberg, G.S., Nicolosi, V., and Coleman, J.N., Liquid exfoliation of solvent-stabilized few-layer black phosphorus for applications beyond electronics, Nat. Commun., 2015, vol. 6, Article no. 8563.
Hu, Z., Niu, T., Guo, R., Zhang, J., Lai, M., He, J., Wang, L. and Chen, W., Two-dimensional black phosphorus: its fabrication, functionalization and applications, Nanoscale, 2018, vol. 10, p. 21575.
Brent, J.R., Savjani, N., Lewis, E.A., Haigh, S.J., Lewis, D.J., and O’Brien, P., Production of few-layer phosphorene by liquid exfoliation of black phosphorus, Chem. Comm., 2014, vol. 50, p. 13338.
Late, D.J., Liquid exfoliation of black phosphorus nanosheets and its application as humidity sensor, Microporous and Mesoporous Materials, 2016, vol. 225, p. 494.
Pang, J., Bachmatiuk, A., Yin, Y., Trzebicka, B., Zhao, L., Fu, L., Mendes, R.G., Gemming, T., Liu, Z., and Rummeli, M.H., Applications of Phosphorene and Black Phosphorus in Energy Conversion and Storage Devices, Adv. Energy Mater., 2018, vol. 8, Iss. 8, Article no. 1702093.
Kulish, V.V., Malyi, O.I., Persson, C., and Wu, P., Phosphorene as an anode material for Na-ion batteries: a first-principles study, Phys. Chem. Chem. Phys., 2015, vol. 17, p. 13921.
Liu, X., Wen, Y., Chen, Z., Shan, B., and Chen, R., A first-principles study of sodium adsorption and diffusion on phosphorene, Phys. Chem. Chem. Phys., 2015, vol. 17, p. 16398.
Sun, X. and Wang, Z., Sodium Adsorption and Diffusion on Monolayer Black Phosphorus with Intrinsic Defects, Appl. Surface Sci., 2018, vol. 427, p. 189.
Sun, J., Lee, H.W., Pasta, M., Yuan, H., Zheng, G., Sun, Y., Li, Y., and Cui, Y., A phosphorene–graphene hybrid material as a high-capacity anode for sodium-ion batteries, Nat. Nanotechnol., 2015, vol. 10, p. 980.
Hernandez, Y., Nicolosi, V., Lotya, M., Blighe, F.M., Sun, Z., De, S., McGovern, I.T., Holland, B., Byrne, M., Gun’ko, Y.K., Boland, J.J., Niraj, P., Duesberg, G., Krishnamurthy, S., Goodhue, R., Hutchison, J., Scardaci, V., Ferrari, A.C., and Coleman, J.N., High-yield production of graphene by liquid-phase exfoliation of graphite, Nat. Nanotechnol., 2008, vol. 3, p. 563.
Chowdhury, C., Karmakar, S., and Datta, A., Capping Black Phosphorene by hBN Enhances Performances in Anodes for Li and Na Ion Batteries, ACS Energy Lett., 2016, vol. 1, p. 253.
Kim, Y., Kim, Y., Choi, A., Woo, S., Mok, D., Choi, N.-S., Jung, Y.S., Ryu, J.H., Oh, S.M., and Lee, K.T., Tin Phosphide as a Promising Anode Material for Na-Ion Batteries, Adv. Mater., 2014, vol. 26, p. 4139.
Olofsson, O., On the crystal structure of Sn4P3, Acta Chem. Scand., 1967, vol. 21, p. 1659.
Qian, J.F., Xiong, Y., Cao, Y.L., Ai, X.P., and Yang, H.X., Synergistic Na-storage reactions in Sn4P3 as a high-capacity, cycle-stable anode of Na-ion batteries, Nano Lett., 2014, vol. 14, p. 1865.
Li, W.J., Chou, S.-L., Wang, J.-Z., Kim, J.H., Liu, H.-K., and Dou, S.-X., Sn4 +xP3@amorphous Sn–P composites as anodes for sodium-ion batteries with low cost, high capacity, long life, and superior rate capability, Adv. Mater., 2014, vol. 26, p. 4037.
Liu, S., Zhang, H., Xu, L., Ma, L., and Chen, X., Solvothermal preparation of tin phosphide as a long-life anode for advanced lithium and sodium ion batteries, J. Power Sources, 2016, vol. 304, p. 346.
Liu, J., Kopold, P., Wu, C., Aken, P.A., Maier, J., and Yu, Y., Uniform yolk-shell Sn4P3@C nanospheres as high-capacity and cycle-stable anode materials for sodium-ion batteries, Energy Environ. Sci., 2015, vol. 8, p. 3531.
Lou, X.W., Wang, Y., Yuan, C., Lee, J.Y., and Archer, L.A., Template-Free Synthesis of SnO2 Hollow Nanostructures with High Lithium Storage Capacity, Adv. Mater., 2006, vol. 18, p. 2325.
Liu, J., Wen, Y.R., Wang, Y., van Aken, P.A., Maier, J., and Yu, Y., Carbon-Encapsulated Pyrite as Stable and Earth-Abundant High Energy Cathode Material for Rechargeable Lithium Batteries, Adv. Mater., 2014, vol. 26, p. 6025.
Kovnir, K.A., Kolen’ko, Y.V., Ray, S., Li, J., Watanabe, T., Itoh, M., Yoshimura, M., and Shevelkov, A.V., A facile high-yield solvothermal route to tin phosphide Sn4P3, J. Solid State Chem., 2006, vol. 179, p. 3756.
Li, Q., Li, Z.Q., Zhang, Z.W., Li, C.X., Ma, J.Y., Wang, C.X., Ge, X.L., Dong, S.H., and Yin, L.W., Low-temperature solution-based phosphorization reaction route to Sn4P3/reduced graphene oxide nanohybrids as anodes for sodium ion batteries, Adv. Energy Mater., 2016, vol. 6, Article no. 1600376.
Wang, G., Wang, B., Wang, X., Park, J., Dou, S., Ahn, H., and Kim, K., Sn/graphene nanocomposite with 3D architecture for enhanced reversible lithium storage in lithium ion batteries, J. Mater. Chem., 2009, vol. 19, p. 8378.
Pan, E., Jin, Y., Zhao, C., Jia, M., Chang, Q., Zhang, R., and Jia, M., Mesoporous Sn4P3-graphene aerogel composite as a high-performance anode in sodium ion batteries, Appl. Surf. Sci., 2019, vol. 475, p. 12.
Fan, X.L., Mao, J.F., Zhu, Y.J., Luo, C., Suo, L.M., Gao, T., Han, F.D., Liou, S.-C., and Wang, C.S., Superior stable self-healing SnP3 anode for sodium-ion batteries, Adv. Energy Mater., 2015, vol. 5, no. 18, Article no. 1500174.
Suryanarayana, C., Mechanical alloying and milling, Progr. Mater. Sci., 2001, vol. 46, Iss. 1–2, p. 1.
Fan, X., Shao, J., Xiao, X., Wang, X., Li, S., Ge, H., and Chen, L., SnLi4.4 nanoparticles encapsulated in carbon matrix as high performance anode material for lithium-ion batteries, Nano Energy, 2014, vol. 9, p. 196.
Fullenwarth, J., Darwiche, A., Soares, A., Donnadieu, B., and Monconduit, L., NiP3: a promising negative electrode for Li- and Na-ion batteries, J. Mater. Chem. A, 2014, vol. 2, p. 2050.
Wu, C., Kopold, P., Aken, P.A.V., Maier, J., and Yu, Y., High performance graphene/Ni2P hybrid anodes for lithium and sodium storage through 3D yolk-shell-like nanostructural design, Adv. Mater., 2017, vol. 29, Article no. 1604015.
Zheng, J., Huang, X., Pan, X., Teng, C., and Wang, N., Yolk-shelled Ni2P@carbon nanocomposite as high-performance anode material for lithium and sodium ion batteries, Appl. Surf. Sci., 2019, vol. 473, p. 699.
Zhou, D., Xue, L.-P., and Wang, N., Robustly immobilized Ni2P nanoparticles in porous carbon networks promotes high-performance sodium-ion storage, J. Alloys and Comps, 2019, vol. 776, p. 912.
Li, H., Wang, X., Zhao, Z., Tian, Z., Zhang, D., and Wu, Y., Ni2P Nanoflake Array/Three Dimensional Graphene Architecture as Integrated Free-Standing Anode for Boosting the Sodiation Capability and Stability, ChemElectroChem., 2019, vol. 6, p. 404.
Wang, J., Wang, B., Liu, X., Wang, G., Wang, H., and Bai, J., Construction of carbon-coated nickel phosphide nanoparticle assembled submicrospheres with enhanced electrochemical properties for lithium/sodium-ion batteries, J. Colloid and Interface Sci., 2019, vol. 538, p. 187.
Zhao, F.P., Han, N., Huang, W.J., Li, J.J., Ye, H.L., Chen, F.J., and Li, Y.G., Nanostructured CuP2/C composites as high-performance anode materials for sodium ion batteries, J. Mater. Chem. A, 2015, vol. 3, p. 21754.
Kim, S.-O. and Manthiram, A., The facile synthesis and enhanced sodium-storage performance of a chemically bonded CuP2/C hybrid anode, Chem. Commun., 2016, vol. 52, p. 4337.
Fan, M.P., Chen, Y., Xie, Y.H., Yang, T.Z., Shen, X.W., Xu, N., Yu, H.Y., and Yan, C.L., Halfcell and full-cell applications of highly stable and binder-free sodium ion batteries based on Cu3P nanowire anodes, Adv. Funct. Mater., 2016, vol. 26, p. 5019.
Yang, Q.-R., Li, W.-J., Chou, S.-L., Wang, J.-Z., and Liu, H.-K., Ball-milled FeP/graphite as a low-cost anode material for the sodium-ion battery, RSC Adv., 2015, vol. 5, p. 80536.
Li, W.-J., Chou, S.-L., Wang, J.-Z., Liu, H.-K., and Dou, S.-X., A new, cheap, and productive FeP anode material for sodium-ion batteries, Chem. Commun., 2015, vol. 51, p. 3682.
Han, F., Tan, C.Y.J., and Gao, Z., Improving the specific capacity and cyclability of sodium-ion batteries by engineering a dual-carbon phase-modified amorphous and mesoporous iron phosphide, ChemElectroChem., 2016, vol. 3, p. 1054.
Li, W.-J., Yang, Q.-R., Chou, S.-L., Wang, J.-Z., and Liu, H.-K., Cobalt phosphide as a new anode material for sodium storage, J. Power Sources, 2015, vol. 294, p. 627.
Li, Z., Zhang, L., Ge, X., Li, C., Dong, S., Wang, C., and Yin, L., Core–shell structured CoP/FeP porous microcubes interconnected by reduced graphene oxide as high performance anodes for sodium ion batteries, Nano Energy, 2017, vol. 32, p. 494.
Zhang, L., Wu, H.B., Madhavi, S., Hng, H.H., and Lou, X.W., Formation of Fe2O3 microboxes with hierarchical shell structures from metal-organic frameworks and their lithium storage properties, J. Am. Chem. Soc., 2012, vol. 134, p. 17388.
Ge, X., Li, Z., and Yin, L., Metal-organic frameworks derived porous core/shell CoP@C polyhedrons anchored on 3D reduced graphene oxide networks as anode for sodium-ion battery, Nano Energy, 2017, vol. 32, p. 117.
Li, W., Ke, L., Wei, Y., Guo, S., Gan, L., Li, H., Zhai, T., and Zhou, H., Highly reversible sodium storage in a GeP5/C composite anode with large capacity and low voltage, J. Mater. Chem. A, 2017, vol. 5, p. 4413.
Gavrilin, I.M., Smolyaninov, V.A., Dronov, A.A., Gavrilov, S.A., Trifonov, A.Yu., Kulova, T.L., Kuz’mina, A.A., and Skundin, A.M., Electrochemical insertion of sodium into nanostructured materials based on germanium, Mend. Comm., 2018, vol. 28, p. 659.
Nam, K.-H., Jeon, K.-J., and Park, C.-M., Layered germanium phosphide-based anodes for high-performance lithium- and sodium-ion batteries, Energy Storage Materials, 2019, vol. 17, p. 78.
Lu, Y., Zhou, P., Lei, K., Zhao, Q., Tao, Z., and Chen, J., Selenium Phosphide (Se4P4) as a New and Promising Anode Material for Sodium-Ion Batteries, Adv. Energy Mater., 2017, vol. 7, Article no. 1601973.
Cao, Y., Majeed, M.K., Li, Y., Ma, G., Feng, Z., Ma, X., and Ma, W., P4Se3 as a new anode material for sodium-ion batteries, J. Alloys and Comps, 2019, vol. 775, p. 1286.
Pan, Q., Chen, H., Wu, Z., Wang, Y., Zhong, B., Xia, L., Wang, H.-Y., Cui, G., Guo, X., and Sun, X., Nanowire of WP as a High-Performance Anode Material for Sodium-Ion Batteries, Chemistry – A European J., 2019, vol. 25, p. 971.
Duveau, D., Sananes, Israel S., Fullenwarth, J., Cuninc, F. and Monconduit, L., Pioneer study of SiP2 as negative electrode for Li- and Na-ion batteries, J. Mater. Chem. A, 2016, vol. 4, p. 3228.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия



