Электрохимия, 2020, T. 56, № 1, стр. 20-55
Емкостная деионизация воды (обзор)
Ю. М. Вольфкович *
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: yuvolf40@mail.ru
Поступила в редакцию 24.04.2019
После доработки 18.06.2019
Принята к публикации 04.07.2019
Аннотация
Рассмотрена литература по емкостной деионизации воды (ЕДВ). ЕДВ – это новый метод опреснения воды, заключающийся в прокачке деионизуемой воды между высокодисперсными углеродными электродами, между которыми задается определенная разность потенциалов. ЕДВ требует гораздо меньших энергетических затрат по сравнению с другими опреснительными методами. Рассмотрены различные модификации ЕДВ: мембранная емкостная деионизация (МЕДВ), ЕДВ с редокс-реакциями на электродах, ЕДВ с проточными электродами. Исследовано влияние на ЕДВ пористой структуры электродов, размера гидратированных ионов, типа углеродных электродов, емкости двойного электрического слоя, функциональных групп, смачиваемости водой, pH и других факторов. Рассмотрены проблемы получения чистой питьевой воды и деградации электродов. Описано применение ЕДВ на практике.
ОГЛАВЛЕНИЕ
Введение
1. Преимущества и недостатки метода ЕДВ
2. Различные модификации ЕДВ
2.1. Мембранная емкостная деионизация воды
2.2. ЕДВ с редокс-реакциями на пористых электродах
2.2.1. Катионная интеркаляционная деионизация воды
2.3. ЕДВ с проточными электродами
2.4. МЕДВ с проточными электродами (ПМЕДВ)
3. Влияние пористой структуры электродов
3.1. Общие положения. Влияние удельной поверхности
3.2. Влияние на электросорбцию заряда и размера гидратированных ионов во взаимосвязи с размером пор
3.3. Влияние мезопористости и макропористости углеродных электродов
4. Влияние смачиваемости водой углеродных электродов
5. Нанесение оксидов металлов на углеродные электроды
6. Допирование углеродных электродов различными допантами
7. Влияние на ЕДВ типа углеродных материалов
7.1. Активированные угли, волокна и ткани
7.2. Углеродные нанотрубки и нановолокна
7.3. Графены
7.4. Сравнение графенов с углеродными нанотрубками
8. Удаление солей тяжелых металлов и других вредных примесей
9. Влияние двойного электрического слоя. Функциональные группы. Сдвиг ПНЗ
10. pH в процессах ЕДВ
11. Изотермы адсорбции
12. Проблемы получения чистой воды. Поверхностная проводимость. Мозаичные мембраны
13. Отравление электродов и их деградация
14. Применение ЕДВ на практике
Заключение
ВВЕДЕНИЕ
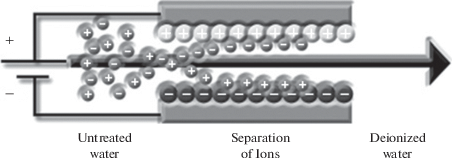
Во многих регионах мира люди ощущают нехватку чистой воды для питья, бытовых нужд, и для применения в сельском хозяйстве (для полива) и в промышленности. Согласно прогнозу Всемирного Банка к 2025 г. 2.5 миллиардов людей в разных странах будут страдать от острой нехватки чистой питьевой воды [1]. До последнего времени применялись следующие основные методы опреснения морской и солоноватой воды: одноступенчатая и многоступенчатая дистилляция, электродеионизация, ионный обмен, химическое опреснение, замораживание, обратный осмос, электродиализ [2]. В последние годы в развитых странах стал интенсивно разрабатываться метод емкостной деионизации воды. ЕДВ является эффективным методом обессоливания солоноватой и морской воды [3–12]. В установке ЕДВ поток опресняемой воды прокачивается между двумя пористыми углеродными электродами с высокой площадью удельной поверхности (УП) 300–2500 м2/г, например, активированными угольными электродами (АУЭ), между которыми задается разность потенциалов >1.2 В (рис. 1).
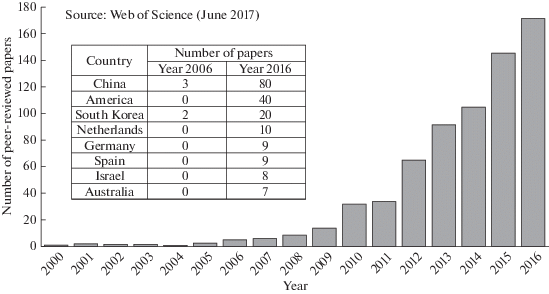
Ионы и другие заряженные частицы электростатически адсорбируются и удерживается на внутренней поверхности электрода противоположного знака. Отрицательный электрод адсорбирует катионы, а положительный электрод адсорбирует анионы. Таким образом, происходит заряжение двойного электрического слоя (ДЭС), аналогично тому, как это имеет место в двойнослойных конденсаторах (ДСК) [13–25]. В конце концов поверхность электродов становится насыщенной ионами и должна быть регенерирована. Это осуществляется размыканием электрической цепи или переполюсовкой. При этом происходит десорбция ионов из электродов и из системы и образуется более концентрированный поток раствора. Емкостная опреснительная установка (ЕОУ), состоящая, как минимум, из двух электрохимических ячеек, в целом работает непрерывно, при том, что каждая из ячеек часть времени работает как деионизционная, а другая в этот же период времени – как концентрационная. В итоге получаются два продукта: деионизованная вода и концентрат, который в принципе может быть использован в народном хозяйстве. ЕОУ только начинают применяться в высокоразвитых странах для опреснения морской воды и для получения чистой воды для бытовых нужд. На практике в деионизационную ячейку подается около 80% опресняемого раствора, а остальная часть подается в регенерационную ячейку, т.е. в ячейку для концентрирования раствора. Из рис. 2 следует, что количество опубликованных статей по ЕДВ растет практически по экспоненте.
Рис. 2.
Число рецензируемых статей, опубликованных в области ЕДВ с 2000 г., и сопоставление количества публикаций по ЕДВ в нескольких странах в 2006 и 2016 гг.
Хотя концепция опреснения воды с использованием пористых электродов и с циклическим процессом заряжения и разряжения датируется 1960-ми гг., термин “емкостная деионизация” имеет гораздо более недавнее происхождение в первой публикации Фармера и др. в материалах конференции 1995 г. [3]. Общность между процессами в ЕДВ и ДСК подтверждается и тем фактом, что одни и те же угольные электроды могут использоваться в обеих этих системах [25].
1. ПРЕИМУЩЕСТВА И НЕДОСТАТКИ МЕТОДА ЕДВ
Основным преимуществом ЕДВ является самый низкий расход энергии, составляющий примерно одну треть от главного конкурирующего метода – обратного осмоса, который в настоящее время в основном применяется в промышленности [26–37]. В табл. 1 приведены величины удельного расхода энергии для основных методов опреснения воды.
Таблица 1.
Величины удельного расхода энергии для основных методов опреснения воды [23]
| Метод опреснения воды | Удельный расход энергии, кВт ч/м3 воды |
|---|---|
| Многоступенчатая дистилляция | 10–58 |
| Обратный осмос | 2–6 |
| Электродиализ | 0.4–8.7 |
| Емкостная деионизация воды | 0.1–2.03 |
В [32] установлено, что измеренная для ЕДВ энергия удаления соли приближается к термодинамическому минимуму для опреснения таких концентрированных растворов, как морская вода. У метода емкостной деионизации воды есть следующие существенные преимущества перед другими методами очистки воды: 1) низкие эксплуатационные расходы, которые составляют приблизительно одну треть от соответствующих эксплуатационных расходов для обратного осмоса; 2) длительная циклируемость материалов электродов; 3) химически стабильные компоненты исключают введение инородных материалов в обрабатываемый поток; 4) ЕДВ может работать при разных уровнях удаления ионов и получения чистой воды; 5) минимальная забивка пор осадком; 6) очень высокая потенциальная наукоемкость ЕДВ, на основе которой можно прогнозировать существенный рост эффективности этого метода в ближайшие годы. У ЕДВ имеется следующий основной недостаток: необходимость создания новых конструкций для установок ЕДВ высокой производительности. Однако, этот недостаток является временным на первой стадии создания крупномасштабных установок.
Как было отмечено во введении, в стадии концентрирования, т.е. регенерации, энергия возвращается в установку для ЕДВ и поэтому происходит частичная компенсация затрат на деионизацию. Поэтому результирующая энергия деионизации WЕДВ равна разности
где Wдеион – энергия, затраченная на стадии деионизации, а Wконц – энергия, высвободившаяся при концентрировании. Именно энергия WЕДВ должна учитываться при работе установки, так как имеет место выигрыш за счет энергии на стадии концентрирования. Этот фактор объясняет минимальные затраты энергии в ЕДВ по сравнению с другими опреснительными методами. В стадии деионизации имеет место заряжение двойнослойного конденсатора, являющегося основой метода, а в стадии концентрирования происходит разряжение ДСК.Зарядно-разрядные процессы в электрохимической ячейке для ЕДВ могут осуществляться в одном из двух режимов: в потенциостатическом режиме при постоянном напряжении (U) или в гальваностатическом режиме при постоянном токе (I). Для потенциостатического режима энергия деионизации и концентрирования рассчитывается по формуле:
а для гальваностатического режима энергия рассчитывается по формуле: где t – время.Огромное значение метода ЕДВ в качестве определяющего класса технологий опреснения было показано в принципиальной статье большого количества признанных авторитетов в области опреснения воды [38]. В [27] были сопоставлены два режима работы установки ЕДВ в сравнимых условиях: при постоянном напряжении (CV) и при постоянном токе (CC). Более высокое общее напряжение элемента в режиме CV приводит к более быстрой адсорбции соли при заданном времени деионизации по сравнению с режимом CC. Однако, с другой стороны, режим CC потреблял примерно на 26–30% меньше энергии, чем потребляется в режиме CV по обоим критериям, но эффективности заряжения в режимах CC и CV были близки между собой. Полученные результаты показывают, что на практике оптимальные адсорбционная емкость по соли и энергопотребление в ЕДВ могут быть достигнуты путем сочетания обоих режимов.
2. РАЗЛИЧНЫЕ МОДИФИКАЦИИ ЕДВ
2.1. Мембранная емкостная деионизация воды
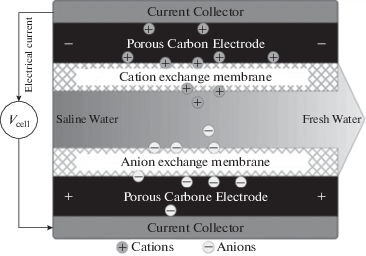
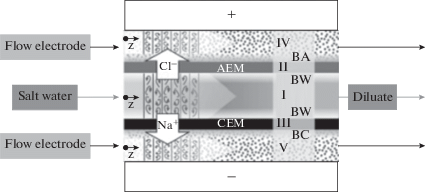
Метод мембранной емкостной деионизации можно рассматривать как одну из модификаций ЕДВ [3, 27–76 ]. В этом случае анионообменная мембрана контактирует с положительно заряженным электродом, а катионообменная мембрана контактирует с отрицательно заряженным электродом. Между обеими мембранами находится пористый сепаратор (или спейсер), в порах которого содержится прокачиваемый водный раствор. Анионообменная мембрана предотвращает транспортирование катионов к аноду, в то время как катионообменная мембрана делает практически невозможным перенос анионов к катоду. Это обеспечивает более полное разделение катионов и анионов в ячейке MЕДВ (рис. 3). В некоторых работах по МЕДВ используется только одна ионообменная мембрана – катионообменная или анионообменная [52, 55, 66].
Однако, в случае использования в классических безмембранных установках ЕДВ угольных электродов с высокой площадью удельной поверхности, имеет место достаточно хорошее разделение противоположно заряженных ионов вследствие заряжения ДЭС внутри пор электродов. С другой стороны, ионообменные мембраны (ИОМ) в установках MЕДВ повышают гидродинамическое сопротивление, что приводит к увеличению расхода энергии. Это является недостатком метода MЕДВ по сравнению с ЕДВ, хотя в каждом конкретном случае нужно учитывать положительное и отрицательное влияние обоих выше перечисленных факторов.
ЕДВ имеет серьезную проблему на этапе регенерации. Это происходит, когда электрод насыщается противоположно заряженными ионами, в этот момент этап очистки останавливается и начинается регенерация путем переполюсовки, т.е. задания противоположных знаков электродов, чтобы начать процесс десорбции ионов из электрода в объемную жидкость. Как только электрический потенциал на электроде изменит свою полярность, он будет десорбировать адсорбированные ионы, но в то же время притягивать и адсорбировать противоположно заряженные ионы из объемной жидкости. Фактически десорбция и адсорбция ионов происходят одновременно на этом этапе. Это вызывает неполную регенерацию электродов, приводящую к истощению их адсорбционной способности, и более длительному времени регенерации и вызывает накопление остаточных ионов, блокирующих путь других ионов во время следующего этапа очистки. Для преодоления этих проблем и был разработан метод МЕДВ [56]. Как отмечалось выше, наименьшие энергозатраты ЕДВ по сравнению с другими опреснительными методами в первую очередь обусловлены тем, что на стадии разряда (регенерации) энергия возвращается в установку и тем самым частично компенсирует знергозатраты на стадии заряда (деионизации). Этот же энергетический механизм относится и к МЕДВ (см. рис. 4) [75]. На этом рисунке дано изображение изменения во времени напряжения на стадии заряда и на стадии разряда для гальваностатического режима работы МЕДВ. Согласно ур. (1) результирующая энергия пропорциональна разности площадей под кривыми разряда и заряда.
Рис. 4.
Схематическое изображение изменения во времени напряжения на стадии заряда и на стадии разряда.
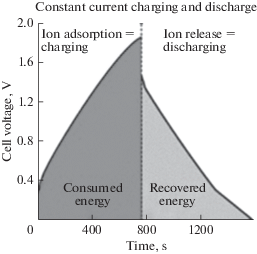
В [32] было исследовано поведение МЕДВ с электродами в виде композита из углеродных нанотрубок (УНТ) и углеродных нановолокон (УНВ). Было проведено сравнение опреснения в МЕДВ с безмембранной емкостной деионизацией. Было показано, что удаление соли в системе МЕДВ было на 49.2% выше, чем у системы ЕДВ. В [76] был сконструирован новый дизайн установки МЕДВ путем упаковки угольного электрода в виде проточной камеры с гранулированным активированным углем (ГАУ). Установка МЕДВ типа ГАУ-MЕДВ обеспечила увеличение скорости опреснения воды в 1.2–2.5 раза по сравнению с обычной установкой МЕДВ при всех тестируемых концентрациях NaCl (~100–1000 мг/л). Наибольшее улучшение производительности в упакованном ГАУ наблюдалось при обработке соленой воды с начальной концентрацией NaCl 100 мг/л. Анализ с помощью электрохимической импедансной спектроскопии (ЭИС) показал, что установка ГАУ-MЕДВ имела значительно меньшее внутреннее сопротивление, чем обычная МЕДВ.
В [66] сравнивалось протекание фарадеевских реакций, происходящих в процессах в ЕДВ и MЕДВ периодического режима, путем исследования изменения концентраций H2О2 и растворенного кислорода, pH, проводимости и тока во время заряда и разряда при различных зарядных напряжениях. Исследования процессов в MЕДВ относились, как для ячеек с двумя разнополярными мембранами, так и с одной катионообменной и с одной анионообменной мембраной. Во время заряда концентрация H2О2 в ЕДВ быстро увеличивалась, а затем уменьшалась, в то время как H2О2 почти не генерировался в MЕДВ из-за неспособности кислорода проникать через ионообменную мембрану. Были разработаны химико-кинетические модели для количественного описания изменения концентрации H2О2, и было обнаружено, что они представляют удовлетворительное описание экспериментальных данных. Результаты этого исследования способствуют лучшему пониманию роли фарадеевских реакций в ЕДВ и MЕДВ и должны быть полезны при оптимизации технологий на основе ЕДВ для конкретных практических применений.
В [51] электроды для МЕДВ получали путем нанесения ионообменников на поверхность углеродного электрода. Бромметилированный поли (2,6-диметил-1,4-фениленоксид) (BPPO) распыляли на углеродную ткань с последующим сульфированием и аминированием с образованием катионообменного и анионообменного слоев соответственно. Изображение СЭМ показало, что углеродная ткань хорошо покрыта и связана с BPPO. Было показано, что сульфоновые и аминные функциональные группы были нанесены на поверхность электродов с катионообменным и анионообменным слоями соответственно. Преимущества разработанных углеродных электродов были последовательно продемонстрированы в периодических и непрерывных режимах для удаления соли с использованием раствора 100 мг/л NaCl.
Для повышения производительности ЕДВ важно идентифицировать электронные и ионные сопротивления в ячейке ЕДВ. В [62] было установлено, что для исходной концентрации солей 20 мМ сопротивление, в основном, расположено в спейсерном канале и внешней электрической цепи, а не в электродах. На основании этих данных было показано, что толщина углеродного электрода может быть увеличена без значительного увеличения потребления энергии на моль соли. Однако, авторы считают, что для более полного сопоставления энергозатрат для МЕДВ и ЕДВ нужно было бы учитывать не только электрические, но и гидродинамические сопротивления. При этом преимущество, вероятно, было бы на стороне ЕДВ по сравнению с МЕДВ вследствие гидродинамического сопротивления ионообменных мембран.
Большинство исследований мембранных емкостных деионизаций были сфокусированы на электродных и ионоомембранных материалах, при этом мало внимания уделяется отсеку сепаратора. Исследование [63] показало, что скорость обессоливания МЕДВ может быть увеличена путем введения активирующих углеродных волокон (АУВ) в отделение сепаратора ячейки. Эти результаты подчеркивают необходимость пересмотра и модификации существующих конструкций сепараторного отсека МЕДВ.
В [57] было проведено сравнение величин энергозатрат для лабораторной установки МЕДВ и для установок обратного осмоса. В результате было показано, что для концентрации NaCl менее 2.5 г/л энергозатраты для МЕДВ существенно меньше, чем для обратного осмоса. Однако, при высоких концентрациях, наоборот, энергозатраты для МЕДВ больше, чем для обратного осмоса. В [60] предложен новый способ извлечения аммония из сточных вод ионообменной смолой, заключающийся в сочетании этого извлечения с предварительной обработкой мембранной емкостной деионизацией (МЕДВ + ионный обмен). Эти сточные воды содержали ионы (K+, ${\text{C}}{{{\text{a}}}^{{2 + }}}$ и ${\text{M}}{{{\text{g}}}^{{2 + }}}$). В итоге применения комбинации этих двух методов было удалено из сточных вод более 65% аммония. Таким образом, опреснение МЕДВ устраняет отрицательные эффекты влияния двухвалентных катионов, таких как ${\text{C}}{{{\text{a}}}^{{2 + }}}$ и ${\text{M}}{{{\text{g}}}^{{2 + }}},$ на процесс абсорбции–десорбции ионообменной смолой.
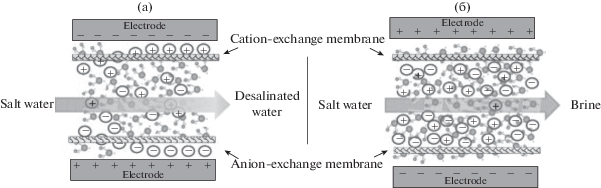
Рисунок 5 иллюстрирует стадии деионизации и регенерации в МЕДВ [23]. В [31] были исследованы механизмы ионной адсорбции и десорбции на поверхностях углеродных электродов в экспериментах с деионизацией с двумя типами емкостной деионизации: ЕДВ и мембранной емкостной деионизацией (МЕДВ), имеющей только катионообменную мембрану на поверхности катода, но без анионообменной мембраны на поверхности анода. Эксперименты по обессоливанию проводились при различных условиях эксплуатации. Эффективность удаления соли в ячейке МЕДВ была увеличена на 32.8–55.9% по сравнению с ячейкой ЕДВ в зависимости от условий эксплуатации.
В [61] исследовали коэффициент восстановления энергии (извлеченная энергия/потребляемая энергия) в различных условиях эксплуатации МЕДВ. Было показано, что адсорбционная способность соли играет важную роль в процессе регенерации энергии и что заряжение постоянным током более благоприятно для рекуперации энергии, чем заряжение при постоянном напряжении. Ожидается, что это исследование предоставит всестороннее руководство по созданию и эксплуатации реальной системы рекуперации энергии для повышения энергоэффективности в процессе МЕДВ. В [68] для увеличения количества извлекаемой воды специально рассматривалась возможность регенерации электродов потоком соли с более высокой концентрацией, чем в исходном растворе. Если на стадии десорбции можно использовать более концентрированный поток, то определенное количество воды для регенерации может быть рециркулировано несколько раз, что затем приводит к большему извлечению воды. Для более точных расчетов авторы осуществили измерения коэффициентов диффузии противоионов и коионов в ионообменных мембранах. Эти эксперименты позволили создать асимметричную модель блока МЕДВ, в которой падение напряжения на катионообменной мембране было больше, чем на анионообменной мембране. Использовав эту модель, было обнаружено, что при периодической работе оптимальное отношение концентрации рассола к концентрации питательной воды близко к двум. Показано, что при непрерывном циклировании может быть достигнуто повышение регенерации воды на 40%, когда регенерационный рассол частично рециркулируется, но производительность воды падает.
В [42] Были изготовлены нитрат-селективные композитные углеродные электроды (NSCCE) для использования в емкостной деионизации для избирательного удаления нитратных ионов из раствора, содержащего смесь анионов. NSCCE был изготовлен путем покрытия поверхности углеродного электрода с помощью анионообменной смолы BHP55. Известно, что BHP55 является селективным ионообменником для ионов нитратов. Адсорбция нитратных ионов составила 19 ммоль/м2, что в 2.3 раза больше, чем адсорбция в системе MЕДВ.
Исследования по математическому моделированию имеют важное значение для разработки и оптимизации процессов в МЕДВ [41, 51, 63, 64, 74]. В этих работах учитывалась пористая структура и электрохимические характеристики углеродных электродов и ионообменных мембран. В [41] была развита математическая модель МЕДВ, в которой учитывался ДЭС у плоской границы спейсера с ионообменной мембраной, контактирующей с другой стороны с угольным электродом. При этом использовалась теория Гуи–Чапмена–Штерна.
2.2. ЕДВ с редокс-реакциями на пористых электродах
Емкостная деионизация, которая зависит от электростатической адсорбции ионов и других заряженных частиц, и определяется емкостью ДЭС пористых электродов под воздействием электрического потенциала, может быть усилена химическим присоединением фиксированных заряженных групп к пористым электродам за счет псевдоемкости Фарадеевских реакций поверхностных групп (ФаЕДВ) [77–83]. Недавно было продемонстрировано, что дальнейшее повышение степени деионизации и снижение энергозатрат может быть достигнуто путем функционализации поверхности электродов окислительно-восстановительными полимерами, в которых заряд на электродах может модулироваться посредством Фарадеевских реакций. В [77] развиты математические модели, разработанные для характеристики систем ЕДВ и ФаЕДВ для установления вклада редокс-реакций в процесс емкостной деионизации воды. Разработанная модель учитывает влияние потенциала нулевого заряда и функции распределения пор по размерам. Данная модель способна прогнозировать наблюдаемые экспериментально эффекты увеличения степени деионизации и производительности аппаратов ЕДВ. Показано, что эффективность деионизации в ячейках ФаЕДВ на 50–100% выше, чем для обычной ЕДВ, причем при меньших напряжениях, в зависимости от окислительно-восстановительных потенциалов фарадеевских реакций.
2.2.1. Катионная интеркаляционная деионизация воды. Интересным вариантом ЕДВ является обратимая катионная интеркаляционная деионизация воды (КИЕДВ) [84–86]. Этот вариант является частным случаем ЕДВ с редокс-реакциями на пористых электродах. В установке КИЕДВ используются пористые электроды, в которых происходит обратимая окислительно-восстановительная интеркаляция катионов. Суммарная емкость электродов складывается из псевдоемкости этой окислительно-восстановительной реакции и емкости ДЭС. Псевдоемкость намного больше емкости ДЭС, поскольку при этом в процессе участвует весь объем электрода, а не только его внутренняя поверхность, как для емкости ДЭС. Поэтому полная емкость таких интеркаляционных электродов намного больше, чем емкость ДЭС. В результате метод КИЕДВ обеспечивает опреснение богатых солями водных ресурсов с высокой регенерацией воды и низким потреблением энергии. Для деионизации водных растворов NaCl в [85 и 86] использовали интеркаляционное соединение NaNiFe(CN)6, которое участвует в следующей обратимой окислительно-восстановительной реакции:
На рис. 6 показана описанная в [86] принципиальная схема ячейки ЕДВ с двумя интеркалирующими электродами с разной степенью интеркаляции и анионообменной мембраной (АОМ), расположенной между ними.
Рис. 6.
Принципиальная схема ЕДВ ячейки с одной анионообменной мембраной (AОM) и двумя смежными и одинаковыми электродами, содержащими NaNiFe(CN)6 [86].
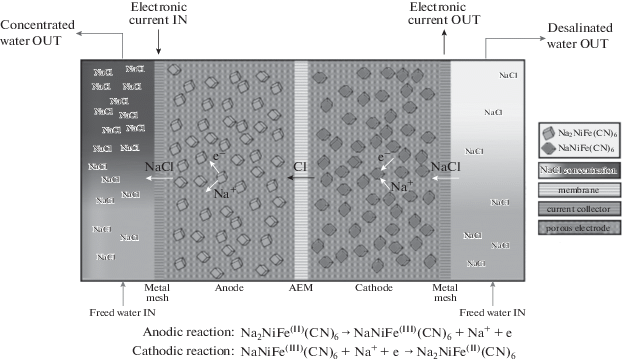
Каналы потока и токосъемники расположены с обеих сторон ячейки. Когда ток проходит слева направо, катионы (в данном случае Na+) деинтеркалируют из Na2NiFe(CN)6, в то время как ионы Cl мигрируют через мембрану (слева) и общий эффект заключается в получении воды повышенной солености с левой стороны. В то же время с правой стороны ионы Na+ внедряются в NaNiFe(CN)6 и образуется обессоленная вода. Через некоторое время максимальное количество интеркалированных ионов Na+ достигается в правом электроде, и направление тока должно быть обратным [86]. При этом имеет место максимизация эффективности заряда и существенное снижение капитальных затрат.
2.3. ЕДВ с проточными электродами
Другой разновидностью метода ЕДВ является ЕДВ с проточными электродами (ПЕДВ) [72, 87–97]. Схематически такая ячейка показана на рис. 7. В качестве проточного электрода обычно используется суспензия из частиц высокодисперсного углеродного материала (часто это активированный уголь (АУ) в водном электролите). Установка ПЕДВ обеспечивает непрерывную деионизацию и высокую эффективность обессоливания. Еще одним преимуществом ПЕДВ является способность деионизировать воду с высокой соленостью, в том числе морской воды. Для достижения эффективной системы ПЕДВ с низким энергопотреблением требуется проточный электрод с высокой емкостью и низким электрическим сопротивлением. Для разработки высоко эффективного проточного электрода следует проводить исследования с учетом пористых углеродных материалов, проводящих добавок и электролитов, составляющих проточный электрод. Были оценены опреснительные характеристики проточных электродов со сферическими частицами АУ и водными электролитами, содержащими NaCl с различными концентрациями. Была подтверждена необходимость умеренного количества соли в электродном потоке для компенсации высокого сопротивления воды. В установке ПЕДВ поток исходного раствора разделяется на две части, причем большая часть направляется в электрохимическую ячейку для деионизации, а меньшая часть в ячейку для концентрирования.
В альтернативных конструкциях ПЕДВ используются химически модифицированные проточные электроды, а также электроды с введенными в них наночастицами и могут быть применены ионоселективные покрытия [90]. В [91] был разработан новый тип суспензионных проточных электродов с целью обессоливания солоноватой и морской воды с использованием смеси частиц АУ и ацетиленовой сажи, где сажа применялась для увеличения электронной проводимости. Была получена удельная емкость 92 Ф/г в статическом режиме в 0.6 М растворе NaCl. Новая система, представленная в этой работе, по мнению авторов, является доказательством того, что такие емкостные электроды можно использовать для обессоливания воды без применения ионообменных мембран.
В [93] была разработана установка ПЕДВ с проточными электродами на основе АУ, взвешенного в воде. При непрерывной работе системы опреснения 1 г/л раствора NaCl при 80%-ной рекуперации воды эффективность тока составляла 0.93. Данная система может позволить снизить затраты на энергию и инвестиции и снизить пороговое значение для широкомасштабного внедрения. В [95] были исследованны электрохимические свойства емкостных проточных электродов при изменениях содержания углерода и концентрации солевого электролита путем использования циклической вольтамперометрии (ЦВА), электрохимической импедансной спектроскопии. Кривые ЦВА были прямоугольными, симметричными и обратимыми для скорости развертки напряжения 2 мВ/с, что указывает на двойнослойное поведение. Результаты ЭИС и циклических испытаний показали, что увеличение содержания углерода и концентрации солевого электролита в суспензии электродов улучшили эффективность ячейки из-за более высокой емкости и более низкого общего сопротивления.
В [94] была предложена система ЕДВ с нейтрализацией раствора (ПНЕДВ) и с проточными электродами путем объединения с нейтрализационным диализом (НД) и ЕДВ с проточными электродами (ПЕДВ). Ее ключевым свойством является то, что с использованием проточных электродов емкостная адсорбция ионов соли происходит одновременно с нейтрализационным диализом. Чтобы сравнить эффективность опреснения между ПНЕДВ и ПЕДВ, была проведена серия экспериментов путем изменения концентрации соли и приложенного электрического напряжения. Данный гибрид демонстрирует перспективную среднюю скорость адсорбции соли и эффективность удаления соли, они составляют соответственно 203.27 ммоль/м2 мин и 72.20% в 0.1 мМ растворе NaCl при напряжении 1.2 В через 120 мин, тогда как соответствующие значения ПЕДВ составляют 120.86 ммоль/м2 мин и 42.92% соответственно. Чтобы облегчить понимание переноса ионов в этой сложной системе, была также разработана теория на основе упрощенного уравнения Нернста–Планка и равновесия Доннана. Эта теория помогает понять экспериментальные данные.
В [89] была разработана простая одномерная модель, описывающая опреснение воды в ПЕДВ на основе модифицированной теории двойного электрического слоя Доннана в микропористых материалах. Было также проведено сравнение данных, рассчитанных по модели, с экспериментальными данными для NaCl с концентрациями 5 и 20 мМ/л. При этом был учтен объем микропор в проточных электродах из АУ. В результате было получено удовлетворительное сходство между этими данными.
2.4. МЕДВ с проточными электродами
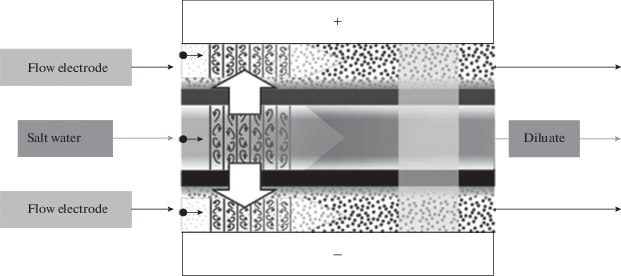
Следующим шагом в усовершенствовании ЕДВ явилось создание сложной установки, содержащей проточные электроды а также анионообменную и катионообменную мембрану, т.е. сочетающую ПЕДВ и МЭДВ (см. рис. 8). Такая установка сочетает в себе преимущества как ПЕДВ, так и МЭДВ, т.е. высокую удельную производительность получения чистой воды и высокую степень ее деионизации [72, 90, 92, 98]. В [72] было осуществлено математическое моделировании процессов в такой установке.
3. ВЛИЯНИЕ ПОРИСТОЙ СТРУКТУРЫ ЭЛЕКТРОДОВ
3.1. Общие положения. Влияние удельной поверхности
Так как максимальная адсорбционная емкость электродов в идеальном случае (т.е. без учета хемосорбции) пропорциональна емкости ДЭС (СДЭС), то максимальное уменьшение концентрации раствора Δсmax в установке для ЕДВ определяется выражением [99]:
где U – напряжение на клеммах ячейки, F – число Фарадея, υ – объем раствора. C другой стороны, как известно, емкость ДЭС в первом приближении пропорциональна площади удельной поверхности электрода (S) [13, 15]. Согласно [100] величину S можно рассчитать из функции распределения пор по радиусам по формуле:(5)
$S = \int\limits_{{{R}_{{\min }}}}^{{{R}_{{\max }}}} {\frac{1}{r}} \left( {\frac{{dV}}{{dr}}} \right)r,$Экспериментальные исследования подтверждают тот факт, что при большой удельной поверхности электродов имеет место большая электросорбция. Например, в [114] установлено, что АУ электрод с высокой удельной поверхностью (до 2680 м2/г) с подходящим распределением пор (0.8–4 нм) показал высокие характеристики обессоливания с электросорбционной способностью 16.1 мг/г в 500 мг/л растворе NaCl. Этот результат обусловлен высокой площадью удельной поверхности и большим объемом пор. В [29, 30, 115–123] было также показано, что углеродные электроды, обладающие достаточно высокой удельной поверхностью и, соответственно, высокой удельной емкостью показали высокую электросорбцию. В [116] было установлено, что иерархические гибриды с микропористыми углеродными сферами, декорированными трехмерными графеновыми каркасами, обладающие удельной емкостью 288.8 Ф/г, показали высокую электросорбционную способность 19.8 мг/ г для NaCl.
Для исследования пористой структуры электродов ЕДВ применялись следующие методы: метод ртутной порометрии – в диапазоне радиусов пор от ~2 нм до 105 нм [101, 102], метод капиллярной конденсации – в узком диапазоне радиусов пор от ~1 до 50 нм [103], метод БЭТ используется для определения удельной поверхности [103], методы микроскопии (электронная [104], туннельная [105] и атомно-силовая [106, 107]). Недавно разработанный метод эталонной контактной порометрии (МЭКП) применим для наиболее широкого диапазона радиусов пор от ~<1 нм до 105 нм а также для исследования гидрофильно-гидрофобных свойств [108, 109], что важно для ЕДВ, поскольку углеродные материалы обладают гидрофильной и гидрофобной пористостью, а электрохимические процессы протекают только на гидрофильной поверхности [100, 110, 112, 113]. МЭКП был признан IUPAC [101].
3.2. Влияние на электросорбцию заряда и размера гидратированных ионов во взаимосвязи с размером пор
В [34, 114] было исследовано влияние на электросорбцию заряда и размера гидратированных ионов во взаимосвязи с размерами пор углеродных электродов. Было установлено, что электросорбция повышается с переходом от 3-х зарядных анионов к 2-х зарядным и к однозарядным. При одинаковой зарядности электросорбция повышается с уменьшением размера гидратированных ионов, поскольку большие гидратированные ионы не могут адсорбироваться в микропорах малого размера. В [124] был установлен следующий ряд анионов по мере увеличения их электросорбции в АУ электроде:
Согласно методу БЭТ, примеренному для исследования пористой структуры АУ, полная удельная поверхность была равна 1117 м2/г, удельная поверхность микропор 592 м2/г, а средний размер микро- и мезопор равен 2.2 нм. Хотя этот размер пор больше размера гидратированных ионов, однако следует учитывать извилистость пор, затрудняющую адсорбцию. В [125] была исследована электросорбция на графене солей NaCl, CaCl2, MgCl2 и FeCl3. Было показано (см. табл. 2), что, как правило, для процесса электросорбции катионы с более высокой валентностью с меньшим гидратированным радиусом, могут более эффективно электросорбироватся из-за большей электростатической силы.
Таблица 2.
Радиусы гидратированных ионов для катионов Na+, Ca2+, Mg2+, Fe3+
| Ион | Гидратированный радиус иона, нм |
|---|---|
| Na+ | 0.358 |
| Ca2+ | 0.412 |
| Mg2+ | 0.428 |
| Fe3+ | 0.457 |
В табл. 2 приведены значения и гидратированный радиус каждого целевого иона.
Электросорбция ряда катионов была установлена в следующем порядке: Fe3+ > Ca2+ > Mg2+ > Na+. Трехзарядный ион железа лучше адсорбируется на отрицательно заряженной поверхности, чем двухзарядные и однозарядные ионы. Вследствие большой электростатической силы ионы железа сильнее притягиваются и, видимо, происходит уменьшение радиуса этого иона. Для катионов с одинаковым зарядом ионы с меньшим гидратированным радиусом лучше адсорбируются.
Путем анализа спектров электрохимического импеданса (СЭИ) было разработано ценное направление для выбора подходящего типа AУ в качестве материала электрода для применения ЕДВ. При низкой концентрации NaCl ионы сильно гидратируются, а проводимость раствора низкая. Анализ СЭИ показывает, что диффузионная доступность гидратированных ионов в микропорах АУ затруднена. В этом случае целесообразно выбрать AУ с высоким содержанием мезопор. При более высокой концентрации NaCl степень гидратации ионов меньше и размер ионов относительно невелик. В этом случае пористые электроды с высокой общей площадью поверхности становятся более благоприятными.
3.3. Влияние мезопористости и макропористости углеродных электродов
Согласно классификации М.М. Дубинина микропоры имеют радиусы, меньшие 2 нм, мезопоры имеют радиусы в интервале от 2 до 50 нм, а радиусы макропор более 50 нм [103]. В [126] было показано, что при использовании толстых угольных электродов целесообразно подбирать электроды с достаточной макропористостью, потому что макропоры обеспечивают повышенную гидродинамическую проницаемость пористых электродов для потока жидкости. В ряде работ в качестве основы электродов применяли мезопористые угли. В [126–131] для ЕДВ для электроосорбционного удаления хлорида натрия были синтезированы мезопористые угли с заданной регулярной структурой путем применения модифицированной золь–гель методики с использованием гидратированного сульфата никеля и краун эфира с последующем растворением сульфата никеля. Методом БЭТ была получена высокая площадь удельной поверхности 1491 м2/г с регулярными мезопорами с размерами 3.7 нм. Эти электроды показали высокую электросорбционную способность. В [132–134] были получены углеродные материалы с иерархической пористой структурой, имеющей несколько четких максимумов на дифференциальной кривой распределения пор по размерам. Эти материалы чаще всего получают на основе активированных углеродных тканей или губок, состоящих из пучков углеродных нанотрубок. В принципе поры в каждом максимуме несут свою функцию. Микропоры обеспечивают получение максимальной площади удельной поверхности, а значит и высокую электросорбцию за большие ее времена, мезопоры обеспечивают электросорбцию за меньшее время (т.е. более быстрый процесс электросорбции), а макропоры обеспечивают хорошую гидродинамическую проницаемость. Кроме того, углеродные электроды с иерархической структурой обладают повышенной электропроводностью.
4. ВЛИЯНИЕ СМАЧИВАЕМОСТИ ВОДОЙ УГЛЕРОДНЫХ ЭЛЕКТРОДОВ
Одной из существенных особенностей пористых углеродных материалов является наличие в них как гидрофильных, так и гидрофобных пор, что отличает их от других материалов [100, 110, 111]. Поскольку электрохимические процессы происходят только на гидрофильной поверхности и в гидрофильных порах, пропитанных деионизуемой водой, то очень важным является возможность измерять эти характеристики, в том числе краевой угол смачивания водой углеродных электродов, причем внутри пор.
Классическим методом определения угла смачивания является оптический метод капли, нанесенной на поверхность исследуемого материала [135]. Однако, он позволяет правильно определить угол смачивания только на гладкой поверхности, но часто этим методом пользуются и для определения угла смачивания на наружной поверхности пористых материалов, в том числе углеродных электродов для ЕДВ [136–139], что не является корректным. Ошборн разработал метод для определения некоего эффективного внутреннего краевого угла смачивания пористого образца, основанный на скорости поднятия воды в подвешенном образце из пористого материала [140]. Однако он не применим для гидрофильно-гидрофобных образцов, в том числе для пористых углеродных электродов. Тем не менее, в некоторых работах он все же применялся для этой цели [141]. Однако этот метод в принципе не дает возможность измерять зависимость краевого угла смачивания от радиуса пор. Единственный метод, который дает такую возможность, это МЭКП, который позволяет также определять отдельно объем гидрофильных и гидрофобных пор, а также площадь гидрофильной удельной поверхности наряду с площадью полной поверхности [100, 110] (см. раздел 3.1).
В работах [99, 142–144] МЭКП были исследованы гидрофильно-гидрофобные свойства пористых углеродных электродов на основе АУ, применяемых для ЕДВ.
Во многих работах предпринимаются различные меры, чтобы гидрофилизировать пористые углеродные электроды, применяемые для ЕДВ [139–146]. В [139] композитный АУ электрод с добавками электропроводящей сажи и ПТФЭ изготавливали с применением поэтапного испарения предварительно введенного этанола и ПАВа в суспензии ПТФЭ. Полученный электрод отличался высокой гидрофильностью и большой электросорбцией. В [145] была исследована в качестве недорогого прекурсора АУ электрода летучая зола сахарного тростника, которая являлась основой электрода для ЕДВ для применения в солоноватой воде. Этот прекурсор подвергался пиролизу при 200°С, что приводило к увеличению концентрации поверхностных кислородосодержащих групп, что резко улучшило смачиваемость электродов, и как следствие приводило к увеличению удельной емкости (от 33 до 55 Ф/г), а также максимальной адсорбционной способности соли NaCl от 2.9 до 5.3 мг/г. В [146] были получены АУ, синтезированные с использованием полианилина (ПАни), т.е. N-содержащего прекурсора, допированного различными анионами. Такие АУ были успешно использованы в качестве электродных материалов для ЕДВ. Целью этой работы было исследование влияния хлоридов (Cl–), п-толуолсульфоната (PTS–), додецилбензосульфоната (DBS–) и полистиренсульфоната (PSS–) в качестве Пани-легирующих примесей на текстурные и электрохимические свойства активированных ПАни углей (ПАУ) и оценка их эффективности для опреснения. Было замечено, что чем выше содержание кислорода, тем выше гидрофильность электрода из-за введения поверхностных полярных групп, как было определено методом XPS. Наибольшая удельная адсорбционная способность (14.9 мг г–1) наряду с наименьшим удельным энергопотреблением была получена с использованием ПАУ, полученного с использованием легированного прекурсора толуолсульфоната. Учитывая низкую стоимость и простоту синтеза такие электроды представляются перспективными для ЕДВ. Поскольку кислородосодежащие функциональные группы обладают гидрофильными свойствами, то нанесение их тем или иным методом на углеродные материалы приводит к их гидрофилизации [24, 147]. В [148] наноструктурированная углеродная ткань подвергалась травлению КОН и HNO3 в течение разных времен и методом XPS проводился анализ функциональных групп. Было установлено, что для обоих случаев зависимости концентраций гидроксильных и карбонильных функциональных групп от времени обработки имеют вид кривых с максимумами, и также через максимумы проходят зависимости электроадсорбции от времен обработки КОН и HNO3. В обоих случаях причиной таких зависимостей является гидрофилизация углеродного материала.
5. НАНЕСЕНИЕ ОКСИДОВ МЕТАЛЛОВ НА УГЛЕРОДНЫЕ ЭЛЕКТРОДЫ
Одним из способов гидрофилизации пористых углеродных электродов для ЕДВ является нанесение на их поверхность оксидов металлов: MnO2, ZnO, TiO2, SnO2, CuO, Fe3O4, ZrO2, Co3O4, SiO2, Al2O3, WO3 и др. [53, 54, 88, 133, 149–167]. В [149] на угольный электрод, полученный методом золь–гель опрыскивания, был нанесен слой TiO2. Краевой угол смачивания водой угольного электрода, измеренный до нанесения TiO2, был равен 132° (т.е. этот электрод был фактически гидрофобным), а после этого покрытия стал 15°, следовательно был получен существенный эффект гидрофилизации. В результате этой гидрофилизации была получена величина электросорбции NaCl 17 мг/г электрода, что вдвое выше, чем было получено до нанесения TiO2. В [151] сообщается о создании электродов, для которых на АУ ткань (АУТ) были привиты наночастицы, наностержни, микрочипы и микросферы ZnO для опреснения воды ЕДВ. Наноматериалы ZnO гидротермально выращивались на AУТ и использовались в качестве электродов в проточной ячейке для опреснения солоноватой воды. В результате была достигнута улучшенная на 22% эффективность удаления соли для АУТ электродов, привитых оксидом цинка. В [152] применяли поэтапный метод для получения композита оксида марганца (MnO2) на УНТ. Полученный композиционный материал использовался для электродов в процессе MЕДВ, и была достигнута высокая эффективность удаления солей 96.8% с адсорбционной емкостью ионов 80.4 мкмоль/г. В [153] был получен интеркалированный АУ нанокомпозит оксида азота (N-AУ/SnO2), легированный азотом с использованием гидротермальной методики, и он был применен в качестве электрода для емкостного опреснения и дезинфекции. Электросорбирующее поведение, исследованное электрохимическими методами, продемонстрировало, что по сравнению с удельной емкостью AУ электрода (207.46 Ф/г) соответствующая величина для N‑AУ/SnO2 выше (408.8 Ф/г) и показывает большую электропроводность. Исследование ЕДВ с использованием приложенного напряжения 1.2 В в водном растворе 50 мг/л NaCl, показало, что электрод N-AУ/SnO2 повысил эффективность опреснения на 61.13% и хорошую антибактериальную эффективность.
В [160] для улучшения электрохимических характеристик на электрод из восстановленного оксида графена (ВОГ) методом гидротермической обработки наносился ZrO2 с различными концентрациями, и для полученных электродов были исследованы электросорбционные характеристики в установке ЕДВ с раствором NaCl. Было установлено, что введение ZrO2 привело к существенной гидрофилизации ВОГ. Если в исходном ВОГ контактный угол смачивания был равен 45.8°, то для ВОГ/ZrO2 он стал равным 0°. В результате гидрофилизации введение ZrO2 привело к явному улучшению электросорбционной способности и показало более высокую удельную емкость по сравнению с чистым ВОГ. Полученные результаты показали, что синтезированный нанокомпозит ВОГ с 10 мас. % ZrO2 показал значительное увеличение удельной емкости до 452.06 Ф/г (это в девять раз больше, чем у исходного ВОГ), очень высокую стабильность при циклировании и превосходную эффективность удаления соли (93.03%). В [161] было исследовано электрохимическое поведение нанесенных на АУ YP-50F (Kuraray Chemical) наночастиц оксида марганца с четырьмя различными туннельными кристаллическими структурами в качестве фарадеевских электродов в ячейках ЕДВ.
Характеристики удаления ионов оценивали не только в растворе NaCl, который традиционно используется в лабораторных экспериментах, но также в растворах KCl и MgCl2. Была установлена высокая способность к удалению ионов (до 27.8, 44.4 и 43.1 мг/г в растворах NaCl, KCl и MgCl2 соответственно) и высокие скорости удаления ионов (до 0.112, 0.165 и 0.164 мг г–1 с–1 в растворах NaCl, KCl и MgCl2 соответственно). Сравнивая способность удаления ионов по отношению к размеру структурного туннеля, было обнаружено, что меньшие по размеры туннели не способствуют удалению катионов с более крупными гидратированными радиусами, и более эффективное удаление более крупных гидратированных катионов может быть достигнуто за счет использования оксидов марганца с более крупными структурными туннелями. Расширенное исследование ЕДВ и рентгеноструктурный анализ ex situ показали отличную стабильность электродов с оксидом марганца в циклах повторного ионного удаления/ионного высвобождения, а композиционный анализ электродов показал, что удаление ионов достигается как поверхностными окислительно-восстановительными реакциями, так и интеркаляцией ионов в структурные туннели. В [162] было показано, что метод ЕДВ на основе восстановленного оксида графена (ВОГ/Co3O4) обладает высокой способностью к удалению ионов 18.63 мг/г (250 мг/л, 1.6 В), что в 2.8 раза выше, чем чистая система ЕДВ на основе ВОГ (6.45 мг/г). Кроме того, композиты ВОГ/Co3O4 обладают отличной способностью к регенерации, что указывает на ее потенциальное использование в высокопроизводительных системах ЕДВ.
6. ДОПИРОВАНИЕ УГЛЕРОДНЫХ ЭЛЕКТРОДОВ РАЗЛИЧНЫМИ ДОПАНТАМИ
В отличие от описанного в разделе 5 допирования углеродных электродов оксидами металлов с целью повышения их смачиваемости водными растворами, в данном разделе описывается допирование этих электродов другими допантами, действующими по другим механизмам. В [168] для улучшения характеристик деионизации исследовали влияние допирования серебром углеродного электрода. Углеродный композитный электрод был изготовлен путем покрытия небольшим количеством Ag углеродного электрода, обладающего характеристиками как ЕДВ, так и суперконденсатора. Были получены следующие основные результаты по сравнению с недопированными электродами: способность деионизации ЕДВ (на 88% больше), скорость деионизации (на 39% больше) и эффективность заряда (76% → 92%). Значительное улучшение характеристик деионизации объясняется увеличенной удельной емкостью, объединяющей двойнослойную емкость в углеродном электроде с псевдоемкостью реакции переноса заряда на серебре (Ag + Cl−$ \rightleftarrows $ AgCl + e). Кроме того, посеребренные электроды ЕДВ (73.3 кДж/моль) превосходили МЕДВ (136.7 кДж/моль) с точки зрения меньшего потребления энергии для деионизации из-за его возможной работы с низким напряжением. В [169] серебро вводили в УНТ, получив положительный эффект.
Композиты УНТ и проводящего полимера полипиррола (PPy), легированного додецилбензолсульфонатом (DBS–) и Cl–, были получены соответственно, методом химического окисления и превращены в два типа композитного электрода (PPy-DBS/УНТ и PPy-Cl/УНТ) для ячейки ЕДВ [170]. Усовершенствованные электрохимические характеристики композитных электродов были подтверждены с помощью теста циклической вольтамперометрии и электрохимической импедансной спектроскопии. Результаты ЦВА показали, что удельная емкость электрода PPy/УНТ, легированного либо DBS–, либо Cl–, примерно в 2.3–2.5 раза больше, чем у CNT-электрода. Тест ЭИС также показал, что сопротивление заряжения как для электродов PPy-DBS/УНТ, так и для PPy-Cl/УНТ было значительно уменьшено и составило лишь около 10% от электрода УНТ. Результаты показали, что ячейки ЕДВ, содержащие либо электрод PPy-DBS/ЕДВ, либо электрод PPy-Cl/ЕДВ, либо оба из них, обладают гораздо большей способностью к электросорбции (от 40.8 до 72.36 мг/г), чем ячейки ЕДВ, собранные с двумя электродами УНТ (около 12.6 мг/г).
В [171] были фторированы АУ электроды и в результате емкость фторированного электрода AУ резко возрастала от 261 до 337 Ф/г по сравнению с необработанным электродом AУ, а адсорбционная способность повышались с 10.6 мг/г до 12.4 мг/г.
В [172] допированные фосфором углеродные нановолоконные аэрогели (P-УНВА) были получены из целлюлозы путем сублимационной сушки и термической обработки. Структура и электрохимические характеристики показывают, что P-УНВА демонстрирует пористую хорошо организованную трехмерную сетевую структуру, а P‑допинг повышает удельную поверхность, облегчает перенос заряда и, таким образом, повышает удельную емкость и электросорбционную способность УНВА. Электросорбционная способность P-УНВА может достигать 16.20 мг/г в растворе 1000 мг/г NaCl, что намного выше, чем у нелегированной УНВА (12.81 мг/г).
Для решения проблемы создания контролируемой удельной поверхности пористых углеродных электродов для ЕДВ в [173] была предложена новая методика путем прямой карбонизации Zn-содержащих металлоорганических каркасов (MOК). Результаты показывают, что, контролируя соотношение Zn/C в MOК, полученные пористые электроды обладают заданной площадью удельной поверхности и, таким образом, обладают повышенными характеристиками электросорбции.
В [174] методом простой термической обработки оксида графена в атмосфере аммиака был изготовлен графен, легированный азотом (NG). Результаты показали, что из-за высокой площади удельной поверхности NG обладает повышенной удельной емкостью и низким сопротивлением переносу заряда, а также обладает высокой электросорбционной способностью 4.81 мг/г, что существенно выше, чем для исходного графена (3.85 мг/г). Аналогичные результаты от допирования азотом полых углеродных наносфер были получены в [175–177].
Известно, что при емкостной деионизации противоионы адсорбируются на электродах, в то время как коионы отталкиваются одновременно от обоих электродов, что приводит к уменьшению производительности ЕДВ. Чтобы уменьшить этот так называемый эффект коиона, в [178] карбоксильные группы были привиты на поверхность коммерческого активированного углеродного волокна (AУВ) с использованием обработки азотной кислотой (AУВ-HNO3). Электроды AУВ-HNO3 показали хорошую селективность в отношении катионов. Была собрана асимметричная ячейка (N-ЕДВ), в которой АУВ-HNO3 использовался в качестве катода, а исходный AУВ в качестве анода. Способность к деионизации для N‑ЕДВ при 1.2 В может достигать 12.8 мг/г, тогда как для симметричной ячейки ЕДВ, состоящей из электродов на основе исходного АУВ (0-УДВ), всего 8.0 мг/г. Соответственно, эффективность заряда N-ЕДВ получилась выше 74%, тогда как заряд 0-ЕДВ составлял менее 40% при различных приложенных напряжениях. Более того, ячейка N-ЕДВ проявляла большую циклическую стабильность, чем 0-ЕДВ. Эти результаты показывают, что использование AУВ-HNO3 в качестве катода может эффективно уменьшить вытеснение коионов, тем самым повышая производительность ЕДВ. В [179] положительый эффект для ЕДВ был достигнут обработкой АУ электродов серной кислотой.
7. ВЛИЯНИЕ НА ЕДВ ТИПА УГЛЕРОДНЫХ МАТЕРИАЛОВ
7.1. Активированные угли, волокна и ткани
В качестве основы для электродов ЕДВ, также, как для электрохимических суперконденсаторов, применяются самые разнообразные высокодисперсные углеродные материалы (ВДУМ): активированные угли, активированные углеродные волокна, активированные углеродные ткани, сажи, углеродные нанотрубки, углеродные нановолокна, графены, аэрогели и др. [24]. Наиболее дешевыми и наиболее распространенными из них являются АУ, АУТ и АУВ. Величины площади удельной поверхности этих материалов в большинстве случаев находятся в интервале от нескольких сотен м2/г до ~3000 м2/г. АУ отличаются максимальным диапазоном размеров пор от долей нанометра до 100 мкм [19, 24]. Они могут иметь разное соотношение объема микропор и мезопор. С точки зрения достижения максимальной электросорбции ионов основную роль играют микропоры, а с точки зрения кинетики электросорбции – мезопоры. Наличие макропор важно для облегчения гидродинамического потока воды через электроды [16, 24, 63, 122, 132, 150, 165, 180–185].
В [150] в качестве электродов для ЕДВ использовали АУ, полученные по двухстадийной активации нефтяного кокса. При этом использовали 3 температуры активации: 700°С (тип АУ-700°), 800°С (АУ-800°) и 900°С (АУ-900°). Следующая стадия активации заключалась в обработке гидроксидом калия (КОН). Методом БЭТ были получены, соответственно, следующие величины площади удельной поверхности: 2844, 2767 и 2715 м2/г, а также следующие величины электросорбции NaCl: 9.2 (для АУ-700°), 9.1 (АУ-800°) и 8.0 мг/г ( для АУ-900°). Таким образом, было показано, что оптимальной температурой активации является 700°С.
В [180] в качестве прекурсора для изготовления активированных АУВ с нетканой многомасштабной текстурой были использованы волокна из полиакрилонитрила (ПАН). Из этих волокон методом электроспиннинга была получена ткань, которая активировалась двуокисью углерода при 750–900°С. Полученные АУТ имели величины УП 335–712 м2/г и средний диаметр нановолокон 285–800 нм, которые могут быть изменены путем изменения температуры активации. В результате была достигнута электросорбционная способность, достигающая 4.64 мг/г при напряжении 1.6 В. Следует отметить, что методика получения электродов методом электроспининга является технологичной для применения на практике [186].
В [182] в качестве электрода для ЕДВ использовали ткани из активированного наноструктурированного угля с УП 1108 м2/г. Для повышения характеристик ЕДВ для раствора NaCl были использованы способы химической модификации поверхности травлением в щелочном (KOH) и кислотном (HNO3) растворах. В результате повышались концентрации карбоксильных, карбонильных и гидроксильных групп, а также повышалась эффективность ЕДВ. Было показано, что вследствие воздействия HNO3 эффект повышения эффективности ЕДВ имел место не только благодаря адсорбции ионов двойным электрическим слоем, но также благодаря переносу электронов в результате фарадеевской реакции.
Ткань из АУ является многообещающим материалом электрода для эффективной деионизации воды. Наиболее привлекательной особенностью является сочетание высокой пористости и способности формировать электроды без полимерного связующего путем простой резки. Следует иметь ввиду, что обычно используемое фторопластовое полимерное связующее обладает существенно гидрофобными свойствами, что уменьшает площадь гидрофильной поверхности АУ, на которой протекают электрохимические процессы [99, 122, 134]. Макропористые межволоконные пространства облегчают поток водной среды [122, 134].
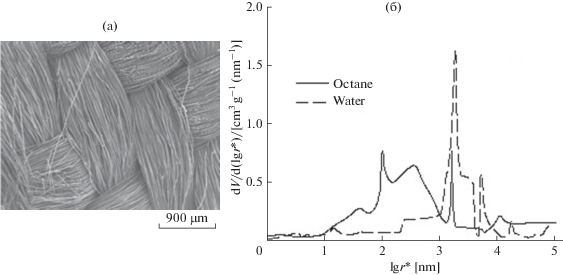
На рис. 9а и 9б для АУ ткани СН-900 (Kuraray Co., Japan) представлены СЭМ фото и дифференциальные кривые распределения пор по эффективным радиусам, измеренные по октану и воде методом эталонной контактной порометрии (МЭКП) [99, 100, 187]. Отсюда видно, что эта АУТ имеет большой объем макропор с размерами от 1 до 100 мкм, что обеспечивает достаточную гидродинамическую проницаемость для потока воды в ЕДВ. Измерения по октану и воде обеспечили возможность получения следующих характеристик пористой структуры: полная и гидрофильная площадь удельной поверхности, соответственно 1520 и 870 м2/г, полная и гидрофильная объемная пористость, соответственно 0.85 и 0.786 см3/см3.
7.2. Углеродные нанотрубки и нановолокна
Во многих работах в качестве основы для электродов ЕДВ использовали углеродные нанотрубки и нановолокна [71, 130, 157, 170, 187–189]. Характерной особенностью этих углеродных наноматериалов является регулярность их структуры, обеспечивающая высокую электропроводность [130, 190]. В основном УНТ обладают мезопористой структурой. В [130] для электродов на основе губок УНТ в проточной ячейке ЕДВ при 1.2 В получили очень высокую величину электросорбции 40 мг/г.
В [134] было разработано новое устройство мембранной емкостной деионизации, объединяющее оба преимущества УНТ и УНВ. Композитная пленка (УНТ-УНВ) была синтезирована низкотемпературным термическим химическим осаждением из паровой фазы. В этой работе была достигнута высокая эффективность удаления соли с низким потреблением энергии. В [71, 187–189] также были исследованы электроды на основе композита УНТ-УНВ. В [157] наночастицы TiO2 были использованы с УНТ для образования композитного электрода (TiO2/УНТ) для ЕДВ. Проводились исследования опреснительных свойств при различных напряжениях. Результаты показали, что электрод TiO2/УНТ, полученный с 1 вес. % TiO2, имеет лучшие результаты по сравнению с другими электродами, имеющими 2 и 5 мас. % TiO2. Примечательно, что лучший электрод показал высокую удельную емкость (122 Ф/г) при скорости развертки потенциала 1 мВ/с в 1 М растворах KCl и хорошую электросорбционную способность (4 мг/г). Следует иметь ввиду, что одностенные УНТ, обладающие наибольшей площадью удельной поверхности и лучшими электрохимическими характеристиками по сравнению с многостенными УНТ, в настоящее время еще довольно дорогие.
7.3. Графены
Последние годы характеризуются бурным развитием разработок графенов – нового класса углеродных наноматериалов. Графены, применяющиеся в различных элоектрохимических устройствах, представляют из себя порошки, обладающие на наноуровне агломератами или стопками из прилипающих друг к другу единичных слоев графена. В [191] тремя разными методами были измерены величин площади удельной поверхности следующих углеродных наноматериалов (УНМ): восстановленного оксида графена, полученного методом взрыва в микроволновой печи; одностенных (ОСУНТ) и многостенных (МСУНТ) углеродных нанотрубок. Были использованы следующие методы: БЭТ, метод эталонной контактной порометрии и метод измерения емкости ДЭС (МДЭС). Для всех трех исследованных УНМ было показано что, во-первых, МЭКП и МДЭС метод дают близкие величины УП, и во-вторых, что эти величины в 2.8–5.2 раза больше соответствующих величин, полученных методом БЭТ. Сильно заниженные величины УП, полученные методом БЭТ, объясняются тем, что отдельные графеновые листы и УНТ, как известно, прилипают друг к другу, образуя агломераты, тяжи или стопки, а молекулы азота при низкой температуре около –200°С (БЭТ) не проникают между отдельными графеновыми слоями и УНТ. С другой стороны, молекулы октана, применявшегося в МЭКП, хорошо смачивающие углеродные материалы (особенно при комнатной температуре), благодаря расклинивающему давлению в процессе измерений внедряются между отдельными графеновыми слоями и УНТ и тем самым существенно увеличивают межфазную поверхность. Водные электролиты при комнатной температуре (в МДЭС), особенно при анодно-катодной поляризации УНМ, также, как октан, обладают расклинивающим давлением и обеспечивают величины УП, близкие к полученным МЭКП. В результате МЭКП и МДЭС для исследованных образцов ВОГ были получены величины УП в интервале от 2000 до 2400 м2/г. Такая высокая УП обусловлена в основном микропорами. Однако, для ВОГ, синтезированных другими методами, получаются меньшие, но все еще достаточно высокие величины УП порядка нескольких сотен м2/г. ВОГ применялся во многих работах в качестве основы электродов для ЕДВ [53, 119, 120, 131, 159, 174, 192–198].
В [193] был синтезирован ВОГ путем восстановления оксида графита (ОГ) с использованием сфокусированного солнечного облучения. Был исследован суперконденсатор (СК), который показал высокую удельную емкость 270 Ф/г в 6 М КОН. Получена также высокая электросорбционная способность (для ЕДВ) 22.4 мг/г для 100 мМ раствора NaCl при напряжении 1 В.
В [194] был получен новый гибридный материал на основе ВОГ и углеродных наносфер, имеющий иерархическую пористую структуру, и обладающий благоприятными свойствами, как для СК, так и для ЕДВ. Была получена высокая удельная емкость 289 Ф/г и высокая электросорбционная способность 19.8 мг/г. В [120] был получен ВОГ с помощью процесса гидротермальной карбонизации и последующей активацией KOH. Этот материал имел иерархическую пористую структуру, обладавшую высокой УП 1401 м2/г с высокой долей мезопористости (20.6%) и демонстрировал достаточно высокую электросорбционную способность 7.74 мг/г.
В [53] было установлено, что композит ВОГ/TiO2, содержавший 20 мас. % TiO2, показал очень высокую удельную емкость 443 Ф/г, а в ячейке МЕДВ показал хорошую электросорбционную способность (9.1 мг/г) при напряжении 0.8 В и начальной концентрации соли ~300 мг/л. В [196] были изготовлены композитные электроды, которые состояли из ВОГ и АУ с повышенной проводимостью, обеспеченной использованием ультразвукового метода электроспиннинга. Была получена достаточно высокая электросорбционная способность NaCl. Результаты показывали, что электросорбционная способность опреснения может быть улучшена за счет увеличения электропроводности электродов.
В [197] было показано, что графеновый гель является очень хорошим материалом для ЕДВ из-за его высокой УП и трехмерной структуры. Было проведено сравнение характеристик опреснения для аргонового гидрогеля (АГ) и графенового аэрогеля (ГА) применительно к ЕДВ. Результаты показали очень высокие электросорбционные емкости АГ и ГА: 49.3 и 45.9 мг/г в растворе NaCl с начальной концентрацией 500 мг/л при 2.0 В.
В [119] был исследован трехмерный ВОГ для ЕДВ. Его опреснительные способности достигали при 2 В следующих достаточно высоких величин: 8.0 мг/г, 16.9 мг/г и 29.6 мг/г в водном растворе NaCl при концентрациях 80 мг/л, 270 мг/л и 572 мг/л соответственно.
7.4. Сравнение графенов с углеродными нанотрубками
При сравнении электросорбционной емкости различных углеродных материалов нужно учитывать, что на нее влияют много факторов: конкретная модификация ЕДВ (см. раздел 2), вид удаляемой соли, ее исходная концентрация, скорость потока раствора, величина напряжения и др. Поэтому наиболее корректным являются сравнения, проведенные в одних и тех же условиях. В большинстве же публикаций рассматривались или только электроды на основе УНТ или только на основе графенов. Корректно сравнивать их в обзоре не представляется правильным, поскольку в каждой работе применяются свои конкретные условия, отличные от других работ. Поэтому в данном разделе рассматриваются только специальные сравнительные исследования работы электродов на основе УНТ и графенов, проведенные в одинаковых условиях.
Кроме того, нужно иметь ввиду, что графены, как правило, дешевле, чем УНТ, особенно, чем ОСУНТ. Актуальными являются работы, в которых сравнивались электросорбционные способности графенов и УНТ [121, 199].
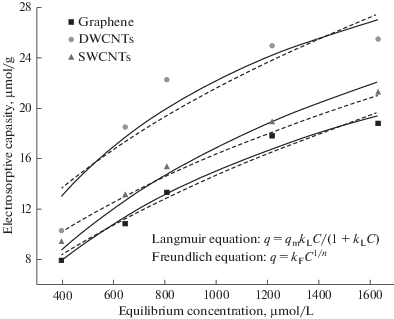
В [199] представлено сравнительное исследование электросорбционного поведения коммерческих одностенных и двустенных УНТ и специально изготовленного графена в качестве потенциальных электродных материалов для ЕДВ. Было установлено, что электросорбционная способность УНТ (одностенных и двустенных) для ЕДВ выше, чем у графенов, что объясняется различиями в их удельной поверхности и более высокой электропроводностью. Этот вывод иллюстрируется на рис. 10, на котором представлены экспериментальные и расчетные изотермы адсорбции (зависимости электросорбции от концентрации равновесного раствора NaCl для графенов, одностенных и двустенных УНТ. Анализ электросорбционой кинетики также подтверждает, что УНТ более подходят в качестве электрода чем графен. На наш взгляд, это объясняется регулярностью пористой структуры УНТ [190]. Однако, учитывая большую стоимость многих марок УНТ, практические выводы о применении этих материалов для ЕДВ нужно решать, принимая во внимание все факторы.
В [121] методом одноступенчатой водяной бани были синтезированы трехмерные (3D) графеновые гидрогели, модифицированные одностенными углеродными нанотрубками (ОСУНТ) и многостенными углеродными нанотрубками (МСУНТ), для увеличения проводимости материалов и уменьшения агрегирования графеновых слоев. Результаты показали, что у композита ОСУНТ/ВОГ была более высокая электросорбционная способность (48.73 мг/г), чем у МСУНТ/ВОГ, и это объяснялось его высокими удельной поверхностью (308.37 м2/г) и удельной емкостью (36.35 Ф/г) а также меньшим сопротивлением переносу заряда по сравнению с МСУНТ/ВОГ. Кроме перечисленных выше углеродных наноматериалов, для ЕДВ используются также аэрогели [34, 115, 200] и углеродные наносферы [30, 201, 202].
8. УДАЛЕНИЕ СОЛЕЙ ТЯЖЕЛЫХ МЕТАЛЛОВ И ДРУГИХ ВРЕДНЫХ ПРИМЕСЕЙ
Удаление из воды методом ЕДВ различных примесей зависит не только от размера гидратированных ионов (об этом см. в разделе 3.2), но и от хемосорбции этих примесей к поверхности конкретного углеродного материала, а значит и от функциональных групп на его поверхности. Хорошо известно, что различные виды АУ обладают специфической хемосорбционной способностью к различным токсичным веществам, что, например, привело к их широкому использованию в противогазах, в медицине и т.д. В ряде работ исследовалось удаление из воды как индивидуальных солей тяжелых металлов и других вредных примесей, так и комбинации этих примесей [127, 200, 203–208].
В [203] была исследована эффективность удаления методом ЕДВ с электродами из АУТ различных ионов тяжелых металлов в различных условиях. Эффективность и механизмы удаления трех ионов – кадмия (Cd2+), свинца (Pb2+) и хрома (Cr3+) исследовались индивидуально и в виде смеси при различных приложенных напряжениях и концентрациях ионов. Было обнаружено, что ЕДВ может эффективно удалять эти металлы, и производительность была положительно коррелирована с приложенным напряжением. Когда при 1.2 В вводили раствор, содержащий 0.5 мМ индивидуальных ионов, удаление Cd2+, Pb2+ и Cr3+ составляло 32, 43 и 52% соответственно. Интересно, что, хотя удаление Pb2+ и Cr3+ оставалось на уровне 46% в смеси трех ионов, удаление Cd2+ значительно уменьшалось до 14%. Аналогичные закономерности наблюдались при использовании 0.05 мМ для имитации состояния естественной загрязненной воды, но эффективность удаления была намного выше, при этом удаление Pb2+ и Cr3+ и Cd2+увеличивалось до 81, 78 и 42% соответственно. Считалось, что причиной низкого влияния валентности является отсутствие хемосорбции Cd2+, а расширенный микроскопический анализ показал явные осадки ионов металлов на поверхности катода после деионизации.
В [200] было проведено исследование для определения возможности удаления методом ЕДВ ионов хрома из промышленных сточных вод с использованием углеродных аэрогелей. В этой работе было исследовано влияние ключевых переменных, включая рН (2–7) и концентрацию 2‒8 (мг/л). Удаление ионов металлов было значительно увеличено при снижении рН и при условии значительной степени заряжения электродов. Концентрация металла в сточных водах может быть снижена на 98.5% при кислотных условиях (рН 2).
Результаты, представленные в [204], описывают фундаментальные аспекты электросорбционного удаления ионов Cu2+ из водных растворов с использованием электродов на основе АУ. При относительно низком напряжении (0.8 В) электроосаждение меди ограничено, и поэтому ионы Cu2+ удалялись из раствора на поверхность электрода посредством чистого электростатического заряжения ДЭС в микро- и мезопорах. Равновесная электросорбционная емкость и константа скорости электросорбции при 0.8 В составляли 24.57 мг/г и 0.038 мг г–1 мин–1 соответственно. Более высокая начальная концентрация приводила к большей электросорбционной способности. Увеличение приложенного напряжения улучшало как способность к электросорбции, так и ее скорость. Дальнейшие эксперименты по электросорбции показали, что ионы Cu2+ обладают высокой селективностью по сравнению с NaCl в конкурентной среде. Электросорбционное удаление ионов Cu2+ с использованием электродов с АУ показало многообещающую перспективу в качестве средства очистки сточных вод.
Для удаления мышьяка из подземных вод в [205] использовался реактор ЕДВ с электродами на основе АУ в присутствии нескольких видов ионов с приложенным напряжением 1.2 В. Результаты показали, что этим методом была достигнута концентрация мышьяка в стоке 0.03 мг/л, что ниже концентрации мышьяка в стандарте для питьевой воды и источников орошения в Тайване. Кроме того, была изучена способность ЕДВ удалять другие сосуществующие ионы: NO3–, ${\text{SO}}_{{\text{4}}}^{{{\text{2--}}}},$ F–, Cl–, Ca2+, Mg2+, Na+, K+. Было показано, что ЕДВ на основе АУ демонстрирует способность быть высокопотенциальной технологией для восстановления чистоты загрязненных мышьяком подземных вод.
В [127] электроды из ВОГ с высокими УП и проводимостью, полученные модифицированным методом Хаммера с использованием гидразина для восстановления оксида графена, были применены для электросорбции FeCl3. Были исследованы различные рабочие параметры, и было установлено, что оптимальная скорость потока раствора и электрическое напряжение составляли 25 мл/мин и 2.0 В соответственно. Было также обнаружено, что равновесная электросорбционная емкость для FeCl3 при 2.0 В составляла 0.88 мг/г. Эксперименты по селективной ионной электросорбции были повторены в растворе с различными ионами, и было отмечено, что электросорбционные способности катионов на ВОГ следуют порядку Fe3+ > Ca2+ > Mg2+ > Na+. Это означает, что электросорбция возрастает с увеличением зарядности катионов.
Целью работы [34] было исследование жизнеспособности ЕДВ при извлечени йодида из воды. Деградация электродов из аэрогеля углерода во время тестирования не наблюдалось. Доля ионов, адсорбированных на аэрогеле углерода (в моль/г аэрогель) во время обработки солоноватой воды зависела от начальных концентраций ионов в питательной воде со следующей селективностью: I–> > Br– > Ca2+ > Mg2+ > Na+ > Cl–. Предпочтительная сорбция йодида на данном аэрогеле углерода показала положительную эффективность для извлечения иодида из солоноватой воды даже в присутствии доминирующих коионов.
9. ВЛИЯНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ. СДВИГ ПНЗ
Поскольку механизм работы метода ЕДВ основан на заряжении ДЭС, то, очевидно, что величина емкости ДЭС (СДЭС) должна существенно влиять на электросорбцию в этом методе. Как было отмечено в разделе 3.1, максимальная (термодинамическая) адсорбционная емкость электродов в классическом случае (т.е. без учета хемосорбции) пропорциональна СДЭС согласно ур. (4). На практике адсорбционная емкость меньше классической вследствие кинетических затруднений. Влияние ДЭС на ЕДВ рассматривалось в [77, 99, 134, 209–215]. Большую сложность представляет учет ДЭС в активированных углях в связи с наличием в них чрезвычайно широкого диапазона размеров пор – от долей нм до 100 мкм (см. раздел 7.1). Очевидно, что в самых мелких порах не может реализоваться диффузный ДЭС по модели Гуи–Чапмена [216], особенно в разбавленных растворах. В этом случае в принципе нужно было бы учитывать перекрытие ДЭС у противоположных стенок пор, что сделать практически нереально, принимая во внимание очень широкое распределение пор по размерам. В этой ситуации применяемые теоретические приближения не представляются адекватными. Например, в [214] в математической модели ЕДВ рассматривался ДЭС в мезопоре одного диаметра. Однако, при этом не учитывалось, что микропоры вносят доминирующий вклад в высокую удельную поверхность высокодисперсных углеродных электродов. В [215], наоборот, использовалась модифицированная модель Доннана, которая фактически учитывает только ДЭС в микропорах, принимая полное перекрытие ДЭС у противоположных стенок пор.
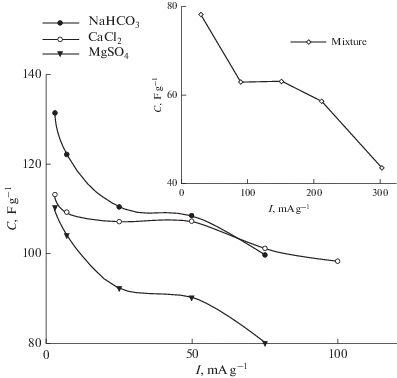
В связи с практической невозможностью на современном уровне теоретически рассчитать емкость ДЭС в АУ с чрезвычайно широким распределением пор по размерам в математических моделях ЕДВ в [99, 134] были использованы величины СДЭС, полученные экспериментально для разных солей. Для этого были измерены зависимости интегральной удельной емкости от тока. В качестве примера на рис. 11 приведена зависимость интегральной емкости АУ электрода CH900 от плотности тока в многокомпонентном растворе. Как показано, уменьшение плотности тока приводит к росту емкости с последующим плато и быстрым увеличением емкости. Увеличение емкости при снижении тока с 300 до 200 мА/г обусловлено значительными омическими потерями при высоком токе и поэтому уменьшение тока сопровождается уменьшением омических потерь. Омические потери становятся чрезвычайно низкими при 200–150 мА/г (область плато); в этом случае емкость определяется практически только емкостью ДЭС. В области очень малых токов становится значительным вклад псевдоемкости фарадеевских редокс-реакций поверхностных групп. На этом же рисунке приведены аналогичные зависимости для АУ СН900 и трех различных солей. Как видим, во всех кривых имеется плато, соответствующее СДЭС для соответствующих электродов и солей [134]. Полученные таким образом величины СДЭС были использованы в математических моделях ЕДВ, развитых в [99, 134]. В модели [134] распределение концентрации во времени и в пространстве сепарационно-электродного блока (СЭБ) описывается уравнением
(8)
$\varepsilon \frac{{\partial c}}{{\partial t}} = D\frac{{{{\partial }^{2}}c}}{{\partial {{x}^{2}}}} + \frac{{{{C}_{{\text{s}}}}}}{{F{{z}_{ + }}}}{{A}_{\varepsilon }}\frac{{\partial \varphi }}{{\partial t}},$Рис. 11.
Удельная емкость АУ электрода “ВИСКУМАК” в зависимости от плотности тока для следующих солей: 1 N NaHCO3, 1 N CaCl2 и 1 N MgSO4. Во вкладыше – зависимость удельной емкости АУ электрода СН 900 от плотности тока для 1 N смеси солей: NaHCO3, CaCl2 и MgSO4 [134].
На рис. 12 приведено сопоставление полученных из этой модели теоретических и экспериментальных гальваностаических кривых, из которого видно, что теоретические кривые хорошо описывают соответствующие экспериментальные кривые, что подтверждает корректность данной математической модели.
Рис. 12.
Экспериментальные (символы) и теоретические (линии) гальваностатические зарядные кривые для различных АУ электродов СН900, VISKUMAK, SAIT. Смешанный раствор, содержащий соли CaCl2, NaHCO3 и MgSO4 (CH900), а также 0.1 N NaHCO3 раствор при плотности тока I = 2.8 мA см–2. На встроенном графике приведена зависимость напряжения и средней концентрации NaHCO3 от времени [134].
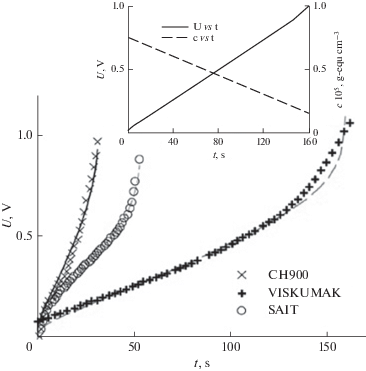
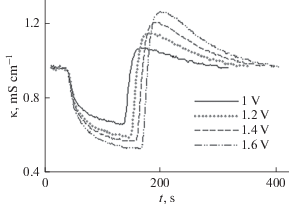
Рисунок 13 иллюстрирует рассчитанное по данной модели распределение концентрации соли по толщине сепарационно-электродного блока. Из этого рисунка видно, что максимальная концентрация соли имеет место в сепараторе (спейсере), поскольку процесс деинизации происходит внутри пористых электродов, а не в сепараторе. На рис. 14 представлены экспериментальные зависимости электропроводности от времени для стадий детонизации (падающие части кривых) и концентрирования. Стадию концентрирования (регенерации) начинали после достижения минимума электропроводности путем замыкания электродов. Этот рисунок иллюстрирует увеличение степени ионизации и степени концентрирования по мере увеличения напряжения. Дело в том, что согласно принятых в работах по ЕДВ определений, степень деионизации равна γдеион = [(cисх – cкон)/cисх] × 100%, а степень концентрирования равна γконц = [(cкон – cисх)/cкон] × × 100%, где cисх и cкон – исходная и конечная концентрации для каждой стадии (деионизации и концентрирования). Поскольку в рассматриваемой на рис. 14 области малых концентраций величины электропроводности KCl практически пропорциональны величинам концентраций, то этот рисунок наглядно иллюстрирует увеличение степени ионизации и степени концентрирования по мере увеличения напряжения.
Рис. 13.
Распределение концентрации соли, рассчитанное для АУ электрода CH900, напряжения 1.25 В, скорости потока раствора $v$ = 0.2 см/с, времени от начала деионизации $t$ = 5 с.
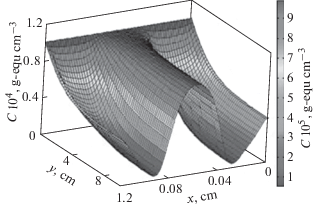
Рис. 14.
Зависимости электропроводности раствора KCl от времени для АУ SAIT для разных напряжений при скорости потока раствора 30 cм3/мин.
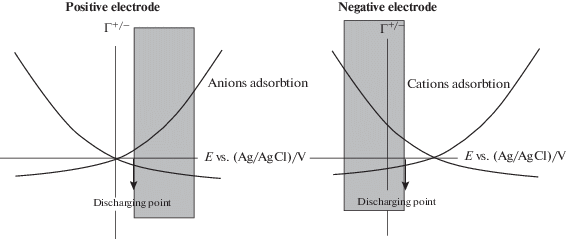
В [210] изучали влияние кислородсодержащих поверхностных групп в АУ электродах на адсорбционно-десорбционное поведение ионов в солоноватой воде. Была разработана специальная методология для оценки эффективности процессов заряда в ЕДВ, которая включает возможность получения различных видов АУ электродов с контролируемой пористостью и поверхностными группами, измерение потенциала нулевого заряда (ПНЗ) и одновременно адсорбции и десорбции ионов в этих электродах. Наличие полярной, содержащей кислород поверхности в АУ не влияет на электросорбционное поведение ионов Na+ и Cl– ионов в порах, средний размер которых превышает 0.58 нм, за исключением значительного изменения потенциала нулевого заряда. В этом случае происходит сдвиг всех кривых адсорбции ионов с потенциалом. Это иллюстрирует рисунок 15. Из него следует, что поверхностно окисленный электрод, который демонстрирует положительный сдвиг его ПНЗ, должен использоваться в качестве отрицательного электрода, в то время как неокисленный электрод следует использовать в качестве положительного электрода. Таким образом реализуется асимметричный сепарационно-электродный блок, в котором достигается желаемая оптимизация при работе с обоими электродами в тех их областях потенциалов, в которых адсорбция противоионов максимальна, а связанная с этим десорбция коиона минимальна.
10. pH В ПРОЦЕССАХ ЕДВ
Существенный интерес представляет как вопрос, как изменятся pH в процессе ЕДВ, так и вопрос о влиянии pH на характеристики ЕДВ [64, 66, 200, 217, 218]. В [64] было проведено теоретическое исследование изменений pH в ЕДВ. Было показано, что при электрохимическом опреснении воды может наблюдаться большая разница в рН между исходным раствором и стоком воды. Эти изменения рН могут влиять на долговременную стабильность мембран и электродов. Раньше считалось, что за наблюдаемыми изменениями рН в процессе деионизации ответственны фарадеевские процессы. В данной же работе была развита количественная теория МЕДВ, которая включает в себя не только фарадеевские реакции, но и тот факт, что все ионы в воде имеют различные подвижности (коэффициенты диффузии). Развитая динамическая модель включает следующие явления: (I) различные подвижности различных ионов в сочетании с кислотно-щелочными равновесными реакциями; (II) химический поверхностный заряд в микропорах, где образуются двойные электрические слои; и (III) фарадеевские реакции в микропорах. Теория предсказывает небольшие изменения рН во время циклов опреснения в МЕДВ, если учитываются только явления (I) и (II), но предсказывает, что эти изменения рН могут быть намного больше, если учитывается явление (III). На рис. 16 приведены изменения рН для ситуации без фарадеевских реакций и с фарадеевскими реакциями.
Рис. 16.
Профили pH на основе расчетов в потоке MЕДВ, как для случая без фарадеевских реакций (а), так и для случая с фарадеевской реакцией (б), в разные моменты во время процесса деионизации.
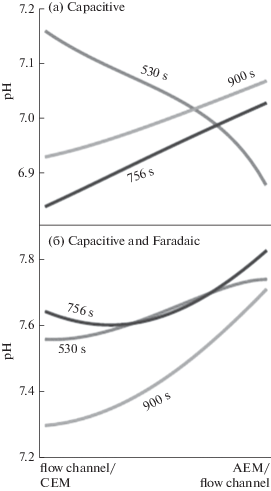
Как видим, изменения pH могут быть как в направлении увеличения, так и уменьшения.
В [217] при установлении изменений pH связали модифицированную модель Доннана со слабым электролитом с кислотно-основной теорией равновесия. В данной модели плотность поверхностного заряда может варьироваться в зависимости от констант равновесия (pK) реакций отдельных поверхностных групп, а также наличия электролита в микропорах. На начальном этапе это равновесие рассматривалось в отсутствие фарадеевских реакций. Модель показала предпочтительную адсорбцию катионов по сравнению с анионами на поверхностях с соответственно кислотным или основным поверхностным зарядом функционалом групп. Был введен новый параметр, который назван “эффективностью химического заряда” для количественной оценки эффективности удаления соли из-за поверхностных функциональных групп. Ценность данной работы заключается в том, что в ней развитая модель проверялась с помощью хорошо контролируемых экспериментов по титрованию для АУ ткани, и количественно определялся начальный и конечный pH раствора после добавления АУТ. Были также использованы метод индуктивно-связанной плазменной масс-спектрометрии и ионной хроматографии для количественной оценки конечных концентраций отдельных видов ионов. Полученные результаты показали хорошее согласие между экспериментами и моделью.
В [200] было проведено исследование для определения возможности электрохимического удаления ионов хрома из промышленных сточных вод с использованием углеродных аэрогелей. В этой работе определяли влияние ключевых переменных, включая рН (2–7), концентрации ионов хрома (2–8 мг/л) и заряда (0.3–1.3 А ч). Удаление ионов металлов было значительно увеличено при снижении рН и в услових высокого заряда. Было показано, что концентрация металла в сточных водах может быть снижена на 98.5% при высоком токе (0.8 А) и кислотных условиях (рН 2). Влияние независимых параметров на процентное удаление была изображена квадратичным уравнением, полученным с использованием модели Box–Behnken. Модель также использовалась для оптимизации параметров, чтобы максимизировать процентное удаление Cr до более, чем 98%.
11. ИЗОТЕРМЫ АДСОРБЦИИ
В ряде работ закономерности электросорбции ионов в ЕДВ были описаны известными изотермами адсорбции [71, 127, 189, 199, 219, 220]. Следует отметить, что в большинстве из этих работ авторы использовали для этой цели изотерму Ленгмюра [71, 127, 189, 199, 219]. В [71] было проведено сравнительное исследование электросорбции для ЕДВ и МЕДВ с использованием для обоих устройств композитных электродов на основе углеродных нанотрубок и углеродных нановолокон (УНТ-УНВ). При этом была получена высокая эффективность деионизации. Изотермы электросорбции в МЕДВ и ЕДВ хорошо описываются изотермой Лэнгмюра, что указывает на отсутствие изменений в адсорбционном поведении, когда в систему ЕДВ вводятся ионообменные мембраны. В [199] было представлено сравнительное исследование электросорбционного поведения для ЕДВ коммерческих одностенных и двустенных УНТ и специально подготовленного восстановленного оксида графена (см. раздел 7.4). Сравнение проведено в одних и тех же экспериментальных условиях и описывалось изотермами адсорбции Ленгмюра и Френдлиха и соответствующими кинетическими моделями. В результате было установлено, что на основе более высокой константы регрессии изотерма Ленгмюра может описывать показатели электросорбции для всех исследованных электродов лучше, чем изотерма Фрейндлиха. К такому же выводу пришли и в [189], где также изучалось электросорбционное поведение композита УНТ-УНВ. В [220] изучалась электросорбция на АУ электроде ионов K+ из водной среды. Экспериментальные равновесные данные адсорбции ионов K+ были аппроксимированы уравнениями Ленгмюра, Фрейндлиха и Темкина. Результаты показали, что на адсорбцию ионов K+ на АУ оказывают влияние многие факторы, включая распределение размера пор, удельная площадь поверхности и химия поверхности активированных углей, а также то, что изотерма Темкина наилучшим образом описывает равновесные данные адсорбции.
12. ПРОБЛЕМЫ ПОЛУЧЕНИЯ ЧИСТОЙ ВОДЫ. ПОВЕРХНОСТНАЯ ПРОВОДИМОСТЬ. МОЗАИЧНЫЕ МЕМБРАНЫ
Анализ показал, что применение метода ЕДВ для получения чистой питьевой воды лимитируется очень высоким электрическим сопротивлением чистой воды в порах углеродных электродов и спейсера (сепаратора). С другой стороны, давно известно, что активированные угли имеют большое количество ионогенных поверхностных групп [147]. В [221] был впервые разработан метод измерения поверхностной проводимости (ПП) для пористых электродов.
На рис. 17 изображен схематический эскиз 6‑камерной 5-электродной ячейки для измерения ПП [221]. После установки исследуемого электрода 1, в камеры 4 и капилляры 8 заливается водный раствор (например, KCl) заданной концентрации. Затем между электродами 13 пропускается определенный ток и по очереди измеряются разности потенциалов между исследуемым электродом и электродами сравнения, и вычисляется разность потенциалов на обоих концах исследуемого электрода. Далее по закону Ома вычисляется сопротивление и ионная электропроводность. Проводя подобные измерения для разных концентраций и экстраполируя ее до нуля, определяется величина ПП. На рис. 17 показана зависимость электропроводности электрода CH900 от концентрации раствора KCl (в области очень малых концентраций) при равновесном потенциале.
Рис. 17.
Схематическое изображение ячейки для измерения ПП: 1 – исследуемый электрод; 2 – платиновый токоотвод; 3 – внешние камеры (термостатирование); 4 – основные камеры; 5 – камеры вспомогательных электродов; 6, 7, 9, 10, 12 – краны; 8 – стеклянные капилляры Луггина; 11 – электроды сравнения; 13 – вспомогательные электроды.
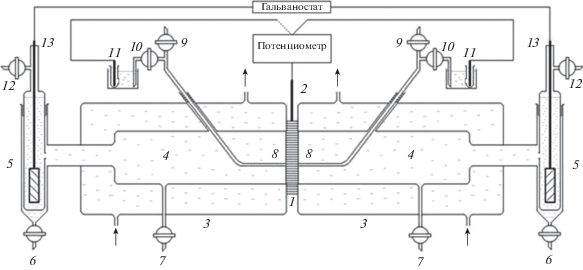
Из рис. 18 следует, что даже в чистой воде электроды на основе АУ обладают достаточной ионной электропроводностью для получения чистой воды в ЕДВ. В [221] было показано, что величина ПП пропорциональна обменной емкости соответствующего АУ электрода, т.е. концентрации поверхностных групп.
Рис. 18.
Зависимость электропроводности от концентрации KCl при равновесном потенциале раствора для АУ электрода CH900.
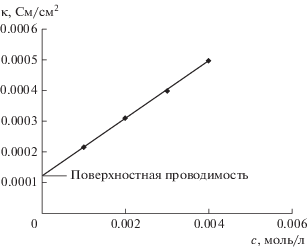
После установления факта наличия ПП у нескольких типов АУ стало ясно, что реальным препятствием для получения чистой воды в установках ЕДВ является чрезвычайно высокое сопротивление такой воды в порах обычных пористых спейсеров. Однако, затем в [142] была решена и эта проблема путем замены такого пористого спейсера на катионо-анионообменную мембрану мозаичной структуры, схематическое изображение которой приведено на рис. 19. Мозаичная мембрана (ММ) содержит перемешанные между собой катионообменные и анионообменные частицы в приблизительно одинаковом количестве.
Рис. 19.
Схематическое изображение структуры мозаичной мембраны: 1 – полимерная матрица; 2 – микропоры; 3 – положительно заряженные фиксированные ионогенные группы, входящие в состав частиц анионита; 4 – анионы; 5 – отрицательно заряженные фиксированные ионогенные группы, входящие в состав частиц катионита; 6 – катионы.
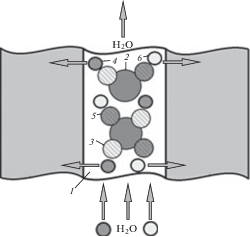
На рис. 20 приведены зависимости электропроводности от концентрации NaCl для двух типов мозаичных мембран пленочного и волокнистого типов в области малых концентраций.
Рис. 20.
Зависимость электропроводности от концентрации NaCl для мозаичных мембран (ММ) (1) пленочного типа и (2) волокнистого типа [142].
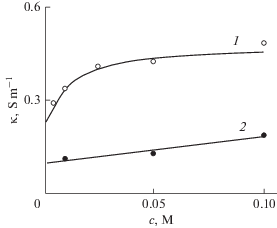
Как видно из рис. 20, для обеих мозаичных мембран при экстраполяции этих кривых на нулевую концентрацию удельная электропроводность (т.е. поверхностная проводимость) достаточно велика, и она обусловлена проводимостью противокатионов и противоанионов.
Рис. 21.
Вольт-фарадные кривые для статической ячейки с ММ волокнистого типа с чистой водой при скоростях развертки напряжения: 1 – 20; 2 – 2; 3 – 1; 4 – 0.1 мВ/с [142].
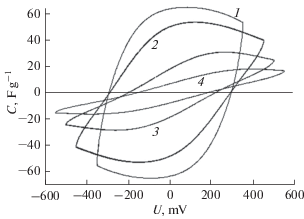
На рис. 21 приведены вольт-фарадные кривые для разных скоростей развертки напряжения для статической ячейки (без потока воды), в которой поры АУ электродов и находящейся между ними мозаичной мембраны волокнистого типа были пропитаны чистой водой. Из рис. 21 видно, что максимальная удельная емкость АУ электродов достигала 56 Ф/г, что является довольно большой величиной для чистой воды.
На рис. 22 приведены сравнительные зависимости удельной результирующей энергии деионизации (на 1 моль деионизованной соли) от напряжения для ЕДВ с мозаичной тканевой мембраной и для ЕДВ с пористым стеклянным спейсером, обычно применяемым в работах по ЕДВ.
Рис. 22.
Зависимости удельной результирующей энергии деионизации от напряжения для ЕДВ с мозаичной тканевой мембраной и для ЕДВ с пористым стеклянным спейсером. Исходная концентрация 0.005 М KCl, скорость потока раствора 5 мл/мин [142].
Из этого рисунка следует, что для обоих типов ячейки ЕДВ удельные энергозатраты уменьшаются с уменьшением напряжения, и при U ≤ 1.4 В энергозатраты для ЕДВ с ММ практически выходят на плато. Как видим, при всех напряжениях энергозатраты для ЕДВ с ММ меньше, чем для ЕДВ со стеклянным спейсером. Это объясняется тем, что при минимальных концентрациях раствора в ячейке с ММ перенос ионов осуществляется не столько свободными ионами, находящимися в порах, сколько подвижными противо-катионами и противо-анионами в мозаичной мембране, а также противоионами поверхностных групп в активированных угольных электродах. В противоположность этому, в стеклянном сепараторе в чистой воде практически отсутствуют подвижные ионы. В результате всех проведенных исследований в [142] был сделан вывод о том, что для получения чистой воды в установках ЕДВ необходимо заменить пористые спейсеры на мозаичные мембраны, а в качестве электродов необходимо использовать активированные угольные электроды, обладающие существенной поверхностной проводимостью.
13. ОТРАВЛЕНИЕ ЭЛЕКТРОДОВ И ИХ ДЕГРАДАЦИЯ
Известно, что ЕДВ отличается меньшей деградацией по сравнению с другими опреснительными методами [222]. Тем не менее, при практическом применении ЕДВ важно исследовать условия отравления высокодисперсных углеродных электродов и их деградации, а также разработать оптимальные условия для ее минимизации. В [98] были проведены эксперименты в разных условиях и наблюдали сильное снижение производительности от 7.3 до 0.5 мг/г после 70 циклов в симметричной ячейке в режиме 1.2/0 В (т.е. деионизация–заряжение при 1.2 В и концентрирование–разряжение при 0 В) из-за окисления анода при анодной поляризации. Чтобы устранить деградацию, были испытаны различные напряжения заряжения и разряжения в асимметричной ячейке, и был выбран режим 0.8/–0.4 В в качестве оптимизированного окна напряжения. При этом режиме была получена величина электросорбции NaCl 6.3 мг/г, что несколько ниже, чем в эксперименте с напряжением 1.2/0 В, но стабильность и эффективность заряда были намного выше и значительно уменьшена коррозия электродов. Кроме того, процесс имел более низкое потребление энергии.
В [222] была исследована работа установки ЕДВ с композитными электродами 3D-графен/углеродные нанотрубки (G-УНТ) с периодически чередующимся режимом изменения напряжения (1.2/0/–1.2/0 В). Целью исследования являлось повышение эффективности и стабильности деионизации. Опреснительная способность электрода G-УНТ постепенно увеличивалась в течение первых нескольких циклов, кроме того, такой режим работы был почти в шесть раз более эффективным по сравнению с ЕДВ с регулярным изменением напряжения (1.2/0 В). Такое повышение характеристик работы электродов и ячейки ЕДВ объясняется синергическими преимуществами чередующегося окисления отрицательного и положительного электрода, которые могут уменьшить окисление положительного электрода, а также уменьшить восстановление отрицательного электрода с отрицательным поверхностным зарядом. Поэтому такой периодический режим с переменным напряжением является экономичным и эффективным способом контроля окисления электродов для повышения эффективности опреснения и уменьшения деградации.
В [66] сравнивались фарадеевские реакции, происходящие в процессах ЕДВ и МЕДВ с периодическим режимом заряда–разряда, путем исследования изменений концентрации H2O2 и растворенного кислорода, pH, проводимости и тока во время заряда и разряда при различных зарядных напряжениях. Во время заряда концентрация H2O2 в ЕДВ быстро увеличивалась, а затем уменьшалась, в то время как H2O2 почти не генерировалась в МЕДВ из-за неспособности кислорода проникать через ионообменную мембрану. Были разработаны химико-кинетические модели для количественного описания изменения концентрации H2O2 и было обнаружено, что они представляют удовлетворительное описание экспериментальных данных. Падение рН во время заряда может быть частично объяснено реакциями Фарадея с генерацией протонов, связанных с окислением углеродных электродов, которые считаются их основным источником. С помощью этих моделей были проанализированы потенциалы электродов, необходимые для возникновения фарадеевских реакций, что дает надежные термодинамические объяснения для возникновения окисления углерода на аноде и образования H2O2 на катоде во время процесса адсорбции ионов. Наконец, было исследовано электрохимическое старение углеродных электродов и получена стабильность характеристик. Результаты этого исследования способствуют лучшему пониманию фарадеевских реакций в ЕДВ и МЕДВ и они должны быть полезны для оптимизации технологий на основе ЕДВ для конкретных практических применений.
Целью работы [223] было исследование жизнеспособности ЕДВ при опреснении добываемой солоноватой воды и извлечения из нее йодида. Были проведены лабораторные эксперименты для определения селективности ионов, ключевых рабочих параметров, проведения оценок производительности обессоливания и решения других проблемы практического применения. Во время тестирования не наблюдалась деградация электродов на основе углеродного аэрогеля.
14. ПРИМЕНЕНИЕ ЕДВ НА ПРАКТИКЕ
Хотя энергетические затраты и стоимость емкостной деионизации воды намного ниже, чем у других опреснительных методов (обратного осмоса, электродиализа и др.) (см. раздел 1), в настоящее время эра крупномасштабного применения большого количества мощных установок ЕДВ еще не наступила. Причина этого состоит в том, что для этого необходимо потратить большие деньги для создания принципиально нового оборудования по сравнению с оборудованием крупнотоннажных заводов для обратного осмоса, которые давно функционируют во многих странах. Тем не менее, в разных странах уже созданы и функционируют опреснительные установки на ЕДВ, пока уступающие по производительности наиболее мощным заводам для обратного осмоса. Приведем некоторые примеры. В 2007 г. в Китае была построена полномасштабная установка ЕДВ ESTPURE мощностью 10 000 тонн в день для улучшения качества очищенной воды [224, 225]. Этот проект позволил снизить общее количество растворенных твердых веществ с 1000 мг/л до 250 мг/л. Восстановление воды может достигать 75%. Уровень потребления электроэнергии составляет 1 кВт ч/м3, а стоимость очистки воды 0.22 долл. США/м3.
В 2008 г. была создана компания Voltea, расположенная в Соединенных Штатах и Нидерландах. Она разработала технологию опреснения воды с использованием МЕДВ и ее назвали “CAPDI”. Было заявлено, что степень извлечения воды составила 95%. У этой компании есть различные установки, начиная от промышленного масштаба и заканчивая миниатюрной версией для домашнего использования под названием “DIUSE”. С тех пор появились различные компании, и наиболее признанными из них являются UR-ATERLLC в Соединенных Штатах [226].
Аппараты ЕДВ могут входить как части в более мощные и многофункциональные опреснительные установки. Например, в 2017 г. В Сингапуре была создана опреснительная установка на основе обратного осмоса, в которую входит также аппарат ЕДВ (см. рис. 23) [227].
Рис. 23.
Принципиальная схема экспериментальной опреснительной установки в Сингапуре на основе обратного осмоса (RO), в которую входит также аппарат ЕДВ (CDI) [227].
Одним из ведущих разработчиков емкостных систем деионизации воды является компания CDT Systems, Inc. (Даллас, Техас, США). CDT Systems посвящена исключительно коммерциализации CDT. Она имела свою первую демонстрацию на заводе в Карлсбаде, штат Калифорния, были подписаны контракты на поставку систем в штат Аризона и в Иорданию для очистки муниципальной воды. Были также заключены контракты с Asea Brown Boveri (ABB, Norwalk, CT) на 31 млрд долларов и с компанией Air Water, Inc. (Осака, Япония), занимающейся экологическим оборудованием и услугами, стоимостью 1.8 миллиарда долларов [228].
Производятся также компактные установки ЕДВ для частного потребления в коттеджах для очистки воды из озер и рек, расположенных вдали от населенных пунктов [224] (см. рис. 24).
Рис. 24.
Схематическое изображение компактной установки ЕДВ для очистки воды из озер и рек (а), изменение концентрации соли во времени (б) [224].
Эти установки работают при температурах в диапазоне от 5 до 60°C в условиях повышенной мутности питательной воды с минимальным вмешательством оператора. Эта технология является экологически чистой благодаря низкому энергопотреблению и минимальному потреблению химикатов, что позволяет любой невозобновляемой воде безопасно возвращаться в экосистему.
Компания Atlantis Technologies сообщает, что их установки ЕДВ удаляют примеси до 99% и могут уменьшить соленость до 100 000 промилле при сниженном техническом обслуживании [229]. У итальянской компании Idropan Dell’Orto имеются установки под названием Plimmer 4G Alpha и Delta, которые позволяют снизить содержание примесей в воде до 70–85% за один проход и до 85–95% за два прохода. У этой компании есть разные партнеры в разных странах, такие как EUROWATER в Дании, ECOWATER в США, AquaSphere в Индии, а также в Тунисе, Австралии и Саудовской Аравии. Компания PowerTech Water, основанная в 2014 г., недавно подготовила прототип и готова к маркетингу. InnoDI – это новый стартап IIT Madras, основанный в 2017 г., и выпустивший первый продукт ЕДВ на рынке в 2017 г. [230].
Компания EST Water & Technologies (КНР) разрабатывает крупномасштабные системы ЕДВ для опреснения, которые могут применяться в различных отраслях промышленности. Примеры включают применение для муниципальных подземных вод, нефтехимической промышленности, сталелитейных заводов, тепловых электростанций, угледобывающих предприятий, бумажных фабрик, для производства удобрений, а также для деионизации соленой воды с высоким содержанием фтора и мышьяка. До недавнего времени в Китае было установлено более 30 промышленных систем, где большая часть оборудования предназначена для регенерации/повторного использования промышленных муниципальных сточных вод с производительностью очистки от 100 до 2000 м3/ч. С точки зрения энергопотребления модули ЕДВ привлекательны по сравнению с модулями обратного осмоса, со значениями энергопотребления около 1.0 кВт ч/м3 для ЕДВ и 1.5 кВт ч/м3 для обратного осмоса [231].
В компании Samsung Electronics стиральные машины снабжаются небольшим аппаратом ЕДВ с целью удалять соли жесткости MgSO4 и CaCl2 из воды, подающейся в стиральную машину, чтобы продлить срок ее работы [99, 134, 136].
Следует отметить, что наиболее широко исследуемым применением для емкостной деионизации воды является опреснение солоноватых вод для производства питьевой или сельскохозяйственной воды, а также для очистки сточных вод различных промышленных предприятий. По сравнению с наиболее распространенными технологиями опреснения, такими как обратный осмос, современные системы ЕДВ потребляют значительно меньше энергии для опреснения при низких уровнях концентрации соли в питательной воде.
ЗАКЛЮЧЕНИЕ
Рассмотрена литература по емкостной деионизации воды. ЕДВ – это новый метод опреснения воды, заключающийся в прокачке деионизуемой воды между высокодисперсными углеродными электродами, между которыми задается определенная разность потенциалов. ЕДВ требует гораздо меньших энергетических затрат по сравнению с другими опреснительными методами. Рассмотрены различные модификации ЕДВ: мембранная емкостная деионизация с катионообменной и анионообменной мембраной, ЕДВ с редокс-реакциями на электродах, ЕДВ с проточными электродами, мембранная емкостная деионизация с проточными электродами. Исследовано влияние на ЕДВ пористой структуры электродов, размера гидратированных ионов, типа углеродных электродов, емкости двойного электрического слоя, функциональных групп, смачиваемости водой, pH и других факторов. Много исследований было посвящено удалению из воды различных ионов: натрия, хлора, фтора, хрома, йода, железа, меди, мышьяка, цинка, урана, тиосульфата, органических солей и т.д. Подбираются типы электродных углей для селективного удаления определенных ионов. Рассмотрены условия деградации электродов и ее минимизации. Рассмотрены проблемы получения чистой питьевой воды. Для решения этой проблемы предложено использование катионо- анионообменной мембраны мозаичной структуры вместо обычного пористого спейсера (сепаратора). Описано применение ЕДВ на практике различными фирмами.
В результате многих исследований было показано, что технологии ЕДВ и МЕДВ обладают огромным потенциалом в области опреснения, а также большой наукоемкостью, и поэтому на это направлено большое количество исследований. Обладая самым низким энергопотреблением и наибольшим потенциалом рекуперации энергии, метод ЕДВ может обеспечить лучшие технологии для опреснения воды определенных типов.
Список литературы
Subramani, A., Badruzzaman, M., Oppenheimer, J., and Jacangelo, J.G., Energy minimization strategies and renewable energy utilization for desalination, A review, Water research, 2011, vol. 45, p. 1907.
Волков, В.В., Мчедлишвили, Б.В., Ролдугин, В.И., Иванчев, С.С., Ярославцев, А.Б. Мембраны и нанотехнологии. Обзор. Российские нанотехнологии. 2008. Т. 3. С. 67. [Volkov, V.V., Mchedlishvili, B.V., Roldugin, V.I., Ivanchev, S.S., and Yaroslavtsev, A.B., Review, Nanotechnologies in Russia, 2008, vol. 3, p. 656.]
Farmer, J.C., Fix, D.V., Mack, G.V., Pekala, R.W., and Poco, J.F., “The Use of Capacitive Deionization with Carbon Aerogel Electrodes to Remove Inorganic Contaminants from Water,” Low Level Waste Conference, Orlando, USA (1995).
Oren, Y., Desalination, Capacitive deionization (CDI) for desalination and water treatment – past, present and future (a review), Desalination, 2008, vol. 228, p. 10.
Strathmann, H., Ion-Exchange Membrane Processes in Water Treatment Sustainability Scienceand Engineering, Elsevier Pabl., 2010.
Avraham, E., Noked, M., Bouhadana, Y., Soffer, A., and Aurbach, D., Limitations of charge efficiency in capacitive deionization II. On the behavior of cdi cells comprising two activated carbon electrodes, J. Electrochem. Soc., 2009, vol. 156, p. 157.
Suss, M.E., Baumann, T.F., Bourcier, W.L., Spadaccini, C.M., Rose, K.A., Santiago, J.G., and Stadermann, M. Capacitive desalination with flow-through electrodes, Energy Environ. Sci., 2012, vol. 5, p. 9511.
Rica, R.A., Ziano, R., Salerno, D., Mantegazza, F., and Brogioli, D. Thermodynamic Relation between Voltage-Concentration Dependence and Salt Adsorption in Electrochemical Cells, Phys. Rev. Lett, 2012, vol. 109, p. 156103.
Porada, S., Zhao R., Van Der Wal, A., Presser, V., and Biesheuvel, P.M., Review on the science and technology of water desalination by capacitive deionization, Prog. Mater. Sci., 2013, vol. 58, p. 1388.
Jande, Y.A.C. and Kim, W.S., Desalination using capacitive deionization at constant current, Desalination, 2013, vol. 329, p. 29.
Soffer, A. and Folman, M., The electrical double layer of high surface porous on carbon electrode, J. Electroanal. Chem., 1972, vol. 38, p. 25.
Li, H., Pan, L., Lu, T., Zhan, Y., Nie, C., and Sun, Z., A comparative study on electrosorptive behavior of carbon nanotubes and graphene for capacitive deionization, J. Electroanal. Chem., 2011, vol. 653, p. 40.
Conway, B.E., Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications, Springer, 1999.
Burke, A., Ultracapacitors: why, how, and where is the technology, J. Power Sources, 2000, vol. 91, p. 37.
Вольфкович, Ю.М., Сердюк, Т.М. Электрохимия. 2002. Т. 38. С. 1043. [Volfkovich, Yu.M. and Serdyuk, T.M. Electrochemical capacitors, Russ. J. Electrochem., 2002, vol. 38, p. 935.]
Pandolfo, A.G. and Hollenkamp, A.F., Carbon properties and their role in supercapacitors, J. Power Sources, 2006, vol. 157, p. 11.
Sharma, P. and Bhatti, T.S., A review on electrochemical double-layer capacitors, Energy Conversion and Management, 2010, vol. 51, p. 2901.
Chen, H., Cong, T.N., Yang, W., Tan, C., Li, Y., and Ding, Y., Progress in electrical energy storage system: A critical review, Prog. Nat. Sci., 2009, vol. 19, p. 291.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., and Bagotsky, V.D., Supercapacitor carbon electrodes with high capacitance. J. Solid State Electrochem., 2014, vol. 18, p. 1351.
Pandolfo, A.G. and Hollenkamp, A.F., Carbon properties and their role in supercapacitors, J. Power Sources, 2006, vol. 157, p. 11.
Вольфкович, Ю.М., Мазин, В.М., Уриссон, Н.А. Работа двойнослойного конденсатора на основе углеродных материалов. Электрохимия. 1998. Т. 34. С. 825–832. [Volfkovich, Y.M., Mazin, V.M., and Urisson, N.A., Operation of double-layer capacitors based on carbon materials, Russian J. Electrochemistry, 1998, vol. 34, p. 740.]
Inagaki, M., Konno, H., and Tanaike, O., Carbon materials for electrochemical capacitors, J. Power Sources, 2010, vol. 195, p. 7880.
Faisal, A., Marzooqi, Al., Amal, A., Ghaferi, A, Saadat, I., and Hilal, N., Application of Capacitive Deionisation in water desalination: A review, Desalination, 2014, vol. 342, p. 3.
Bagotsky, V.S., Skundin, A.M., Volfkovich, Yu.M., Electrochemical Power Sources. Batteries, Fuel Cells, Supercapacitors. Jhon Wiely & Sons Inc. Publisher. N., J. 2015. 372 p.
Ma, X., Wang, H., Wu, Q., Zhang, J., Liang, D., Lu, S., and Xiang, Y., Bamboo like Carbon Microfibers Derived from Typha Orientalis Fibers for Supercapacitors and Capacitive Deionization, J. Electrochemical Society, 2019, vol. 166(2), p. A236.
Zhao, R., Porada, S., Biesheuvel, P.M., and van der Wal A., Energy consumption in membrane capacitive deionization for different water recoveries and flow rates, and comparison with reverse osmosis, Desalination, 2013, vol. 330, p. 35.
Kang, J., Kim, T, Jo, K, and Yoon J., Comparison of salt adsorption capacity and energy consumption between constant current and constant voltage operation in capacitive deionization, Desalination, 2014, vol. 352, p. 52.
Kim, T., Dykstra, J.E., Porada, S., Yoon, J., and Biesheuvel, P.M., Enhanced charge efficiency and reduced energy use in capacitive deionization by increasing the discharge voltage, J. Colloid Interface Science, 2015, vol. 446, p. 317.
Yang, Li., She, J., Jiansheng, Li., Sun, X., Shen, J., Han, W., and Wang, L., A protic salt-derived porous carbon for efficient capacitive deionization: Balance between porous structure and chemical composition, Carbon, 2017, vol. 116, p. 21.
Krüner, B., Srimuk, P., Fleischmann, S., Zeiger, M., Schreiber, A., Aslan, M., Quade A., and Volker, P., Hydrogen-treated, sub-micrometer carbon beads for fast capacitive deionization with high performance stability, Carbon, 2017, vol. 117, p. 46.
Choi, S., Chang, B., Kang, J.H., Diallo, M.S., and Choi, J.W., Energy-efficient hybrid FCDI-NF desalination process with tunable salt rejection and high water recovery, J. Membr. Sci., 2017, vol. 541, p. 580.
Andelman, M., Flow Through Capacitor basics, Separation and Purification Technology, 2011, vol. 80, p. 262.
Anderson, M.A., Cudero, A.L., and Palma J., Capacitive deionization as an electrochemical means of saving energy and delivering clean water. Comparison to present desalination practices: Will it compete? Electrochimica Acta, 2010, vol. 55, p. 3845.
Xu, P., Jorg, E. Drewes, J.E., Heil, D., and Wang, G., Treatment of brackish produced water using carbon aerogel-based capacitive deionization technology, Water Res., 2008, vol. 42, p. 2605.
Strathmann, H., Ion-exchange membrane process: their principle and practical applications, Balaban Desalination pub, Hopkinton. USA. 2016.
Liu, S., Kyle, C., and Smith, K.C., Quantifying the Trade between Energy Consumption and Salt Removal in Membrane-free Cation Intercalation Desalination, Electrochimica Acta., 2017, vol. 230, p. 333.
Yang, S.C., Choi, J., Yeo, J., Jeon, S., Park, H., and Kim, D.K., Flow-Electrode Capacitive Deionization Using an Aqueous Electrolyte with a High Salt Concentration, Environ. Sci. Technol., 2016, vol. 50, p. 5892.
Biesheuvel, P.M., Bazant, M.Z., Cusick, R.D., Hatton, T.A., Hatzell, K.B., Hatzell, M.C., Liang, P., Lin, S., Porada, S., Santiago, J.G., Smith, K.C., Stadermann, M., Su, X., Sun, X., Waite, T.D., van der Wal. A., Yoon, J., Zhao, R., Zou, L., and Suss, M.E., Capacitive Deionization–defining a class of desalination technologies, Applied Physics, 2017, vol. 16, p. 19.
Xie, J., Xue, Y., He, M., Luo, W., Wang, H., Wang, R., and Yan, Y.-M., Organic-inorganic hybrid binder enhances capacitive deionization performance of activated-carbon electrode, Carbon, 2017, vol. 123, p. 574.
Tang, W., He, D., Zhang, C. T., and Waite, D., Optimization of sulfate removal from brackish water by membrane capacitive deionization (MCDI), Water Res., 2017, vol. 121, p. 302.
Hassanvand, A., Chen, G.Q, Webley, P.A., and Kentish, S.E., Improvement of MCDI operation and design through experiment and modelling: Regeneration with brine and optimum residence time, Desalination, 2017, vol. 417, p. 36.
Kim, J.-S. and Choi, J.-H. Fabrication and characterization of a carbon electrode coated with cation-exchange polymer for the membrane capacitive deionization applications, J. Membr. Sci., 2010, vol. 355, p. 85.
Kim, Y.-J. and Choi, J.-H., Enhanced desalination efficiency in capacitive deionization with an ion-selective membrane, Separation and Purification Technology, 2010, vol. 71, p. 70.
Lee, J.-H. and Choi, J.-H., The production of ultrapure water by membrane capacitive deionization (MCDI) technology, J. Membr. Sci., 2012, vols. 409–410, p. 251.
Li, H. and Zou, L., Ion-exchange membrane capacitive deionization: a new strategy for brackish water desalination, Desalination, 2011, vol. 275, p. 62.
Lee, J.-B., Park, K.-K., Euma, H.-M., and Lee, C.-W., Desalination of a thermal power plant wastewater by membrane capacitive deionization, Desalination, 2006, vol. 196, p. 125.
Kim, Y.-J. and Choi, J.-H., Improvement of desalination efficiency in capacitive deionization using a carbon electrode coated with an ion-exchange polymer, Water Res., 2010, vol. 44, p. 990.
Biesheuvel, P.M., Zhao, R., Porada, S., and van der Wal, A. Theory of membrane capacitive deionization including the effect of the electrode pore space. J. Colloid Interface Sci., 2011, vol. 360, p. 239.
Zhao, R., Satpradit, O., Rijnaarts, H.M., P.M. Biesheuvel, and van der Wal A., Optimization of salt adsorption rate in membrane capacitive deionization, Water Res., 2013, vol. 147, p. 1941.
Lee, J.-Y., Seo, S.-J., Yun, S.-H., and Moon, S.-H., Preparation of ion exchanger layered electrodes for advanced membrane capacitive deionization (MCDI). Water Res., 2011, vol. 45, p. 5375.
Biesheuvel, P.M. and van der Wal, A., Membrane capacitive deionization, J. Membr. Sci., 2010, vol. 346, p. 256.
Yang, J., Zou, L., and Song H., Preparing MnO2/PSS/CNTs composite electrodes by layer-by-layer deposition of MnO2 in the membrane capacitive deionisation, Desalination, 2012, vol. 286, 2012, p. 108.
Bai, Y., Huang, Z.-H., Yu, X.-L., and Kang, F., Graphene oxide-embedded porous carbon nanofiber webs by electrospinning for capacitive deionization, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, vol. 444, p. 153.
El-Deen, A.G., Choi, J.H., Kima, C.S., Abdelrazek, K, Khalil, K.A., Almajid, A.A., and Barakat, N.A.M., TiO2 nanorod-intercalated reduced graphene oxide as high performance electrode material for membrane capacitive deionization, Desalination, 2015, vol. 61, p. 53.
Gao, X., Omosebi, A., Holubowitch, N., Liua, A, Ruha, K., Landon, J., and Liu, K., Polymer-coated composite anodes for efficient and stable capacitive deionization, Desalination, 2016, vol. 399, p. 16.
Zhao, Y., Wang, Y., Wang, R., Wu, Y., Xu, S., and Wang J., Performance comparison and energy consumption analysis of capacitive deionization and membrane capacitive deionization processes. Review, Desalination, 2013, vol. 324, p. 127.
Zhao, Y., Wang, Y., Wang, R., Wu, Y., Xu, S., and Wang J., Energy consumption in membrane capacitive deionization for different water recoveries and flow rates, and comparison with reverse osmosis, Desalination, 2013, vol. 330, p. 35.
Li, H., Gao, Y., Pan, L., Zhang, L., Chen, Y., and Sun, Z., Electrosorptive desalination by carbon nanotubes and nanofibres electrodes and ion-exchange membranes, Water Res., 2008, vol. 42, p. 4923.
Wang, Z., Gong, H., Zhang, Y., Liang, P., and Wang, K., Nitrogen recovery from low-strength wastewater by combined membrane capacitive deionization (MCDI) and ion exchange (IE) process, Chemical Engineering J., 2017, vol. 316, p. 1.
Singha, K., Poradab, S., de Gierb, H.D., Biesheuvel, P.M., and de Smeta, L.C.P.M., Timeline on the application of intercalation materials in Capacitive Deionization, Desalination, 2019, vol. 455, p. 115.
Kang, J., Kima, T., Shin, T., Lee, J., Ha, J.-I., and Yoon J., Direct energy recovery system for membrane capacitive deionization, Desalination, 2016, vol. 398, p. 144.
Dykstra, J.E., Zhao, R., Biesheuvel, P.M., and van der Wal, A., Resistance identification and rational process design in Capacitive Deionization, Water Res., 2016, vol. 88, p. 358.
Bian, Y., Liang, P., Yang, X., Jiang, X., Zhang, C., and Huang, X., Using activated carbon fiber separators to enhance the desalination rate of membrane capacitive deionization, Desalination, vol. 381, p. 95.
Dykstra, J.E., Keesman, K.J., Biesheuvel, P.M., van der Wal., A., Dykstra, J.E., Keesman, K.J., Biesheuvel P.M., and van der Wal. A., Theory of pH changes in water desalination by capacitive deionization, Water Res., 2017, vol. 119, p. 178.
Lado, J.J, Rafael, L., Zornitta, R.L., Calvi, F.A., Tejedor-Tejedor, M.I., Anderson, M.A., and Ruotolo, L.A.M., Enhanced capacitive deionization desalination provided by chemical activation of sugar cane bagasse fly ash electrodes, J. Analytical and Applied Pyrolysis, 2017, vol. 126, p. 143.
Tang, W., He, D., Zhang, C., Kovalsky, P., and Waite, T.D., Comparison of Faradaic reactions in capacitive deionization (CDI) and membrane capacitive deionization (MCDI) water treatment processes, Water Res., 2017, vol. 120, p. 229.
Tang, W., He, D., Zhang, C., and Waite, T.D., Optimization of sulfate removal from brackish water by membrane capacitive deionization (MCDI), Water Res., vol. 2017, p. 302.
Hassanvand, A., Chen, G.Q., Webley, P.A., and Kentish, S.E., Improvement of MCDI operation and design through experiment and modelling: Regeneration with brine and optimum residence time, Desalination, 2017, vol. 417, p. 36.
Kim, Y.-J. and Choi, J.-H., Selective removal of nitrate ion using a novel composite carbon electrode in capacitive deionization, Water Res., 2012, vol. 46, p. 6033.
Koo, J.S., Kwak, N.-S., Hwang, T.S., Koo, J.S., Kwak, N.-S., and Hwang, T.S., Synthesis and properties of ananion-exchange membrane based on vinylbenzylchloride–styrene–ethylmethacrylatecopolymers, J. Membr. Sci., vols. 423–424, p. 293.
Li, H., Gao, Y., Pan, L., Zhang, Y., Chen, Y., and Sun, Z., Electrosorptive desalination by carbon nanotubes and nanofibres electrodes and ion-exchange membranes, Water Res., 2008, vol. 42, p. 4923.
Rommerskirchena, A., Ohsb, B., Hepp, K.A., Femmer, R., and Wessling M., Modeling continuous flow-electrode capacitive deionization processes with ion-exchange membranes, J. Membr. Sci., 2018, vol. 546, p. 188.
Smith, K.C., Theoretical evaluation of electrochemical cell architectures using cation intercalation electrodes for desalination, Electroch. Acta, 2017, vol. 230, p. 333.
Wang, L., Biesheuvel, P.M., and Lin, S, Reversible thermodynamic cycle analysis for capacitive deionization with modified Donnan model, J. Colloid Interface Sci., 2018, vol. 512, p. 522.
Starthman, H, Ion- exchange membrane processes: their principle and practical applications, Balaban Desalination Publications, Stuttgart, Germany. 2016.
Bian, Y., Yang, X., Liang, P., Jiang, Y., Zhang, C., and Huang, X., Enhanced desalination performance of membrane capacitive deionization cells by packing the flow chamber with granular activated carbon, Water Res., 2015, vol. 85, p. 371.
He, F., Biesheuvel, P.M., Bazant, M.Z., and Hatton, T.A., Theory of water treatment by capacitive deionization with redox active porous electrodes, Water Res., 2018, vol. 132, p. 282.
Achilleos, D.S. and Hatton, T.A., Selective molecularly mediated pseudocapacitive separation of ionic species in solution, ACS Appl. Mater. Interfaces, 2016, vol. 8, p. 32743.
Su, X. and Hatton, T.A., Electrosorption at functional interfaces: from molecularlevel interactions to electrochemical cell design, Phys. Chem. Chem. Phys., 2017, vol. 19, p. 23570.
Su, X. and Hatton, T.A., Redox-electrodes for selective electrochemical separations, Adv. Colloid Interface Sci., 2017, vol. 244, p. 6.
Su, X., Hübner, J., Kauke, M.J., Dalbosco, L., Thomas, J., Gonzalez, C.C., Zhu, E., Franzreb, M., Jamison, T.F., and Hatton, T.A., Redox interfaces for electrochemically controlled protein-surface interactions: bioseparations and heterogeneous enzyme catalysis, Chem. Mater., 2017, vol. 29, p. 5702.
Su, X., Kulik, H.J., Jamison, T.F., and Hatton, T.A., Anion-selective redox electrodes: electrochemically mediated separation with heterogeneous organometallic interfaces, Adv. Funct. Mater., 2016, vol. 26, p. 3394.
Su, X., Tan, K.-J., Elbert, J., Rüttiger, C., Gallei, M., Jamison, T.F., and Hatton, T.A., Asymmetric Faradaic systems for selective electrochemical separations, Energy Environ. Sci., 2017, vol. 10, p. 1272.
Smith, K.C., Theoretical evaluation of electrochemical cell architectures using cation intercalation electrodes for desalination, Electrochimica Acta, 2017, vol. 230, p. 333.
Liu, S. and Smith, K.S., Quantifying the trade-offs between energy consumption and salt removal rate in membrane-free cation intercalation desalination, Electrochimica Acta, 2018, vol. 271, p. 652.
Porada, S., Shrivastava, A, Bukowska, P., Biesheuvel, P.M., and Smith, K.S., Nickel Hexacyanoferrate Electrodes for Continuous Cation Intercalation Desalination of Brackish Water, Electrochimica Acta, 2017, vol. 255, p. 369.
Yang, S.C., Choi, J., Yeo, J., Jeon, S, Park, H, and Kim, D.K., Flow-electrode capacitive deionization using an aqueous electrolyte with a high salt concentration, Environ. Sci. Technol., 2016, vol. 50, p. 5892.
Walker, P.J., Mauter, M.S., and Whitacre. J.F., Electrodeposited MnO2 for Pseudocapacitive Deionization: Relating Deposition Condition and Electrode Structure to Performance, Electrochimica Acta, 2015, vol. 182, p. 1008.
Guyes, E.N., Shocron, A.N., Simanovski, A., Biesheuvel, P.M., and Suss, M.E., A one-dimensional model for water desalination by flow-through electrode capacitive deionization, Desalination, 2017, vol. 415, p. 8.
Kim, T, Dykstra, J.E., Porada, S., van der Wal, A, Yoon, J., and Biesheuvel, P.M., Enhanced charge efficiency and reduced energy use in capacitive deionization by increasing the discharge voltage, J. Colloid Interface Science, 2015, vol. 446, p. 317.
Hatzel, K.B, Iwama, E., Ferris A., Daffos, B, Uritab, K, Tzedakisc, T., Chauvet, F., Taberna, P-L, Gogotsi, Y., and Simon, P., Capacitive deionization concept based on suspension electrodes without ion exchange membranes, Electrochemistry Communications, 2014, vol. 43, p. 18.
Gendel, G, Klara, A, Rommerskirchen, E, David, O., and Wessling M., Batch mode and continuous desalination of water using flowing carbon deionization (FCDI) technology, Electrochemistry Communications, 2014, vol. 46, p. 152.
Rommerskirchen, A, Gendel, and Y. Wessling M., Single module flow-electrode capacitive deionization for continuous water desalination, Electrochemistry Communications, 2015, vol. 60, p. 34.
Wang, M., Hou, S, Liu, Y, Ting, X. Zhao, L.R., and Pan, L., Capacitive neutralization deionization with flow electrodes, Electrochimica Acta, 2016, vol. 216, p. 211.
Nativ, P., Badash, Y., and Gendel, Y., New insights into the mechanism of flow-electrode capacitive deionization, Electrochemistry Communications, 2017, vol. 76, p. 24.
Choo, K.Y., Yoo, C.Y., Han, M.H., and Kim, D.K., Choo, K.Y., Yoo, C.Y., Han, M.H., and Kim, D.K., Electrochemical analysis of slurry electrodes for flow-electrode capacitive Deionization, J. Electroanalytical Chemistry, 2017, vol. 806, p. 50.
Yang, S.C., Choi, J. Yeo, J., Jeon, S., Park, H., and Kim D.K., Flow-Electrode Capacitive Deionization Using an Aqueous Electrolyte with a High Salt Concentration, Environ. Sci. Technol., 2016, vol. 50, p. 5892.
Lu, D., Cai, W., and Wang, Y., Optimization of the voltage window for long-term capacitive deionization stability, Desalination, 2017, vol. 424, p. 53.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., Rychagov, A.Yu., Sosenkin, V.E., and Park, D.C, Capacitive deionization of aqueous solutions. modeling and experiments, Desalination and water treatment, 2017, vol. 69, p. 130.
Volfkovich, Yu.M., Filippov, A.N., and Bagotsky, V.S., Structural properties of porous materials and powders used in different fields of science and technology, Springer Publisher, N.Y., 2014.
Rouquerol, J., Baron, G., Denoyel, R., Giesche, H., Groen, J., Klobes, P., Levitz, P., Neimark, A.V., Rigby, S., Skudas, R., Sing, K., Thommes, M., and Unger, K., Pure Appl. Chem., 2012, vol. 84, p. 107.
Drake, C., Pore-Size Distribution in Porous Materials, Ind. Eng. Chem., 1949, vol. 1, p. 780.
Gregg, S.J. and Sing, K.S.W., Adsorption, Surface Area and Porosity, Academic Press, N.Y., 1967.
https://en.wikipedia.org/wiki/Electron_microscope.
Tersoff, J. and Hamann, D.R., Theory of the scanning tunneling microscope, Physical Review, 1985, vol. 31, p. 805.
Dietz, P., Hansma, P.K., and Inacker, O., Surface pore structures of micro- and ultrafiltration membranes imaged with the atomic force microscope, J. Membr. Sci., 1992, vol. 65, p. 101.
Yurov, V.Y. and Klimov, A.N., “Scanning tunneling microscope calibration and reconstruction of real image: Drift and slope elimination., Review of Scientific Instruments., 1994, vol. 65, p. 1551.
Volfkovich, Yu.M., Filippov, A.N., and Bagotsky, V.S., Structural Properties of Porous Materials and Powders Used in Different Fields of Science and Technology, Springer Publisher, N.Y., 2014.
Volfkovich, Yu.M. and Bagotzky, V.S., The method of standard porosimetry 2. Investigation of the formation of porous structures, J. Power Sources, 1994, vol. 48, p. 339.
Volfkovich, Yu.M., Bagotzky, V.S., Sosenkin, V.E., and Blinov, I.A., The standard contact porosimetry, Colloids Surfaces A Physicochem. Eng. Asp., 2001, vol. 187, p. 349.
Volfkovich, Yu.M., Sakars, A.V., and Volinsky, A.A., Application of the standard porosimetry method for nanomaterials, Int. J. Nanotechnology, 2005, vol. 2, p. 292.
Dzyazko, Yu.S., Ponomaryova, L.N., Volfkovich, Yu.M., Sosenkin, V.E., and Belyakov, V.N., Polymer Ion-Exchangers Modified with Zirconium Hydrophosphate for Removal of Cd2+ Ions from Diluted Solutions, Separ. Sci. Technol., 2013, vol. 48, p. 2140.
Volfkovich, Yu.M., Blinov, I.A., and Sakar, A.V., Porosimetric device, US Patent 7,059,175 (2006).
Li, G-X., Hou, P.-X., Zhao, S.-Y., Chang, Liu, and Cheng, H.-M., A flexible cotton-derived carbon sponge for high-performance capacitive deionization, Carbon, 2016, vol. 101, p. 1.
Kohli, D.K., Bhartiya, S., Singh, A., Singh, R., Singh, M.K., and Gupta, P.K., Capacitive deionization of ground water using carbon aerogel based electrodes, Desalination and water treatment, 2016, vol. 57, p. 1.
Xu, X., Liu, Y., Wang, M., Zhu, C., Lu, T., Zhao, R., and Pan, L., Hierarchical hybrids with microporous carbon spheres decorated three-dimensional graphene frameworks for capacitive applications in supercapacitor and deionization, Electrochimica Acta, 2016, vol. 193, p. 88.
Xu, X., Pan, L., Liu, Y., Lu, T., and Sun, Z., Enhanced capacitive deionization performance of graphene by nitrogen doping, J. Colloid Interface Science, 2015, vol. 445, p. 143.
Zhao, S., Yan, T., Wang, H., Chen, G., Huang, L., Zhang, J., Shi, L., and Zhang, D., High capacity and high rate capability of nitrogen-doped porous hollow carbon spheres for capacitive deionization, Applied Surface Science, 2016, vol. 369, p. 460.
Li, J., Ji, B., Jiang, R., Zhang, P., Chen, N., Zhang, G., and Qu, L., Hierarchical hole-enhanced 3D graphene assembly for highly efficient capacitive deionization, Carbon, 2018, vol. 129, p. 95.
Feng, J., Yang, Z., Hou, S., Li, M., Lv, R., Kanga, F., and Huang, Z.-H., GO/auricularia-derived hierarchical porous carbon used for capacitive deionization with high performance. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2018, vol. 547, p. 134.
Cao, J., Wang, Y., Chen, C., Yu, F., and Ma, J., A Comparison of graphene hydrogels modified with single-walled/multi-walled carbon nanotubes as electrode materials for capacitive deionization, J. Colloid Interface Science, 2018, vol. 518, p. 69.
Kim, C., Srimuk, P., Lee, J., Fleischmann, S., Aslan, M., and Presser, V., Influence of pore structure and cell voltage of activated carbon cloth as a versatile electrode material for capacitive deionization, Carbon, 2017, vol. 122, p. 329.
Chena, Z., Zhang, H., Wu, C., Luo, L., Wang, C., Huang, S., and Xu, H., A study of the effect of carbon characteristics on capacitive deionization (CDI) performance, Desalination, 2018, vol. 433, p. 68.
Chen, Z., Zhang, H., Wu, C., Wang, Y., and Li, W., A study of electrosorption selectivity of anions by activated carbon electrodes in capacitive deionization, Desalination, 2015, vol. 369, p. 46.
Liu, P.-I., Chung, L.-C., Ho, C.-H., Shaoa, H., Liang, T.-M., Chang, M.-C, Ma, C.-C.M., and Horng, R.-Y., Horng Comparative insight into the capacitive deionization behavior of the activated carbon electrodes by two electrochemical techniques, Desalination, 2016, vol. 379, p. 34.
Zornitta, R.L., Lado, J.J., Anderson, M.A., Luís, and Ruotolo, A.M., Effect of electrode properties and operational parameters on capacitive deionization using low-cost commercial carbons, Separation and Purification Technology, 2016, vol. 158, p. 39.
Li, H., Zou, L., Pan,L., and Sun, Z., Using graphene nano-flakes as electrodes to remove ferric ions by capacitive deionization, Separation and Purification Technology, 2010, vol. 75, p. 8.
Li, L., Zou, L., Song, H., and Morris, G., Ordered mesoporous carbons synthesized by a modified sol–gel process for electrosorptive removal of sodium chloride, Carbon, vol. 47, p. 775.
Nadakatti, S., Tendulkar, M., and Kadam, M., Use of mesoporous conductive carbon black to enhance performance of activated carbon electrodes in capacitive deionization technology, Desalination, 2011, vol. 268, p. 182.
Wang, L., Wang, M., Huang, Z.-H., Cui, T., Gui, X., Kang, F., Wang, K., and Wu., D., Capacitive deionization of NaCl solutions using carbon nanotube sponge electrodes, J. Mater. Chem., 2011, vol. 21, p. 18295.
Zhang, D., Wen, X., Shi, L., Tingting, Yan, and Jianping, Zhang, Enhanced capacitive deionization of graphene/mesoporous carbon composites, Nanoscale, 2012, vol. 4, p. 5440.
Wang, G., Dong, Q., Ling, Z., Pan, C., Yu, C. and Qiu, J., Hierarchical activated carbon nanofiber webs with tuned structure fabricated by electrospinning for capacitive deionization, J. Mater. Chem., 2012, vol. 22, p. 21819.
Wen, X., Zhang, D., Shi, L., Yan, T., Wang, H. and Zhang, H., Wen, X., Zhang, D., Shi, L., Yan, T., Wang, H. and Zhang, H., Three-dimensional hierarchical porous carbon with a bimodal pore arrangement for capacitive deionization, J. Mater. Chem., 2012, vol. 22, p. 23835.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., Rychagov, A.Yu., Sosenkin, V.E., Milyutin, V.V. and Park, D., Electrodes Based on Carbon Nanomaterials: Structure, Properties and Application to Capacitive Deionization in Static Cells. Cahapter 9. Nano-Optics, Nanophotonics, Nanomaterials, and Their Applications. Edited by Olena Fesenko and Leonid Fesenko, Shpringer publ., 2018, p. 127.
https://www.czl.ru/applications/contact-angle-measurement-technology/.
Seo, S.-J., Jeon, H., Lee, J.K., Kim, J.-Y., Park, D., Nojima, H., Lee, J. and Moon, S.-H., Investigation on removal of hardness ions by capacitive deionization (CDI) for water softening applications, Water Res., 2010, vol. 44, p. 2267.
Lee, J.B., Park, K.K., Yoon, S.-W., Park, P.-W., Park, K.-I., and Lee, C.-W., Desalination performance of a carbon-based composite electrode, Desalination, vol. 237, p. 155.
Jia, B. and Zou, L., Wettability and its influence on graphene nansoheets as electrode material for capacitive deionization, Chemical Physics Letters, vol. 548, p. 23.
Lu, G., Wang, G., Wang, P.-H., Yang, Z., Yana, Ni, W., Zhang, L. and Yan, W.M., Enhanced capacitive deionization performance with carbon electrodes prepared with a modified evaporation casting method, Desalination, vol. 386, p. 32.
Rulison, C., Wettability studies for porous solids including powders and fibrous materials, Application Note, vol. 402, 1996.
Alencherrya, T., R.N.A., Ghosha, S., Daniela, J., and R, V, Effect of increasing electrical conductivity and hydrophilicity on the electrosorption capacity of activated carbon electrodes for capacitive deionization, Desalination, vol. 415, p. 14.
Volfkovich, Yu.M., Rychagov. A.Yu., Mikhalin, A.A., Kardash, M.M., Kononenko, N.A., Ainetdinov, D.V., Shkirskaya, S.A., and V.E. Sosenkin, Capacitive deionization of water using mosaic membrane, Desalination, vol. 426, p. 1.
Zhou, F., Gao, T., Luo, M., and Haibo, Li, Heterostructured graphene@Na4Ti9O20 nanotubes for asymmetrical capacitive deionization with ultrahigh desalination capacity, Chemical Engineering J., vol. 343, p. 8.
Volfkovich, Yu.M., Capacitive deionization of water (review). In book: Membrane and Sorption Materials and Technologies: Present and Future, Yu.S. Dzyazko, Y.V. Plisko, M.O. Chabam (eds.), 2018, p. 79.
Zornitta, R.L., García-Mateos, F.J., Lado, J.J., Rodríguez-Mirasol, J., Cordero, T., Hammer, P., and Ruotolo, L.A.M., Study of sugar cane bagasse fly ash as electrode material for capacitive deionization, J. Analytical and Applied Pyrolysis, 2016, vol. 120, p. 389.
Zornitta, R.L., García-Mateos, F.J., Lado, J.J., Rodríguez-Mirasol, J., Cordero, T., Hammer, P. and Ruotolo, L.A.M., High-performance activated carbon from polyaniline for capacitive deionization, Carbon, 2017, vol. 123, p. 318.
Тарасевич, М.Р. Электрохимия углеродных материалов. Изд. “Наука”. Москва. 1984.
H.J., Lee, J.-H., Jeong, Y., Lee, J.-H., Chi e, C.-S., and Oh, H.-J., Nanostructured carbon cloth electrode for desalination from aqueous solutions, Materials Science and Engineering A, 2007, vol. 449, p. 841.
Kim, C., Lee, J., Kim, S., Yoon, J., Kim, C., Lee, J., Kim, S. and Yoon, J., TiO2 sol–gel spray method for carbon electrode fabrication to enhance desalination efficiency of capacitive deionization, Desalination, 2014, vol. 342, p. 70.
Po-I Liu, Li-Ching Chung, Chia-Hua Ho, Hsin Shao, Teh-Ming Liang, Ren-Yang Horng, Min-Chao Chang, and Chen-Chi M., Effects of activated carbon characteristics on the electrosorption capacity of titanium dioxide/activated carbon composite electrode materials prepared by a microwave-assisted ionothermal synthesis method, J. Colloid and Interface Science, 2015, vol. 446, p. 352.
Myint, M.T.Z., Al-Harthi, S.H., and Dutta, J., Brackish water desalination by capacitive deionization using zinc oxide icro/nanostructures grafted on activated carbon cloth electrodes, Desalination, 2014, vol. 344, p. 236.
Yang, J., Zou, L., and Song, H., Preparing MnO2/PSS/CNTs composite electrodes by layer-by-layer deposition of MnO2 in the membrane capacitive deionisation, Desalination, 2012, vol. 286, p. 108.
Yasin, A.S., Jeong, J.J., Mohamed, I.M.A., Park, C.H., and Kim, C.S., Fabrication of N-doped &SnO2-incorporated activated carbon to enhance desalination and bio-decontamination performance for capacitive deionization, J. Alloys and Compounds, 2017, vol. 729, p. 764.
Yang, J., Zou, L., Song, H. and Hao, Z., Development of novel MnO2/nanoporous carbon composite electrodes in capacitive deionization technology, Desalination, vol. 276, p. 199.
Liu, J., Lu, M., Yang, J., Cheng, J. and Cai, W., Capacitive desalination of ZnO/activated carbon asymmetric capacitor and mechanism analysis, Electrochimica Acta, 2015, vol. 151, p. 312.
El-Deen, A.G., Barakat, N.A.M., and Kim, H.Y., Graphene wrapped MnO2-nanostructures as effective and stable electrode materials for capacitive deionization desalination technology, Desalination, 2014, vol. 344, p. 289.
Li, H., Ma, Y., Li, R.N.H., Ma, Y., and Niu, R., Improved capacitive deionization performance by coupling TiO2 nanoparticles with carbon nanotubes, Separation and Purification Technology, 2016, vol. 171, p. 93.
El-Deen, A.G., Barakat, N.A.M., Khalil, K.A., Motlak, M., and Kim, H.Y., Graphene/SnO2 nanocomposite as an effective electrode material for saline water desalination using capacitive deionization, Ceramics International, 2014, vol. 40, p. 14627.
Gu, X., Hu, M., Du, Z., Huang, J. and Wang, C., Fabrication of mesoporous graphene electrodes with enhanced capacitive deionization, Electrochimica Acta, 2015, vol. 182, p.183.
Yasin, A.S., Mohamed, H.O., Mohamed, I.M.A., Mousa, H.M., and Barakat, N.A.M., Enhanced desalination performance of capacitive deionization using zirconium oxide nanoparticles-doped graphene oxide as a novel and effective electrode, Separation and Purification Technology, 2016, vol. 171, p. 34.
Byles, B.W., Cullen, D.A., More, K.L. and Pomerantseva, E., Tunnel structured manganese oxide nanowires as redox active electrodes for hybrid capacitive deionization, Nano Energy, 2018, vol. 44, p. 476.
Divyapriya, G., Vijayakumar, K.K., and Nambi, I., Development of a novel graphene/Co3O4 composite for hybrid capacitive deionization system, Desalination, 2018, vol. 451, p. 102.
Chang, L.M.C., Duan, X.Y., and Liu, W., Preparation and electrosorption desalination performance of activated carbon electrode with titania, Desalination, 2011, vol. 270, p. 285.
Leonard, K.C., Genthe, J.R., Sanfilippo, J.L., Zeltner, W.A., and Anderson, M.A., Synthesis and characterization of asymmetric electrochemical capacitive deionization materials using nanoporous silicon dioxide and magnesium doped aluminum oxide, Electrochimica Acta, 2009, vol. 54, p. 5286.
Myint, M.T.Z. and Dutta J., Fabrication of zinc oxide nanorods modified activated carbon cloth electrode for desalination of brackish water using capacitive deionization approach, Desalination, 2012, vol. 305, p. 24.
Ryoo, M.W. and Seo, G., Improvement in capacitive deionization function of activated carbon cloth by titania modification, Water Res., 2003, vol. 37, p. 1527.
Yang, J., Zou, L., Song, H., and Hao, Z., Development of novel MnO2/nanoporous carbon composite electrodes in capacitive deionization technology, Desalination, 2011, vol. 276, p. 199.
Yoon, H., Lee, J., Kim S., and Yoon, J., Hybrid capacitive deionization with Ag coated carbon composite electrode, Desalination, 2017, vol. 422, p. 42.
Rodolfo, J.J., Pérez-Roa, E., Wouters, J.J., Tejedor-Tejedor, M.M., Federspill, C., Ortiz, J.M., Marc and Anderson, A., Removal of nitrate by asymmetric capacitive deionization, Separation and Purification Technology, 2017, vol. 183, p. 145.
Cai, Y., Wang, Y., Han, X, Zhang, L., Xua, S, Wang, J, Cai, Y., Wang, Y., Han, X., Zhang, L., Xu, S. and Wang, J., Optimization on electrode assemblies based on ion-doped polypyrrole/carbon nanotube composite in capacitive deionization process, J. Electroanalytical Chemistry, 2016, vol. 768, p. 72.
Jo, H., Kim, K.H., Jung, M.-J., Park, J.H. and Lee, Y.-S., Fluorination effect of activated carbons on performance of asymmetric capacitive deionization, Applied Surface Science, 2017, vol. 409, p. 17.
Li, Y., Liu, Y., Wang, M., Xu, X., Lu, T., Sun, C.Q., and Pan, L., Phosphorus-doped 3D carbon nanofiber aerogels derived from bacterial-cellulose for highly-efficient capacitive deionization, Carbon, 2018, vol. 130, p. 377.
Wang, M., Xu, X., Yanjiang, Y.Li, Lu, T., and Pan, L., From metal-organic frameworks to porous carbons: A promising strategy to prepare high-performance electrode materials for capacitive deionization, Carbon, 2016, vol. 108, p. 433.
Xu, X., Pan, L., Liu, Y., Lu, T., and Sun, Z., Enhanced capacitive deionization performance of graphene by nitrogen doping, J. Colloid Interface Science, 2015, vol. 445, p. 143.
Zhao, S., Yan, T., Wang, H., Chen, G., Huang, L., Zhang, J., Shi, L., Zhao, D.Z.S., Yan, T., Wang, H., Chen, G., Huang, L., Zhang, J., Shi, L. and Zhang, D., High capacity and high rate capability of nitrogen-doped porous hollow carbon spheres for capacitive deionization, Applied Surface Science, 2016, vol. 369, p. 460.
Liu, Y., Chen, T., Lu, T., Sun, Z., Chua, D.H.C. and Panm, L., Nitrogen-doped porous carbon spheres for highly efficient capacitive deionization, Electrochimica Acta, 2015, vol. 158, p. 403.
Li, Y., Hussain, I., Qi, J., Liu, C., Li, J., Shen, J., Sun, X., Han, W., and Wang, L., N-doped hierarchical porous carbon derived from hypercrosslinked diblock copolymer for capacitive deionization, Separation and Purification Technology, 2016, vol. 165, p. 190.
Wu, T., Wang, G., Dong, Q., Qian, B., Meng, Y. and Qiu, J., Asymmetric capacitive deionization utilizing nitric acid treated activated carbon fiber as the cathode, Electrochimica Acta, 2015, vol. 176, p. 426.
Niu, R., Li, H., Ma, Y., He, L., and Li, J. An insight into the improved capacitive deionization performance of activated carbon treated by sulfuric acid, Electrochimica Acta, 2015, vol. 176, p. 755.
Wang, G., Pana, C., Wang, L., Dong, Q., Yu, C., Zhao, Z. and Qiu, J., Activated carbon nanofiber webs made by electrospinning for capacitive deionization, Electrochimica Acta, 2012, vol. 69, p. 65.
Nadakatti, S., Tendulkar, M. and Kadam, M., Use of mesoporous conductive carbon black to enhance performance of activated carbon electrodes in capacitive deionization technology, Desalination, 2011, vol. 268, p. 182.
Oh, H.-J., Lee, J.-H., Ahn, H.-J., Jeong, Y., Kim, Y.-J., and Chi, C.-S., Nanoporous activated carbon cloth for capacitive deionization of aqueous solution, Thin Solid Films, 2006, vol. 515, p. 220.
Dong, Q., Wang, G., Qian, B., Hu, C., Wang, Y., and Qiu, J., Electrospun Composites Made of Reduced Graphene Oxide and Activated Carbon Nanofibers for Capacitive Deionization, Electrochimica Acta, 2014, vol. 137, p. 388.
Dong, Q., Wang, G., Wu, T., Peng, S. and Qiu, J., Enhancing capacitive deionization performance of electrospun activated carbon nanofibers by coupling with carbon nanotubes, J. Colloid Interface Science, 2015, vol. 446, p. 373.
Liu, X, Chen, T., Qiao, W., Wang, Z., and Yu, L., Fabrication of graphene/activated carbon nanofiber composites for high performance capacitive deionization, J. Taiwan Institute Chemical Engineers, 2017, vol. 72, p. 213.
Вольфкович, Ю.М., Пономарев, Ив.И., Сосенкин, В.Е., Пономарев, И.И., Скупов, К.М., Разоренов, Д.Ю. Исследование пористой структуры нановолокнистых электроспиннинговых материалов на основе полиакрилонитрила методом эталонной контактной порометрии. Физикохимия поверхности и защита материалов. 2019. Т. 55. С. 100. [Volfkovich, Yu.M., Ponomarev, Iv.I., Sosenkin, V.E. Ponomarev, I.I., Skupov, K.M., and Razorenov, D.Yu., A Porous Structure of Nanofibrous Electrospun Polyacrylonitrile-Based Materials: a Standard Contact Porosimetry Study, Protection of Metals and Physical Chemistry of Surfaces, 2019, vol. 55, p. 194].
Gao, Y., Pan, L., Li, H., Zhang,Y., Zhang, Z., Chen, Y. and Sun, Z., Electrosorption behavior of cations with carbon nanotubes and carbon nanofibres composite film electrodes, Thin Solid Films, 2009, vol, 517, p. 1616.
Pan, L., Wang, X., Gao, Y., Zhang, Y., Chen, Y., and Sun, Z., Electrosorption of anions with carbon nanotube and nanofibre composite film electrodes, Desalination, 2009, vol. 244, p. 139.
Li, H., Pan, L., Zhang, Y., Zou, L., Sun, C., Zhan, Y. and Sun, Z., Kinetics and thermodynamics study for electrosorption of NaCl onto carbon nanotubes and carbon nanofibers electrodes, Chemical Physics Letters, 2010, vol. 485, p. 161.
Вольфкович, Ю.М., Рычагов, А.Ю., Сосенкин, В.Е., Крестинин, А.В. Силовой электрохимический суперконденсатор на основе углеродных нанотрубок. Электрохимическая энергетика. 2008. Т. 8. С. 106.
Вольфкович, Ю.М., Рычагов, А.Ю., Сосенкин, В.Е., Ефимов, О.Н., Осьмаков, М.И., Селиверстов, А.Ф. К вопросу об измерении удельной поверхности углеродных наноматериалов. Электрохимия. 2014. Т. 50. С. 1222. [Volfkovich, Yu.M. Rychagov, A.Yu., Sosenkin, V.E., Efimov, O.N., Os’makov, M.I., and Seliverstov, A.F., Measuring the Specific Surface Area of Carbon Nanomaterials by Different Methods, Russ. J. Electrochemistry, 2014, vol. 50, p. 1099.]
Wang, Z., Dou, B., Zheng, L., Zhang, G., Liu, Z., and Hao, Z., Effective desalination by capacitive deionization with functional graphene nanocomposite as novel electrode material, Desalination, 2012, vol. 299, p. 96.
Mohanapriya, K., Ghosh, G., and Jha, N., Solar light reduced Graphene as high energy density supercapacitor and capacitive deionization electrode, Electrochimica Acta, vol. 209, p. 719.
Xu, X., Liu, Y., Wang, M., Zhu, C., Lu, T., Zhao, R., and Pan, L., Hierarchical hybrids with microporous carbon spheres decorated three-dimensional graphene frameworks for capacitive applications in supercapacitor and deionization, Electrochimica Acta, 2016, vol. 193, p. 88.
Yasin, A.S., Mohamed, H.O., Mohamed, I.M.A., Mousa, H.M., and Barakat, A.M., Enhanced desalination performance of capacitive deionization using zirconium oxide nanoparticles-doped graphene oxide as a novel and effective electrode, Separation and Purification Technology, 2016, vol. 171, p. 34.
Wang, G., Dong, Q., Wu, T., Zhan, F., Zhou, M. and Qiu, J., Ultrasound-assisted preparation of electrospun carbon fiber/graphene electrodes for capacitive deionization: Importance and unique role of electrical conductivity, Carbon, 2016, vol. 103, p. 311.
Ma, J., Wang, L., and Yu, F., Water-enhanced performance in capacitive deionization for desalination based on graphene gel as electrode material, Electrochimica Acta, 2018, vol. 263, p. 40.
Li, H., Pan, L., Lu, T., Zhan, Y., Nie, C., and Sun, Z., Hierarchical hole-enhanced 3D graphene assembly for highly efficient capacitive deionization, Carbon, 2018, vol. 129, p. 95.
Li, H., Pan, L., Lu, T., Zhan, Y., Nie, C., and Sun, Z., A comparative study on electrosorptive behavior of carbon nanotubes and graphene for capacitive deionization. J. Electroanalytical Chemistry, 2011, vol. 653, p. 40.
Rana, P., Mohan, N., and Rajagopal, C, Electrochemical removal of chromium from wastewater by using carbon aerogel electrodes, Water Res., 2004, vol. 38, p. 2811.
Liu, Y., Chen, T., Lu, T., Sun, Z., Chua, D.H.C, and Pan, L., Nitrogen-doped porous carbon spheres for highly efficient capacitive deionization, Electrochimica Acta, 2015, vol. 158, p. 403.
Liu, Y., Pan, L., Chen, T., Xu, X., Lu, T., Sun, Z., and Chua, D.H.C., Porous carbon spheres via microwave-assisted synthesis for capacitive deionization, Electrochimica Acta, vol. 151, p. 489.
Huang, Z., Lu, L., Cai, Z. and Jason Ren, Z.J., Individual and competitive removal of heavy metals using capacitive deionization, J. Hazardous Materials, 2016, vol. 302, p. 323.
Huang, S.-Y., Fan, C.-S., and Hou, C.-H., Electro-enhanced removal of copper ions from aqueous solutions by capacitive deionization, J. Hazardous Materials, 2014, vol. 278, p. 8.
Fan, C.-S., Liou, S.Y.H., and Hou, S.-H., Capacitive deionization of arsenic-contaminated groundwater in a single-pass mode, Chemosphere, 2017, vol. 184, p. 924.
Foo, K.Y. and Hameed, B.H., A short review of activated carbon assisted electrosorption process: An overview, current stage and future prospects, J. Hazardous Materials, 2009, vol. 170, p. 552.
Litter, M.I. and Morgada, M.E., Possible treatments for arsenic removal in Latin American waters for human consumption, Jochen Bundschuh. Environmental Pollution, 2010, vol. 158, p. 1105.
Watson, K., Farré, M.J., and Knight, N., Strategies for the removal of halides from drinking water sources, and their applicability in disinfection by-product minimisation: A critical review, J. Environmental Management, 2012, vol. 110, p. 276.
Biesheuvel, P.M., Thermodynamic cycle analysis for capacitive deionization, J. Colloid Interface Science, vol. 332, p. 258.
Avraham, E., Noked, M., Bouhadana, Y., Soffer, A. and Aurbach, D., Limitations of charge efficiency in capacitive deionization processes III: The behavior of surface oxidized activated carbon electrodes, Electrochimica Acta, 2010, vol. 56, p. 441.
He, F., Biesheuvel, P.M., Bazant, M.Z. and Hatton, T.A., Theory of water treatment by capacitive deionization with redox active porous electrodes, Water Research, vol. 132, p. 282.
Hou, C.-H. and Huang, C.-Y., A comparative study of electrosorption selectivity of ions by activated carbon electrodes in capacitive deionization, Desalination, vol. 314, p. 124.
Wu, T., Wang, G., Zhan, F., Dong, Q., Ren, Q., Wang, J., and Qiu, J., Surface-treated carbon electrodes with modified potential of zero charge for capacitive deionization, Water Research, 2016, vol. 93, p. 30.
Yang, K.-L., Ying, T.-Y., Yiacoumi, S., Tsouris, C., and Vittoratos, E.S., Electrosorption of Ions from Aqueous Solutionsby Carbon Aerogel: An Electrical Double-Layer Model, Langmuir, 2001, p. 1961.
Biesheuvel, P. M., Porada, S., Levi, M., and, Bazant, M.Z., Attractive forces in microporous carbon electrodes for capacitive deionization, J. Solid State Electrochem, 2014, vol. 18, p. 1365.
Дамаскин, Б.Б., Петрий, О.А., Цирлина. Электрохимия. “Химия”. Москва. 2008.
Diego, A.H., Oyarzun, I., Palko, J.Y., Hawks, S.A., Stadermann, M. and Santiago, J.G., Equilibria model for pH variations and ion adsorption in capacitive deionization electrodes, Water Res., 2017, vol. 122, p. 387.
Zhang, C., He, D., Ma, Tang, W., and Waite, T.D., Faradaic reactions in capacitive deionization (CDI) – problems and possibilities: A review, Water Res., vol. 128, p. 314.
Wang, L., Wang, M., Huang, Z.-H., Cui, T., Gui, Kang, F., Wang, K., and Wu, D., Capacitive deionization of NaCl solutions using carbon nanotube sponge electrodes, J. Mater. Chem., 2011, vol. 21, p. 18295.
Ying, L., Qiang, X., Wen, Y., Yan, W., Zhonghua, Z., Ying, L., Qiang, X., Wen, Y., Yan, W. and Zhonghua, Adsorption of K+ from an aqueous phase onto an activated carbon used as an electric double-layer capacitor electrode, Mining Science and Technology, 2010, vol. 20, p. 551.
Вольфкович, Ю.М., Михалин, А.А., Рычагов, А.Ю. Измерение поверхностной проводимости пористых углеродных электродов. Электрохимия. 2013. Т. 49. С. 667. [Volfkovich, Yu.M., Mikhalin, A.A.,and Rychagov, A.Yu., Surface Conductivity Measurements for Porous Carbon Electrodes, Russian J. Electrochemistry, 2013, vol. 49, p. 594.]
Zhang, H., Liang, P., Bian, Y., Sun, X., Ma, J., Jiang and Huang, X., Enhancement of salt removal in capacitive deionization cell through periodically alternated oxidation of electrodes, Separation and Purification Technology, 2018, vol. 194, p. 451.
Xu, P., Drewes, J.E., Heil, D. and Wang, G., Treatment of brackish produced water using carbon aerogel-based capacitive deionization technology, Water Res., 2008, vol. 42, p. 2605.
Zhao, R., Porada, S., Biesheuvel, P.M., van der Wal, A., Energy consumption in membrane capacitive deionization for different water recoveries and flow rates, and comparison with reverse osmosis, Desalination. 2013, vol. 330, p. 35.
https://en.wikipedia.org/wiki/Capacitive_deionization.
Al Marzooqi, F.A., Al Ghaferi, A.A., Saadat, I., and Hilal, N., Application of Capacitive Deionisation in water desalination: A review, Desalination, 2014, vol. 342, p. 3.
Virapan, R., Saravanane, V., Murugaiyan, Treatment of Reverse Osmosis Reject Water from Industries, Intern. J. Applied Environmental Sciences, 2017, vol. 12, p. 489.
Dietz, S., Design, Service and Manufacturing Grantees and Research Conference, Proceedings of the 2004 NSF. Birmingham, AL, January 2004.
http://www.atlantiswater.com/.
https://product.statnano.com/company/idropan%20 dell%E2%80%99orto%20depuratori%20srl%20water.
https://www.desalination.biz/60421/d/EST-Water-and-Technologies-Company-Ltd.
Дополнительные материалы отсутствуют.