Электрохимия, 2020, T. 56, № 10, стр. 869-879
Влияние комплексообразования на массоперенос при электроосаждении металла на вращающемся дисковом электроде
В. М. Волгин a, b, *, А. Д. Давыдов b, **
a Тульский государственный университет
300012 Тула, просп. Ленина, 92, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
* E-mail: volgin@tsu.tula.ru
** E-mail: davydov@elchem.ac.ru
Поступила в редакцию 19.08.2019
После доработки 19.12.2019
Принята к публикации 20.02.2020
Аннотация
Проведено теоретическое исследование влияния комплексоообразования на массоперенос при электроосаждении металла на вращающемся дисковом электроде из раствора, содержащего три сорта ионов (катион металла, катионный комплекс и неэлектроактивный анион). В качестве математической модели использованы приведенные к безразмерному виду уравнения Нернста–Планка в приближении электронейтральности раствора, учитывающие электродиффузионный и конвективный перенос всех сортов ионов, а также гомогенную реакция комплексообразования. Для учета кинетики электрохимических реакций использовали уравнения Батлера–Фольмера. В отличие от известных работ не были использованы приближения слоя Нернста, равенства коэффициентов диффузии всех сортов ионов и равновесия реакции комплексообразования. В результате численного решения получены распределения концентраций, потенциала и скорости реакции комплексообразования при различных значениях параметров рассматриваемой системы. Показано, что наиболее сильное влияние на массоперенос оказывают константы равновесия и скорости реакции комплексообразования, а также соотношение коэффициентов диффузии комплексного катиона и аниона.
ВВЕДЕНИЕ
При электроосаждении металлов и сплавов достаточно широко используются растворы, содержащие комплексы ионов металла с отрицательно заряженными лигандами [1, 2]. Процессы массопереноса в растворах с комплексами включают гомогенные химические реакции и потоки лигандов, возникающие при восстановлении комплексов, что позволяет существенно повысить эффективность электрохимических процессов за счет реализации электро- и автокатализа, эффекта экзальтации [3–14]. В работах Харкаца и Бека с соавторами [3, 4, 6, 7, 9–11] было теоретически показано и экспериментально подтверждено, что электромиграция может значительно увеличить значение предельной плотности тока в случае электровосстановления катионов из растворов, содержащих комплексы, а при определенных условиях предельный ток может вообще отсутствовать [3]. В этих работах при теоретическом анализе массопереноса в условиях комплексообразования использовались упрощенные математические модели (приближение диффузионного слоя Нернста, условие равновесия реакции комплексообразования, равенство коэффициентов диффузии всех компонентов), что позволило в ряде случаев получить приближенные аналитические решения. В частности, Ю.И. Харкац провел теоретическое исследование особенностей электромиграции и комплексообразования в реакциях восстановления катионов на примере трехкомпонентной электрохимической системы, содержащей двухзарядные катионы, однозарядные анионы и комплексные катионы [9]. В указанной работе были получены аналитические решения электродиффузионной задачи при отсутствии и при избытке фонового электролита.
Очень часто приближения, принятые в упрощенных математических моделях, не выполняются: ионы имеют существенно различающиеся значения коэффициентов диффузии, наряду с электродиффузионным осуществляется и конвективный перенос компонентов, реакция комплексообразования является неравновесной, что может оказывать существенное влияние на закономерности массопереноса в условиях комплексообразования. В связи с этим представляет интерес исследование влияния гидродинамических условий, транспортных свойств и скорости гомогенной химической реакции на процессы переноса в условиях комплексообразования, которое можно выполнить только с использованием численных методов.
Настоящая работа посвящена теоретическому исследованию процессов массопереноса при электровосстановлении катионов металла на вращающемся дисковом электроде (ВДЭ) из раствора, содержащего катионные комплексы.
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ
Рассмотрим трехкомпонентную электрохимическую систему, содержащую электроактивные двухзарядные катионы ${{{\text{M}}}^{{2 + }}},$ электроактивные комплексные однозарядные катионы ${\text{M}}{{{\text{A}}}^{ + }},$ однозарядные анионы ${{{\text{A}}}^{ - }}.$
Будем считать, что на катоде протекают две электрохимические реакции:
(2)
${\text{M}}{{{\text{A}}}^{ + }} + 2{\text{e}} \to {\text{M}}{\kern 1pt} \downarrow + \,\,{{{\text{A}}}^{ - }},$Будем считать, что раствор получен из исходного вещества ${\text{M}}{{{\text{A}}}_{{\text{2}}}},$ которое не полностью диссоциирует в растворе по второй ступени с образованием трех сортов ионов (${{{\text{M}}}^{{2 + }}},$ ${\text{M}}{{{\text{A}}}^{ + }}$ и ${{{\text{A}}}^{ - }}$).
В одномерном приближении уравнения, описывающие процессы переноса вблизи ВДЭ, имеют следующий вид [15]:
(4)
$\begin{gathered} \frac{{\partial {{c}_{{\text{M}}}}}}{{\partial t}} = {{D}_{{\text{M}}}}\frac{{{{\partial }^{2}}{{c}_{{\text{M}}}}}}{{\partial {{z}^{2}}}} + \frac{{2F{{D}_{{\text{M}}}}}}{{RT}}\frac{\partial }{{\partial z}}\left( {{{c}_{{\text{M}}}}\frac{{\partial \varphi }}{{\partial z}}} \right) - {{v}_{z}}\frac{{\partial {{c}_{{\text{M}}}}}}{{\partial z}} + q, \hfill \\ \frac{{\partial {{c}_{{{\text{MA}}}}}}}{{\partial t}} = {{D}_{{{\text{MA}}}}}\frac{{{{\partial }^{2}}{{c}_{{{\text{MA}}}}}}}{{\partial {{z}^{2}}}} + \frac{{F{{D}_{{{\text{MA}}}}}}}{{RT}}\frac{\partial }{{\partial z}}\left( {{{c}_{{{\text{MA}}}}}\frac{{\partial \varphi }}{{\partial z}}} \right) - {{v}_{z}}\frac{{\partial {{c}_{{{\text{MA}}}}}}}{{\partial z}} - q, \hfill \\ \frac{{\partial {{c}_{{\text{A}}}}}}{{\partial t}} = {{D}_{{\text{A}}}}\frac{{{{\partial }^{2}}{{c}_{{\text{A}}}}}}{{\partial {{z}^{2}}}} - \frac{{F{{D}_{{\text{A}}}}}}{{RT}}\frac{\partial }{{\partial z}}\left( {{{c}_{{\text{A}}}}\frac{{\partial \varphi }}{{\partial z}}} \right) - {{v}_{z}}\frac{{\partial {{c}_{{\text{A}}}}}}{{\partial z}} + q, \hfill \\ \end{gathered} $В рамках приближения электронейтральности раствора выполняется следующее соотношение:
Источниковый член q для гомогенной химической реакции (3) можно представить в следующем виде:
где $k,$ $\beta $ – константы скорости и равновесия реакции комплексообразования (3) соответственно.Нормальная к поверхности ВДЭ составляющая гидродинамической скорости определяется с использованием следующего соотношения [16]:
где ω = 2πn/60 – угловая скорость ВДЭ; n – количество оборотов ВДЭ в минуту; ν – кинематическая вязкость раствора.Граничные условия для системы уравнений (4) могут быть заданы в следующем виде:
– в объеме раствора электролита $\left( {z = \infty } \right)$
(8)
${{c}_{{\text{M}}}} = {{c}_{{{\text{M}},b}}},{\text{ }}{{c}_{{{\text{MA}}}}} = {{c}_{{{\text{MA}},b}}},{\text{ }}{{c}_{{\text{A}}}} = {{c}_{{{\text{A}},b}}},{\text{ }}\varphi = 0$,– на ВДЭ $\left( {z = 0} \right)$
(9)
$\begin{gathered} {{N}_{{\text{M}}}} = - {{D}_{{\text{M}}}}\left( {\frac{{\partial {{c}_{{\text{M}}}}}}{{\partial z}} + \frac{{2F}}{{RT}}{{c}_{{\text{M}}}}\frac{{\partial \varphi }}{{\partial z}}} \right) = \frac{{{{i}_{{\text{M}}}}}}{{2F}}, \hfill \\ {{N}_{{{\text{MA}}}}} = - {{D}_{{{\text{MA}}}}}\left( {\frac{{\partial {{c}_{{{\text{MA}}}}}}}{{\partial z}} + \frac{F}{{RT}}{{c}_{{{\text{MA}}}}}\frac{{\partial \varphi }}{{\partial z}}} \right) = \frac{{{{i}_{{{\text{MA}}}}}}}{{2F}}, \hfill \\ {{N}_{{\text{A}}}} = - {{D}_{{\text{A}}}}\left( {\frac{{\partial {{c}_{{\text{A}}}}}}{{\partial z}} - \frac{F}{{RT}}{{c}_{{\text{A}}}}\frac{{\partial \varphi }}{{\partial z}}} \right) = - \frac{{{{i}_{{{\text{MA}}}}}}}{{2F}}, \hfill \\ \end{gathered} $Кинетику электрохимических реакций (1) и (2) будем задавать с использованием уравнений Батлера–Фольмера:
(10)
$\begin{gathered} {{i}_{{\text{M}}}} = {{i}_{{{\text{M,0}}}}}\left[ {\exp \left[ {\frac{{2{{\alpha }_{{\text{M}}}}F}}{{RT}}\left( {u - {{\varphi }_{0}}} \right)} \right]} \right. - \\ - \,\,\left. {\left( {\frac{{{{c}_{{{\text{M,0}}}}}}}{{{{c}_{{{\text{M}},b}}}}}} \right)\exp \left[ { - \frac{{2\left( {1 - {{\alpha }_{{\text{M}}}}} \right)F}}{{RT}}\left( {u - {{\varphi }_{0}}} \right)} \right]} \right], \\ {{i}_{{{\text{MA}}}}} = {{i}_{{{\text{MA,0}}}}}\left[ {\exp \left[ {\frac{{2{{\alpha }_{{{\text{MA}}}}}F}}{{RT}}\left( {u - {{\varphi }_{0}}} \right)} \right]} \right. - \\ - \,\,\left. {\left( {\frac{{{{c}_{{{\text{MA,0}}}}}}}{{{{c}_{{{\text{MA}},b}}}}}} \right)\exp \left[ { - \frac{{2\left( {1 - {{\alpha }_{{{\text{MA}}}}}} \right)F}}{{RT}}\left( {u - {{\varphi }_{0}}} \right)} \right]} \right], \\ \end{gathered} $Суммарная плотность тока электровосстановления металла на вращающемся дисковом электроде равна
Для удобства численного решения и анализа результатов приведем уравнения математической модели к безразмерному виду. При этом в качестве единицы концентрации будем использовать полную концентрацию металла в растворе ${{c}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}},b}}}$ (равную концентрации исходного вещества MA2), в качестве единицы потенциала RT/F. В качестве единицы длины будем использовать толщину диффузионного слоя, которая согласно теории Левича определяется следующим соотношением [16]:
В результате перехода к безразмерным переменным будем иметь:
(13)
$\begin{gathered} \frac{{\partial {{C}_{{\text{M}}}}}}{{\partial \tau }} = {{{\bar {D}}}_{{\text{M}}}}\frac{{{{\partial }^{2}}{{C}_{{\text{M}}}}}}{{\partial {{Z}^{2}}}} + 2{{{\bar {D}}}_{{\text{M}}}}\frac{\partial }{{\partial Z}}\left( {{{C}_{{\text{M}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) + a{{Z}^{2}}\frac{{\partial {{C}_{{\text{M}}}}}}{{\partial Z}} + Q, \\ \frac{{\partial {{C}_{{{\text{MA}}}}}}}{{\partial \tau }} = {{{\bar {D}}}_{{{\text{MA}}}}}\frac{{{{\partial }^{2}}{{C}_{{{\text{MA}}}}}}}{{\partial {{Z}^{2}}}} + {{{\bar {D}}}_{{{\text{MA}}}}}\frac{\partial }{{\partial Z}}\left( {{{C}_{{{\text{MA}}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) + \\ + \,\,a{{Z}^{2}}\frac{{\partial {{C}_{{{\text{MA}}}}}}}{{\partial Z}} - Q, \\ \frac{{\partial {{C}_{{\text{A}}}}}}{{\partial \tau }} = {{{\bar {D}}}_{{\text{A}}}}\frac{{{{\partial }^{2}}{{C}_{{\text{A}}}}}}{{\partial {{Z}^{2}}}} - {{{\bar {D}}}_{{\text{A}}}}\frac{\partial }{{\partial Z}}\left( {{{C}_{{\text{A}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) + a{{Z}^{2}}\frac{{\partial {{C}_{{\text{A}}}}}}{{\partial Z}} + Q, \\ \end{gathered} $Взаимосвязь между размерными и безразмерными переменными и параметрами устанавливается с помощью следующих соотношений:
(15)
$\begin{gathered} {{C}_{m}} = \frac{{{{c}_{m}}}}{{{{c}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}},b}}}}},{\text{ }}Z = \frac{z}{\delta },{\text{ }}\tau = \frac{{{{D}_{{\text{M}}}}}}{{{{\delta }^{2}}}}t,{\text{ }} \\ {{{\bar {D}}}_{m}} = \frac{{{{D}_{m}}}}{{{{D}_{{\text{M}}}}}},{\text{ }}\Phi = \frac{F}{{RT}}\varphi ,{\text{ }} \\ {\text{ }}K = \frac{{k{{\delta }^{2}}}}{{{{D}_{{\text{M}}}}}},{\text{ }}B = {{c}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}},b}}}\beta ,{\text{ }}Q = K({{C}_{{{\text{MA}}}}} - B{{C}_{{\text{M}}}}{{C}_{{\text{A}}}}). \\ \end{gathered} $Граничные условия (8)–(10) в безразмерном виде примут вид:
– в объеме раствора электролита $\left( {Z = \infty } \right)$
(16)
${{C}_{{\text{M}}}} = {{C}_{{{\text{M}},b}}},{\text{ }}{{C}_{{{\text{MA}}}}} = {{C}_{{{\text{MA}},b}}},{\text{ }}{{C}_{{\text{A}}}} = {{C}_{{{\text{A}},b}}},{\text{ }}\Phi = 0$,– на ВДЭ $\left( {Z = 0} \right)$
(17)
$\begin{gathered} {{{\bar {N}}}_{{\text{M}}}} = - {{{\bar {D}}}_{{\text{M}}}}\left( {\frac{{\partial {{C}_{{\text{M}}}}}}{{\partial Z}} + 2{{C}_{{\text{M}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = - {{I}_{{\text{M}}}}, \hfill \\ {{{\bar {N}}}_{{{\text{MA}}}}} = - {{{\bar {D}}}_{{{\text{MA}}}}}\left( {\frac{{\partial {{C}_{{{\text{MA}}}}}}}{{\partial Z}} + {{C}_{{{\text{MA}}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = - {{I}_{{{\text{MA}}}}}, \hfill \\ {{{\bar {N}}}_{{\text{A}}}} = - {{{\bar {D}}}_{{\text{A}}}}\left( {\frac{{\partial {{C}_{{\text{A}}}}}}{{\partial Z}} - {{C}_{{\text{A}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = {{I}_{{{\text{MA}}}}}, \hfill \\ \end{gathered} $(18)
$\begin{gathered} {{I}_{{\text{M}}}} = - {{I}_{{{\text{M,0}}}}}\left[ {\exp \left[ {2{{\alpha }_{{\text{M}}}}\left( {U - {{\Phi }_{0}}} \right)} \right] - _{{_{{_{{_{{}}}}}}}}^{{^{{^{{^{{}}}}}}}}} \right. \\ \left. { - \,\,\left( {\frac{{{{C}_{{{\text{M,0}}}}}}}{{{{C}_{{{\text{M}},b}}}}}} \right)\exp \left[ { - 2\left( {1 - {{\alpha }_{{\text{M}}}}} \right)\left( {U - {{\Phi }_{0}}} \right)} \right]} \right], \\ {{I}_{{{\text{MA}}}}} = - {{I}_{{{\text{MA,0}}}}}\left[ {\exp \left[ {2{{\alpha }_{{{\text{MA}}}}}\left( {U - {{\Phi }_{0}}} \right)} \right] - _{{_{{_{{_{{_{{}}}}}}}}}}^{{^{{^{{^{{}}}}}}}}} \right. \\ \left. { - \left( {\frac{{{{C}_{{{\text{MA,0}}}}}}}{{{{C}_{{{\text{MA}},b}}}}}} \right)\exp \left[ { - 2\left( {1 - {{\alpha }_{{{\text{MA}}}}}} \right)\left( {U - {{\Phi }_{0}}} \right)} \right]} \right], \\ \end{gathered} $Значения безразмерных концентраций в объеме раствора электролита определяются по концентрациям исходных веществ и условию равновесия реакции комплексообразования [9]:
(19)
$\begin{gathered} {{C}_{{{\text{M}},b}}} + {{C}_{{{\text{MA}},b}}} = 1,\,\,\,\,{{C}_{{{\text{MA}},b}}} + {{C}_{{{\text{A}},b}}} = 2, \\ {{C}_{{{\text{MA,}}b}}} = B{{C}_{{{\text{M,}}b}}}{{C}_{{{\text{A,}}b}}}. \\ \end{gathered} $В результате решения системы уравнений (19) будем иметь:
(20)
$\begin{gathered} {{C}_{{{\text{M,}}b}}} = {{ - (1 + {{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} B}} \right. \kern-0em} B})} \mathord{\left/ {\vphantom {{ - (1 + {{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} B}} \right. \kern-0em} B})} 2}} \right. \kern-0em} 2} + \sqrt {{{{{{(1 + {{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} B}} \right. \kern-0em} B})}}^{2}}} \mathord{\left/ {\vphantom {{{{{(1 + {{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} B}} \right. \kern-0em} B})}}^{2}}} 4}} \right. \kern-0em} 4} + {1 \mathord{\left/ {\vphantom {1 B}} \right. \kern-0em} B}} , \\ {{C}_{{{\text{MA}},b}}} = 1 - {{C}_{{{\text{M}},b}}},\,\,\,\,{{C}_{{{\text{A}},b}}} = {{C}_{{{\text{M}},b}}} + 1. \\ \end{gathered} $В качестве начальных условий будем принимать равномерные распределения концентраций вблизи поверхности ВДЭ, значения которых равны их объемным значениям:
(21)
$\begin{gathered} {{C}_{{\text{M}}}}(Z,0) = {{C}_{{{\text{M}},b}}},{\text{ }}{{C}_{{{\text{MA}}}}}(Z,0) = {{C}_{{{\text{MA}},b}}},{\text{ }} \\ {{C}_{{\text{A}}}}(Z,0) = {{C}_{{{\text{A}},b}}}. \\ \end{gathered} $В результате решения предлагаемой математической модели могут быть определены распределения концентраций и потенциала, а также получены зависимости плотности тока
от приложенного потенциала ВДЭ при различных значениях параметров.Математическая модель (13)–(22) является обобщением модели, рассмотренной Харкацом [9], так как в ней: 1) не использовано приближение диффузионного слоя Нернста, имеющего одинаковую толщину для всех сортов ионов; 2) не использовано условие равенства коэффициентов диффузии всех сортов ионов и 3) не использовано условие равновесия гомогенной химической реакции.
При $a = 0$ получаем систему уравнений, описывающую процессы переноса в неподвижном растворе, т.е. в диффузионном слое Нернста. При исключении из системы уравнений (13) миграционных членов получаем систему уравнений переноса в растворе с избытком фонового электролита, а при исключении производных по времени получаем систему уравнений, описывающих процессы переноса в стационарных условиях.
МЕТОД ЧИСЛЕННОГО РЕШЕНИЯ
Ввиду нелинейности уравнений переноса, обусловленной миграционными и источниковыми членами, аналитическое решение предлагаемой модели не может быть получено. Численное решение предложенной математической модели осуществлялось методом конечных объемов [17] с использованием неравномерной сетки. Размер расчетной области принимался равным ${{Z}_{{\max }}} = 3,$ что обеспечивало независимость результатов расчетов от конечного размера расчетной области. При расчетах использовалась сетка, состоящая из 1000–5000 узлов, шаг которой изменялся в геометрической прогрессии от 10–6 (у поверхности ВДЭ) до 0.05 (на внешней границе расчетной области).
Для каждого конечного объема использовались следующие разностные уравнения, обладающие свойством консервативности:
(23)
$\begin{gathered} C_{{m,i}}^{{n + 1}} = - \frac{{2\Delta t}}{{{{h}_{i}} + {{h}_{{i + 1}}}}}\left( {\bar {N}_{{m,i + }}^{{n + 1}} - \bar {N}_{{m,i - }}^{{n + 1}}} \right) + \Delta tQ_{{m,i}}^{{n + 1}}, \\ \sum\limits_{m = 1}^3 {{{z}_{m}}} C_{{m,i}}^{{n + 1}} = - \sum\limits_{m = 1}^3 {{{z}_{m}}} \frac{{2\Delta t}}{{{{h}_{i}} + {{h}_{{i + 1}}}}}\left( {\bar {N}_{{m,i + }}^{{n + 1}} - \bar {N}_{{m,i - }}^{{n + 1}}} \right) = 0, \\ \end{gathered} $В соответствии с уравнениями (16), граничные условия на внешней границе расчетной области (Z = 3) задавались в следующем виде:
(24)
$\begin{gathered} C_{{{\text{M,}}N}}^{{n + 1}} = {{C}_{{{\text{M}},b}}},\,\,\,\,C_{{{\text{MA,}}N}}^{{n + 1}} = {{C}_{{{\text{MA}},b}}}, \\ C_{{{\text{A,}}N}}^{{n + 1}} = {{C}_{{{\text{A}},b}}},\,\,\,\,\Phi _{N}^{{n + 1}} = 0, \\ \end{gathered} $На поверхности ВДЭ использовались следующие уравнения, выражающие граничные условия (17):
(25)
$\begin{gathered} C_{{m,0}}^{{n + 1}} = - \frac{{2\Delta t}}{{{{h}_{1}}}}\left( {\bar {N}_{{m,0 + }}^{{n + 1}} - \bar {N}_{{m,0}}^{{n + 1}}} \right) + \Delta tQ_{{m,0}}^{{n + 1}}, \\ \sum\limits_{m = 1}^3 {{{z}_{m}}} C_{{m,0}}^{{n + 1}} = - \frac{{2\Delta t}}{{{{h}_{1}}}}\sum\limits_{m = 1}^3 {{{z}_{m}}} \left( {\bar {N}_{{m,0 + }}^{{n + 1}} - \bar {N}_{{m,0}}^{{n + 1}}} \right) = 0. \\ \end{gathered} $Потоки через границы конечных объемов рассчитывались с использованием следующих соотношений:
(26)
$\begin{gathered} \bar {N}_{{m,i + }}^{{n + 1}} = - {{{\bar {D}}}_{m}}\left( {\frac{{C_{{m,i + 1}}^{{n + 1}} - C_{{m,i}}^{{n + 1}}}}{{{{h}_{{i + 1}}}}} + } \right. \\ \left. { + \,\,{{z}_{m}}\frac{{C_{{m,i}}^{{n + 1}} + C_{{m,i + 1}}^{{n + 1}}}}{2}\frac{{\Phi _{{i + 1}}^{{n + 1}} - \Phi _{i}^{{n + 1}}}}{{{{h}_{{i + 1}}}}}} \right) - aZ_{i}^{2}C_{{m,i + 1}}^{{n + 1}}, \\ \bar {N}_{{m,i - }}^{{n + 1}} = - {{{\bar {D}}}_{m}}\left( {\frac{{C_{{m,i}}^{{n + 1}} - C_{{m,i - 1}}^{{n + 1}}}}{{{{h}_{i}}}} + } \right. \\ \left. { + \,\,{{z}_{m}}\frac{{C_{{m,i - 1}}^{{n + 1}} + C_{{m,i}}^{{n + 1}}}}{2}\frac{{\Phi _{i}^{{n + 1}} - \Phi _{{i - 1}}^{{n + 1}}}}{{{{h}_{i}}}}} \right) - aZ_{i}^{2}C_{{m,i}}^{{n + 1}}, \\ \bar {N}_{{{\text{M}},0}}^{{n + 1}} = - I_{{\text{M}}}^{{n + 1}},\,\,\,\,\bar {N}_{{{\text{MA}},0}}^{{n + 1}} = - I_{{{\text{MA}}}}^{{n + 1}},\,\,\,\,\bar {N}_{{{\text{A}},0}}^{{n + 1}} = I_{{{\text{MA}}}}^{{n + 1}}, \\ \end{gathered} $Итерационное численное решение нелинейных разностных уравнений осуществлялось методом Ньюмена [18] до получения решения с заданной точностью. Детальное описание процедуры численного решения приведено в предыдущих работах [19–21].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Математическая модель рассматриваемой электрохимической системы, приведенная к безразмерному виду и включающая систему уравнений (13), (14) с граничными условиями (16)–(20) и начальными условиями (21), содержит 9 безразмерных параметров (два коэффициента диффузии: ${{\bar {D}}_{{{\text{MA}}}}},$ ${{\bar {D}}_{{\text{A}}}}$ (${{\bar {D}}_{{\text{M}}}}$ = 1); два параметра гомогенной химической реакции: K, B; четыре параметра электрохимических реакций: IM, 0, IMA, 0, αM, αMA и один параметр $\bar {U},$ характеризующий условия проведения процесса (при достаточно больших значениях этого параметра может достигаться предельная плотность тока)).
Анализ влияния комплексообразования на массоперенос при восстановлении металла удобно начать с более простых моделей, позволяющих провести качественный анализ. Здесь мы ограничимся рассмотрением двух предельных случаев, для которых имеются простые аналитические решения:
– в растворе присутствуют только катионы металла и анионы (что соответствует предельному случаю B = 0),
– в растворе присутствуют только комплексы и анионы (что соответствует предельному случаю B = ∞).
В приближении слоя Нернста уравнения переноса при отсутствии в растворе комплексов могут быть представлены в следующем виде:
(27)
$\begin{gathered} {{{\bar {N}}}_{{\text{M}}}} = - {{{\bar {D}}}_{{\text{M}}}}\left( {\frac{{\partial {{C}_{{\text{M}}}}}}{{\partial Z}} + 2{{C}_{{\text{M}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = - {{I}_{{\text{M}}}}, \hfill \\ {{{\bar {N}}}_{{\text{A}}}} = - {{{\bar {D}}}_{{\text{A}}}}\left( {\frac{{\partial {{C}_{{\text{A}}}}}}{{\partial Z}} - {{C}_{{\text{A}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = 0, \hfill \\ {{C}_{{\text{A}}}} = 2{{C}_{{\text{M}}}}, \hfill \\ \end{gathered} $При достижении предельной плотности тока ${{\partial {{C}_{{\text{M}}}}} \mathord{\left/ {\vphantom {{\partial {{C}_{{\text{M}}}}} {\partial Z}}} \right. \kern-0em} {\partial Z}} = 1,$ что приводит к следующему значению предельной плотности тока ${{I}_{{\text{M}}}}$ = 3.
В приближении слоя Нернста уравнения переноса при отсутствии в растворе катионов металла могут быть представлены в следующем виде:
(29)
$\begin{gathered} {{{\bar {N}}}_{{{\text{MА}}}}} = - {{{\bar {D}}}_{{{\text{MА}}}}}\left( {\frac{{\partial {{C}_{{{\text{MА}}}}}}}{{\partial Z}} + {{C}_{{{\text{MА}}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = - {{I}_{{{\text{MА}}}}}, \hfill \\ {{{\bar {N}}}_{{\text{A}}}} = - {{{\bar {D}}}_{{\text{A}}}}\left( {\frac{{\partial {{C}_{{\text{A}}}}}}{{\partial Z}} - {{C}_{{\text{A}}}}\frac{{\partial \Phi }}{{\partial Z}}} \right) = {{I}_{{{\text{MА}}}}}, \hfill \\ {{C}_{{\text{A}}}} = {{C}_{{{\text{MА}}}}}, \hfill \\ \end{gathered} $(30)
$\frac{{\partial {{C}_{{{\text{MA}}}}}}}{{\partial Z}} = \frac{{{{{\bar {D}}}_{{\text{A}}}} - {{{\bar {D}}}_{{{\text{MA}}}}}}}{{2{{{\bar {D}}}_{{{\text{MA}}}}}{{{\bar {D}}}_{{\text{A}}}}}}{{I}_{{{\text{MA}}}}}.$При равенстве коэффициентов диффузии комплекса и аниона из соотношения (30) следует, что ${{\partial {{C}_{{{\text{MA}}}}}} \mathord{\left/ {\vphantom {{\partial {{C}_{{{\text{MA}}}}}} {\partial Z}}} \right. \kern-0em} {\partial Z}}$ = 0 при любом значении приложенного потенциала. Так как концентрация раствора не изменяется при прохождении тока, то предельный ток отсутствует. При различных значениях коэффициентов диффузии комплекса и аниона знак производной ${{\partial {{C}_{{{\text{MA}}}}}} \mathord{\left/ {\vphantom {{\partial {{C}_{{{\text{MA}}}}}} {\partial Z}}} \right. \kern-0em} {\partial Z}}$определяется знаком разности коэффициентов диффузии анионов и комплекса (${{\bar {D}}_{{\text{A}}}}$ – ${{\bar {D}}_{{{\text{MA}}}}}$).
При ${{\bar {D}}_{{\text{A}}}}$ > ${{\bar {D}}_{{{\text{MA}}}}}$ из соотношения (30) следует, что ${{\partial {{C}_{{{\text{MA}}}}}} \mathord{\left/ {\vphantom {{\partial {{C}_{{{\text{MA}}}}}} {\partial Z}}} \right. \kern-0em} {\partial Z}} > 0,$ т.е. по мере приближения к ВДЭ концентрация комплекса уменьшается и существует предельная плотность тока (при ${{\partial {{C}_{{{\text{MA}}}}}} \mathord{\left/ {\vphantom {{\partial {{C}_{{{\text{MA}}}}}} {\partial Z}}} \right. \kern-0em} {\partial Z}} = 1$):
(31)
${{I}_{{{\text{MA}}}}} = \frac{{2{{{\bar {D}}}_{{{\text{MA}}}}}{{{\bar {D}}}_{{\text{A}}}}}}{{{{{\bar {D}}}_{{\text{A}}}} - {{{\bar {D}}}_{{{\text{MA}}}}}}}.$При ${{\bar {D}}_{{\text{A}}}}$ < ${{\bar {D}}_{{{\text{MA}}}}}$ значение производной ${{\partial {{C}_{{{\text{MA}}}}}} \mathord{\left/ {\vphantom {{\partial {{C}_{{{\text{MA}}}}}} {\partial Z}}} \right. \kern-0em} {\partial Z}}$ является отрицательным, т.е. по мере приближения к ВДЭ концентрация увеличивается. При этом предельный ток отсутствует.
Качественный анализ предельных случаев показывает, что эффект комплексообразования на массоперенос существенно зависит от значений параметров рассматриваемой системы. Для оценки фактического эффекта требуется проведение анализа процессов переноса при конкретных значениях параметров. Для упрощения анализа рассматриваемой системы примем, что αM = αMA = 0.5. Для удобства сравнения с результатами, приведенными в работе Харкаца [9], примем ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015.$
На рис. 1 приведены безразмерные поляризационные кривые, полученные при ${{I}_{{{\text{MA,0}}}}} = 0.015,$ B = 2, ${{\bar {D}}_{{{\text{MA}}}}} = 1,$ ${{\bar {D}}_{{\text{A}}}} = 1$ и различных значениях константы скорости реакции комплексообразования и безразмерной плотности тока обмена реакции восстановления катионов металла. Результаты, полученные при одинаковых значениях коэффициентов диффузии всех сортов ионов и большом значении константы скорости реакции, (рис. 1а, кривые 1–3) хорошо согласуются с результатами работы [9]: плотность тока восстановления комплекса изменяется немонотонно; при увеличении приложенного потенциала достигается предельное значение плотности тока, равное 4.492, которое мало отличается от приближенного аналитического значения 4.376 [9]. Это отличие обусловлено более точным учетом конвективного переноса.
Рис. 1.
Безразмерные поляризационные кривые восстановления катионов металла (1, 4), комплекса (2, 5) и полной плотности тока (3, 6) при IMA, 0 = 0.015, B = 2, ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 1: (а) $K = {{10}^{6}};$ (б) $K = {{10}^{4}};$ (в) $K = {{10}^{2}};$ (г) $K = {{10}^{0}};$ (1–3) ${{I}_{{{\text{M,0}}}}} = 0.01;$ (4–6) ${{I}_{{{\text{M,0}}}}} = 0.02.$
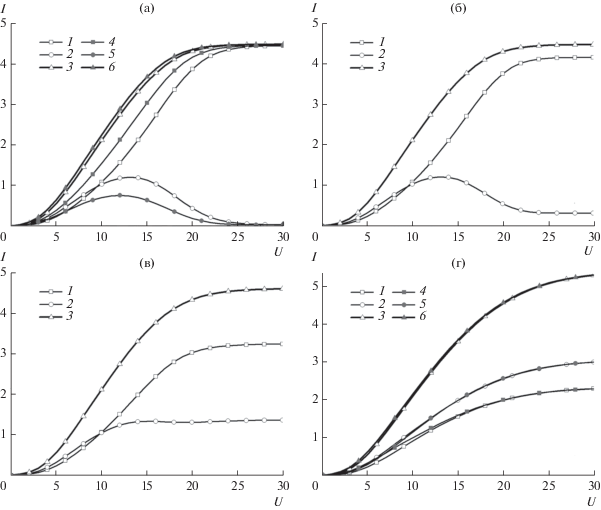
При уменьшении скорости гомогенной химической реакции плотность тока увеличивается. При этом парциальная плотность тока восстановления ионов металла уменьшается, а парциальная плотность тока восстановления комплекса увеличивается (рис. 1б–1г). Так же изменяется характер зависимости плотности тока восстановления комплекса от приложенного потенциала – немонотонная зависимость, имеющая место при малых отклонениях от равновесия реакции комплексообразования (рис. 1а, 1б), становится монотонно возрастающей зависимостью при достаточно больших отклонениях от равновесия (малых значениях константы скорости реакции) (рис. 1в, 1г). Безразмерная плотность тока обмена реакции восстановления катионов металла оказывает достаточно слабое влияние на зависимость I(U), которое проявляется в большой степени при больших скоростях реакции комплексообразования (рис. 1а, кривые 4–6). При увеличении ${{I}_{{{\text{M,0}}}}}$ от 0.01 до 0.02 при K = 106 плотность тока восстановления катионов металла увеличивается (рис. 1а, кривые 1, 4), а плотность тока восстановления комплекса уменьшается (рис. 1а, кривые 2, 5). При этом полная плотность тока тоже увеличивается, но весьма незначительно. По мере увеличения приложенного потенциала достигается предельная плотность тока, которая не зависит от параметров электрохимической реакции. При малых значениях константы скорости реакции комплексообразования изменение ${{I}_{{{\text{M,0}}}}}$ не оказывает заметного влияния, как на поляризационные кривые восстановления катионов металла и комплекса, так и зависимость полной плотности тока от приложенного потенциала (рис. 1г).
На рис. 2 приведены безразмерные поляризационные кривые, полученные при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $B = 2$ и различных значениях константы скорости реакции комплексообразования, и различных значениях коэффициентов диффузии комплекса и аниона.
Рис. 2.
Безразмерные поляризационные кривые восстановления катионов металла (1, 4), комплекса (2, 5) и полной плотности тока (3, 6) при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $B = 2{\text{:}}$ (а) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1.5, ${{\bar {D}}_{{\text{A}}}}$ = 1; (б) ${{\bar {D}}_{{{\text{MA}}}}}$ = 0.5, ${{\bar {D}}_{{\text{A}}}}$ = 1; (в) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 1.5; (г) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 0.5; (д) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1.5, ${{\bar {D}}_{{\text{A}}}}$ = 1.5; (е) ${{\bar {D}}_{{{\text{MA}}}}}$ = 0.5, ${{\bar {D}}_{{\text{A}}}}$ = 0.5, (1–3) $K = {{10}^{6}};$ (4–6) $K = 1.$
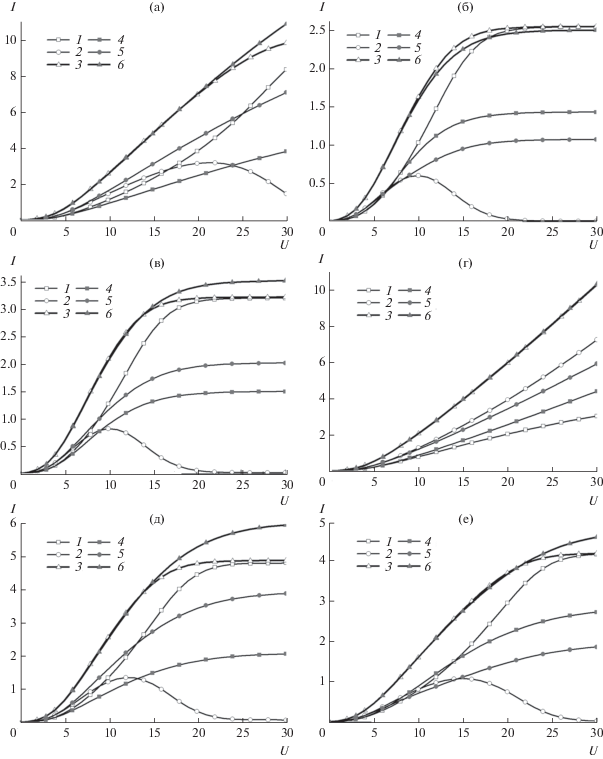
Увеличение коэффициента диффузии комплекса ведет к заметному увеличению плотности тока, а увеличение коэффициента диффузии аниона ведет к уменьшению плотности тока, что согласуется с результатами качественного анализа предельных случаев. Уменьшение скорости химической реакции тоже приводит к увеличению плотности тока, но этот эффект выражен не так сильно.
При различных значениях коэффициентов диффузии ионов и конечной скорости реакции комплексообразования предельная плотность тока зависит от этих параметров. На рис. 3 приведены зависимости предельной плотности тока от константы равновесия реакции комплексообразования и различных значений параметров системы. Кривая 1 очень хорошо согласуется с приближенным аналитическим решением [9]:
(32)
$\begin{gathered} I = \frac{1}{B}\left[ {\frac{2}{{{{{\left( {1 - B{{C}_{{{\text{M,}}b}}}} \right)}}^{2}}}} + \frac{2}{{1 - B{{C}_{{{\text{M,}}b}}}}} + } \right. \\ \left. { + \,\,2\ln \left( {1 - B{{C}_{{{\text{M,}}b}}}} \right) - B{{C}_{{{\text{M,}}b}}} - 4} \right]. \\ \end{gathered} $Рис. 3.
Зависимости предельной плотности тока от константы равновесия реакции комплексообразования: (1, 2) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 1; (3, 4) ${{\bar {D}}_{{{\text{MA}}}}}$ = 0.5, ${{\bar {D}}_{{\text{A}}}}$ = 1; (5, 6) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 1.5; (7, 8) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1.5, ${{\bar {D}}_{{\text{A}}}}$ = 1; (9, 10) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 0.5; (11, 12) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1.5, ${{\bar {D}}_{{\text{A}}}}$ = 1.5; (13, 14) ${{\bar {D}}_{{{\text{MA}}}}}$ = 0.5, ${{\bar {D}}_{{\text{A}}}}$ = 0.5; (1, 3, 5, 7, 9, 11, 13) $K = {{10}^{6}};$ (2, 4, 6, 8, 10, 12, 14) $K = 1.$
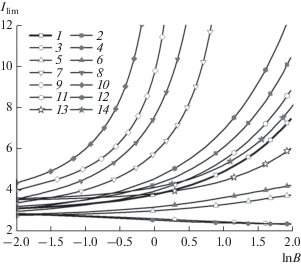
Как видно из полученных результатов, различия в коэффициентах диффузии и конечная скорость реакции комплексообразования оказывают существенное влияние на предельную плотность тока. Причем при повышенных значениях коэффициента диффузии комплекса или пониженных значениях коэффициента диффузии аниона (рис. 3, кривые 7–10) достигаются наибольшие значения предельной плотности тока.
При некотором значении константы равновесия достигается режим отсутствия предельной плотности тока. При этом концентрация комплекса на поверхности ВДЭ принимает значения, превышающие ее объемные значения. При достаточно больших значениях константы равновесия в растворе в основном присутствуют комплексы, а концентрация ионов металла достаточно мала. При этих условиях величина тока, протекающего через систему, определяется, в первую очередь, переносом комплексов. В силу электронейтральности раствора концентрация анионов близка к концентрации комплексов. Если коэффициент диффузии комплекса больше, чем коэффициент диффузии аниона, то вследствие замедленности доставки комплексов к поверхности электрода достигается режим предельной плотности тока. В противоположном случае, т.е. когда коэффициент диффузии аниона меньше, чем коэффициент диффузии комплекса, затруднен отвод анионов от ВДЭ. Так как анионы выделяются (а не потребляются) в результате восстановления комплексов, то создаются условия увеличения концентрации комплексов на поверхности ВДЭ (вследствие электронейтральности). При этом предельный ток отсутствует.
Поляризационные кривые позволяют оценить влияние комплексоообразования на процессы массопереноса, но не позволяют в полной мере понять механизм этого влияния. Для более детального анализа влияния комплексоообразования на массоперенос рассмотрим влияние параметров системы на распределения концентраций, скорости реакции комплексообразования и парциальных плотностей тока вблизи ВДЭ (рис. 4–6).
Рис. 4.
Распределения концентраций катионов металла (1, 3, 5) и комплекса (2, 4, 6) вблизи поверхности ВДЭ при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $B = 2,$ ${{\bar {D}}_{{{\text{MA}}}}}$ = = ${{\bar {D}}_{{\text{A}}}}$ = 1: (1, 2) аналитическое решение в приближении слоя Нернста и равновесии реакции комплексообразования; (3–6) численное решение; (3, 4) $K = {{10}^{6}};$ (5, 6) $K = 1$. Вертикальная пунктирная линия обозначает внешнюю границу слоя Нернста.
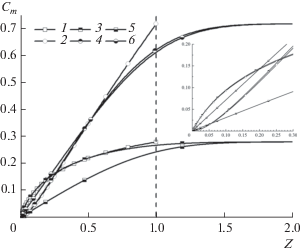
Рис. 5.
Распределения интенсивности (скорости) реакции комплексообразования вблизи поверхности ВДЭ при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $B = 2,$ ${{\bar {D}}_{{{\text{MA}}}}}$ = ${{\bar {D}}_{{\text{A}}}}$ = 1: (1–4) $K = {{10}^{6}};$ (5) $K = 1;$ (1, 5) режим предельной плотности тока; (2) режим максимальной плотности тока восстановления комплексов (U = 13); (3) U = 10; (4) U = 5.
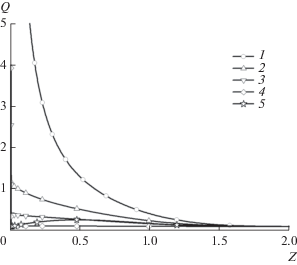
Рис. 6.
Распределения парциальных плотностей тока (1–3, 5–7) и полной плотности тока (4, 8) вблизи поверхности ВДЭ при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $B = 2,$ $K = {{10}^{6}},$ ${{\bar {D}}_{{{\text{MA}}}}}$ = ${{\bar {D}}_{{\text{A}}}}$ = 1: (1–4) режим предельной плотности тока; (5–8) режим максимальной плотности тока восстановления комплексов (U = 13); (1, 5) ${{I}_{{\text{M}}}};$ (2, 6) ${{I}_{{{\text{MА}}}}};$ (3, 7) ${{I}_{{\text{А}}}}.$
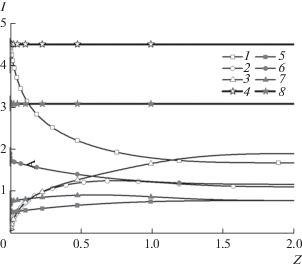
При малом отклонении от равновесия реакции комплексоообразования $\left( {K = {{{10}}^{6}}} \right)$ и одинаковых значениях коэффициентов диффузии (${{\bar {D}}_{{{\text{MA}}}}}$ = ${{\bar {D}}_{{\text{A}}}}$ = 1) результаты численного решения хорошо согласуются с приближенным аналитическим решением Харкаца [9] (рис. 4, кривые 1–4). При уменьшении скорости реакции комплексообразования до K = 1 распределения концентраций катиона металла и комплекса существенно изменяются (рис. 4, кривые 5, 6): концентрация катионов металла уменьшается, а концентрация комплекса увеличивается. Как видно из рис. 5, значение Q, характеризующего интенсивность внутреннего источника, обусловленного гомогенной химической реакцией, является положительным. Иначе говоря, происходит диссоциация комплекса с образованием катионов металла и анионов. При малом отклонении от равновесия реакции комплексообразования скорость распада комплекса велика, что ведет к заметному снижению его концентрации вблизи ВДЭ, и это в свою очередь, приводит к уменьшению плотности тока. Скорость реакции распада комплекса зависит не только от константы скорости, но и от величины приложенного потенциала. Именно с этим связано наличие максимума на поляризационных кривых восстановления комплекса. При увеличении приложенного потенциала интенсивность распада комплекса увеличивается (рис. 5), что способствует уменьшению скорости восстановления комплекса, но одновременно с этим увеличивается потенциал (перенапряжение), что способствует увеличению скорости восстановления комплекса. В области достаточно низких приложенных потенциалов преобладает влияние второго фактора (рис. 6, кривая 6), а в области больших приложенных потенциалов более сильное влияние оказывает первый фактор (рис. 6, кривая 2). При K = 1 скорость распада комплекса мала и не оказывает заметного влияния на распределения концентраций, при этом плотность тока восстановления комплекса монотонно увеличивается при увеличении приложенного потенциала.
При увеличении концентрации комплекса и при выполнении условия ${{\bar {D}}_{{{\text{MA}}}}}$ > ${{\bar {D}}_{{\text{A}}}}$ могут быть созданы условия, при которых предельный ток отсутствует, т.е. концентрации постоянны в диффузионном слое или же они увеличиваются по мере приближения к ВДЭ, даже при достаточно большой скорости реакции комплексообразования. На рис. 7 представлены распределения концентраций при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $K = {{10}^{6}},$ U = = 40 и разных значениях коэффициентов диффузии и констант равновесия реакции комплексообразования.
Рис. 7.
Распределения концентраций катионов металла (1, 4, 7), комплекса (2, 5, 8) и анионов (3, 6, 9) вблизи поверхности ВДЭ при ${{I}_{{{\text{M,0}}}}} = 0.01,$ ${{I}_{{{\text{MA,0}}}}} = 0.015,$ $K = {{10}^{6}}{\text{:}}$ (а) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1.5, ${{\bar {D}}_{{\text{A}}}}$ = 1, (1–3) B = 3, (4–6) B = 4, (7–9) B = 3.331; (б) ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 0.5, (1–3) B = 1, (4–6) B = 2, (7–9) B = 1.5.
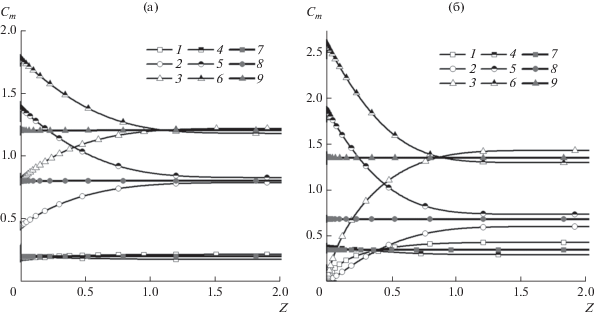
При ${{\bar {D}}_{{{\text{MA}}}}}$ = 1.5, ${{\bar {D}}_{{\text{A}}}}$ = 1 при B = 3 концентрации у ВДЭ меньше, чем в объеме раствора электролита (рис. 7а, кривые 1–3), следовательно, при этих условиях существует предельный ток, значение которого может быть определено при выполнении расчетов при больших значениях приложенного потенциала. При увеличении константы равновесия реакции комплексообразования до 4 (что соответствует увеличению концентрации комплекса) концентрации вблизи ВДЭ имеют большие значения, чем в объеме (рис. 7а, кривые 4–6), несмотря на то, что через систему протекает плотность тока, равная 18.13 (что более, чем в 6 раз превышает предельную плотность тока восстановления катионов металла при отсутствии комплексов). Это свидетельствует о том, что при данных условиях предельный ток отсутствует, и при увеличении приложенного потенциала будет увеличиваться плотность тока, протекающего в системе. При B = 3.331 в диффузионном слое концентрации являются постоянными, что соответствует предельному состоянию отсутствия предельной плотности тока (рис. 7а, кривые 7–9). При ${{\bar {D}}_{{{\text{MA}}}}}$ = 1, ${{\bar {D}}_{{\text{A}}}}$ = 0.5 наблюдается аналогичная картина (рис. 7б), только в этом случае граница области, в которой отсутствует предельная плотность тока, достигается при меньшем значении константы равновесия реакции комплексообразования, равном 1.5.
ЗАКЛЮЧЕНИЕ
Проведен теоретический анализ процессов массопереноса при электроосаждении металла на вращающемся дисковом электроде из электролита, содержащего как простые, так и комплексные катионы. В отличие от опубликованных ранее работ по этой проблеме, в настоящей работе не использованы приближения диффузионного слоя Нернста, равенства коэффициентов диффузии всех сортов ионов и равновесия гомогенной химической реакции. Кинетика электрохимических реакций восстановления простых и комплексных катионов задана уравнениями Батлера–Фольмера.
Результаты численного решения задачи выявили важное взаимное влияние соотношения коэффициентов диффузии комплексного катиона и неактивного аниона, констант равновесия и скорости реакции комплексообразования, потенциала ВДЭ. Показано, как эти параметры влияют на скорость осаждения, величину предельного тока или условия его отсутствия. Приведены рассчитанные для модельной системы поляризационные кривые, распределения концентраций всех сортов ионов вблизи поверхности ВДЭ и другие характеристики электрохимической системы.
При ряде упрощений условий задачи результаты выполненного численного решения хорошо согласуются с результатами известных приближенных аналитических решений.
Список литературы
Survila, A., Electrochemistry of metal complexes: applications from electroplating to oxide layer formation, Weinheim: John Wiley & Sons, 2015. 306 p.
Березин, Н.Б., Межевич, Ж.В. Электроосаждение металлов из водных растворов комплексных соединений. Казань: КНИТУ, 2015. 168 с.
Бек, Р.Ю., Цупак, Т.Е., Бородихина, Л.И., Нгуен, З.Ш. Особенности влияния комплексообразования на эффект миграции. Электрохимия. 1983. Т. 19(8). С. 1149.
Бек, Р.Ю., Цупак, Т.Е. Влияние комплексообразования на эффекты миграции в системах с многозарядными катионами и отрицательно заряженными лигандами. Электрохимия. 1987. Т. 23(4). С. 560.
Ying, R.Y., Ng, P.K., Mao, Z., and White, R.E., Electrodeposition of Copper–Nickel Alloys from Citrate Solutions on a Rotating Disk Electrode II. Mathematical Modeling, J. Electrochem. Soc., 1988, vol. 135(12), p. 2964.
Харкац, Ю.И. Миграционные токи в электрохимической кинетике, М.: ВИНИТИ, 1991. 143 с.
Kharkats, Y.I. and Sokirko, A.V., The theory of limiting diffusion-migration currents in partially dissociated electrolytes, J. Electroanal. Chem. Interfac. Electrochem., 1991, vol. 303(1–2), p. 17.
Podlaha, E.J., Bonhote, C., and Landolt, D., A mathematical model and experimental study of the electrodeposition of Ni–Cu alloys from complexing electrolytes. Electrochim. Acta, 1994, vol. 39(18), p. 2649.
Харкац, Ю.И. Особенности электромиграции и комплексообразования в реакциях восстановления катионов. Электрохимия. 1998. Т. 34. С. 593. [Kharkats, Yu.I., Electromigration and complexing in reactions of reduction of cations, Russ. J. Electrochem., 1998. vol. 34, p. 526.
Бек, Р.Ю., Цупак, Т.Е., Шураева, Л.И., Косолапов, Г.В. Влияние комплексообразования на массоперенос в растворах, содержащих комплексы кадмия с ионами хлора, Электрохимия. 1987. Т. 23. С. 1618.
Бек, Р.Ю., Цупак, Т.Е., Шураева, Л.И. Эффекты электромиграции и взаимодействия потоков разряжающихся ионов при электроосаждении металлов из комплексных электролитов. Электрохимия. 1998. Т. 34. С. 182.
Rode, S., Henninot, C., Vallieres, C., and Matlosz, M., Complexation chemistry in copper plating from citrate baths, J. Electrochem. Soc., 2004. vol. 151(6), p. C405.
Rode, S., Henninot, C., and Matlosz, M., Complexation chemistry in nickel and copper–nickel alloy plating from citrate baths, J. Electrochem. Soc., vol. 152(4), p. C248.
Седойкин, А.А., Цупак, Т.Е. Роль миграционного массопереноса при электроосаждении никеля из сульфатно-хлоридных и хлоридных растворов, содержащих янтарную кислоту. Электрохимия. 2008. Т. 44. С. 343. [Sedoikin, A.A. and Tsupak, T.E., The role of migration mass transfer in the electrodeposition of nickel from sulfate-chloride and chloride solutions containing succinic acid, Russ. J. Electrochem., 2008, vol. 44, p. 319.]
Плесков, Ю.В., Филиновский, В.Ю. Вращающийся дисковый электрод, М.: Наука, 1972. 344 с. [Pleskov, Yu.V. and Filinovsky, V.Yu. Rotating disk electrode, N.Y.: Consultants Bureau, 1976.]
Левич, В.Г. Физико-химическая гидродинамика, М.: Физматгиз, 1959. 700 c. [Levich, V.G., Physicochemical hydrodynamics, N.Y.: Prentice-Hall, Englewood Cliffs. 1962.]
Moukalled, F., Mangani, L., Darwish, M., The finite volume method in computational fluid dynamics, Cham: Springer, 2016.
Ньюмен, Д., Электрохимические системы, М: Мир, 1977. 464 с.
Volgin, V.M. and Davydov, A.D., Ionic transport through ion-exchange and bipolar membranes, J. Membrane Sci., 2005, vol. 259(1), p. 110.
Volgin, V.M. and Davydov, A.D., Numerical simulation of steady state ion transfer to rotating disk electrode: accuracy and computational efficiency, J. Electroanal. Chem., 2007, vol. 600(1), p. 171.
Volgin, V.M. and Davydov, A.D., Effect of migration on homogeneous redox electrocatalysis at rotating disk electrode, Electrochim. Acta, 2018, vol. 259, p. 56.
Дополнительные материалы отсутствуют.


