Электрохимия, 2020, T. 56, № 11, стр. 963-977
Активированные угли как нанопористые электроно-ионообменники
Ю. М. Вольфкович a, *, А. А. Михалин a, А. Ю. Рычагов a, В. Е. Сосенкин a, Д. А. Бограчев a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Ленинский проспект, 31, корп. 4, Россия
* E-mail: yuvolf40@mail.ru
Поступила в редакцию 23.07.2019
После доработки 24.12.2019
Принята к публикации 20.02.2020
Аннотация
Исследованы электрохимические, ионообменные, сорбционные, гидрофильно-гидрофобные свойства ряда типов электродов на основе активированных углей (АУ) и их пористая структура. Методом эталонной контактной порометрии было установлено, что АУ обладают как гидрофильной, так и гидрофобной пористостью, и высокой площадью удельной поверхности (600–2600 м2/г), что является причиной использования их в суперконденсаторах и для емкостной деионизации воды (ЕДВ). Обнаружено новое явление супергидрофильности вследствие набухания поверхностных групп (ПГ) в воде. Измерения поверхностной проводимости АУ показали, что даже в чистой воде АУ обладают существенной ионной проводимостью, что позволяет использовать их для получения чистой воды методом ЕДВ. Установлено, что АУ являются электроно-ионообменниками, что является их уникальной особенностью. Обнаружен существенный вклад псевдоемкости редокс-реакций ПГ в полную емкость наряду с емкостью двойного электрического слоя. Показано, что при глубоком катодном заряжении до отрицательных потенциалов о. в. э. в концентрированной H2SO4 величина удельной емкости АУ достигает 1100 Ф/г в основном за счет псевдоемкости реакции интеркаляции водорода в углерод. Это соответствует образованию нового соединения C6H. В чистой воде получена удельная емкость АУ до 66 Ф/г, которая не увеличивается при увеличении концентрации KCl, что свидетельствует о том, что эта емкость обусловлена поверхностными группами.
ВВЕДЕНИЕ
О важности для электрохимии активированных углей (АУ) свидетельствует тот факт, что А.Н. Фрумкин свою первую правительственную награду получил в 1931 г. за исследования АУ [1, 2]. Известно, что АУ обладают следующими уникальными основными свойствами: высокой площадью удельной поверхности (УП) ~500–2500 м2/г [3–10], большой адсорбционной способностью [3–5, 9], электронной проводимостью и наличием большого количества поверхностных групп (ПГ) [6, 9]. УП и электронная проводимость обусловили широкое применение АУ в суперконденсаторах [7, 11–19] и для емкостной деионизации воды [20–29]. Как известно, исходным сырьем для АУ являются природные материалы (древесина, косточки ягод, и т.п.) или синтетические полимеры, например полиакрилонитрил. АУ обычно изготавливаются в две стадии: 1) стадия карбонизации и 2) стадия активации [6, 9, 29, 30]. Стадию карбонизации, которая заключается в пиролитическом разложении исходного сырья, можно схематически описать уравнением (1),
(1)
${\text{CXYZ}} \to {\text{C}} + {\text{X}}{\kern 1pt} \uparrow {\text{ + }}\,\,{\text{Y}}{\kern 1pt} \uparrow + \,\,{\text{Z}} \uparrow \,\,\,\,(500{\text{--}}600^\circ {\text{C}}).~$В результате пиролиза из исходного материала удаляются в виде газов все элементы (водород, кислород, азот, сера и др.), кроме углерода.
Стадию активации можно описать, например, уравнениями (2)–(5):
(2)
${{{\text{С}}}_{х}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {{{\text{H}}}_{2}} + {\text{CO}} + \,\,{{{\text{C}}}_{{x{\text{ }}--}}}_{1}\,\,\,\,\,(800{\text{--}}900^\circ {\text{C}}),$(3)
${{{\text{С}}}_{х}} + {\text{C}}{{{\text{O}}}_{2}} \to 2{\text{CO}} + {{{\text{C}}}_{{x{\text{ }}--}}}_{1}\,\,\,(800{\text{--}}900^\circ {\text{C}}),$(4)
${{{\text{С}}}_{х}} + {{{\text{O}}}_{2}} \to 2{\text{CO}} + {{{\text{C}}}_{{x{\text{ }}--}}}_{2}\,\,\,\,(800{\text{--}}900^\circ {\text{C}}),$(5)
${{{\text{С}}}_{х}} + {{{\text{O}}}_{2}} \to {\text{C}}{{{\text{O}}}_{2}} + {{{\text{C}}}_{x}}{{_{--}}_{1}}\,\,\,({\text{ < 6}}00^\circ {\text{C}}).$В результате активации из карбонизованного материала удаляется часть углерода и на его месте образуются микро- и мезо-поры.
Целью данной работы было исследование пористой структуры, гдрофильно-гидрофобных, ионообменных, электрохимических свойств АУ, а также их поверхностной проводимости (ПП), редокс-реакций поверхностных групп, псевдоемкости медленных процессов, протекающих при глубоком катодном заряжении АУ.
1. МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДИКИ
1.1. Материалы
В данной работе исследовались следующие материалы на основе активированных углей:
1. Активированная углеродная ткань (АУТ) “ВИСКУМАК”, НПО “Неорганика”, г. Электросталь (РФ).
2. АУТ СН900 компании Kuraray (Япония).
3. Композитные электроды SAIT на основе АУ SAIT + 5% политетрафторэтилен (ПТФЭ) (республика Корея).
4. Композитные электроды СКБ “РИКОН” (г. Воронеж, РФ), изготовленные путем каландрирования смеси АУ Norit со связующим в виде 4% порошка ПТФЭ.
5. АУ АГ-3, НПО “Неорганика”, г. Электросталь (РФ).
6. АУ СКТ-6А, НПО “Неорганика”, г. Электросталь (РФ).
7. KJEC 600, Nouryon Polymer chemistry, США.
1.2. Исследование пористой структуры
Для исследования пористой структуры и гидрофильно-гидрофобных свойств АУ использовался метод эталонной контактной порометрии (МЭКП) [31–34]. Этот метод позволяет не только исследовать пористую структуру любых материалов в максимально широком диапазоне радиусов пор ~от 1 до 3 × 105 нм, но и изучать их гидрофильно-гидрофобные свойства. При использовании в качестве измерительной жидкости октана измеряются порометрические кривые для всех пор, а при использовании воды – только гидрофильных пор. Этот метод был признан IUPAC [35].
1.3. Электрохимические измерения
Измерение гальваностатических и ЦВА кривых осуществлялось во фторопластовой ячейке согласно методике, подробно описанной в [17]. В [36] была впервые разработана и детально описана методика измерений ионной поверхностной проводимости пористых электродов вообще и угольных электродов в частности. Для измерений ПП использовалась 6-камерная 5-электродная стеклянная ячейка [36]. Один из этих электродов – исследуемый угольный электрод; кроме того в состав ячейки входят два противоэлектрода из платинированной платины и два электрода сравнения. Данный метод измерения ПП является еще одним методом исследования ДЭС.
Методика измерений катионообменной и анионообменной емкости АУ-электродов описана в [28, 37]. В [28] был разработан метод определения емкости ДЭС для пористых углеродных электродов. Специфика этого метода заключается в том, что емкость таких электродов складывается из емкости ДЭС и емкости редокс-реакций поверхностных групп (ПГ). Кроме того, в этом методе нужно было также учитывать омические потери. Метод заключался в измерении зависимости емкости от тока. Емкость ДЭС определялась в области плато на этой зависимости (см. ниже).
Определение концентрации (в мкмоль/г) и состава поверхностных соединений (фенольные, лактонные, карбоксильные и основные группы), локализованных на поверхности АУ, определяли по стандартизованному методу титрования углеродных материалов Боэма [38–40].
2. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
2.1. Исследование структуры активированных угольных электродов
На рис. 1 приведены микрофотографии, полученные методом СЭМ для АУТ ВИСКУМАК, АУТ СН900 и АУ SAIT. Использовался сканирующий электронный микроскоп JEOL (Япония).
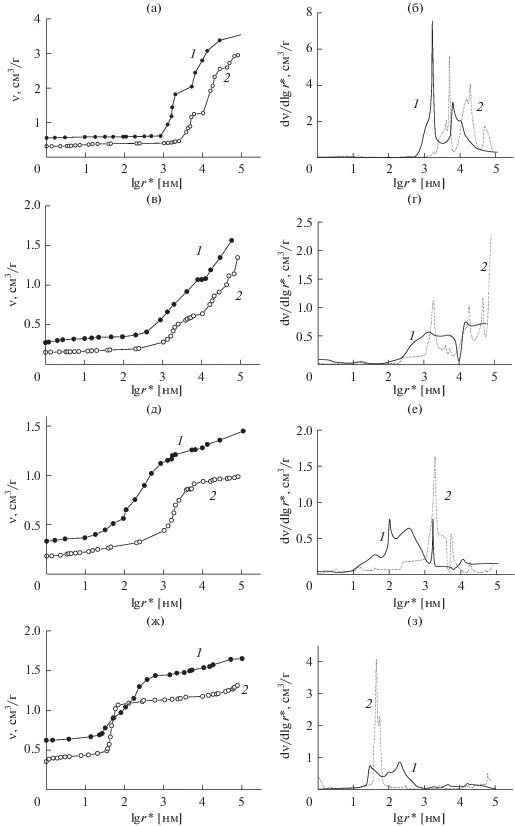
Как видим, для АУТ ВИСКУМАК и АУТ СН900 явственно видны волокна, а для АУ SAIT проявляется композитная структура, состоящая из частиц АУ и ПТФЭ. На рис. 2 приведены интегральные (а, в, д, ж) и дифференциальные (б, г, е, з) кривые распределения пор по эффективным радиусам r* для АУ-материалов СН900 (а, б), ВИСКУМАК (в, г), SAIT (д, е) и СКБ “РИКОН” (ж, з), измеренные с использованием октана (1) и воды (2), где r* = r/cosθ, r – истинный радиус пор, θ – краевой угол смачивания в воде. Поскольку октан практически идеально смачивает все материалы, то для него θ ~ 0 и r* ~ r, а для воды θ > 0 и r* > r.
Рис. 2.
Интегральные (а, в, д, ж) и дифференциальные (б, г, е, з) кривые распределения пор по эффективным радиусам r* для АУ-материалов СН900 (а, б) ВИСКУМАК (в, г), SAIT (д, е) и СКБ “РИКОН” (ж, з), измеренные с использованием октана (1) и воды (2).
На рис. 3 приведены рассчитанные из порометрических кривых для октана и воды согласно [32], зависимости θ от r для СН900, ВИСКУМАК, SAIT и СКБ “РИКОН”.
Из рис. 2 видно, что все АУ имеют максимально широкий диапазон радиусов пор от долей нм до 100 мкм, т.е. более 5 порядков. Следовательно, АУ по широте диапазона размеров пор являются уникальными материалами. Микропоры (с r < 1 нм), а также крупные макропоры (с r > 103 нм) имеются у всех материалов. Мезопоры, радиус которых составляет 1–100 нм, практически отсутствуют в АУТ CH900 и ВИСКУМАК. В то же время для электродов SAIT и РИКОН были обнаружены все типы пор, в том числе и мезопоры. Сложный характер зависимостей θ от r (см. рис. 3) объясняется неравномерным распределением гидрофильных кислородосодержащих поверхностных групп в порах разных размеров в АУ, а также наличием гидрофобных частиц ПТФЭ в РИКОН и SAIT. Основные данные МЭКП приведены в табл. 1 . Как видно, пористая структура всех АУ электродов включает как гидрофильную, так и гидрофобную пористость. Величины гидрофобной пористости у композитных АУ-электродов SAIT и РИКОН больше, чем у АУТ-электродов СН900 и ВИСКУМАК, потому что в состав композитных электродов входят частицы гидрофобного фторопластового связующего.
Таблица 1.
Характеристики пористой структуры и гидрофильно-гидрофобных свойств АУ-электродов
| Электрод | Площадь удельной поверхности, м2/ г | Отношение гидрофильной к полной удельной поверхности | Пористость | |||
|---|---|---|---|---|---|---|
| полная (по октану) | гидрофильная (по воде) | полная (по октану) | гидрофильная (по воде) | гидрофобная | ||
| СН900 | 1520 | 850 | 0.56 | 0.85 | 0.786 | 0.064 |
| “ВИСКУМАК” | 600 | 416 | 0.70 | 0.729 | 0.623 | 0.106 |
| SAIT | 940 | 520 | 0.55 | 0.715 | 0.490 | 0.225 |
| “РИКОН” | 1705 | 825 | 0.48 | 0.762 | 0.673 | 0.089 |
| KJEC 600 | 2500 | 2600 | – | 0.89 | 0.84 | 0.05 |
Как видно из рис. 2 и табл. 1 , даже для АУТ CH900 и ВИСКУМАК, не содержащих гидрофобного связующего, имеются как гидрофильные, так и гидрофобные поры. Это является существенным свойством активированных углей, отличающих их от практически всех других материалов, являющихся или полностью гидрофильными (например, металлы, их оксиды, иониты), или полностью гидрофобными (например, политетрафторэтилен и полиэтилен). Это можно объяснить тем, что гидрофильные свойства обусловлены кислородосодержащими ПГ, имеющимися в большом количестве в АУ, тогда как графит, не содержащий ПГ, является гидрофобным материалом. Эти гидрофильно-гидрофобные свойства АУ нужно учитывать при их применении в водных растворах, в которых электрохимические процессы протекают только в гидрофильных порах. Как видно из табл. 1 , значения УП в октане полной площади удельной поверхности довольно высоки (600–2500 м2/г) и они достаточно сильно отличаются друг от друга. Сравнение данных, полученных в водной и октановой средах, показывает более высокую гидрофильную пористость по сравнению с гидрофобной (см. рис. 2 и табл. 1 ).
2.2. Углеродные поверхностные группы в активированных углях
Известно, что в активированных углях содержится большое количество поверхностных групп [6, 9], например:
Эти ПГ встроены в углеродные шестигранники АУ. Данные по исследованию химии поверхности активированных углей, полученные по стандартизованному методу Боэма [38–40], представлены в табл. 2. Из этих данных видно, что на поверхности обеих марок углей преобладают основные группы, причем на АУ СКТ-6А их в 2 раза больше, чем на угле АГ-3. На угле СКТ-6А отсутствуют фенольные группы, а на угле АГ-3 карбоксильные и фенольные группы.
Таблица 2.
Содержание поверхностных соединений на поверхности активированных углей АГ-3 и СКТ-6А
| Марка угля | Кол-во карбоксильных групп, мкмоль/г | Кол-во лактонных групп, мкмоль/г | Кол-во фенольных групп, мкмоль/г | Кол-во основных групп, мкмоль/г |
|---|---|---|---|---|
| АГ-3 | – | 86 | – | 695 |
| СКТ-6А | 71 | 141 | – | 1402 |
ПГ оказывают существенное влияние на различные свойства АУ. Противоионы поверхностных групп обеспечивают наличие у АУ ионной поверхностной проводимости (ПП). В [36] впервые была разработана методика измерения ПП в пористых электродах на примере активированных углей. Согласно классическому определению поверхностной проводимости (ПП), данному Смолуховским [41], раствор электролита, заполняющий капилляр или поры диафрагмы, обладает большей удельной электропроводностью по сравнению с окружающим равновесным раствором. Эта добавочная или поверхностная проводимость обусловлена подвижностью избыточных ионов, а именно ионов ДЭС. Таким образом, удельная электропроводность раствора в порах (κ) представляет собой сумму удельной электропроводности свободного равновесного раствора (κv) и ПП. Поверхностная проводимость является, таким образом, продольной (тангенциальной) проводимостью ДЭС. В свою очередь ПП, согласно нашим представлениям, равна сумме проводимости, обусловленной проводимостью противоионов ПГ в высокодисперсном углеродном электроде (κsg) и поверхностной проводимости (κsch), обусловленной электростатическим зарядом, т.е. классическим ДЭС [42]. Величина κsg зависит от концентрации поверхностных групп csg на угле, т.е. их обменной емкости Q, а κsch зависит от потенциала E и концентрации раствора (с). Таким образом, можно написать:
(6)
$\begin{gathered} \kappa \left( {c,E} \right) = {{\kappa }_{{\text{v}}}}\left( c \right) + {{\kappa }_{{\text{s}}}}\left( {c,E} \right) = \\ = {{\kappa }_{{\text{v}}}}\left( c \right) + {{\kappa }_{{{\text{sch}}}}}\left( {c,E} \right) + {{\kappa }_{{{\text{sg}}}}}\left( Q \right). \\ \end{gathered} $На рис. 4а, 4б приведены зависимости измеренных величин электропроводности κ от концентраций KCl для электродов CH900 и SAIT при их стационарных потенциалах. Как видим, в области c = 0.0001–0.0004 М эти зависимости практически линейны. Величины κsg были получены путем экстраполяции этих зависимостей на величину с = 0. Таким образом, даже в чистой воде АУ обладают ионной электропроводностью, обусловленной наличием большого количества поверхностных групп (ПГ). Этой электропроводности достаточно для получения чистой воды методом ЕДВ [37]. Из рис. 4 видно, что величины κsg равны 1.25 × 10–4 и 0.4 × 10–4 См/см2 соответственно для СН900 и SAIT. Поскольку величины κsg зависят от концентрации ПГ, то были измерены величины их обменной емкости Q в разбавленных растворах KCl.
Рис. 4.
Зависимости электропроводности κ от концентраций KCl для электродов CH900 (а) и SAIT (б) при их стационарных потенциалах. Иллюстрация экстраполяционного получения величины κsg.

Таблица 3.
Стационарные потенциалы (Eстац) для поверхностной проводимости (κsg), и обменная емкость по иону калия (Q) [28]
| CH900 | SAIT |
|---|---|
| Eстац = 0.497 В | Eстац = 0.482 В |
| κsg = 0.000123 См/см | κsg = 0.00004 См/см |
| Q (по иону K+) = = 1.14 мг-экв/г | Q (по иону K+) = = 0.37 мг-экв/г |
В табл. 3 приведены величины стационарных потенциалов (Eстац) для поверхностной проводимости (κsg), и величины обменной емкости по иону калия (Q)22. Из таблицы видно, что соотношение величин Q для электродов CH900 и SAIT равно 3.08, а соответствующее соотношение величин κsg равно 3.12. Из практического равенства между собой этих величин можно сделать важный вывод, что при с = 0 величина κsg практически пропорциональна обменной емкости поверхностных групп:
где κsgi – ПП приходящаяся на единичную обменную емкость Q = 1 мг-экв/г. В отличие от ПП, исследовавшейся Смолуховским для пористых мембран и капилляров в области коллоидной химии, принципиальным отличием ПП для АУ-электродов является то, что АУ обладают не только ионной проводимостью, но также и электронной проводимостью. Таким образом, активированные угли являются электроно-ионообменниками, что является их уникальной особенностью.На рис. 3а–3г приведены измеренные зависимости κ от потенциала (относительно н. в. э.) для разных концентраций KCl для CH900 (3а и 3б) и SAIT (3в и 3г). Как видим, эти зависимости имеют минимумы. По нашему мнению, потенциалы в точках минимумов соответствуют потенциалам полного нулевого заряда (ПНЗ). Для СН900 ПНЗ изменяется от 0.23 до 0.18 В (о. в. э.) при изменении концентрации KCl от 0.002 до 0.2 М, а для SAIT – от 0.38 до 0.23 В при изменении концентрации KCl от 0.001 до 0.1 М. Из литературы [12, 13, 43] известно, что потенциалы минимумов, полученные из зависимостей дифференциальной емкости от потенциала для различных углеродных материалов, зависят от вида этих материалов (пирографит, стеклоуглерод, сажа, активированный уголь и др.) и находятся в широком интервале от 0.05 до 0.33 В. Таким образом, полученные нами величины ПНЗ для АУ приблизительно соответствуют этим данным, учитывая отраженный в литературе большой разброс этих величин для разных углеродных материалов. Таким образом, разработанный нами метод измерения ПП является еще одним методом исследования ДЭС в пористых электродах. При применении АУ-электродов для емкостной деионизации воды важно было измерить их величины каионообменной и анионообменной емкости. В табл. 4 приведены эти величины, измеренные для АУ Norit и CH900 [37].
Рис. 5.
Зависимости электропроводности κ от потенциала (относительно н. в. э.) для CH900 для концентраций KCl, М: 1 – 0.002, 2 – 0.003, 3 – 0.004, 4 – 0.005, 5 – 0.006 (а) и 1 – 0.05, 2 – 0.1, 3 – 0.2 (б); (в) и (г) – аналогичные зависимости для SAIT при концентрациях KCl, М: 1 – 0.001, 2 – 0.002, 3 – 0.003; 4 – 0.004, 5 – 0.005, 6 – 0.006 (в); 1 – 0.05, 2 – 0.1 (г).
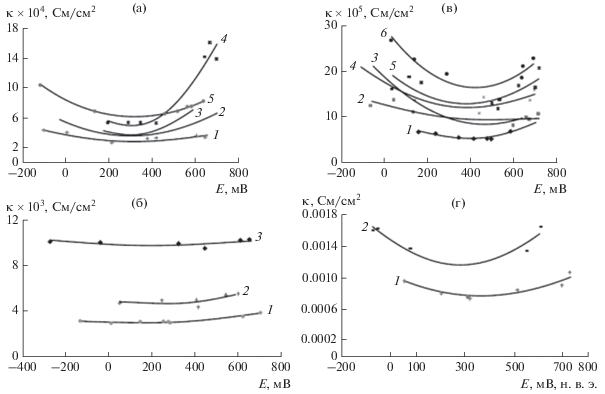
Таблица 4.
Катионообменная и анионообменная емкость АУ
| Активиро-ванные угли | Катионо-обменная емкость, ммоль/г | Анионо-обменная емкость, ммоль/г |
|---|---|---|
| Norit | 0.56 | 0.20 |
| CH900 | 0.06 | 0.70 |
Таким образом, активированные угли обладают как катионообменными, так и анионообменными свойствами. Благодаря этому свойству АУ являются наиболее предпочтительными электродными материалами для получения чистой воды методом ЕДВ. Однако при этом лимитирующим элементом становится пористый сепаратор, поскольку вода в его порах обладает огромным сопротивлением, что приводит к очень большим энергозатратам. Поэтому в [37] была разработана ионообменная мембрана мозаичной структуры, обладающая катионообменными и анионообменными свойствами. Такая мозаичная мембрана (ММ) была использована вместо обычного пористого сепаратора для получения чистой воды, поскольку она обладает достаточной ионной проводимостью даже в чистой воде. На рис. 6 приведено схематическое изображение структуры мозаичной мембраны.
Рис. 6.
Схематическое изображение структуры мозаичной мембраны: 1 – полимерная матрица; 2 – микропоры, 3 – положительно заряженные фиксированные ионогенные группы, входящие в состав частиц анионита; 4 – анионы; 5 – отрицательно заряженные фиксированные ионогенные группы, входящие в состав частиц катионита; 6 – катионы.

Рис. 7.
Вольт-фарадные кривые, для концентраций KCl (а) с = 0, (б) с = 0; 0.01 М; 0.05 М при скоростях развертки напряжения 0.1 мВ/с (а и б), 0.5 мВ/с (а), 2 мВ/с (а), 5 мВ/с (а). Электроды Norit и мозаичная мембрана.

В статической электрохимической ячейке для ЕДВ (без потока жидкости) были проведены измерения ЦВА-кривых. Ячейка состояла из двух АУ-электродов Norit, между которыми находилась ММ. Поры электродов и ММ были пропитаны дважды перегнанной водой. На рис. 7 приведены измеренные таким образом вольт-фарадные кривые при разных скоростях развертки напряжения (w), где С = I/w – емкость, I – ток. Был установлен следующий механизм работы электрохимической ячейки с чистой водой (для рис. 7а), При включении электрического поля противокатионы одного АУ-электрода вследствие наличия ПП мигрируют по эстафетному механизму от одного противокатиона к другому, и далее они мигрируют к ММ, где они по аналогичному эстафетному механизму мигрируют к противоэлектроду. В это же время противоанионы первого АУ-электрода мигрируют по эстафетному механизму от одного противоаниона к другому, и далее к ММ, где они также переносятся по эстафетному механизму от одного противоаниона к другому и далее мигрируют к противоэлектроду, в котором они мигрируют от одного противоаниона к другому. Таким образом происходит заряжение двойного электрического слоя (ДЭС). Как видим, форма ЦВФ кривых на рис. 7а соответствует форме соответствующих кривых для двойнослойного конденсатора, и при минимальной скорости развертки напряжения 0.1 мВ/с она имеет вид, близкий к прямоугольнику, т.е. характеризует заряжение ДЭС [7, 15]. При этом величина удельной емкости АУ-электродов равна 66 Ф/г. Учитывая, что, согласно данным МЭКП, величина гидрофильной удельной поверхности АУ Norit (электроды “РИКОН”) равна 825 м2/г (см. табл. 1 ), удельная емкость этих электродов на единицу гидрофильной удельной поверхности рана 8 мкФ/см2. Поскольку измерения проводились в чистой воде, то, учитывая также микропористый характер структуры АУ, влияние диффузного ДЭС здесь практически исключено, и, вероятно, можно говорить только о плотном двойном электрическом слое Гельмгольца.
На рис. 7б приведены ЦВФ-кривые для ячейки с АУ-электродами Norit и ММ для концентраций KCl с = 0; 0.01 и 0.05 М при скорости развертки напряжения 0.1 мВ/с. Как видим, эти кривые имеют типичный двойнослойный вид и они практически совпадают друг с другом. Следовательно, концентрация соли практически не влияет на емкость ДЭС АУ-электродов, в отличие от емкости ДЭС для металлических электродов, например для Pt и Hg, для которых, как известно, диффузная часть емкости возрастает с увеличением концентрации электролита [42]. Отсюда можно сделать вывод, что емкость ДЭС АУ-электродов определяется практически только концентрацией ПГ. На этом основании можно сделать приблизительную оценку удельной емкости (Csg) АУ Norit на единицу обменной емкости ПГ. Из табл. 4 видно, что сумма катионообменной и анионообменной емкости равна 0.76 ммоль/г. Отсюда Csg = 66 Ф/г/0.76 ммоль/г = = 86.8 Ф/ммоль ПГ.
2.3. Редокс-реакции поверхностных групп
Протекание редокс-реакций ПГ было обнаружено путем анализа зависимостей емкости электрохимических суперконденсаторов (ЭХСК) с АУ-электродами от тока в широком диапазоне токов [28]. Величины емкости определялись из гальваностатических кривых. Из рис. 8, где приведена зависимость интегральной электрохимической емкости электрода CH900 от плотности тока в растворе смеси CaCl2, NaHCO3 и MgSO4 (см. вкладыш), видно, что при изменении тока от больших значений к меньшим происходит сначала рост емкости, затем образуется плато и в конце снова резкий рост. Происходит это ввиду того, что при достаточно больших токах имеются большие омические потери. При уменьшении тока эти потери уменьшаются, и емкость возрастает. При дальнейшем уменьшении тока омические потери в области плато на кривой становятся очень малыми и емкость определяется практически только ДЭС; и она остается приблизительно постоянной вплоть до момента, когда в суммарную емкость начинает вносить заметный вклад псевдоемкость фарадеевских процессов. Согласно [7, 15, 28, 44], эти процессы для АУ-электродов в основном представляют собой квазиобратимые редокс-реакции поверхностных групп. Как видно из рис. 8а, для смеси солей CaCl2 (660 мг/л), NaHCO3 (373 мг/л) и MgSO4 (644 мг/л) величина удельной емкости ДЭС СДЭС = 63 Ф/г. Эта методика оценки емкости ДЭС применялась и для других растворов. Из табл. 4 видно, что сумма катионообменной и анионообменной емкости для СН900 равна 0.76 ммоль/г. Отсюда Csg = 63 Ф/г/0.76 ммоль/г = = 83 Ф/ммоль ПГ, что близко для АУ Norit. Из рис. 8 также видно, что зависимости емкости от тока для АУ-электрода “ВИСКУМАК” и различных растворов имеют вид, аналогичный для АУ СН900, т.е. содержат характерное плато.
Рис. 8.
Зависимость удельной емкости АУ-электрода “ВИСКУМАК” от плотности тока для следующих солей 1 н NaHCO3, 1н CaCl2 и 1 н MgSO4. Во вкладыше – зависимость удельной емкости АУ-электрода СН 900 от плотности тока для 1 н смеси солей: NaHCO3, CaCl2 и MgSO4.

В [28] была разработана математическая модель, позволяющая рассчитывать гальваностатические кривые ЭХСК, в которой были использованы величины емкости ДЭС, полученные из кривых зависимостей емкости от тока, подобных изображенным на рис. 8. На рис. 9 приведены типичные гальваностатические расчетные и экспериментальные кривые заряжения АУ-электродов SAIT и “Вискумак” в координатах U (напряжение) от t (время) для разных токов. Расчетные кривые получены по данной модели. Как видим, расчетные кривые близки к экспериментальным, что говорит о корректности модели и описанного выше метода определения СДЭС.
Рис. 9.
Экспериментальная и теоретические зарядные гальваностатические кривые при плотности тока 2.8 мA/см2 для АУ-электрода SAIT в растворе 0.1 N NaHCO3 (рис. слева) и АУ-электрода АУТ “Вискумак” в растворе 0.1 N CaCl2.

Другой метод обнаружения редокс-реакций поверхностных групп АУ-электродов заключался в измерении зависимости КПД по энергии (это отношение энергии разряда к энергии заряда) на основании измерений гальваностатических кривых ЭХСК с АУ-электродами СН900 [44]. Здесь следует подчеркнуть важный факт, что КПД по энергии ЭХСК не лимитируется поляризацией электродных реакций, в отличие от аккумуляторов, а ограничивается только омическими потерями энергии. Поэтому в принципе КПД ЭХСК может приближаться к 100%. Величины удельной энергии (W), КПД (W), емкости одного электрода (C) были рассчитаны из соответствующих экспериментальных гальваностатических кривых, т.е. из зависимостей напряжения от времени разряда и заряда. На рис. 10 представлены зависимости зарядной и разрядной емкости АУ-электрода “РИКОН” от плотности тока для водного электролита 1 N LiClO4.
Рис. 10.
Зависимости емкости (рассчитанной на один электрод) заряда (I) и разряда (II) от плотности тока для ЭХСК с электродами “РИКОН”.

Как видно из рис. 10, емкость возрастает с уменьшением тока. В области больших токов возрастание достаточно медленное, оно обусловлено снижением омических потерь. Однако при малых токах имеет место резкое возрастание емкости до величин 170 и 240 Ф/г, соответственно, для разряда и заряда. Это, вероятно, обусловлено появлением существенного вклада псевдоемекости редокс-реакций поверхностных групп.
На рис. 11 представлены экспериментальная (2) и теоретическая зависимости КПД от тока для ЭХСК на основе АУ Norit. Как видим, эта зависимость имеет колоколобразный вид. Из этой зависимости видно, что величина КПД при движении в сторону больших токов сначала возрастает, затем достигает максимума КПД (около 90%), а затем уменьшается. Это объясняется тем, что при малых токах в суммарную емкость вносят заметный вклад псевдоемкостной (аккумуляторный) процесс, у которого КПД мал вследствие поляризации электродной реакции, а при больших токах проявляются омические потери. При средних же токах имеет место практически только заряжение ДЭС без псевдоемкостных процессов и омических потерь. Поскольку заряжение ДЭС является обратимым процессом, то и КПД этого процесса максимален. Эта зависимость важна для практики применения ЭХСК для сглаживания пиковых нагрузок электрических сетей, поскольку в этом случае нужно стремиться работать в области максимального КПД. Область малых токов левее максимума на рис. 11 соответствует области большой псевдоемкости на рис. 10. В [44] была развита математическая модель, учитывающая как заряжение ДЭС, так псевдоемкость редокс-реакций ПГ. Из рис. 11 видно, что рассчитанная таким образом зависимость КПД от тока близка к экспериментальной, что подтверждает принятый механизм работы ЭХСК.
Рис. 11.
Теоретическая (1) и экспериментальная (2) зависимости КПД от тока для ЭХСК на основе АУ Norit.

Рис. 12.
Интегральные кривые распределения пор по эффективным радиусам, измеренные для сажи KJEC 600 МЭКП в октане (1) и в воде (2).
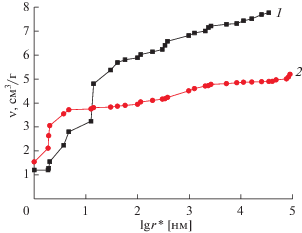
Влияние редокс-реакций ПГ групп было также исследовано в суперконденсаторе KJEC 600/Li с неводным электролитом: 1 М раствор LiPF6 в смеси этиленкарбонат (1/3), диэтилкарбонат (1/3), диметилкарбонат (1/3) [45]. На рис. 12 приведены интегральные кривые распределения пор по эффективным радиусам, измеренные для сажи KJEC 600 МЭКП в октане и в воде. Из этого рисунка видно, что пористость по октану существенно больше, чем пористость по воде, что говорит о наличии как гидрофильных, так и гидрофобных пор. Величины полной пористости по октану – 7.8 см3/г, гидрофильной пористости – 4.9 см3/г, гидрофобной пористости 2.9 см3/г. Интересно, что в области мелких пор с r ~ 10 нм эти кривые пересекаются, т.е. кривая по воде сдвинута в сторону меньших величин r* = r/cos θ по сравнению с октановой кривой, где r – истинный радиус пор, а θ – краевой угол смачивания в воде. Поскольку октан практически идеально смачивает все материалы, то для него θ ~ 0; следовательно это пересечение означает, что данный материал (KJEC 600) смачивается водой еще лучше, чем октаном. Это явление можно назвать “супергидрофильностью”. Его можно объяснить наличием большого количества поверхностных групп, которые гидратируются в воде, что приводит к набуханию материала. Из данных порометрических кривых, согласно [32], были рассчитаны величины площади удельной поверхности по октану (2500 м2/г) и воде (2600 м2/г) (см. табл. 1 ).
На рис. 13 представлены гальваностатические зарядные и разрядные кривые для суперконденсатора KJEC 600/Li для разных токов. Из этих кривых была рассчитана зависимость КПД по энергии от разрядного тока (см. рис. 14). Как видим, эта зависимость имеет максимум, как и у кривой на рис. 11 для АУ “РИКОН”, измеренной в водном электролите 1N LiClO4. Наличие этого максимума объясняется также тем, что вклад в емкость вносит как емкость ДЭС, так и псевдоемкость фарадеевских редокс-реакций ПГ.
Рис.13.
Гальваностатические зарядные и разрядные кривые для суперконденсатора KJEC 600/Li при удельных токах 500, 1000 и 2500 мА/г.

Рис. 14.
Зависимость КПД по энергии от разрядного тока для суперконденсатора KJEC 600/Li в неводном электролите.

В [45] было осуществлено математическое моделирование, которое учитывает оба этих процесса. Из сопоставления рассчитанных и измеренных зарядно-разрядных кривых, приведенных на рис. 13, видно, что эти кривые вполне удовлетворительно согласуются между собой, что может говорить о корректности модели. Найденные с помощью фитинга плотность тока обмена и удельная емкость ДЭС на истинную поверхность оказываются равны соответственно ${{i}_{{0,\,{\text{ad}}}}}$ = 3.6 × × 10–29 A/см2 и ${{С}_{{{\text{dl}}}}}$ = 4.7 мкФ/см2. Столь малые токи обмена начинают играть роль при достижении значительных перенапряжений, что видно по изменению наклона кривых заряжения.
Итеркаляция водорода в углерод
В литературе для АУ-суперконденсаторных электродов с водными электролитами обычно приводятся величины емкости ДЭС 50–200 Ф/г [7, 12–14, 19]. В [46] для углеродных материалов достигли предельной емкости 320 Ф/г за счет существенного вклада псевдоемкости квазиобратимых редокс-реакций ПГ. Однако, в последнее время в [17, 47, 48] были получены величины удельной емкости до 1100 Ф/г. В данной работе в качестве электролита в основном использовалась концентрированная серная кислота с концентрациями от 30 до 60%. В качестве электрода была использована АУТ СН900. Исследования проводились в широком интервале потенциалов от –0.8 до 1.0 В о. в. э. Возможность глубокого катодного заряжения до столь отрицательных потенциалов обеспечивалась большой поляризацией выделения водорода на углеродных материалах. На рис. 15 приведено сравнение циклических вольт-фарадных кривых, измеренных в 48.5% H2SO4 при разных скоростях развертки потенциала в двух областях потенциалов: в двойнослойной области (от 0.1 до 0.9 В) и в области глубокого заряжения (от –0.8 до 1 В). Из кривой 4, измеренной в первой обратимости следует, что здесь имеет место практически только заряжение ДЭС (так как форма кривых практически прямоугольная), а псевдоемкость редокс-реакций поверхностных групп в данном случае очень мала. Из кривой 4 следует, что величина емкости ДЭС приблизительно равна 160 Ф/г. Учитывая, что Sfi = 870 м2/г, получаем, что СДЭС ~ 18 мкФ/см2 истинной гидрофильной поверхности углерода. Эта величина близка к классической величине емкости ДЭС для платины [49]. В области отрицательных потенциалов (<‒0.1 В) (кривые 1–3) наблюдается протекание фарадеевских процессов с очень большой псевдоемкостью. Максимальный удельный заряд – 1560 Кл/г – был получен после заряда в течение 22 ч при потенциале E = –0.31 В о. в. э. в 56.4% H2SO4. В литературе ничего, даже близкого к этой величине, получено не было.
Рис. 15.
Вольт-фарадные циклические кривые для АУТ СН900. Скорости развертки потенциала, мВ/с: 0.5 (1), 1.0 (2), 2.0 (3, 4).

Рис. 16.
Зависимость удельного заряда АУТ СН900 от концентрации серной кислоты при времени заряда 18 ч, Еначальный = –0.34 В, Eконечный = 0.98 В и токе i = 90 мА/г.

На рис. 16 приведена зависимость максимального удельного заряда СН900 от концентрации серной кислоты для времени потенциостатического заряда 18 ч. Как видим, удельный заряд возрастает с увеличением концентрации серной кислоты. Как известно [50–52], в концентрированных растворах серной кислоты происходит ее интеркаляция в графит и в графитоподобные материалы, возрастающая с ростом этой концентрации. При этом происходит расширение щели между графеновыми слоями, куда проникает кислота. Известно также, что при адсорбции различных адсорбтивов в активированные угли происходит их некоторое разбухание [51]. Поскольку в АУ содержатся графитоподобные включения [53], то на основании всех этих данных можно предположить, что в данном случае имеет место двойная интеркаляция. Серная кислота интеркалирует в АУ, расширяя межслоевое (межграфеновое) пространство. Затем в это пространство при глубоком катодном заряжении АУ устремляются атомы водорода. Это межслоевое пространство служит транспортным путем для водорода. Затем он взаимодействует с графеновыми слоями с образованием в пределе соединения С6Н [54] (гидрид углерода или карбид водорода) (см. рис. 17).
Согласно закону Фарадея, для образования соединения С6Н требуется 1320 Кл/г. В данной же работе была получена максимальная величина Qmax = = 1560 Kл/г (это соответствует 1560 Kл/г/1.4 В = = 1100 Ф/г). Следовательно, на остальные перезаряжаемые процессы приходится 240 Kл/г. Эта величина включает в себя в первую очередь величину QДЭС = СДЭС∆Е, где ∆Е – интервал потенциалов. В данном случае ∆Е = 1.4 В, поэтому в первом приближении СДЭС = 240/1.4 = 170 Ф/г. Это приблизительно та же величина, которая была получена выше из кривой 4 рис. 15. Однако, это приблизительная оценка, поскольку величина СДЭС несколько зависит от потенциала, а также вследствие того, что небольшой вклад в величину Qmax вносит также псевдоемкость редокс-реакций поверхностных групп. Тем не менее, данная приблизительная оценка показывает корректность принятого механизма глубокого заряжения АУ.
В [17, 48] на основании полученных экспериментальных данных была разработана двумерная математическая модель заряда–разряда высокодисперсного углеродного электрода, учитывающая заряжение ДЭС, интеркаляцию водорода в углерод, твердофазную диффузию водорода, кинетику Батлера–Фольмера на межфазной поверхности, скорость адсорбции водорода, ионный перенос и распределение потенциала в пористом электроде. На рис. 18 представлен фитинг разрядной кривой для плотности тока 2 мА/см2. Как видим, расчетная кривая близка к экспериментальной, что говорит о корректности принятой математической модели. На основании этого фитинга была получена величина коэффициента твердофазной диффузии водорода в углерод АУ 10–14 см2/с а также плотность тока обмена интеркаляции водорода 0.5 × 10–8 А/см2.
Рис. 18.
Фитинг разрядной кривой для плотности тока 2 мА/см2. I – экспериментальная, II – расчетная кривые.

Кроме исследования глубокого катодного заряжения АУТ СН900 в растворах H2SO4, аналогичная работа была проведена для 90%-ного водного раствора H3PO4. Рассчитанная из этого графика величина удельного заряда равна 1200 Кл/г. Из рис. 15 следует, что при заряжении разряжении АУ-электрода СН900 вклад в емкость вносят заряжение ДЭС, а также псевдоемкость процесса интеркаляции водорода в углерод [17]. Однако, как показано выше (см. раздел 2.3), в общем случае в суммарную емкость АУ вносит вклад также псевдоемкость редокс-реакций ПГ. Это, например, следует из рис. 19, где представлены ЦВА кривые для АУ АГ-3 в 30% H2SO4 [54]. На этом рисунке кривая 4, измеренная в интервале потенциалов от +0.3 до +0.9 В включает в себя емкость ДЭС и псевдоемкость редокс-реакций поверхностных групп (см. участки А1 и К1), а ЦВА-кривые 1, 2, 3, измеренные в широком диапазоне от –0.8 до +0.9 В, включают в себя также псевдоемкость процесса интеркаляции водорода в углерод (участки А2 и К2), аналогично соответствующим кривым на рис. 15 для АУ СН900.
ЗАКЛЮЧЕНИЕ
Исследованы электрохимические, ионообменные, сорбционные, гидрофильно-гидрофобные свойства ряда типов электродов на основе активированных углей (АУ) и их пористая структура. Методом эталонной контактной порометрии было установлено, что все АУ имеют максимально широкий диапазон радиусов пор от долей нм до 100 мкм, т.е. более 5 порядков. Следовательно, АУ по широте диапазона размеров пор являются уникальными материалами. АУ обладают как гидрофильной, так и гидрофобной пористостью и высокой площадью удельной поверхности (600–2600 м2/г), что является причиной использования их в суперконденсаторах и для емкостной деионизации воды (ЕДВ). Обнаружено новое явление супергидрофильности вследствие набухания поверхностных групп в воде. Измерения поверхностной проводимости АУ показали, что даже в чистой воде АУ обладают существенной ионной проводимостью, что позволяет использовать их для получения чистой воды методом ЕДВ. Установлено, что АУ являются электроно-ионообменниками, что является их уникальной особенностью. Показано, что АУ обладают как катионообменными, так и анионообменными свойствами. Обнаружен существенный вклад псевдоемкости редокс-реакций поверхностных групп в полную емкость наряду с емкостью двойного электрического слоя. Это привело к наличию максимумов на зависимостях КПД по энергии от тока для суперконденсаторов с водным и неводным электролитами. Показано, что при глубоком катодном заряжении до отрицательных потенциалов относительно водородного электрода в концентрированной H2SO4 величина удельной емкости АУ достигает 1100 Ф/г в основном за счет псевдоемкости обратимой реакции интеркаляции водорода в углерод. Согласно закону Фарадея это соответствует образованию нового соединения C6H. В чистой воде получена удельная емкость АУ до 66 Ф/г, которая не увеличивается при увеличении концентрации KCl, что свидетельствует о том, что эта емкость обусловлена поверхностными группами.
Список литературы
Тютюнник, В.М. Химики-лауреаты ленинской премии, Новое в жизни, науке, технике, Сер. Химия. М.: Знание, 1978. № 9. 64 с.
Khrushcheva, M.L. За что академик А.Н. Фрумкин получил премию им. В.И. Ленина. Soc. Science and Technology, 2018. vol. 9. no. 4.
Адсорбенты, их получение, свойства и применение. Отв. ред. Дубинин, М.М., Плаченов, Т.Г. 1962, Ленинград. Наука.
Kinoshita, K., Carbon: electrochemical and physicochemical properties. N.Y., 1988.
Gregg, S.J. and Sing, K.S.W., Adsorption, Surface Area and Porosity, N.Y., Academic Press, 1967.
Тарасевич, М.Р. Электрохимия углеродных материалов. М.: Наука, 1984.
Conway, B.E., Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications, 1999, Springer.
Mattson, J.S. and Makr, H.B. Activated carbon. N.Y.: Marcel Dekker, 1971. 237 p.
Тарковская, И.А. Окисленный уголь. Киев: Наукова думка, 1981. 198 с.
Volfkovich, Yu.M., Filippov, A.N., and Bagotsky, V.S., Structural properties of porous materials and powders used in different fields of science and technology, N.Y.: Springer, 2014.
Burke, A., Ultracapacitors: why, how, and where is the technology, J. Power Sources, 2000, vol. 91, p. 37.
Вольфкович, Ю.М., Сердюк, Т.М. Электрохимия. 2002. Т. 38. С. 1043. [Volfkovich, Yu.M. and Serdyuk, T.M. Electrochemical capacitors, Russ. J. Electrochem., 2002, vol. 38, p. 935.]
Pandolfo, A.G. and Hollenkamp, A.F., Carbon properties and their role in supercapacitors, J. Power Sources, 2006, vol. 157, p. 11.
Sharma, P. and Bhatti, T.S., A review on electrochemical double-layer capacitors, Energy Conversion and Management, 2010, vol. 51, p. 2901.
Bagotsky, V.S., Skundin, A.M., and Volfkovich, Yu.M., Electrochemical Power Sources. Batteries, Fuel Cells, Supercapacitors. N.J. Jhon Wiely & Sons Inc. Publisher, 2015, 372 p.
Chen, H., Cong, T.N., Yang, W., Tan, C., Li, Y., and Ding, Y., Progress in electrical energy storage system: A critical review, Prog. Nat. Sci., 2009, vol. 19, p. 291.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., and Bagotsky, V.S., Supercapacitor carbon electrodes with high capacitance, J. Solid State Electrochem., 2014, vol. 18, p. 1351.
Вольфкович, Ю.М., Мазин, В.М., Урссон, Н.А. Работа двойнослойного конденсатора на основе углеродных материалов. Электрохимия. 1998. Т. 34. С. 825. [Volfkovich, Yu.M., Mazin, V.M., and Urisson, N.A., Operation of double-layer capacitors based on carbon materials, Russ. J. Electrochem., 1998, vol. 34, p. 740.]
Inagaki, M., Konno, H., and Tanaike, O., Carbon materials for electrochemical capacitors, J. Power Sources, 2010, vol. 195, p. 7880.
Faisal, A., Marzooqi, Al., Amal, A., Ghaferi, A., Saadat, I., and Hilal, N., Application of Capacitive Deionisation in water desalination: A review, Desalination, 2014, vol. 342, p. 3.
Farmer, J.C., Fix, D.V., Mack, G.V., Pekala, R.W., and Poco, J.F., “The Use of Capacitive Deionization with Carbon Aerogel Electrodes to Remove Inorganic Contaminants from Water,” Low Level Waste Conference, Orlando, USA, 1995.
Oren, Y., Desalination. Capacitive deionization (CDI) for desalination and water treatment – past, present and future (a review), Desalination, 2008. vol. 228. p. 10.
Strathmann, H., Ion-Exchange Membrane Processes in Water Treatment Sustainability Scienceand Engineering, Elsevier Pabl., 2010.
Avraham, E., Noked, M., Bouhadana, Y., Soffer, A., and Aurbach, D., Limitations of charge efficiency in capacitive deionization II. On the behavior of cdi cells comprising two activated carbon electrodes, J. Electrochem. Soc., 2009, vol. 156, p. 157.
Suss, M.E., Baumann, T.F., Bourcier, W.L., Spadaccini, C.M., Rose, K.A., Santiago, J.G., and Stadermann, M., Capacitive desalination with flow-through electrodes, Energy Environ. Sci., 2012, vol. 5, p. 9511.
Rica, R.A., Ziano, R., Salerno, D., Mantegazza, F., and Brogioli, D., Thermodynamic Relation between Voltage-Concentration Dependence and Salt Adsorption in Electrochemical Cells, Phys. Rev. Lett, 2012, vol. 109, p. 156103.
Porada, S., Zhao R., Van Der Wal, A., Presser, V., and Biesheuvel, P.M., Review on the science and technology of water desalination by capacitive deionization, Prog. Mater. Sci., 2013, vol. 58, p. 1388.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., Rychagov, A.Yu., Sosenkin, V.E., Milyutin, V.V., and Park, D., Electrodes Based on Carbon Nanomaterials: Structure, Properties and Application to Capacitive Deionization in Static Cells. Cahapter 9. Nano-Optics, Nanophotonics, Nanomaterials, and Their Applications. Edited by Olena Fesenko and Leonid Fesenko. Shpringer Publ., 2018, p. 127.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., Rychagov, A.Yu., Sosenkin, V.E., and Park, D.C., Capacitive deionization of aqueous solutions. modeling and experiments, Desalination and water treatment, 2017, vol. 69, p. 130.
Бутырин, Г.М. Высокопористые углеродные материалы. Химия. 1976. 190 с.
Volfkovich, Yu.M. and Bagotzky, V.S., The method of standard porosimetry 2. Investigation of the formation of porous structures, J. Power Sources, 1994, vol. 48, p. 339.
Volfkovich, Yu.M., Filippov, A.N., and Bagotsky, V.S., Structural properties of porous materials and powders used in different fields of science and technology, Springer Publ., London, 2014.
Volfkovich, Yu.M., Sakars, A.V., and Volinsky, A.A., Application of the standard porosimetry method for nanomaterials, Int. J. Nanotechnology, 2005, vol. 2, p. 292.
Dzyazko, Yu.S., Ponomaryova, L.N., Volfkovich, Yu.M., Trachevskii, V.V., and Palchik, A.V., Ion-exchange resin modified with aggregated nanoparticles of zirconium hydrophosphate. Morphology and functional properties, Microporous and Mesoporous Materials, 2014, vol. 198, p. 55.
Rouquerol, J., Baron, G., Denoyel, R., Giesche, H., Groen, J., Klobes, P., Levitz, P., Neimark, A.V., Rigby, S., Skudas, R., Sing, K., Thommes, M., and Unger, K., Pure Appl. Chem., 2012, vol. 84, p. 107.
Вольфкович, Ю.М., Михалин, А.А., Рычагов, А.Ю. Измерение поверхностной проводимости пористых углеродных электродов. Электрохимия. 2013. Т. 49. С. 667. [Volfkovich, Yu.M., Mikhalin, A.A., and Rychagov, A.Yu., Surface Conductivity Measurements for Porous Carbon Electrodes. Russ. J. Electrochem., 2013. vol. 49, p. 594.]
Volfkovich, Yu.M., Rychagov. A.Yu., Mikhalin, A.A., Kardash, M.M., Kononenko, N.A., Ainetdinov, D.V., Shkirskaya, S.A., and Sosenkin, V.E., Capacitive deionization of water using mosaic membrane, Desalination, 2018, vol. 426, p. 1.
Goertzen, S.L., Theriault, K.D., Oickle, A.M., Tarasuk, A.C., and Andreas, H.A., Standardization of the Boehm titration. Part I. CO2 expulsion and endpoint determination, Carbon, 2010, vol. 48, p. 1252.
Oickle, A.M., Goertzen, S.L., Hopper, K.R., Abdalla, Y.O., and Andreas, H.A. Standardization of the Boehm titration: Part II. Method of agitation, effect of filtering and dilute titrant, Carbon, 2010. vol. 48. p. 3313.
Вольфкович, Ю.М., Горончаровская, И.В., Евсеев, А.К., Сосенкин, В.Е, Гольдин, М.М. Влияние электрохимического модифицирования активированных углей полипирролом на их структурные характеристики, состав поверхностных соединений и адсорбционные свойства. Электрохимия. 2017. Т. 53. С. 1616. [Vol’fkovich, Yu.M., Goroncharovskaya, I.V., Evseev, A.K., Sosenkin, V.E., and Gol’din, M.M., The Effect of Electrochemical Modification of Activated Carbons by Polypyrrole on Their Structure Characteristics, Composition of Surface Compounds, and Adsorption Properties, Russ. J. Electrochem., 2017, vol. 53, p. 1363.]
Фридрихсберг, Д.А. В сб.: Электрокинетические свойства капиллярных систем под ред. Жукова И.И. М.: Изд. АН СССР, 1956. С. 156.
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. Химия. М.: 2008. 298 с.
Фрумкин, А.Н. Потенциалы нулевого заряда. М.: Наука, 1979.
Volfkovich, Yu.M., Bograchev, D.A., Rychagov, A.Yu., Sosenkin, V.E., and Chaika, M.Yu., Supercapacitors with carbon electrodes. Energy efficiency: modeling and experimental verification, J. Solid State Electrochem., 2015, vol. 19, p. 1.
Bograchev, D.A., Gryzlov, D.Yu., Sosenkin, V.E., and Volfkovich, Yu.M., Modeling and experimental verification of operation of supercapacitors with carbon electrodes in non-aqueous electrolytes. The energy efficiency, Electrochim. Acta, 2019, vol. 319, p. 552.
Bleda-Martinez, M.J., Agull, J.A., Lozano-Caste, D., Morall, E., Cazorla-Amor, D., and Linares-Solano, A. Role of surface chemistry on electric double layer capacitance of carbon materials, Carbon, 2005, vol. 43, p. 2677.
Вольфкович, Ю.М., Михалин, А.А., Бограчев, Д.А., Сосенкин, В.Е. Углеродные электроды с большой псевдоемкостью для суперконденсаоров. Электрохимия. 2012. Т. 48. С. 4667. [Vol’fkovich, Yu.M., Mikhalin, A.A., Bograchev, D.A., and Sosenkin, V.E., Carbon electrodes with high pseudocapacitance for supercapacitors. Russ. J. Electrochem., 2012, vol. 48, p. 424.]
Volfkovich, Yu.M., Mikhailin, A.A., Bograchev, D.A., Sosenkin, V.E., and Bagotsky, V.S., Studies of supercapacitor carbon electrodes with high pseudocapacitance. “Chapter 7 in book: "Recent Trend in Electrochemical Science and Technology, INTECH open access publisher. 2012. www.intechopen.com. p. 159.
Фрумкин, А.Н., Багоцкий, В.С., Иофа, З.А., Кабанов, Б.Н. Кинетика электродных процессов. М.: Изд-во. МГУ, 1952
Убеллоде, А.Р., Льюис, Ф.А. Графит и его кристаллические соединения. 1965. М.: Мир, 256 с.
Фиалков, А.С. Углерод, межслоевые соединения икомпозиты на его основе. Аспект Пресс. 1997. 718 с.
Yakovlev, V.Yu., Fomkin, A.A., and Tvardovski, A.V., J. Colloid and Interface Sci., 2004. vol. 280. p. 305.
Фенелонов, В.Б. Пористый углерод. Новосибирск: Изд. Ин-та катализа, 1995. 518 с.
Рычагов, А.Ю., Вольфкович Ю.М. Малообратимые процессы заряжения на высокодисперсных углеродных электродах. Электрохимия. 2009. Т. 45. С. 323. [Rychagov, A.Yu. and Volfkovich, Yu.M. Low reversible charging processes on highly dispersed carbon electrodes, Russ. J. Electrochem., 2009. vol. 45, p. 304.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия







