Электрохимия, 2020, T. 56, № 11, стр. 1034-1041
Кинетика медиаторного биоэлектрокаталитического окисления глюкозы белковыми экстрактами Escherichia coli
М. В. Дмитриева a, *, И. Н. Шишов b, С. В. Шмалий b, В. Д. Мязин b, А. Ю. Баженов b, Е. В. Герасимова a, Е. В. Золотухина a, c
a Институт проблем химической физики
Черноголовка, Россия
b Московский государственный университет
Москва, Россия
c Московский физико-технический институт
Долгопрудный, Россия
* E-mail: angel.maria@mail.ru
Поступила в редакцию 25.10.2019
После доработки 06.04.2020
Принята к публикации 15.05.2020
Аннотация
Изучена кинетика реакции биоэлектрокаталитического окисления глюкозы белковыми экстрактами, полученными посредством ультразвукового разрушения клеток Escherichia coli BB, в присутствии [Fe(CN)6]3– в качестве медиаторной системы. С использованием электрохимических методов исследовано влияние концентраций медиатора, глюкозы и белкового экстракта, и по полученным результатам определены значения эффективных параметров: константы скорости биоокисления глюкозы, константы субстратного ингибирования и энергии активации. Показано, что значение энергии активации изучаемой реакции соответствует диапазону энергии активации для дегидрогеназных реакций. Определены вольт-амперные характеристики модельного ассиметричного биотопливного элемента, работающего на белковом экстракте в качестве анодного катализатора. Максимальная удельная мощность такого модельного биотопливного элемента составила 400 мкВт/см2 (4000 мВт/м2).
ВВЕДЕНИЕ
Высокая селективность и чувствительность биоэлектрокатализаторов к большому ряду субстратов, а также очевидные перспективы их применения в биосенсорах и биотопливных элементах являются основными причинами большого интереса к таким системам. На данный момент уже существуют экспериментальные образцы биологических топливных элементов, которые разработаны в качестве переносных источников питания для устройств, потребляющих низкую мощность электроэнергии (мобильные телефоны, самопитаемые биосенсоры, устройства для энергоснабжения имплантируемых медицинских приборов) [1].
Биоэлектрокатализ можно рассматривать как ускорение электрохимического процесса биологическим агентом. Для эффективного биоэлектрокатализа необходимо взаимодействие ферментативной реакции в растворе и электрохимической реакции на поверхности инертного электрода. Существуют два различных способа сопряжения биокаталитической и электрохимической реакций: прямой биоэлектрокатализ и медиаторный биоэлектрокатализ [2].
Прямой биоэлектрокатализ установлен лишь для ограниченного числа редокс-ферментов [3]. В остальных случаях перенос электронов между биокатализатором (фермент, микроорганизмы, белковый субстрат и т.д.) и электродом происходит за счет медиаторов. Медиаторный биоэлектрокатализ в общем случае можно описать в виде пинг-понг механизма: ферментативное окисление субстрата (глюкозы), электронный перенос между ферментом и редокс-медиатором, диффузия восстановленного медиатора к поверхности электрода. В случае, когда перенос электронов через редокс-медиатор происходит очень быстро по сравнению со скоростью ферментативной реакции, то электродная реакция будет следовать псевдокинетике первого порядка. Для такого случая общая скорость процесса медиаторного окисления
(1)
${{{\text{S}}}_{{{\text{red}}}}} + {{{\text{E}}}_{{{\text{ox}}}}}\underset{{{{k}_{{ - 1}}}}}{\overset{{{{k}_{1}}}}{\longleftrightarrow}}\,\,[{\text{E}} - {\text{S}}]\xrightarrow{{{{k}_{2}}}}{{{\text{E}}}_{{{\text{red}}}}} + {{{\text{P}}}_{{{\text{ox}}}}},$(2)
${{{\text{M}}}_{{{\text{ox}}}}} + {{{\text{E}}}_{{{\text{red}}}}}\underset{{{{k}_{{ - 3}}}}}{\overset{{{{k}_{3}}}}{\longleftrightarrow}}\,\,[{\text{E}} - {\text{M}}]\xrightarrow{{{{k}_{4}}}}{{{\text{E}}}_{{{\text{ox}}}}} + {{{\text{M}}}_{{{\text{red}}}}},$(3)
${{{\text{M}}}_{{{\text{red}}}}}\xrightarrow{{{\text{электрод}}}}{{{\text{M}}}_{{{\text{ox}}}}} + {\text{e}}$(4)
$v = \frac{{{{v}_{{\max }}}}}{{{{1 + {{K}_{{\text{M}}}}} \mathord{\left/ {\vphantom {{1 + {{K}_{{\text{M}}}}} {[{{{\text{M}}}_{{{\text{ox}}}}}]}}} \right. \kern-0em} {[{{{\text{M}}}_{{{\text{ox}}}}}]}} + {{{{K}_{{\text{s}}}}} \mathord{\left/ {\vphantom {{{{K}_{{\text{s}}}}} {[{\text{S}}]}}} \right. \kern-0em} {[{\text{S}}]}}}},$(5)
${{v}_{{\max }}} = {{K}_{{{\text{cat}}}}}[{\text{E}}] = \frac{{{{k}_{2}}{{k}_{4}}}}{{{{k}_{2}} + {{k}_{4}}}}[{\text{E}}].$Существуют различные электрохимические методы для определения кинетики реакций, основанных на медиаторном биоэлектрокатализе. В основе всех этих методов лежит основной принцип: определение биокаталитических параметров основывается на измерении токовых откликов, полученных в результате реакций, протекающих между биокатализатором, субстратом и редокс-медиатором. Важным требованием к медиатору является его стабильность в окисленной и восстановленной формах, а также способность быстро взаимодействовать с биокатализатором [8]. Ряд исследователей изучают кинетику биоэлектрокаталитических реакций при использовании метода циклической вольтамперометрии [9–13], другие же используют хроноамперометрический метод [14, 15], нередко предпочтение отдается методикам с применением вращающегося дискового электрода [16–20], благодаря возможности определять образование продукта биокаталитической реакции или изменение концентрации субстрата.
Ранее мы сообщали о новом типе биоэлектрокатализатора – белковом ферментном экстракте, полученном путем ультразвуковой дезинтеграции мембран микробных клеток [21, 22]. Целью настоящего исследования является изучение кинетики биоокисления глюкозы белковым ферментным экстрактом Escherichia coli BB (E. coli BB) посредством электрохимического метода и проверка работоспособности анодного биоэлектрокатализатора в ассиметричной биотопливной ячейке специальной конструкции.
МЕТОДИКА ЭКСПЕРИМЕНТА
Реагенты
KH2PO4, K2HPO4, KOH, TRIS (Sigma Aldrich, p. a.) были использованы для приготовления буферных растворов в тридистиллированной воде (SZ97A Automatic third pure-water distillator, Shanghai Yarong Biochemistry instrument factory). Феррицианид калия (Alfa Aesar, >98%, p. a.) был использован в качестве редокс-медиатора. Глюкоза (Avogadro, ultrapure) была использована в качестве субстрата.
Получение белкового экстракта из E. coli
Бактерии выращивали в среде Lysogeny broth (LB), содержащей 1% (в/о) пептона Bacto™ (“BD”, США), 0.5% (в/о) дрожжевого экстракта Bacto™ (“BD”, США), 1% (в/о) NaCl и 0.1% (в/о) глюкозу. Колонию E. coli BB, выращенную на твердой среде (LB, 2% агар) инокулировали в 10 мл LB для получения ночной культуры. Ночную культуру (1 мл) вносили в 100 мл LB в 500-мл колбах и выращивали при 37°С при интенсивной аэрации. Через 6 ч после начала выращивания бактерии осаждали центрифугированием при 1700 g и использовали для получения экстракта.
Осажденные бактерии ресуспендировали в 50 мМ калий-фосфатном буферном растворе, pH 7.1, из расчета 1 мл на 50 мл выращенной культуры. Клетки разрушали на льду на ультразвуковом дезинтеграторе УЗДН-2Т при частоте 22 кГц в ходе пяти серий по 10 с, охлаждая образцы между сериями. Экстракты осветляли центрифугированием при 15 000 g в течение 15 мин. Экстракты хранили при температуре –20°С. Дегидрогеназную активность полученных экстрактов определяли при помощи 2,3,5-трифенилтетразолия хлорида (ТТХ), который под действием дегидрогеназ восстанавливается до ТТХ-формазана, методика определения описана в предыдущей работе [22].
Электрохимические измерения
Электрохимические эксперименты проводили на потенциостате Autolab PGSTAT 101 (“Metrohm”, Нидерланды) в стандартной стеклянной трехэлектродной ячейке с разделенными пространствами, содержащей 15 мл буферного раствора в качестве фонового электролита. В качестве рабочего электрода использовался стеклоуглеродный дисковый электрод площадью 0.07 см2. Потенциометрические измерения проводили относительно насыщенного хлоридсеребряного электрода сравнения, отделенного от рабочего отделения ячейки стеклянной фриттой. Вспомогательным электродом служила платиновая фольга, также отделенная от рабочего отделения ячейки стеклянной фриттой (для исключения влияния процессов на противоэлектроде). Большинство экспериментов проводилось в инертной атмосфере, дегазирование осуществляли посредством линии Шленка. Активные вещества (медиатор, глюкоза, экстракт биомассы) вводили непосредственно в ячейку, находящуюся под давлением аргона (20 мбар). Все измерения проводились в двух режимах поляризации: 1) потенциодинамический (циклическая вольтамперометрия со скоростью развертки потенциала 20 и 100 мВ/с); 2) потенциостатический (потенциал поляризации для феррицианида калия составил 0.5 В). Измерения проводили при постоянном перемешивании раствора магнитной мешалкой (150 об/мин).
Модельная биотопливная ячейка
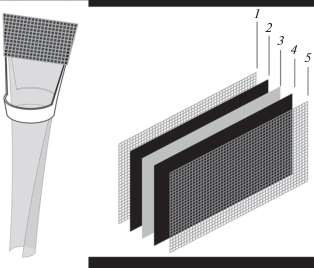
Для изучения вольт-амперных характеристик топливного элемента (ТЭ) с биоанодом на основе исследуемого белкового экстракта была спроектирована модельная биотопливная ячейка. Такая модель представляет собой ассиметричную двухкамерную ячейку с воздушным катодом (20 мас. % Pt/C, HiSPEC) и ионообменной мембраной Nafion 212. Катод (рис. 1) представляет собой два газодиффузионных слоя (ГДС) из углеродной бумаги FreudenbergH23C5 с напыленным слоем платина-углеродного катализатора 20 мас. % Pt/C (HiSPEC), прижатые вплотную к протонообменной мембране Nafion 212. Поджим газодифузионных слоев и токосъема осуществляли при помощи серебряной сетки; жесткость конструкции придается рамкой, которая образована двумя пластиковыми цилиндрами с прорезями и кольцом, в которое пропускается мембрана для придания ей жесткости. Мембрана ориентирована вертикально, ионная проводимость осуществляется вдоль мембраны [23], поскольку ее нижняя часть опущена в емкость с рабочим раствором, содержащим компоненты биоанода. Это, с одной стороны, дает возможность погружать в рабочий раствор только часть ТЭ по аналогии с работой Miyake et al. [32], а с другой – защищает материал воздушного катода от нежелательного воздействия компонентов рабочего раствора биоанода.
Анодная полуячейка представлена рабочим раствором, содержащим белково-ферментный комплекс и медиатор, в который погружен электрод (в данной работе использована платиновая проволока площадью 0.004 см2), на котором по реакции (3) электрохимически окисляется восстановленная форма медиатора, образующаяся в объеме раствора в ходе реакции (2). На основании исследований, представленных в работе [22], в качестве рабочего раствора был выбран буферный раствор 0.1 М TRIS, рН 7.2. Общая схема такой ячейки представлена на рис. 2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как было показано ранее [22], исследуемый белковый экстракт содержит НАД-зависимую дегидрогеназу с активным центром Fe3+. Окисление глюкозы кишечной палочкой в процессе ее питательного цикла приводит к образованию ряда продуктов и электронов [24, 25]. Перенос этих электронов между электродом и ферментной системой в растворе возможен за счет редокс-медиаторной системы (растворимой соли феррицианида калия в нашем случае). Это означает, что в растворе и на поверхности электрода происходят реакции с участием электронов.
Измерения электрохимической активности экстракта, полученного из культуры E. coli BB, в присутствии как субстрата (глюкозы), так и медиаторной системы проводили в потенциостатическом режиме. Для исключения влияния катодного процесса на измеряемый ток было выбрано значение потенциала поляризации в анодной области за потенциалом анодного пика. Медиатор в исходном растворе глюкозы (без добавления ферментного экстракта) находится в окисленном состоянии. Добавление белкового экстракта в раствор приводит как к окислению глюкозы, так и к восстановлению медиатора, поскольку субстрат и медиатор способны непосредственно взаимодействовать с коферментом или ферментом. При высоком анодном потенциале окисление медиатора на поверхности электрода происходит быстро (в момент, когда восстановленная форма медиатора достигла поверхности электрода). В перемешиваемом растворе концентрация медиатора вблизи поверхности электрода устанавливается мгновенно. Таким образом, измеряемый ток (реакция (3)) пропорционален концентрации продукта, образующегося в ходе реакций (1) и (2).
В случае, когда начальная концентрация медиатора в растворе равна или превышает концентрацию образующихся электронов в реакции (1), то скорость реакции (2) не зависит от начальной концентрации [Fe(CN)6]3– в растворе. Когда концентрация медиатора в растворе более низкая, то недостаток медиатора приводит к низкой скорости реакции (3).
Так как белковый экстракт, полученный в различных синтезах, может различаться по содержанию белка, необходимо использовать какую-либо удельную характеристику для сравнения. Однако расчет удельных плотностей тока в случае использования белковых экстрактов не является тривиальной задачей, поскольку содержание белка в экстракте включает не только ферменты группы глюкозодегидрогеназ (которые активны в реакции окисления глюкозы), но и все другие белки, образующиеся во время распада мембраны клеток. Это означает, что для расчета удельных плотностей тока нужна информация о присутствии глюкозодегидрогеназы в экстракте. По этой причине мы использовали сведения о дегидрогеназной активности, измеренной через превращение ТТХ в формазан [21]. Эта активность оценивалась как мг (или моль) формазана на мг белка [26]. В предположении, что TTX и фермент реагируют в эквивалентных количествах, можно оценить удельную плотность тока на моль формазана (мкА см–2 на моль формазана). Такое приближение уже успешно использовалось в нашей предыдущей работе [22]. Измеряемая плотность тока пропорциональна концентрации медиатора в восстановленной форме. Окисление восстановленной формы медиатора на поверхности электрода в потенциостатических условиях при потенциале 0.5 В отн. Ag|AgCl ограничивается только диффузией электроактивных частиц к поверхности электрода.
Для вычисления концентрации восстановленной формы медиатора построили калибровочную кривую (плотность тока–концентрация [Fe(CN)6]4–), измеренную в том же фоновом растворе и гидродинамическом режиме, что и в биоэлектрокаталитических экспериментах. Полученный калибровочный коэффициент составил 144 мкA cм–2 мM–1. Таким образом, концентрация восстановленной формы медиатора [Fe(CN)6]4– может быть непосредственно рассчитана по измеренной плотности тока с помощью параметров калибровочной кривой. Как можно видеть из рис. 3, когда концентрация медиатора в 10 раз ниже концентрации фермента, то концентрация восстановленной формы не может быть обнаружена на электроде (кривая 1). Увеличение концентрации медиатора в растворе приводит к увеличению концентрации восстановленной формы в растворе, однако для диапазона концентраций 0.055–0.25 мМ это увеличение происходит только в кратковременном диапазоне. Через несколько минут после начала реакции концентрация [Fe(CN)6]4– практически не изменяется. Начальная скорость биоэлектрохимического процесса, оцененная по начальным участкам кинетических кривых на рис. 3, зависит от концентрации медиатора в растворе до концентрации в 1 мМ. Увеличение же концентрации медиатора приводит к кинетике нулевого порядка для медиатора (рис. 4).
Рис. 3.
Изменение концентрации [Fe(CN)6]4– во времени в растворе 0.6 мл белкового экстракта, полученного из 6-часовой культуры E. coli BB (0.06 мM дегидрогеназ) и 4.6 мM глюкозы в 0.5 M калий фосфатном буферном растворе, pH 7.2 при 32°C при различных начальных концентрациях [Fe(CN)6]3–, мM: 1 – 0.005; 2 – 0.055; 3 – 0.125, 4 – 0.139, 5 – 0.25; 6 – 0.5; 7 – 1.0.

Рис. 4.
Зависимость скорости окисления глюкозы в растворе 0.6 мл белкового экстракта, полученного из 6-часовой культуры E. coli BB (0.06 мM дегидрогеназ) и 4.6 мM глюкозы в 0.5 M калий фосфатном буферном растворе, pH 7.2 при 32°C, от концентрации [Fe(CN)6]3–.

Рис. 5.
Конверсия медиатора в растворе 0.6 мл белкового экстракта, полученного из 6-часовой культуры E. coli BB (0.06 мМ дегидрогеназ) и 4.6 мМ глюкозы в 0.5 M калий фосфатном буферном растворе, pH 7.2 при 32°C. Продолжительность эксперимента 2000 с.

Конверсия медиатора в растворе через 30 мин от начала реакции составила 20% для 1 мМ раствора медиатора и 5% для 5 мМ (рис. 5), что говорит о недостатке медиатора в разбавленных растворах и приводит к ограничению скорости биоэлектрохимической реакции.
Таким образом, когда скорость реакции не зависит от концентрации медиатора, можно считать, что она лимитирована только параметрами биохимической реакции (1). В квазистационарных условиях кинетика ферментативного катализа описывается уравнением Михаэлиса–Ментен (6)
(6)
$v = \frac{{{\text{d}}{{c}_{{{{{\text{M}}}_{{{\text{red}}}}}}}}}}{{{\text{d}}t}} = \frac{{{\text{d}}{{c}_{{\text{P}}}}}}{{{\text{d}}t}} = \frac{{{{k}_{3}}c_{{\text{E}}}^{0}}}{{{{c}_{{{\text{Glucose}}}}} + {{K}_{{\text{M}}}}}}{{c}_{{{\text{Glucose}}}}},$В условиях, когда концентрация глюкозы значительно превышает константу Михаэлиса, скорость биокаталитической реакции максимальна и зависит только от концентрации фермента.
(7)
${{v}_{{\max }}} = {{\left( {\frac{{{\text{d}}{{c}_{\operatorname{P} }}}}{{{\text{d}}t}}} \right)}_{{\max }}} = {{k}_{3}}c_{{\text{E}}}^{0}.$Для оценки максимальной скорости и константы скорости k3 были проведены эксперименты с варьированием содержания экстракта в реакционной смеси. Как видно из рис. 6а, увеличение содержания фермента в растворе приводит к соответствующим изменениям плотности тока. Начальная скорость процесса окисления глюкозы пропорциональна содержанию фермента в растворе (рис. 6б). Константа скорости, k3, рассчитанная как наклон этой зависимости, составила 0.004 с–1.
Рис. 6.
Изменение плотности тока во времени при различных концентрациях экстракта (a) и зависимость максимальной скорости биокаталитической реакции от концентрации глюкозодегидрогеназы в растворе (б). Состав раствора: 5 мМ K3[Fe(CN)6] и 4.6 мМ глюкозы в 0.5M калий-фосфатном буферном растворе, pH 7.2 при 32°C, 1 – 0.3 мл экстракта (0.025 мМ), 2 – 0.6 мл экстракта (0.050 мМ), 3 – 0.9 мл экстракта (0.075 мМ).

Другим важным параметром является концентрация глюкозы. Известно, что увеличение концентрации субстрата в некоторых случаях может привести к субстратному ингибированию биокаталитической реакции [28] за счет образования устойчивых комплексов с субстратом. Как видно (рис. 7а), зависимость скорости реакции от концентрации глюкозы в растворе при концентрации фермента 0.06 мМ является типичной для случая субстратного ингибирования [29]. При малых концентрациях глюкозы 1 мкМ–1 мМ наблюдается рост токовых откликов и, соответственно, скорости окисления, при увеличении концентрации глюкозы в растворе более 2–3 мМ наблюдается заметное снижение скорости окисления вследствие субстратного ингибирования. В соответствии с уравнением (8) можно оценить константу ингибирования Ki для этой реакции (рис. 7б) и максимальную скорость реакции vmax.
(8)
$\frac{1}{v} = \frac{1}{{{{v}_{{\max }}}}} + \frac{{{{c}_{{{\text{Glucose}}}}}}}{{{{v}_{{\max }}}{{K}_{{\text{i}}}}}}.$Рис. 7.
(а) Начальная скорость окисления глюкозы в зависимости от начальной концентрации глюкозы в растворе и (б) скорость окисления глюкозы в зависимости от текущей концентрации глюкозы в растворе в критериальных координатах уравнения (6). Состав раствора: 0.6 мл белкового экстракта, полученного из 6-часовой культуры E. coli BB (0.06 мМ дегидрогеназ) и 5 мМ K3[Fe(CN)6] в 0.5 M калий-фосфатном буферном растворе, pH 7.2 при 35°C.

Рассчитанное значение константы субстратного ингибирования для изучаемой биокаталитической реакции составляет 0.2 М, а значение максимальной скорости реакции – 2.3 × 10–4 мМ/с, что хорошо согласуется с данными, полученными из рис. 6б.
Кинетические данные, найденные посредством электрохимических измерений, также могут быть использованы для вычисления энергии активации биокаталитической реакции окисления глюкозы. Зависимость константы скорости реакции от температуры описывается уравнением Аррениуса. Эта зависимость была изучена в температурном диапазоне от 27 до 60°С при найденных ранее оптимальных значениях рН и концентрации буферного раствора [22]. Как видно из рис. 8, эта зависимость хорошо согласуется с данными, полученными для чистых ферментов в реакции окисления глюкозы [26]. Имеются две части кривой, соответствующие активации и инактивации ферментативной реакции. Энергия активации, вычисленная в температурном диапазоне 27–45°С, составляет 35 кДж моль–1. Это значение согласуется с известным диапазоном энергии активации 40–80 кДж моль–1 для глюкозодегидрогеназных реакций [30]. Оптимальный температурный диапазон для белкового экстракта составляет 35–40°С. Это означает, что при такой температуре можно получить максимальную удельную мощность биотопливных элементов, работающих на белковом экстракте в качестве биоэлектрокатализатора.
Рис. 8.
Зависимость Аррениуса для константы скорости окисления глюкозы. Состав раствора: 0.6 мл белкового экстракта, полученного из 6-часовой культуры E. coli BB (0.06 мМ дегидрогеназ) и 5 мМ K3[Fe(CN)6] в 0.5 M калий-фосфатном буферном растворе, pH 7.2 при 35°C.

Основываясь на найденных параметрах биоэлектрохимической реакции, проверяли биоэлектрокаталитическую активность получаемых экстрактов в модельной асимметричной топливной ячейке с воздушным катодом, подробное описание конструкции которой приведено в методической части. В рабочей анодной камере использовали раствор при температуре 38°C с концентрациями растворов глюкозы и медиатора, указанными на рис. 9. Как видно из рис. 9, максимальная удельная мощность такого модельного биоэлемента составила 400 мкВт/см2 (4 Вт/м2). Полученная величина сопоставима с данными для микробного топливного элемента на основе Escherichia coli – 1.6 Вт/м2 [31] и превышает известные значения удельной мощности от 0.175 до 95 мкВт/см2 для различных имплантируемых ферментативных топливных элементов [33].
ЗАКЛЮЧЕНИЕ
Таким образом, электрохимический метод может быть использован для изучения кинетических параметров биокаталитической реакции в растворе в случае медиаторного электрокатализа. Оцененные значения константы скорости, константы ингибирования и энергии активации реакции окисления глюкозы белковым ферментным экстрактом Escherichia coli выглядят обоснованными.
Изучаемый белковый экстракт показал электрохимические характеристики, не уступающие и в некоторых случаях даже превосходящие результаты, полученные с использованием чистых ферментов или микроорганизмов. На наш взгляд, для практического использования полученный экстракт имеет определенные преимущества как перед живыми микроорганизмами, так и перед чистыми ферментами. С одной стороны, нет зарастания мембраны и быстрой пассивации электрода, что наблюдается при использовании живых клеток, поэтому можно применять простые по конструкции ячейки. Кроме того, свойства экстракта более предсказуемы в сравнении со свойствами живого микроорганизма. С другой стороны, в сравнении с чистыми ферментами технология получения экстракта гораздо проще и экономичнее.
Список литературы
Cosnier, S., Gross, A.J., Le Goff, A., and Holzinger, M., Recent advances on enzymatic glucose/oxygen and hydrogen/oxygen biofuel cells: Achievements and limitations, J. Power Sources, 2016, vol. 325, p. 252.
Rabaey, K., Boon, N., Höfte, M., and Verstraete, W., Microbial phenazine production enhances electron transfer in biofuel cells, Environ. Sci. Technol., 2005, vol. 39, p. 3401.
Stoica, L., Ruzgas, T., Ludwig, R., Haltrich, D., and Gorton, L., Direct electron transfers a favorite electron route for cellobiose dehydrogenase (CDH) from Trametes v illosa. Comparison with CDH from Phanerochaete chrysosporium, Langmuir, 2006, vol. 22, p. 10801.
Hickey, D.P., Milton, R.D., Rasmussen, M., Abdellaoui, S., Nguyen, K., and Minteer, S.D, Fundamentals and applications of bioelectrocatalysis, Electrochemistry, 2015, vol. 13, p. 97.
Cooper, J. and Cass, A., Biosensors, N.Y.: OUP Oxford, 2004. p. 59.
Bartlett, P.N., Bioelectrochemistry: Fundamentals, Experimental Techniques and Applications, N.Y.: John Wiley & Sons, 2008. p. 273.
Bartlett, P.N. and Pratt, K.F.E., A study of the kinetics of the reaction between ferrocene monocarboxylic acid and glucose oxidase using the rotating-disc electrode, J. Electroanal. Chem., 1995, vol. 397, nos. 1–2, p. 53.
Alegret S., Integrated Analytical Systems, Amsterdam: Gulf Professional Publishing, 2003. p. 330.
Flexer, V., Ielmini, M.V., Calvo, E.J., and Bartlett, P.N., Extracting kinetic parameters for homogeneous [Os (bpy) 2ClPyCOOH]+ mediated enzyme reactions from cyclic voltammetry and simulations, Bioelectrochem., 2008, vol. 74, no. 1, p. 201.
Hui, T.W., Wong, K.Y., and Shiu, K.K., Kinetics of o-benzoquinone mediated oxidation of glucose by glucose oxidase at edge plane pyrolytic graphite electrode, Electroanalysis, 1996, vol. 8, no. 6, p. 597.
delle Noci, S., Frasconi, M., Favero, G., Tosi, M., Ferri, T., and Mazzei, F., Electrochemical kinetic characterization of redox mediated glucose oxidase reactions: A simplified approach, Electroanalysis: An International Journal Devoted to Fundamental and Practical Aspects of Electroanalysis, 2008, vol. 20, no. 2, p. 163.
Limoges, B. and Savéant, J.M., Cyclic voltammetry of immobilized redox enzymes. Interference of steady-state and non-steady-state Michaelis–Menten kinetics of the enzyme–redox cosubstrate system, J. Electroanal. Chem., 2003, vol. 549, p. 61.
Yokoyama, K. and Kayanuma, Y., Cyclic voltammetric simulation for electrochemically mediated enzyme reaction and determination of enzyme kinetic constants, Analytical Chem., 1998, vol. 70, no. 16, p. 3368.
Herenda, S., Ostojić, J., Hasković, E., Hasković, D., Miloš, M., and Galić, B., Electrochemical Investigation of the Influence of K2[B3O3F4OH] on the Activity of Immobilized Superoxide Dismutase, Int. J. Electrochem. Sci., 2018, vol. 13, p. 3279.
Britz, D. and Strutwolf, J., Digital simulation of chronoamperometry at an electrode within a hemispherical polymer drop containing an enzyme: Comparison of a hemispherical with a flat disk electrode, Biosensors and Bioelectronics, 2013, vol. 50, p. 269.
Araminaitė, R., Garjonytė, R., and Malinauskas, A., Rotating disk electrode study of Prussian blue-and glucose oxidase-based bioelectrode, J. Electroanal. Chem., 2012, vol. 672, p. 12.
Sekretaryova, A.N., Vagin, M.Y., Beni, V., Turner, A.P., and Karyakin, A.A., Unsubstituted phenothiazine as a superior water-insoluble mediator for oxidases, Biosensors and Bioelectronics, 2014, vol. 53, p. 275.
Ikeda, T., Katasho, I., Kamei, M., and Senda, M., Electrocatalysis with a glucose-oxidase-immobilized graphite electrode, Agricultural and biological chemistry, 1984, vol. 48, no. 8, p. 1969.
Prévoteau, A., Geirnaert, A., Arends, J.B., Lannebère, S., Van de Wiele, T., and Rabaey, K., Hydrodynamic chronoamperometry for probing kinetics of anaerobic microbial metabolism–case study of Faecalibacterium prausnitzii, Scientific reports, 2015, vol. 5, p. 11484.
Léger, C., Dementin, S., Bertrand, P., Rousset, M., and Guigliarelli, B., Inhibition and aerobic inactivation kinetics of Desulfovibrio fructosovorans NiFe hydrogenase studied by protein film voltammetry, J. Amer. Chem. Soc., 2004, vol. 126, no. 38, p. 12162.
Dmitrieva, M.V., Zolotukhina, E.V., Gerasimova, E.V., Terent’ev, A.A., and Dobrovol’skii, Y.A., Dehydrogenase and electrochemical activity of Escherichia coli extracts, Appl. Biochem. and Microbiol., 2017, vol. 53, p. 458.
Dmitrieva, M.V., Gerasimova, E.V., Terent’ev, A.A., Dobrovol’skii, Y.A., and Zolotukhina, E.V., Electrochemical Peculiarities of Mediator-Assisted Bioelectrocatalytic Oxidation of Glucose by a New Type of Bioelectrocatalyst, Russ. J. Electrochem., 2019, vol. 55, p. 889.
Золотухина, Е.В., Чайка, М.Ю., Кравченко, Т.А., Новикова, В.В., Булавина, Е.В., Вдовина, С.Н. Электронная проводимость и потенциал модифицированной дисперсной медью сульфокатионообменной мембраны МК-40. Сорбционные и хроматографические процессы. 2008. № 8(4). С. 636.
Kegg: Metabolic pathways—Escherichia coli O25b:K100:H4-ST131 EC958 (UPEC)
Han, M.-J. and Lee, S.Y., The Escherichia coli proteome: past, present and future prospects, Microbiol. Mol. Biol. Rev., 2006, vol. 70, no. 2, p. 362.
Ghaly, A.E. and Mahmoud, N.S., Optimum conditions for measuring dehydrogenase activity of Aspergillus niger using TTC, Amer. J. Biochem. and Biotechnol., 2006, vol. 2, no. 4, p. 186.
https://www.brenda-enzymes.org/enzyme.php?ecno= 1.1.1.49.
Shijie, Liu, Bioprocess Engineering: Kinetics, Sustainability, and Reactor Design, Amsterdam: Elsevier, 2016. 1172 p.
Reed, M.C., Lieb, A., and Nijhout, H.F., The biological significance of substrate inhibition: a mechanism with diverse functions, Bioessays, 2010, vol.32, no. 5, p.422.
Doran, P M., Bioprocess Engineering Principles, London: Acad. Press Limited, 1995. 445 p.
Mehdinia, A., Ehsan, Z., and Jabbari, A., Facile microwave-assisted synthesized reduced graphene oxide/tin oxide nanocomposite and using as anode material of microbial fuel cell to improve power generation, Internat. J. Hydrogen Energy, 2014, vol. 39, no. 20, p. 10724.
Miyake, T., Haneda, K., Nagai, N., Yatagawa, Y., Onami, H., Yoshino, S., and Nishizawa, M., Enzymatic biofuel cells designed for direct power generation from biofluids in living organisms, Energy & Environmental Sci., 2011, vol. 4, no. 12, p. 5008.
Gonzalez-Solino, C. and Lorenzo, M.D., Enzymatic fuel cells: Towards self-powered implantable and wearable diagnostics, Biosensors, 2018, vol. 8, no. 1, p. 11.
Дополнительные материалы отсутствуют.