Электрохимия, 2020, T. 56, № 2, стр. 149-157
Стабильность и функциональные свойства флюоритоподобных Ce0.6 – xLa0.4PrxO2 – δ как компонентов электродов твердооксидных топливных элементов
А. И. Иванов a, *, И. И. Зверькова a, Е. В. Ципис a, С. И. Бредихин a, В. В. Хартон a
a Федеральное государственное бюджетное учреждение науки
Институт физики твердого тела Российской академии наук
142432 Московской обл., Черноголовка, ул. академика Осипьяна, 2, Россия
* E-mail: aliv@issp.ac.ru
Поступила в редакцию 28.09.2018
После доработки 23.02.2019
Принята к публикации 04.07.2019
Аннотация
С целью оценки применимости твердых растворов Ce0.6 –хLa0.4PrхO2 – δ (x = 0–0.2) для защитных подслоев и компонентов композитных электродов среднетемпературных твердооксидных топливных элементов (ТОТЭ) проведены исследования термического расширения, химического взаимодействия с материалом твердого электролита, устойчивости к восстановлению и электрохимического поведения материалов данной системы. Установлено, что введение празеодима в Ce0.6La0.4O2 – δ приводит к увеличению параметров элементарной ячейки и росту коэффициентов термического расширения в среднетемпературной области от (13.2 ± 0.3) × 10–6 до (18.5 ± 0.8) × 10–6 К–1. Возрастание общей концентрации редкоземельных катионов в флюоритоподобной структуре диоксида церия коррелирует также со снижением термодинамической устойчивости как в окислительных, так и в восстановительных условиях. В результате химическое взаимодействие Pr-замещенных материалов и твердого электролита на основе галлата лантана при высоких температурах является более интенсивным по сравнению с Ce0.6La0.4O2 – δ, а восстановление Pr-содержащих твердых растворов может приводить к сегрегации примесной фазы со структурой С-типа. Комбинация этих факторов приводит к ухудшению совместимости подслоя с другими компонентами ТОТЭ. В результате перенапряжение катодов PrBaFe1.2Ni0.8O6 – δ в ячейке с твердым электролитом (La0.9Sr0.1)0.98Ga0.8Mg0.2O3 – δ составило –42 и –143 мВ в О2 при плотности тока –58 мА/см2 и 1073 К при использовании подслоев из Ce0.6La0.4O2 – δ или Ce0.5La0.4Pr0.1O2 – δ соответственно.
ВВЕДЕНИЕ
В последние десятилетия проводится активная разработка альтернативных источников энергии, в частности твердооксидных топливных элементов (ТОТЭ) – эффективных электрохимических устройств, позволяющих преобразовывать химическую энергию топлива (водород, синтез-газ, легкие углеводороды) непосредственно в электрическую с высоким КПД (70–90%) [1–3]. Одним из ключевых компонентов ТОТЭ являются пористые электроды, которые представляют собой одно- или многослойные системы, состоящие из функциональных электродных слоев с различной микроструктурой и защитного подслоя, расположенного между электролитом и электродом [1, 4–10]. Такие защитные подслои используются для предотвращения возможного химического взаимодействия между компонентами ТОТЭ, в результате которого могут образоваться изолирующие фазы, приводящие к деградации характеристик ТОТЭ. Материалы для подслоев должны удовлетворять ряду жестких требований, которые включают: высокую ионную или смешанную ионно-электронную проводимость, каталитическую активность в электродных реакциях, химическую совместимость и совместимость по коэффициенту термического расширения (КТР) с контактирующими материалами, а также фазовую стабильность в условиях функционирования (873–1173 К) и изготовления (1373–1673 К) ТОТЭ. В качестве стандартных защитных материалов используются флюоритоподобные твердые растворы на основе диоксида церия (Ce,Ln)O2 – δ, где Ln – Gd, Sm, Y, La [1, 4–12]. Недостатками таких систем являются низкая электронная проводимость p-типа и электрокаталитическая активность в окислительных условиях, что ограничивает их применение с катодной стороны ТОТЭ [3, 13–15].
Твердые растворы Ce1 –хPrхO2 – δ представляют собой альтернативную группу материалов, обладающих за счет наличия редокс-пары Pr4+/Pr3+ более высокой дырочной проводимостью в окислительной среде и электрокаталитической активностью в реакциях с участием молекулярного кислорода (катодные реакции в случае ТОТЭ) [13, 16–18]. Благодаря широкой области гомогенности по кислороду в сочетании со смешанной ионно-электронной проводимостью и высокой скоростью кислородного обмена эти системы также находят применение в качестве кислород-аккумулирующих материалов для широкого спектра электрохимических устройств, каталитических и технологических процессов [19–22]. Согласно литературным данным [13, 18, 23–26], увеличение содержания празеодима приводит к росту общей проводимости и уменьшению ее энергии активации. Однако введение празеодима также вызывает существенные объемные увеличения при нагревании или понижении парциального давления кислорода (p(O2)) вследствие выхода кислорода из решетки оксида и роста концентрации сравнительно крупных катионов Pr3+ [16, 21–23, 26–30]. Такое (химическое) расширение может приводить к несовместимости Ce1 –хPrхO2 – δ и твердого электролита [3, 22, 28]. В частности, в работах [22, 30] было установлено, что при 873‒973 К на воздухе кажущийся КТР керамики Ce1 –хPrхO2 – δ может достигать достаточно высоких значений (36–41) × 10–6 К–1. В этом температурном интервале также зафиксирован максимальный уровень микронапряжений в кристаллической решетке Ce1 –хPrхO2 – δ [16].
Следует отметить, что функциональные свойства Ce1 –хPrхO2 – δ как компонентов электродов ТОТЭ изучались в ячейках с твердыми электролитами на основе стабилизированного ZrO2 или допированного CeO2. В контакте с электролитом на базе галлата лантана, обладающим более высокой кислородно-ионной проводимостью, потенциалом применения в качестве электрохимически активных защитных слоев могут иметь системы с двойным допированием Ce0.6 –хLa0.4PrхO2 – δ [25, 26]. Наличие катионов празеодима обеспечивает электронный транспорт в катодных условиях, а также увеличивает каталитическую активность в реакциях с участием молекулярного кислорода. C другой стороны, частичное замещение церия лантаном (40 ат. %) вблизи предела растворимости в CeO2 [31] обеспечивает химическую стабильность по отношению к галлату лантана [5–8].
В настоящем исследовании был проведен синтез высокодисперсных порошков флюоритоподобных оксидов системы Ce0.6 –хLa0.4PrхO2 – δ (x = = 0–0.2) глицин-нитратным методом. Было изучено влияние концентрации празеодима на стабильность материалов в восстановительных средах, реакционную способность с материалом электролита и термомеханические свойства. Сравнительные электрохимические исследования проводили трех-электродным методом на ячейках с электролитом (La0.9Sr0.1)0.98Ga0.8Mg0.2O3 – δ (LSGM), перовскитом PrBaFe1.2Ni0.8O6 – δ (PBFN) в качестве рабочего электрода и подслоями из Ce0.6La0.4O2 – δ или Ce0.5La0.4Pr0.1O2 – δ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Однофазные высокодисперсные порошки Ce0.6 –xLa0.4PrxO2 – δ (x = 0–0.2) и PrBaFe1.2Ni0.8O6 – δ для изготовления керамических образцов и пористых слоев получали с помощью глицин-нитратного метода; условия синтеза подробно описаны ранее [10, 25]. Рентгенофазовый анализ (РФА) проводили при комнатной температуре на дифрактометре Siemens D-500-BRAUN (CuKα1-излучение, шаг 0.02°, интервал углов 20° ≤ 2θ ≤ 120°). Фазовый анализ образцов и расчет параметров решетки проводился с использованием программ Match и PowderCell 2.4. Из полученных порошков сложных оксидов методом одноосного гидравлического прессования (~100–200 МПа) формировали образцы в форме дисков диаметром 27 мм и толщиной 2–3 мм с дальнейшим спеканием при 1723 K в течение 10 ч на воздухе со средней скоростью нагрева/охлаждения не более 2.5 К/мин. Далее из спеченной керамики вырезали образцы в форме прямоугольного параллелепипеда (12 × 1.5 × × 1.5 мм3) для дилатометрических измерений. Относительная плотность керамики составляла 91‒94%.
Для изучения стабильности материалов в восстановительных условиях образцы отжигали в газовой смеси 4% H2–Ar, пропускаемой через осушитель. Парциальное давление кислорода (p(O2)) в реакторе контролировали при помощи кислородного датчика на основе стабилизированного диоксида циркония.
Реакционную способность Ce0.6 –xLa0.4PrxO2 – δ по отношению к галлатному электролиту оценивали методом контактных отжигов спрессованных смесей. Для этого исходные однофазные порошки подслоя Ce0.6 –xLa0.4PrxO2 – δ и твердого электролита La0.8Sr0.2Ga0.8Mg0.2O3 – δ (Fuel Cell Materials, США) тщательно перемешивались в агатовой ступке в весовом соотношении 1 : 1. Затем для улучшения механического контакта между исследуемыми материалами перетертую смесь прессовали при 100–200 МПа и отжигали при 1473–1623 К в течение 72 ч. После отжига спеченные образцы растирали в порошок и проводили РФА.
Дилатометрические измерения проводили на вертикальном дилатометре Linseis L75VS1400, откалиброванном на цилиндрическом образце из оксида алюминия. Исследуемый материал нагревали до 1273 К на воздухе с последующим ступенчатым охлаждением до 973 K (шаг 50 К) с изотермической выдержкой в течение 5 ч на каждой из температур до полного уравновешивания с газовой фазой. Примеры дилатометрических кривых с использованием данного режима измерений приведены в работе [10]. Значения кажущегося КТР определялись из наклона зависимости равновесного относительного удлинения (ΔL/L0) образца от температуры в интервале 973–1223 К.
Электрохимические испытания проводили 3‑электродным методом. Модельные ячейки представляли собой газоплотные диски твердого электролита LSGM (диаметр 11 мм, толщина 1.5 мм) с пористыми слоями рабочего электрода, противоэлектрода и электрода сравнения. В качестве противоэлектрода и электрода сравнения использовались пористые платиновые слои, вожженные при 1223 К; токовым коллектором служила платиновая сетка. Порошки защитного подслоя из Ce0.6La0.4O2 – δ или Ce0.5La0.4Pr0.1O2 – δ и рабочего электрода на основе PrBaFe1.2Ni0.8O6 – δ смешивали со связующим Heraeus V-006 в весовом соотношении 1 : 1 и последовательно наносили на диски LSGM метом трафаретной печати с последующим вжиганием при 1473 К. Измерения проводили в потенциостатическом режиме с использованием потенциостат/гальваностата AutoLab PGSTAT302N при 1073 К в потоке кислорода. Время выдержки при каждом напряжении составляло 30–60 мин. Значения омического и поляризационного сопротивления определяли из импедансных спектров, полученных в частотном диапазоне от 0.05 Гц до 100 кГц, с использованием программы Zview (Version 2.80, Scribner Associates, Inc.). Геометрия ячейки, методика и аппаратура для тестирования ТОТЭ данным способом подробно описаны раннее [32]. Анализ микроструктуры электрохимических ячеек выполняли с использованием растрового микроскопа с полевым эмитирующим катодом LEO SUPRA 50VP при ускоряющих напряжениях 5–10 кВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно данным РФА, синтезированные материалы Ce0.6 –xLa0.4PrxO2 – δ являлись однофазными (рис. 1, 2) и имели флюоритоподобную кристаллическую структуру с пространственной группой ПГ № 225, Fm$\bar {3}$m. Параметр и объем элементарной ячейки увеличиваются с ростом содержания празеодима (рис. 3, табл. 1), что связано с увеличением концентрации катионов Pr3+, более крупных по отношению к Ce4+ [27]. Аналогичное влияние допирования празеодимом наблюдалось для системы Ce1 –хPrхO2 – δ [20].
Рис. 1.
Дифрактограммы порошков Ce0.6La0.4O2 – δ после отжига в различных условиях, твердого электролита LSGM и смеси Ce0.6La0.4O2 – δ + LSGM после контактного отжига на воздухе.

Рис. 2.
Дифрактограммы исходных порошков (Ce,La,Pr)O2 – δ и смесей (Ce,La,Pr)O2 – δ + LSGM после контактных отжигов на воздухе. Символом ↓ обозначены рефлексы LaSrGaO4.

Рис. 3.
Зависимости объема элементарной ячейки и КТР Ce0.6 –xLa0.4PrxO2 – δ от концентрации празеодима.

Таблица 1.
Параметры элементарной ячейки Ce0.6 –xLa0.4PrxO2 – δ и LSGM и их относительные изменения после отжига в различных условиях, а также после контактных отжигов
| Процедура | Условия | a, нм | Δa/a†, % | |
|---|---|---|---|---|
| T, K | p(O2), атм | |||
| Ce0.6La0.4O2 – δ | ||||
| Получение | 1723 | 0.21 | 0.5524 | – |
| Отжиг | 1223 | 10–18 | 0.5537 | +0.23 |
| Отжиг | 973 | 10–23 | 0.5528 | +0.07 |
| Контактный отжиг с LSGM | 1623 | 0.21 | 0.5531 | +0.13 |
| Ce0.5La0.4Pr0.1O2 – δ | ||||
| Получение | 1723 | 0.21 | 0.5535 | – |
| Отжиг | 1223 | 10–18 | 0.5551 | +0.29 |
| Отжиг | 973 | 10–23 | 0.5547 | +0.22 |
| Контактный отжиг с LSGM* | 1623 | 0.21 | 0.5537 | +0.04 |
| 1573 | 0.5532 | –0.05 | ||
| 1523 | 0.5533 | –0.04 | ||
| 1473 | 0.5530 | –0.09 | ||
| Ce0.4La0.4Pr0.2O2 – δ | ||||
| Получение | 1723 | 0.21 | 0.5541 | – |
| Отжиг | 1223 | 10–18 | 0.5569** | +0.50 |
| Отжиг | 973 | 10–23 | 0.5564** | +0.41 |
| Контактный отжиг с LSGM* | 1623 | 0.21 | 0.5536 | –0.09 |
| 1523 | 0.5532 | –0.16 | ||
| 1473 | 0.5530 | –0.20 | ||
| LSGM*** | ||||
| Исходный | – | – | 0.3915 | – |
| Контактный отжиг с Ce0.6La0.4O2 – δ | 1623 | 0.21 | 0.3922 | +0.18 |
| Контактный отжиг с Ce0.5La0.4Pr0.1O2 – δ* | 1623 | 0.21 | 0.3913 | –0.05 |
| 1573 | 0.3903 | –0.31 | ||
| 1523 | 0.3910 | –0.13 | ||
| 1473 | 0.3915 | 0 | ||
| Контактный отжиг с Ce0.4La0.4Pr0.2O2 – δ* | 1623 | 0.21 | 0.3913 | –0.05 |
| 1523 | 0.3913 | –0.05 | ||
| 1473 | 0.3912 | –0.08 | ||
Важным критерием применимости материалов защитных подслоев ТОТЭ является химическая стабильность в контакте с выбранным твердым электролитом при повышенных температурах, используемых для изготовления и эксплуатации электрохимических ячеек. На рис. 1 приводятся дифрактограммы Ce0.6La0.4O2 – δ, LSGM и их смеси, отожженной при 1623 K. Все рефлексы смеси Ce0.6La0.4O2 – δ + LSGM принадлежат индивидуальным компонентам; было зафиксировано незначительное изменение параметров кристаллической решетки (табл. 1). Эти данные говорят об отсутствии существенного химического взаимодействия между Ce0.6La0.4O2 – δ и LSGM, что подтверждает литературные данные [5–8].
Примеры дифрактограмм смесей (Ce,La,Pr)O2 – δ + + LSGM, полученных после контактного отжига, показаны на рис. 2. Как уже отмечалось, рост концентрации празеодима в CeO2 увеличивает уровень локальных искажений кристаллической решетки вследствие разницы размеров катионов Pr4+ и Pr3+ ($r_{{{{{\Pr }}^{{4 + }}}}}^{{{\text{VIII}}}}$ = 0.0960 нм, $r_{{{{{\Pr }}^{{3 + }}}}}^{{{\text{VIII}}}}$ = 0.1126 нм), La3+ ($r_{{{\text{L}}{{{\text{a}}}^{{3 + }}}}}^{{{\text{VIII}}}}$ = 0.1160 нм) и Ce4+ ($r_{{{\text{C}}{{{\text{e}}}^{{4 + }}}}}^{{{\text{VIII}}}}$ = 0.0970 нм) [16, 27]. Поэтому частичное замещение церия ионами празеодима в Ce0.6La0.4O2 – δ приводит к ограничению стабильности флюоритоподобной фазы. Как результат, после контактного отжига (Ce,La,Pr)O2 – δ + LSGM наблюдается образование умеренного количества (7–15 вес. %) низкопроводящей фазы LaSrGaO4 (рис. 2). Соотношения наиболее интенсивных неперекрывающихся рефлексов продукта взаимодействия LaSrGaO4 (103) и (Ce,La,Pr)O2 – δ (111) приведены в табл. 2. В сочетании с отсутствием обнаружимых количеств других примесей, стехиометрия примесной фазы показывает, что ее выделение может быть связано с диффузией катионов La3+ и Pr3+ из (Ce,La,Pr)O2 – δ в LSGM. Вместе с тем количество сегрегированного LaSrGaO4 слабо зависит от температуры отжига (табл. 2), а изменения параметров элементарных ячеек реагирующих фаз после контактных отжигов сравнимы с аналогичными данными для реакционной пары Ce0.6La0.4O2 – δ–LSGM в пределах погрешности (табл. 1). Это позволяет сделать вывод, что процесс локализован на поверхности зерен LSGM и в значительной степени блокируется после образования LaSrGaO4 на этой поверхности.
Таблица 2.
Отношения интенсивностей I(103) LaSrGaO4/I(111) Ce0.6 –xLa0.4PrxO2 – δ после контактного отжига порошковых смесей Ce0.6 –xLa0.4PrxO2 – δ и электролита LSGM при различных температурах в течение 72 ч
| T, K | [I(103) LaSrGaO4/I(111) Ce0.6 –xLa0.4PrxO2 – δ], % | |
|---|---|---|
| Ce0.5La0.4Pr0.1O2 – δ | Ce0.4La0.4Pr0.2O2 – δ | |
| 1623 | 7.9 | 14.5 |
| 1573 | 15.3 | – |
| 1523 | 9.9 | 14.2 |
| 1473 | 9.7 | 19.0 |
Значение КТР для Ce0.6La0.4O2 – δ, составляющее (13.2 ± 0.3) × 10–6 К–1 в среднетемпературном интервале (рис. 3), хорошо согласуется с КТР твердых растворов на основе CeO2 [3]. Введение празеодима увеличивает средний КТР до (16.2 ± ± 0.5) × 10–6 К–1 при x = 0.1 и (18.5 ± 0.8) × 10–6 К–1 при x = 0.2 (рис. 3) за счет роста химической составляющей в общее расширение образца. Данные по равновесным значениям относительного удлинения керамических материалов суммированы в табл. 3.
Таблица 3.
Равновесные значения относительного удлинения керамики Ce0.6 –xLa0.4PrxO2 – δ, полученные на воздухе
| T, K | ΔL/L0, % | ||
|---|---|---|---|
| Ce0.6La0.4O2 – δ | Ce0.5La0.4Pr0.1O2 – δ | Ce0.4La0.4Pr0.2O2 – δ | |
| 1223 | 1.10 | 1.20 | 1.27 |
| 1173 | 1.03 | 1.12 | 1.17 |
| 1123 | 0.96 | 1.03 | 1.08 |
| 1073 | 0.90 | 0.95 | 0.99 |
| 1023 | 0.83 | 0.87 | 0.90 |
| 973 | 0.77 | 0.80 | 0.81 |
Возрастание концентрации редкоземельных катионов уменьшает термодинамическую стабильность твердых растворов в области низких p(O2). Для Ce0.6La0.4O2 – δ и Ce0.5La0.4Pr0.1O2 – δ изменений фазового состава не обнаружено после восстановления в потоке 4% H2–Ar при 973 и 1223 К (рис. 1), в то время как для Ce0.4La0.4Pr0.2O2 – δ наблюдается образование следовых количеств фазы С-типа Ln2O3 [26].
Уровень химического расширения при изотермическом переходе от воздуха к восстановительным атмосферам также растет с х и соответствует значениям относительного удлинения на уровне 0.41–0.50% для Ce0.4La0.4Pr0.2O2 – δ (табл. 1). Таким образом, введение празеодима в Ce0.6La0.4O2 – δ ограничивает термомеханическую совместимость (Ce,La,Pr)O2 – δ с остальными компонентами ТОТЭ.
На рис. 4a–4г проиллюстрирована микроструктура поперечного сечения между электролитом LSGM и рабочим электродом PBFN, нанесенным на защитные подслои из Ce0.6La0.4O2 – δ или Ce0.5La0.4Pr0.1O2 – δ. Защитные подслои имели пористую поверхность, сформированную частицами размером 0.2–0.5 мкм (рис. 4б, 4г). Следует отметить, что, несмотря на химическое взаимодействие между Ce0.5La0.4Pr0.1O2 – δ и твердым электролитом, следов образования диффузионного слоя на межфазной границе электролит/защитный подслой не обнаружено (рис. 4г). Однако в структуре Ce0.5La0.4Pr0.1O2 – δ подслоя наблюдается образование микрообластей в виде каверн (рис. 4в, 4г), образующихся в результате локального отслаивания материала вследствие разницы КТР между Ce0.5La0.4Pr0.1O2 – δ и электролитом и роста уровня микронапряжений при вжигании. Аналогичные образования меньшего размера можно наблюдать в структуре подслоя Ce0.6La0.4O2 – δ (рис. 4а, 4б).
Рис. 4.
Электронно-микроскопическое изображение поперечного сечения модельных ТОТЭ с электролитом LSGM, рабочим катодом PBFN и подслоями из Ce0.6La0.4O2 – δ (CLO) (а, б) и Ce0.5La0.4Pr0.1O2 – δ (CLPO) (в, г) после изготовления на воздухе при 1473 К. Стрелками показаны микрообласти структуры, образующиеся в результате локального отслаивания подслоя.

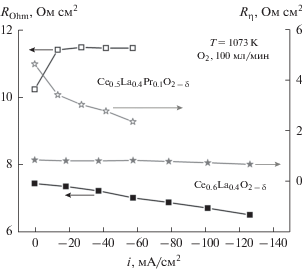
Импедансная спектроскопия показала, что катодный процесс включает как минимум две лимитирующие стадии (рис. 5). Увеличение плотности тока приводит к росту омического сопротивления ячейки с подслоем из Ce0.5La0.4Pr0.1O2 – δ (рис. 6), что может быть связано с ухудшением механического и электрического контакта материала с электролитом вследствие объемного расширения слоя Ce0.5La0.4Pr0.1O2 – δ в результате его восстановления при катодной поляризации. Поляризационные кривые показаны на рис. 7. При катодном токе –58 мА/см2 перенапряжение составляет примерно –42 и –143 мВ для ячеек с подслоем из Ce0.6La0.4O2 – δ и Ce0.5La0.4Pr0.1O2 – δ соответственно. Таким образом, можно заключить, что Pr-содержащие подслои уступают по электрохимическим характеристикам Ce0.6La0.4O2 – δ по причине возможного взаимодействия с электролитом и высокими объемными изменениями, приводящими к микроструктурным нарушениям.
ЗАКЛЮЧЕНИЕ
В ходе настоящей работы были получены керамика и пористые защитные подслои из твердых растворов Ce0.6 –хLa0.4PrхO2 – δ (x = 0–0.2). С помощью контактных отжигов порошковых смесей при 1473–1623 К с дальнейшим рентгенофазовым анализом было установлено, что увеличение концентрации празеодима приводит к увеличению интенсивности химического взаимодействия с твердым электролитом на основе галлата лантана с образованием LaSrGaO4. Увеличение x в Ce0.6 ‒ хLa0.4PrхO2 – δ приводит также к увеличению параметров элементарной ячейки и средних КТР в среднетемпературной области. Возрастание суммарной концентрации допирующих катионов приводит к снижению термодинамической стабильности твердых растворов в области низких p(O2). В результате при восстановлении Ce0.4La0.4Pr0.2O2 – δ в потоке 4% H2–Ar при 973–1223 К наблюдается образование следов примесной фазы C-типа Ln2O3. Были изготовлены и протестированы модельные ячейки с электролитом на основе LSGM, рабочим катодом PrBaFe1.2Ni0.8O6 – δ и подслоями из Ce0.6 –хLa0.4PrхO2 – δ. Подтверждено, что существенные объемные изменения при нагревании и восстановлении являются важным фактором, влияющим на электрохимическое поведение подслоев на основе Ce0.6 –хLa0.4PrхO2 – δ.
Список литературы
Бредихин, С.И., Голодницкий, А.Э., Дрожжин, О.А., Истомин, С.Я., Ковалевский, В.П., Филиппов, С.П. Стационарные энергетические установки с топливными элементами: материалы, технологии, рынки, М.: НТФ “Энергопрогресс” Корпорации “ЕЭЭК”, 2017. 392 с. [Bredikhin, S.I., Golodnitskii, A.E., Drozhzhin, O.A., Istomin, S.Ya., Kovalevskii, V.P., and Filippov, S.P., Statsionarnye energeticheskie ustanovki s toplivnymi elementami: materialy, tekhnologii, rynki (in Russian), M., NTF “Energoprogress” Korporatsii “EEEK”, 2017, 392 p.]
Abdalla, A.M., Hossain, Sh., Azad, A.T., Petra, P.M.I., Begum, F., Eriksson, S.G., and Azad, A.K., Nanomaterials for solid oxide fuel cells: A review, Renewable and Sustainable Energy Rev., 2018, vol. 82, p. 353.
Tsipis, E.V. and Kharton, V.V., Electrode materials and reaction mechanisms in solid oxide fuel cells: a brief review, J. Solid State Electrochem., 2008, vol. 12, p. 1039.
Бурмистров, И.Н., Агарков, Д.А., Коровкин, Е.В, Яловенко, Д.В., Бредихин, С.И. Изготовление мембранно-электродных блоков методом совместного спекания электродов при повышенных температурах. Электрохимия. 2017. Т. 53. С. 795. [Burmistrov, I.N., Agarkov, D.A., Korovkin, E.V., Yalovenko, D.V., and Bredikhin, S.I., Fabrication of Membrane–Electrode Assemblies for Solid-Oxide Fuel Cells by Joint Sintering of Electrodes at High Temperature, Russ. J. Electrochem., 2017, vol. 53, p. 873.]
Kuritsyna, I., Sinitsyn, V., Melnikov, A., Fedotov, Yu., Tsipis, E., Viskup, A., Bredikhin, S., and Kharton, V., Oxygen exchange, thermochemical expansion and cathodic behavior of perovskite-like Sr0.7Ce0.3MnO3 – δ, Solid State Ionics, 2014, vol. 262, p. 349.
Курицына, И.Е., Синицын, В.В., Федотов, Ю.С., Бредихин, С.И., Ципис, E.В., Хартон, В.В. Стабильность и функциональные свойства Sr0.7Ce0.3MnO3 – δ как катодного материала твердооксидных топливных элементов. Электрохимия. 2014. Т. 50. С. 795. [Kuritsyna, I.E., Sinitsyn, V.V., Fedotov, Yu.S., Bredikhin, S.I., Tsipis, E.V., and Kharton, V.V., Stability and Functional Properties of Sr0.7Ce0.3MnO3 – δ as Cathode Material for Solid Oxide Fuel Cells, Russ. J. Electrochem., 2014, vol. 50, p. 713.]
Wan, J., Goodenough, J.B., and Zhu, J.H., Nd2 ‒ xLaxNiO4 + δ, a mixed ionic/electronic conductor with interstitial oxygen, as a cathode material, Solid State Ionics, 2007, vol. 178, p. 281.
Wan, J.-H., Yan, J.-Q., and Goodenough, J.B., LSGM-Based Solid Oxide Fuel Cell with 1.4 W/cm2 Power Density and 30 Day Long-Term Stability, J. Electrochem. Soc., 2005, vol. 152, p. A1511.
Ma, Q., Tietz, F., Leonide, A., and Ivers-Tiffée, E., Anode-supported planar SOFC with high performance and redox stability, Electrochem. Communications, 2010, vol. 12, p. 1326.
Иванов, А.И., Колотыгин, В.А., Ципис, Е.В., Бредихин, С.И., Хартон, В.В. Электропроводность, термическое расширение и электрохимические свойства перовскитов PrBaFe2 –xNixO5 + δ. Электрохимия. 2018. Т. 54. С. 615. [Ivanov, A.I., Kolotygin, V.A., Tsipis, E.V., Bredikhin, S.I., and Kharton, V.V., Electrical Conductivity, Thermal Expansion and Electrochemical Properties of Perovskites PrBaFe2 –xNixO5 + δ, Russ. J. Electrochem., 2018, vol. 54, p. 533.]
Shimura, K., Nishino, H., Kakinuma, K., Brito, M.E., and Uchida, H., Effect of samaria-doped ceria (SDC) interlayer on the performance of La0.6Sr0.4Co0.2Fe0.8O3 – δ/SDC composite oxygen electrode for reversible solid oxide fuel cells, Electrochim. Acta, 2017, vol. 225, p. 114.
Somekawa, T., Matsuzaki, Y., Tachikawa, Y., Taniguchi, S., and Sasaki, K., Characterization of yttrium-doped ceria with various yttrium concentrations as cathode interlayers of SOFCs, Ionics, 2017, vol. 23, p. 95.
Kharton, V.V., Viskup, A.P., Figueiredo, F.M., Naumovich, E.N., Yaremchenko, A.A., and Marques, F.M.B., Electron–hole conduction in Pr-doped Ce(Gd)O2 – δ by faradaic efficiency and emf measurements, Electrochim. Acta., 2001, vol. 46, p. 2879.
Shimonosono, T., Hirata, Y., Ehira, Yu., Sameshima, S., Horita, T., and Yokokawa, H., Electronic conductivity measurement of Sm- and La-doped ceria ceramics by Hebb–Wagner method, Solid State Ionics, 2004, vol. 174, p. 27.
Xiong, Yu., Yamaji, K., Horita, T., Sakai, N., and Yokokawa, H., Hole and Electron Conductivities of 20 mol % REO1.5 Doped CeO2 (RE = Yb, Y, Gd, Sm, Nd, La), J. Electrochem. Soc., 2004, vol. 151, p. A407.
Lenser, Ch., Gunkel, F., Sohn, Y.J., and Menzler, N.H., Impact of defect chemistry on cathode performance: A case study of Pr-doped ceria, Solid State Ionics, 2018, vol. 314, p. 204.
Ren, Y., Ma, J., Ai, D., Zan, Q., Lin, X., and Deng, Ch., Fabrication and performance of Pr-doped CeO2 nanorods-impregnated Sr-doped LaMnO3–Y2O3-stabilized ZrO2 composite cathodes for intermediate temperature solid oxide fuel cells, J. Mater. Chem., 2012, vol. 22, p. 25042.
Chiba, R., Komatsu T., Orui, H., Taguchi, H., Nozawa, K., and Arai, H., SOFC Cathodes Composed of LaNi0.6Fe0.4O3 and Pr-Doped CeO2, Electrochem. and Solid-State Letters, 2009, vol. 12, p. B69.
Trovarelli, A., Catalytic Properties of Ceria and CeO2-Containing Materials, Catal. Rev., 2006, vol. 38, p. 439.
Shuk, P. and Greenblatt, M., Hydrothermal synthesis and properties of mixed conductors based on Ce1 ‒ xPrxO2 – δ solid solutions, Solid State Ionics, 1999, vol. 116, p. 217.
Fagg, D.P., Marozau, I.P., Shaula, A.L., Kharton, V.V., and Frade, J.R., Oxygen permeability, thermal expansion and mixed conductivity of GdxCe0.8 –xPr0.2O2 – δ, x = 0, 0.15, 0.2, J. Solid State Chem., 2006, vol. 179, p. 3347.
Fagg, D.P., Kharton, V.V., Shaula, A., Marozau, I.P., and Frade, J.R., Mixed conductivity, thermal expansion, and oxygen permeability of Ce(Pr,Zr)O2 – δ, Solid State Ionics, 2005, vol. 176, p. 1723.
Chiba, R., Taguchi, H., Komatsu, T., Orui, H., Nozawa, K., and Arai, H., High temperature properties of Ce1 –xPrxO2 – δ as an active layer material for SOFC cathodes, Solid State Ionics, 2011, vol. 197, p. 42.
Bishop, S.R., Stefanik, T.S, and Tuller, H.L., Defects and transport in PrxCe1 –xO2 – δ: Composition trends, J. Mater. Res., 2012, vol. 27, p. 2009.
Иванов, А.И., Загитова, А.А., Бредихин, С.И., Хартон, В.В. Синтез и смешанная проводимость Ce1 –x–yLaxPryO2 – δ для каталитически активных защитных подслоев твердооксидных топливных элементов. Альтернативн. энергетика и экология. 2014. № 20(160). С. 15. [Ivanov, A.I., Zagitova, А.А., Bredikhin, S.I., and Kharton, V.V., Synthesis and mixed conductivity of Ce1 –x–yLaxPryO2 – δ for catalytically active interlayers of solid oxide fuel cells, Al’ternativnaya Energetika I Ekologiya (in Russian), 2014, no. 20(160), p. 15.]
Иванов, А.И., Колотыгин, В.А., Патракеев, М.В., Марков, А.А., Бредихин, С.И., Хартон, В.В. Кислородная нестехиометрия и транспортные свойства смешанных проводников Ce0.6 –xLa0.4PrxO2 – δ. Электрохимия. 2018. Т. 54. С. 561. [Ivanov, A.I., Kolotygin, V.A., Patrakeev, M.V., Markov, A.A., Bredikhin, S.I., and Kharton, V.V., Electrical Conductivity, Oxygen Nonstoichiometry and Transport Properties of Mixed-Conducting Ce0.6 –xLa0.4PrxO2 – δ, Russ. J. Electrochem., 2018, vol. 54, p. 486.]
Shannon, R.D., Revised Effective Ionic Radii and Systematic Studies of Interatomie Distances in Halides and Chaleogenides, Acta Cryst., 1976, vol. A32, p. 751.
Bishop, S.R., Marrocchelli, D., Chatzichristodoulou, C., Perry, N.H., Mogensen, M.B., Tuller, H.L., and Wachsman, E.D., Chemical Expansion: Implications for Electrochemical Energy Storage and Conversion Devices, Annual Rev. Mater. Res., 2014, vol. 44, p. 205.
Heidenreich, M., Kaps, Ch., Simon, A., Schulze-Küppers, F., and Baumann, S., Expansion behaviour of (Gd, Pr)-substituted CeO2 in dependence on temperature and oxygen partial pressure, Solid State Ionics, 2015, vol. 283, p. 56.
Chatzichristodoulou, C., Hendriksen, P.V., and Hagen, A., Defect Chemistry and Thermomechanical Properties of Ce0.8PrxTb0.2 –xO2 – δ, J. Electrochem. Soc., 2010, vol. 157, p. B299.
Wei-ping, G., Rui, Z., and Zhong-sheng, C., Thermodynamic modelling and applications of Ce–La–O phase diagram, Trans. Nonferrous Met. Soc. China, 2011, vol. 21, p. 2671.
Kharton, V.V., Tsipis, E.V., Marozau, I.P., Viskup, A.P., Frade, J.R., and Irvine, J.T.S., Mixed conductivity and electrochemical behavior of (La0.75Sr0.25)0.95Cr0.5Mn0.5O3 – δ, Solid State Ionics, 2007, vol. 178, p. 101.
Дополнительные материалы отсутствуют.