Электрохимия, 2020, T. 56, № 2, стр. 100-107
Электрохимические свойства электродных материалов на основе Pr5Mo3O16 + δ
Н. В. Лысков a, *, А. И. Котова b, С. Я. Истомин b, Г. Н. Мазо b, Е. В. Антипов b
a Центр компетенций НТИ при ИПХФ РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119992 Москва, ГСП-1, Ленинские горы, 1, стр. 3, Россия
* E-mail: lyskov@icp.ac.ru
Поступила в редакцию 10.09.2018
После доработки 14.02.2019
Принята к публикации 13.06.2019
Аннотация
Исследована электрохимическая активность электродного материала на основе Pr5Mo3O16 + δ (РМО), нанесенного на поверхность твердого электролита Ce0.9Gd0.1O1.95 (GDC), в интервале температур 873–1173 K в окислительных (на воздухе) и восстановительных (Ar/H2) условиях. Показано, что величины поляризационного сопротивления (Rη) при 1073 K на воздухе и в восстановительной атмосфере составили 8.8 и 4.8 Ом см2 соответственно. С целью определения возможности повышения электрохимической активности РМО в реакции восстановления кислорода изучены электрохимические свойства композитных электродов PМО–xGDC и PМО–xPr6O11 на воздухе. Показано, что наиболее перспективными с точки зрения достижения высокой электрохимической производительности являются композиты PМО–xPr6O11. При переходе от однофазного РМО к композиту PMO–xPr6O11 наблюдается значимое снижение величины Rη (в случае х = 50 мас. % Pr6O11 – на порядок величины до 0.6 Ом см2 при 1073K на воздухе). На основании полученных данных РМО можно рассматривать в качестве основы для создания электродного материала симметричных твердооксидных топливных элементов.
ВВЕДЕНИЕ
Сложные оксиды со структурой перовскита с общей формулой ABO3 – δ, где A – редкоземельный и/или щелочноземельный катион, а В – один или несколько катионов d-металлов, находят применение в качестве электродных материалов твердооксидных топливных элементов (ТОТЭ) [1, 2]. Этот факт не вызывает удивления, поскольку оксиды со структурой перовскита обладают высокой термодинамической устойчивостью в рабочих условиях ТОТЭ, имеют высокую электропроводность, а также могут обладать достаточно высокой кислород-ионной проводимостью, которая снижает активационные поляризационные потери на электродах. Кроме того, ряд перовскитов имеет величины коэффициентов термического расширения (КТР), близкие к КТР стандартных электролитов ТОТЭ на основе оксидов со структурой флюорита (Zr0.84Y0.16O1.92 (YSZ), Ce0.9Gd0.1O1.95 (GDC)). Основным недостатком перовскитов как электродных материалов ТОТЭ является присутствие в их составе крупных, а значит, оснóвных А-катионов, в частности катионов щелочноземельных металлов, в то время как материалы электролитов – это кислотные оксиды. В результате на границе электрод/электролит возможно образование дополнительных непроводящих электрический ток фаз. Поэтому проблема поиска новых электродных материалов ТОТЭ на основе оксидов, кристаллизующихся в отличных от перовскита структурных типах, представляется весьма актуальной. В литературе присутствуют весьма ограниченные сведения о таких электродных материалах. В частности, это относится и к электродным материалам симметричного ТОТЭ (СТОТЭ), в котором материалы катода и анода имеют одинаковый химический состав. В этом случае круг потенциальных кандидатов еще более ограничен, так как электродный материал СТОТЭ должен одновременно обладать устойчивостью как в атмосфере катодных, так и анодных газов, а также иметь высокую электропроводность в этих условиях [3, 4]. В качестве достаточно редкого примера электродного материала СТОТЭ на основе оксидов с неперовскитоподобной структурой можно привести соединение Fe0.5Mg0.25Ti0.25Nb0.9Mo0.1O4 – δ (FMTNM), кристаллизующееся в структуре α-PbO2 [5].
Альтернативными электродными материалами СТОТЭ могут служить оксиды R5Mo3O16 + δ (R = La–Tb, δ = 0–0.5) [6], кристаллизующиеся в структуре, производной от структуры флюорита (пр. гр. Pn$\bar {3}$n, a ≈ 2 × aфлюор ≈ 11 Å). Действительно, такие соединения имеют флюоритоподобную структуру и, следовательно, могут обладать значимой кислород-ионной проводимостью. Они также содержат в своем составе катионы молибдена, которые в восстановительной атмосфере могут существенно повышать электронную проводимость материала вследствие частичного восстановления при уменьшении кислородного содержания. Было показано, что фазы R5Mo3O16 + δ являются смешанными проводниками и обладают кислород-ионной проводимостью, которая в области высоких парциальных давлений кислорода немного превышает электронную, достигая 10–2 См/см при 973–1173 K [6–8]. Также они имеют КТР, близкие к КТР стандартных электролитов ТОТЭ GDC и YSZ [7]. Проведенное нами исследование высокотемпературной электропроводности Pr5Mo3O16 + δ (PMO) в восстановительной атмосфере [9] выявило существенный рост электропроводности, достигающей 1.2 См/см при 1173 K, а также продемонстрировало высокую химическую устойчивость оксида по отношению к Pr6O11, а также YSZ и GDC – стандартным электролитам ТОТЭ. Однако какие-либо сведения об электрохимических свойствах электродных материалов на основе PMO для СТОТЭ в литературе отсутствуют.
Целью настоящей работы являлось изучение перспективности использования PMO в качестве электродного материала СТОТЭ. Для этого было проведено исследование электрохимического поведения пористого электрода на основе PMO, нанесенного на поверхность твердого электролита GDC, при различных температурах и парциальных давлениях кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез порошка Pr5Mo3O16 + δ (PMO) был осуществлен твердофазным методом на воздухе. В качестве исходных веществ использовали оксиды Pr6O11 (99.99%) и MoO3 (99.99%), взятые в стехиометрических соотношениях. Оксид празеодима предварительно прокаливали на воздухе при температуре 623 К для удаления сорбированных на поверхности примесей диоксида углерода и воды. Смесь исходных веществ с добавкой н-гептана гомогенизировали в планетарной мельнице (Fritsch Pulverisette 6, Германия) в течение 30 мин (скорость вращения 600 об/мин). Далее полученный порошок сушили на воздухе до полного удаления н-гептана, прессовали в таблетки и подвергали ступенчатому нагреву на воздухе: при температуре 873 К в течение 30 ч, затем при 1273 К в течение 58 ч. Фазовый состав контролировали методом рентгенофазового анализа (РФА) на дифрактометре Huber G670 (излучение CuKα1, Huber Diffraktiontechnik GmbH & Co. KG, Германия).
Смеси PMO–xGDC и PMO–xPr6O11 (x соответствует содержанию GDC или Pr6O11 в композите и изменяется от 20 до 50 мас. %) готовили путем тщательного перетирания соответствующих количеств порошков в планетарной мельнице в течение 30 мин под слоем н-гептана. В качестве твердоэлектролитной добавки был использован порошок коммерческого реактива GDC (Aldrich®, размер частиц порошка 0.1–0.5 мкм).
Исследование высокотемпературного термического расширения композитных материалов проводили на керамических образцах цилиндрической формы (6–8 мм диаметром и длиной 4.8–5.2 мм) при помощи дилатометра Netzsch DIL 402C (Германия) на воздухе и в восстановительной атмосфере Ar/H2 (8% H2) в температурном интервале 298–1273 K; скорость нагрева составляла 10 К/мин.
Для исследования электрохимических характеристик границы электрод/электролит были приготовлены симметричные ячейки типа “электрод/электролит/электрод”. В качестве твердого электролита были использованы таблетки GDC, приготовленные спеканием коммерческих порошков Ce0.9Gd0.1O1.95 (Aldrich®) при 1673К в течение 4 ч на воздухе. Плотность полученных таблеток GDC составила ~95% от рентгенографической. Для нанесения электродных слоев были приготовлены пасты, состоящие из порошка композитного материала и органического связующего (Heraeus V006) в соотношении 1 : 1 по массе. Нанесение электродных паст на противоположные поверхности таблеток твердых электролитов для формирования рабочего и противоэлектрода осуществляли методом трафаретной печати с использованием тканевых сеток VS-Monoprint PES HT PW 77/55 (Verseidag-Techfab GmbH). После этого образцы сушили при 423 K в течение 1 ч и отжигали при температуре 1173 K в течение 4 ч на воздухе. Площадь поверхности единичного электрода составляла ~0.16 см2.
Измерение поляризационного сопротивления электрода (Rη) осуществляли методом импедансной спектроскопии по трехэлектродной схеме подключения с использованием импедансметра P-5X (Electrochemical Instruments, Россия) в диапазоне частот от 0.1 до 5 × 105 Гц с амплитудой сигнала 10 мВ в интервале температур 773–1173 К на воздухе и в восстановительной атмосфере Ar/H2 (5% H2). Противоэлектрод и рабочий электрод, нанесенные методом трафаретной печати на поверхность таблетки твердого электролита, были идентичные. В качестве электрода сравнения был использован Pt-электрод, для создания которого на боковую поверхность таблетки твердого электролита наносили Pt-пасту. Токоподводами служила платиновая проволока, в качестве токосъемных контактов выступали платиновые сетки, плотно прижатые к противоэлектроду и рабочему электроду. Температуру образца измеряли с помощью Pt–Pt/Rh термопары, расположенной вблизи образца. Обработку импедансных спектров проводили с помощью программы ZView 2 (v.3.1, Scribner Associates, Inc.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работы была проведена оценка электрохимической активности РМО в качестве электродного материала СТОТЭ. Для этого методом импедансной спектроскопии исследовали электрохимическое поведение симметричных ячеек PMO/GDC/PMO на воздухе и в восстановительной атмосфере (Ar (95%)–H2 (5%)). На рис. 1а–1г приведены типичные импедансные спектры электрода PMO, нанесенного на поверхность твердого электролита GDC, в области повышенных (выше 973 К) и умеренных температур (845–973 К) на воздухе и в атмосфере Ar/H2 соответственно.
Рис. 1.
Спектры электродного импеданса границы PMO/GDC: при 1053 К на воздухе (а) и в восстановительной атмосфере (б); при 843 К на воздухе (в) и в восстановительной атмосфере (г). Эквивалентные электрические схемы, использованные для аппроксимации импедансных спектров на воздухе (д) и в восстановительной атмосфере (е).

Импедансный отклик в области повышенных температур на воздухе (рис. 1а) представляет собой совокупность двух дуг окружности. Это свидетельствует о том, что электродный процесс включает, по крайней мере, две четко различимые стадии, определяющие скорость электродной реакции. Для описания полученных спектров была использована эквивалентная электрическая схема (ЭЭС), состоящая из резистора (Rel), отвечающего сопротивлению твердого электролита, и двух последовательных цепочек параллельно соединенных резистора и элемента постоянного сдвига фаз (R1–CPE1, R2–CPE2) (рис. 1д, сверху). Величину общего поляризационного сопротивления (Rη) электрода рассчитывали как сумму величин сопротивлений R1 и R2, соответствующих высокочастотной и низкочастотной дугам окружности, с учетом нормировки на площадь электрода. При переходе в область умеренных температур на воздухе форма спектра незначительно изменяется (рис. 1в). В области высоких частот проявляется дуга окружности, отвечающая вкладу импеданса твердого электролита. В связи с этим для описания спектров при умеренных температурах была использована модифицированная ЭЭС (рис. 1д, снизу). Расчетная величина Rη электрода в этом случае также представляла собой сумму величин сопротивлений R1 и R2, полученных из аппроксимации средне- и низкочастотных областей импедансного отклика.
На рис. 1б и 1г приведены типичные импедансные спектры электрода PMO в восстановительной атмосфере в области повышенных и умеренных температур, соответственно. Следует отметить, что при переходе из области повышенных температур в область умеренных наблюдется изменение соотношения между высоко- и низкочастотным вкладами в электродный импеданс. При этом с понижением температуры наблюдается увеличение доли высокочастотного вклада в общий электродный импеданс исследуемой системы. При изменении состава атмосферы и переходе от окислительной среды к восстановительной наблюдается резкое смещение импедансных спектров в область малых значений импеданса. При этом происходит значительное снижение величины омического сопротивления, вызванное появлением электронной составляющей проводимости GDC в восстановительных условиях [10]. Это эквивалентно появлению параллельной резистивной ветки (Re) на ЭЭС, которая описывает электронную проводимость в исследуемой электрохимической системе. С учетом этого расчет величины Rη в восстановительной атмосфере был проведен с помощью ЭСС (рис. 1е), исходя из условия, что ионная проводимость GDC от рО2 не зависит, и величина сопротивления, соответствующая вкладу ионной проводимости GDC (Ri) в общее сопротивление, определяется, преимущественно, исходя из Rel на воздухе (окислительные условия). При этом величина сопротивления, обусловленная электронной проводимостью (Re), была рассчитана с помощью следующего уравнения
(1)
${{R}_{{\text{e}}}} = \frac{{{{R}_{{\text{i}}}}{{R}_{{{\text{HF}}}}}\left( {{\text{Ar--}}{{{\text{H}}}_{2}}} \right)}}{{{{R}_{{\text{i}}}} - {{R}_{{{\text{HF}}}}}\left( {{\text{Ar--}}{{{\text{H}}}_{2}}} \right)}},$На рис. 2 приведены температурные зависимости величины поляризационного сопротивления электрода PMO на воздухе и в восстановительной атмосфере (Ar (95%)–H2 (5%)). Полученные зависимости демонстрируют термоактивационное поведение во всем исследованном интервале температур. В случае воздушной атмосферы для реакции восстановления кислорода величина кажущейся энергии активации (Еа) составляет 1.08 эВ, а величина Rη – 8.8 Ом см2 при 1073 К. При переходе от окислительной атмосферы к восстановительной среде наблюдается повышение электрохимической активности электрода РМО. Величина поляризационного сопротивления электрода для реакции окисления водорода в случае восстановительной атмосферы в области повышенных температур (выше 973 К) снижается в 1.5–2 раза по сравнению с величиной Rη в реакции восстановления кислорода в окислительных условиях и составляет 4.8 Ом см2 при 1073 К. Следует отметить, что при понижении температуры разница между величинами Rη на воздухе и в восстановительной атмосфере нивелируется и при температуре 843 К они становятся сравнимы. При этом величина Еа в восстановительной атмосфере незначительно повышается до 1.28 эВ. Таким образом, исследование электрохимической активности показало, что РМО может рассматриваться в качестве основы для создания электродного материала при его использовании в СТОТЭ. Однако электрохимическая активность РМО недостаточна для создания эффективного СТОТЭ. В связи с этим нами была предпринята попытка улучшения электрохимической производительности электрода РМО в реакции восстановления кислорода. Для этого было проведено изучение электрохимических свойств композитной системы PMO–GDC.
Рис. 2.
Температурная зависимость общего поляризационного сопротивления (Rη) для электродов на основе однофазного PMO: (1) на воздухе; (2) в восстановительной атмосфере.

Известно, что создание композитных электродов представляет собой один из эффективных методов улучшения производительности работы электрода за счет увеличения протяженности зоны, на которой происходят электрохимические процессы [11–13]. В качестве кислородпроводящей фазы для создания композитного электрода нами был выбран твердый электролит GDC, что обусловлено его высокой ионной проводимостью и отсутствием химического взаимодействия с РМО до 1273 К, что было показано ранее [9].
На рис. 3 представлены температурные зависимости общего поляризационного сопротивления композитных электродов PМО–xGDC на воздухе. Зависимости имеют термоактивационный характер во всем исследованном интервале температур. В табл. 1 приведены величины кажущейся энергии активации (Ea), рассчитанные из аррениусовской зависимости величины, обратной Rη, при 873–1173 К на воздухе. Полученные величины Еа составляют 1.20–1.30 эВ. Локальный максимум величины активационного барьера (Ea = 1.33 эВ) наблюдается для композитного электрода, содержащего 30 мас. % GDC. Анализируя зависимость величины общего поляризационного сопротивления от состава композитного электрода при различных температурах (рис. 4), можно отметить немонотонное изменение величины Rη в зависимости от состава композитного электрода. При этом, как для чистого РМО, так и в случае составов, содержащих 30 и 50 мас. % GDC, достигаются сопоставимые величины локальных минимумов Rη (табл. 1). Таким образом, качественного улучшения электрохимической активности границы электрод/электролит на воздухе в случае композитов PМО–xGDC достичь не удается.
Рис. 3.
Температурная зависимость общего поляризационного сопротивления (Rη) для электродов на основе однофазного PMO (1) и композитов PMO–хGDC (х = мас. %) на воздухе: x = 20 (2), x = 30 (3), x = 40 (4), х = 50 (5).

Таблица 1.
Кажущиеся энергии активации (Ea), рассчитанные в интервале температур 600–900°C, обратных величин удельного поляризационного сопротивления (1/Rη) и величины Rη при 1073 К электродных материалов на основе PМО–хGDC на воздухе
| Состав электрода, х, мас. % GDC | Ea, эВ (±0.03 эВ) | Rη, Ом см2 |
|---|---|---|
| 0 | 1.08 | 8.8 |
| 20 | 1.28 | 13.5 |
| 30 | 1.33 | 8.4 |
| 40 | 1.23 | 12.4 |
| 50 | 1.21 | 9.1 |
Рис. 4.
Зависимость общего поляризационного сопротивления (Rη) композитных электродов PMO–хGDC от содержания GDC при различных температурах на воздухе, К: (1) 1173; (2) 1133; (3) 1093; (4) 1053; (5) 1018; (6) 973; (7) 933.
Другим способом повышения электрохимической активности РМО в реакции восстановления кислорода может быть использование композитных электродов PMO–xPr6O11. Выбор оксида празеодима Pr6O11 в качестве электроактивной добавки [14–16] обусловлен возможностью его использования в качестве катализатора окислительно-восстановительных реакций благодаря наличию перехода между различными степенями окисления празеодима Pr3+ → Pr4+. И хотя оксид обладает высоким значением КТР (18.9 ppm K–1 [17]), это не исключает возможности его применения в качестве электроактивного компонента композитного электрода.
Исследование высокотемпературного термического расширения композита PМО–xPr6O11 (x = 50 мас. % Pr6O11) на воздухе (рис. 5) показало возрастание КТР до 14.8 ppm K–1 по сравнению с PMO, демонстрирующим КТР 12.4 ppm K–1 [9]. Следует отметить, что эта величина является приемлемой при использовании данного материала с электролитом на основе GDC. В восстановительной атмосфере Ar/H2 (8%) композит показывает КТР 8.8 ppm K–1 в температурном интервале 450–1273 K. При этом на дилатометрической кривой присутствует высокотемпературный участок (1200–1273 K), на котором наблюдается сжатие образца (рис. 5). Для сравнения на рис. 5 приведена дилатометрическая кривая PMO, снятая в атмосфере Ar/H2 (8%). Следует отметить, что для композита линейный участок кривой сохраняется вплоть до 1200 K, тогда как для PMO лишь до 1000 K [9].
Рис. 5.
Дилатометрические кривые композита PМО–xPr6O11 (x = 50 мас. % Pr6O11) на воздухе (1), в атмосфере Ar/H2 (8%) (2), а также образца PMO в атмосфере Ar/H2 (8%) (3).

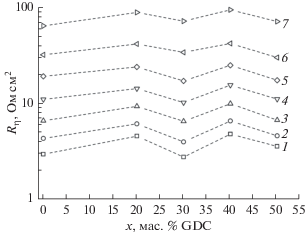
На рис. 6 представлены температурные зависимости общего поляризационного сопротивления композитных электродов PМО–xPr6O11 на воздухе. Зависимости также демонстрируют термоактивационное поведение во всем исследованном интервале температур. В табл. 2 приведены величины кажущейся энергии активации, рассчитанные из аррениусовской зависимости величины, обратной общему поляризационному сопротивлению в температурном интервале 873–1173 К на воздухе. Следует отметить, что введение Pr6O11 в состав электродного материала способствует снижению величины Ea от ~1.20 до ~0.90–1.00 эВ, что может быть связано с облегчением кислород-ионного транспорта через границу электрод/электролит. Рассматривая концентрационную зависимость Rη от состава композитного электрода (рис. 7), можно отметить, что увеличение содержания Pr6O11 способствует градиентному повышению электрохимической активности электрода в реакции восстановления кислорода. При переходе от однофазного РМО к композиту PMO–xPr6O11 наблюдается значимое снижение величины Rη, например, в случае х = 50 мас. % Pr6O11 – на порядок величины до 0.6 Ом см2 при 1073 К (табл. 2). Учитывая также отмеченную выше приемлемую величину КТР данного композита на воздухе, его можно рекомендовать в качестве электродного материала симметричного ТОТЭ.
Рис. 6.
Температурная зависимость общего поляризационного сопротивления (Rη) для электродов на основе однофазного PMO (1) и композитов PMO–хPr6O11 (х = мас. %) на воздухе: x = 20 (2), x = 30 (3), x = 40 (4), х = 50 (5).

Таблица 2.
Кажущиеся энергии активации (Ea), рассчитанные в интервале температур 873–1173 К, обратных величин удельного поляризационного сопротивления (1/Rη) и величины Rη при 1073 К электродных материалов на основе PМО–хPr6O11 на воздухе
| Состав электрода, х, мас. % Pr6O11 | Ea, эВ (±0.03 эВ) | Rη, Ом см2 |
|---|---|---|
| 20 | 1.04 | 6.2 |
| 30 | 0.80 | 4.1 |
| 40 | 0.87 | 1.8 |
| 50 | 0.86 | 0.6 |
Рис. 7.
Зависимость общего поляризационного сопротивления (Rη) композитных электродов PMO–хPr6O11 от содержания Pr6O11 при различных температурах на воздухе, К: (1) 1173; (2) 1133; (3) 1093; (4) 1053; (5) 1013; (6) 973; (7) 928.

Сравнение величин поляризационного сопротивления электродов на основе однофазного материала РМО при 1073 К показывает, что в случае восстановительной среды полученная величина Rη в несколько раз выше по сравнению с данными для таких перспективных электродных материалов для СТОТЭ как Sr2Fe1.5Mo0.5O6 (0.21 Ом см2 [18]) и La2CoTi0.7Mg0.3O6 (0.81 Ом см2 [19]). В случае воздушной атмосферы величины Rη для РМО в 2 раза меньше, чем для La2CoTi0.7Mg0.3O6, но уступают характеристикам для Sr2Fe1.5Mo0.5O6. Однако переход от чистого РМО к композитам PМО–хPr6O11 обеспечивает достижение близких с Sr2Fe1.5Mo0.5O6 величин Rη на воздухе.
ЗАКЛЮЧЕНИЕ
Проведена оценка возможности использования PMO в качестве электродного материала СТОТЭ. Исследование электрохимической активности РМО, нанесенного на поверхность твердого электролита GDC методом трафаретной печати, в окислительной и восстановительных средах показало, что величины поляризационного сопротивления электрода РМО при 1073 К на воздухе и в восстановительной атмосфере составили 8.8 и 4.8 Ом см2 соответственно. Это указывает на возможность использования РМО в качестве электродного материала СТОТЭ. Для повышения электрохимической активности РМО в реакции восстановления кислорода рассмотрены варианты использования композитных электродов PМО–xGDC и PМО–xPr6O11. Было показано, что наиболее перспективными с точки зрения достижения высокой электрохимической производительности являются композиты PМО–xPr6O11. Так, при переходе от однофазного РМО к композиту PMO–xPr6O11 наблюдается значимое снижение величины Rη (в случае х = 50 мас. % Pr6O11 – на порядок величины до 0.6 Ом см2 при 1073 К на воздухе).
Список литературы
Perovskite Oxide for Solid Oxide Fuel Cells (Ed. T. Ishihara), New York: Springer, 2009, 302 p.
Бредихин, С.И., Голодницкий, А.Э., Дрожжин, О.А., Истомин, С.Я., Ковалевский, В.П., Филиппов, С.П. Стационарные энергетические установки с топливными элементами: материалы, технологии, рынки. М.: НТФ “Энергопрогресс” Корпорации “ЕЭЭК”, 392 с.
Ruiz-Morales, C., Marrero-López, D., Canales-Vázquez, J., and Irvine, J.T.S., Symmetric and reversible solid oxide fuel cell, RSC Adv., 2011, vol. 1, p. 1403.
Su, C., Wang, W., Liu, M., Tadé, M.O., and Shao, Z., Progress and Prospects in Symmetrical Solid Oxide Fuel Cells with Two Identical Electrodes, Adv. Energy Mater., 2015, vol. 5, p. 1.
Ni, C., Feng, J., Cui, J., Zhou, J., and Ni, J., An n-type oxideFe0.5Mg0.25Ti0.25Nb0.9Mo0.1O4 – δ for both cathode and anode of a solid oxide fuel cell, J. Electrochem. Soc., 2017, vol. 164, p. F283.
Tsai, M., Greenblatt, M., and McCarroll, W.H., Oxide ion conductivity in Ln5Mo3O16 +x (Ln = La, Pr, Nd, Sm, Gd; x = 0.5), Chem. Mater., 1989. vol. 1, p. 253.
Voronkova, V.I., Leonidov, I.A., Kharitonova, E.P., Belov, D.A., Patrakeev, M.V., Leonidova, O.N., and Kozhevnikov, V.L., Oxygen ion and electron conductivity in fluorite-like molybdates Nd5Mo3O16 and Pr5Mo3O16, J. Alloys Compounds, 2014, vol. 615, p. 395.
Biendicho, J.J., Playford, H.Y., Rahman, S.M.H., Norberg, S.T., Eriksson, S.G., and Hull, S., The fluorite-like phase Nd5Mo3O16 ± δ in the MoO3−Nd2O3 system: synthesis, crystal structure, and conducting properties, Inorg. Chem., 2018, vol. 57, p. 7025.
Истомин, С.Я., Котова, А.И., Лысков, Н.В., Мазо, Г.Н., Антипов, Е.В. Pr5Mo3O16 + δ – новый анодный материал для твердооксидных топливных элементов, Журн. неорган. химии, 2018, Т. 63, С. 1274. [Istomin, S.Ya., Kotova, A.I., Lyskov, N.V., Mazo, G.N., and Antipov, E.V., Pr5Mo3O16 + δ: A new anode material for solid oxide fuel cells, Russ. J. Inorg. Chem., 2018, vol. 63, p. 1291.]
High Temperature and Solid Oxide Fuel Cells Fundamentals, Design and Applications (Ed. S.C. Singhal and K. Kendall), Amsterdam: Elsevier, 2003, 406 p.
Kenjo, T., Osawa, S., and Fujikawa, K. High-temperature air cathodes containing ion conductive oxides, J. Electrochem. Soc., 1991, vol. 138, p. 349
Kolchina, L.M., Lyskov, N.V., Petukhov, D.I., and Mazo, G.N., Electrochemical characterization of Pr2CuO4–Ce0.9Gd0.1O1.95 composite cathodes for solid oxide fuel cells, J. Alloys Compd., 2014, vol. 605, p. 89.
Lyskov, N.V., Kolchina, L.M., Galin, M.Z., and Mazo, G.N., Development of lanthanum-doped praseodymium cuprates as cathode materials for intermediate-temperature solid oxide fuel cells, Solid State Ionics, 2018, vol. 319, p. 156.
Taguchi, H., Chiba, R., Komatsu, T., Orui, H., Watanabe, K., and Hayashi, K., LNF SOFC cathodes with active layer using Pr6O11 or Pr-doped CeO2, J. Power Sources, 2013, vol. 241, p. 768.
Вшивкова, А.И., Горелов, В.П. Активация кислородной реакции пленкой оксида празеодима на платиновом электроде в контакте с электролитом YSZ, Электрохимия. 2016. Т. 52. С. 549. [Vshivkova, A.I. and Gorelov, V.P., Activation of oxygen reaction by praseodymium oxide film on platinum electrode in contact with YSZ electrolyte, Russ. J. Electrochem., 2016, vol. 52, p. 488.]
Ding, X., Zhu, W., Hua, G., Li, J., and Wu, Z., Enhanced oxygen reduction activity on surface-decorated perovskite La0.6Ni0.4FeO3 cathode for solid oxide fuel cells, Electrochim. Acta, 2015, vol. 163, p. 204.
Chiba, R., Taguchi, H., Komatu, T., Orui, H., Nozawa, K., and Araiet, H. High temperature properties of Ce1 –xPrxO2 – δ as an active layer material for SOFC cathodes, Solid State Ionics, 2011, vol. 197, p. 42.
Liu, Q., Dong, X., Xiao, G., Zhao, F., and Chen, F., A novel electrode material for symmetrical SOFCs, Adv. Mater., 2010, vol. 22, p. 5478.
Mazo, G.N., Lyskov, N.V., Istomin, S.Ya., and Antipov, E.V., Evaluation of La2CoTi0.7Mg0.3O6 as an electrode material for a symmetrical SOFC, J. Electroceram., 2018, vol. 40, p. 162.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия


