Электрохимия, 2020, T. 56, № 2, стр. 108-118
Новые электродные материалы симметричного твердооксидного топливного элемента на основе перовскитов (La,Ca)(Fe,Co,Mg,Mo)O3 – δ
А. В. Морозов a, *, С. Я. Истомин a, **, Д. А. Стребков a, Н. В. Лысков b, М. М. Абдуллаев a, Е. В. Антипов a
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
119992 Москва, ГСП-1, Ленинские горы, 1, стр. 3, Россия
b Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
* E-mail: 89067146888@mail.ru
** E-mail: isserge71@gmail.com
Поступила в редакцию 10.09.2018
После доработки 11.02.2019
Принята к публикации 05.07.2019
Аннотация
Проведено исследование электропроводности перовскитов La0.3Ca0.7Fe0.6Mg0.175Mo0.225O3 – δ (LCF6) и La0.3Ca0.7Fe0.5Mg0.25Mo0.25O3 – δ (LCF5) в интервале температур 573–1173 К при варьируемом парциальном давлении кислорода. Установлено, что при переходе от воздушной к восстановительной атмосфере (8% Ar/H2) для обоих образцов наблюдается рост электропроводности при 1173 K от 4.6 до 25 См/см для LCF6 и 0.5 до 10 См/см для LCF5. Показано, что для LCF5 электропроводность практически не зависит от парциального давления кислорода во всем изученном интервале температур и парциальных давлений кислорода, тогда как для LCF6 наблюдается присутствие двух участков. Установлено, что величины электропроводности LCF5 сохраняются при циклической смене атмосферы от воздушной к восстановительной и обратно. Методом импедансной спектроскопии изучено электрохимическое поведение на воздухе пористого электрода на основе (La,Ca)(Fe,Mg,Mo)O3 – δ, нанесенного на твердый электролит Ce0.8Gd0.2O1.9 (GDC). Показано, что поляризационное сопротивление границы электрод/электролит (Rη) для электродов LCF5 и LCF6 при 1173 K составляет 2.7 и 3.6 Ом см2 соответственно. Частичное замещение Fe на Со позволяет снизить величину Rη до ∼1.2 Ом см2 для La0.3Ca0.7Fe0.45Co0.05Mg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.55Co0.05Mg0.175Mo0.225O3 – δ. Эти материалы обладают также близкими к GDC величинами КТР и приемлемой электропроводностью на воздухе, а также в восстановительной атмосфере и могут быть рекомендованы для использования в качестве электродных материалов симметричного твердооксидного топливного элемента.
ВВЕДЕНИЕ
В настоящее время одним из перспективных направлений современного развития технологии твердооксидного топливного элемента (ТОТЭ) является создание так называемого симметричного ТОТЭ (СТОТЭ), в котором материалы катода и анода имеют одинаковый химический состав. Преимуществами СТОТЭ являются пониженные энергозатраты при его изготовлении, благодаря уменьшению количества стадий термообработки при его производстве, а также решение проблемы отравления анода при использовании углеводородного топлива благодаря возможности циклически переключать потоки анодных и катодных газов, окисляя осевшие на аноде частицы углерода и серосодержащих соединений [1–3]. Требования к электродным материалам СТОТЭ достаточно жесткие – обладая устойчивостью в атмосфере катодных и анодных газов, материал должен также иметь высокую электропроводность и каталитическую активность в электрохимических реакциях на электродах и, более того, обладать химической и термомеханической совместимостью с материалом электролита. Однофазными электродными материалами СТОТЭ являются сложные оксиды общего состава ABO3 со структурой перовскита [2, 3]. В В-подрешетке они содержат катионы d-металлов, таких как Sc, Ti, Cr, Mn, Fe, Co, а также Mo. Как правило, такие перовскиты содержат одновременно в своем составе два или более различных В-катиона. Присутствие одного из них обеспечивает устойчивость перовскитной фазы (например, катионы Sc+3, Ti+3/+4, Cr+3) в восстановительной атмосфере, а других – высокую электропроводность и каталитическую активность в электродных реакциях (например, Mn, Fe, Co, Mo). В качестве примеров можно привести материалы СТОТЭ на основе перовскитов La0.75Sr0.25Cr0.5Mn0.5O3 – δ (LSCM) [4], La0.8Sr0.2Sc0.2Mn0.8O3 – δ (LSSM) [5], (La,Sr)(Ti,Fe)O3 – δ [6–8], Sr2Fe1.5Mo0.5O6 – δ (SFM) [9, 10].
Среди различных материалов СТОТЭ на основе перовскитов наибольший интерес, с нашей точки зрения, привлекают железосодержащие оксиды. Легкость образования кислородных вакансий в их кристаллических структурах, связанная с устойчивостью различных координационных чисел для катионов Fe в кислородном окружении, приводит к значимой кислород-ионной проводимости, что улучшает их электрохимические характеристики при использовании в качестве электродных материалов ТОТЭ. Однако такие перовскиты должны содержать в В-подрешетке, помимо катионов Fe, также катионы с устойчивой октаэдрической координацией (например, катионы Mg2+). Это будет способствовать повышению термодинамической устойчивости фаз в восстановительной атмосфере. Кроме того, пример двойного перовскита Sr2Fe1.5Mo0.5O6 – δ [9, 10] показывает, что наличие в В-подрешетке также катионов Mo способствует повышению электропроводности и каталитической активности при низких парциальных давлениях кислорода (pO2). Из вышесказанного следует, что состав В-подрешетки перовскита должен отвечать формуле A(Fe,Mg,Mo)O3. При этом следует избегать использования большого количества катионов Fe в составе оксида (вероятно, не более 50–60%), чтобы не понизить термодинамическую устойчивость перовскитной фазы за счет значимого количества пар Fe–O–Fe и, следовательно, высокой вероятности образования большого количества кислородных вакансий при низких pO2.
Более того, наличие в составе перовскита крупных катионов Sr2+ приводит к повышенной реакционной способности электродных материалов по отношению к традиционным электролитам ТОТЭ, представляющим собой кислотные оксиды со структурой флюорита (например, YSZ), его необходимо заменить на меньший (и, значит, менее оснóвный) катион Ca2+. Для зарядового баланса в качестве второго А-катиона можно использовать самый крупный из РЗЭ катионов La3+. Это связано с тем, что в этом случае можно ожидать значения t-фактора близкие к 1, а значит, и наименьшей степени искажения структуры перовскита. Это, в соответствии с одноэлектронной моделью зонной структуры перовскита Дж. Гуденафа [11], должно приводить к наиболее широким энергетическим зонам и высокой электропроводности оксида.
Недавно нами были синтезированы и исследованы подобные перовскиты (La,Ca)(Fe,Mg,Mo)O3 – δ [12]. По совокупности высокотемпературных свойств полученных оксидов, важных для практического использования в качестве электродного материала СТОТЭ, таких как химическая устойчивость в восстановительной атмосфере и по отношению к традиционным электролитам ТОТЭ, сопоставимость по величинам коэффициентов термического расширения (КТР), а также наличию достаточной высокотемпературной электропроводности на воздухе и в восстановительной атмосфере наиболее перспективными являются составы La0.3Ca0.7Fe0.6Mg0.175Mo0.225O3 – δ и La0.3Ca0.7Fe0.5Mg0.25Mo0.25O3 – δ. В настоящей работе нами было проведено детальное исследование высокотемпературной электропроводности этих перовскитов при различных парциальных давлениях кислорода, а также их электрохимической активности в реакции восстановления кислорода методом импедансной спектроскопии. С целью улучшения электрохимических характеристик электродных материалов на воздухе были приготовлены и охарактеризованы перовскиты La0.3Ca0.7Fe0.6 – хCoxMg0.175Mo0.225O3 – δ и La0.3Ca0.7Fe0.5 –xCoxMg0.25Mo0.25O3 – δ с частичным (х = 0.05 и 0.1) замещением железа на кобальт.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез порошкообразных образцов La0.3Ca0.7Fe0.6 – xCoxMg0.175Mo0.225O3 – δ и La0.3Ca0.7Fe0.5 –xCoxMg0.25Mo0.25O3 – δ (x = 0.0, 0.05 и 0.10) проводили при помощи золь–гель-метода. Для этого стехиометрические навески исходных веществ, рассчитанные на получение 5 г конечного продукта, взвешивали на аналитических весах с точностью до ±0.0002 г. В качестве исходных веществ использовали Fe(NO3)3 ⋅ 9Н2О (99.999%), Co(NO3)2 ⋅ 6Н2О (99.999%), La(NO3)3 ⋅ 6Н2О (99.999%), (NH4)6Mo7O24 ⋅ 4H2O (99.999%), CaCO3 (99.999%) и MgO (99.999%). Учитывая, что содержание молекул воды в гидратах меняется при хранении, с целью определения точного химического состава был проведен их термогравиметрический анализ на воздухе. В ходе синтеза нитраты железа, кобальта, лантана и гептамолибдат аммония растворяли в минимальном количестве дистиллированной воды в стакане объемом 100 мл. Оксид магния и карбонат кальция растворяли в 20 мл концентрированной азотной кислоты, а затем приливали к раствору нитратов. Полученный раствор переливали в фарфоровую чашку объемом 500 мл, нагревали смесь на газовой горелке до кипения и добавляли 5%-ный водный раствор 1.25 г поливинилового спирта, после этого маленькими порциями засыпали 20 г моногидрата лимонной кислоты. Раствор упаривали на газовой горелке до образования черной или темно-коричневой массы. Фарфоровую чашку охлаждали, остаток переносили в агатовую ступку и перетирали в течение 10–15 мин. После этого проводили два отжига при температуре 1173 К в течение 12 ч и 1373 К в течение 5 ч с промежуточным перетиранием между отжигами под слоем ацетона.
Рентгенофазовый анализ (РФА) поликристаллических образцов проводили при комнатной температуре в камере Гинье Huber G670 Guinier (CuKα1-излучение, λ = 1.5406 Å; детектор image plate). Фазовый анализ образцов осуществляли с использованием базы данных ICDD PDF-2. Для расчета рентгенограмм и уточнения параметров элементарных ячеек использовался программный пакет STOE “WinXPOW”.
Катионный состав перовскитов La0.3Ca0.7Fe0.6 ‒ xCoxMg0.175Mo0.225O3 – δ и La0.3Ca0.7Fe0.5 –xCoxMg0.25Mo0.25O3 – δ, x = 0.05 и 0.10 определяли методом рентгеноспектрального микроанализа (РСМА) с помощью энергодисперсионного детектора вторичного рентгеновского излучения “INCA” (Oxford instruments) в электронном сканирующем микроскопе JEOL JSM-6490LV (ускоряющее напряжение 20 кВ).
Электропроводность керамических образцов измеряли четырехзондовым методом на постоянном токе с помощью потенциостата/гальваностата Autolab PGSTAT302N с модулем FRA 32M в ячейке ProboStat (Norеcs) в режиме циклической вольтамперометрии при развертке тока в интервале от –100 до 100 мА со скоростью 20 мА/с. Измерения проводили в интервале температур 573–1173 К на воздухе и в атмосфере Ar/H2 (8%), а для La0.3Ca0.7Fe0.6Mg0.175Mo0.225O3 – δ и La0.3Ca0.7Fe0.5Mg0.25Mo0.25O3 – δ при варьировании парциального давления кислорода от 10–4 до 1 атм. Удельное сопротивление образца (ρ) рассчитывали в соответствии с законом Ома по тангенсу угла наклона вольт-амперной кривой, измеренной при заданной температуре:
где $\frac{{\partial U}}{{\partial I}}$ – тангенс угла наклона вольт-амперной кривой; S – площадь сечения образца; l – расстояние между потенциальными электродами.Поляризационное сопротивление границы электрод/электролит измеряли методом импедансной спектроскопии с помощью потенциостата/гальваностата Autolab PGSTAT302N с модулем FRA 32M в ячейке ProboStat (Norеcs) по трехэлектродной схеме подключения в диапазоне частот от 1 МГц до 10 МГц с амплитудой сигнала 10 мВ. Измерения проводили в интервале температур 973–1173 K на воздухе. Температуру контролировали с помощью Pt–Pt/Rh-термопары, расположенной вблизи образца.
Образцы для измерений представляли собой симметричные электрохимические ячейки типа “электрод/электролит/электрод”. В качестве электролита были использованы плотноспеченные керамические таблетки Ce0.8Gd0.2O1.9 (GDC) (диаметр 8 мм, высота ~3–4 мм), на торцевую поверхность которых наносили электродные материалы (площадь поверхности единичного электрода – 0.16 см2, толщина электродного слоя ~50 мкм). Для приготовления таблеток твердого электролита GDC был использован коммерческий порошок Ce0.8Gd0.2O1.9 марки GDC20-TC производства компании FuelCellMaterials (США). Нанесение электродных слоев на торцевые стороны таблеток GDC проводили методом трафаретной печати. Для этого были приготовлены электродные пасты, состоящие из порошка исследуемого материала и органического связующего (Heraeus V006, Германия), которое добавляли в соотношении 1 : 1 по массе. Нанесение электродных паст осуществляли через полимерную сетку VS-Monoprint PES HT PW 100/40 (Verseidag-Techfab GmbH, Германия) с помощью резинового ракеля. После нанесения электродных слоев образцы сушили при 393 К в течение 30 мин. Процедуру нанесения повторяли 2 раза с каждой стороны электрохимической ячейки. Последующую термическую обработку электрохимических ячеек проводили в многоступенчатом режиме с финальным отжигом при 1373 К в течение 2 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Высокотемпературная электропроводность La0.3Ca0.7Fe0.6Mg0.175Mo0.225O3 – δ и La0.3Ca0.7Fe0.5Mg0.25Mo0.25O3 – δ при варьируемом pO2
На рис. 1 представлены температурные зависимости электропроводности в аррениусовских координатах для La0.3Ca0.7Fe0.5Mg0.25Mo0.25O3 – δ (LCF5) и La0.3Ca0.7Fe0.6Mg0.175Mo0.225O3 – δ (LCF6) при различных парциальных давлениях кислорода. Образцы демонстрируют термоактивационное поведение во всем исследованном интервале температур и парциальных давлениях кислорода. Следует отметить, что в интервале pO2 от 10–4 до 1 атм с повышением парциального давления кислорода наблюдается увеличение электропроводности. Это свидетельствует о том, что основными носителями заряда в исследованных соединениях являются дырки, локализованные на катионах железа (Fe4+ или ${\text{Fe}}_{{{\text{Fe}}}}^{\centerdot }$), образование которых можно описать следующим квазихимическим уравнением:
(2)
${\text{2Fe}}_{{{\text{Fe}}}}^{x} + {\text{V}}_{{\text{O}}}^{{\centerdot \centerdot }} + \frac{1}{2}{{{\text{O}}}_{2}}({\text{г}}) \to 2{\text{Fe}}_{{{\text{Fe}}}}^{\centerdot } + {\text{O}}_{{\text{O}}}^{x},$Рис 1.
Температурные зависимости электропроводности LCF5 (а) и LCF6 (б) при различных парциальных давлениях кислорода.

В свою очередь образование кислородных вакансий может быть обусловлено как процессами потери кислорода с ростом температуры, так и понижением парциального давления кислорода в газовой фазе. Кроме того, формирование кислородных вакансий в анионной подрешетке также обусловлено гетеровалентным замещением атомов лантана на кальций:
(3)
$\begin{gathered} 2{\text{CaO}} + {\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{3}}\xrightarrow{{{\text{LaFe}}{{{\text{O}}}_{{\text{3}}}}}} \\ \to 2{\text{Ca}}_{{{\text{La}}}}^{'} + 2{\text{Fe}}_{{{\text{Fe}}}}^{x} + 4{\text{O}}_{{\text{O}}}^{x} + V_{{\text{O}}}^{{\centerdot \centerdot }}, \\ \end{gathered} $При переходе к восстановительной атмосфере (8% Ar/H2) для обоих образцов наблюдается резкое возрастание электропроводности. Так для образца LCF6 наблюдается рост электропроводности от 4.6 до 25 См/см, а для LCF5 от 0.5 до 10 См/см при 1173 K при переходе от воздушной атмосферы к Ar/H2. Причиной такого поведения может являться смена типа проводимости с p- на n-, при восстановлении части катионов Mo6+ до Mo5+ и Fe3+ до Fe2+ в соответствии со следующими квазихимическими уравнениями:
(4)
$2{\text{Fe}}_{{{\text{Fe}}}}^{x} + {\text{O}}_{{\text{O}}}^{x} \to 2{\text{Fe}}_{{{\text{Fe}}}}^{'} + {\text{V}}_{{\text{O}}}^{{\centerdot \centerdot }} + \frac{1}{2}{{{\text{O}}}_{2}}({\text{г}}),$(5)
$2{\text{Mo}}_{{{\text{Mo}}}}^{x} + {\text{O}}_{{\text{O}}}^{x} \to 2{\text{Mo}}_{{{\text{Mo}}}}^{'} + {\text{V}}_{{\text{O}}}^{{\centerdot \centerdot }} + \frac{1}{2}{{{\text{O}}}_{2}}({\text{г}}),$Смена типа проводимости с p- на n-тип наблюдается также для других Fe-содержащих перовскитов. В частности, для SrFe0.7Mo0.3O3 – δ [13], который также демонстрирует более высокую электропроводность в восстановительной атмосфере, чем на воздухе.
Столь резкий рост электропроводности в восстановительной атмосфере можно также связать с восстановлением перовскита с образованием металлического железа и/или молибдена, а также высокопроводящих оксидов (например, Fe3O4). Такое поведение демонстрируют, в частности, перовскиты La0.5 –xSr0.5 –xTi0.6Fe0.4O3 – δ, которые частично восстанавливаются в водороде до α-Fe [14]. Из данных РФА образцов после измерений в восстановительной атмосфере следует, что они не содержат в своем составе восстановленных оксидов или металлов, а основной остается фаза со структурой перовскита. Кроме того, для образца LCF5 дополнительно было проведено in situ циклирование атмосферы в измерительной ячейке от восстановительной до воздушной и опять до восстановительной. Из полученных результатов (рис. 2) следует стабильность величин высокотемпературной электропроводности при такой циклической смене атмосферы, что доказывает, по-видимому, обратимость механизма переключения между проводимостью p- и n-типа в этих условиях. Это очень важный результат, демонстрирующий возможность применения таких электродных материалов в симметричном ТОТЭ, в котором обратимое изменение газовых потоков для анодного и катодного газовых пространств является одним из основных преимуществ.
Рис. 2.
Температурные зависимости электропроводности LCF5 при циклировании в атмосфере воздуха и 8% Ar/H2.

Для детального анализа изменения электропроводности от рО2 и изучения механизма взаимодействия кислорода из газовой фазы с перовскитными материалами были построены изотермы электропроводности в зависимости от pO2 в билогарифмических координатах (рис. 3). Следует отметить различный характер этих зависимостей для исследованных образцов. Так для LCF5 (рис. 3а) электропроводность практически не зависит от парциального давления кислорода во всем изученном интервале температур и парциальных давлений кислорода (тангенс угла наклона составляет 0.05 ± 0.01). В то же время для LCF6 (рис. 3б) наблюдается присутствие двух участков, где тангенс угла наклона зависимостей при низких pO2 меняется с ростом температуры от 0.25 до 0.17. Наличие положительного наклона на lg–lg-кривых, по всей видимости, связано с образованием дырок при внедрении кислорода в кислородные вакансии (см. ниже). Соответственно различное поведение двух перовскитов, очевидно, можно объяснить различной способностью к образованию кислородных вакансий в их структурах. Из кристаллохимии оксидов Fe, Mg и Mo следует, что кислородные вакансии могут образовываться лишь в парах Fe–O–Fe, но не в парах Mg–O–M или Mo–O–M (M = Fe, Mg, Mo). Соответственно для перовскита LCF6 можно ожидать большей склонности к образованию кислородных вакансий с ростом температуры и понижении парциального давления кислорода в силу статистически большего количества пар Fe–O–Fe в нем.
Рис. 3.
Зависимость электропроводности LCF5 (а) и LCF6 (б) от парциального давления кислорода при различных температурах (цифрами указан тангенс угла наклона соответствующих прямых).

Для LCF6 (рис. 3б) тангенс угла наклона зависимости электропроводности от рО2 при 573–673 K в интервале парциальных давлений 10–4–0.21 атм составляет ~1/4. Такое поведение $\left( {\sigma \propto p_{{{{{\text{O}}}_{{\text{2}}}}}}^{{1{\text{/}}4}}} \right)$ может отвечать процессу внедрения кислорода в анионную подрешетку, что описывается следующим квазихимическим уравнением [15]:
(6)
$\frac{1}{2}{{{\text{O}}}_{2}}({\text{г}}) + {\text{V}}_{{\text{O}}}^{{\centerdot \centerdot }} \Leftrightarrow {\text{O}}_{{\text{O}}}^{x} + 2{{h}^{\centerdot }}.$Повышение температуры от 773 до 1173 K приводит к уменьшению тангенса угла наклона изотерм проводимости до ~1/6, в результате чего внедрение кислорода из газовой фазы в кристаллическую решетку могло бы осуществляться за счет образования междоузельного кислорода [16]:
(7)
$\frac{1}{2}{{{\text{O}}}_{2}}({\text{г}}) \Leftrightarrow {\text{O}}_{i}^{{''}} + 2{{h}^{\centerdot }}.$Следует отметить, что в структуре перовскита образование междоузельного кислорода невозможно вследствие геометрических затруднений, поэтому описание соответствующих участков lg(σ)–lg$\left( {{{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right)$-кривых в рамках этой модели некорректно. Из литературы известно, что зависимость тангенса угла наклона lg–lg-кривых 1/6 характерна для железосодержащих сложных оксидов и может быть объяснена при учете диспропорционирования Fe3+, а также межэлектронного обмена между катионами Fe и Mo [13, 17, 18].
Электрохимическая активность La0.3Ca0.7Fe0.5Mg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.6Mg0.175Mo0.225O3 – δ в реакции восстановления кислорода на воздухе
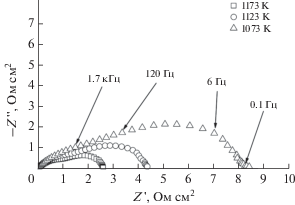
На рис. 4 и 5 представлены типичные спектры электродного импеданса для симметричных ячеек с электродными материалами на основе LCF5 и LCF6 на воздухе. Приведенные спектры электродного импеданса состоят из совокупности двух дуг окружности. Это свидетельствует о том, что процесс восстановления кислорода включает, по крайней мере, две четко различимые стадии, определяющие скорость электродной реакции.
Для описания полученных импедансных спектров была использована эквивалентная электрическая схема (ЭЭС), представленная на рис. 6. Эквивалентная схема состоит из последовательно соединенных трех резисторов (R1, R2 и R3) и двух элементов постоянной фазы (CPE1 и CPE2), соединенных параллельно с R2 и R3, соответственно. Импеданс CPE может быть выражен как:
где A – коэффициент пропорциональности, j – мнимая единица, ω – угловая частота и P – экспоненциальный показатель, обозначающий фазовое отклонение [19]. Величина R1 соответствует сопротивлению электролита, определяемому по величине высокочастотной отсечки. Величины R2 и R3, отвечающие высоко- и низкочастотным дугам импедансного спектра, соответственно, представляют отклик, обусловленный вкладом электродных процессов.Рис. 6.
Эквивалентная электрическая схема, используемая для описания спектров импеданса на рис. 4 и 5.

Следует отметить, что величина общего поляризационного сопротивления (Rη), определяемая как сумма величин R2 и R3 с учетом нормирования на площадь электрода, для обоих составов LCF5 и LCF6 составляют 2.7 и 3.6 Ом см2 при температуре 1173 K, соответственно. Полученные величины являются относительно большими по сравнению Rη для традиционных катодных материалов на основе манганитов лантана–стронция [20], но вполне достаточными для протекания реакции восстановления кислорода. Температурные зависимости Rη для изученных перовскитов представлены на рис. 7. Энергия активации Ea реакции восстановления кислорода составляет 1.45 и 1.62 эВ для составов LCF5 и LCF6 соответственно. Это сопоставимо с данными для катодных материалов на основе перовскитов 3d-металлов [21]. Следует отметить, что дальнейшее повышение электрохимической активности исследуемых материалов в реакции восстановления кислорода может быть связано с оптимизацией микроструктуры границы электрод/электролит, а также с модификацией их химического состава, в частности введением в состав перовскита катионов кобальта.
Синтез и высокотемпературные свойства кобальт-замещенных перовскитов La0.3Ca0.7Fe0.5 – xCoxMg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.6 – xCoxMg0.175Mo0.225O3 – δ (x = 0.05 и 0.1)
Из литературы известно, что введение небольшого количества катионов кобальта в состав катодного материала способствует улучшению электрохимической активности в реакции восстановления кислорода благодаря тому, что кобальтсодержащие перовскиты имеют высокую электронную и, главное, кислород-ионную проводимость [22]. С целью улучшения электрохимических характеристик электродных материалов на основе перовскитов LCF5 и LCF6 на воздухе нами был проведен синтез кобальтзамещенных составов La0.3Ca0.7Fe0.5 – xCoxMg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.6 –xCoxMg0.175Mo0.225O3 – δ (x = 0.05 и 0.1). На дифрактограммах всех полученных образцов помимо рефлексов основной перовскитной фазы присутствуют рефлексы CaMoO4 (<5%). Отражения, относящиеся к перовскитной фазе, были успешно проиндицированы в элементарных ячейках с параметрами, указывающими на образование ромбически искаженной перовскитной фазы (пространственная группа Pnma, a ≈ $\sqrt 2 $aпер; b ≈ 2aпер; c ≈ $\sqrt 2 $aпер, где aпер – параметр элементарной ячейки кубического перовскита). Данные РФА синтезированных образцов вместе с их сокращенными обозначениями приведены в табл. 1. Результаты РСМА полученных образцов подтвердили их катионный состав (табл. 1). Для образцов Fe0.45Co0.05 и Fe0.4Co0.1 наблюдается небольшое снижение объема элементарной ячейки с ростом содержания кобальта. Это связано с меньшим ионным радиусом катионов Co3+ (r = = 0.61 Å, высокоспиновое состояние [23]) по сравнению с радиусом катионов Fe3+ (r = 0.645 Å). Кроме того, составы Fe0.55Co0.05 и Fe0.5Co0.1 демонстрируют противоположную тенденцию – рост объема элементарной ячейки с увеличением содержания кобальта. Это можно связать с изменением (уменьшением) кислородного содержания перовскитной фазы с ростом содержания кобальта. Действительно, большее количество катионов Fe/Co в составе этих образцов (60% от общего количества В-катионов) увеличивает количество пар Fe/Co–O–Fe/Co, что, как отмечалось выше, должно привести к образованию перовскитов с большим кислородным дефицитом. С целью изучения устойчивости полученных перовскитов в восстановительной атмосфере был проведен их отжиг в потоке Ar/H2 (10%) при 1173 К в течение 24 ч. РФА образцов после термообработки показал сохранение в них фаз со структурой перовскита и даже существенное снижение примеси CaMoO4. Это свидетельствует об устойчивости кобальтзамещенных составов в данных экспериментальных условиях.
Таблица 1.
Параметры и объем элементарных ячеек La0.3Ca0.7Fe0.5 – xCoxMg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.6 ‒ xCoxMg0.175Mo0.225O3 – δ (x = 0.05 и 0.1), а также их катионный состав, полученный из данных РСМА
| Образец | Теоретический катионный состав | Параметры (Å) и объем элементарной ячейки (Å3) | Данные РСМА-анализа |
|---|---|---|---|
| Fe0.55Co0.05 | La0.3Ca0.7Fe0.55Co0.05Mg0.175Mo0.225 | a = 5.4741(1) | La0.29Ca0.71Fe0.47Co0.04Mg0.23Mo0.26 |
| b = 5.5270(1) | |||
| c = 7.7626(1) | |||
| V = 234.860(5) | |||
| Fe0.5Co0.1 | La0.3Ca0.7Fe0.5Co0.1Mg0.175Mo0.225 | a = 5.4848(2) | La0.3Ca0.7Fe0.49Co0.1Mg0.18Mo0.22 |
| b = 5.5366(2) | |||
| c = 7.7761(3) | |||
| V = 236.14(2) | |||
| Fe0.45Co0.05 | La0.3Ca0.7Fe0.45Co0.05Mg0.25Mo0.25 | a = 5.4799(2) | La0.30Ca0.7Fe0.42Co0.05Mg0.25Mo0.28 |
| b = 5.5353(1) | |||
| c = 7.7759(2) | |||
| V = 235.87(1) | |||
| Fe0.4Co0.1 | La0.3Ca0.7Fe0.4Co0.1Mg0.25Mo0.25 | a = 5.4780(2) | La0.3Ca0.7Fe0.38Co0.1Mg0.25Mo0.27 |
| b = 5.5284(1) | |||
| c = 7.7706(1) | |||
| V = 235.34(4) |
Дилатометрические кривые на воздухе кобальтсодержащих образцов приведены на рис. 8. Все образцы показывают коэффициенты термического расширения (КТР) на воздухе в интервале 12.6–13.1 ppm K–1, что близко к значениям КТР составов без кобальта [12], а также GDC (12.8 ppm K–1 [24]). Составы с большим содержанием Co демонстрируют немного более высокие значения КТР по сравнению с таковыми с низким содержанием Co (например, 12.6 ppm K–1 для Fe0.45Co0.05 и 13.1 ppm K–1 для Fe0.4Co0.1). Это, вероятно, связано с наличием переходов между низко- и высокоспиновым состояниями катиона Co3+ с ростом температуры [25].
Рис. 8.
Дилатометрические кривые на воздухе La0.3Ca0.7Fe0.5 – xCoxMg0.25Mo0.25O3 – δ (а) и La0.3Ca0.7Fe0.6 ‒ xCoxMg0.175Mo0.225O3 – δ (б).

На рис. 9а представлена температурная зависимость электропроводности образцов La0.3Ca0.7Fe0.5 – xCoxMg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.6 –xCoxMg0.175Mo0.225O3 – δ (x = 0.05 и 0.1) на воздухе. Следует отметить, что величина электропроводности при 1173 К образцов Fe0.45Co0.05 (0.5 См/см) и Fe0.4Co0.1 (1.0 См/см) оказывается сравнима с таковой для недопированного состава (0.5 См/см), тогда как образцы Fe0.55Co0.05 (1.0 См/см) и Fe0.5Co0.1 (1.0 См/см) демонстрируют меньшую электропроводность, чем LCF6 (4.6 См/см). В восстановительной атмосфере (рис. 9б) наблюдается увеличение электропроводности в несколько раз. Наибольшего значения при 1173 К электропроводность достигает для образца Fe0.55Co0.05 (8.8 См/см). Таким образом, частичное замещение железа на кобальт в перовскитах LCF5 и LCF6 не приводит к увеличению их электропроводности ни на воздухе, ни в восстановительной атмосфере.
Рис. 9.
Температурная зависимость электропроводности кобальтсодержащих образцов на воздухе (а) и в Ar/H2 (8%) (б).

На рис. 10 и 11 представлены типичные импедансные спектры симметричных ячеек электрод/GDC/электрод, где в качестве электродов использованы перовскиты La0.3Ca0.7Fe0.5 – xCoxMg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.6 –xCoxMg0.175Mo0.225O3 – δ (x = 0.05 и 0.1) при 1013, 1053 и 1133 K на воздухе.
Рис. 10.
Спектры электронного импеданса La0.3Ca0.7Fe0.5 –xCoxMg0.25Mo0.25O3 – δ, x = 0.05 (а) и 0.1 (б) на воздухе при температурах 1013, 1053 и 1133 K.

Рис. 11.
Спектры электронного импеданса La0.3Ca0.7Fe0.6 –xCoxMg0.25Mo0.25O3 – δ, x = 0.05 (а) и 0.1 (б) на воздухе при температурах 1013, 1053 и 1133 K.

Для описания спектров была также использована ЭЭС, представленная на рис. 6. Величины поляризационного сопротивления, рассчитанные исходя из ЭЭС, как сумма сопротивлений R2 и R3 с учетом нормирования на площадь электрода при 1173 К для образцов Fe0.45Co0.05, Fe0.5Co0.1, Fe0.55Co0.05 и Fe0.5Co0.1 составили 1.2, 2.7, 1.2 и 3.2 Ом см2 соответственно. Из полученных результатов следует, что частичное замещение железа на кобальт способствует снижению величины Rη границы электродный материал/GDC в несколько раз (для LCF5 и LCF6 Rη при 1173 K составляют 2.7 и 3.6 Ом см2, соответственно). Однако этот эффект проявляется только в случае составов с небольшим (x = 0.05) замещением железа на кобальт, тогда как величины Rη для x = 0.1 близки к таковым для незамещенных перовскитов. Температурные зависимости Rη для изученных составов представлены на рис. 12. Следует отметить, что при увеличении степени замещения Fe на Co (х) происходит снижение энергии активации Ea 1.45 эВ (х = 0.0) до 1.23 эВ (х = 0.05) и 1.09 эВ (x = 0.1) для La0.3Ca0.7Fe0.5 –xCoxMg0.25Mo0.25O3 – δ и 1.62 эВ (x = 0.0) до 1.26 эВ (х = 0.05) и 1.15 эВ (х = 0.1) для La0.3Ca0.7Fe0.6 –xCoxMg0.175Mo0.225O3 – δ. Дальнейшее улучшение электрохимической активности исследуемых материалов в реакции восстановления кислорода может быть связано с использованием технологических подходов, направленных на оптимизацию микроструктуры границы электрод/электролит.
ЗАКЛЮЧЕНИЕ
Исследование высокотемпературной электропроводности перовскитов LCF5 и LCF6 при варьируемом парциальном давлении кислорода показало существенный рост электропроводности от 4.6 до 25 См/см для LCF6, а для LCF5 от 0.5 до 10 См/см при 1173 K при переходе от воздушной атмосферы к восстановительной атмосфере Ar/H2 (8%), связанное, вероятно, со сменой типа проводимости с p- на n- при частичном восстановлении катионов Mo6+ до Mo5+ и/или Fe3+ до Fe2+. При этом величины электропроводности сохраняются при циклической смене атмосферы от воздушной к восстановительной и обратно, что является ценным свойством для электродного материала СТОТЭ. Величины поляризационного сопротивления границы электродный материал/GDC при 1173 K на воздухе для электродных материалов LCF5 и LCF6 составляют 2.66 и 3.56 Ом см2 соответственно. Частичное замещение Fe на Co в LCF5 и LCF6 позволяет снизить их более чем в два раза до ∼1.2 Ом см2 при 1173 К для составов с небольшим содержанием кобальта La0.3Ca0.7Fe0.45Co0.05Mg0.25Mo0.25O3 – δ и La0.3Ca0.7Fe0.55Co0.05Mg0.175Mo0.225O3 – δ. Эти составы демонстрируют низкие КТР на воздухе (12.6 ppm K–1), сравнимые с КТР электролита GDC, а также приемлемые величины высокотемпературной электропроводности. Таким образом, данные составы можно рекомендовать для использования в качестве электродных материалов СТОТЭ.
Список литературы
Bastidas, D.M., Tao, S., and Irvine, J.T.S., A symmetrical solid oxide fuel cell demonstrating redox stable perovskite electrodes, J. Mater. Chem., 2006, vol. 16, p. 1603.
Ruiz-Morales, C., Marrero-López, D., Canales-Vázquez, J., and Irvine, J.T.S., Symmetric and reversible solid oxide fuel cell, RSC Adv., 2011, vol. 1, p. 1403.
Su, C., Wang, W., Liu, M., Tadé, M.O., and Shao, Z., Progress and Prospects in Symmetrical Solid Oxide Fuel Cells with Two Identical Electrodes, Adv. Energy Mater., 2015, vol. 5, p. 1.
Ruiz-Morales, J.C., Canales-Vázquez, J., Peña-Martínez, J., Marrero-López, D., and Núñez, P., On the simultaneous use of La0.75Sr0.25Cr0.5Mn0.5O3 – δ as both anode and cathode material with improved microstructure in solid oxide fuel cells, Electrochim. Acta, 2006, vol. 52, p. 278.
Zheng, Y., Zhang, C., Ran, R., Cai, R., Sao, Z., and Farrusseng, D., A new symmetric solid-oxide fuel cell with La0.8Sr0.2Sc0.2Mn0.8O3 – δ perovskite oxide as both the anode and cathode, Acta Mater., 2009, vol. 57, p. 1165.
Canales-Vázquez, J., Ruiz-Morales, J.C., Marrero-López, D., Peña-Martinez, J., Núñez, P., and Gomez-Romero, P., Fe-substituted (La,Sr)TiO3 as potential electrodes for symmetrical fuel cells (SFCs), J. Power Sources, 2007, vol. 171, p. 552.
Fagg, D.P., Kharton, V.V., Frade, J.R., and Ferreira, A.A.L. Stability and mixed ionic–electronic conductivity of (Sr,La)(Ti,Fe)O3 – δ perovskites, Solid State Ionics, 2003, vol. 156, p. 45.
Park, C.Y. and Jacobson, A.J., Electrical Conductivity and Oxygen Nonstoichiometry of La0.2Sr0.8Fe0.55Ti0.45O3 – δ, J. Electrochem. Soc., 2005, vol. 152, p. 65.
Liu, Q., Dong, X., Xiao, G., Zhao, F., and Chen, F., Enhancement in surface exchange coefficient and electrochemical performance of Sr2Fe1.5Mo0.5O6 electrodes by Ce0.8Sm0.2O1.9 nanoparticles, Adv. Mater., 2010, vol. 22, p. 5478.
Zhang, L., Liu, Y., Zhang, Y., Xiao, G., Chen, F., and Xia, C., A Novel Electrode Material for Symmetrical SOFCs, Electrochem. Commun., 2011, vol. 13, p. 711.
Goodenough, J.B., Metallic Oxides in Progress in Solid State Chemistry, Eds, Reiss, H., Oxford: Pergamon Press, 1971, vol. 5, p. 145.
Istomin, S.Ya., Morozov, A.V., Abdullayev, M.M., Batuk, M., Hadermann, J., Kazakov, S.M., Sobolev, A.V., Presniakov, I.A., and Antipov, E.V., High-temperature properties of (La,Ca)(Fe,Mg,Mo)O3 – δ perovskites as prospective electrode materials for symmetrical SOFC, J. Solid State Chem., 2018, vol. 258, p. 1.
Merkulov, O.V., Markov, A.A., Patrakeev, M.V., Leonidov, I.A., Shalaeva, E.V., Tyutyunnik, A.P., and Kozhevnikov, V.L., Structural features and high-temperature transport in SrFe0.7Mo0.3O3 – δ, J. Solid State Chem., 2018, vol. 258, p. 447.
Fagg, D.P., Waerenborgh, J.C., Kharton, V.V., and Frade, J.R., Redox behavior and transport properties of La0.5 –xSr0.5 –xFe0.4Ti0.6O3 – δ (0 < x < 0.1) validated by Mössbauer spectroscopy, Solid State Ionics, 2002, vol. 146, p. 87.
Hong, D.J.L. and Smyth, D.M., Defect chemistry of La2 –xSrxCuO4 –x/2 (0 < x ≤ 1), J. Solid State Chem., 1993, vol. 102, p. 250.
Hong, D.J.L. and Smyth, D.M., Defect chemistry of undoped La2CuO4, J. Solid State Chem., 1992, vol. 97, p. 427.
Merkulov, O.V., Naumovich, E.N., Patrakeev, M.V., Markov, A.A., Bouwmeester, H.J.M., Leonidov, I.A., and Kozhevnikov, V.L., Oxygen nonstoichiometry and defect chemistry of perovskite-structured SrFe1 ‒ xMoxO3 – δ solid solutions, Solid State Ionics, 2016, vol. 292, p. 116.
Patrakeev, M.V., Leonidov, I.A., Kozhevnikov, V.L., and Kharton, V.V., Ion–electron transport in strontium ferrites: relationships with structural features and stability, Solid State Sci., 2004, vol. 6, p. 907.
Barsoukov, E. and Macdonald, J.R., Impedance spectroscopy: theory, experiment, and applications, New Jersey: John Wiley & Sons, 2005. 595 p.
Co, A.C., Xia, S.J., and Birss, V.I., A Kinetic Study of the Oxygen Reduction Reaction at LaSrMnO3–YSZ Composite Electrodes, J. Electrochem. Soc., 2005, vol. 152, p. 570.
Rupasov, D.P., Berenov, A.V., Kilner, J.A., Istomin, S.Ya., and Antipov, E.V. Oxygen diffusion in Sr0.75Y0.25CoO2.62, Solid State Ionics, 2011, vol. 197, p. 18.
Истомин, С.Я., Антипов, Е.В. Катодные материалы на основе перовскитоподобных оксидов переходных металлов для среднетемпературных твердооксидных топливных элементов. Успехи химии. 2013. Т. 82. С. 686. [Istomin, S.Ya. and Antipov, E.V., Cathode materials based on perovskite-like transition metal oxides for intermediate temperature solid oxide fuel cells, Russ. Chem. Rev., 2013. vol. 82, p. 686.]
Shannon, R.D., Revised Effective Ionic Radii and Systematic Studies of Interatomic Distances in Halides and Chalcogenides, Acta Crystallogr., Sect. A, 1976, vol. 32, p. 751.
Tietz, F., Thermal expansion of SOFC materials, Ionics, 1999, vol. 5, p. 129.
Uhlenbruck, S. and Tietz, F., High-temperature thermal expansion and conductivity of cobaltites: potentials for adaptation of the thermal expansion to the demands for solid oxide fuel cells, Mater. Sci. Eng., B, 2004, vol. 107, p. 277.
Дополнительные материалы отсутствуют.