Электрохимия, 2020, T. 56, № 3, стр. 204-220
ВЛИЯНИЕ НЕКОТОРЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ЭЛЕКТРОПОЛИРОВАНИЕ УГЛЕРОДИСТОЙ СТАЛИ В КИСЛОТЕ H3PO4 В УСЛОВИЯХ НОРМАЛЬНОЙ И ПРИНУДИТЕЛЬНОЙ КОНВЕКЦИИ
А. А. Таха a, Ф. М. Абузейд a, *, М. М. Кандиль a
a Отделение химии, Факультет науки, Александрийский университет
Александрия, Египет
* E-mail: fatma.abouzeid@yahoo.com
Поступила в редакцию 16.03.2019
После доработки 14.06.2019
Принята к публикации 04.07.2019
Аннотация
Некоторые фармацевтические соединения, а именно валсартан, гидрохлоротиазид, тиоцианат эритромицина и диклофенак калия, были изучены в качестве химических добавок для улучшения конечной поверхности углеродистой стали. Была измерена зависимость тока, ограничивающего потенциал анода, и путем сравнения постепенно увеличивающихся концентраций фармацевтического соединения (от 1 × 10–4 до 7 × 10–4 М) и методом потери массы. Характеристики растворения углеродистой стали в присутствии фармацевтических соединений изучали в условиях естественной конвекции (вращающийся цилиндрический электрод (ВЦЭ)) и принудительной конвекции (вращающийся дисковый электрод (ВДЭ)). Изучали скорость вращения ВЦЭ и ВДЭ. Было обнаружено, что предельный ток уменьшается с увеличением концентрации добавок и увеличивается с ростом температуры (от 293 до 313 К). Значения энергий активации подтверждают, что скорость реакции контролировалась диффузией. Результаты показали, что улучшение, полученное при электрополировании в присутствии фармацевтических соединений, происходит за счет адсорбции их молекул на поверхности металла. Адсорбция соединений подчиняется термодинамической модели. Процент запаздывания, полученный при измерении потери веса, сопоставим с данными, полученными при измерениях гальваностатической поляризации. Данные в различных условиях контролировались безразмерными корреляциями, которые описывают числа Шервуда (Sh), Шмидта (Sc) и Рейнольда (Re). Исследование морфологии поверхности подтвердило, что добавление фармацевтического соединения в ванну для растворения углеродистой стали в значительной степени улучшает внешний вид поверхности и качество ее текстуры.
ВВЕДЕНИЕ
Электрополирование (ЭП) является широко применяемой процедурой при изготовлении, полезной для обработки больших изделий из металлов и сплавов для снятия заусенцев в дополнение к удалению потускнения и осветлению. Электрополирование, которое достигается за счет анодного растворения поверхности металла, контролируется в соответствующем электролите и может улучшить эффективность сглаживания поверхности металла [1, 2], где различия глубины пиков и впадин уменьшаются [3, 4]. Оно классически возникает при предельном токе процесса массообмена, когда поверхность металла становится гладкой и ровной. Одновременно на всем протяжении ЭП может образовываться ряд протравленных углублений и дефектов на поверхности металла вследствие выделения газообразного кислорода с поверхности анода при потенциале, превышающем плато предельного тока [5–7]. Чтобы снизить вероятность поверхностных дефектов, образующихся на углеродистой стали во время ЭП, в полировочную ванну вводили различные добавки [8–12].
Однако пока, насколько нам известно, это первое сообщение об использовании фармацевтических соединений в качестве добавок в процессе ЭП. В последнее время фармацевтические соединения используются в качестве ограничителей коррозии [13]. Использование фармацевтических соединений для предотвращения коррозии металлов имеет некоторые преимущества по сравнению с использованием некоторых органических/неорганических ингибиторов, поскольку они нетоксичны, дешевы и экологически безопасны. Их можно легко производить и очищать. Как правило, многие авторы [14–17] согласны с тем, что лекарственные средства представляют собой ингибиторы, которые могут выгодно конкурировать с благоприятными для окружающей среды ингибиторами, и большинство лекарственных средств можно синтезировать из натуральных продуктов. Следовательно, целью данного исследования является изучение поведения при растворении углеродистой стали в присутствии фармацевтических соединений. Исследуемые соединения представляют интерес, поскольку хорошо растворимы в воде, безопасны, их молекулы имеют большой размер и содержат электроотрицательные атомы N, S и О, их легко можно синтезировать из относительно дешевого сырья, причем они являются биоразлагаемыми и могут соответствовать некоторым из экологических ограничений.
ПРОЦЕДУРЫ И МЕТОДЫ
Оборудование
Углеродистая сталь имела следующий химический состав, выраженный в массовых процентах: C 0.2, Mn 2.6, Si 0.33, S 0.04, P 0.039, остаток Fe. H3PO4 (85 мас. %) получали от компании BDH. Выбранные фармацевтические соединения, чистота которых превышала 97%, получали от компании Fluka и использовали без очистки. При приготовлении растворов использовали деионизированную (дважды дистиллированную) воду с измеренным удельным сопротивлением, превышающим 18 МОм см. Концентрации фармацевтических соединений находились в диапазоне от 1 × 10–4 до 7 × 10–4 М.
Четыре изученных соединения имеют следующие структуры
Гальваностатическая поляризация
Естественная конвекция. Используемая ячейка представляла собой прямоугольный контейнер из плексигласа, имеющий основание 15 × 5 и высоту 10 см, с листами из углеродистой стали (высота 10 см и ширина 5 см) в качестве электродов. Расстояние между электродами составляло 15 см. Конструкцию электрической цепи составляли источник питания (6 В постоянного тока), многодиапазонный амперметр, высокоимпедансный вольтамперметр и переменное сопротивление, которые были последовательно соединены через ячейку. Регулирование температуры (20, 30, 40 и 50°C) ± 0.5°C обеспечивала термостатическая водяная баня, в которой находилась ячейка.
Принудительная конвекция. В качестве ячейки использовали цилиндрический плексигласовый контейнер высотой 20 см и диаметром 15 см. В качестве анода присутствовал вращающийся стальной стержень диаметром 2 см, изолированный эпоксидной смолой (рабочая площадь диска (нижняя часть металлического цилиндра, подвергаемая воздействию электролита) составляла 3.14 см2) и стальной стержень диаметром 2 см и рабочей высотой 2 см (рабочая площадь цилиндра составляла 12.56 см2), соединен с валом переменной скорости с помощью пластиковой муфты. Металлический цилиндрический катод имел диаметр 5 см. Обратная сторона катода была покрыта эпоксидной смолой. Скорость вращения двигателя в диапазоне от 125 до 750 об./мин регулировали, используя оптический тахометр.
Метод потери массы
Углеродистую листовую сталь (3 × 3 × 0.1 см) обрабатывали наждачной бумагой, затем промывали бидистиллированной водой и ацетоном. Образцы взвешивали, затем погружали в 100 мл 8 М H3PO4 в лабораторном стакане объемом 250 мл с добавлением и без добавления фармацевтических соединений в различных концентрациях. Через полчаса образцы извлекали, промывали, сушили и точно взвешивали. Так может быть получена регулярная разность массы образцов.
Если ∆Wхолост представляет собой потерю массы при отсутствии фармацевтических соединений, ∆Wфарм. соед представляет собой потерю массы в присутствии фармацевтических соединений, то значение IE% может быть вычислено из следующего уравнения:
(1)
$\% \,IE = \left[ {1 - \left( {{{\Delta {{W}_{{{\text{фарм}}{\text{.}}\,{\text{соед}}}}}} \mathord{\left/ {\vphantom {{\Delta {{W}_{{{\text{фарм}}{\text{.}}\,{\text{соед}}}}}} {\Delta {{W}_{{{\text{холост}}}}}}}} \right. \kern-0em} {\Delta {{W}_{{{\text{холост}}}}}}}} \right)} \right] \times 100.$Характеристика поверхности с помощью сканирующей электронной микроскопии (СЭМ)
Изображения методом сканирующей электронной микроскопии получали, используя сканирующий микроскоп JEOL JSM-5300 от компании Oxford Instruments. Размеры образца составляли 1 см × 1 см.
Физические свойства растворов для расчета безразмерных чисел Шервуда (Sh), Шмидта (Sc) и Рейнольдса (Re), физические свойства раствора (плотность (ρ) и вязкость (µ)) определяли экспериментально с использованием стандартных методов. Коэффициент диффузии Fe3+ при различных концентрациях H3PO4 определяли путем измерения предельного тока анодного растворения вращающегося диска из углеродистой стали в H3PO4 с применением уравнения Левича [18].
(2)
${{i}_{{\text{L}}}} = 0.62zF{{D}^{{0.667}}}{{\nu }^{{--0.167}}}{{c}_{{{\text{F}}{{{\text{e}}}^{{3 + }}}}}}{{{\omega }}^{{0.5}}},$(3)
${{i}_{{\text{L}}}} = 0.079zF{{D}^{{0.644}}}{{d}^{{ - 0.3}}}{{\nu }^{{ - 0.344}}}{{c}_{{{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}}}}{{{\omega }}^{{0.7}}},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Процесс выравнивания (электрополирование в H3PO4)
Типичная поляризационная кривая получена для электролита, состоящего из ортофосфорной кислоты в концентрации от 6 до 14 М (табл. 1). Кривая (рис. 1) разделена на три части: электролитическое травление, полирование и выделение газа (O2) с появлением точечной коррозии. Влияние концентрации H3PO4 на значения IL может быть выяснено на основе уравнения массообмена (4) [18–20].
(4)
${{I}_{{\text{L}}}} = \frac{{zFD}}{\delta }{{c}_{{{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}}}}.$Таблица 1.
Влияние концентрации H3PO4 на анодное растворение углеродистой стали при 20°C
| Концентрация H3PO4, моль/л | IL, А | 103${{c}_{{{\text{F}}{{{\text{e}}}^{{3 + }}}}}},$ моль см–3 | 106D, см2 c–1 | η, г см–1 с–1 |
|---|---|---|---|---|
| 6 | 0.52 | 1.00 | 4.15 | 1.891 |
| 8 | 0.45 | 0.99 | 3.61 | 4.211 |
| 10 | 0.31 | 0.82 | 3.35 | 5.750 |
| 12 | 0.26 | 0.80 | 1.03 | 6.220 |
| 14 | 0.07 | 0.76 | 0.93 | 14.35 |
Рис. 1.
Поляризационная кривая для электрорастворения вертикальной углеродистой стальной пластины при 20°C в присутствии различных концентраций H3PO4.

Растворимость насыщения FePO4 уменьшается с увеличением концентрации H3PO4 (табл. 1), что приводит к снижению IL. Кроме того, увеличение концентрации H3PO4 приводит к увеличению вязкости раствора (η), поэтому диффузионная способность иона Fe3+ (D) будет уменьшаться, а толщина диффузионного слоя (δ) будет увеличиваться, что приведет к уменьшению значений IL. Ограничивающие характеристики тока ЭП углеродистой стали в H3PO4 (рис. 1) обусловлены уверенностью, что растворение металла контролируется массопереносом [8, 9], в ходе процесса диффузия продуктов реакции ограничена и рассматривается как лимитирующая стадия общей скорости реакции. Механизм осажденной соляной пленки включает ограничение скорости диффузии растворяющихся катионов металлов с поверхности анода в объем раствора [18, 19]. При значении IL концентрация насыщения тонкой соляной пленки металлического катиона присутствует на поверхности анода и определяет скорость, с которой ионы металла покидают поверхность анода.
Электрополирование углеродистой стали в электролите H3PO4 в присутствии фармацевтических соединений
Кривые гальваностатической поляризации переменных концентраций фармацевтических соединений в зависимости от поведения углеродистой стали в растворе 8 M H3PO4 представлены на рис. 2. Предельный ток (IL) получали из графика. Скорость растворения металла (IL) и процент эффективности ингибирования (IE%) для исследуемого фармацевтического соединения с диапазоном концентраций (от 1 × 10–4 до 7 × 10–4 М) и температурами в диапазоне от 20 до 50°C приведены в табл. 2.
Рис. 2.
Электрополировка поляризационных кривых для вертикальных углеродистых стальных пластин в растворе 8 M H3PO4, содержащем различные концентрации валсартана при 20°C.
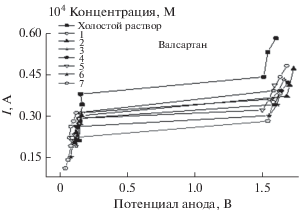
Таблица 2.
Предельные значения тока для растворения углеродистой стали в чистом растворе 8 М H3PO4 и в растворах 8 М H3PO4, содержащих фармацевтические соединения, при различных температурах
| Концентрация, 104 М | Фармацевтические соединения | 20°C | IE% | 30°C | IE% | 40°C | IE% | 50°C | IE% |
|---|---|---|---|---|---|---|---|---|---|
| 0.0 | Валсартан | 0.45 | 0.52 | 0.58 | 0.6 | 6.25 | |||
| 1.0 | 0.33 | 26.67 | 0.42 | 19.23 | 0.5 | 13.79 | 0.54 | 15.63 | |
| 2.0 | 0.3 | 33.33 | 0.4 | 23.08 | 0.46 | 20.69 | 0.52 | 18.75 | |
| 3.0 | 0.27 | 40.00 | 0.36 | 30.77 | 0.42 | 27.59 | 0.49 | 23.44 | |
| 4.0 | 0.25 | 44.44 | 0.31 | 40.38 | 0.35 | 39.66 | 0.45 | 29.69 | |
| 5.0 | 0.21 | 53.33 | 0.25 | 51.92 | 0.32 | 44.83 | 0.53 | 17.19 | |
| 6.0 | 0.25 | 44.4 | 0.31 | 40.38 | 0.41 | 29.31 | 0.57 | 10.94 | |
| 7.0 | 0.31 | 31.11 | 0.36 | 30.77 | 0.47 | 18.96 | 0.6 | 6.25 | |
| 0.0 | Гидрохлоротиазид | 0.45 | 0.52 | 0.58 | 0.64 | ||||
| 1.0 | 0.36 | 20.00 | 0.44 | 15.38 | 0.5 | 13.79 | 0.58 | 9.38 | |
| 2.0 | 0.34 | 24.44 | 0.41 | 21.15 | 0.48 | 17.24 | 0.55 | 14.06 | |
| 3.0 | 0.32 | 28.89 | 0.38 | 26.92 | 0.46 | 20.69 | 0.53 | 17.19 | |
| 4.0 | 0.29 | 35.56 | 0.35 | 32.69 | 0.43 | 25.86 | 0.5 | 21.88 | |
| 5.0 | 0.25 | 44.44 | 0.31 | 40.38 | 0.4 | 31.03 | 0.47 | 26.56 | |
| 6.0 | 0.31 | 31.11 | 0.39 | 25.00 | 0.47 | 18.97 | 0.55 | 14.06 | |
| 7.0 | 0.36 | 20.00 | 0.43 | 17.31 | 0.51 | 12.07 | 0.58 | 9.38 | |
| 0.0 | Тиоцианат эритромицина | 0.45 | 0.52 | 0.58 | 0.64 | ||||
| 1.0 | 0.39 | 13.33 | 0.46 | 11.54 | 0.53 | 8.62 | 0.6 | 6.25 | |
| 2.0 | 0.36 | 20.00 | 0.43 | 17.31 | 0.5 | 13.79 | 0.57 | 10.94 | |
| 3.0 | 0.33 | 26.67 | 0.4 | 23.08 | 0.47 | 18.97 | 0.55 | 14.06 | |
| 4.0 | 0.31 | 31.11 | 0.37 | 28.85 | 0.44 | 24.14 | 0.53 | 17.19 | |
| 5.0 | 0.28 | 37.78 | 0.34 | 34.62 | 0.41 | 29.31 | 0.5 | 21.88 | |
| 6.0 | 0.35 | 22.22 | 0.42 | 19.23 | 0.49 | 15.52 | 0.56 | 12.50 | |
| 7.0 | 0.40 | 11.11 | 0.48 | 7.69 | 0.55 | 5.17 | 0.61 | 4.69 | |
| 0.0 | Диклофенак калия | 0.45 | 0.52 | 0.58 | 0.64 | ||||
| 1.0 | 0.4 | 11.11 | 0.47 | 9.62 | 0.53 | 8.62 | 0.59 | 7.81 | |
| 2.0 | 0.37 | 17.78 | 0.44 | 15.38 | 0.51 | 12.07 | 0.57 | 10.94 | |
| 3.0 | 0.34 | 24.44 | 0.41 | 21.15 | 0.49 | 15.52 | 0.55 | 14.06 | |
| 4.0 | 0.32 | 28.89 | 0.39 | 25.00 | 0.45 | 22.41 | 0.51 | 20.31 | |
| 5.0 | 0.29 | 35.56 | 0.36 | 30.77 | 0.41 | 29.31 | 0.48 | 25.00 | |
| 6.0 | 0.34 | 24.44 | 0.41 | 21.15 | 0.47 | 18.97 | 0.55 | 14.06 | |
| 7.0 | 0.39 | 13.33 | 0.46 | 11.54 | 0.52 | 10.34 | 0.58 | 9.38 |
В присутствии валсартана (в различных концентрациях) в качестве примера фармацевтических соединений кривая (рис. 2) показывает характерное плато IL, расширяющееся выше широкого диапазона потенциала, что свидетельствует о том, что процесс массопереноса контролируется в присутствии фармацевтических соединений.
Если предельный ток в отсутствие фармацевтических соединений составляет (IL)холост, а в присутствии фармацевтических соединений составляет (IL)фарм. соед, то IE% можно оценить из последующего уравнения
(5)
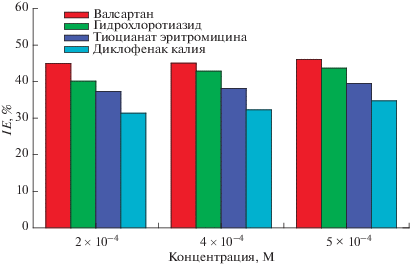
$IE\% = \left[ {{{{{{\left( {{{I}_{{\text{L}}}}} \right)}}_{{{\text{холост}}}}} - {{{\left( {{{I}_{{\text{L}}}}} \right)}}_{{{\text{фарм}}{\text{.}}\,{\text{соед}}}}}} \mathord{\left/ {\vphantom {{{{{\left( {{{I}_{{\text{L}}}}} \right)}}_{{{\text{холост}}}}} - {{{\left( {{{I}_{{\text{L}}}}} \right)}}_{{{\text{фарм}}{\text{.}}\,{\text{соед}}}}}} {{{{\left( {{{I}_{{\text{L}}}}} \right)}}_{{{\text{холост}}}}}}}} \right. \kern-0em} {{{{\left( {{{I}_{{\text{L}}}}} \right)}}_{{{\text{холост}}}}}}}} \right] \times 100.$Рисунок 3 демонстрирует соотношение между процентной эффективностью ингибирования (IE%) и концентрацией фармацевтических соединений.
Рис. 3.
График процентной эффективности ингибирования (IE%) для углеродистой стали в 8 M растворе H3PO4, содержащем несколько концентраций четырех исследованных фармацевтических соединений, при нескольких температурах.

Кроме того, как показано в табл. 2, добавление валсартана, гидрохлоротиазида, тиоцианата эритромицина и диклофенака калия приводит к снижению IL процесса растворения углеродистой стали и увеличению значения IE% до 1 × 10–5 М, тогда как при 6 × 10–4 и 7 × 10–4 скорость растворения углеродистой стали (IL) увеличивается, вызывая последующее снижение IE%. Таблица 2 и рисунок 3 показывают, что IE% увеличивается с увеличением концентрации исследуемых фармацевтических соединений и снижением температуры. Кроме того, IE%, вызванная фармацевтическими соединениями, составляла от 53.33 до 4.69 в зависимости от их концентрации и типа. IE% является функцией нескольких аспектов, включая заряженный металл и заряженные молекулы ингибитора электростатического притяжения; наличие дополнительного гетероциклического кольца; несколько активных адсорбционных центров; ингибитор молекулярного размера или сочетание всех предыдущих факторов.
Среди изученных фармацевтических соединений валсартан и гидрохлоротиазид проявляют наибольшее замедляющее действие по сравнению с другими. Возможно, это связано с тем, что в валсартане присутствует несколько атомов азота и ароматических колец, поэтому адсорбция молекул на поверхности металла будет увеличиваться. Валсартан может адсорбироваться на поверхности углеродистой стали в виде отдельных молекул или через конфигурацию покрытия полимерного характера с “бидентатной структурой”, где частицы валсартана упорядочены в горизонтальных перекрещивающихся последовательностях и присоединены через связь N–Fe3+–N. Это согласуется с ингибированием бензотриазола для углеродистой стали в кислоте H2SO4 [17], поскольку он содержит гетероциклическое триазольное кольцо, тогда как валсартан содержит тетразольное кольцо. С другой стороны, что касается ориентации валсартана, вероятно, что валсартан не отклонялся горизонтально через поверхность, кроме неподеленной пары связи атома азота и атома металла на поверхности.
Гидрохлоротиазид содержит атомы N (которые имеют неподеленную пару электронов) (2 атома N азинового шестичленного кольца в дополнение к группе NH2) и π-электроны в бензоле. Эти характеристики будут влиять на адсорбционную способность соединения на границе раздела металл/раствор кислоты одним или несколькими из следующих путей: взаимодействие между свободными парами электронов на гетероатомах азота и незанятой d-орбитали на поверхности углеродистой стали, донорно-акцепторное взаимодействие π-электронов ароматического кольца и незанятой d-орбитали на поверхности углеродистой стали. При этом тиоцианат эритромицина имеет множество центров адсорбции, включая (S, N, O), так как присутствие высокодонорных групп –OH обеспечивает пять центров адсорбции в молекуле. Также благодаря электронодонорному эффекту двух метильных групп, связанных с N (в тиоцианате эритромицина), электронная плотность в этом центре адсорбции будет высокой. В случае тиоцианата эритромицина атом серы может усилить взаимодействие молекул с поверхностью металла. Еще одна возможность состоит в том, что, поскольку валсартан представляет собой очень большую молекулу, их сфера действия будет больше.
Диклофенак калия предлагает N и π-электроны в бензольных кольцах в качестве возможных центров адсорбции. Введение электронно-притягивающих групп, таких как хлор, в орто-положения бензольного кольца направлено на уменьшение электронной плотности фенильной группы молекулы. Снижение электронной плотности еще более усложняет перенос электрона между центром адсорбции и металлом, что в свою очередь ослабляет связывание диклофенака с поверхностью углеродистой стали. Это приводит к наименьшей ингибирующей эффективности диклофенака калия. При концентрации 6 × 10–4 четыре исследованных соединения ускоряют скорость растворения. Наблюдаемое в результате явление представляет собой значительное растворение металла, что приводит к десорбции пленки ингибитора с поверхности металла. Таким образом, скорость адсорбции ингибитора ниже, чем скорость десорбции [21–23]. Из табл. 2 видно, что значения IE%, обусловленные фармацевтическими соединениями, расположены в следующем порядке:
Валсартан > гидрохлоротиазид > тиоцианат эритромицина > диклофенак калия.
Влияние температуры на процесс растворения и параметры активации
Температура является важным фактором при исследовании растворения металла. Для расчета энергий активации реакции растворения металла были проведены измерения поляризации при различных температурах (20–50°С) с несколькими концентрациями фармацевтических соединений и без них. Увеличение температуры приводит к увеличению скорости растворения (IL) в чистом растворе 8 M H3PO4 и в содержащем фармацевтические соединения растворе 8 H3PO4 [21, 24].
IE% уменьшается с ростом температуры (табл. 2 и рис. 3). Снижение эффективности ингибирования (IE%) подтвердило физическую адсорбцию фармацевтических соединений на поверхности металла [24].
Параметры активации рассчитывали с использованием уравнений Аррениуса и переходного состояния.
(6)
$\ln {{I}_{{\text{L}}}} = - \left( {{{{{E}^{\# }}} \mathord{\left/ {\vphantom {{{{E}^{\# }}} {RT}}} \right. \kern-0em} {RT}}} \right) + \ln A,$(7)
${{I}_{{\text{L}}}} = \left( {{{RT} \mathord{\left/ {\vphantom {{RT} {Nh}}} \right. \kern-0em} {Nh}}} \right)\exp \left( {{{\Delta {{S}^{\# }}} \mathord{\left/ {\vphantom {{\Delta {{S}^{\# }}} R}} \right. \kern-0em} R}} \right)\exp \left( {{{ - \Delta {{H}^{\# }}} \mathord{\left/ {\vphantom {{ - \Delta {{H}^{\# }}} {RT}}} \right. \kern-0em} {RT}}} \right).$Рисунок 4a иллюстрирует температурную зависимость ln(IL/T) в аррениусовских координатах для углеродистой стали в чистом растворе 8 М H3PO4 и в растворах 8 М H3PO4, содержащих различные концентрации валсартана, в качестве примера на рисунке 4б приведена зависимость ln IL(A) от l/T.
Рис. 4.
Графк уравнения 6 (а), график уравнения 7 (б) для процесса растворения углеродистой стали в 8 М растворе H3PO4, содержащем различные концентрации валсартана.
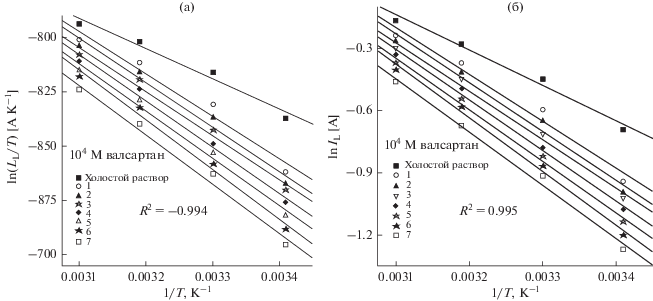
Таблица 3 показывает, что значение E# ниже в чистом растворе, чем в растворе, содержащем фармацевтические соединения. Более высокие значения E# являются хорошим доказательством физической адсорбции фармацевтических соединений на поверхности углеродистой стали. Превосходные значения E# в растворе, содержащем фармацевтические соединения, могут быть связаны с увеличением толщины адсорбированного слоя, что улучшает E# процесса растворения углеродистой стали [25–27]. На рис. 4б показаны графики зависимости ln IL (A) от l/T, полученные для растворения углеродистой стали в чистом растворе 8 М H3PO4 и в растворе 8 М H3PO4, содержащем валсартан (несколько концентраций) в качестве примера. Построив график зависимости ln(IL/T) от l/T, непосредственно получают график с наклоном –∆H#/R и точкой пересечения оси ln(R/Nh) + ∆S#/R. Наблюдаются более низкие значения ΔH# в отсутствие, чем в присутствии валсартана, эритромицина, гидрохлоротиазида, тиоцианата и диклофенака калия. Это указывает на то, что добавление в ванну для растворения фармацевтического соединения увеличивает высоту энергетического барьера для процесса растворения [25]. Большие отрицательные значения ΔS# как в чистом растворе 8 М H3PO4, так и в растворе 8 М H3PO4, содержащем фармацевтические соединения, показывают, что переход реагентов в состояние активированного комплекса, который образуется на лимитирующей стадии, сопровождается увеличением упорядоченности [26].
Таблица 3.
Значения параметров активации для растворения углеродистой стали в чистом растворе 8 М H3PO4 и в растворах 8 М H3PO4, содержащих фармацевтические соединения
| Концентрация, 104 М | Фармацевтические соединения | E#, кДж моль–1 | A | ∆H#, кДж моль–1 | –∆S#, Дж моль–1 K–1 | ∆G#, кДж моль–1 |
|---|---|---|---|---|---|---|
| 0.0 | Валсартан | 9.33 | 20.84 | 6.74 | 228.36 | 73.65 |
| 1 | 15.73 | 211.45 | 13.14 | 209.09 | 74.40 | |
| 2 | 15.25 | 161.394 | 12.66 | 211.34 | 74.58 | |
| 3 | 16.94 | 286.83 | 14.35 | 206.55 | 74.87 | |
| 4 | 16.93 | 252.62 | 14.34 | 207.56 | 75.15 | |
| 5 | 20.08 | 754.850 | 17.48 | 198.51 | 75.65 | |
| 6 | 20.19 | 965.262 | 17.60 | 196.47 | 75.16 | |
| 7 | 16.70 | 284.177 | 14.10 | 206.63 | 74.65 | |
| 0.0 | Гидрохлоротиазид | 9.33 | 20.84 | 6.74 | 228.36 | 73.65 |
| 1 | 12.46 | 60.325 | 9.86 | 219.52 | 74.18 | |
| 2 | 12.80 | 65.35 | 10.21 | 218.85 | 74.33 | |
| 3 | 13.63 | 85.455 | 11.04 | 216.61 | 74.51 | |
| 4 | 14.72 | 121.097 | 12.12 | 213.72 | 74.74 | |
| 5 | 17.20 | 288.87 | 14.61 | 206.49 | 75.11 | |
| 6 | 15.26 | 163.93 | 12.67 | 211.21 | 74.55 | |
| 7 | 12.82 | 69.34 | 10.22 | 218.36 | 74.20 | |
| 0.0 | Тиоцианат эритромицина | 9.33 | 20.84 | 6.74 | 228.36 | 73.65 |
| 1 | 11.47 | 43.26 | 8.88 | 222.28 | 74.00 | |
| 2 | 12.23 | 54.71 | 9.64 | 220.33 | 74.20 | |
| 3 | 13.53 | 85.25 | 10.94 | 216.64 | 74.42 | |
| 4 | 14.21 | 104.36 | 11.61 | 214.96 | 74.60 | |
| 5 | 15.36 | 151.56 | 12.77 | 211.86 | 74.84 | |
| 6 | 12.51 | 59.662 | 9.92 | 219.61 | 74.27 | |
| 7 | 11.24 | 40.81 | 8.65 | 222.77 | 73.92 | |
| 0.0 | Диклофенак калия | 9.33 | 20.84 | 6.74 | 228.36 | 73.65 |
| 1 | 10.30 | 27.555 | 7.70 | 226.03 | 73.93 | |
| 2 | 11.57 | 42.91 | 8.97 | 222.35 | 74.12 | |
| 3 | 12.99 | 70.75 | 10.40 | 218.19 | 74.33 | |
| 4 | 12.34 | 51.26 | 9.75 | 220.87 | 74.47 | |
| 5 | 13.12 | 63.97 | 10.53 | 219.03 | 74.71 | |
| 6 | 12.61 | 60.27 | 10.02 | 219.53 | 74.34 | |
| 7 | 10.51 | 29.39 | 7.92 | 225.50 | 73.99 |
Константа Аррениуса A (предэкспоненциальный коэффициент) для содержащего фармацевтические соединения раствора 8 М H3PO4 (табл. 3) больше, чем для чистого раствора 8 М H3PO4. Это указывает на то, что при адсорбции фармацевтических соединений на преимущественно активных адсорбционных центрах (имеющих низкое значение энергии) процесс растворения также происходит в основном на активных центрах с более высокой энергией [20].
Процесс потери массы
Значения потери массы углеродистой стали в чистом растворе 8 М H3PO4 и в растворах 8 М H3PO4, содержащих фармацевтические соединения, при 20°C после выдерживания в течение 30 мин представлены в табл. 4. Процентная эффективность ингибирования (IE%) вычислена с использованием уравнения (1) и представлена в табл. 4. Установлено, что добавление любого из четырех исследованных фармацевтических соединений приводит к снижению потери веса листа углеродистой стали, по сравнению с таким же значением в холостом растворе. Эти результаты показали, что они действуют как ингибиторы анодного растворения углеродистой стали. Ингибирующее действие четырех исследованных фармацевтических соединений может быть основано на адсорбционном поведении их молекул на поверхности из углеродистой стали, образующей барьер между чистым металлом и средой растворения.
Таблица 4.
Данные потери массы углеродистой стали в чистом растворе 8 М H3PO4 и в растворе 8 М H3PO4, содержащем различные концентрации фармацевтических соединений, при 20°C и выдерживании в течение 30 мин
| Фармацевтические соединения | Концентрация, 104 М | W1(средн) | W2(средн) | Потеря массы | IE% | Скорость ЭП, 104 г с см–2 |
|---|---|---|---|---|---|---|
| Отсутствуют | 0.00 | 6.4786 | 6.0965 | 0.3821 | 0.00 | 1.41 |
| Валсартан | 2 | 5.8196 | 5.6093 | 0.2103 | 44.96 | 0.78 |
| 4 | 7.0461 | 6.8362 | 0.2099 | 45.06 | 0.77 | |
| 5 | 7.1692 | 6.9636 | 0.2056 | 46.12 | 0.76 | |
| Гидрохлоротиазид | 2 | 6.7034 | 6.4746 | 0.2288 | 40.12 | 0.85 |
| 4 | 6.8019 | 6.5837 | 0.2182 | 42.89 | 0.81 | |
| 5 | 6.6897 | 6.4746 | 0.2151 | 43.70 | 0.79 | |
| Тиоцианат эритромицина | 2 | 6.6281 | 6.3885 | 0.2396 | 37.29 | 0.89 |
| 4 | 6.4515 | 6.2153 | 0.2362 | 38.16 | 0.87 | |
| 5 | 6.5483 | 6.3171 | 0.2312 | 39.49 | 0.85 | |
| Диклофенак калия | 2 | 6.7915 | 6.5294 | 0.2621 | 31.40 | 0.97 |
| 4 | 6.9382 | 6.6795 | 0.2587 | 32.29 | 0.95 | |
| 5 | 7.0831 | 6.8338 | 0.2493 | 34.75 | 0.92 |
Избыточные атомы азота в гетероциклическом кольце и π-электроны в бензольных кольцах могут усиливать адсорбцию частиц валсартана на поверхности стали. Имея большие молекулы, способные лучше покрывать поверхность, чем молекулы других соединений, он демонстрирует наилучшую эффективность ингибирования. Ингибирующее поведение гидрохлоротиазида могут обуславливать π-электроны бензольного кольца и гетероатомы, такие как N, S. Неподеленная пара электронов двух атомов N азинового шестичленного кольца и NH2 7-сульфонамидной 1,1‑диоксидной группы занимает орбитали Fe, образуя нерастворимый комплекс [28]. Добавление эритромицина в ванну растворения стали приводит к снижению IE%. Такое поведение может быть объяснено теоретически адсорбционным взаимодействием между неподеленными парами электронов атомов O, N и орбиталями поверхности Fe. Наличие электронодонорной группы, такой как (–ОН) и метильной группы (–CH3) в боковой цепи молекул, приводит к увеличению электронной плотности на атомах O, N, но большой размер эритромицина приводит к стерическим затруднениям при его адсорбции на поверхности стали, что приводит к снижению его IE% по сравнению с валсартаном и гидрохлоротиазидом. Низкая ингибирующая эффективность диклофенака калия может быть связана с наличием электронодонорных групп в фенильном кольце.
Для того чтобы оценить ингибирующую эффективность фармацевтических соединений в течение определенного периода времени, были проведены испытания потери массы в кислом растворе 8 М H3PO4 в присутствии и в отсутствие фармацевтических соединений в различных концентрациях в течение 30–240 мин при 20°С, и была построена диаграмма потери веса массы в зависимости от времени выдерживания для изученных соединений, которая представлена на рис. 5.
Рис. 5.
Графики зависимости потери массы от времени для растворения углеродистой стали в чистом растворе 8 М H3PO4 и в растворах 8 М H3PO4, содержащих различные концентрации фармацевтических соединений, при 20°C.

Из рис. 5 видно, что потеря массы увеличивается с увеличением продолжительности исследования. Такое поведение отражает образование слабой защитной пленки на стальной поверхности. График также показывает, что растворение углеродистой стали под действием H3PO4 происходит гетерогенным путем, сочетающим различные или одинаковые скорости, а не простым гомогенным путем [10, 29]. Рисунок 6 показывает, что значение IE% увеличивается при увеличении концентрации, достигая своего максимального значения при 5 × 10–4 М для всех фармацевтических соединений. Повышение концентрации ингибитора, вероятно, приведет к увеличению числа молекул ингибитора на поверхности Fe, образующих защитный слой.
Вычисление скорости электрополирования
Скорость электрополирования вычисляли согласно уравнению:
(8)
$\begin{gathered} {\text{Скорость ЭП}} = \\ {\text{ = }}\,\,{{({{W}_{{{\text{до ЭП}}}}}--{{W}_{{{\text{после ЭП}}}}})} \mathord{\left/ {\vphantom {{({{W}_{{{\text{до ЭП}}}}}--{{W}_{{{\text{после ЭП}}}}})} {\left( {{\text{площадь}}\,\,{\text{время}}} \right)}}} \right. \kern-0em} {\left( {{\text{площадь}}\,\,{\text{время}}} \right)}}, \\ \end{gathered} $Изотермы адсорбции
Механизм взаимодействия между фармацевтическими соединениями и металлической поверхностью можно выяснить с помощью изотерм адсорбции.
Механизм адсорбции фармацевтических соединений на поверхности углеродистой стали был установлен путем подбора значений θ для нескольких изотерм адсорбции Ленгмюра (рис. 7а) и термодинамической модели (рис. 7б) по уравнениям (9) и (10).
Рис. 7.
Изотермы (а) Ленгмюра и (б) кинетико-термодинамической адсорбции для углеродистой стали в растворе 8 М H3PO4, содержащем фармацевтические соединения.

Изотерма Ленгмюра определяется следующим образом:
(9)
${C \mathord{\left/ {\vphantom {C \theta }} \right. \kern-0em} \theta } = {1 \mathord{\left/ {\vphantom {1 {{{K}_{{{\text{адс}}}}}}}} \right. \kern-0em} {{{K}_{{{\text{адс}}}}}}} + C,$Термодинамическая модель адсорбции может быть записана в виде
(10)
$\lg \left( {{\theta \mathord{\left/ {\vphantom {\theta {1 - \theta }}} \right. \kern-0em} {1 - \theta }}} \right) = \lg {\kern 1pt} K{\kern 1pt} ' + y\lg C,$(11)
$K = K{\kern 1pt} '{{{\kern 1pt} }^{{\left( {{1 \mathord{\left/ {\vphantom {1 y}} \right. \kern-0em} y}} \right)}}},$Значения 1/y для всех фармацевтических соединений составляют более чем 1 (табл. 5), т.е. данные фармацевтические молекулы занимают более чем один активный центр. Значения у, составляющие менее чем 1, показывают, что молекула фармацевтического соединения будет занимать несколько активных центров [30], повышенное значение K для валсартана по сравнению с другими фармацевтическими соединениями (гидрохлоротиазид, тиоцианат эритромицина и дихлофенак калия) указывает на более сильную адсорбцию валсартана на поверхности углеродистой стали [16].
Таблица 5.
Параметры линейной аппроксимации фармацевтических соединений при 20°С для углеродистой стали
| Фармацевтические соединения | Термодинамическая изотерма | |||
|---|---|---|---|---|
| y | 1/y | Kадс | –ΔGадс, кДж моль–1 | |
| Валсартан | 0.672 | 1.488 | 1943.9 | 28.23 |
| Гидрохлоротиазид | 0.679 | 1.472 | 1220.58 | 27.09 |
| Тиоцианат эритромицина | 0.835 | 1.197 | 1012.47 | 26.64 |
| Диклофенак калия | 0.901 | 1.109 | 1007.7 | 26.60 |
Стандартная свободная энергия адсорбции $\left( {\Delta G_{{{\text{адс}}}}^{0}} \right)$ может быть выражена следующим образом:
здесь R представляет собой универсальную газовую постоянную, T представляет собой абсолютную температуру, а величина 55.5 – концентрацию молекул воды (М) в растворе на границе раздела металла и раствора.Большое отрицательное значение $\Delta G_{{{\text{адс}}}}^{0}$ (табл. 5) показывает, что адсорбция фармацевтических соединений на поверхности углеродистой стали допускается с термодинамической точки зрения, а также указывает на то, что процесс адсорбции является самопроизвольным, а адсорбированный слой на поверхности углеродистой стали является устойчивым [31].
Величина $\Delta G_{{{\text{адс}}}}^{0}$ для этих фармацевтических соединений показывает, что $ - \Delta G_{{{\text{адс}}}}^{0}$ находится в диапазоне от –20 кДж/моль до –30 кДж/моль, и это означает, что возможна адсорбция при сжатии (физическая и химическая адсорбция) [32].
Морфологическое исследование SEM (естественная конвекция)
На рис. 8a–8к показаны СЭМ-изображения морфологий поверхности углеродистой стали, которая были отполированы в чистом растворе 8 M H3PO4 и в растворе 8 M H3PO4, содержащем фармацевтические соединения. Рисунок 8а показывает, что поверхность образца из необработанной углеродистой стали была сильно повреждена и была шероховатой с большим количеством выступов и углублений. После обработки в 8 М H3PO4 (рис. 8б) поверхность кажется шероховатой, неровной, все еще четко видны выступы и углубления, которые отражают различное растворение ионов Fe3+ в 8 M H3PO4. В присутствии 2 × 10–4 М валсартана (рис. 8в), поверхность кажется шероховатой, неровной и значительно улучшается в присутствии высокой концентрации валсартана (рис. 8г). Наблюдается равномерность, границы гранул полностью устранены. Поверхность хорошо отполирована, что усиливает адсорбционную способность молекул валсартана, в результате чего все глубокие полости заполняются.
Рис. 8.
Полученные сканирующим электронным микроскопом изображения углеродистой стали в чистом растворе 8 М H3PO4 (а), (б) и в растворах 8 М H3PO4, содержащих различные концентрации фармацевтических соединений (в)–(к).

Рисунок 8д представляет СЭМ-изображения углеродистой стали в растворе 8 M H3PO4, содержащем 2 × 10–4 М гидрохлоротиазида. По сравнению с холостым раствором наблюдается незначительное различие, и все еще присутствуют границы гранул. Такое поведение может быть связано со слабой адсорбцией молекул гидрохлоротиазида при этой концентрации.
В присутствии высокой концентрации гидрохлоротиазида (рис. 8е), электрополированная поверхность стали выглядит ровной, гладкой и блестящей по сравнению с низкой концентрацией. Такое поведение может быть связано с увеличением адсорбции гидрохлоротиазида и, следовательно, границы зерен устраняются. Наблюдается постепенное улучшение качества поверхности при переходе от низкого (рис. 8ж) к высокому (рис. 8з) уровню концентрации тиоцианата эритромицина, где эффекты придания блеска и выравнивания заметно улучшились.
Рисунок 8и представляет изображение образца для 2 × 10–4 М диклофенака калия. Наблюдается выравнивание и блеск. По сравнению с холостым раствором отмечено небольшое отличие, причем границы гранул все еще присутствуют на поверхности металла, но однородность поверхности все же оказывается выше, чем при отсутствии диклофенака калия.
При высокой концентрации диклофенака калия (рис. 8к) яркость и регулярность поверхности были более выраженными, чем на изображении (рис. 8и), поскольку границы зерен полностью устранены.
Принудительная конвекция
Эффект перемешивания. На рис. 9a–9г представлены в качестве примера кривые поляризации, полученные для углеродистой стали ВДЭ и ВЦЭ в чистом растворе 8 M H3PO4 и в растворе 8 M H3PO4, содержащем 10–4 М валсартана. При 20°C графики показывают хорошую аппроксимацию и широкий диапазон потенциала для плато предельного тока. Широкий диапазон потенциала для плато предельного тока обуславливает формирование соляной пленки, где концентрация растворенных ионов металла на граница раздела электролита и металла является постоянной и соответствует насыщенной соляной пленке, образованной катионами металлов и анионами электролита. Как пишут Гримм и Ландольт [33], в этих условиях “Скорость растворения контролируется массопереносом и включает диффузию и миграцию ионов металлов через застойный диффузионный слой Нернста, причем толщина диффузионного слоя зависит от скорости вращения”. Из рисунков видно, что при увеличении скорости вращения высота плато (величина предельного тока) усиливается. Согласно приведенному выше, при увеличении скорости вращения толщина величины диффузионного слоя Нернста уменьшается, что приводит к уменьшению длины диффузионного пути для ионов, следовательно, величина предельного тока увеличивается. Благодаря перемешиванию электролита пузырьки выделяющегося газа на аноде покраснеют при перемешивании, прежде чем он может покинуть поверхностные пути, минимальное уменьшение как толщины, так и шероховатости поверхности при различной скорости перемешивания [19]. Последствия перемешивания могут начать усиливать шероховатость поверхности после определенной точки, удаляя слишком много толстой пленки, что предотвращает травление низколежащих участков поверхности.
Рис. 9.
Кривые анодной поляризации, полученные на состоящем из углеродистой стали ВДЭ при различных скоростях вращения (а) в чистом растворе 8 М H3PO4, (б) в растворе 8 М H3PO4, содержащем 10–4 М валсартана, и RCE при различной скорости вращения (в) в чистом растворе 8 М H3PO4, (г) в растворе 8 М H3PO4, содержащем 10–4 М валсартана.

Частицы ограничивающие массоперенос
Анодное растворение углеродистой стали в растворе 8 М H3PO4, содержащем фармацевтические соединения, контролируется переносом частиц Fe3+ от растворяющегося анода и повышением их концентрации вблизи поверхности анода, а локальная концентрация Fe3+ вблизи поверхности электрода увеличивается за счет повышения плотности тока.
На рис. 10а представлен график Левича, т.е. iL как функция от ω0.5. Наблюдается, что значения iL пропорциональны ω0.5 при любой скорости и в отсутствие и в присутствии фармацевтических соединений при концентрациях 1 × 10–4 М и при комнатной температуре, что отражает растворение стального электрода в чистом растворе 8 М H3PO4 и в растворе 8 М H3PO4, содержащем фармацевтические соединения, которое контролируется условиями массопереноса [34].
Рис. 10.
Зависимости плотности предельного тока от угловой скорости (а) ω0.5 и (б) ω0.7 в чистом растворе 8 М H3PO4 и в растворе 8 М H3PO4, содержащем фармацевтические соединения, при 20°C.
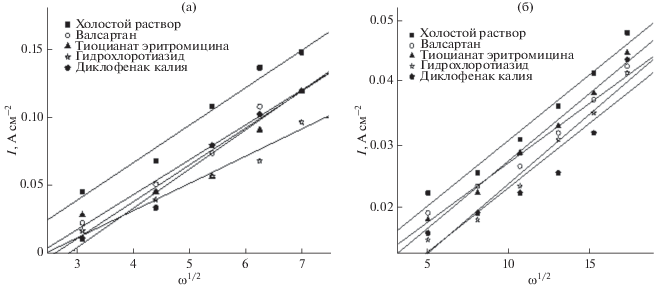
На рис. 10б представлены графики зависимости плотности предельного тока от угловой скорости ω0.7 в чистом растворе 8 М H3PO4 и в растворе 8 М H3PO4, содержащем фармацевтические соединения в различных концентрациях, при 20°С. Наблюдается, что значения iL пропорциональны ω0.7 при всех скоростях вращения в чистом растворе 8 М H3PO4 и в растворе 8 М H3PO4, содержащем фармацевтические соединения в различных концентрациях, которые были исследованы, что свидетельствует о том, что растворение электрода из углеродистой стали контролируется с помощью условий массообмена. Условия массообмена вращающегося цилиндра используют для повышения производительности вращающегося цилиндрического реактора в режиме контролируемой диффузией реакции посредством наложения осевого потока [35].
Характеристика поверхности вращающегося цилиндрового электрода
СЭМ-исследование поверхности для выявления и оценки развития морфологии поверхности (рис. 11a–11е) демонстрирует сравнение образцов ВЦЭ для образца из углеродистой стали при 125 и 500 об/мин. При более низкой скорости вращения вращающегося цилиндра из углеродистой стали (125 об/мин) наблюдалась неровная и шероховатая поверхность, где присутствуют выступы, которые показывают, что выравнивающий эффект уменьшается при уменьшении скорости вращения; когда скорость вращения цилиндра увеличивается до 500 об/мин, выравнивающий эффект улучшался там, где выступы исчезли, поэтому фармацевтические соединения добавляют в ванну для электрополирования при более низких оборотах, чтобы улучшить качество поверхности. На рис. 11в–11е показана поверхность углеродистой стали в присутствии фармацевтических соединений. Качество поверхности значительно улучшилось, а выступы полностью уменьшились. Можно сделать вывод, что фармацевтические соединения оказывают положительное влияние на электрополирование ванны, присутствие фармацевтических соединений увеличивает вязкость изолирующей анодной пленки, которая покрывает поверхность, и увеличивает электрическое сопротивление повышенной скорости ионного движения через диффузионный слой. Анодный слой покрывает незначительные выступы и углубления, избегая растворения, в то время как высокие выступы при повышенной концентрации выступают за пределы анодной пленки, растворяются очень легко, но адсорбция фармацевтических соединений на более высоких выступах приводит к аналогичному и регулярному растворению, и тогда достигается выравнивание и улучшение качества поверхности.
Корреляция данных
Общее отношения массопереноса в зависимости от тока получено с использованием метода безразмерного исследования в виде следующих уравнений:
здесь Sh, Re и Sc – числа Шервуда (Sh = kl/D), Рейнольдса (Re = lU/ν) и Шмидта (Sc = ν/D) соответственно, a и b – эмпирические постоянные, показатель степени Sc составляет 0.33 (показатель Sc, указывающий на принудительную конвекцию). При построении графика зависимости Sh/Sc0.33 от lg Re была получена прямая линия; ее наклон дает постоянную b, и точка пересечения с осью постоянную a. Рисунок 12 иллюстрирует соотношение массопереноса для всех факторов, используемых в электрополировании. Из этого рисунка следует, что данные можно коррелировать с помощью следующих уравнений (табл. 6).Рис. 12.
Общая корреляция массопереноса для процесса растворения в чистом растворе 8 М H3PO4 и в растворах 8 М H3PO4, содержащих фармацевтические соединения, при 20°C изготовленных из углеродистой стали ВЦЭ и ВДЭ.
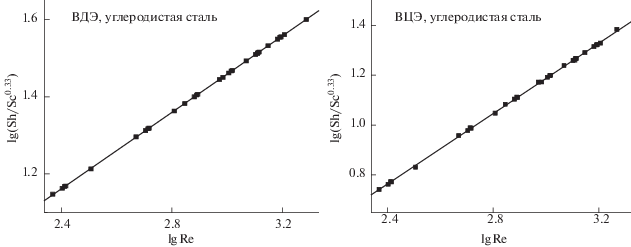
Таблица 6.
Уравнение корреляции данных для диска и цилиндра из углеродистой стали
| Фармацевтические соединения | Цилиндр | Диск |
|---|---|---|
| Отсутствуют | Sh = 0.1137Sc0.33 Re0.70 ± 1.27E–3 | Sh = 0.9156Sc0.33 Re0.50 ± 1.557E–4 |
| Валсартан | Sh = 0.1116Sc0.33 Re0.70 ± 1.38E–3 | Sh = 0.9242Sc0.33 Re0.50 ± 1.635E–4 |
| Тиоцианат эритромицина | Sh = 0.1156Sc0.33 Re0.70 ± 1.13E–3 | Sh = 0.9236Sc0.33 Re 0.50 ± 3.139E–4 |
| Гидрохлоротиазид | Sh = 0.1187Sc0.33 Re0.70 ± 1.68E–3 | Sh = 0.9289Sc0.33 Re0.50 ± 1.575E–4 |
| Диклофенак калия | Sh = 0.1167Sc0.33 Re0.70 ± 0.00251 | Sh = 0.9297Sc0.33 Re0.50 ± 3.948E–4 |
| Общая корреляция массообмена | Sh = 0.1165Sc0.33 Re0.70 ± 3.08E–3 | Sh = 0.9284Sc0.33 Re0.497 ± 5.910E–4 |
Показатель степени в вышеприведенном уравнении указывает на ламинарный поток, который совпадает с предыдущими исследованиями массопереноса в водном растворителе, а также повышенное значение Sh демонстрируют, что диффузионный слой находится внутри ламинарного подслоя [36].
ВЫВОДЫ
• Фармацевтические соединения эффективно замедляют растворение углеродистой стали в 8 М H3PO4.
• С концентрацией фармацевтических соединений эффективность ингибирования увеличивается, но снижается при повышении температуры.
• Реакция растворения ингибировалась посредством адсорбции фармацевтических соединений на поверхности углеродистой стали.
• Адсорбция фармацевтических соединений на поверхности углеродистой стали из 8 М H3PO4 подчиняется термодинамической модели адсорбции.
• СЭМ-изображения подтверждают адсорбцию фармацевтических соединений на поверхности углеродистой стали, что приводит к улучшению текстуры поверхности углеродистой стали.
• Отрицательные значения $\Delta G_{{{\text{адс}}}}^{0}$ показывают сильную и самопроизвольную адсорбцию фармацевтических соединений на поверхности углеродистой стали.
• Кажущаяся энергия Ea активации растворения углеродистой стали увеличивалась при использовании фармацевтических соединений.
• При увеличении скорости вращения электродов ВДЭ и ВЦЭ предельный ток процесса растворения также увеличивается.
• В присутствии четырех исследованных фармацевтических соединений морфология поверхности улучшена для поверхности углеродистой стали ВЦЭ при низкой скорости вращения.
• Безразмерные параметры Sh, Sc и Re были оценены с помощью корреляции данных
Список литературы
Eliaz, N. and Nissan, O., Innovative processes for electropolishing of medical devices made of stainless steels, J. Biomed, Mater. Res., 2007, vol. 83, p.546.
Deyab, M.A., Corrosion inhibition of heat exchanger tubing material (titanium) in MSF desalination plants in acid cleaning solution using aromatic nitro compounds, Desalination, 2018, vol. 439, p. 73.
El-Rabiee, M.M., Helal, N.H., Abd El-Hafez, Gh.M., and Badawy, W.A., Corrosion control of vanadium in aqueous solution by amino acids, J. Alloy. Compd, 2008, vol. 459, p.466.
Khun, N.W., Sumption, M., and Frankel, G.S., Smoothening of Niobium by Electropolishing, J. Appl. Electrochem, 2013, vol. 43, p. 829.
Zhao, X., Corcoran, Se.G., and Kelley, M.J., Sulfuric acid-methanol electrolytes as an alternative to sulfuric-hydrofluoric acid mixtures for electropolishing of niobium, J. Appl. Electrochem., 2011, vol. 41, p. 633.
Dhavale, A.S., Ciovati, G., and Myneni, G.R., Symposium on the Superconducting Science and Technology of Ingot Niobium AIP Conf. Proc., 2011, vol. 1352, p. 119. https://doi.org/10.1063/1.3579230. 2011 American Institute of Physics 978-0-7354-0909
Huo, J., Solanki, R., and Mcandrew, J., Study of anodic layers and their effects on electropolishing of bulk and electroplated films of copper, Appl. Electrochem., 2004, vol. 34, p. 305.
Abdel-Rahman, H.H., Hafez, A.M., and Helmy, A.A., Physicochemical Study on the Effectiveness of Eco-Friendly Anti-Corrosion Agent on the Corrosion of Steel in H3PO4 Solution, Electrochem., 2015, vol. 83, p. 440.
Abdel-Rahman, H.H., Seleim, S.M., Hafez, A.M., and Helmy, A.A., Study of electropolishing inhibition of steel using natural products as a green inhibitor in ortho-phosphoric acid, Green ChemLett Rev., 2015, vol. 8, p. 88.
Abouzeid, F.M., Comparison Between Electropolishing Behavior of Copper and Mild Steel in the Presence of Lactic and Mandolic Acid, Int. J. Electrochem. Sci., 2016, vol. 11, p. 7269.
Abouzeid, F.M., Surface active properties of gelatin and their effect on the electropolishing behavior of steel in orthophosphoric acid, Egyptian J. Petroleum, 2016, vol. 25, p. 229
Abouzeid, F.M., Morphology and Optical Properties of Electropolished Steel in Presence of Vitamin C, Asian J. Chem.,2016, vol.28, p.743.
Fouda, A.S., Al-Sarawy, A.A., Ahmed, F.Sh., and El-Abbasy, H.M., Corrosion inhibition of aluminum 6063 using some pharmaceutical compounds, Corros. Sci., 2009, vol. 51, p.485
Eddy, N.O. and Ebenso, E.E., Adsorption and Quantum Chemical Studies on Cloxacillin and Halides for the Corrosion of Mild Steel in Acidic Medium, Int. J. Electrochem. Sci., 2010, vol. 5, p. 731.
Abdallah, M., Antibacterial Drugs as Corrosion Inhibitors for Corrosion of Aluminum in Hydrochloric Acid Solution, Corros. Sci., 2004, vol. 46, p. 1981.
Morad, M.S., Inhibition of iron corrosion in acid solutions by Cefatrexyl: Behaviour near and at the corrosion potential, Corros. Sci., 2008, vol. 50, p. 436.
Karthik, G., Sundaravadivelu. M., Studies on the inhibition of mild steel corrosion in hydrochloric acid solution by atenolol drug, Egyptian J. Petroleum, 2016, vol. 25, p. 183.
Taha, A.A., Abdel Rahman, H.H., and Abouzeid, F.M., Effect of surfactants on the rate of diffusion controlled anodic dissolution of copper in orthophosphoric Acid, Int. J. Electrochem. Sci., 2013, vol. 8, p. 6751.
Taha, A.A., Abdel Rahman, H.H., Ahmed, A.M., and Abouzeid, F.M., A study of factors influencing on dissolution behavior of copper in orthophosphoric acid using rotating cylinder electrode (RCE) and rotating disc electrode (RDE), Int. J. Electrochem. Sci., 2013, vol. 8, p. 9041
Taha, A.A., Ahmed, A.M., AbdelRahman, H.H., and Abouzeid, F.M., The effect of surfactants on the electropolishing behavior of copper in orthophosphoric acid, Appl. Surf. Sci., 2013, vol. 277, p. 159
Adejoro, I.A., Ojo, F.K., and Obafemi, S.K., Corrosion inhibition potentials of ampicillin for mild steel in hydrochloric acid solution, J. TaibahUnivSci., 2015, vol. 9, p. 196.
Loto, R.T., Loto, C.A., Joseph, O., and Olanrewaju, G., Adsorption and corrosion inhibition properties of thiocarbanilide on the electrochemical behaviour of high carbon steel in dilute acid solutions, Results in Physics, 2016, vol. 6, p. 305.
Abdallaha, M., Zaafaranya, I.A., and AL Jahdaly, B.A., Corrosion Inhibition of Zinc in Hydrochloric Acid using some Antibiotic Drugs, J. Mater. Environ. Sci., 2016, vol. 7, p. 1107.
Bammou, L., Belkhaouda, M., Salghi, R., Benali, O., Zarrouk, A., Zarrok, H., and Hammouti, B., Corrosion inhibition of steel in sulfuric acidic solution by the Chenopodium Ambrosioides Extracts J. A. A. U. B. A.S. 2014, vol. 16, p. 83.
Deyab, M.A. and Taiwan, J., Corrosion inhibition of aluminum in biodiesel by ethanol extracts of Rosemary leaves, Inst. Chem. Eng., 2016, vol. 58, p. 536.
Umoren, S.A., Eduok, U.M., Solomon. M.M., and Udoh, A.P., Corrosion inhibition by leaves and stem extracts of Sida acuta for mild steel in 1M H2SO4 solutions investigated by chemical and spectroscopic techniques, ARAB. J. CHEM., 2016, vol. 9, p. 209.
Deyab, M.A., Egyptian licorice extract as a green corrosion inhibitor for copper in hydrochloric acid solution, Ind. Eng. Chem. Res., 2015, vol. 22, p. 384.
Afolabi, A.S., Muhirwa, A.C., Abdulkareem, A.S., and Muzenda, E., Weight Loss and Microstructural Studies of Stressed Mild Steel in Apple Juice, Int. J. Electrochem. Sci., 2014, vol. 9, p. 5895.
Lahhit, N., Bouyanzer, A., and Desjobert, J., Fennel (Foeniculum Vulgare) Essential Oil as Green Corrosion Inhibitor of Carbon Steel in Hydrochloric Acid Solution, Port. Electrochim. Acta, 2011, vol. 29, p. 127.
Li, L., Qu, Q., Bai, W., Yang, F., Chen. Y., Zhang, S., and Ding, Z., Sodium diethyldithiocarbamate as a corrosion inhibitor of cold rolled steel in 0.5 M hydrochloric acid solution, Corros. Sci., 2012, vol. 59, p. 249.
Javadian, S., Darbasizadeh, B., Yousefi, A., Ektefa, F., Dalir, N., and Kakemam, J., Dye-surfactant aggregates as corrosion inhibitor for mild steel in NaCl medium: Experimental and theoretical studies, J. Taiwan. Inst. Chem. Eng., 2017, vol. 71, p. 344.
Abd El-Lateef, H.M., Soliman, K.A., and Tantawy, A.H., Novel synthesized Schiff base-based cationic gemini surfactants: electrochemical investigation, theoretical modeling and applicability as biodegradable inhibitors for mild, J. Mol. Liq., 2017, vol. 232, p. 478.
Landolt, D., Fundamental aspects of electropolishing, Electrochim. Acta, 1987, vol. 32, p. 1.
Martínez, R.G., Flores, J.M., Romero, R.D., and Llongueras, J.G., Rotating Cylinder Electrode Study on the Influence of Turbulent Flow, on the Anodic and Cathodic Kinetics of X52 Steel Corrosion, in H2S Containing Solutions, Afinidad, 2005, vol. 62, p. 448.
Abdel-Aziz, M.S.M., El-Shazly, A.H., Faraand, H.A., and Sedahmed, G.H., Mass transfer behavior of rotating square cylinder electrochemical reactor in relation to wastewater treatment, Energy Convers. Manage., 2011, vol. 52, p. 2870.
Bilson, M. and Bremhorst, K., Comparison Of Turbulent Scalar Transport in A Pipe and A Rotating Cylinder, Third International Conference on CFD in The Minerals and Process Industries. CSIRO, Melbourne, Australia. 10–12 December 2003.
Дополнительные материалы отсутствуют.