Электрохимия, 2020, T. 56, № 3, стр. 221-228
Одновременное определение изомеров нитрофенола на стеклоуглеродном электроде, модифицированном композитным материалом, содержащим углеродные нанотрубки, β-циклодекстрин и полидифениламин
a Школа химии, Дамганский университет
Дамган, Иран
* E-mail: zarei@du.ac.ir
Поступила в редакцию 28.01.2019
После доработки 10.04.2019
Принята к публикации 04.07.2019
Аннотация
Изомеры нитрофенола (NP) токсичны для человека, животных и растений. Поэтому их определение в окружающей среде очень актуально и важно. В этой статье циклическая вольтамперометрия была применена для полимеризации дифениламина (DPA) на стеклоуглеродном электроде (GCE), модифицированном композитным материалом, содержащим многостенные углеродные нанотрубки и β-циклодекстрин (MWCNT-β-CD) в растворе мономера и 5 M H2SO4, а затем были определены изомеры NP с использованием модифицированного электрода. После адсорбции изомеров NP на PDPA/MWCNT-β-CD при 0.2 В в течение 150 с наблюдали два пика восстановления в фосфатном буферном растворе при pH 7. Пик 4-нитрофенола (4-NP) обнаружен как отдельный пик, но пики 2‑нитрофенола (2-NP) и 3-нитрофенола (3-NP) перекрывались друг с другом. Поэтому для одновременного анализа данных вольтамперограммы была применена нечеткая адаптивная нейронная система (ANFIS). Пределы обнаружения для 2-NP, 3-NP и 4-NP определены как 5.0 × 10–7, 1.1 × 10–7 и 1.3 × 10–7 M соответственно. Эти результаты показали, что модифицированный электрод обладает хорошей чувствительностью и селективностью для одновременного определения изомеров NP. Этот датчик был применен для определения изомеров NP при анализе проб воды. Это первое применение этого датчика и метода ANFIS для одновременного определения изомеров NP. Механизм восстановления также был исследован.
ВВЕДЕНИЕ
Изомеры нитрофенола (NP) представляют собой ряд структурных изомеров и широко используются в промышленном производстве пестицидов, красителей и фармацевтических препаратов. Эти соединения токсичны для людей, животных и растений и могут вызывать нежелательный вкус и запах питьевой воды. Кроме того, они были описаны как потенциальные канцерогены, тератогены и мутагены [1]. Поэтому очень важно разработать простой и надежный метод определения следовых количеств изомеров NP в окружающей среде. В последние несколько лет были разработаны некоторые методологии для одновременного аналитического определения изомеров NP в различных образцах. Эти процедуры включали использование высокоэффективной жидкостной хроматографии [2], капиллярного электрофореза [3, 4], спектрофотометрии [5, 6], анализа методом инжекции потока [7] и электрохимических методов [8–14]. По сравнению с другими вариантами электроаналитические методы имеют преимущества простоты, быстрых результатов и высокой чувствительности.
В электроаналитических датчиках некоторые материалы, такие как наноматериалы, лиганды и полимеры, были применены для развития чувствительности и селективности датчика. Углеродные нанотрубки (CNT) представляют собой наноматериалы с особыми химическими, электронными и механическими свойствами, которые могут способствовать переносу электронов между электроактивными веществами и электродом. Предыдущие работы показывают, что электроды, модифицированные предварительно обработанными CNT, проявляют очень хорошую каталитическую активность [15–19]. С другой стороны, поскольку CD имеют гидрофильные внешние поверхности и гидрофобные полости, они являются хорошими кандидатами для связывания с различными гостевыми молекулами с образованием комплексов включения [20]. β-CD проявляет большое сродство к нитрофенолам [21]. В последнее время большое внимание уделяется электрохимическим датчикам или биодатчикам, основанным на модификации комплексов включения CD [22–29]. В дополнение к вышеупомянутым модификаторам проводящие полимеры улучшают линейный диапазон обнаружения и чувствительность электрохимических датчиков благодаря их электропроводности или свойствам переноса заряда [30]. Полидифениламин (PDPA) является проводящим полимером, похожим на анилин по структуре, но имеет некоторые различия в свойствах. Эти различия в свойствах между PANI и PDPA происходят из-за явных изменений в основных структурах, которые генерируются во время полимеризации. Сообщалось, что механизм полимеризации дифениламина (DPA) отличается от других N-замещенных анилинов и анилина [30].
В настоящей работе был создан пленочно-модифицированный стеклоуглеродный электрод (GCE), содержащий полидифениламин, многостенные углеродные нанотрубки и β-циклодекстрин (PDPA/MWCNT-β-CD), и его применение было исследовано для электрохимического восстановления изомеров NP с помощью циклической и дифференциальной импульсной вольтамперометрии. Синергетический эффект MWCNT и проводящего полимера PDPA и эффект накопления CD обеспечивали чувствительность при определении изомеров NP. Кроме того, в настоящей работе была продемонстрирована способность нечеткой адаптивной нейронной системы (ANFIS) в качестве хемометрического метода при разрешении данных вольтамперограммы.
ANFIS представляет собой синергизм между системами нечеткой логики (FL) и нейронными сетями (NN). Целью нечеткой нейронной системы является применение нейронных методов обучения для определения параметров и/или структуры нечетких нейронных систем [31]. Каждое нечеткое правило в системе нечеткого вывода (FIS) описывает локальное поведение системы. ANFIS представляет собой сетевую структуру, которая реализует FIS и использует гибридные правила обучения для обучения FIS в стиле Сугено с линейными выходами правил. Цель ANFIS состоит в том, чтобы найти модель или карту, которая будет правильно связывать входные данные (например, токи) с целями (например, концентрациями). Теория нечеткой адаптивной нейронной системы была адекватно описана в других работах [32]. В настоящей работе ANFIS применяли для моделирования между токами и концентрациями изомеров NP.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и реагенты
Для вольтамперометрических экспериментов использовали электрохимический анализатор PAR (Princeton Applied Research) модели 394. Трехэлектродная система состоит из чистого GCE, MWCNT-β-CD/GCE или PDPA/MWCNT-β-CD/GCE в качестве рабочего электрода, Ag/AgCl/KCl (насыщенный) в качестве электрода сравнения и платинового провода в качестве вспомогательного электрода. Измеритель pH Metrohm (модель 827) применяли для контроля значения pH растворов. Изомеры NP и дифениламин (ME-820528) получены от компании Merck. Бета-циклодекстрин (856088) и MWCNT (наружный диаметр OD = 10–20 нм; длина L < 1–2 мкм) получены от компаний Sigma-Aldrich и IoLiTec соответственно. Буферные растворы (0.2 М) готовили путем смешивания указанных объемов 0.2 М NaH2PO4 и 0.2 М Na2HPO4, а затем точное значение рН проверяли с использованием измерителя рН. Растворы дезоксигенировали азотом высокой чистоты в течение 240 с перед каждым экспериментом, что осуществляли в атмосфере азота.
Изготовление композитного модифицированного электрода PDPA/MWCNT-β-CD. Первоначально осуществляли удаление примесей из MWCNT и их функционализацию [33]. Затем 20 мг обработанных MWCNT добавляли к 10 мл 0.01 М водного раствора β-CD. Смесь обрабатывали ультразвуком в течение 30 мин для получения дисперсных MWCNT. Перед модификацией GCE полировали с использованием 0.05 мкм суспензии оксида алюминия на полировочной ткани. 4 мкл дисперсии MWCNT-β-CD наносили по каплям на поверхность хорошо полированного GCE и сушили. Электрополимеризацию DPA проводили на MWCNT-β-CD/GCE путем непрерывной циклической вольтамперометрии в 5 М H2SO4, содержащей мономер в концентрации 1.0 мМ. Электрохимия полимерной пленки, а также ее исследование обсуждались в других работах [34].
Методика
5.0 мл 0.2 М фосфатного буферного раствора (PBS) с pH 7.0 и соответствующими объемами изомеров NP разбавляли водой до 10 мл и затем переносили в вольтамперометрическую ячейку и продували азотом в течение 240 с. Затем потенциал накопления (0.2 В) в течение 150 с прилагали к рабочему электроду в процессе перемешивания раствора. Через 5 с для релаксации регистрировали дифференциальную импульсную вольтамперограмму от –0.4 до –0.7 В со скоростью сканирования 33.3 мВ с–1. Холостой раствор без изомеров NP использовали для получения холостого пика тока.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Электрохимическое поведение изомеров NP на различных электродах
Поведение электрохимического восстановления изомеров NP исследовали в 0.1 М фосфатном буферном растворе pH 7 на чистом GCE, MWCNT-β-CD/GCE и PDPA/MWCNT-β-CD/GCE с помощью дифференциальной импульсной вольтамперометрии. На чистом GCE пик восстановления не был получен для изомеров NP. Ток увеличился на MWCNT-β-CD/GCE. Однако на PDPA/MWCNT-β-CD/GCE не только значительно увеличился ток (более чем в 2 раза по сравнению с MWCNT-β-CD/GCE), но и форма вольтамперограммы оказалась лучше, чем на MWCNT-β-CD/GCE. При этом были обнаружены два пика, представленные на рис. 1; первый пик может быть обусловлен восстановлением нитрогруппы 2-NP и 3-NP с образованием 2-гидроксиламинофенола и 3-гидроксиламинофенола, соответственно, в процессе электрохимического восстановления с переносом 4e–/4H+, а появление второго пика может быть связано с восстановлением 4-NP.
Предложенный механизм реакции восстановления
Механизм восстановления NP-изомеров при PDPA/MWCNT-β-CD/GCE в диапазоне потенциалов от 0.5 до –1.3 В был исследован методом циклической вольтамперометрии. Результаты соответствовали литературным данным [35, 36]. Циклические вольтамперограммы показаны на рис. 2. Рисунок 2a представляет ЦВ для 4-NP. На первом цикле большой пик восстановления наблюдается при –0.7 В при прямом сканировании, а анодный пик при 0.15 В наблюдается при обратном сканировании. Пик при –0.7 В связан с одним 4e–/4H+ восстановлением нитрогруппы до гидроксиламиновой группы в OH-φ-NO2 (схема 1 ). Анодный пик при 0.15 В относится к окислению 2e–/2H+ частиц гидроксиламина до родственного оксима. Во время второго цикла появляется пик восстановления при 0.09 В, соответствующий 2e–/2H+ восстановлению оксимной группы, полученной при первом сканировании. Более того, катодный пиковый ток при –0.7 В процесса уменьшается во втором сканировании, что может быть связано с адсорбцией 4-NP на поверхности электрода. Во время первого цикла большая часть поглощенного 4-NP восстанавливается, и ток второго пика восстановления оказался меньшим, чем ток предыдущего пика.
Схема 1 . Предложенный механизм электрохимической реакции восстановления 4-нитрофенола на PDPA/MWCNT-β-CD/GCE.
Рис. 2.
Циклические вольтамперограммы 5.5 × 10–4 M 4-NP (a) 3-NP (б) и 2-NP (в) на PDPA/MWCNT-β-CD/GCE в 0.1 М PBS (pH 7) при скорости сканирования 0.1 В с–1 (без подложки).
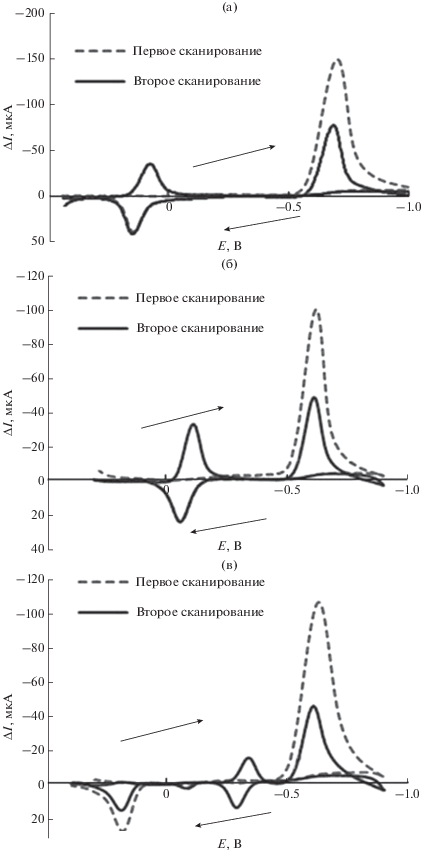
ЦВ для 3-NP почти аналогична 4-NP, как представлено на рис. 2б. Но в ЦВ 2-NP (рис. 2в), в дополнение к предыдущему анодному пику, который присутствует около –0.25 В, наблюдается один новый анодный пик около 0.25 В, что, вероятно, соответствовало ожидаемым реакциям конденсации, связанным с окислением образовавшихся восстановленных промежуточных продуктов, генерирующих электроактивные азоксипроизводные [36].
Влияние рН
Различные 0.1 М фосфатные буферные растворы с рН 3–9 использовали для исследования влияния рН на восстановление изомеров NP на поверхности модифицированного электрода методом дифференциальной импульсной вольтамперометрии. Отклик тока изомеров NP на PDPA/MWCNT-β-CD/GCE увеличился при изменении pH от 3 до 7, а затем уменьшился при значениях pH выше 7 (рис. 3). В результате pH 7 было выбрано в качестве оптимального значения pH, и дальнейшие исследования были проведены при pH 7. Также было обнаружено, что потенциал пика смещается в сторону отрицательного значения с увеличением рН буфера от 3 до 9 (рис. 3). В этом диапазоне pH существует линейная зависимость между pH и потенциалом пика. Уравнения регрессии для 2-NP, 3-NP и 4-NP были следующими: Epc (мВ) = –52.2, pH – 71.2 (r = 0.9862), Epc (мВ) = –54.3, pH – 72.5 (r = 0.9907) и Epc (мВ) = = –53.7, pH – 135.4 (r = 0.9904) соответственно. Наклон около 59 мВ/pH предполагает, что весь процесс был протон-зависимым и что этап переноса электрона осуществлялся протонированием с равным количеством протонов и электронов, участвующих в восстановлении изомеров NP.
Одновременное определение изомеров NP
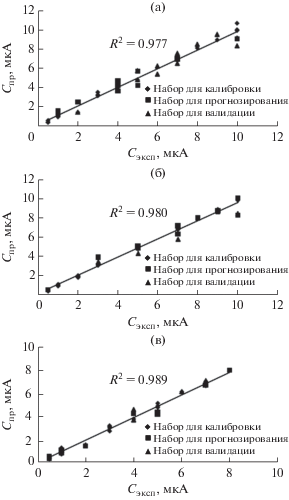
Рисунок 1 показывает, что пиковые токи 2-NP и 3-NP перекрывались, но пиковый ток 4-NP был разделен, вероятно, из-за более сильного комплексообразования между 4-NP и β-циклодекстрином. Однако для одновременного определения изомеров должен применяться один хемометрический метод. С этой целью была применена нечеткая адаптивная нейронная система (ANFIS). Для построения моделей ANFIS значения тока при –470 (потенциал пика 2-NP), –510 мВ (потенциал пика 3-NP) и –610 мВ (потенциал пика 4-NP) использовались в качестве входного слоя в построении трех моделей ANFIS, и для каждой модели ANFIS выходными слоями были концентрации 2-NP, 3-NP и 4-NP соответственно. Для этой цели было приготовлено 45 растворов с различными концентрациями (в диапазоне от 0.5 до 10 мкМ для каждого NP) и различным соотношением концентраций 2-NP, 3-NP и 4-NP. Затем они были случайным образом разделены на три набора: наборы для калибровки (25 растворов), прогнозирования (10 растворов) и валидации (10 растворов).
Было разработано моделирование ANFIS в два этапа: идентификация структуры, которая зависит от подходящего количества правил, и идентификация параметров, которая связана с настройкой системных параметров (на скрытом уровне существуют функции узлов в качестве функций принадлежности (MF), в которых каждый узел выполняет определенную функцию). С этой целью число и тип MF, необходимые для разработки модели ANFIS, были оптимизированы с использованием минимизации среднеквадратической ошибки (RMSE) для набора прогнозирования (контрольный набор). Показано, что количество правил увеличивается соответственно за счет увеличения количества MF на вход.
После оптимизации построенная модель для 2-NP состоит из двух π-MF для каждого из первого и второго входов (токи при –470 и –510 мВ) и одной π-MF для третьего входа (токи при –610 мВ). Для прогнозирования концентрации 3-NP модель ANFIS состоит из двух гауссовых MF для каждого из первого и второго входов и одной гауссовой MF для третьего входа. Модель ANFIS для 4-NP, содержащая одну π-MF и одну гауссову MF для первого входа и две гауссовых MF и одну гауссову MF для второго и третьего входов соответственно. Наконец, для оценки прогностической силы ANFIS оптимизированные модели были применены ко всему набору данных (наборы калибровки, прогнозирования и валидации). Статистические результаты приведены в табл. 1.
Таблица 1.
Статистические результаты, представленные моделью ANFIS для прогнозирования изомеров NP
| Серии | R2 | RMSE | ||||
|---|---|---|---|---|---|---|
| 2-NP | 3-NP | 4-NP | 2-NP | 3-NP | 4-NP | |
| Калибровка | 0.9934 | 0.9992 | 0.9948 | 0.3028 | 0.0844 | 0.1766 |
| Прогнозирование | 0.9623 | 0.9567 | 0.9843 | 0.5724 | 0.6484 | 0.3655 |
| Валидация | 0.8953 | 0.9356 | 0.9840 | 0.7298 | 0.6721 | 0.3032 |
Графики корреляции для моделей ANFIS показывают высокие значения R2 для 2-NP, 3-NP и 4-NP, как 0.977, 0.980 и 0.989 соответственно (рис. 4). Высокие значения R2 для общего набора данных указывают на то, что модель ANFIS можно рассматривать как мощный инструмент для одновременного определения изомеров NP.
Предел обнаружения и воспроизводимость метода
Полученные обнаружения (CLOD = $3{{s}_{b}},$ где ${{s}_{b}}$CLOD = $3{{s}_{b}},$ и ${{s}_{b}}$ представляет собой среднеквадратическое отклонение для 5 повторных определений концентрации холостых проб, полученных из моделей ANFIS) составляли 0.5, 0.1 и 0.1 мкМ для 2-NP, 3-NP и 4-NP соответственно. Относительные стандартные отклонения для пяти повторных измерений смеси 1.0, 4.0 и 1.0 мкМ 2-NP, 3-NP и 4-NP составляли 6.0, 4.6 и 6.4% соответственно. По сравнению с другими электрохимическими методами, предел обнаружения этого метода сопоставим или лучше, чем у некоторых других методов [8–10, 13], а также диапазон его определения шире, чем у некоторых описанных электрохимических методов определения изомеров NP [9, 12].
Исследование влияния примесей
Влияние более 20 частиц на определение 3.0 мкМ 2-NP, 3-NP и 4-NP было изучено в оптимизированных условиях, описанных выше. Предел допуска определяется как концентрация посторонних ионов, вызывающая ошибку менее 3.0% для одновременного определения изомеров NP. Результаты показывают, что многие частицы, такие как Ca2+, Cu2+, Mn2+, Fe3+, Ba2+, K+, Mg2+, Ni2+, Na+, Al3+, Co2+, ${\text{NO}}_{3}^{ - },$ Cl–, I–, F–, аскорбиновая кислота, биотин, пирокатехин, фиолетовый 1‑нитрозо-2-нафтол, не влияли даже в 100 000-кратной концентрации на определение изомеров NP. Кроме того, Cd2+ и Pb2+ и такие соединения, как гидрохинон, нитропирен, аминопирен, фенол, 2,6-диметил-4-нитрофенол и 3-метил-4-нитрофенол, не влияют в 5000-кратной концентрации на определение изомеров NP.
Анализ проб воды
Предложенный метод был успешно применен для одновременного определения добавленных изомеров NP в минеральных водах. Результаты представлены в табл. 2. Статистический критерий Стьюдента показал, что существует согласование между оцененными и полученными результатами. Данные, полученные для образцов с добавлением NP-изомеров, показали хорошие степени определения.
Таблица 2.
Одновременное определение изомеров NP в пробах минеральной воды
| Добавлено, мкМ | Найдено, мкМa | Степень определения, % | ||||||
|---|---|---|---|---|---|---|---|---|
| 2-NP | 3-NP | 4-NP | 2-NP | 3-NP | 4-NP | 2-NP | 3-NP | 4-NP |
| 10.0 | 7.0 | 5.0 | 10.0 ± 0.6 | 7.3 ± 0.4 | 4.9 ± 0.5 | 100.0 | 104.0 | 100.0 |
| 4.0 | 7.0 | 3.0 | 3.8 ± 0.4 | 6.9 ± 0.3 | 3.1 ± 0.2 | 82.5 | 98.5 | 93.3 |
| 8.0 | 10.0 | 7.0 | 8.3 ± 0.5 | 9.9 ± 0.5 | 7.2 ± 0.6 | 103.7 | 100.0 | 102.8 |
ВЫВОДЫ
В настоящем исследовании успешно получен вольтамперометрический датчик, основанный на электрополимеризации пленки PDPA на GCE, модифицированном MWCNT-β-CD, для одновременного определения изомеров NP. По сравнению с неизолированным электродом ток восстановления изомеров NP значительно увеличился, а потенциал пика восстановления разделился на два пика, и полученный датчик был применен для обнаружения изомеров NP в пробах воды с удовлетворительной степенью определения.
Список литературы
Li, J., Kuang, D., Feng, Y., Zhang, F., Xu, Z., and Liu, M., A graphene oxide-based electrochemical sensor for sensitive determination of 4-nitrophenol., J. Hazard. Mater., 2012, vol. 201–202, p. 250.
Belloli, R., Barletta, B., Bolzacchini, E., Meinardi, S., Orlandi, M., and Rindone, B., Determination of toxic nitrophenols in the atmosphere by high-performance liquid chromatography., J. Chromatogr. A, 1999, vol. 846, p. 277.
Guo, X., Wang, Z., and Zhou, S., The separation and determination of nitrophenol isomers by high-performance capillary zone electrophoresis, Talanta, 2004, vol. 64, p. 135.
Fischer, J., Barek, J., and Wang, J., Separation and detection of nitrophenols at capillary electrophoresis microchips with amperometric detection, Electroanalysis, 2006, vol. 18, p. 195.
Niazi, A. and Yazdanipour, A., Spectrophotometric simultaneous determination of nitrophenol isomers by orthogonal signal correction and partial least squares, J. Hazard. Mater., 2007, vol. 146, p. 421.
Perry, D.A., Son, H.J., Cordova, J.S., Smith, L.G., and Biris, A.S., Adsorption analysis of nitrophenol isomers on silver nanostructures by surface-enhanced spectroscopy, J. Colloid Interf. Sci., 2010, vol. 342, p. 311.
Miró, M., Cladera, A., Estela, J.M., and Cerdà, V., Dual wetting-film multi-syringe flow injection analysis extraction application to the simultaneous determination of nitrophenols, Anal. Chim. Acta, 2001, vol. 438, p. 103.
Chu, L., Han, L., and Zhang, X., Electrochemical simultaneous determination of nitrophenol isomers at nano-gold modified glassy carbon electrode, J. Appl. Electrochem., 2011, vol. 41, p. 687.
Liu, Z., Ma, X., Zhang, H., Lu, W., Ma, H., and Hou, S., Simultaneous Determination of Nitrophenol Isomers Based on β-Cyclodextrin Functionalized Reduced Graphene Oxide, Electroanalysis, 2012, vol. 24, p. 1178.
Luo, L.-Q., Zou, X.-l., Ding, Y.-P., and Wu, Q.-S., Derivative voltammetric direct simultaneous determination of nitrophenol isomers at a carbon nanotube modified electrode, Sens. Actuat. B: Chem., 2008, vol. 135, p. 61.
Wei, T., Huang, X., Zeng, Q., and Wang, L., Simultaneous electrochemical determination of nitrophenol isomers with the polyfurfural film modified glassy carbon electrode, J. Electroanal. Chem., 2015, vol. 743, p. 105.
Xu, X., Liu, Z., Zhang, X., Duan, S., Xu, S., and Zhou, C., β-Cyclodextrin functionalized mesoporous silica for electrochemical selective sensor: Simultaneous determination of nitrophenol isomers, Electrochim. Acta, 2011, vol. 58, p. 142.
Yao, C., Sun, H., Fu, H.-F., and Tan, Z.-C., Sensitive simultaneous determination of nitrophenol isomers at poly(p-aminobenzene sulfonic acid) film modified graphite electrode, Electrochim. Acta, 2015, vol. 156, p. 163.
Zhang, T., Lang, Q., Yang, D., Li, L., Zeng, L., Zheng, C., Li, T., Wei, M., and Liu, A., Simultaneous voltammetric determination of nitrophenol isomers at ordered mesoporous carbon modified electrode, Electrochim. Acta, 2013, vol. 106, p. 127.
Qi, H. and Zhang, C., Simultaneous determination of hydroquinone and catechol at a glassy carbon electrode modified with multiwall carbon nanotubes, Electroanasis, 2005, vol. 17, p. 832.
Umasankar, Y., Periasamy, A. P., and Chen, S.-M., Electrocatalysis and simultaneous determination of catechol and quinol by poly(malachite green) coated multiwalled carbon nanotube film, Anal. Biochem., 2011, vol. 411, p. 71.
Wang, S. F. and Xu, Q., Square wave voltammetry determination of brucine at multiwall carbon nanotube modified glassy carbon electrodes, Anal. Lett., 2005, vol. 38, p. 657.
Wang, Z., Li, S., and Lv, Q., Simultaneous determination of dihydroxybenzene isomers at single-wall carbon nanotube electrode, Sens. Actuat. B, 2007, vol. 127, p. 420.
Chekin, F. and Bagheri, S., Tyrosine sensing on phthalic anhydride functionalized chitosan and carbon nanotube film coated glassy carbon electrode, Russ. J. Electrochem., 2016, vol. 52, p. 174.
Lu, Z., Lu, C., and Meng, Q., An inclusion complex of β-cyclodextrin with mnt anion (mnt = maleonitriledithiolate) studied by induced circular dichroism, J. Incl. Phenom. Macrocycl. Chem., 2008, vol. 61, p. 101.
Tredici, I., Merli, D., Zavarise, F., and Profumo, A., α‑Cyclodextrins chemically modified gold electrode for the determination of nitroaromatic compounds, J. Electroanal. Chem., 2010, vol. 645, p. 22.
Akola, J., Rytkönen, K., and Manninen, M., Electronic properties of single-walled carbon nanotubes inside cyclic supermolecules, J. Phys. Chem. B, 2006, vol. 110, p. 5186.
Ali, M. B., Kalfat, R., Sfihi, H., Chovelon, J. M., Ouada, H. B., and Jaffrezic-Renault, N., Sensitive cyclodextrin–polysiloxane gel membrane on EIS structure and ISFET for heavy metal ion detection, Sens. Actuat. B: Chem., 2000, vol. 62, p. 233.
Camacho, C., Chico, B., Cao, R., Matías, J. C., Hernández, J., Palchetti, I., Simpson, B. K., Mascini, M., and Villalonga, R., Novel enzyme biosensor for hydrogen peroxide via supramolecular associations, Biosens. Bioelectron., 2009, vol. 24, p. 2028.
Casas-Solvas, J.M., Ortiz-Salmerón, E., Fernández, I., García-Fuentes, L., Santoyo-González, F., and Vargas-Berenguel, A., Ferrocene–β-cyclodextrin conjugates: synthesis, supramolecular behavior, and use as electrochemical sensors, Chem. Eur. J., 2009, vol. 15, p. 8087.
de Abreu, F.C., Ferreira, D.C.M., Goulart, M.O.F., Buriez, O., and Amatore, C., Electrochemical activation of β-lapachone in β-cyclodextrin inclusion complexes and reactivity of its reduced form towards oxygen in aqueous solutions, J. Electroanal. Chem., 2007, vol. 608, p. 125.
Fang, B., Zhang, W., Kan, X., Tao, H., Deng, X., and Li, M., Fabrication and application of a novel modified electrode based on β-cyclodextrin/ferrocenecarboxylic acid inclusion complex, Sens. Actuat. B, 2006, vol. 117, p. 230.
Shen, Q. and Wang, X., Simultaneous determination of adenine, guanine and thymine based on β-cyclodextrin/MWNTs modified electrode, J. Electroanal. Chem., 2009, vol. 632, p. 149.
Wang, Z., Xiao, S., and Chen, Y., β-Cyclodextrin incorporated carbon nanotubes-modified electrodes for simultaneous determination of adenine and guanine, J. Electroanal. Chem., 2006, vol. 589, p. 237.
Rahman, M., Kumar, P., Park, D.-S., and Shim, Y.-B., Electrochemical sensors based on organic conjugated polymers, Sensors, 2008, vol. 8, p. 118.
Zarei, K., Atabati, M., and Moghaddary, S., Predicting the heats of combustion of polynitro arene, polynitro heteroarene, acyclic and cyclic nitramine, nitrate ester and nitroaliphatic compounds using bee algorithm and adaptive neuro-fuzzy inference system, Chemometr. Intell. Lab. Syst., 2013, vol. 128 p. 37.
Jalali-Heravi, M. and Shahbazikhah, P., Quantitative structure–mobility relationship study of a diverse set of organic acids using classification and regression trees and adaptive neuro-fuzzy inference systems, Electrophoresis, 2008, vol. 29, p. 363.
Zarei, K. and Helli, H., Electrochemical determination of aminopyrene on glassy carbon electrode modified with multi-walled carbon nanotube–sodium dodecyl sulfate/Nafion composite film, J. Electroanal. Chem., 2015, vol. 749, p. 10.
Zarei, K., Teymori, E., and Kor, K., Very sensitive differential pulse adsorptive stripping voltammetric determination of 4-nitrophenol at poly (diphenylamine)/multi-walled carbon nanotube-β-cyclodextrin-modified glassy carbon electrode, Inter. J. Environ. Anal. Chem., 2014, vol. 94, p. 1407.
Fodjo, E.K., Li, Y.T., Li, D.W., Riaz, S., and Long, Y.T., Rapid determination of nitrophenol isomers in polluted water based on multi-walled carbon nanotubes modified screen-printed electrode, Med. J. Chem., 2011, vol. 1, p. 19.
Zhang, D.P., Wu, W.L., Long, H.Y., Liu, Y.C., and Yang, Z.S., Voltammetric Behavior of o-Nitrophenol and Damage to DNA, Int. J. Mol. Sci., 2008, vol. 9, p. 316.
Дополнительные материалы отсутствуют.