Электрохимия, 2020, T. 56, № 4, стр. 293-307
Электрохимическое получение многослойного графена и его использование в Со–N–C-электрокатализаторах восстановления кислорода и выделения водорода
Я. И. Курысь a, *, Е. А. Парийская a, Д. О. Мазур a, К. С. Гавриленко b, c, В. Г. Кошечко a, В. Д. Походенко a
a Институт физической химии им. Л.В. Писаржевского НАН Украины
03028 Киев, просп. Науки, 31, Украина
b Киевский национальный университет им. Тараса Шевченко, Химико-биологический центр
02094 Киев, ул. Красноткацкая, 67, Украина
c ООО НПП “Енамин”
02094 Киев, ул. Красноткацкая, 78, Украина
* E-mail: kurys@inphyschem-nas.kiev.ua
Поступила в редакцию 06.05.2019
После доработки 30.05.2019
Принята к публикации 18.07.2019
Аннотация
Показано, что применение в процессе электрохимической эксфолиации графита водных электролитов на основе солей различных ароматических карбоновых кислот позволяет получать многослойные графены (МСГ), при этом предохраняя их от негативного окислительного воздействия кислородсодержащих радикалов, в частности ∙ОН, образующихся при электролизе воды на графитовом аноде. Установлена возможность использования электрохимически полученных МСГ для формирования несодержащих благородных металлов карбонизированных нанокомпозиционных Co–N–C-электрокатализаторов реакций восстановления кислорода (РВК) и выделения водорода (РВВ). Показано, что такой электрокатализатор на основе поли-2,6-диаминопиридина в водной 0.5 М H2SO4 превышает по своим функциональным характеристикам в РВК и РВВ аналог на основе ацетиленовой сажи, а в процессе восстановления кислорода также обладает высокой толерантностью к СО и метанолу. На основе экспериментальных данных сделано предположение о различной природе доминирующих активных центров в Co–N–C-электрокатализаторах на основе МСГ и ацетиленовой сажи, а также об участии одних и тех же активных центров в РВК и РВВ.
ВВЕДЕНИЕ
Электрохимическое расслоение графита является достаточно простым и весьма перспективным методом, позволяющим получать графеновые материалы (ГМ) в больших количествах и в экологически благоприятных условиях [1–3]. Варьирование условий проведения электрохимического процесса, типа электролита, добавок к нему дает возможность управлять характеристиками образующихся 2D-материалов [2, 3], что является затруднительным при их получении традиционными методами, например жидкофазной эксфолиацией. Реализация данного подхода возможна в условиях как катодного, так и анодного процессов, где расширение и последующее расслоение графитового электрода инициируются интеркаляцией соответствующих катионов или анионов. Одним из преимуществ анодной эксфолиации графита является возможность использования легкодоступных водных электролитов, например, на основе серной кислоты [4–6], гидроксида натрия [7], неорганических сульфатов [6, 8] или простых органических карбоновых кислот [5, 9]. Кроме того, применение специфических водных электролитов при анодном расслоении графитового электрода позволяет в одну стадию получать ГМ, допированные гетероатомами азота или серы [2, 10, 11], которые имеют значительный потенциал для различных приложений (электрохимическая энергетика, сенсорика и др.), в частности, в качестве эффективных электрокатализаторов реакции восстановления кислорода (РВК) [12–14].
Ранее нами была установлена возможность весьма эффективного получения многослойных графенов (МСГ) путем эксфолиации графитового электрода в водных растворах бензоата натрия (в присутствии и отсутствие Na2SO4) в условиях электролиза с импульсным изменением потенциала поляризации электрода, обеспечивающего быстрый переход от процесса интеркаляции к деинтеркаляции анионов [15]. Полученные МСГ с латеральным размером частиц до нескольких мкм содержали ~11–21 единичных графеновых слоев и характеризовались низким содержанием в них кислородсодержащих дефектов (С/О от 9 до 25). Исходная предпосылка для реализации таких процессов заключалась в том, что, по нашему мнению, нековалентное π–π-взаимодействие с участием ароматических фрагментов солей ароматических карбоновых кислот может благоприятствовать интеркаляции соответствующих анионов в межслоевое пространство графита, тем самым облегчая расслоение графитового электрода. Кроме того, при высоких анодных потенциалах, которые необходимы для электрохимической эксфолиации графита, анионы RCOO– способны претерпевать декарбоксилирование [16, 17], а выделяющийся при этом CO2 может не только способствовать эксфолиации, но и влиять на природу и количество кислородсодержащих дефектов в ГМ. В связи с этим, представляло интерес исследовать возможность применения в процессе электрохимического расслаивания графита не только C6H5COONa, но и солей других ароматических карбоновых кислот, в частности C6H5CH2COONa, 2-F–C6H4CH2COONa, 4-F–C6H4CH2COONa и C6H4(COONa)2. В условиях, подобных использованным в настоящей работе, фенилуксусная кислота и ее производные способны к декарбоксилированию [17, 18], а терефталевая кислота – к электрохимической деградации с выделением СО2 [19].
В ходе исследований электрохимических свойств МСГ, полученного при применении электролита на основе бензоата и сульфата натрия, нами была установлена его высокая электрокаталитическая активность в процессах окисления NADH и аскорбиновой кислоты [15]. Другим, привлекательным приложением МСГ может быть, на наш взгляд, их использование для создания металл–азот–углеродных (Ме–N–C, где Ме = Co и/или Fe) нанокомпозиционных электрокатализаторов широко востребованных процессов восстановления кислорода и выделения водорода [20–23]. Значительный интерес к Ме–N–C-электрокатализаторам обусловлен, прежде всего, достаточно высокими их функциональными характеристиками, при отсутствии в их составе платины или других благородных металлов, что существенно снижает стоимость таких катализаторов.
Таким образом, цель данной работы заключалась в изучении возможности использования солей различных ароматических карбоновых кислот в качестве фонового электролита процесса электрохимического расслоения графита, а также в сравнительном исследовании функциональных характеристик Со–N–C-электрокатализаторов восстановления кислорода и выделения водорода, сформированных с использованием МСГ или ацетиленовой сажи (АС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали графитовые стержни высокой чистоты (Alfa Aesar, 99.9995%), АС (Alfa Aesar, 99.9+%), а также коммерчески доступные реактивы и растворители – Na2SO4 (“х. ч.”), C6H5COONa (UOSlab, >95%), C6H5CH2COONa (UOSlab, >95%), 2-F–C6H4CH2COONa (UOSlab, >95%), 4-F–C6H4CH2COONa (UOSlab, >95%), C6H4(COONa)2 (UOSlab, >95%), 2,6-диаминопиридин (Acros Organics, 98%), (NH4)2S2O8 (Aldrich, >98%), Co(NO3)2 · 6H2O (Aldrich, > 98%), этиловый спирт (96%), гептан (“ч. д. а.”) – все без дополнительной очистки. Водные растворы H2SO4, HCl и NaOH были приготовлены из фиксаналов. Использовавшийся для сравнения оксид графена (ОГ) получали в виде водной дисперсии жидкофазной эксфолиацией оксида графита, синтезированного по модифицированному методу Хаммерса [24].
Электрохимическую эксфолиацию графита проводили по предложенному нами ранее подходу [15] в неразделенной ячейке (рабочий и вспомогательный электроды – графитовые стержни; электрод сравнения – Ag/AgCl (KClнасыщ) с использованием потенциостата ПИ-50-1.1 (Гомельский завод измерительных приборов, Беларусь) в режиме электролиза с импульсным изменением потенциала поляризации электрода – выдерживая электрод при потенциалах +3.0 и –1.5 В (по 30 с) в течении 20 ч. В качестве электролита использовались водные растворы 0.1 M натриевой соли карбоновой кислоты (C6H4(COONa)2, C6H5CH2COONa, 2-F–C6H4CH2COONa или 4-F–C6H4CH2COONa) + 0.1 M Na2SO4. Полученные в виде дисперсии ГМ отфильтровывали на мембранном фильтре с диаметром пор 0.2 мкм (SUPELCO), промывали водой, этиловым спиртом и гептаном, после чего их переносили в H2O или C2H5OH, где проводили повторное диспергирование на протяжении 2 мин в ультразвуковой моечной ванне УВМ-5 (Selmi, Украина).
Композиты Со–N–CМСГ (на основе МСГ, синтезированного согласно [15] с использованием электролита на основе C6H5COONa и Na2SO4), а также Co–N–CАС (на основе АС) получали по аналогии с методикой, приведенной в [25]. Путем ультразвукового диспергирования проводили гомогенизацию смеси, содержащую 0.25 г 2,6-диаминопиридина (мономера), 1.0 г (NH4)2S2O8 (окислителя), 0.05 г МСГ или АС и 0.093 г Co(NO3)2 ⋅ 6H2O в 1.0 М водном растворе HCl. При этом массовое соотношение мономер:углеродный материал составляло 5 : 1, мольное соотношение мономер:окислитель – 1 : 2, а содержание кобальта – 10% от суммарной массы мономера и углеродного материала. Далее реакционную смесь оставляли на воздухе на 24 ч, что являлось достаточным для осуществления окислительной полимеризации 2,6-диаминопиридина до поли-2,6-диаминопиридина (ПДАП). После указанного времени проводили упаривание смеси и проводили термообработку сухого остатка в трубчатой печи в токе аргона при 800°С (2 ч; скорость нагрева образца ~ 5°С/мин). Полученные карбонизированные композиты Со–N–CМСГ и Со–N–CАС обрабатывали водной 0.05 М H2SO4 (80°С, 3 ч), затем на фильтре промывали водой (до рН ~ 7) и высушивали в сушильном шкафу при 90°С.
Электронные микрофотографии избранных участков поверхности образцов графеновых материалов были получены методами сканирующей электронной микроскопии (СЭМ) (микроскоп Mira 3 LMU, Tescan, Чехия), ускоряющее напряжение 10 кВ и просвечивающей электронной микроскопии (ПЭМ) (микроскоп ПЭМ-125К, Selmi, Украина), ускоряющее напряжение 100 кВ). ИК-спектры регистрировали на ИК-фурье-спектрометре SPECTRUM ONE (Perkin Elmer, США) в таблетированных образцах с KBr. УФ-видимые спектры дисперсий графеновых материалов снимали на спектрофотометре SQ-4802 (Unico, США), а рамановские спектры – на спектрометре T64000 (Horiba Jobin-Yvon, Япония; Ar–Kr-лазер, λ = 488 нм). Анализ газовых смесей проводили с помощью хроматографа Кристаллюкс 4000М (Мета-хром, Россия).
Идентификацию продуктов превращений электролита после проведения электрохимического расслоения графита проводили методом ядерного магнитного резонанса (ЯМР) путем сравнения положения сигналов с описанными в литературе, учитывая, что положения сигналов в спектрах 19F ЯМР существенно меняется в зависимости от растворителя [26]. Из-за частичного перекрывания сигналов в спектрах 1Н ЯМР идентификацию продуктов, а также выводы об отсутствии определенных продуктов делали по наличию наиболее характеристичных сигналов (находящихся в самом слабом или самом сильном поле в области ароматических протонов, сигналов группы СН2 в бензиловом спирте). Спектры ЯМР на ядрах 1H и 19F регистрировали на спектрометре BioSpin GmbH при частоте 500 МГц (Bruker, Германия).
Циклические вольтамперограммы (ЦВА), хроноамперограммы, а также поляризационные кривые выделения водорода регистрировали с помощью компьютеризированного комплекса на базе потенциостата ПИ-50-1.1 (при исследовании графеновых материалов) и потенциостата/гальваностата VersaSTAT4-200 (Princeton Applied Research, США) с использованием неразделенной электрохимической ячейки с рабочим дисковым стеклоуглеродным (GC) электродом с видимой площадью поверхности 0.03 см2. Перед модификацией GC-электрод полировали суспензиями алмазных частиц (1.0 мкм) и наночастиц Al2O3 (0.05 мкм) с последующей ультразвуковой очисткой в смеси вода–этанол (1 : 1, об.) и затем в дистиллированной воде.
Для модификации GC-электрода графеновыми материалами на его поверхность наносили 2 мкл дисперсии соответствующего ГМ в этиловом спирте с последующим высушиванием на воздухе. Для проведения электрохимических исследований Со–N–CМСГ и Со–N–CАС с помощью ультразвука диспергировали 2 мг соответствующего композита и 8 мкл 5% спиртового раствора нафиона (Aldrich) в 48 мкл смеси изопропанол : вода с объемным соотношением 1 : 1, после чего 2 мкл дисперсии наносили на поверхность электрода с дальнейшим высушиванием на воздухе.
Исследования методом вращающегося дискового электрода с кольцом (ВДЭК) проводили на приборе 636А (Princeton Applied Research, США) (площадь поверхности GC-диска – 0.2475 см2, Pt-кольца – 0.1866 см2) при потенциале кольца 1.2 и 0.4 В (отн. Ag/AgCl) в кислом и щелочном электролитах соответственно, в комплексе с бипотенциостатом MTech ВP-10 (MTechLab, Украина), с использованием разделенной электрохимической ячейки. Для определения количества электронов (n), доли электронов, участвующих в 4‑электронном процессе (4е%), а также выхода перекиси водорода (H2O2%) использовали следующие формулы:
(3)
${{{\text{H}}}_{2}}{{{\text{O}}}_{2}}\% = 200\frac{{\frac{{{{I}_{{\text{r}}}}}}{N}}}{{{{I}_{{\text{d}}}} + \frac{{{{I}_{{\text{r}}}}}}{N}}},$Количество электронов (n) также определяли по тангенсу угла наклона зависимостей в координатах Коутецкого–Левича по уравнению:
(4)
$\frac{1}{i} = \frac{1}{{{{i}_{{\text{k}}}}}} + \frac{1}{{{{i}_{{\text{d}}}}}} = \frac{1}{{nFkc}} + \frac{1}{{0.62nF{{D}^{{2{\text{/}}3}}}c{{\nu }^{{ - 1/6}}}{{\omega }^{{1/2}}}}},$Основные кинетические параметры реакций выделения водорода и восстановления кислорода на полученных электрокатализаторах рассчитывали используя уравнение Тафеля:
(5)
$\eta = a + b\lg j = \frac{{2.3RT}}{{\alpha nF}}\lg {{j}_{0}} + \frac{{2.3RT}}{{\alpha nF}}\lg j,$Для проведения электрохимических измерений в качестве противоэлектрода использовали платиновую проволоку, а электрода сравнения – насыщенный хлоридсеребряный электрод. Все значения потенциалов в работе (за исключением исследований МСГ методом циклической вольтамперометрии) приведены относительно обратимого водородного электрода (RHE), Е(RHE) = Ei + + 0.202 В + 0.059рН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как было установлено нами ранее [15], при использовании бензоата натрия образование МСГ в процессе электрохимического расслоения графита в условиях электролиза с импульсным изменением потенциала поляризации электрода имеет место как в отсутствии, так и в присутствие Na2SO4 в электролите. Наличие Na2SO4 приводит, с одной стороны, к увеличению количества единичных графеновых слоев в упаковке МСГ, а с другой – позволяет снизить число кислородсодержащих дефектов в таких графеновых материалах [15]. Путем измерения потери массы графитового электрода в процессе электролиза во времени нами была исследована сравнительная производительность эксфолиации графита в 0.1 М С6H5COONa + 0.1 М Na2SO4 и 0.1 М С6H5COONa и установлено, что добавление в электролит Na2SO4 приводит к увеличению скорости процесса ~в 3 раза. Учитывая это, в настоящей работе нами было проведено электрохимическое расслоение графитового электрода в водных электролитах, содержащих одновременно соответствующий ароматический карбоксилат (C6H4(COONa)2, C6H5CH2COONa, 2-F–C6H4CH2COONa, 4-F–C6H4CH2COONa) и Na2SO4. Независимо от природы использовавшихся карбоксилатов во всех случаях в процессе электролиза имела место эксфолиация графита и переход в объем электролита частиц графенового материала, с толщиной, не превышающей 10 нм. Методами СЭМ и ПЭМ установлено, что полученные материалы представляют собой МСГ и характеризуются многослойной структурой, образованной пластинчатыми графеновыми частицами с латеральным размером от нескольких сот нанометров до нескольких микрон (рис. 1).
Рис. 1.
СЭМ (а), (б) и ПЭМ (в)–(д) изображения частиц МСГ, полученных электрохимически при использовании электролитов на основе C6H4(COONa)2 (а)–(в), C6H5CH2COONa (б), 2-F–C6H4CH2COONa (г) и 4-F–C6H4CH2COONa (д).

Методом газовой хроматографии было установлено, что после проведения электрохимической эксфолиации графита в присутствии фенилацетата натрия и Na2SO4 в составе газовой смеси в приэлектролитном пространстве содержится 0.45% СО, 1.5% СО2 и 20% О2. В то же время при проведении расслоения графита в тех же условиях, но в не содержащем солей карбоновых кислот 0.1 М водном Na2SO4, наличия оксидов углерода в атмосфере электрохимической ячейки зафиксировать не удалось, что может свидетельствовать в пользу того, что главным источником СО2, являются карбоксилат-анионы. С помощью метода ЯМР установлено, что в условиях проведения электрохимического процесса действительно имеет место декарбоксилирование фенилацетат и фторфенилацетат анионов, о чем свидетельствуют идентифицированные нами продукты превращения соответствующих электролитов после синтеза МСГ. В частности, при использовании C6H5CH2COONa – C6H5CH2CH2C6H5 (1Н: δ 7.2, 7.1, 3.2) и C6H5COO– (1Н: δ 7.67); 4-F–C6H4CH2COONa – 4-F–C6H4CH2OН (1Н: δ 7.16, 7.11, 4.46; 19F: δ –114.5) и 4-F–C6H4COOН (1Н: δ 7.16, 7.11, 4.58; 19F: δ –106.3); 2-F–C6H4CH2COONa – 2-F–C6H4CH2OН (1Н: δ 7.4, 7,37, 7.12, 7.01, 4.54; 19F: δ –119.5) и 2-F–C6H4COOН (1Н: δ 8.1, 7.8; 19F: δ –120.3). Можно предположить, что в случае C6H5CH2COONa наряду с классической реакцией Кольбе, приводящей к димеру (дибензилу), что согласуется с данными об анализе продуктов препаративного электролиза фенилуксусной кислоты [18], имеет образование бензилового спирта (либо по реакции реакция Хофера–Места, либо в результате взаимодействия радикалов ${{{\text{C}}}_{6}}{{{\text{H}}}_{5}}{\text{CH}}_{2}^{\centerdot }$ с водой или гидроксильными радикалами) с дальнейшим окислением C6H5CH2OН до бензоат аниона. В случае же 2-F–C6H4CH2COONa или 4‑F–C6H4CH2COONa отсутствие продуктов реакции сочетания (димеров) может свидетельствовать о том, что реакция Кольбе не вносит вклада в анодное окисление фторфенилацетат анионов в исследованных условиях проведения электролиза.
Учитывая известные представления о протекании эксфолиации графитового электрода в водных электролитах [2, 3], а также установленные нами продукты электролиза, можно предположить следующий механизм протекания процессов в ходе электрохимической эксфолиации графита при использовании натриевых солей фенил-уксусной и фторфенилуксусных кислот. При приложении положительного потенциала к электроду происходит окисление молекул воды с образованием гидроксильных и, возможно, других обладающих высокой окислительной способностью кислородсодержащих радикалов, которые атакуя графитовый анод открывают его края и границы зерен, облегчая тем самым интеркаляцию анионов ${\text{SO}}_{4}^{{2 - }}$ и RCOO– в межграфитовые плоскости [2, 3]. При этом также имеет место разряд карбоксилат-анионов с образованием RCOO∙ с последующим быстрым декарбоксилированием последних с выделением СО2 и образованием соответствующих углеводородных радикалов R∙. Такие радикалы далее могут вступать в реакцию сочетания по Кольбе (только в случае электролита на основе C6H5CH2COONa, что приводит к димеру C6H5CH2CH2C6H5) [16–18], а также взаимодействовать с водой или гидроксильными радикалами, образуя спирты ROH, которые могут в дальнейшем окисляться до кислот RʹСООH (где R = R'СH2). Образование ROH возможно и по реакции Хофера–Места [16, 17] как результат взаимодействия катионов карбения R+ (образующихся при электрохимическом окислении R∙) с водой, являющейся нуклеофилом. В случае приложения отрицательного потенциала – имеет место деинтеркаляция ${\text{SO}}_{4}^{{2 - }},$ а также RCOO–, которые не претерпели декарбоксилирование. Таким образом, многократное повторение циклов интеркаляции/деинтеркаляции ${\text{SO}}_{4}^{{2 - }}$ и RCOO– анионов в межграфитовые плоскости, выделение СО2, а также Н2 и О2, которое происходит параллельно в результате частичного анодного разложения Н2О, обеспечивают расслоение графита и эксфолиацию частиц МСГ в объем электролита.
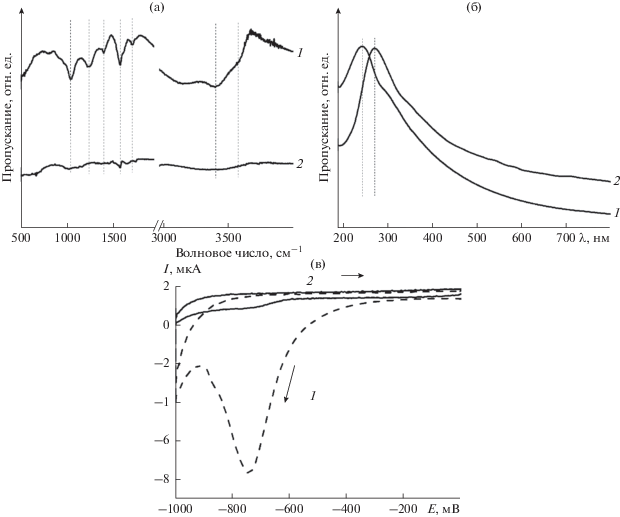
Важной особенностью полученных МСГ является их незначительная степень окисления, что может быть связано со способностью ароматического ядра карбоновых кислот [27] или радикалов R∙, которые генерируются при декарбоксилировании RCOO– анионов, выступать в качестве ловушки кислородсодержащих радикалов, в частности ∙OH, образующихся в результате электролиза воды на графитовом аноде и являющихся в значительной степени ответственными за окисление расслоенных графеновых листов [28]. Небольшое число кислородсодержащих дефектов в структуре ГМ обусловливает отсутствие или крайне малую интенсивность характеристичных для кислородсодержащих фрагментов полос в ИК-спектрах, положение максимума поглощения в области 265–272 нм в УФ-видимых спектрах дисперсий МСГ в этаноле, а также незначительные катодные токи в ЦВА таких материалов, отвечающие процессу их необратимого электрохимического восстановления. Указанные особенности проиллюстрированы на рис. 2 на примере ГМ, полученного при использовании электролита на основе C6H4(COONa)2.
Рис. 2.
ИК-спектры (а), УФ-видимые спектры дисперсий в этаноле (б) и ЦВА (в) ОГ (1) и МСГ, полученного при использовании C6H4(COONa)2 (2). Условия регистрации ЦВА: электролит – деаэрированный 0.5 M KNO3/Н2О, скорость развертки потенциала – 10 мВ/с.
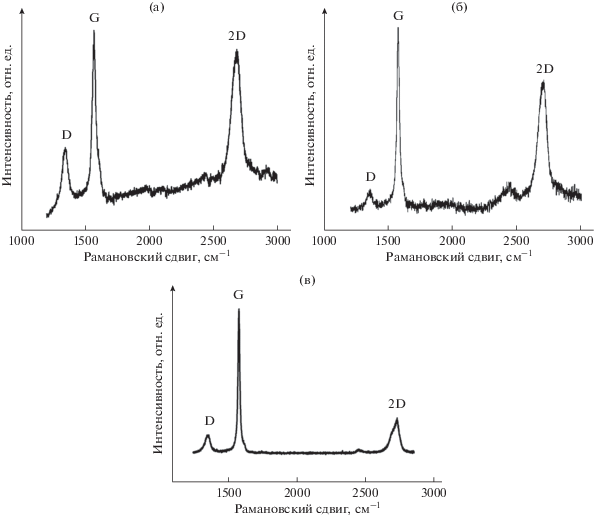
Строение полученных МСГ было также изучено нами методом рамановской спектроскопии. Как следует из рис. 3, положение в рамановских спектрах характеристичных полос D (1355–1366 см–1), G (1582–1584 см–1) и 2D (2705–2712 см–1), их ширина на полувысоте, а также соотношение интенсивностей несколько отличаются для МСГ, сформированных в различных электролитах. В то же время, во всех случаях соотношение I(G)/I(2D) > 1, что свидетельствует о многослойности электрохимически полученных ГМ [29] и объясняет значительное подобие их рамановских спектров со спектром исходного графита. Как известно, соотношение интенсивностей линий D и G в рамановских спектрах ГМ позволяет оценить степень дефектности их структуры [29, 30]. Рассчитанная величина I(D)/I(G) для МСГ, полученных при использовании электролитов на основе C6H4(COONa)2, C6H5CH2COONa и 4-F–C6H4CH2COONa, составляет, соответственно, 0.08, 0.10 и 0.12 (рис. 3). Такие значения I(D)/I(G) являются заметно меньшими по сравнению с установленными для электрохимически полученного графена в H2SO4 (0.42) [4] и химически или термически восстановленных ОГ (~1.2–1.5) [31, 32] и свидетельствуют о небольшом количестве дефектов в полученных нами МСГ.
Рис. 3.
Рамановские спектры МСГ, полученных при использовании электролитов на основе C6H4(COONa)2 (а), C6H5CH2COONa (б) и 4-F–C6H4CH2COONa (в).
Как было отмечено выше, одним из интересных приложений МСГ может быть, на наш взгляд, их использование при формировании несодержащих благородных металлов нанокомпозиционных Ме–N–C-электрокатализаторов РВК, которая, в частности, реализуется в топливных элементах и металл-воздушных источниках тока. Учитывая это, пиролизом МСГ (полученного, согласно [15], в электролите на основе C6H5COONa и Na2SO4) совместно с нитратом Со(II) и ПДАП (в качестве источника азота) нами был получен композит Со–N–CМСГ и проведено сравнение его электрохимических свойств в РВК с таковыми для аналога Со–N–CАС, сформированного в тех же условиях, но с использованием АС вместо МСГ. Выбор ПДАП был обусловлен высоким содержанием в нем азота, а также способностью соответствующего мономера к эффективной окислительной полимеризации с использованием (NH4)2S2O8 как окислителя.
В результате проведенных исследований Со–N–CМСГ и Со–N–CАС методом циклической вольтамперометрии в деаэрированных электролитах нами не обнаружено каких-либо редокс-переходов при сканировании потенциала в области 200–900 мВ (рис. 4а, 4б). В то же время при развертке потенциала свыше 900 мВ в ЦВА наблюдается резкое возрастание анодных токов (рис. 4б, кривая 1 '), что, по-видимому, обусловлено окислением частиц Co9S8 [33, 34], присутствующих в таких композитах вследствие способа их формирования [25] – использования при пиролизе смеси мономера с окислителем (NH4)2S2O8 вместо предварительно полученного ПДАП.
Рис. 4.
ЦВА GC-электродов, модифицированных Со–N–CАС (а) и Со–N–CМСГ (б) в деаэрированных (1, 1 ') и насыщенных кислородом (2) 0.5 М H2SO4 (а) и 0.1 NaOH (б); ЦВА GC-электродов (в), модифицированных Со–N–CАС (1) и Со–N–CМСГ (2) в насыщенной кислородом 0.5 М H2SO4; зависимость плотности тока (∆j = (ja – jc)/2 (г), при 350 мВ от скорости сканирования для GC-электродов, модифицированных Со–N–CАС (1) и Со–N–CМСГ (2) в 0.5 М H2SO4.
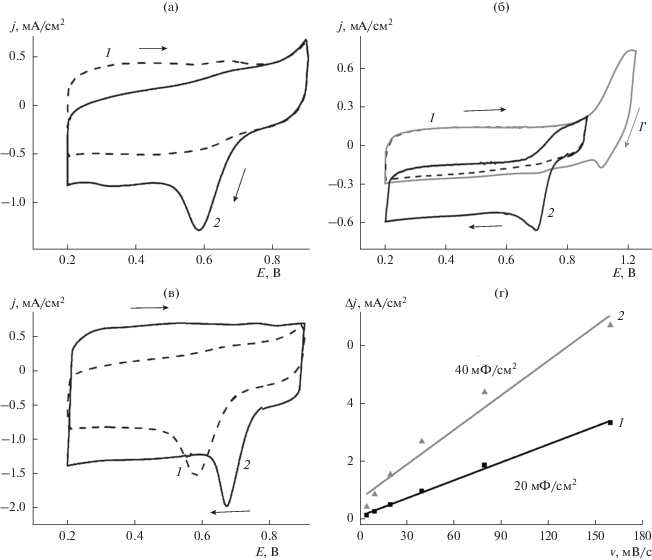
Иная картина имеет место в присутствии кислорода. Появление заметных токов и необратимого пика на катодных ветвях ЦВА Со–N–CМСГ и Со–N–CАС в насыщенных кислородом 0.5 М H2SO4 и 0.1 М NaOH (рис. 4а–4в) свидетельствует о способности синтезированных материалов выступать в качестве электрокатализаторов восстановления кислорода в электролитах с различным рН. Следует отметить, что активность в РВК немодифицированного GC-электрода в условиях проведения измерений является незначительной и основной вклад в токообразующий процесс вносит электрохимическое восстановление кислорода на нанокомпозиционных электрокатализаторах.
Как видно из приведенных ЦВА (рис. 4в), в кислом электролите эффективность в РВК Со–N–CМСГ является более высокой по сравнению с Со–N–CАС, что проявляется в анодном сдвиге максимума пика восстановления кислорода на ~90 мВ. Важно также отметить, что в 0.5 М H2SO4 площадь под ЦВА для Со–N–CМСГ заметно превышает таковую для Со–N–CАС (рис. 4в) при одинаковой загрузке катализаторов на электроде, что может указывать на большую площадь поверхности электрода, модифицированного композитом на основе МСГ, которая доступна электролиту. Относительное изменение такой площади поверхности при переходе от Со–N–CАС к Со–N–CМСГ было оценено нами на основе поляризационной емкости двойного электрического слоя (ДЭС) – СДЭС, рассчитанной из ЦВА композитов, зарегистрированных при различных скоростях развертки потенциала в 0.5 М H2SO4 в области потенциалов 300–400 мВ, где величина тока определяется только током заряжения ДЭС. Рассчитанное значение СДЭС для Со–N–CМСГ (40 мФ/см2) почти в 2 раза превышает установленное для Со–N–CАС (рис. 4г), что подтверждает предположение о большей площади поверхности электрода, доступной раствору электролита в случае катализатора, сформированного из МСГ, и в свою очередь определяет функциональное преимущество последнего.
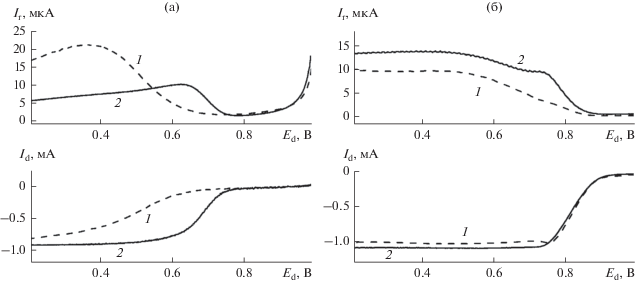
Для сравнения свойств полученных электрокатализаторов в РВК в электролитах с различным рН, а также выяснения механизма протекания на них указанного процесса нами были проведены исследования методом ВДЭК. Как следует из представленных на рис. 5 данных, форма I–E кривых, относящихся к диску и кольцу, является различной для Со–N–CМСГ- и Со–N–CАС-катализаторов в кислом электролите и близкой – в щелочном. В 0.1 М NaOH (рис. 5б) токи диска (Id) и кольца (Ir) с ростом перенапряжения выходят на плато в случае обоих электрокатализаторов, при этом величины Id и Ir несколько выше на Со‒N–CМСГ-катализаторе, что свидетельствует о его большей активности в РВК, но и с относительно большим образованием Н2О2 как интермедиата. В то же время в кислом электролите (рис. 5а) явно выраженное плато для Id наблюдается только для Со–N–CМСГ, причем величина токов на диске, особенно в области больших потенциалов, существенно выше по сравнению с такими для Со–N–CАС. На Со–N–CМСГ-катализаторе токи кольца с увеличением перенапряжения резко возрастают и затем монотонно снижаются (от Е ~ 640 мВ), в то время как для Со–N–CАС характерна куполообразная зависимость Ir–Еd с максимумом ~ 370 мВ, причем величина Ir в 0.5 М H2SO4 для катализатора на основе МСГ существенно ниже, чем для Со–N–CАС, практически во всей исследованной области потенциалов.
Рис. 5.
Поляризационные кривые для GC-электродов, модифицированных Со–N–CАС (1) и Со–N–CМСГ (2) в насыщенных кислородом 0.5 М H2SO4 (а) и 0.1 М NaOH (б) при 1200 об/мин, а также соответствующие зависимости Ir–Еd, полученные при потенциале поляризации Pt-кольца 1400 мВ.
Большая эффективность Со–N–CМСГ, по сравнению с Со–N–CАС, в процессе восстановления кислорода в кислом электролите подтверждается рассчитанными на основании данных ВДЭК величинами Eonset, потенциала полуволны (Е1/2), тафелевского наклона (b), числа электронов, участвующих в электрохимической реакции (n), а также количества образующейся Н2О2 (%Н2О2) для таких электрокатализаторов (табл. 1). Коэффициенты b для Со–N–CМСГ и Со–N–CАС определяли по тангенсу угла наклона прямолинейного участка зависимостей η–Id, построенных на основании соответствующих поляризационных кривых Id–Ed (рис. 5а), записанных при скорости вращения электрода 1200 об/мин, скорости сканирования потенциала 5 мВ/с в области 1000–0 мВ. В 0.5 М H2SO4Eonset и Е1/2 для Со–N–CМСГ превышают соответствующие значения для Со–N–CАС на ~55 и 180 мВ соответственно, а b для катализатора на основе МСГ более чем 2 раза ниже, чем для Со–N–CАС (табл. 1). Наблюдаемые отличия в электрокаталитических свойствах Со–N–CМСГ и Со–N–CАС могут быть связаны с доминированием в составе таких катализаторов различных активных центров (Co9S8, CoNx, C/Nx), на которых проходит адсорбция, активация и каталитические превращения О2. На разный вклад активных центров и, как следствие, на различный механизм РВК на таких электрокатализаторах может указывать, в частности, и существенное отличие в величинах b для Со–N–CМСГ и Со–N–CАС (табл. 1). Согласно известным теоретическим представлениям [28], при тафелевском наклоне ~120 мВ/порядок скорость РВК лимитируется электрохимической стадией переноса первого электрона, а ~60 мВ/порядок – миграцией адсорбированных интермедиатов кислорода на катализаторах. Учитывая полученные значения b для Со–N–CМСГ и Со–N–CАС (71 и 158 мВ/порядок, соответственно) можно предположить, что восстановление кислорода на первом катализаторе контролируется одновременно переносом заряда и миграцией интермедиатов, а на втором – ввиду заметного превышения b величины 120 мВ/порядок – адсорбцией кислорода на активных центрах [35].
Таблица 1.
Электрохимические характеристики Со–N–CМСГ- и Со–N–CАС-катализаторов в РВК, рассчитанные на основании результатов исследований методом ВДЭК в разных электролитах
| Катализатор | Еonset, мВ | Е1/2, мВ | b, мВ/порядок | %Н2О2 | n | 4e% |
|---|---|---|---|---|---|---|
| 0.5 М H2SO4 | ||||||
| Со–N–CМСГ | 775 | 680 | 71 | 6 | 3.9 | 94 |
| Со–N–CАС | 720 | 500 | 158 | 16 | 3.7 | 84 |
| 0.1 М NaOH | ||||||
| Со–N–CМСГ | 900 | 830 | 71 | 6 | 3.9 | 94 |
| Со–N–CАС | 900 | 840 | 64 | 4 | 3.9 | 95 |
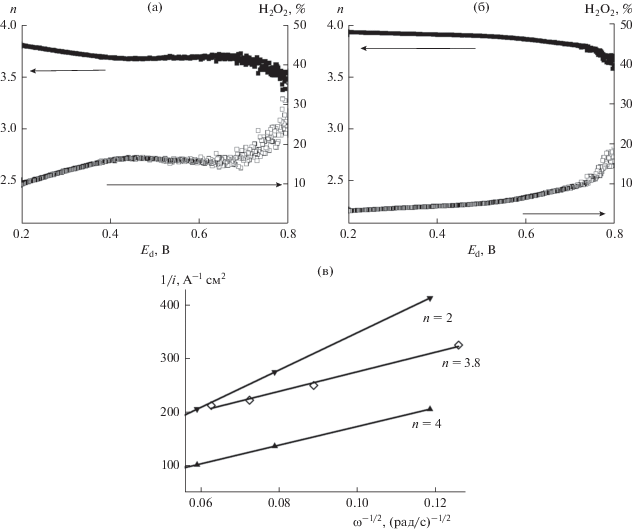
На рис. 6 приведены зависимости n и %Н2О2 от потенциала для полученных катализаторов, согласно которым среднее значение n (уравнение (1)) для Со–N–CМСГ в диапазоне потенциала 200–800 мВ составляет 3.9, а количество образовавшейся перекиси водорода (уравнение (3)) не превышает 20% (среднее значение – 6%), тогда как для катализатора Со–N–CАС среднее значение n – 3.7, а %Н2О2 при невысоком перенапряжении достигает ~ 30% (среднее значение – 16%). Следует также отметить, что значение n ~ 3.8, рассчитанное нами для Со–N–CМСГ-катализатора на основании уравнения Коутецкого–Левича (уравнение (3), рис. 6в) при потенциале 600 мВ (диффузионно-кинетическая область) является сопоставимым с установленным методом ВДЭК. Учитывая полученные результаты, можно предположить, что в кислом электролите на обоих катализаторах доминирующим является прямое 4‑электронное восстановление кислорода до воды, а имеющий место небольшой вклад 2-электронного процесса снижается с увеличением перенапряжения. Рассчитанная по уравнению (2) доля электронов, принимающих участие в 4‑электронном процессе (4е%) для Со–N–CМСГ- и Со–N–CАС-катализаторов, составляет 94 и 84%, соответственно.
Рис. 6.
Зависимости n–Еd и %Н2О2–Еd для Со–N–CАС- (а) и Со–N–CМСГ- (б) катализаторов, построенные на основании результатов исследований методом ВДЭК в насыщенной кислородом 0.5 М H2SO4. Скорость вращения электрода 1200 об/мин; в – зависимости Коутецкого–Левича для Со–N–CМСГ-катализатора (Е = 600 мВ), а также теоретически рассчитанные для n = 2 и n = 4.
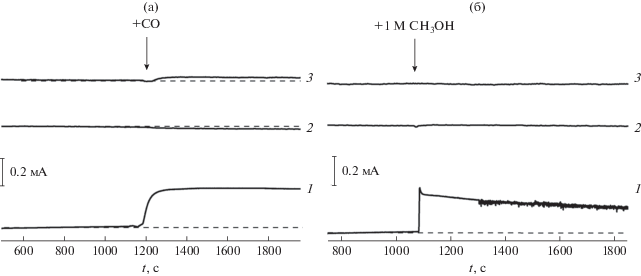
Помимо электрокаталитической эффективности в РВК, стабильность катализаторов также является важным фактором, обуславливающим перспективы их практического применения. В связи с этим представляло интерес сравнить толерантность Со–N–CМСГ, Со–N–CАС и Pt/C к СО и метанолу, которые способны отравлять катализаторы РВК в условиях работы водородных и метанольных топливных элементов. Как видно из приведенных на рис. 7б хроноамперограмм, после добавления 1.0 М метанола в насыщенную кислородом 0.5 М H2SO4 плотность тока для Со–N–CМСГ и Со–N–CАС, в отличие от Pt/C, остается практически неизменной, указывая на хорошую толерантность полученных катализаторов к CH3OH. Подобный эффект имеет место и при введении в электролит СО (рис. 7а), подтверждая высокую стабильность Со-содержащих катализаторов к монооксиду углерода, однако в этом случае для Со–N–CАС-катализатора все же наблюдается незначительное уменьшение плотности тока. Частичное отравление Со–N–CАС, может быть связано с блокировкой СО некоторой части металлсодержащих активных центров [36], а отсутствие такого эффекта в случае Со–N–CМСГ косвенно подтверждает высказанное выше предположение о различном соотношении в составе указанных катализаторов таких центров (Co9S8, CoNx), которые в свою очередь могут отличаться способностью к взаимодействию с монооксидом углерода.
Рис. 7.
Влияние добавок СО (а) и CH3OH (б) в электролит на вид хроноамперограмм Pt/C (1) (Е = 700 мВ), Со–N–CМСГ- (2) (Е = 700 мВ) и Со–N–CАС- (3) (Е = 600 мВ) катализаторов в насыщенной кислородом 0.5 М H2SO4. Скорость вращения электрода – 1600 об/мин.
При переходе от кислого к щелочному электролиту активность в РВК электрокатализаторов Со–N–CМСГ и, особенно, Со–N–CАС увеличивается, что находит свое отражение в анодном сдвиге соответствующих значений Eonset и Е1/2, уменьшении b и %Н2О2 (для Со–N–CАС), а также увеличении n и 4е% (табл. 1, рис. 8). В 0.1 М NaOH характеристики в РВК полученных электрокатализаторов являются близкими между собой и сопоставимыми с такими для известных аналогов [20], причем активность Со–N–CАС в указанном процессе является даже несколько большей, чем у Со–N–CМСГ. Интересно отметить значительные различия в активности катализатора на основе АС в кислом и щелочном электролитах (табл. 1). Причина наблюдаемых различий может быть связана с тем, что в 0.1 М NaOH высокую активность в РВК могут обеспечивать не только CoNx-центры, но и Co9S8- [33] и C/Nx-центры [37], являющиеся менее эффективными в кислом электролите. Можно предположить, что последние доминируют в составе Со–N–CАС-катализатора, в то время как основной вклад в активность катализатора на основе МСГ вносят CoNx-центры.
Рис. 8.
Зависимости n–Еd и %Н2О2–Еd для Со–N–CАС- (а) и Со–N–CМСГ- (б) катализаторов, построенные на основании результатов исследований методом ВДЭК в насыщенной кислородом 0.1 М NaOH. Скорость вращения электрода – 1200 об/мин.
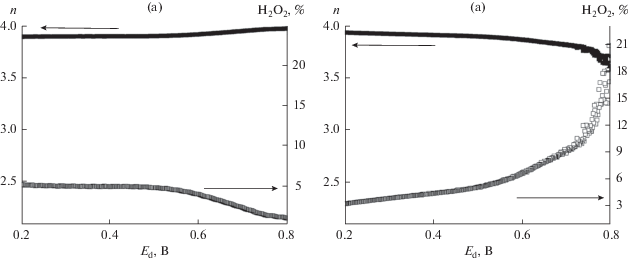
Близкие величины тафелевского наклона для Со–N–CМСГ и Со–N–CАС в щелочном электролите (табл. 1) могут свидетельствовать о сходном механизме РВК на обоих электрокатализаторах в 0.1 М NaOH, причем восстановление кислорода на катализаторе на основе АС в большей степени контролируется диффузией интермедиатов на поверхности по сравнению с переносом заряда, чем в случае Со–N–CМСГ. На основании рассчитанных значений n и зависимости %Н2О2–Ed для исследованных катализаторов (рис. 8) можно предположить, что в щелочном электролите, как и в кислом, процесс восстановления кислорода проходит преимущественно по прямому 4-электронному механизму (4е% для Со–N–CМСГ- и Со–N–CАС-катализаторов составляет 94 и 95%, соответственно).
Как известно, Me–N–C-электрокатализаторы могут проявлять бифункциональную природу, обладая активностью не только в РВК, но и в реакции выделения водорода (РВВ) [20, 21, 34] – важном процессе получения Н2 высокой чистоты из воды. Для выяснения проявления возможной электрокаталитической активности синтезированных нами Со–N–CМСГ и Со–N–CАС в РВВ методом вольтамперометрии с линейной разверткой потенциала были проведены исследования GC-электрода, модифицированного указанными композитами в 0.5 М H2SO4 и 1.0 М NaOH (рис. 9). На основе полученных данных были построены поляризационные кривые в тафелевских координатах (рис. 9, вставки) и рассчитаны основные кинетические параметры РВВ (b и ток обмена j0) в соответствии с уравнением Тафеля (уравнение (5)).
Рис. 9.
Поляризационные кривые и поляризационные кривые в тафелевских координатах (вставки), полученные с учетом IR-компенсации в 0.5 М H2SO4 (а) и 1.0 М NaOH (б) для GC-электродов, модифицированных Со–N–CМСГ (1) и Со–N–CАС (2).
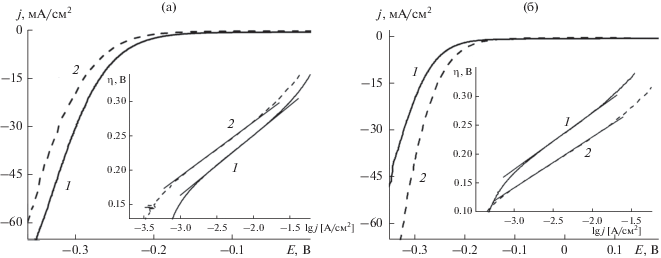
Как следует из приведенных на рис. 9а поляризационных кривых, в кислом электролите Со–N–CМСГ как электрокатализатор РВВ характеризуется более положительной величиной Eonset и меньшим перенапряжением при 10 мА/см2 (η10) по сравнению Со–N–CАС (табл. 2). Кроме того, в 0.5 М H2SO4 катализатор на основе МСГ также превосходит Со–N–CАС по величине j0 (табл. 2). В то же время установленное в кислом электролите существенное преимущество Со–N–CМСГ как электрокатализатора РВК по сравнению с Со–N–CАС (табл. 1) не является столь очевидным в РВВ. В частности, рассчитанная величина тафелевского наклона для катализатора на основе АС оказалась несколько меньшей, чем для Со–N–CМСГ (табл. 2).
Таблица 2.
Параметры РВВ на Со–N–CМСГ- и Со–N–CАС-электрокатализаторах в разных электролитах
| Катализатор | Еonset, мВ | b, мВ/порядок | j0, А/см2 × 105 | η10, мВ |
|---|---|---|---|---|
| 0.5 М H2SO4 | ||||
| Со–N–CМСГ | –180 | 86 | 1.1 | 250 |
| Co–N–CАС | –185 | 78 | 36.0 | 275 |
| 1.0 М NaOH | ||||
| Со–N–CМСГ | –195 | 100 | 2.1 | 255 |
| Со–N–CАС | –130 | 87 | 2.6 | 225 |
Напротив, в щелочном электролите лучшие характеристики в РВВ, как и в РВК, присущи катализатору Со–N–CАС (табл. 1 и 2). По сравнению с Со–N–CМСГ катализатор на основе АС характеризуется в 1.0 М NaOH анодным сдвигом Eonset на 65 мВ, меньшей на 30 мВ величиной η10, в ~1.2 раза большим j0 и меньшей на 13 мВ/порядок величиной b (рис. 8б, табл. 2). Учитывая общую тенденцию для полученных катализаторов в РВК и РВВ (большую активность в кислом электролите для Со–N–CМСГ, а в щелочном – для Со–N–CАС), можно предположить, что в обоих процессах задействованы одни и те же центры катализаторов, причем природа доминирующих активных центров в Со–N–CМСГ и Со–N–CАС различна.
На основании рассчитанных нами тафелевских наклонов для Со–N–CМСГ и Со–N–CАС (табл. 2) и известных представлений о протекании РВВ в кислых и щелочных электролитах [38] можно предположить, что выделение водорода на полученных нами электрокатализаторах проходит по механизму Фольмера–Гейровского, причем учитывая рассчитанные нами значения b, можно допустить, что скорости реакции первичного разряда (стадия Фольмера) и реакции десорбции являются соизмеримыми, что обусловливает промежуточные значения b между характерными для этих стадий 39 и 116 мВ/порядок.
ЗАКЛЮЧЕНИЕ
Таким образом, использование солей ряда ароматических карбоновых кислот при проведении электрохимической эксфолиации графита в условиях электролиза с импульсным изменением потенциала поляризации электрода позволяет получать МСГ и предохраняет графеновые листы от нежелательного окислительного воздействия кислородсодержащих радикалов, в частности ∙ОН, образующихся при электролизе воды на графитовом аноде.
Показана возможность применения электрохимически полученного МСГ для формирования несодержащего благородных металлов карбонизированного Co–N–CМСГ-электрокатализатора РВК, характеризующегося толерантностью к СО и метанолу. Установлено, что такой электрокатализатор проявляет высокую активность не только в РВК, но и в РВВ, причем в обоих процессах его функциональные характеристики в водной 0.5 М H2SO4 превышают установленные для аналога на основе АС. Одной из причин наблюдаемых отличий в электрокаталитических свойствах Со–N–CМСГ и Со–N–CАС, которые для РВК в значительно большей степени имеют место в кислом электролите, а для РВВ – в щелочном, может быть различная природа доминирующих активных центров (Co9S8, CoNx, C/Nx) в составе таких катализаторов, причем одни и те же центры в Со‒N–CМСГ и Со–N–CАС, по-видимому, задействованы в РВК и РВВ.
Список литературы
Zhong, Y.L., Tian, Z., Simon, G.P., and Li, D., Scalable production of graphene via wet chemistry: progress and challenges, Mater. Today, 2015, vol. 18, no. 2, p. 73.
Paredes, J.I. and Munuera, J.M., Recent advances and energy-related applications of high quality/chemically doped graphenes obtained by electrochemical exfoliation methods, J. Mater. Chem. A, 2017, vol. 5, p. 7228.
Ambrosi, A. and Pumera, M., Exfoliation of layered materials using electrochemistry, Chem. Soc. Rev., 2018, vol. 47, no. 19, p. 7213.
Parvez, K., Li, R., Puniredd, S.R., Hernandez, Y., Hinkel, F., Wang, S., Feng, X., and Müllen, K., Electrochemically exfoliated graphene as solution-processable, highly conductive electrodes for organic electronics, ACS Nano, 2013, vol. 7, no. 4, p. 3598.
Liu, J., Poh, C.K., Zhan, D., Lai, L., Lim, S.H., Wang, L., Liu, X., Sahoo, N.G., Li, C., Shen, Z., and Lin, J., Improved synthesis of graphene flakes from the multiple electrochemical exfoliation of graphite rod, Nano Energy, 2013, vol. 2, no. 3, p. 377.
Qi, B., He, L., Bo, X., Yang H., and Guo, L., Electrochemical preparation of free-standing few-layer graphene through oxidation–reduction cycling, Chem. Eng. J., 2011, vol. 171, no. 1, p. 340.
Rao, K.S., Senthilnathan, J., Liu, Y.-F., and Yoshimura, M., Role of peroxide ions in formation of graphene nanosheets by electrochemical exfoliation of graphite, Sci. Rep., 2014, vol. 4, p. 4237.
Parvez, K., Wu, Z.-S., Li, R., Liu, X., Graf, R., Feng, X., and Müllen, K., Exfoliation of graphite into graphene in aqueous solutions of inorganic salts, J. Amer. Chem. Soc., 2014, vol. 136, no. 16, p. 6083.
Кривенко, А.Г., Манжос, Р.А., Комарова, Н.С., Коткин, А.С., Кабачков, Е.Н., Шульга, Ю.М. Сравнительное исследование графита и продуктов его электрохимического расщепления. Электрохимия. 2018. Т. 54. C. S32. [Krivenko, A.G., Manzhos, R.A., Komarova, N.S., Kotkin, A.S., Kabachkov, E.N., and Shul’ga, Yu.M., Comparative Study of Graphite and the Products of Its Electrochemical Exfoliation, Russ. J. Electrochem., 2018, vol. 54, p. 825.]
Mahanandia, P., Simon, F., Heinrich, G., and Nanda, K.K., An electrochemical method for the synthesis of few layer graphene sheets for high temperature applications, Chem. Commun., 2014, vol. 50, no. 35, p. 4613.
Ustavytska, O., Kurys, Ya., Koshechko, V., and Pokhodenko, V., One-step electrochemical preparation of multilayer graphene functionalized with nitrogen, Nanoscale Res. Lett., 2017, vol. 12, p. 175.
Zhou, N., Wang, N., Wu, Z., and Li, L., Probing active sites on metal-free, nitrogen-doped carbons for oxygen electroreduction: a review, Catalysts, 2018, vol. 8, p. 509.
Yan, X., Jia, Y., and Yao, X., Defects on carbons for electrocatalytic oxygen reduction, Chem. Soc. Rev., 2018, vol. 47, p. 7628.
Тарасевич, М.Р., Давыдова, Е.С. Неплатиновые катодные катализаторы для топливных элементов со щелочным электролитом (обзор). Электрохимия. 2016. Т. 52. С. 227. [Tarasevich, M.R. and Davydova, E.S., Nonplatinum cathodic catalysts for fuel cells with alkaline electrolyte (Review), Russ. J. Electrochem., 2016, vol. 52, p. 193.]
Kurys, Ya.I., Ustavytska, O.O., Koshechko, V.G., and Pokhodenko, V.D., Structure and electrochemical properties of multilayer graphene prepared by electrochemical exfoliation of graphite in presence of benzoate ions, RSC Adv., 2016, vol. 6, no. 42, p. 36050.
Органическая электрохимия, Кн. 1, под ред. Бейзера, М.М. и Лунда, X., М.: Химия, 1988. 469 с. [Organic electrochemistry: an introduction and a guide, 2nd ed., ed. by Baizer, M.M. and Lund, H., N. Y.: Marcel Dekker, 1983, 1166 p.]
Anodic Oxidation. Organic Chemistry: A Series of Monographs, vol. 32, Eds. Ross, S.D., Finkelstein, M., and Rudd, E.J., N. Y.: Acad. Press INC., 1975. 339 p.
Linstead, R.P., Shephard, B.R., and Weedon, B.C.L., Anodic syntheses. Part VII. Electrolyses of mono-, di-, and tri-phenylacetic acids in non-aqueous solutions, J. Chem. Soc., 1952, p. 3624.
Sandhwar V.K. and Prasad B., A comparative study of electrochemical degradation of benzoic acid and terephthalic acid from aqueous solution of purified terephthalic acid (PTA) wastewater, J. Water Process Eng., 2019, vol. 30, 100381.
Zhu, Y.P., Guo, C., Zheng, Y., and Qiao, S.-Z., Surface and interface engineering of noble-metal-free electrocatalysts for efficient energy conversion processes, Acc. Chem. Res., 2017, vol. 50, no. 4, p. 915.
Liu, K., Zhong, H., Meng, F., Zhang, X., Yan, J., and Jiang, Q, Recent advances in metal–nitrogen–carbon catalysts for electrochemical water splitting, Mater. Chem. Front., 2017, vol. 1, no. 11, p. 2155.
Gewirth, A.A., Varnell, J.A., and DiAscro, A.M., Nonprecious metal catalysts for oxygen reduction in heterogeneous aqueous systems, Chem. Rev., 2018, vol. 118, no. 5, p. 2313.
He, Y., Tan, Q., Lu, L., Sokolowski J., and Wu G., Metal–Nitrogen–Carbon catalysts for oxygen reduction in PEM fuel cells: self-template synthesis approach to enhancing catalytic activity and stability, Electrochem. Energ. Rev., 2019, vol. 2, no. 2, p. 231.
Kovtyukhova, N.I., Ollivier, P.J., Martin, B.R., Mallouk, T.E., Chizhik, S.A., Buzaneva, E.V., and Gorchinskiy, A.D., Layer-by-layer assembly of ultrathin composite films from micron-sized graphite oxide sheets and polycations, Chem. Mater., 1999, vol. 11, no. 3, p. 771.
Парийская, Е.А., Мазур, Д.О., Курысь, Я.И., Кошечко, В.Г., Походенко, В.Д. Влияние условий формирования на активность Co–N–C электрокатализаторов на основе поли-м-фенилендиамина в процессе восстановления кислорода. Теорет. эксперим. химия, 2018. Т. 54. № 6. С. 356. [Pariiska, O.O., Mazur, D.O., Kurys, Ya.I., Koshechko, V.G., and Pokhodenko V.D., Effect of the formation conditions on the activity of Co–N–C electrocatalysts derived from poly-m-phenylenediamine in the reduction of oxygen, Theor. Exp. Chem., 2019, vol. 54, no. 6, p. 386.]
Rosenau, C.P., Jelier, B.J., Gossert, A.D., and Togni, A., Exposing the origins of irreproducibility in fluorine NMR spectroscopy, Angew. Chem. Int. Ed., 2018, vol. 57, p. 1.
Munuera, J.M., Paredes, J.I., Villar-Rodil, S., Ayán-Varela, M., Martínez-Alonso, A., and Tascón J.M.D., Electrolytic exfoliation of graphite in water with multifunctional electrolytes: en route towards high quality, oxide-free graphene flakes, Nanoscale, 2016, vol. 8, p. 2982.
Lu, J., Yang, J., Wang, J., Lim, A., Wang, S., and Loh, K.P., One-pot synthesis of fluorescent carbon nanoribbons, nanoparticles, and graphene by the exfoliation of graphite in ionic liquids, ACS Nano, 2009, vol. 3, no. 8, p. 2367.
Das, A., Chakraboty, B., and Sood, A.K., Raman spectroscopy of graphene on different substrates and influence of defects, Bull. Mater. Sci., 2008, vol. 31, no. 3, p. 579.
Min, Y., Shen, Z., Zhang, X., and Ma, S., Achieving concentrated graphene dispersions in water/acetone mixtures by the strategy of tailoring Hansen solubility parameters, J. Phys. D: Appl. Phys., 2013, vol. 46, no. 2, p. 025301.
López, V., Sundaram, R.S., Gómez-Navarro, C., Olea, D., Burghard, M., Gómez-Herrero, J., Zamora, F., and Kern, K., Chemical vapor deposition repair of graphene oxide: a route to highly-conductive graphene monolayers, Adv. Mater., 2009, vol. 21, no. 46, p. 4683.
Mattevi, C., Eda, G., Agnoli, S., Miller, S., Mkhoyan, K.A., Celik, O., Mastrogiovanni, D., Granozzi, G., Garfunkel, E., and Chhowalla, M., Evolution of electrical, chemical, and structural properties of transparent and conducting chemically derived graphene thin films, Adv. Funct. Mater., 2009, vol. 19, no. 16, p. 2577.
Wang, S., Dou, S., Tao, L., Huo, J., and Dai, L., Etched and doped Co9S8/graphene hybrid for oxygen electrocatalysis, Energy Environ. Sci., 2016, vol. 9, p. 1320.
Zhang, L., Liu, W., Dou, Y., Du., Z., and Shao, M., The role of transition metal and nitrogen in Metal–N–C composites for hydrogen evolution reaction at universal pHs, J. Phys. Chem. C, 2016, vol. 120, no. 51, p. 29047.
Wang, X., Ke, Y., Pan, H., Ma, K., Xiao, Q., Yin, D., Wu, G., and Swihart, M.T., Cu-deficient plasmonic Cu2–xS nanoplate electrocatalysts for oxygen reduction, ACS Catal., 2015, vol. 5, no. 4, p. 2534.
Zhang, Q., Mamtani, K., Jain, D., Ozkan, U., and Asthagiri, A., CO poisoning effects on FeNC and CNx ORR catalysts: A combined experimental–computational study, J. Phys. Chem. C, 2016, vol. 120, no. 28, p. 15173.
Zhang, J., Chen, G., Müllen, K., and Feng, X., Carbon-rich nanomaterials: Fascinating hydrogen and oxygen electrocatalysts, Adv. Mater., 2018, vol. 30, 1800528.
Shinagawa, T., Garcia-Esparza, A.T., and Takanabe, K., Insight on Tafel slopes from a microkinetic analysis of aqueous electrocatalysis for energy conversion, Sci. Rep., 2015, vol. 5, 13801.
Дополнительные материалы отсутствуют.


