Электрохимия, 2020, T. 56, № 5, стр. 397-406
Электрохимическая иммобилизация наночастиц серебра в полиметилолакриламидную матрицу
Е. В. Щитовская a, b, *, Л. Г. Колзунова a, **, М. А. Карпенко a
a Федеральное государственное бюджетное учреждение науки Институт химии Дальневосточного отделения РАН
690022 Владивосток, просп. 100-летия Владивостока, 159, Россия
b Дальневосточный федеральный университет
690950 Владивосток, ул. Суханова, 8, Россия
* E-mail: schitovskaya.ev@dvfu.ru
** E-mail: kolzunova@ich.dvo.ru
Поступила в редакцию 27.02.2019
После доработки 09.04.2019
Принята к публикации 09.09.2019
Аннотация
Исследованы возможности электрохимического получения нанокомпозита полимер/наночастицы серебра. Формирование композита проводили в две стадии, включающие синтез полиметилолакриламидной пленки методом электрополимеризации и последующую иммобилизацию наночастиц серебра в полимерную матрицу методом электрохимического восстановления ионов металла до Ag0 в пленке, пропитанной раствором AgNO3. Исследованы физические, химические, электрохимические и каталитические характеристики гибридных материалов. Наличие Ag0 в полимере подтверждено как визуально, так и методами рентгенофазового анализа, плазмонного резонанса, сканирующей электронной микроскопии, энергодисперсионного и атомно-абсорбционного анализов. Определены оптимальные режимы электрохимической иммобилизации наночастиц Ag0 в полимер. Изучено влияние скорости развертки потенциала, числа циклов и концентрации AgNO3 на полноту восстановления Ag+ и количество иммобилизованного в композит серебра. Установлено, что электровосстановление Ag+ до Ag0 происходит преимущественно в первом цикле. Методом малоуглового рентгеновского рассеяния получены функции распределения частиц серебра по радиусам. Установлено, что средний диаметр наночастиц Ag составляет около 20 нм. Обнаружено, что полимерные метилолакриламидные пленки, содержащие наночастицы серебра, проявляют электрокаталитическую активность по отношению к пероксиду водорода.
ВВЕДЕНИЕ
Гибридные материалы металл–полимер все активнее используются в мировой практике. Спрос на них постоянно растет, что вызвано тем, что эти материалы сочетают оптимальные свойства полимеров и неорганических частиц [1–12]. Кроме того, объединение полимеров с другими материалами может приводить к появлению новых свойств, не характерных для отдельных компонентов композита. В качестве полимерной матрицы можно использовать как проводящие полимеры (полианилин, полипиррол, политиофен и их производные [3]), так и непроводящие полимеры (полиметилолакриламид [4]). В качестве неорганических наполнителей могут служить наночастицы благородных металлов (Au, Ag, Pt и Pd), а также Cu, Ni, Fe, Co, графен [6] и оксиды металлов (SnO2, Fe3O4) [8, 9]. Особое внимание привлекают композиты на основе полимеров с включением наночастиц благородных металлов. Такие материалы перспективны для применения как эффективные катализаторы химических, электрохимических и фотохимических реакций [10–20].
Особое место среди металлополимерных композитов занимают материалы с включением наночастиц серебра (AgNPs). Области применения таких материалов преимущественно включают медицину [16–25], а также используются для производства оптических, химических, биологических сенсоров и катализаторов [21–25]. Такие материалы активно используют в качестве электрохимических сенсоров для определения пероксида водорода, образующегося в процессе биологических и фермент-катализируемых реакций, тщательный контроль за протеканием которых очень важен [13, 14, 22].
Наночастицы серебра вводят в полимерную матрицу для их механического закрепления. Обычно процесс получения таких материалов является многостадийным и довольно сложным. Поэтому необходим поиск более простых и доступных технологических решений. С этих позиций, на наш взгляд, перспективным является метод электрополимеризации мономеров с последующим электрохимическим либо химическим восстановлением ионов серебра до AgNPs непосредственно в полимерной матрице. Можно предположить, что такой подход позволит сократить общее время получения композитов полимер–серебро, равномерно распределить AgNPs в слое полимера, предотвратить или уменьшить слипание (агрегацию) частиц серебра внутри фиксирующего полимерного слоя. В качестве полимерной матрицы мы предлагаем использование пленок полиметилолакриламида (ПМАА), синтез которых методом электрополимеризации (ЭП), их молекулярная и объемная структура нами хорошо изучены [26–28]. В этом случае иммобилизация AgNPs в химически и электрохимически устойчивую полимерную матрицу является наиболее предпочтительной, поскольку такая матрица не оказывает дестабилизирующего действия на наночастицы серебра, не взаимодействуя с ним.
Основными методами формирования композитов полимер–наночастицы металлов являются химическая металлизация полимеров и осадительная полимеризация в присутствии металлических коллоидов. Однако оба этих метода технически несовершенны, многостадийны, трудоемки. Альтернативой может являться электрохимическое формирование полимерной матрицы с последующей химической или электрохимической иммобилизацией в нее наночастиц серебра. Метод значительно упрощает технологию и сокращает время получения композита до нескольких минут. В работах [29, 30] нами было показано, что композит ПМАА/AgNPs может быть сформирован по двухстадийному способу, который включает ЭП полиметилолакриламидной пленки и последующее химическое восстановление серебра в матрице, насыщенной раствором AgNO3. Однако восстановление серебра может быть выполнено и электрохимически. Данные по такому восстановлению в литературе отсутствуют. Поэтому целью настоящего исследования является изучение альтернативной возможности электрохимической иммобилизации AgNPs в электрополимеризованную ПМАА-матрицу и изучение физико-химических, электрохимических и каталитических характеристик полученных гибридных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для формирования полиметилолакриламидных пленок использовали акриламид 2K (99%) и N,N′-метилен-бис-акриламид (99%) (Acros, США) без дополнительной очистки. Формальдегид ФМ в/с (НеваРеактив, Россия) использовали в виде 29–31% предварительно перегнанного раствора. Массовую долю формальдегида определяли по ГОСТ 1625-89 [31]. Хлорид цинка (Pharmpur, Испания) использовали в виде 2–4 М раствора с pH 3–4. Точную концентрацию хлорида цинка устанавливали комплексонометрическим титрованием трилоном Б стандарт-титр (УралХимИнвест, Россия). Нитрат серебра, 99.98% “ч. д. а.” (РЕАХИМ, Россия), использовали для иммобилизации ионов серебра. Электрохимическое восстановление Ag+ до Ag0 проводили в 0.1 М растворе нитрата калия “ос. ч.” (НеваРеактив, Россия).
Растворы мономерных композиций для получения полимерных пленок готовили непосредственно перед началом эксперимента. В качестве растворителя использовали деионизированную воду.
Электрохимические измерения и синтез полимеров и композитов проводили с использованием потенциостатов–гальваностатов IPC-Pro 8.0 (Cronas, Россия) и Solartron (Великобритания). Ячейку подключали к потенциостату по трехэлектродной схеме. Рабочим электродом (катодом) служил стержень из нержавеющей стали (НС) марки AISI 314, ∅ = 2.5 мм, вспомогательным (анодом) – платиновая пластина S = 7.5 см2. В качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод ЭВЛ‑1М3, отделенный от раствора электролитическим ключом. Рабочие электроды предварительно полировали и обезжиривали пастой из мелкодисперсного оксида магния, тщательно промывали дистиллированной водой. Электролиз проводили в стеклянных ячейках объемом 10–20 см3 без дегазации и без разделения анодного и катодного пространства. Формирование полимерных пленок проводили из электролита, состав которого приведен в табл. 1. Растворение подслоя цинка, осаждающегося на катоде одновременно с формированием полимерного слоя, осуществляли в 0.1 М HCl.
Таблица 1.
Состав мономерной композиции для электрополимеризации
| Компоненты мономерной композиции | Концентрация, М |
|---|---|
| Акриламид | 3.00 |
| N,N′-метилен-бис-акриламид | 0.05 |
| Формальдегид | 3.00 |
| Хлорид цинка | 0.20 |
Внедрение ионов серебра в полимер проводили путем погружения электрода с ПМАА-пленкой в раствор AgNO3 (концентрация 10–3–10–2 М). Восстановление Ag+ до Ag0 осуществляли в 0.1 М KNO3 при 5–10-кратном циклировании потенциала в диапазоне (100–450) мВ при различных скоростях развертки потенциала.
Исследование структуры, морфологии, микрорельефа полимерных пленок проводили на сканирующих автоэмиссионных электронных микроскопах TM300 и S5500 (Hitachi, Япония). Локальное содержание серебра, иммобилизованного в полимерную пленку, определяли на энергодисперсионном спектрометре Thermo Scientific (США), установленном в виде приставки к микроскопу Hitachi S5500 (Япония).
Количество серебра, электровосстановленного в ПМАА-матрице и на поверхности катода, определяли методом атомно-абсорбционного анализа на приборе SOLAAR M-series (Thermo, США). Для отделения пленки ПМАА/AgNPs от рабочего электрода стержень из нержавеющей стали с композитным покрытием помещали в горячую деионизованную воду, в результате чего полимерная пленка, содержащая частицы серебра, набухала и отделялась от рабочего электрода. Затем серебро, осажденное на НС и восстановленное в ПМАА, отдельно растворяли в горячей концентрированной (65%) азотной кислоте. Рентгенофазовый анализ выполняли на дифрактометре Advance D-8 (Bruker, Германия) на полимерной пленке, нанесенной на стеклянную кювету.
Спектры плазмонного резонансного поглощения композитных пленок снимали на спектрофотометре Shimadzu UV-2550 (Япония). Распределение частиц серебра в полимере устанавливали с помощью малоуглового рентгеновского рассеяния (МУРР) на дифрактометре Hecuss 3-Micro-Pix (Австрия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как следует из [26–28], наиболее изученными композициями для формирования покрытий и пленок на металлах методом ЭП являются составы на основе водных растворов акриламида (АА) и его производных. Получаемые пленки ПМАА являются неэлектропроводными, что исключает прямое электровосстановление металлов на их поверхности. Одним из способов модификации таких пленок является иммобилизация в них частиц различных металлов с целью создания композиционных материалов с новыми свойствами. Нами было показано [4, 32], что создание таких композитов возможно в одну стадию, вводя соли золотохлористоводородной или платинохлористоводородной кислоты непосредственно в раствор мономеров. В результате на катоде происходит формирование полимерной пленки в процессе электрополимеризации и одновременное электровосстановление частиц металла, захватываемых растущей полимерной матрицей. Такой подход невозможен при иммобилизации серебра в матрицу ПМАА, поскольку исходная мономерная композиция содержит в качестве косвенного инициатора добавку ZnCl2 (табл. 1). В результате взаимодействия ионы хлора и серебра образуют нерастворимую в воде соль AgCl. Однако, как показано нами в [29, 30], задача может быть решена через двухстадийную технологию, в соответствии с которой ЭП пленки ПМАА, насыщение ее раствором AgNO3 и химическое восстановление серебра проводят последовательно. В настоящей работе мы исследовали возможности электрохимического внедрения наночастиц серебра в матрицу ПМАА.
Электрохимическое восстановление ионов серебра в полимере
Сформированные на нержавеющей стали ПМАА покрытия промывали деионизированной водой, помещали в 0.1 М HCl для удаления подслоя цинка, восстановленного в процессе электрополимеризации. Затем тщательно промытые пленки выдерживали в 10–3–10–2 М AgNO3 в течение 48–120 ч.
Электрохимическое восстановление ионов серебра Ag+ до Ag0 проводили циклированием потенциалов в области 100–450 мВ. Указанный интервал потенциалов был выбран исходя из данных поляризационных зависимостей, полученных в 0.1 М KNO3 с добавкой 10–3 М AgNO3, из которых следует, что в этом диапазоне потенциалов может быть достигнута максимальная скорость (плотность тока) электровосстановления серебра как на чистом катоде при Eмакс = 215 мВ (рис. 1, кривая 1*), так и на катоде с пленкой ПМАА при Емакс = 116 мВ (рис. 1, кривая 2*). Такой подход позволил, во-первых, исключить протекание побочных процессов разложения фонового электролита KNO3 и воды, поскольку, как следует из рис. 1, в выбранном диапазоне потенциалов материал катода (рис. 1, кривая 1) и ПМАА-пленка (рис. 1, кривая 2) инертны по отношению к фону KNO3. Во-вторых, в указанных условиях не происходит растворение либо окисление свежеосажденного серебра при развертке потенциала в анодную область.
Рис. 1.
Катодные поляризационные кривые для нержавеющей стали (1, 1*) и композитного электрода с серебром (2, 2*) в 0.1 М растворе нитрата калия (1, 2) и в 0.1 М растворе нитрата калия с добавкой AgNO3 10–3 М (1*, 2*). Скорость развертки потенциала 20 мВ/с.

Дальнейшие исследования показали, что на чистом катоде при циклическом электровосстановлении серебра в первом цикле потенциал максимума достигает Емакс = 300 мВ, тогда как уже во втором и последующих циклах наблюдается смещение Емакс в анодную область до 312–322 мВ (рис. 2, кривые 1). Такой эффект связан с изменением состояния поверхности катода (нержавеющая сталь) вследствие выделения на нем слоя серебра. Аналогичная зависимость имеет место на катоде, покрытом композитной пленкой ПМАА/AgNPs. В этом случае потенциал максимума смещается с 245 до 265 мВ (рис. 2, кривые 2). Кроме того, как видно из рис. 2, наличие пленки ПМАА на поверхности катода лимитирует процесс электровосстановления серебра, снижая плотность тока максимума первого цикла по сравнению с чистым катодом с 0.96 мА/см2 (рис. 2, кривые 1) до 0.86 мА/см2 (рис. 2, кривые 2). Одновременно потенциал максимума восстановления Ag+ до Ag0 смещается в катодную область на 55 мВ для НС/ПМАА по сравнению с НС (соответственно Емакс = 300 и 245 мВ).
Рис. 2.
Вольт-амперные зависимости в 0.1 М растворе нитрата калия с добавкой 10–3 М AgNO3. Нержавеющая сталь (1), композит полимер/серебро (2). Скорость развертки потенциала 20 мВ/с.

Изучено влияние количества циклов развертки потенциала на полноту восстановления серебра в пленке (рис. 3).
Рис. 3.
Циклические вольтамперограммы восстановления Ag+ (а) и зависимость плотности тока максимума от количества циклов развертки потенциала (б). Концентрация пропитывающего раствора 10–2 М AgNO3; время пропитки 96 ч. Скорость развертки потенциала 20 мВ/с.

Обнаружено, что электровосстановление Ag+ до Ag0 происходит преимущественно в первом цикле (рис. 3а) при максимальной плотности тока (jмакс = 0.85 мА/см2), что составляет 51.8%. Во втором цикле плотность тока снижается в 2.4 раза и составляет 21.3% (jмакс = 0.35 мА/см2), достигая после завершения 5 циклов минимального значения (jмакс = 0.09 мА/см2). Зависимость плотности тока максимума от числа циклов при последовательном циклировании приведена на рис. 3б.
Исследовано влияние концентрации AgNO3 в растворе для пропитки НС/ПМАА-пленки на кинетику электровосстановления серебра (рис. 4а). Обнаружено, что величина максимума плотности тока изменяется практически пропорционально концентрации пропитывающего раствора (рис. 4б).
Рис. 4.
Циклические вольтамперограммы восстановления Ag+ в пленке в 0.1 М KNO3 (а) и зависимость плотности тока максимума (б) от концентрации пропитывающего раствора AgNO3 (М): 10–3 (1), 5 10–3 (2), 10–2 (3). Время пропитки 96 ч. Скорость развертки потенциала 20 мВ/с.

Изучена зависимость массы электровосстановленного серебра в полимерной матрице от концентрации раствора AgNO3, времени пропитки полимера нитратом серебра и скорости циклирования потенциала (табл. 2). Установлено, что при низкой скорости развертки потенциала (10 мВ/с) количество Ag0 в композите увеличивается с ростом исходной концентрации AgNO3 и временем выдержки пленки в растворе нитрата серебра (образцы 1, 2). Увеличение скорости циклирования до 40 мВ/с снижает общую массу восстановленного металла в композите (образцы 3, 4), что может быть связано со смещением выделения осадка Ag0 непосредственно на поверхность катода. При этом процесс более ярко выражен при увеличении продолжительности пропитки полимерной пленки нитратом серебра.
Таблица 2.
Влияние условий электрохимического внедрения серебра в полимерную матрицу на массу восстановленного серебра
| Номер образца п/п | Скорость развертки потенциала, мВ/с | Концентрация AgNO3, М | Время пропитки раствором AgNO3, ч | Масса серебра, мг см–2 |
|---|---|---|---|---|
| 1 | 10 | 0.001 | 96 | 0.0020 |
| 0.005 | 0.0035 | |||
| 0.010 | 0.0052 | |||
| 2 | 10 | 0.001 | 120 | 0.0024 |
| 0.005 | 0.0063 | |||
| 0.010 | 0.0087 | |||
| 3 | 40 | 0.001 | 48 | 0.0009 |
| 0.005 | 0.0019 | |||
| 0.010 | 0.0042 | |||
| 4 | 40 | 0.001 | 144 | 0.0017 |
| 0.005 | 0.0017 | |||
| 0.010 | 0.0038 |
Формирование композита сопровождается изменением окраски пленки от бесцветной до серебристо-серой в зависимости от количества внедренного в композит серебра. Наличие Ag0 в полимере подтверждено методами РФА, плазмонного резонанса, атомной абсорбции и сканирующей электронной микроскопии.
На рис. 5 приведена рентгенограмма пленки, выдержанной в растворе 10–2 М нитрата серебра в течение 96 ч с последующим электрохимическим восстановлением ионов серебра. Как следует из рисунка, полиметилолакриламидная пленка содержит металлическое серебро Ag0, что подтверждается брэгговскими рефлексами в областях: 38.1°; 44.1°; 64.4°; 77.3°; 81.7° [33–35].
Для всех композитных ПМАА/AgNPs-систем, полученных электрохимическим восстановлением серебра, были сняты спектры плазмонного резонансного поглощения влажных пленок в дальней ультрафиолетовой и видимой области (рис. 6). Спектры имеют слабо выраженную полосу поглощения в диапазоне 410–420 нм (плавный пик), в котором регистрируется плазмонный резонанс наночастиц серебра. Форма полосы поглощения свидетельствует о широком диапазоне распределения наночастиц по размеру. По данным работ [36–38], положение максимума полосы плазмонного резонанса при 410 нм и выше в длинноволновую область спектра предполагает, что диаметр полученных наночастиц около 20 нм.
Рис. 6.
Спектры плазмонного резонансного поглощения в дальней ультрафиолетовой и видимой областях в диапазоне 300–900 нм для ПМАА/AgNPs. Концентрация пропитывающего раствора AgNO3 (М): 10–3 (1), 5 × 10–3 (2); 10–2 (3).

Методом МУРР получены функции распределения частиц серебра по радиусам (рис. 7). Вид спектра указывает, что форма частиц близка к сферической. Установлено, что средний радиус AgNPs составляет 11.8 нм (∅ = 23.6 нм), что соответствует данным, полученным другими методами.
Изучение морфологии и элементного состава композитов ПМАА/серебро
Исследование морфологии, элементного состава полимерных пленок, содержащих серебро, проводили методом сканирующей автоэмиссионной электронной микроскопии с приставкой для энергодисперсионного анализа. На рис. 8 приведены СЭМ-изображения поверхности полимерных композитов с включением серебра, восстановленного электрохимическим способом, для границы раздела композит/раствор (внешняя или прирастворная сторона композита) (рис. 8а) и границы раздела композит/электрод (внутренняя или приэлектродная сторона композита (рис. 8б).
Рис. 8.
СЭМ-изображения поверхности композита полимер/серебро: прирастворная сторона пленки (а), приэлектродная сторона (б).

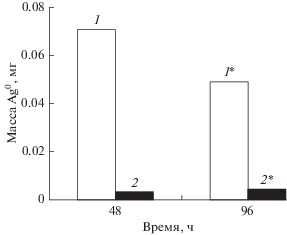
Как видно из микрофотографий, представленных на рис. 8, на внутренней стороне полимера находится меньшее количество частиц серебра, чем на внешней. Это хорошо согласуется с данными энергодисперсионного анализа, в соответствии с которыми среднее количество серебра на внешней поверхности полимера составляет 6.51 ± 0.94 ат. %, а на внутренней стороне – 0.91 ± 0.23 ат. % (определяемые элементы: Cl, P, N, O, C, Zn, Ag). Такой эффект, вероятно, связан с тем, что, во-первых, раствор нитрата серебра, в котором выдерживали полимерные пленки, недостаточно насыщает приэлектродный слой пленки, который, как показано в работе [27], является очень плотным и мелкопористым. Во-вторых, на границе раздела катод/полимерная пленка идет перераспределение серебра на поверхность катода, что подтверждают данные атомно-абсорбционного анализа (рис. 9, 1, 1*). Причем, при увеличении времени выдержки ПМАА в растворе AgNO3 количество Ag0 в пленке (рис. 9, 2, 2*) возрастает в 1.5 раза (рис. 9, 2*) вследствие лучшего насыщения плотного полимерного слоя нитратом серебра. Одновременно происходит снижение массы серебра (в 1.4 раза), восстановленного на катоде из НС (рис. 9, 1*). (Эксперименты выполнены в идентичных условиях при одинаковой площади поверхности рабочего электрода и полимерного композита.) При этом необходимо отметить, что по результатам РФА и атомно-абсорбционного анализа металлическое серебро отсутствует в пленке, выдержанной в растворе AgNO3 без электрохимического восстановления Ag+, что указывает на инертность полимерной матрицы.
Исследование электрохимических свойств ПМАА/AgNPs-электродов
Электрокаталитические свойства электродов НС/ПМАА/AgNPs исследовали в реакции электровосстановления H2O2 в фосфатном буферном растворе (рН 6.68). Предварительно исследовали изменение потенциала электрода без поляризации при контакте с H2O2 (рис. 10). Потенциал погружения оставался неизменным в течение 60 с, после чего вводили пероксид водорода и фиксировали изменение потенциала в течение 180 с, до установления постоянного значения. Скачок потенциала на катоде из чистой НС при контакте с пероксидом водорода составляет 143.7 мВ (рис. 10, кривая 1). На катоде, модифицированном ПМАА-пленкой без серебра, скачок потенциала снижается почти в два раза и составляет 80.8 мВ, поскольку полимерный слой лимитирует диффузию пероксида водорода к электроду (рис. 10, кривая 2). Тогда как для композита НС/ПМАА/AgNPs при контакте с пероксидом водорода скачок потенциала возрастает до 129.5 мВ, что ближе к значению, полученному на НС. Это свидетельствует об участии иммобилизованных в полимерной матрице наночастиц серебра в электрокаталитическом процессе.
Рис. 10.
Изменение потенциала электрода в фосфатном буферном растворе (рН 6.68) при контакте с Н2O2 (0.24 М) без поляризации для электродов: НС (1), НС/ПМАА (2), НС/ПМАА/AgNPs (3).

Исследовали электрокаталитическую активность НС/ПМАА/AgNPs по отношению к пероксиду водорода. Как видно из циклических вольтамперограмм, полученных для композитного электрода в фосфатном буферном растворе (рис. 11, кривая 1) и в присутствии 0.24 М пероксида водорода (рис. 11, кривая 2), в области электрохимического восстановления Н2O2 буферный раствор является электрохимически устойчивым (кривая 1), тогда как при добавлении Н2O2 происходит возрастание плотности тока в катодной области при Е = –0.8 В почти в 6 раз в первом цикле и в 4.5 раза – во втором.
Рис. 11.
Циклические вольтамперограммы для НС/ПМАА/AgNPs в фосфатном буферном растворе (1), и в присутствии 0.24 М H2O2 (2). Скорость развертки потенциала 100 мВ/с.

При последовательном добавлении равного количества H2O2 в ячейку (по 0.24 М) (рис. 12а) выявлена четкая линейная зависимость электрохимического отклика (плотности тока первого цикла электровосстановления H2O2) от концентрации пероксида водорода (R2 = 0.9845) (рис. 12б). На основании полученных результатов можно сделать вывод, что композитный электрод проявляет электрокаталитические свойства в реакции электровосстановления H2O2, что позволит использовать его в качестве соответствующего электрохимического сенсора. Сравнение каталитических характеристик данного композита с ранее полученными результатами для аналогичного композита с химически иммобилизованным серебром [29] показало, что электрохимический отклик исследуемого электрокатализатора на присутствие Н2О2 почти в 1.5 раза выше.
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали возможность электрохимической иммобилизации наночастиц серебра в полиметилолакриламидную матрицу, сформированную методом электрополимеризации.
Включение в композит наночастиц металлического серебра подтверждено методами рентгенофазового анализа, микроскопии, плазмонного резонанса и малоуглового рентгеновского рассеяния. Установлено, что наночастицы серебра имеют сферическую форму, диаметр которых составляет 20–23 нм.
Определены оптимальные условия внедрения наночастиц Ag0 в полимер. Изучено влияние скорости развертки потенциала и концентрации AgNO3 на полноту восстановления Ag+ и количество иммобилизованного в композит серебра. Установлено, что электровосстановление Ag+ до Ag0 происходит преимущественно в первом цикле. Обнаружено, что при низкой скорости развертки потенциала (10 мВ/с) количество Ag0 в композите увеличивается с ростом концентрации пропитывающего раствора AgNO3 и времени выдержки в нем пленки. Увеличение скорости циклирования до 40 мВ/с снижает общую массу восстановленного металла в композите ПМАА/AgNPs, что связано со смещением выделения осадка Ag0 непосредственно на поверхность катода.
Методом сканирующей электронной микроскопии изучена морфология поверхности и распределение серебра в композите. Обнаружено, что содержание серебра в пленке на границе раздела композит/раствор в 7–10 раз больше, чем на прикатодной стороне композита, что может быть обусловлено ассиметричной структурой полимерной пленки (изменение плотности матрицы по толщине слоя).
Установлено, что полимерные метилолакриламидные пленки, содержащие наночастицы серебра, проявляют электрокаталитическую активность по отношению к пероксиду водорода. Причем сравнение каталитических характеристик данного композита с ранее полученными результатами для аналогичного композита с химически иммобилизованным серебром [29] показало, что электрохимический отклик исследуемого электрокатализатора на присутствие Н2О2 почти в 1.5 раза выше.
Таким образом, по результатам проведенных исследований можно сделать вывод, что формирование композита ПМАА/AgNPs методом электрохимического восстановления серебра в полимерной матрице не только возможно, но и имеет некоторые преимущества по сравнению с химической иммобилизацией серебра в пленку. Помимо более высокой каталитической активности, примененный электрохимический подход позволяет исключить использование химических реагентов в качестве восстановителей и тем самым удешевить процесс и избежать вторичного загрязнения композитного материала.
Список литературы
Blanco, I., Bottino, F.A., Cicala, G., and Latteri, A., A kinetic study of the thermal and thermal oxidative degradations of new bridged POSS/PS nanocomposites, Polym. Degrad. Stab., 2013, vol. 98, p. 2564.
Blanco, I., A kinetic study of the thermal and thermal oxidative degradations of new bridged POSS/PS nanocomposites, Polyhedral oligomeric silsesquioxanes (POSS)s in medicine, J Nanomed., 2018, vol. 1, p. 1002.
Han, J., Wang, M., Hua, Y., Zhou, Ch., and Guo, R., Conducting polymer-noble metal nanoparticle hybrids: Synthesis mechanism application, Prog. Polym. Sci., 2017, vol. 70, p. 52.
Щитовская, Е.В., Колзунова, Л.Г., Курявый, В.Г., Слободюк, А.Б. Электрохимическое формирование и свойства полиметилолакриламидной пленки с включением частиц платины. Электрохимия. 2015. Т. 51. С. 1235. [Shchitovskaya, E.V., Kolzunova, L.G., Kuryavyi, V.G., and Slobodyuk, A.B., Electrochemical formation and properties of polymethylolacrylamide film with inclusion of platinum particles, Russ. J. Electrochem., 2015, vol. 51, p. 1097.]
Zheng, Y., Wang, H., and Ma, Z., A nanocomposite containing Prussian Blue, platinum nanoparticles and polyaniline for multi-amplification of the signal of voltammetric immunosensors: highly sensitive detection of carcinoma antigen 125, Microchim. Acta, 2017, vol. 184, p. 4269.
Ma, Y., Shen, X-L., Zeng, Q., and Wang, L-S., A glassy carbon electrode modified with graphene nanoplatelets, gold nanoparticles and chitosan, and coated with a molecularly imprinted polymer for highly sensitive determination of prostate specific antigen, Microchim. Acta, 2017, vol. 184, p. 4469.
Jin, S.A., Heo, Y., Lin, L.K., Deering, A.J., Chiu, G.T.C., Allebach, J.P., and Stanciu, L.A., Gold decorated polystyrene particles for lateral flow immunodetection of escherichia coli O157:H7, Microchim. Acta, 2017, vol. 184, p. 4879.
Kafi, A.K.M., Wali, Q., Jose, R., Biswas, T.K., and Yusoff, M.M., A glassy carbon electrode modified with SnO2 nanofibers, polyaniline and hemoglobin for improved amperometric sensing of hydrogen peroxide, Microchim. Acta, 2017, vol. 184, p. 4443.
Ahmad, H., Ahmad, A., and Islam, S.S., Magnetic Fe3O4@poly(methacrylic acid) particles for selective preconcentration of trace arsenic species, Microchim. Acta, 2017, vol. 184, p. 2007.
Haghshenas, E., Madrakian, T., and Afkhami, A., A novel electrochemical sensor based on magneto Au nanoparticles/carbon paste electrode for voltammetric determination of acetaminophen in real samples, Mater. Sci. Eng., 2015, vol. 57, p. 205.
Priecela, P., Salamia, H.A., Padillaa, R.H., Zhong, Z., and Lopez-Sancheza, J.A., Anisotropic gold nanoparticles: Preparation and applications in catalysis, Chin. J. Catal., 2016, vol. 37, p. 1619.
Zinchenko, A., Miwa, Y., Lopatina, L.I., Sergeyev, V.G. and Murata, S., DNA Hydrogel as a Template for Synthesis of Ultrasmall Gold Nanoparticles for Catalytic Applications, ACS Appl. Mater. Interface., 2014, V. 6, p. 3226.
Chen, S.H., Yuan, R., Chai, Y.Q., and Hu, F.X., Electrochemical sensing of hydrogen peroxide using metal nanoparticles: a review, Microchim. Acta, 2013, vol. 180, no. 1–2, p. 15.
Moozarm, N.P., Lorestani, F., Meng, W.P., and Alias, Y., A novel non-enzymatic H2O2 sensor based on polypyrrole nanofibers-silver nanoparticles decorated reduced graphene oxide nano composites, Appl. Surf. Sci., 2015, vol. 332, p. 648.
Крутяков, Ю.А., Кудринский, А.А., Оленин, А.Ю., Лисичкин, Г.В. Синтез и свойства наночастиц серебра: достижения и перспективы. Успехи химии. 2008. Т. 77. № 3. С. 242. [Krutyakov, Yu.A., Kudrinsky, A.A., Olenin, A.Yu., and Lisichkin, G.V., Synthesis and properties of silver nanoparticles: Achievements and prospects, Russ. Chem. Revs., 2008, vol. 77, no. 3, p. 233.]
Bogle, K.A., Dhole, S.D., and Bhoraskar, V.N., Silver nanoparticles: Synthesis and size control by electron irradiation, Nanotechnology, 2006, vol. 17, p. 3204.
Guzman, M., Dille, J., and Godet, S., Synthesis and antibacterial activity of silver nanoparticles against gram-positive and gram-negative bacteria, Nanomed. Nanotech. Biol. Med., 2012, vol. 8, p. 37.
Kim, J.S., Kuk, E., Yu, K.N., Kim, J.-H., Park, S.J., Lee, H.J., Kim, H., Park, Y.K., Park, Y.H., Hwang, C.-Y., Kim, Y.-K., Lee, Y.-S., Jeong, D.H., and Cho, M.-H., Antimicrobial effects of silver nanoparticles, Nanomed. Nanotech. Biol. Med., 2007, vol. 3, p. 95.
Perelshtein, I., Applerot, G., Perkas, N., Guibert, G., Mikhailov, S., and Gedanken, A., Sonochemical coating of silver nanoparticles on textile fabrics (nylon, polyester and cotton) and their antibacterial activity, Nanotechnology, 2008, vol. 19, p. 245705.
Mahouche-Chergui, S., Guerrouache, M., Carbonnier, B., and Chehimi, M.M., Polymer-immobilized nanoparticles, Colloids and Surfaces A: Physicochem. and Engineering Aspects, 2013, vol. 439, p. 43.
Самсонова, М.В. Наномедицина: современные подходы к диагностике и лечению заболеваний, вопросы безопасности. Пульмонология. 2008. № 5. С. 5. [Samsonova, M.V., Nanomedicine: Modern Approaches to Diagnosis and Treatment of Diseases, Security Issues, Pulmonologiya, 2008, no. 5, p. 5.]
Gholamia, M. and Koivistoc, B., A flexible and highly selective non-enzymatic H2O2 sensor based on silver nanoparticles embedded into Nafion, Appl. Surf. Sci., 2019, vol. 467-468, p. 112.
Wei, L. and Chanchan, X., Nano-silver used for anti-microbial dressing and preparation method thereof. Patent 103785857, (China). 2014.
Kolzunova, L., Antibacterial effect and biodegradation of electrosynthesized polymethylolacrylamide films, Polym. Eng. Sci., 2017, vol. 57, p. 716.
Сосенкова, Л.С., Егорова, Е.М. Наночастицы серебра малого размера для исследований биологических эффектов. Журн. физ. химии. 2011. Т. 85. С. 1. [Sosenkova, L.S. and Egorova, E.M., Small-sized silver nanoparticles for studies of biological effects, Russ. J. Phys. Chem., 2011, vol. 85, p. 264.]
Колзунова, Л.Г., Калугина, И.Ю., Коварский, Н.Я. Возможности синтеза ультрафильтрационных и обратноосмотических мембран методом электрохимического инициирования полимеризации мономеров. Журн. прикл. химии. 1996. Т. 69. № 1. С. 135. [Kolzunova, L.G., Kalugina, I.Yu., and Kovarskii, N.Ya., Synthesis of ultrafiltration and reverse-osmosis membranes by electrochemically initiated polymerization of monomers, Russ. J. Appl. Chem., 1996, vol. 69, no. 1, p. 117.]
Карпенко, М.А., Колзунова, Л.Г., Карпенко, А.А. Структурные и морфологические исследования электрохимически синтезированных полиакриламидных ультрафильтрационных мембран. Электрохимия. 2006. Т. 42. С. 100. [Karpenko M.A., Kolzunova, L.G., and Karpenko, A.A., Structural and morphological investigation of electrochemically synthesized polyacrylamide ultrafiltration membranes, Russ. J. Electrochem., 2006, vol. 42, p. 89.]
Kolzunova, L.G., Electropolymerization as the Method of Producing Functional Polymer Films and Coatings in Polymer Films. In: Properties, Performance and Applications, Romano, S.A., and Somners, G.P., Eds., Nova Science Publishers, Inc. N.Y., 2012, p. 1–108.
Щитовская, Е.В., Колзунова, Л.Г., Буркова, Ю.Л. Включение частиц серебра в электросинтезированную полиакриламидную матрицу. Вестн. ДВО РАН. 2016. № 6. С. 63. [Shchitovskaya, E.V., Rolzunova, L.G., and Burkova, Yu.L., Inclusion of silver particles in the electro-synthesized polyacrylamide matrix, Bull. FEB RAS, 2016, no. 6, p. 63.]
Kolzunova, L.G., Shchitovskaya, E.V., and Rodzik, I.G., Formation of hybrid nanocomposites polymethylolacrylamide/Silver, IOP Conf. Series: Mater. Sci. Eng. (PCM-2018), 2018, vol. 369, p. 012018. https://doi.org/10.1088/1757-899X/369/1/012018
ГОСТ 1625-89 (СТ СЭВ 2337-80) Формалин технический. ТУ. – Введ. 01.01.1991. – 18 с.
Kolzunova, L.G., Shchitovskaya, E.V., and Karpenko, M.A., Electrochemical one-step synthesis of hybrid nanocomposites Au/polymer, IOP Conf. Series: Mater. Sci. Eng. (PCM-2018), 2018, vol. 369, p. 012027. https://doi.org/10.1088/1757-899X/369/1/012027
Lungu, C.P., Iwasaki, K., Kishi, K., Yamamoto, M., and Tanaka, R., Tribo-ecological coatings prepared by ECR sputtering, Vacuum, 2004, vol. 76, p. 119.
Ni, K., Chen, L., and Lu, G., Synthesis of silver nanowires with different aspect ratios as alcohol-tolerant catalysts for oxygen electroreduction, Electrochem. Commun., 2008, vol. 10, p. 1027.
Gao, Y., Munroe, N., Kong, X., and Jones, K., Assessing the catalyst processing for low temperature cofired ceramic-based direct methanol fuel cells, J. Power Sources, 2009, vol. 189, p. 935.
Брюханов, В.В., Тихомирова, Н.С., Горлов, Р.В., Слежкин, В.А. Взаимодействие поверхностных плазмонов наночастиц серебра на силохроме и шероховатых пленках серебра с электронно-возбужденными адсорбатами молекул родамина. Изв. КГТУ. 2013. № 6. С. 115. [Bryukhanov, V.V., Tikhomirova, N.S., Gorlov, R.V., and Slezhkin, V.A., Interaction of surface plasmons of silver nanoparticles on silochrome and rough silver films with electronically excited adsorbates of rhodamine molecules, Izvestiya KGTU, 2013 (in Russian), no. 6, p. 115.]
Durr, M., Obermaier, M., Yasuda, A., and Nelles, G., Adsorption-/desorption-limited diffusion of porphyrin molecules in nano-porous TiO2 networks, Chem. Phys. Lett., 2009, vol. 467, p.358.
Слежкин, В.А., Горлов, Р.В. Плазмонный резонанс в сплошных серебряных электрохимических и химических пленках и его проявление в спектрах флуоресценции молекул родамина 6Ж в тонких пленках поливинилового спирта. Изв. КГТУ. 2011. № 20. С. 115. [Slezhkin, V.A. and Gorlov, R.V., Plasmon resonance in solid silver electrochemical and chemical films and its manifestation in the fluorescence spectra of rhodamine 6G molecules in thin films of polyvinyl alcohol, Izvestiya KGTU, 2011 (in Russian) no. 20, p. 115.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия