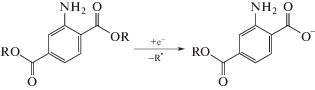Электрохимия, 2020, T. 56, № 5, стр. 456-462
Электрохимические свойства N-замещенных α-дифенилфосфиноглицинов
О. С. Софьичева a, Ю. А. Кислицын a, А. А. Нестерова a, b, А. Б. Добрынин a, Д. Г. Яхваров a, b, *
a Институт органической и физической химии им. А.Е. Арбузова –
обособленное структурное подразделение ФИЦ КазНЦ РАН
420088 Казань, ул. Арбузова, 8, Россия
b Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: yakhvar@iopc.ru
Поступила в редакцию 18.03.2019
После доработки 22.04.2019
Принята к публикации 12.09.2019
Аннотация
Методом циклической вольтамперометрии на стеклоуглеродном электроде исследованы электрохимические свойства N-замещенных α-дифенилфосфиноглицинов N-(2-метоксибензил) дифенилфосфиноглицин (1), N-(пиразин-2-ил) дифенилфосфиноглицин (2), N-(1-адамантил) дифенилфосфиноглицин (3) и N-(2,5-диметоксикарбонилфенил) дифенилфосфиноглицин (4), полученных в реакции трехкомпонентной конденсации дифенилфосфина, моногидрата глиоксиловой кислоты и соответствующего амина. Структура соединения 4 подтверждена методом рентгеноструктурного анализа. Установлено, что соединения 1–4 проявляют электрохимическую активность в анодной области потенциалов за счет наличия способного к окислению дифенилфосфинового фрагмента в молекуле, а соединение 4 также способно электрохимически восстанавливаться при катодных потенциалах рабочего электрода за счет сложноэфирных групп в ароматическом фрагменте.
ВВЕДЕНИЕ
На протяжении длительного времени комплексы переходных металлов играют решающую роль во многих каталитических процессах, включая процессы олигомеризации и полимеризации этилена, как на уровне лабораторного эксперимента, так и на промышленном уровне. Однако процесс получения каталитически активных форм катализаторов на настоящий момент является достаточно сложным и требует использования пожароопасных металлоорганических активаторов типа метилалюмоксана или других органических производных алюминия, в случае систем типа Циглера–Натта [1] и катализаторов Брукхарта [2–4], или использование низкостабильных комплексов никеля (0), например [Ni(COD)2], где COD – циклооктадиен-1,5, в случае запатентованных компанией Shell систем на основе PCCO-хелатных лигандов (SHOP – Shell Higher Olefin Process) [5]. Следует отметить, что последние хорошо зарекомендовали себя в качестве лигандов в комплексах никеля, используемых для процессов получения линейных α-олефинов путем гомогенной олигомеризации этилена.
Ранее нами показано, что электрохимический метод может быть эффективно применен для процессов in situ генерирования активных катализаторов полимеризации и олигомеризации этилена на основе третичных орто-фосфинофенолов, когда генерирование активной формы катализатора происходит in situ в присутствии фосфинового лиганда, стабильного в доступной области потенциалов [6]. Однако на настоящий момент более интересными в плане промышленно-приемлемых каталитических систем являются системы на основе N-замещенных α-фосфино-α-аминокислот, которые могут быть легко получены путем конденсации вторичного фосфина, первичного амина и моногидрата глиоксиловой кислоты при комнатной температуре [7–10]. Такие системы на основе α-фосфино-α-аминокислот, которые при взаимодействии с комплексом [Ni(COD)2] приводят к образованию в растворе активной формы никельорганического катализатора, способны эффективно олигомеризовать этилен с образованием в качестве основных продуктов низкомолекулярных линейных α-олефинов, что делает их очень перспективными в плане промышленного использования. Более того, данные системы не только позволяют селективно получать высоко-маржинальные продукты, необходимые для современной химической индустрии, но и используют в качестве основного сырья природные реагенты – производные органических карбоновых кислот и аминокислот, что позволяет также отнести данные системы к экологически приемлемым процессам, протекающим в соответствии с принципами “зеленой химии”. В соответствии с вышесказанным, представляет значительный интерес воспроизведение данной методики с целью электрохимического генерирования активных форм никельорганических катализаторов на основе α-дифенилфосфиноглицинов. Однако для этого необходимо иметь представление об электрохимических свойствах соединений рассматриваемого класса.
Таким образом, целью настоящей работы явилось получение и исследование электрохимических свойств α-фосфино-α-аминокислот при использовании метода циклической вольтамперометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все эксперименты проведены в инертной атмосфере (азот) при использовании стандартной аппаратуры Шленка. Диэтиловый эфир, метанол, ДМФА абсолютировали при использовании стандартных методик и хранили в атмосфере азота. Дифенилфосфин был получен восстановлением дифенилхлорфосфина при использовании эфирной суспензии LiAlH4. Первичные амины 2‑метоксибензиламин (98%), аминопиразин (98%), 1-адамантиламин (97%), диметиламинотерефталат (97%), а также моногидрат глиоксиловой кислоты (98%) являются коммерчески доступными реактивами (Sigma-Aldrich), и использовались без дополнительной очистки. В качестве фоновой соли использовали (NBu4)BF4 (99%) – коммерчески доступный реактив (Sigma-Aldrich), который осушали расплавлением в вакууме непосредственно перед использованием для удаления следов остаточной воды.
Растворители, используемые для ЯМР-исследований, конденсировали или дегазировали в ультразвуковой бане. Моногидрат глиоксиловой кислоты растворяли в диэтиловом эфире с помощью ультразвуковой бани при комнатной температуре.
Электрохимические свойства полученных соединений исследовали при использовании циклической вольтамперометрии (ЦВА). В исследованиях методом ЦВА в качестве рабочего электрода использовали электрод из стеклоуглерода (СУ) с площадью рабочей поверхности 3.14 мм2. Вольтамперограммы (ЦВА-кривые) регистрировали при включении электрохимической ячейки по трехэлектродной схеме. Регистрацию ЦВА-кривых осуществляли в ДМФА на фоне 0.1 M (NBu4)BF4 и скорости линейной развертки потенциала 50 мВ/с при использовании потенциостата BASI EC Epsilon (США) с ячейкой C3. Электродом сравнения служила система Ag/0.01 М AgNO3 в ацетонитриле (Е0(Fc/Fc+) = +0.20 B). Все потенциалы в работе приведены относительно этого электрода сравнения. В качестве вспомогательного электрода использовали Pt-проволоку диаметром 1 мм и длиной 20 мм. Измерения проводили в ячейке в атмосфере азота при комнатной температуре. При проведении экспериментов объем рабочего раствора был равен 5 мл, а концентрация субстрата составляла 5 × 10–3 М.
Кристаллографические данные: кристаллы соединения 4 (C24H22NO6P ⋅ CH4O M = 483.44) триклинные. При 296 K получены следующие параметры ячейки: a = 10.6039(4), b = 10.9993(5), c = = 11.2451(5) Å, α = 71.341(2), β = 83.750(2), γ = = 73.502(2)°, V = 1191.25(9) Å3, Z = 4, пространственная группа P-1, dвыч = 1.348 г см–3, μ = 0.161 мм–1, F(000) = 508. Данные получены на автоматическом дифрактометре Bruker Kappa APEX II CCD [графитовый монохроматор, λ(MoKα) = 0.71073 Å, ω-сканирование], 2θ < 54°, Rint = 0.032. Было измерено 19824 отражений, из них 5191 независимых, число наблюдаемых отражений с I > 2σ(I) равно 4292, окончательные значения факторов расходимости R 0.0386, wR2 0.1400, GOF = 1.11, число определяемых параметров 317. Структура депонирована в Кембриджской базе кристаллоструктурных данных (CCDC 1940060; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
Получение N-(2-метоксибензил) дифенилфосфиноглицина (1). Глиоксиловую кислоту (0.428 г, 4.50 ммоль) растворили в диэтиловом эфире (10 мл) и добавили к раствору дифенилфосфина (0.78 мл, 4.50 ммоль) и 2-метоксибензиламина (0.58 мл, 4.50 ммоль) в диэтиловом эфире (15 мл). Реакционную смесь перемешивали 12 ч, после чего отфильтровали желтый осадок, промыли диэтиловым эфиром и полученный порошок сушили в вакууме в течение 5 ч. Получено 1.21 г (выход 71%) соединения 1. 1H-NMR (CD3OD): δ = 3.65 (д, 2J = 13.2 Гц, 2H, CH2), 3.73 (с, 3H, CH3), 4.07 (д, 2JPH = 1.8 Гц, 1H, PCH), 5.32 (уширенный с, 3H, NH2, OH), 6.77–6.86 (м, 2H), 7.10–7.32 (м, 8H, Ph), 7.42–7.55 (м, 4H, Ph) м.д. 13C{1H} NMR (CD3OD): δ = 22.87 (с, CH3), 49.00 (с, CH3OH), 56.99 (с, OCH3), 57.28 (д, 3JPC = 9.0 Гц, NCH), 60.64 (д, 1JPC = 14.3 Гц, PCH), 114.20 (с, 3'-CH), 128.42 (с, 2 2'-CH), 128.65 (д, 3JPC = 6.6 Гц, 2 m-CH), 129.08 (с, p-CH), 129.75 (с, p-CH), 134.00 (д, 2JPC = = 18.1 Гц, 2 o-CH), 135.39 (д, 2JPC = 21.2 Гц, 2 o-CH), 136.63 (д, 1JPC = 15.0 Гц, i-Cq), 136.87 (с, 1'-CqA), 137.28 (д, 1JPC = 17.1 Гц, i-Cq), 159.83 (с, 4'-Cq), 173.32 (д, 2JPC = 10.6 Гц, CO) м.д. 31P{1H}-NMR (CD3OD): δ = –2.32 м.д.
Получение N-(пиразин-2-ил) дифенилфосфиноглицина (2). Глиоксиловую кислоту (1.00 г, 10.50 ммоль) растворили в метаноле (10 мл) и добавили к раствору дифенилфосфина (1.83 мл, 10.50 ммоль) и 2-аминопиразина (1.00 г, 10.50 ммоль) в метаноле (15 мл). Реакционную смесь перемешивали в течение суток при комнатной температуре. После этого отфильтровали образовавшийся светло-желтый осадок, промыли диэтиловым эфиром и высушили на вакууме. Получено 3.40 г (выход 96%) соединения 2. 1H-NMR (CD3OD): δ = 3.66 (уширенный с, PCH), 5.63 (уширенный с, 1H, NH), 7.27–7.38 (м, 6H, Ph), 7.50–7.65, (м, 4H, Ph), 7.64 (д, J ≈ 3 Hz, 1H, пиразин), 7.92 (м, 2H, пиразин) м.д. 13C{1H}-NMR (CD3OD): δ = 54.71 (д, 1JPC = 22.5 Гц, PCH), 129.38 (д, 3JPC = 5.3 Гц, 2 m-CHA), 129.45 (д, 3JPC = 6.6 Гц, 2 m-CHB), 130.32 (уширенный с, p-CHA), 130.55 (с, p-CHB), 132.68, 134.65 (2 с, CH-3, CH-5), 134.57 (д, 2JPC = 19.9 Гц, 2 o-CHA), 135.10 (д, 2JPC = 19.9 Гц, 2 o-CHB), 136.09 (д, 1JPC = 15.9 Гц, i-CqA), 136.13 (д, 1JPC ≈ 16.0 Гц, i‑CqB), 142.90 (с, CH-6), 155.76 (д, 3JPC = 4.0 Гц, Cq‑2), 174.16 (д, 2JPC = 10.6 Гц, COОН) м.д. 31P{1H}-NMR (CD3OD): δ = 2.2 м.д.
Получение N-(1-адамантил) дифенилфосфиноглицина (3). Раствор, содержащий моногидрат глиоксиловой кислоты (0.55 г, 5.98 ммоль) в метаноле (15 мл), был добавлен к раствору, содержащему дифенилфосфин (1.07 мл, 5.75 ммоль) и 1‑адамантиламин (0.87 г, 5.75 ммоль) в том же растворителе (25 мл). Через 15 мин перемешивания при комнатной температуре наблюдали образование белого осадка. Реакционная смесь перемешивалась 3 дня, после чего осадок был отфильтрован, промыт диэтиловым эфиром и высушен. Выход соединения 3 составил 2.15 г. (выход 95%). Тпл = 121–124°С. 1H NMR (CD3OD): δ = 1.61, 1.65 (с, 4H, CH2), 1.68 (наложенный умеренный с, 6H, CH2), 1.81 (д, 3J = 2.7 Гц, 2H, CH2), 2.07 (с, 3H; δ‑CH), 4.37 (с, 1H, PCH), 5.54 (уширенный с, 1H, NH), 7.24–7.61 (м, 8H, Ph), 7.74–7.82 (м, 2H, Ph) м.д. 13C{1H} NMR (CD3OD): δ = 30.42 (CH), 36.43 (CH2), 41.67 (CH2), 52.60 (NCq), d = 54.78 (д, 1JPC = = 20.8 Гц, PCHN), 128.63 (д, 3J = 6.7 Гц, 2 m-CH), 129.81 (д, 3J = 6.7 Гц, 2 m-CH), 129.26 (p-CH), 129.70 (p-CH), 134.30 (д, 2J = 18.4 Гц, 2 o-CH), 134.59 (д, 2J = 18.1 Гц, 2 o-CH) м.д. 31P{1H} NMR (CD3OD): δ = 1.89 м.д.
Получение N-(2,5-диметоксикарбонилфенил) дифенилфосфиноглицина (4). Раствор, содержащий моногидрат глиоксиловой кислоты (0.55 г, 5.98 ммоль) в метаноле (15 мл) был добавлен к раствору, содержащему дифенилфосфин (1.07 мл, 5.75 ммоль) и диметил-2-аминотерефталат (1.20 г, 5.75 ммоль) в том же растворителе (20 мл), который предварительно перемешивался 30 мин. Сразу после смешения растворов наблюдали образование желтого осадка. Смесь перемешивали в течение 12 ч, после чего осадок отфильтровали, промыли диэтиловым эфиром и высушили на вакууме. Выход соединения 4 составил 1.87 г (выход 72%). Тпл = 127–130°С. 1H-NMR (CD3OD): δ = = 3.81 (с, 2-OCH3), 3.86 (с, 5-OCH3), 3.88 (д, 2JPH = = 1.5 Гц, PCH), 5.61 (уширенный с, 1H, NH), 7.20 (дд, 3J = 8.1, 4J = 1.5 Гц, 1H), 7.31 (д, 4J = 1.5 Гц, 1H), 7.32–7.40 (м, 6H, Ph), 7.48–7.55 (м, 2H, Ph), 7.56–7.62 (м, 2H, Ph), 7.70–7.85 (с, OH), 7.92 (д, 2J = 8.1 Гц, 1H) м.д. 13C{1H} NMR (CD3OD): δ = = 52.88 (OCH3), 53.35 (OCH3), 114.73 (с, 6'-CH), 116.14 (с, 2'-Cq), 117.51 (с, 4'-CH), 130.02 (д, 3J = = 6.6 Гц, 2 m-CH), 130.16 (д, 3J = 6.6 Гц, 2 m-CH), 130.99 (с, p-CH), 131. 10 (с, p-CH), 133.42 (с, 3'-CH), 135.26 (д, 2J = 19.9 Гц, 2 o-CH), 135.39 (д, 2J = = 21.2 Гц, 2 o-CH), 135.87 (д, 1J = 17 Гц, i-Cq), 136.17 (д, 1J = 14.6 Гц, i-Cq), 136.69 (с, 5'-Cq), 151.04 (д, 3J = 4.0 Гц, 1'-Cq), 174.47 (д, 2JPC = 8.0 Гц, COOH) м.д. 31P{1H} NMR (CD3OD): δ = 4.67 м.д.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В качестве объектов настоящего исследования были выбраны N-(2-метоксибензил) дифенилфосфиноглицин (1), N-(пиразин-2-ил) дифенилфосфиноглицин (2), N-(1-адамантил) дифенилфосфиноглицин (3) и N-(2,5-диметоксикарбонилфенил) дифенилфосфиноглицин (4), которые были получены в реакции трехкомпонентной конденсации дифенилфосфина, моногидрата глиоксиловой кислоты и соответствующего амина (схема 1 ) [8–10]. Следует отметить, что реакция трехкомпонентной конденсации протекает одностадийно, в мягких условиях, и является наиболее простым способом получения α-фосфино-α-аминокислот 1–4.
Схема 1 .
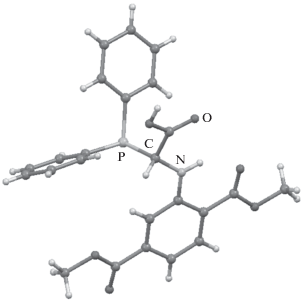
Строение полученных соединений 1–4 подтверждено методами 1H, 13C и 31P ЯМР спектроскопии, а для соединения 4 дополнительно проведен рентгеноструктурный анализ (рис. 1). Соединение 4 кристаллизуется в виде сольвата с метиловым спиртом в соотношении 1 : 1 в триклинной пространственной группе P-1. Атом фосфора имеет пирамидальную конфигурацию, вдоль P1–C2-связи одна из фенильных групп находится в транс-положении относительно связи C2–N1 (торсионный угол C3P1C2N1 139.08(12)°), а другая – в ортогональном положении (торсионный угол C9P1C2N1 – 111.96(12)°). Метоксикарбонильные группы в 2,5-диметоксикарбонилфенильном заместителе лежат в плоскости бензольного кольца.
Для изучения возможности электрохимического генерирования активных никельорганических катализаторов олигомеризации и полимеризации этилена на основе фосфорорганических лигандов методом циклической вольтамперометрии были исследованы электрохимические свойства полученных α-фосфино-α-аминокислот 1–4 (рис. 2, табл. 1). Как видно из полученных данных, соединения 1–3 являются стабильными в катодной области потенциалов при сканировании потенциала рабочего электрода до –2.50 В (отн. Ag/AgNO3 0.01 М в CH3CN). Следует отметить, что при более катодных значениях потенциала рабочего электрода происходит восстановление используемого фонового электролита ((NBu4)BF4, 0.1 M). В случае соединения 4 наличие двух сложноэфирных групп в ароматическом фрагменте приводит к появлению на ЦВА-кривой двух квазиобратимых пиков восстановления С1 и С2 в области потенциалов –(1.90–2.30) В (отн. Ag/AgNO3 0.01 М в CH3CN). Таким образом, электрохимическая стабильность α-фосфино-α-аминокислот в катодной области потенциалов делает их удобными реагентами для проведения процесса электрохимического генерирования активных никельорганических катализаторов по реакции окислительного присоединения электрохимически генерируемых комплексов никеля(0) к рассматриваемым соединениям, так как целевой процесс протекает при потенциале системы Ni(II)/Ni(0) равном –1.65 В (отн. Ag/AgNO3 0.01 М в CH3CN) [11–14].
Рис. 2.
ЦВА-кривые соединений 1 (1 – сплошная линия), 2 (2 – пунктир), 3 (3 – штрих-пунктир), 4 (4 – сплошная линия) в среде ДМФА (концентрация субстрата 5 × 10–3 М, рабочий электрод – СУ, электрод сравнения – Ag/AgNO3 0.01 M в CH3CN, (NBu4)BF4, 0.1 М, v = 50 мВ/с).

Таблица 1.
Потенциалы пиков* на ЦВА-кривых α-фосфино-α-аминокислот 1–4 и трифенилфосфина (концентрация субстрата 5 × 10–3 М, рабочий электрод – СУ, (NBu4)BF4, 0.1 М, v = 50 мВ/с)
| № | Соединение | Формула | Катодные пики $E_{{\text{p}}}^{{{\text{red}}}},$ В | Анодные пики $E_{{\text{p}}}^{{{\text{ox}}}},$ В | ||
|---|---|---|---|---|---|---|
| 1 | N-(2-метоксибензил)- дифенилфосфиноглицин |  |
– | – | A1 A2 |
+0.52 +0.87 |
| 2 | N-(пиразин-2-ил)дифенилфосфиноглицин | 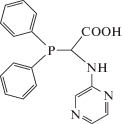 |
– | – | A1 | +0.96 |
| 3 | N-(1-адамантил)дифенилфосфиноглицин | 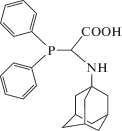 |
– | – | A1 | +0.70 |
| 4 | N-(2,5-диметоксикарбонилфенил)дифенилфосфиноглицин |  |
С1 С2 |
-1.97 -2.18 |
A1 A2 |
+0.83 +1.29 |
| 5 | Трифенилфосфин |  |
– | – | A1 | +0.86 |
Однако при сканировании потенциала рабочего электрода в анодную область, на ЦВА-кривых всех исследованных соединений присутствуют необратимые анодные пики окисления. Это обусловлено наличием в структуре данных соединений электрохимически активной в анодной области функциональной группы –PPh2, в которой возможно окисление фосфорного центра. Интересно отметить, что одновременное присутствие в молекуле соединения 4 дифенилфосфинового и сложноэфирного фрагментов приводит к возникновению двух пиков окисления $E_{{\text{p}}}^{{{\text{ox}}}}$ = +0.83 и +1.29 В (отн. Ag/AgNO3 0.01 М в CH3CN) (рис. 2, табл. 1). Подобные пики восстановления также были ранее зафиксированы на ЦВА-кривых диметил-2-аминотерефталата [15], где авторами было показано, что в результате катодного процесса происходит разрыв связи алкил-кислород в сложноэфирном фрагменте, приводящий к отщеплению алкильной группы и образованию карбоксильного аниона (схема 2 ).
Схема 2 .
В случае соединений 1–3 на ЦВА-кривых наблюдается только один пик окисления, соответствующий окислению атома фосфора в дифенилфосфиновом фрагменте молекулы (рис. 1, табл. 1).
Для подтверждения предполагаемого механизма, в изучаемых условиях были исследованы электрохимические свойства трифенилфосфина PPh3 (5), взятого в качестве модельного соединения, для которого было найдено, что его потенциал окисления равен $E_{{\text{p}}}^{{{\text{ox}}}}$ = +0.83 В [16], что соответствует области окисления дифенилфосфинового фрагмента исследуемых α-фосфино-α-аминокислот 1–4. Это дополнительно подтверждает предложенный механизм процесса анодного окисления исследованных фосфорорганических соединений.
ЗАКЛЮЧЕНИЕ
Таким образом, исследование электрохимических свойств N-замещенных α-дифенилфосфиноглицинов N-(2-метоксибензил) дифенилфосфиноглицина, N-(пиразин-2-ил) дифенилфосфиноглицина, N-(1-адамантил) дифенилфосфиноглицина и N-(2,5-диметоксикарбонилфенил) дифенилфосфиноглицина, полученных в реакции трехкомпонентной конденсации дифенилфосфина, моногидрата глиоксиловой кислоты и соответствующего амина, показало, что данные соединения проявляют электрохимическую активность в анодной области потенциалов за счет наличия способного к окислению дифенилфосфинового фрагмента в молекуле, а N-(2,5-диметоксикарбонилфенил)дифенилфосфиноглицин также способен электрохимически восстанавливаться при катодных потенциалах рабочего электрода более –1.90 В за счет сложноэфирных групп в ароматическом фрагменте. Электрохимическая стабильность данных соединений в области потенциалов до –1.90 В делает их перспективными реагентами для проведения процесса in situ электрохимического генерирования активных катализаторов гомогенной олигомеризации и полимеризации этилена на основе комплексов никеля(0) электрохимически генерируемых при потенциалах ‒(1.50–1.70) В.
Список литературы
Chen, C., Designing catalysts for olefin polymerization and copolymerization: beyond electronic and steric tuning, Nat. Rev. Chem., 2018, vol. 2, p. 6.
Shamiri, A., Chakrabarti, M., Jahan, S., Hussain, M., Kaminsky, W., Aravind, P., and Yehye, W., The Influence of Ziegler-Natta and Metallocene Catalysts on Polyolefin Structure, Properties, and Processing Ability, Materials, 2014, vol. 7, p. 5069.
Ittel, S., Johnson, L., and Brookhart, M., Late-Metal catalysts for ethylene homo- and copolymerization, Chem. Rev., 2000, vol. 100, p. 1169.
Lamberti, M., Mazzeo, M., Pappalardo, D., and Pellecchia, C., Mechanism of stereospecific polymerization of α-olefins by late-transition metal and octahedral group 4 metal catalysts, Coord. Chem. Rev., 2009, vol. 253, p. 2082.
Keim, W., Oligomerization of Ethylene to α-Olefins: Discovery and Development of the Shell Higher Olefin Process (SHOP), Angew. Chem. Int. Ed., 2013, vol. 52, p. 12492.
Фомина, О.С., Кислицын, Ю.А., Бабаев, В.М., Ризванов, И.Х., Синяшин, О.Г., Хайнике, И., Яхваров, Д.Г. Электрохимические свойства и каталитическая активность в процессах полимеризации этилена комплексов никеля с 2,2'-бипиридилом в присутствии производных орто-фосфинофенола. Электрохимия. 2015. Т. 51. С. 1206. [Fomina, O.S., Kislitsyn, Yu.A., Babaev, V.M., Rizvanov, I.Kh., Sinyashin, O.G., Heinicke, J.W., and Yakhvarov, D.G., Electrochemical properties and catalytic activity in the ethylene polymerization processes of nickel complexes with 2,2′-bipyridine in the presence of ortho-phosphinophenol derivatives, Russ. J. Electrochem., 2015, vol. 51, p. 1069.]
Peulecke, N., Yakhvarov, D., and Heinicke, J., Chemistry of α-phosphanyl α-amino acids, Eur. J. Inorg. Chem., 2019, p. 1507.
Фомина, О.С., Яхваров, Д.Г., Хайнике, И.B., Синяшин, О.Г. Синтез и каталитическая активность новых N-замещенных α-дифенилфосфино-α-аминокислот. Учен. зап. Казан. ун-та. 2012. Т. 154. С. 13. [Fomina, O.S., Yakhvarov, D.G., Heinicke, J.W., and Sinyashin, O.G., Synthesis and catalytic activity of new N-substituted α-diphenylphosphino-α-aminoacids, Uchen. Zap. Kazan. Univer. Ser. Estestvennye Nauki, 2012, vol. 154, p. 13.]
Heinicke, J., Lach, J., Kockerling, M., Paim, G., Fomina, O., Yakhvarov, D., and Sinyashin, O., Phosphinoglycines – synthesis, structure and reactivity, Phosphorus, Sulfur, and Silicon, 2015, vol. 190, p. 947.
Fomina, O., Heinicke, J., Sinyashin, O., and Yakhvarov, D., The synthesis of novel N-heterocyclic α-diphenylphosphinoglycines, Phosphorus, Sulfur, and Silicon, 2016, vol. 191, p. 1478.
Яхваров, Д.Г., Трофимова, Е.А., Ризванов, И.Х., Фомина, О.С., Синяшин, О.Г. Электрохимический синтез и каталитическая активность никельорганических сигма-комплексов. Электрохимия. 2011. Т. 47. С. 1180. [Yakhvarov, D.G., Trofimova, E.A., Rizvanov, I.Kh., Fomina, O.S., and Sinyashin, O.G., Electrochemical synthesis and catalytic activity of organonickel sigma-complexes, Russ. J. Electrochem., 2015, vol. 47, p. 1100.]
Yakhvarov, D.G., Tazeev, D.I., Sinyashin, O.G., Giambastiani, G., Bianchini, C., Segarra, A.M., Lonnecke, P., and Hey-Hawkins, E., Electrochemical synthesis of the σ-aryl complex [NiBr(Mes)(bpy)] and its use as catalyst precursor for the oligomerization of ethylene (Mes = 2,4,6-trimethylphenyl, bpy = 2,2'-bipyridine), Polyhedron, 2006, vol. 25, p. 1607.
Яхваров, Д.Г., Будникова, Ю.Г., Синяшин, О.Г. Никельорганические σ-комплексы – ключевые интермедиаты электрокаталитических циклов. Электрохимия. 2003. Т. 39. С. 1407. [Yakhvarov, D.G., Budnikova, Yu.G., and Sinyashin, O.G., Organonickel σ-complexes-key intermediates of electrocatalytic cycles, Russ. J. Electrochem., 2003, vol. 39, p. 1261.]
Яхваров, Д.Г., Ганушевич, Ю.С., Трофимова, Е.А., Синяшин, О.Г. Электрохимический способ получения никельорганических сигма-комплексов, Пат. 2396375 (Россия). 2010. [Yakhvarov, D.G., Ganushevich, Yu.S., Trofimova, E.A., and Sinya-shin, O.G., Electrochemical method for synthesis of organonickel sigma-complexes, Patent 2396375 (Russia), 2010.]
Lauw, S., Lee, J., Tessensohn, M., Leong, W., and Webster, R., The electrochemical reduction of di-(2-ethylhexyl) phthalate (DEHP) in acetonitrile, J. Electroanal. Chem., 2017, vol. 794, p. 103.
Schiavon, G., Zecchin, S., and Cogoni, G., Anodic oxidation of triphenylphosphine at a platinum electrode in acetonitrile medium, J. Electroanal. Chem. Interfac. Electrochem., 1973, vol. 48., p. 425.
Дополнительные материалы отсутствуют.