Электрохимия, 2020, T. 56, № 5, стр. 450-455
Электрохимическое аминирование изомерных хлоранилинов в водных растворах серной кислоты
Ю. А. Лисицын a, *, А. В. Сухов a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
Казань, Россия
* E-mail: Yuri.Lisitsyn@kpfu.ru
Поступила в редакцию 27.02.2019
После доработки 12.04.2019
Принята к публикации 17.07.2019
Аннотация
В водных растворах 9–17 М серной кислоты изучены процессы непрямого катодного аминирования пара-, орто- и мета-хлоранилинов с помощью системы Ti(IV)–NH2OH. Эффективность и региоселективность катион-радикального замещения возрастают с повышением кислотности и температуры электролита. При функционализации пара-хлоранилина в 17 М H2SO4 получен 4-хлор-1,3-фенилендиамин с массовой долей 99.7% и выходом по гидроксиламину при его полной конверсии 91%, единственным побочным продуктом аминирования является пара-фенилендиамин.
ВВЕДЕНИЕ
Аминирование ароматических субстратов с помощью гидроксиламина и медиаторной системы Ti(IV)/Ti(III) дает соответствующие моно- и/или диаминосоединения [1, 2]. Изомерный состав и выходы фенилендиаминов зависят от концентрации серной кислоты и природы заместителя в ароматическом кольце, определяющих, по-видимому, относительное содержание в католите молекулярных ассоциатов ArNH2 ⋅ ${\text{HSO}}_{4}^{ - }$, ионных пар ${\text{ArNH}}_{3}^{ + }$, ${\text{HSO}}_{4}^{ - }$ и катионов ${\text{ArNH}}_{3}^{ + }$ [3–8]. В ассоциатах ароматические кольца активированы по отношению к электрофильным реагентам. В ионных парах вследствие воздействия гидросульфат-ионов влияние аммониевых групп ограничено эффектом поля [9], и кольца дезактивированы в меньшей степени, чем в катионах. В ассоциатах и катионах за ориентацию замещения отвечают соответственно амино- и аммониевая группы [10], а в ионных парах – заместитель, за исключением соседних с аммониевой группой дезактивированных положений ароматического кольца (в ионной паре ${{{\text{C}}}_{6}}{{{\text{H}}}_{5}}{\text{NH}}_{3}^{ + }$, ${\text{HSO}}_{4}^{ - }$ пара- и мета-положения, вероятно, практически равнозначны для атаки аминокатион-радикала).
При функционализации анизола, субстрата, активированного по отношению к аминокатион-радикалам, практически единственным конечным продуктом замещения является 4-метокси-1,3-фенилендиамин [5], что позволяет осуществить его высокоселективный синтез из пара- и орто-анизидинов [8]. В случае же аминирования хлорбензола, дезактивированного соединения, образуются все изомерные хлорфенилендиамины, кроме 5-хлор-1,3-изомера [7]. Данный результат объясняется тем, что если анизидины в сернокислых растворах находятся фактически только в виде катионов, связанных и отчасти несвязанных в ионные пары [3, 5, 8], то хлоранилины присутствуют и в форме молекулярных ассоциатов [7], поскольку атом хлора, оттягивающий на себя электронную плотность с кольца изомерного хлоранилиния, облегчает отрыв протона от аммониевой группы сульфат-ионом.
Несмотря на образование в процессе аминирования пяти изомерных хлорфенилендиаминов, анализ зависимости их распределения от концентрации серной кислоты [7] и результаты пробного электролиза системы Ti(IV)–NH2OH–п-ClC6H4NH2 [3] указывают на возможность селективного синтеза одного из них, а именно 4‑хлор-1,3-фенилендиамина (4-Cl-1,3-ФДА), который может быть использован, например, для получения термостойких огнестойких высокопрочных волокон, пленок и лаков [11]. С целью нахождения условий, благоприятствующих образованию 4-Cl-1,3-ФДА, и получения данных, подтверждающих корректность интерпретации результатов аминирования хлорбензола [7], в настоящей работе изучены процессы аминирования пара-, орто- и мета-хлоранилинов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аминирование хлоранилинов выполняли в термостатируемой стеклянной электрохимической ячейке с разделенными керамической диафрагмой катодным и анодным пространствами. В комплект ячейки входили платиновый катод (8.2 см2), анод из платинированной платины, обратный холодильник, капилляр Луггина, капилляр для подачи инертного газа.
Католит объемом 25 мл содержал 0.1 М Ti(IV), 0.2 М NH2OH, 0.2 М изомерного хлоранилина и водный раствор серной кислоты требуемой концентрации. Перед проведением электролиза католит, перемешиваемый при помощи магнитной мешалки IKA RET basic safety control (IKA-Werke GmbH & Co. KG, Германия), дезаэрировали потоком аргона, пропущенным предварительно через склянку Дрекселя с раствором H2SO4 исследуемой концентрации. В ходе электролиза аргон пропускали над католитом, скорость вращения оси магнита мешалки составляла 1200 об/мин.
Аминирование ароматических субстратов проводили при плотности тока –2 мА/см2 с помощью потенциостата-гальваностата Autolab PGSTAT 302N (Metrohm, Нидерланды) или IPC-Pro MF (Вольта, Россия). Перед электролизом катод, промытый ацетоном и водой, подвергали анодно-катодной поляризации в водном растворе H2SO4 рассматриваемой концентрации при силе тока ±0.5 А. Регистрацию катодного потенциала в процессе аминирования осуществляли относительно хлоридсеребряного электрода. В качестве анолита использовали водный раствор H2SO4, имеющий концентрацию кислоты католита.
После завершения электролиза католит разбавляли холодной водой до концентрации кислоты 1–1.5 М, подщелачивали при охлаждении насыщенным водным раствором NaOH и нейтрализовали NaHCO3.
Аминосоединения, экстрагированные бензолом [12, 13], анализировали с помощью хроматографа Хроматэк-Кристалл 5000.2 (Хроматэк, Россия) с пламенно-ионизационным детектором. Температура капиллярных колонок CP-Sil 8 CB и BPX35 (60 м × 0.25 мм × 0.25 мкм) и давление гелия, газа-носителя, составляли 160°C и 200 кПа.
В работе использовали раствор 1.2 М Ti(IV) в водной 4 М H2SO4 (“ч. д. а.”); сульфат гидроксиламиния (Acros, 99%), перекристаллизованный в воде; H2SO4 (“х. ч.”); NaOH (“ч. д. а.”); NaHCO3 (“х. ч.”); перегнанные ацетон (“ч. д. а.”) и бензол (“х. ч.”); пара-, орто- (Lancaster, 98%) и мета-хлоранилины (Lancaster, 99%), очищенные вакуумной перегонкой над KOH (Acros, for analysis, 85%); сублимированные в вакууме пара- (“ч.”), орто- (“ч.”), мета-фенилендиамины (Acros, 99 + %), 4-хлор-1,3-, 4-хлор-1,2- (Aldrich, 97%), 3‑хлор-1,2- (Matrix, 95 + %) и 5-хлор-1,3-фенилендиамины (Lancaster, 97%); сублимированные в вакууме 2-хлор-1,4- и 2-хлор-1,3-фенилендиамины, полученные соответственно из сульфата 2‑хлор-1,4-фенилендиаминия (Aldrich, 95%) и восстановлением титаном(III) 1-хлор-2,6-динитробензола (Lancaster, 98 + %); бидистиллированную воду.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При аминировании хлорбензола [7] 4-Cl-1,3-ФДА образуется главным образом из ионных пар пара- и в меньшей степени орто-хлоранилиниев. Наиболее высокие выходы по току (ВТ) хлорфенилендиамина (до 27.6%) наблюдаются в средах с высоким содержанием серной кислоты, в которых минимальны концентрации молекулярных ассоциатов хлоранилинов и скорость конкурентной замещению реакции (1):
(1)
$\mathop {\text{N}}\limits^\centerdot {{{\text{H}}}_{2}} + {\text{Ti(III}})\,\,\xrightarrow{{{{{\text{H}}}^{ + }}}}\,\,{\text{N}}{{{\text{H}}}_{3}} + {\text{Ti(IV}}).$Изначально особые перспективы синтеза 4‑Cl-1,3-ФДА связывали с аминированием пара-хлоранилина, так как функционализация как его ионных пар, так и катионов должна приводить только к целевому продукту. В частицах $n{\text{ - Cl}}{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}{\text{NH}}_{3}^{ + }$, ${\text{HSO}}_{4}^{ - }$ за ориентацию замещения отвечает атом хлора [7], в катионе – главным образом +NH3-группа [10]. Процесс аминирования на примере иона пара-хлоранилиния можно представить в первом приближении следующей схемой:
Поскольку при аминировании хлорбензола резкое возрастание ВТ и доли 4-Cl-1,3-ФДА среди изомерных хлорфенилендиаминов наблюдается в средах с концентрацией серной кислоты более 9 М [7], электролизы системы Ti(IV)–NH2OH–п-ClC6H4NH2 проводили в ее 9–17 М водных растворах. Выбор нижней границы концентрации обусловливался также тем, что при аминировании анилина в растворах 9–11 М H2SO4 практически все аминокатион-радикалы взаимодействуют только с высокореакционноспособными ассоциатами C6H5NH2 ⋅ ${\text{HSO}}_{4}^{ - }$, а мета-фенилендиамин, образующийся из ионных пар ${{{\text{C}}}_{6}}{{{\text{H}}}_{5}}{\text{NH}}_{3}^{ + }$, ${\text{HSO}}_{4}^{ - }$, а затем и из ионов анилиния, вновь появляется лишь в более кислых средах [14]. Экспериментальные условия были аналогичны использованным при аминировании анизидинов [8]. Количество электричества, пропускаемое через электролит, составляло 482.4 Кл и соответствовало полной теоретической выработке гидроксиламина в процессе с участием одного электрона на его молекулу.
Аминирование пара-хлоранилина в растворе 9 М H2SO4 при 40°C протекает при потенциалах электрохимического восстановления ионов гидроксония. Так как при электролизе системы Ti(IV)–NH2OH–C6H5NH2, проводимом при более высокой катодной плотности тока (6 мА/см2), выделение водорода наблюдается лишь в средах с концентрацией кислоты менее 7 М [14], можно полагать, что в присутствии пара-хлоранилина данный процесс является электрокаталитическим [15].
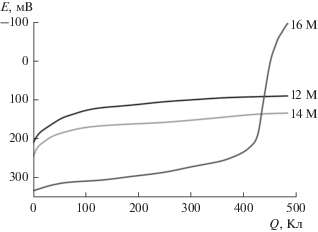
Функционализация ароматического субстрата идет в отсутствие восстановления ионов гидроксония в католитах с содержанием H2SO4 12 и более М, однако в 12–14 М растворах еще существенной является скорость реакции (1). Вследствие образования Ti(IV) в этой реакции на кулонопотенциограммах, регистрируемых в данных средах (рис. 1), отсутствует скачок потенциала катода, характерный для более кислых растворов. Аминирование пара-хлоранилина протекает по цепному механизму (схема), и смещение потенциала связано с процессом катодного выделения водорода, проявляющимся после полной конверсии гидроксиламина и восстановления большей части Ti(IV) до Ti(III).
Рис. 1.
Влияние концентрации H2SO4 на вид кулонопотенциограмм в процессе аминирования пара-хлор-анилина при 40°C.
Как и ожидалось, продуктами аминирования пара-хлоранилина в рассматриваемых условиях являются 4-Cl-1,3-ФДА, 4-хлор-1,2-фенилендиамин (4-Cl-1,2-ФДА) и пара-фенилендиамин. 4‑Cl-1,2-ФДА образуется из ассоциатов, включающих молекулу пара-хлоранилина и гидросульфат-ион, пара-фенилендиамин является продуктом ипсо-замещения [9, 10] атома хлора в кольце хлоранилина.
В растворе 9 М H2SO4 общий ВТ изомерных хлорфенилендиаминов и пара-фенилендиамина составляет менее 1%. Повышение концентрации кислоты ведет к подавлению процесса выделения водорода, возрастанию редокс-потенциала медиаторной системы Ti(IV)/Ti(III) [16, 17], снижению скорости реакции (1) и повышению общей эффективности замещения за счет образования 4-Cl-1,3-ФДА (рис. 2). Выход 4-Cl-1,2-ФДА при этом падает вследствие уменьшения концентрации ассоциатов п-ClC6H4NH2 ⋅ ${\text{HSO}}_{4}^{ - }$. В 17 М H2SO4 ВТ 4-Cl-1,3-ФДА достигает 91.0%, а массовая доля – 99.7%, единственным побочным продуктом, образующимся с выходом 0.36%, является пара-фенилендиамин. ВТ 4-Cl-1,3-ФДА превышает 90% и в 16 М кислоте при увеличении температуры электролиза до 60°C (рис. 2).
Рис. 2.
Зависимости выходов по току 4-Cl-1,3-ФДА (1), 4-Cl-1,2-ФДА (2) и пара-фенилендиамина (3) от концентрации H2SO4 при аминировании пара-хлор-анилина.

Учитывая результаты функционализации хлорбензола [7] и пара-хлоранилина, электролизы системы Ti(IV)–NH2OH–о-ClC6H4NH2 проводили только в 16 М H2SO4.
При аминировании орто-хлоранилина, как и в случае пара-изомера, основным продуктом замещения является 4-Cl-1,3-ФДА, однако электрохимический процесс, в соответствии с нашими ожиданиями, протекает менее селективно (табл. 1). Наряду с 4-Cl-1,3-ФДА обнаруживаются также 2‑хлор-1,3-фенилендиамин (2-Cl-1,3-ФДА), 2‑хлор-1,4-фенилендиамин (2-Cl-1,4-ФДА), 3‑хлор-1,2-фенилендиамин (3-Cl-1,2-ФДА) и орто-фенилендиамин. 4-Cl-1,3-ФДА и 2-Cl-1,3-ФДА образуются, очевидно, из ионных пар и ионов орто-хлоранилиния, а два последних изомерных хлорфенилендиамина – из ассоциатов о‑ClC6H4NH2 ⋅ ${\text{HSO}}_{4}^{ - }$, присутствующих в 16 М серной кислоте в довольно малой концентрации. Поскольку водородная связь в ассоциатах слабее электростатического взаимодействия в ионных парах [5], повышение температуры электролита с 20 до 60°C сопровождается снижением выходов 2-Cl-1,4-ФДА и 3-Cl-1,2-ФДА (табл. 1) вследствие теплового движения компонентов электролита, выход орто-фенилендиамина при этом возрастает с 0.17 до 0.27%.
Таблица 1.
Влияние температуры на выходы по току изомерных хлорфенилендиаминов при аминировании орто-хлоранилина в 16 М H2SO4
| Т, °C | ВТ, % | ||||
|---|---|---|---|---|---|
| 4-Cl-1,3-ФДА | 2-Cl-1,3-ФДА | 2-Cl-1,4-ФДА | 3-Cl-1,2-ФДА | Ʃ | |
| 20 | 26.8 | 9.8 | 3.14 | 0.12 | 39.9 |
| 40 | 41.2 | 11.0 | 2.98 | 0.10 | 55.3 |
| 60 | 67.2 | 11.9 | 2.91 | 0.09 | 82.1 |
В эксперименте, выполненном при 20ºC, после потребления количества электричества более 150 Кл потенциал электрода смещается в область значений, при которых протекает процесс электрохимического восстановления ионов гидроксония (рис. 3). Повышение температуры электролиза способствует подавлению данного процесса и возрастанию общей эффективности замещения главным образом за счет образования 4-Cl-1,3-ФДА (табл. 1). Однако, несмотря на увеличение доли 4-Cl-1,3-ФДА, его селективный синтез из орто-хлоранилина в сернокислых средах, по-видимому, невозможен.
Рис. 3.
Кулонопотенциограммы, полученные при электрохимическом аминировании орто-хлоранилина в 16 М H2SO4.

Для уточнения общей картины процесса аминирования хлорбензола до хлорфенилендиаминов нами была осуществлена функционализация и мета-хлоранилина в 16 и 16.6 М H2SO4. Продуктами замещения для данного субстрата являются 2-Cl-1,4-ФДА, 4-Cl-1,2-ФДА, 3-Cl-1,2-ФДА, 5‑хлор-1,3-фенилендиамин (5-Cl-1,3-ФДА) и мета-фенилендиамин. При 40°C общие выходы хлорфенилендиаминов по току в этих средах достигают 61.9 и 69.3%. Повышение температуры раствора 16.6 М H2SO4 до 60°C приводит к увеличению общего ВТ хлорфенилендиаминов до 84.6%. Если при 40°C выходы 2-Cl-1,4-ФДА, 4‑Cl-1,2-ФДА, 3-Cl-1,2-ФДА, 5-Cl-1,3-ФДА и мета-фенилендиамина составляют соответственно 49.7, 16.0, 1.42, 2.23 и 1.44%, то при 60°C – 66.2, 15.2, 1.12, 2.09 и 2.18%.
Влияние температуры на выходы изомерных хлорфенилендиаминов хорошо согласуется с тем, что 2-Cl-1,4-ФДА – продукт аминирования главным образом ионных пар мета-хлоранилиния, а 4-Cl-1,2-ФДА и 3-Cl-1,2-ФДА – ассоциатов мета-хлоранилина. Тогда как наличие 5-Cl-1,3-ФДА определенно связано с функционализацией катионов мета-хлоранилиния (при 40°C ВТ 5-Cl-1,3-ФДА, составляющий в 16 М H2SO4 1.53%, меньше, чем в 16.6 М растворе). Незначительные количества 5-Cl-1,3-изомера, регистрируемые при аминировании мета-хлоранилина, подтверждают наш вывод о том, что при аминировании хлорбензола в сильнокислых средах именно связанные в ионные пары катионы мета-хлоранилиния отвечают за образование 2-Cl-1,4-ФДА [7]. Низкая реакционная способность ароматических колец катионов по сравнению с кольцами в ионных парах и явилась причиной отсутствия 5‑Cl‑1,3-ФДА в процессе функционализации хлорбензола [7].
По окончании процессов аминирования изомерных хлоранилинов в 15–17 М H2SO4 при 40 и 60°C католиты имели зеленовато-голубой (пара- и орто-хлоранилины) или серо-коричневый (мета-хлоранилин) цвет, переходящий в черно-фиолетовый, характерный для растворов Ti(III) [18], только после разбавления водой. Этот факт согласуется с полученными при аминировании хлорбензола данными [7], свидетельствующими об участии хлоранилинов в процессах комплексообразования с ионами титана. Обесцвечивание проб разбавленных католитов при добавлении к ним сернокислого гидроксиламина указывает на то, что в данных средах наблюдается полная конверсия гидроксиламина, и выходы продуктов замещения по току соответствуют выходам по источнику аминорадикалов.
При всех рассмотренных концентрациях H2SO4 общие выходы диаминосоединений по пара-, орто- и мета-хлоранилину являются количественными.
ЗАКЛЮЧЕНИЕ
Таким образом, данные, полученные в настоящей работе, находятся в полном соответствии с нашими представлениями о состоянии анилинов в сернокислых средах [1–8, 14] и интерпретацией результатов аминирования хлорбензола до изомерных хлорфенилендиаминов [7]. Повышение содержания серной кислоты в католите и его температуры ведет к снижению концентрации молекулярных ассоциатов хлоранилинов, увеличению доли ионных пар хлоранилиниев и, как следствие, возрастанию региоселективности замещения. Влияние дезактивированных по отношению к аминокатион-радикалам ионов хлор-анилиниев на состав хлорфенилендиаминов проявляется в незначительной степени даже в растворах 16–17 М H2SO4.
В средах с высоким содержанием кислоты, в которых отсутствуют ассоциаты пара-хлоранилина, совпадение ориентирующего влияния атома хлора и аммониевой группы соответственно в ионных парах и катионах пара-хлоранилиния дает возможность осуществить высокоселективный синтез 4-Cl-1,3-ФДА из пара-хлоранилина. В 17 М H2SO4 при 40°C выход по току (гидроксиламину) и массовая доля 4-Cl-1,3-ФДА достигают 91 и 99.7%. Схожие результаты наблюдаются и в 16 М H2SO4 при 60°C.
Список литературы
Лисицын, Ю.А., Каргин, Ю.М. Электрохимическое аминирование непредельных и ароматических соединений. Электрохимия. 2000. Т. 36. С. 103. [Lisi-tsyn, Yu.A. and Kargin, Yu.M., Electrochemical amination of unsaturated and aromatic compounds, Russ. J. Electrochem., 2000, vol. 36, p. 89.]
Лисицын, Ю.А., Каргин, Ю.М., Бусыгина, Н.В. Электрохимическое катион-радикальное аминирование ароматических соединений. Рос. хим. журн. 2005. Т. 49. № 5. С. 121. [Lisitsyn, Yu.A., Kargin, Yu.M., and Busygina, N.V., Electrochemical radical cation amination of aromatic compounds, Ross. Khim. Zhurn. (in Russian), 2005, vol. 49, no. 5, p. 121.]
Лисицын, Ю.А., Сухов, А.В. Селективное аминирование анилинов, содержащих в четвертом положении орто-пара-ориентирующие заместители, до соответствующих 1,3-фенилендиаминов. Журн. орган. химии. 2015. Т. 51. С. 452. [Lisitsyn, Yu.A. and Sukhov, A.V., Selective Synthesis of Benzene-1,3-diamines by Amination of Anilines Containing ortho/para-Orienting Substituents in the para Position, Russ. J. Organ. Chem., 2015, vol. 51, p. 439.]
Лисицын, Ю.А., Сухов, А.В. Электрохимическое аминирование. Синтез анилина в водно-ацетонитрильных растворах серной кислоты. Электрохимия. 2015. Т. 51. С. 1229. [Lisitsyn, Yu.A. and Sukhov, A.V., Electrochemical Amination. Synthesis of Aniline in Aqueous–Acetonitrile Solutions of Sulfuric Acid, Russ. J. Electrochem., 2015, vol. 51, p. 1092.]
Лисицын, Ю.А., Сухов, А.В. Электрохимическое аминирование. Селективное введение двух аминогрупп в ароматическое кольцо. Журн. общ. химии. 2017. Т. 87. С. 20. [Lisitsyn, Yu.A. and Sukhov, A.V., Electrochemical Amination. Selective Introduction of Two Amino Groups into an Aromatic Ring, Russ. J. Gen. Chem., 2017, vol. 87, p. 16.]
Лисицын, Ю.А., Сухов, А.В. Электрохимическое аминирование бензола в водно-уксуснокислых растворах серной кислоты. Журн. общ. химии. 2017. Т. 87. С. 737. [Lisitsyn, Yu.A. and Sukhov, A.V., Electrochemical Amination of Benzene in Aqueous-Acetic Solutions of Sulfuric Acid, Russ. J. Gen. Chem., 2017, vol. 87, p. 929.]
Лисицын, Ю.А., Сухов, А.В. Электрохимическое аминирование хлорбензола в водно-органических растворах серной кислоты. Электрохимия. 2018. Т. 54. № 10 Приложение. С. S62. [Lisitsyn, Yu.A. and Sukhov, A.V., Electrochemical Amination of Chlorobenzene in Aqueous-Organic Solutions of Sulfuric Acid, Russ. J. Electrochem., 2018, vol. 54, no. 11, p. 886.]
Лисицын, Ю.А., Сухов, А.В. Электрохимическое аминирование. Селективная функционализация пара- и орто-анизидинов в водных растворах серной кислоты. Электрохимия. 2019. Т. 55. № 1. С. 125. [Lisitsyn, Yu.A. and Sukhov, A.V., Electrochemical Amination. Selective Functionalization of para- and ortho-Anisidines in Aqueous Sulfuric Acid Solutions, Russ. J. Electrochem., 2018, vol. 54, no. 12, p. 1294.]
Сайкс, П. Механизмы реакций в органической химии, М.: Химия, 1991. 448 с. [Sykes, P., A Guidebook to Mechanisms in Organic Chemistry, Longman Publishing Group, 1986. 416 p.]
Ингольд, К. Теоретические основы органической химии, М.: Мир, 1973. 1055 с. [Ingold, C.K, Structure and mechanism in organic chemistry, Ithaca and London: Cornell University press, 1969. 1266 p.]
Вулах, Е.Л., Черных, Т.Е., Чернобровкина, М.Н., Мельников, А.И., Боровлев, А.А., Никуленко, С.Н., Иванов, О.Н., Федотов, П.И., Меркин, А.А. Способ получения хлорзамещенных фенилендиаминов, Пат. 2547264 (Россия). 2015. [Vulakh, E.L., Chernykh, T.E., Chernobrovkina, M.N., Mel’nikov, A.I., Borovlev, A.A., Nikulenko, S.N., Ivanov, O.N., Fedotov, P.I., and Merkin, A.A., Method of producing chlorine-substituted phenylenediamines, Patent 2547264 (Russia), 2015.]
Коренман, И.М. Экстракция в анализе органических веществ, М.: Химия, 1977. 200 с. [Korenman, I.M., Extraction in the analysis of organic compounds (in Russian), Moscow: Khimiya, 1977. 200 p.]
Коренман, И.М. Константы распределения органических веществ между двумя жидкими фазами, Вып. 5. Горький: Изд-во Горьк. гос. ун-та, 1979. С. 29. [Korenman, I.M., The distribution constants of organic compounds between two liquid phases (in Russian), no. 5, Gor`ki: Gor’ki State Univ., 1979. p. 29.]
Лисицын, Ю.А., Макарова, О.Н., Каргин, Ю.М. Электрохимическое аминирование. VII. Введение аминогруппы в ароматическое кольцо. Журн. общ. химии. 1999. Т. 69. С. 286. [Lisitsyn, Yu.A., Makarova, O.N., and Kargin, Yu.M., Electrochemical amination: VII. Introduction of amino group into aromatic ring, Russ. J. Gen. Chem., 1999, vol. 69, p. 275.]
Дамаскин, Б.Б., Некрасов, Л.Н., Петрий, О.А., Подловченко, Б.И., Стенина, Е.В., Федорович, Н.В. Электродные процессы в растворах органических соединений, М.: Изд-во Моск. ун-та, 1985. С. 258. [Damaskin, B.B., Nekrasov, L.N., Petriy, O.A., Podlovchenko, B.I., Stenina, E.V., and Fedorovich, N.V., Electrode processes in solutions of organic compounds (in Russian), Moscow: Publ. house Moscow univ., 1985. p. 258.]
Fatouros, N., Krulic, D., and Larabi, N., Electrochemical kinetics of the Ti(IV)/Ti(III) couple in sulfuric acid, J. Electroanal. Chem., 2004, vol. 568, p. 55.
Лисицын, Ю.А., Бусыгина, Н.В., Зявкина, Ю.И., Штырлин, В.Г. Электрохимическое аминирование. Медиаторная система Ti(IV)/Ti(III) в водных растворах серной кислоты. Электрохимия. 2010. Т. 46. С. 544. [Lisitsyn, Yu.A., Busygina, N.V., Zyavkina, Yu.I., and Shtyrlin, V.G., Electrochemical amination. Ti(IV)/Ti(III) mediator system in aqueous solutions of sulfuric acid, Russ. J. Electrochem, 2010, vol. 46, p. 512.]
Реми, Г. Курс неорганической химии, Т. 2. М.: Мир, 1974. С. 69. [Remy, H., Lehrbuch der Anorganischen Chemie, Band II, Leipzig: Akademische Verlagsgesellschaft Geest & Portig K.-C., 1961. 1023 p.]
Дополнительные материалы отсутствуют.



