Электрохимия, 2020, T. 56, № 6, стр. 558-567
Исследование окисления органического сульфида на графитовом электроде, модифицированном наночастицами Co, Fe и Ni
Г. С. Фирдоуси a, М. Джафариан a, *, С. Райати a, П. Нафарих a
a Технологический университет им. Насир ад-Дина Туси
1541849611 Тегеран, Иран
* E-mail: mjafarian@kntu.ac.ir
Поступила в редакцию 22.10.2018
После доработки 06.05.2019
Принята к публикации 11.07.2019
Аннотация
Электроокисление метилфенилсульфида на Ni, Co, Fe и их сплавах на графитовом электроде в уксусной кислоте в качестве нетоксичного растворителя исследовано с целью получения сульфоксида и сульфона. Модифицированные электроды готовили методом циклической вольтамперометрии. Морфологию поверхности электрода исследовали методом сканирующей электронной микроскопии, а присутствие наночастиц металлов на графите – методом рентгеновской дифракции. Каталитическая обработка и синергическое воздействие на модифицированных электродах исследовались электрохимическими методами – циклической вольтамперометрией и хроноамперометрией. Эксплуатационные характеристики модифицированных электродов оказались хорошими. В присутствии метилфенилсульфида модифицированный электрод графит/CoFe демонстрирует наилучшие характеристики в отношении электроокисления. Наблюдается линейная зависимость между корнем квадратным из скорости развертки потенциала и анодным током (при небольших скоростях развертки), что указывает на диффузионный контроль процесса. Для электрохимического окисления метилфенилсульфида определены коэффициент диффузии, гетерогенная константа скорости и коэффициент электронного переноса. Исследовано электроокисление метилфенилсульфида в ходе электролиза; продукты окисления изучены методом газовой хроматографии. На основе хроматографических данных установлено, что продуктами электролиза метилфенилсульфида являются метилфенилсульфоксид и метилфенилсульфон. Предложен механизм электроокисления метилфенилсульфида. Это первое использование неблагородных металлов в качестве электрокатализаторов при электроокислении органических сульфидов позволило разработать очень легкий, доступный по цене и быстрый метод приготовления модифицированных электродов с высокой производительностью, не требующий применения окислителей и сопутствующих катализаторов, позволяющий использовать гомогенные среды с подходящей электропроводностью для окисления нерастворимых в воде соединений. Продемонстрированы важные свидетельства в пользу применения описанной методики и электродов в последующих исследованиях сульфидов.
ВВЕДЕНИЕ
Окисление органических соединений и, в особенности, окисление сульфидов – важная область исследований в химии [1], поскольку продукты окисления сульфидов (сульфоксиды и сульфоны) являются важными исходными реагентами для производства противогрибковых, противоатеросклеротических и антибактериальных медицинских препаратов [1, 2]. С другой стороны, окисление сульфидов очень важно для контроля загрязнения воздуха, воды, и производств [3], так как некоторые сульфиды – это отходы бумажной, нефтяной и горнодобывающей промышленности [4]. Процесс десульфирования путем окисления – интересный путь, поскольку окислительное десульфирование проще, чем общепринятый процесс гидродесульфирования [5, 6]. Среди возможных окислителей, пероксид водорода – это недорогой, чистый и легко доступный окислитель, но ему требуется активатор для полной реализации его возможностей. Многие исследователи использовали в качестве такого активатора пероксида водорода различные кислоты: трифторуксусную, муравьиную, уксусную и гетерополикислоты. Хотя использование гомогенных катализаторов вполне успешно, но их трудно регенерировать [7]. Было затрачено много усилий для того, чтобы разработать гетерогенные методы, такие как использование твердых подложек, включая органосиликаты, углеродистые материалы, силиконовые материалы и цеолиты. Для этой цели ряд исследователей использовали пероксид водорода со стабилизированными порфиринами [8, 9], ионной жидкостью [2], полиионной жидкостью [10], комплексами металлов [1, 11, 12] или оксидом графена [7] в качестве возобновляемых катализаторов. Однако твердые катализаторы обычно деактивируются в ходе реакции, так как их поверхность отравляется [5]. В результате в присутствии гетерогенных катализаторов скорость преобразования оказывается меньше, чем в присутствии гомогенных катализаторов. Кроме того, многие окислители могут реагировать с катализаторами, разрушая их.
С другой стороны, электрохимические методики обычно более доступны, более избирательны, более экологичны и легче, чем химические. Кроме того, побочные продукты электрохимических реакций могут быть преобразованы в целевые продукты и в конце концов в электрохимические реакции, здесь нет проблем с растворимостью, которые обычно возникают с неорганическими окислительно-восстановительными реагентами в органических растворителях [13]; наконец, электрохимические эксперименты занимают меньше времени и не нуждаются в дополнительных анализах [6]. В электрохимических методиках электрокатализ играет очень важную роль в промышленном производстве. Обычно электрокатализаторы – это благородные металлы или их сплавы, но они дороги и их запасы ограничены. Поэтому разработка электрокатализаторов из неблагородных металлов – важная задача [14]. Среди таких электрокатализаторов модифицированные электроды имеют меньшее перенапряжение, они более чувствительны и избирательны [3].
Давно установлено, что никель, кобальт, железо и их сплавы и сочетания могут быть использованы в качестве эффективных электрокатализаторов для окисления органических соединений, таких как глюкоза [15], этиленгликоль и глицерин [16], аскорбиновая кислота [17], метанол, этанол и другие спирты [18–27]. Однако не существует публикаций о неблагородных металлах как электрокатализаторах окисления органических сульфидов, а во всех предшествующих публикациях для окисления использовались химические окислители. К тому же у углерода большая площадь поверхности, пористая структура и большая электропроводность; по этой причине он представляет собой хороший выбор в качестве механической подложки [28].
Соответственно, из-за важности процесса окисления сульфидов для различных областей мы исследовали обработку графитовых электродов наночастицами Ni, Co и Fe и их синергическое воздействие на окисление метилфенилсульфида (в качестве образца сульфидов), как очень легкий, недорогой и высокопроизводительный метод окисления сульфидов в нетоксичном растворителе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и растворы
Все использованные реактивы имели квалификацию “ч. д. а.” и использовались без дополнительной очистки. Метилфенилсульфид, гидроксид натрия, гексагидрат хлорида никеля(II), гексагидрат сульфата железа(II), гексагидрат хлорида кобальта(II) – все эти реактивы были приобретены у химической компании Merck. Уксусная кислота была приобретена у компании Ameretat Shimi. Все растворы готовили на деионизованной воде.
Приборы
Использовали электрохимическую ячейку трехэлектродной конфигурации. Противоэлектродом служил графитовый стержень, а рабочим электродом – такой же графитовый стержень, но модифицированный. Все потенциалы записывались по отношению к Ag/AgCl (насыщ. KCl)-электроду сравнения. Установку дополнял потенциостат/гальваностат EG&G, модель 273A. Установкой управлял персональный компьютер с коммерческим программным обеспечением M270 и M398 через интерфейс GPIB. Морфологию поверхности рабочего электрода исследовали методом сканирующей электронной микроскопии (SEM) на приборе HIT 416002. Рентгенофазовый анализ выполняли на рентгеновском дифрактометре X’Pert Pro. Процесс окисления изучали с помощью газового хроматографа HP Agilent 7890, снабженного капиллярной колонной HP-5 (фенилметилсилоксан 30 × 320 × 0.25 мм) и пламенно-ионизационным детектором. Все эксперименты проводили при температуре 298 K.
Приготовление модифицированных электродов
Рабочими электродами служили графитовые стержни. Сначала их помещали в раствор аммиака (25%) на 24 ч. Далее, эти графитовые стержни покрывали раствором смолы и отвердителя (10 : 1) и сушили; поверхность электродов полировали механически, промывали и сушили мягкой тканью. Осаждение никеля, кобальта, железа и их сплавов на графитовые стержни с чистой поверхностью проводили по электрохимической методике [18].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пленки металлов на графитовых электродах осаждали методом циклической вольтамперометрии в области потенциалов от –0.6 до –1.5 В (Ag/AgCl) (50 циклов) из раствора 1 M CoCl2 ⋅ 6H2O при осаждении Co, 1 M NiCl2 ⋅ 6H2O при осаждении Ni, 1 M FeSO4 ⋅ 6H2O при осаждении Fe, 1 M CoCl2 ⋅ ⋅ 6H2O + 1 M NiCl2 ⋅ 6H2O при осаждении CoNi n, 1 M CoCl2 ⋅ 6H2O + 1 M FeSO4 ⋅ 6H2O при осаждении CoFe и 1 M NiCl2 ⋅ 6H2O + 1 M FeSO4 ⋅ 6H2O при осаждении FeNi. Затем на этих электродах методом циклической вольтамперометрии формировали гидроксиды металлов в области потенциалов от 0 до 1 В (50 циклов) из раствора 1 M NaOH. На рис. 1 и 2 приведены циклические вольтамперограммы приготовления осадков Ni в качестве образца модифицированного электрода. Как видно из рис. 1, пик тока восстановления при –1.2 В связан восстановлением иона никеля на поверхности графитового электрода. На рис. 2 представлены последовательно снятые циклические вольтамперограммы электрода графит/Ni в 1 M растворе NaOH при скорости развертки потенциала 100 мВ/с. На этих кривых пару окислительно-восстановительных пиков тока при потенциалах 500 и 50 мВ отн. Ag/AgCl-электрода сравнения следует приписать окислительно-восстановительной паре Ni2+/Ni3+ в щелочной среде. В целом, поведение электрода находится в хорошем согласии с прежними сообщениями об образовании и внутренних превращениях α- и β-фаз Ni(OH)2, их превращении в NiOOH и обогащении частицами Ni3+ их поверхности или приповерхностной зоны. Повышение базового тока в этих циклах связано с окислением Ni до Ni(II).
Рис. 1.
Циклические вольтамперограммы осаждения Ni в области потенциалов от –0.6 до –1.5 В (Ag/AgCl) (50 циклов) из раствора 1 M NiCl2 ⋅ 6H2O при скорости развертки потенциала 100 мВ/с. (Площадь поверхности электрода 12.56 мм2.)
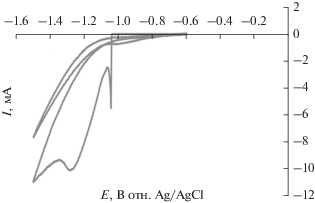
Рис. 2.
Циклические вольтамперограммы осаждения Ni(OH)2 и NiOOH в области потенциалов от 0 до 1 В (Ag/AgCl) (50 циклов) из раствора 1 M NaOH при скорости развертки потенциала 100 мВ/с. (Площадь поверхности электрода 12.56 мм2.)

Анализ методами сканирующей электронной микроскопии и рентгеновской дифракции
На рис. 3 и 4 даны SEM-микрофотографии графитового электрода и электрода графит/CoFe при различных увеличениях. Как можно видеть из рис. 3б, после электрохимического модифицирования Fe и Co образуют на поверхности графита наноструктуры типа “цветной капусты”, что подтверждает успешное модифицирование графитового электрода. На рис. 5 приведены рентгеновские дифрактограммы электрода графит/CoFe. Существование различных пиков при 2θ = 34°, 39.5°, 57.5°, 68.5°, 72° для Co и 2θ = 34.5°, 40.5°, 44.5°, 54.5° и 73° для Fe говорит о том, что на графитовом электроде успешно образованы частицы металлов. Для того чтобы оценить размер этих частиц, образовавшихся на графите, мы использовали формулу Шеррера
Здесь, τ – размер кристаллитов, K – безразмерный фактор формы, λ – длина волны рентгеновского излучения, β – уширение полосы на полувысоте интенсивности в максимуме (FWHM), а θ – брэгговский угол. Вычисленный на основании формулы Шеррера размер кристаллитов составляет 41 нм.Влияние состава электролита
Для выбора подходящего электролита, способного растворять органические сульфиды, достаточно электропроводного и нетоксичного, мы провели соответствующее исследование с графитовым электродом, модифицированным Ni (в качестве примера модифицированного электрода). В конце концов, выбрали смесь 10 мл ледяной уксусной кислоты и 1 мл 1 М раствора NaOH. Как показано на рис. 6, для повышения электропроводности к уксусной кислоте добавляли ацетат натрия. Однако из-за образования ионных пар электропроводность не слишком сильно увеличилась. После добавления 1 мл воды к смеси уксусной кислоты и ацетата натрия электропроводность выросла, так как добавленная вода уменьшила эффект образования ионных пар между уксусной кислотой и ацетатом натрия. Таким образом, наилучший электролит с большой электропроводностью – это смесь (90/10) уксусной кислоты с 1 М раствором NaOH; она и использовалась в последующих опытах. Такая смесь лучше, чем другие среды, потому что присутствующие в ней ионы OH, адсорбируясь на поверхности электрода, активируют электрокатализатор. Исходя из удельного сопротивления исследованных электролитов, смесь уксусной кислоты с ацетатом натрия и водой имеет удельное сопротивление втрое выше, чем смесь уксусной кислоты с 1 М раствором NaOH, так что эти два электролита различаются очень сильно.
Рис. 6.
Исследование влияния состава раствора на модифицированном электроде (графит/Ni) в системах: уксусная кислота, уксусная кислота + ацетат натрия, уксусная кислота + ацетат натрия + вода и уксусная кислота + гидроксид натрия + вода.

Rуксусная кислота = 0.18 × 106 Ω.
Rуксусная кислота+ ацетат натрия = 0.12 × 106 Ω.
R = 0.045 × 106 Ω.
Rуксусная кислота+ гидроксид натрия + вода = 0.0138 × 106 Ω.
Оценка поведения модифицированных графитовых электродов
Каждый приготовленный электрод оценивали как электрокатализатор. Было показано, что графитовые электроды, модифицированные наночастицами железа и кобальта, отличаются наиболее высокой электрокаталитической активностью. На рис. 7 показаны циклические вольтамперограммы графитового электрода с чистой поверхностью и модифицированного Co и Fe, в электролите в присутствии и в отсутствие 2 × 10–5 М метилфенилсульфида, снятые в области потенциалов от 0.2 до 2.5 В (Ag/AgCl).
Рис. 7.
Циклические вольтамперограммы (a) графитового электрода и (б) графитового электрода, модифицированного CoFe (1) в отсутствие и (2) в растворе метилфенилсульфида (2 × 10–5 М) в кислой среде. Скорость развертки потенциала 100 мВ/с. (Площадь поверхности электрода 0.78 мм2.)

Рассмотрим вначале окисление метилфенилсульфида на графитовом электроде с чистой поверхностью. Как видно из рис. 7, добавление метилфенилсульфида (2 × 10–5 М) к кислому раствору (кривая a2) не только не увеличивает электрохимический ток, но и снижает анодный ток из-за повышения сопротивления раствора. Это означает, что добавленный метилфенилсульфид не окисляется.
Использование (G/CoFe) графитовых электродов, модифицированных наночастицами железа и кобальта, для окисления сульфида оказалось успешным: после добавления метилфенилсульфида к кислому раствору наблюдается значительное увеличение плотности анодного тока (кривая б2). Действительно, электрод графит/CoFe демонстрирует значительную электрокаталитическую активность по отношению к окислению метилфенилсульфида.
На рис. 8 дано общее сравнение модифицированных графитовых электродов в растворе 2 × 10–5 М метилфенилсульфида в области потенциалов от 0.2 до 2.5 В (Ag/AgCl). Как видно из рис. 8, из всех модифицированных электродов тот, что модифицирован бинарным сплавом CoFe, показал самую высокую плотность тока. Поэтому именно этот электрод выбран, как наилучший электрокатализатор для последующего изучения окисления сульфида. Следует отметить, что как рис. 4, так и рис. 8 показывают необратимый характер электроокисления метилфенилсульфида.
Рис. 8.
Циклические вольтамперограммы электродов (1) из графита, (2) графит/Ni, (3) графит/FeNi, (4) графит/CoNi, (5) графит/Co, (6) графит/Fe и (7) графит/CoFe в растворе метилфенилсульфида (2 × 10–5 М) в кислой среде. Скорость развертки потенциала 100 мВ/с. (Площадь поверхности электрода: 0.78 мм2.)

Зная площадь поверхности, из циклических вольтамперограмм, снятых для электроосаждения Fe и Co на графитовый электрод (рисунок не приводится), по закону Фарадея определили, что на поверхность графита осаждено приблизительно 260 монослоев Fe и Co, а полная толщина полученного покрытия составляет около 65 нм.
Влияние концентрации метилфенилсульфида
На рис. 9 показаны циклические вольтамперограммы модифицированного электрода в кислой среде для различных концентраций метилфенилсульфида (0–12 × 10–5 М), снятые при скорости развертки потенциала 100 мВ/с. Рисунок показывает, что анодный ток растет при увеличении концентрации метилфенилсульфида. Кроме того, Co и Fe оказывают синергическое воздействие на окисление метилфенилсульфида. Отсутствие катодного пика тока в присутствии метилфенилсульфида указывает на необратимый характер процесса. Следует отметить, что при концентрации, равной 1 × 10–4 М (рис. 9б), анодный ток остается постоянным из-за насыщения активных мест на поверхности модифицированного электрода.
Рис. 9.
Циклические вольтамперограммы (a), снятые на электроде графит/CoFe в кислом растворе в присутствии 0, 2 × 10–5, 4 × 10–5, 8 × 10–5, 10 × 10–5 и 12 × 10–5 М метилфенилсульфида (скорость развертки потенциала 100 мВ/с). Связь между концентрацией метилфенилсульфида и анодным пиковым током (б). (Площадь поверхности электрода 0.78 мм2.)

При исследовании электроокисления метилфенилсульфида на графитовом электроде, модифицированном Co и Fe, была использована хроноамперометрия. На рис. 10 показана хроноамперограмма, полученная в растворе, содержащем 12 × 10–5, согласуется с циклической вольтамперограммой; ток окисления метилфенилсульфида равняется приблизительно 200 мкA. Также не наблюдается тока, отвечающего обратной реакции.
Рис. 10.
Двухступенчатая хроноамперограмма электрода графит/CoFe в кислой среде в присутствии 12 × 10–5 М метилфенилсульфида. (Площадь поверхности электрода 0.78 мм2.) Ступень потенциала 1: 2.238 В, ступень потенциала 2: 0.4 В, t1 и t2: 100 с.

Для того, чтобы полнее оценить эффективность электрода графит/CoFe, снимали типичные хроноамперограммы при последовательном добавлении метилфенилсульфида к электролиту (на каждой ступени добавляли по 4 порции по 4 мкл, так что финальная концентрация на каждой ступени составляла 0.006, 0.012, 0.018 и 0.024 M). Как видно на рис. 11, отклик электрода быстрый, и с ростом концентрации метилфенилсульфида анодный ток увеличивается.
Результаты классического анализа
Для получения кинетических характеристик мы исследовали влияние скорости развертки потенциала на каждый скан. Рисунок 12 демонстрирует влияние скорости развертки потенциала на циклические вольтамперограммы электрода графит/CoFe в присутствии 0.1 М метилфенилсульфида при 298 K. Как видно из рисунка, с ростом скорости развертки потенциала анодный ток возрастает, а потенциал пика тока становится положительнее, что указывает на необратимый характер реакции на электроде. Из литературы о необратимых реакциях известно, что величина $\left| {{{E}_{{\text{р}}}} - {{E}_{{{\text{р/2}}}}}} \right|$ пропорциональна корню квадратному из скорости развертки потенциала. По отрезку, отсекаемому на оси графиком (рис. 12б), по формуле [29]:
(2)
$\left| {{{E}_{{\text{р}}}} - {{E}_{{{\text{р/2}}}}}} \right| = \frac{{47.7}}{{n\alpha }}\,\,{\text{мВ}}\,\,{\text{при 25}}^\circ {\text{C}}$(3)
${{i}_{{\text{p}}}} = 2.99 \times {{10}^{5}}{{(n\alpha )}^{{1/2}}}A{{c}_{0}}D_{0}^{{1/2}}{{v}^{{1/2}}},$Рис. 12.
Циклические вольтамперограммы (a), снятые на электроде графит/CoFe в кислой среде в присутствии 0.1 М метилфенилсульфида при скорости развертки потенциала 5, 10, 20, 40, 80, 160 и 320 мВ/с. Зависимость $E{\text{p}} - E{\text{p/}}2$ от корня квадратного из скорости развертки потенциала (б). Зависимость анодного пикового тока от корня квадратного из скорости развертки потенциала (0–10 мВ/с) (в). Зависимость анодного пикового тока от логарифма скорости развертки потенциала (г).

(4)
$\begin{gathered} {{E}_{{{\text{pa}}}}} = {{E}^{0}} + \frac{{RT}}{{\left( {1 - \alpha } \right)nF}}\ln \left( {\frac{{\left( {1 - \alpha } \right)nF}}{{RT{{k}_{{{\text{et}}}}}}}} \right) + \\ + \,\,\frac{{RT}}{{\left( {1 - \alpha } \right)nF}}\ln v. \\ \end{gathered} $Согласно этому уравнению, наклон графика зависимости потенциала анодного пика тока (Epa) от логарифма скорости развертки потенциала (рис. 12г) дает (1 – α)n, а ket может быть получена из величины отрезка, отсекаемого графиком на оси. Для определения ket необходимо знание стандартного электродного потенциала (E0). Поскольку в литературе отсутствует величина E0 для этой реакции, для подстановки в это уравнение мы воспользовались величиной потенциала окисления; как результат, ket оказалась равной 9.8 × 10–6.
Влияние температуры на окисление метилфенилсульфида
Специальными электрохимическими опытами было изучено влияние температуры на электроокисление метилфенилсульфида. Их проводили при различных температурах. На рис. 13 видно, что с ростом температуры электроокисление ускоряется и что наилучшая температура равняется 323 K. При более высоких температурах, чем 323 K, электрод графит/CoFe неустойчив.
Рис. 13.
Циклические вольтамперограммы, снятые на электроде графит/CoFe в кислой среде в присутствии 0.1 М метилфенилсульфида при температуре 273, 283, 298, 308, 323 K. Скорость развертки потенциала 5 мВ/с. (Площадь поверхности электрода: 14.51 мм2.)

В типичном опыте пять смесей 0.3 M метилфенилсульфида (0.1 мл) в качестве образца сульфида, уксусной кислоты (2.5 мл) в качестве нетоксичного растворителя и 1 М раствора гидроксида натрия (0.3 мл) в качестве индифферентного электролита подвергались электролизу с модифицированным электродом графит/CoFe в течение 0, 14, 28, 57 и 157 мин (током 0.025 A) при комнатной температуре (площадь поверхности электрода: 57.25 мм2). Продукты реакции исследовали методом газовой хроматографии. Результаты представлены в табл. 1. Данные газовой хроматографии говорят о том, что с ростом времени электролиза выход по веществу увеличивается. В соответствии с законом Фарадея, для 157-минутного электролиза ожидаемый выход продукта – 100% – почти равен выходу, найденному методом газовой хроматографии (выход по веществу = 91%) [29]. При длительном электролизе, благодаря подкислению раствора, устранено разрушение электрода. На модифицированном электроде возможна адсорбция реагента и продуктов реакции.
I – ток в единицах ампер: 0.025 A; t – время в секундах: 9420 с (157 мин); n – число перенесенных электронов: 2; F – постоянная Фарадея: 96 485 Кл/моль.Таблица 1.
Влияние продолжительности электролиза на выход по веществу
| Реагент | Продолжительность электролиза, мин | Выход, % | Продукт |
|---|---|---|---|
| Метилфенилсульфид | 0 | 0 | Метилфенилсульфоксид/метилфенилсульфон |
| Метилфенилсульфид | 14 | 0 | Метилфенилсульфоксид/метилфенилсульфон |
| Метилфенилсульфид | 28 | 8 | Метилфенилсульфоксид/метилфенилсульфон |
| Метилфенилсульфид | 57 | 45 | Метилфенилсульфоксид/метилфенилсульфон |
| Метилфенилсульфид | 157 | 91 | Метилфенилсульфоксид/метилфенилсульфон |
Механизм реакции
Результаты настоящего исследования и прежде всего циклические вольтамперограммы показывают, что реакция электроокисления сульфида протекает в одну стадию, поскольку на вольтамперограмме виден только один пик тока при любой скорости развертки потенциала. Для дальнейшего исследования механизма реакции в типичном опыте измеряли методом циклической вольтамперометрии концентрацию метилфенилсульфида в различные моменты времени (0, 20, 40, 100 с). С течением времени ток окисления возрастал и в конце концов достиг своего предельного значения в результате адсорбции сульфида на поверхности электрокатализатора и ускорения реакции окисления (схемы 1, 2 ).
Схема 1 . Суммарная реакция электроокисления сульфида.
Схема 2 . Предлагаемый механизм электроокисления сульфида.
ЗАКЛЮЧЕНИЕ
В настоящей работе с помощью модифицированных электродов успешно проведено окисление метилфенилсульфида в уксусной кислоте в качестве нетоксичного растворителя. Эти модифицированные электроды были приготовлены с помощью электрохимического метода. Полученные результаты показывают, что модифицированные электроды – графит/Co, графит/Fe и графит/CoFe – наиболее эффективные катализаторы электроокисления метилфенилсульфида. В растворе метилфенилсульфида модифицированный электрод графит/CoFe показал наивысшую эффективность в его окислении. Исследованы зависимости анодного тока от скорости развертки потенциала и концентрации метилфенилсульфида. Показано, что Fe и Co оказывают синергическое воздействие на систему. Результаты исследований методом газовой хроматографии позволяют заключить, что продуктами электроокисления метилфенилсульфида являются метилфенилсульфоксид и метилфенилсульфон, причем с течением времени выход по веществу возрастает.
Простота приготовления электродов и отсутствие необходимости использовать окислители и активировать катализатор – вот главные основания для использования описанных методик и электродов в дальнейших исследованиях сульфидов.
Список литературы
Rayati, S., Khodaei, E., Jafarian, M., and Wojtczak, A., Mn-Schiff base complex supported on magnetic nanoparticles: Synthesis, crystal structure, electrochemical properties and catalytic activities for oxidation of olefins and sulfides, Polyhedron, 2017, vol. 133, p. 327.
Fareghi-Alamdari, R., Zekri, N., Moghadam, A.J., and Farsani, M.R., Green oxidation of sulfides to sulfoxides and sulfones with H2O2 catalyzed by ionic liquid compounds based on Keplerate polyoxometalates, Catal. Commun., 2017, vol. 98, p. 71.
Paim, L.L. and Stradiotto, N.R., Electrooxidation of sulfide by cobalt pentacyanonitrosylferrate film on glassy carbon electrode by cyclic voltammetry, Electrochim. Acta, 2010, vol. 55, p. 414.
Miller, B. and Chen, A., Effect of concentration and temperature on electrochemical oscillations during sulfide oxidation on Ti/Ta2O5–IrO2 electrodes, Electrochim. Acta, 2005, vol. 50, p. 2203.
Muñoz, M., Gallo, M.A., Gutiérrez-Alejandre, A., Gazzoli, D., and Cabello, C.I., Molybdenum-containing systems based on natural kaolinite as catalysts for selective oxidation of aromatic sulfides, Appl. Catal. B Environ., 2017, vol. 219, p. 683.
Hristova, E., Mitov, M., Rashkov, R., Arnaudova, M., and Popov, A., Sulphide oxidation on electrodeposited Ni–Mo–W catalysts, Bulg. Chem. Commun., 2008, vol. 40, p. 291.
Abdi, G., Alizadeh, A., and Khodaei, M.M., Highly carboxyl-decorated graphene oxide sheets as metal-free catalytic system for chemoselective oxidation of sulfides to sulfones, Mater. Chem. Phys., 2017, vol. 201, p. 323.
Rayati, S., Nejabat, F., and Zakavi, S., Chemoselective oxidation of sulfides to sulfoxides with urea hydrogen peroxide UHP, catalyzed by non-, partially and fully ??-brominated meso-tetraphenylporphyrinatomanganeseIII, acetate, Inorg. Chem. Commun., 2014, vol. 40, p. 82.
Rayati, S. and Nejabat, F., Catalytic activity of Fe-porphyrins grafted on multiwalled carbon nanotubes in the heterogeneous oxidation of sulfides and degradation of phenols in water, Comptes Rendus Chim., 2017, vol. 20, p. 967.
Rafiee, E. and Shahebrahimi, S., Organic-inorganic hybrid polyionic liquid based polyoxometalate as nano porous material for selective oxidation of sulfides, J. Mol. Struct., 2017, vol. 1139, p. 255.
Rayati, S. et al., Ni(II), and V(IV), Schiff base complexes derived from 2,2'-dimethylpropandiamine: the crystal structure, electrochemical properties and catalytic activities in oxidation of sulfides, J. Coord. Chem., 2017, vol. 70, p. 1424.
Rayati, S. et al., Cu-Schiff base complex grafted onto graphene oxide nanocomposite: Synthesis, crystal structure, electrochemical properties and catalytic activity in oxidation of olefins, Inorg. Chim. Acta, 2017, vol. 466, p. 520.
Hammerich, O. and Speiser, B., Organic Electrochemistry: Revised and Expanded, CRC Press, 2015.
Dai, L., Carbon-based Catalysts for Metal-free Electrocatalysis, Curr. Opin. Electrochem. 2017.
Ferdowsi, G.S., Seyedsadjadi, S.A., and Ghaffarinejad, A., Electroless Deposition of the Ni Nanoparticles on the Graphite Electrode for Glucose Oxidation, 2014.
Lin, Q., Wei, Y., Liu, W., Yu, Y., and Hu, J., Electrocatalytic oxidation of ethylene glycol and glycerol on nickel ion implanted-modified indium tin oxide electrode, Int. J. Hydrogen Energy, 2017, vol. 42, p. 1403.
Petersson, M., Electrocatalytic oxidation of ascorbic acid and voltammetric determination with a ferrocene-modified platinum electrode, Anal. Chim. Acta, 1986, vol. 187, p. 333.
Rostami, T., Jafarian, M., Miandari, S., Mahjani, M.G., and Gobal, F., Synergistic effect of cobalt and copper on a nickel-based modified graphite electrode during methanol electro-oxidation in NaOH solution, Cuihua Xuebao/Chinese J. Catal., 2015, vol. 36, p. 1867.
Ferdowsi, G.S., Seyedsadjadi, S.A., and Ghaffarinejad, A., Ni nanoparticle modified graphite electrode for methanol electrocatalytic oxidation in alkaline media, J. Nanostructure Chem., 2015, vol. 5, 17.
Amin, R.S., Hameed, R.M.A., El-Khatib, K.M., Youssef, M.E., and Elzatahry, A.A., Pt–NiO/C anode electrocatalysts for direct methanol fuel cells, Electrochim. Acta, 2012, vol. 59, p. 499.
Osmieri, L. et al., Fe–N/C catalysts for oxygen reduction reaction supported on different carbonaceous materials. Performance in acidic and alkaline direct alcohol fuel cells, Appl. Catal. B Environ., 2017, vol. 205, p. 637.
Muench, F. et al., Electroless synthesis of nanostructured nickel and nickel–boron tubes and their performance as unsupported ethanol electrooxidation catalysts, J. Power Sources, 2013, vol. 222, p. 243.
Soliman, A.B., Abdel-Samad, H.S., Rehim, S.S.A., Ahmed, M.A., and Hassan, H.H., High performance nano-Ni/Graphite electrode for electro-oxidation in direct alkaline ethanol fuel cells, J. Power Sources, 2016, vol. 325, p. 653.
Cuña, A. et al., Electrochemical and spectroelectrochemical analyses of hydrothermal carbon supported nickel electrocatalyst for ethanol electro-oxidation in alkaline medium, Appl. Catal. B Environ., 2017, vol. 202, p. 95.
Xu, Z. et al., Enhanced ethanol electro-oxidation on CeO2-modified Pt/Ni catalysts in alkaline solution, Chinese J. Catal., 2017, vol. 38, p. 305.
Chen, W., Zhang, Y., and Wei, X., Catalytic performances of PdNi/MWCNT for electrooxidations of methanol and ethanol in alkaline media, Int. J. Hydrogen Energy, 2015, vol. 40, p. 1154.
Jongsomjit, S., Prapainainar, P., and Sombatmankhong, K., Synthesis and characterisation of Pd–Ni–Sn electrocatalyst for use in direct ethanol fuel cells, Solid State Ionics, 2016, vol. 288, p. 147.
Jafarian, M., Mirzapoor, A., Danaee, I., Shahnazi, S.A.A., and Gobal, F., A comparative study of the electrooxidation of C1 to C3 aliphatic alcohols on Ni modified graphite electrode, Sci. China Chem., 2012, vol. 55, p. 1819.
Bard, A.J., Faulkner, L.R., Leddy, J., and Zoski, C.G., Electrochemical Methods: Fundamentals and Applications, Ed. 2, New York: Wiley, 1980.
Laviron, E., General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems, J. Electroanal. Chem., 1979, vol. 101, p. 19.
Дополнительные материалы отсутствуют.








