Электрохимия, 2020, T. 56, № 6, стр. 483-493
Вольтамперометрическое и потенциометрическое определение Cu2+ с помощью электрохимического сенсора на основе сверхокисленного полипиррола
А. Багхери a, *, М. Х. Маранд b
a Исламский Университет Азад
86145-311 Шахреза, Иран
b Иранский научно-технологический Университет
Тегеран, Иран
* E-mail: a.bagheri85@gmail.com
Поступила в редакцию 28.10.2018
После доработки 02.04.2019
Принята к публикации 10.05.2019
Аннотация
Выполнена электрополимеризация пиррола на поверхности электрода с использованием анионного лиганда сульфосалициловой кислоты, с последующим “сверхокислением” мембраны с целью создать новый тип модифицированного электрода для специфического определения Cu2+ через комплексообразование и вхождение иона меди в полимерную мембрану. Факторы, способствующие связыванию Cu2+ с полимерной мембраной и понижающие наименьшую определяемую концентрацию – это способность лиганда к связыванию меди, сверхокисление, приложенный потенциал и структура полимера на модифицированном электроде. Присутствие Cu2+ внутри мембраны было подтверждено рентгеноспектральным электронно-зондовым анализом. После предварительного концентрирования определяемого вещества внутри модифицированного электрода снимали дифференциальные импульсные вольтамперограммы анодного растворения с целью количественно измерить концентрацию Cu2+. Для того чтобы протестировать способность электрода функционировать в качестве ион-селективного электрода для непосредственного измерения концентрации Cu2+, проводили потенциометрические измерения. Элементы Ag и Hg затрудняли проведение анализов, в то время как другие, такие как Ni2+, Al3+, Zn2+, Ba2+, Mn2+, Co2+, Cd2+ и Pb2+, даже при 100-кратном избытке не являлись помехой определению Cu2+. Электрод демонстрирует устойчивый и воспроизводимый сигнал с относительным стандартным отклонением менее 0.9%, областью линейности от 1.0 × 10–8 до 1.0 × 10–3 M; наименьшая определяемая концентрация Cu2+ равняется 1.5 × 10–9 M. В случае потенциометрических измерений относительное стандартное отклонение равняется 0.4%, область линейности – от 1.0 × 10–8 до 1.0 × 10–3 M, а наименьшая определяемая концентрация равняется приблизительно 4.0 × 10–9; время отклика составляет 8–40 с.
ВВЕДЕНИЕ
Полярографию на постоянном токе используют в качестве аналитического метода для измерения концентрации ионов металлов; однако этот метод страдает рядом недостатков, в числе которых недостаточно низкая наименьшая определяемая концентрация. Самое важное техническое усовершенствование аналитические применения электрохимических приборов претерпели после 1955 г. Было показано [1], что химически модифицированные электроды играют важную роль в избирательном и количественном определении ионов металлов в следовых концентрациях; они сделались предметом многочисленных исследований [2–14]. Химически модифицированные электроды широко используют в медицине и фармацевтике [15–17]. Например, простой, чувствительный и недорогой химически модифицированный электрод, такой как ферроценовый электрод, используется для определения флавоксата HCl, а полиэтиленгликолевый химически модифицированный электрод – для определения тартрата толтеродина [18]. Многочисленные исследователи изучают полимерные мембраны на электродах, допированных комплексообразующими лигандами [19–22]. Большим преимуществом химически модифицированных электродов является то, что большинство их демонстрирует быстрый отклик, низкую наименьшую определяемую концентрацию и отличается своей дешевизной. При разумном выборе модифицирующего соединения и электродного потенциала химически модифицированные электроды обычно высокочувствительны и высокоизбирательны. Поэтому химически модифицированные электроды получили широкое электроаналитическое применение, как видно, например, из сравнения многих примеров наименьшей определяемой концентрации Ag(I), приведенных в работе [10], наименьшая из которых равняется приблизительно 1 × 10–11 M. Для разных целей применяются разные химически модифицированные электроды; например, полимерная пленка на поверхности электрода используется для связывания ионов металлов электростатическими или координационными силами [23, 24]. Наименьшая определяемая концентрация здесь равняется 10–7 M [9] для ароматических аминов на платиновом электроде, покрытом карбоксальдегидом ферроцена. В данной методике поверхность химически модифицированного электрода использована для предварительного концентрирования определяемого вещества из раствора, и это – наилучший способ повысить чувствительность химически модифицированных электродов. Поэтому после предварительного концентрирования определяемого вещества на поверхности химически модифицированного электрода или внутри него применение стандартной вольтамперометрии с анодным растворением оказывается весьма успешным [25]. Вначале определяемое вещество химически осаждают на поверхность электрода на стадии предварительного концентрирования в тщательно контролируемых условиях. Затем это предосажденное вещество снимают электрохимически в ходе анодного растворения вольтамперометрическим или потенциометрическим методом и количественно определяют его концентрацию. Одновременное осаждение Zn, Cd, Pb, Cu и Hg с последующими измерениями методом дифференциальной импульсной вольтамперометрии было выполнено [5] с использованием хелатной смолы Amberlite IRC 718. Исследование, подобное проведенному нами в настоящей работе, было выполнено [26] с использованием анионного лиганда эриохром Blueblack B.
В настоящей работе мы разработали новый химически модифицированный электрод, на котором ион Cu2+ связывается анионным лигандом – сульфосалициловой кислотой (в качестве допанта), инкорпорированной в полипиррол. Действие системы включает три стадии: 1) электрохимическую полимеризацию пиррола и сульфосалициловой кислоты методом хроноамперометрии; 2) “сверхокисление” методом циклической вольтамперометрии; 3) предконцентрирование методом хроноамперометрии. Для определения различных металлов можно использовать различные допирующие лиганды, что делает эту систему очень действенной и одновременно простой в употреблении в применении к электроаналитическим измерениям. Фактически в разных условиях приходится менять много факторов, таких как pH, продолжительность предконцентрирования, наименьшая определяемая концентрация, воспроизводимость и область линейности электродной функции. В будущих исследованиях такой метод может дать много нового.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реактивы
Пиррол марки “ч. д. а.” был приобретен у компании Merk; он использовался после перегонки в вакууме, потому что без такой перегонки полимеризация пиррола невозможна. Чистая сульфосалициловая кислота была приобретена у компании Merk и использовалась без дополнительной очистки. Исходные растворы нитрата меди, гидроксида калия, нитрата калия, хлорида калия, азотной кислоты и нитратов Ag(I), Hg(II), Pb(II), Ba(II), Zn(II), Cd(II), Ni(II), Fe(II), Mg(II), Co(II), Cr(II) были приобретены у компании Merk и использовались без дополнительной очистки. Эти исходные растворы разбавляли, чтобы получить растворы меньшей концентрации. Для приготовления всех растворов использовалась трижды перегнанная вода. В экспериментах по электрополимеризации методами циклической вольтамперометрии и дифференциальной импульсной вольтамперометрии для удаления кислорода из растворов через них пропускали аргон.
Электроды
Рабочие электроды из стеклоуглерода, платины и золота полировали оксидом алюминия (зерно 0.3 мкм) и выдерживали в воде в ультразвуковом поле в течение 10 мин.
Электрохимическая полимеризация пиррола
Использовали ячейку с тремя электродами: электродом сравнения, рабочим и вспомогательным электродами. Ячейку заполняли раствором 0.5 M пиррол + 0.1 M сульфосалициловая кислота. Ячейку помещали на мешалку и раствор перемешивали 20 мин, в течение которых кислород удаляли из раствора, пропуская через него аргон, так что сверху раствор был прикрыт аргоном в течение всего эксперимента. Электрополимеризацию проводили при постоянном потенциале 750 мВ в течение 7 с. Приготовленные электроды хранили в трижды перегнанной воде.
Циклическая вольтамперометрия и дифференциальная импульсная вольтамперометрия
Аналитическое измерение концентрации Cu2+ выполняли в две основные ступени; 1) предварительное концентрирование определяемого вещества на модифицированном электроде методом хроноамперометрии в течение 200 с при потенциале –500 мВ и 2) измерение концентрации ионов Cu2+, которые были предварительно сконцентрированы на модифицированном электроде, методом анодного растворения с помощью дифференциальной импульсной вольтамперометрии. В методе дифференциальной импульсной вольтамперометрии использовали скорость развертки потенциала 100 мВ/с; высота ступени потенциала была 50 мВ в области потенциалов от –300 до +200 мВ.
Приборы
Измерения методами потенциометрии, хроноамперометрии, циклической вольтамперометрии и дифференциальной импульсной вольтамперометрии проводили на потенциостате/гальваностате EG&G, модель M273 (США). В других потенциометрических экспериментах использовали потенциометр TS-Technology (Иран). Величину pH растворов измеряли потенциометром Jenway, модель 3505 (Великобритания). Для очистки электродов использовали ультразвуковую ванну Luc-410 (Корея). Немодифицированные рабочие электроды (стеклоуглерод, Pt или Au) были изготовлены в Иране, а электродом сравнения в этих экспериментах служила двойная электролитная система Ag/AgCl (Schott-Geräte, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полный процесс исследования в отношении Cu2+ складывался из трех ступеней: 1) эксперименты методом циклической вольтамперометрии для определения точного потенциала восстановления ионов меди, при котором мы можем измерять их концентрацию и наблюдать общий вид циклических вольтамперограмм, по которому можно судить о поведении ионов меди в окислительно-восстановительном процессе; 2) стадия предварительного концентрирования, в которой можно собрать медь в модифицированном электроде, погрузив его в раствор ионов меди на заданное время (эта стадия предварительного концентрирования действительно уменьшает наименьшую определяемую концентрацию); 3) измерение концентрации ионов меди методом анодного растворения с помощью дифференциальной импульсной вольтамперометрии.
Для улучшения характеристик разработанного модифицированного электрода и снижения наименьшей определяемой концентрации следует оптимизировать многие аспекты методики определения, например рабочий потенциал модифицированного электрода, pH растворов, продолжительность предварительного концентрирования. Также должны быть оптимизированы факторы, влияющие на электрополимеризацию рабочего электрода, такие как потенциал, материал электрода, растворитель, индифферентный электролит, концентрация лиганда, pH, температура и время полимеризации.
Окисление пиррола наблюдается между 0.66 и 0.9 В (НКЭ), при более высоких потенциалах снижается электропроводность полимера. Это называется сверхокислением. Сверхокисление необратимо и увеличивается с ростом потенциала. Механизм сверхокисления до сих пор не вполне ясен; однако в щелочном растворе водных нуклеофилов агрессивное воздействие OH– на полипиррол приводит к образованию карбонильных групп на α-углеродных атомах пиррольного кольца. Это разрушает сопряжение полимерных цепочек [27, 28]. Утверждалось, что сверхокисление приводит к образованию кислородсодержащих групп, действующих как Льюисовы основания, образующие комплексы с жесткими катионами, в то время как окислительно-восстановительное взаимовлияние уменьшается из-за более низкой электронной электропроводности “сверхокисленного” полипиррола [29, 30].
Физические свойства пленки определяются методом ее электрополимеризации – гальваностатическим [31], потенциостатическим [32] или потенциодинамическим [33]. При постоянном потенциале или постоянном токе получается более шероховатый и пористый полимер. Однако, если для электрополимеризации используется процесс циклической вольтамперометрии, то получается более гладкий и плотный полимер [34].
Влияние потенциала электрода на стадии предварительного концентрирования
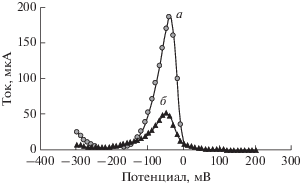
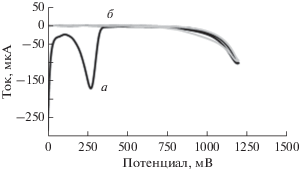
Степень предварительного концентрирования зависит от потенциала модифицированного электрода, потому что его величина оказывает влияние на полимерную мембрану электрода. Поэтому приложенный электродный потенциал может усиливать степень предварительного концентрирования. Методика предварительного концентрирования заключается в погружении приготовленного модифицированного электрода в 1.0 × 10–5 M раствор Cu2+ на 200 с при оптимальном потенциале электрода –500 мВ. На рис. 1 проиллюстрировано применение анодной дифференциальной импульсной вольтамперометрии и определение пикового тока как в присутствии, так и в отсутствие приложенного потенциала. По-видимому, связывание и поглощение Cu2+ полимерной мембраной увеличивается с ростом потенциала электрода из-за того, что возрастает миграция положительных ионов меди сквозь полимерную мембрану электрода, которая теперь становится электрически более отрицательной.
Рис. 1.
Влияние приложенного потенциала на ток электрода: a – потенциал приложен; б – потенциал не приложен.

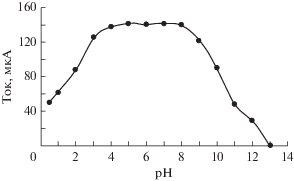
Значение pH раствора предварительного концентрирования важно для накопления ионов меди внутри полимерной мембраны на модифицированном электроде. Взаимосвязь, существующая между значением pH раствора предварительного концентрирования и пиком тока дифференциальной импульсной вольтамперометрии показывает, что наилучшая область рН для предварительного концентрирования – от 4.0 до 6.5 (рис. 2). При более низких pH ион водорода конкурирует с Cu2+, и это снижает число ионов меди, способных пройти сквозь полимерную мембрану, что, соответственно, увеличивает наименьшую определяемую на данном модифицированном электроде концентрацию. Однако при более высоких pH происходит осаждение гидроксида меди (для которого Ksp = 2.2 × 10–20). В обоих случаях (более высоких и более низких pH) наблюдается положительная ошибка в определении искомой концентрации растворенного вещества.
Влияние времени предварительного концентрирования
При выполнении предварительного концентрирования отрицательный потенциал модифицированного электрода способствует вхождению ионов меди в полимерную мембрану электрода. Время предварительного концентрирования – это еще один важный фактор, влияющий на количество меди, способной осаждаться на модифицированном электроде. Амперометрические измерения выявили взаимосвязь между временем предварительного концентрирования и обеднением раствора в ячейке по ионам Cu2+ (рис. 3).
При нулевом времени предварительного концентрирования ток максимален благодаря присутствию ионов меди; однако через 5 с бóльшая часть ионов меди оказывается удалена из раствора, и ток уменьшается, хотя и не спадает до нуля. Рисунок 3 показывает, что бóльшая часть ионов меди входит в полимерную мембрану в течение первых 5 с, и продление времени предварительного концентрирования не делает существенной разницы в окончательном результате. Однако для большей точности и надежности, чтобы максимальное число ионов меди вошло в полимерную мембрану и ток достиг своего максимума, мы выбрали время предварительного концентрирования во всех экспериментах, равное 200 с.
Влияние концентрации лиганда
Лиганд сульфосалициловой кислоты в мембране выполняет три главных функции:
– в качестве аниона-допанта поддерживает электронейтральность;
– поддерживает электропроводность раствора;
– связывает ионы меди на стадии предварительного концентрирования.
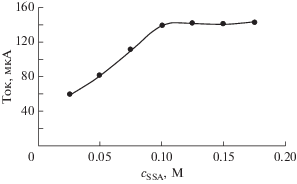
Для выбора оптимальной концентрации лиганда в процессе электрополимеризации мы проводили полимеризацию пиррола при различных концентрациях лиганда, и каждый раз для предварительного концентрирования ионов меди использовался свежеприготовленный модифицированный электрод. На рис. 4 представлена связь между током анодной дифференциальной импульсной вольтамперометрии и концентрацией лиганда; видно, что оптимальная концентрация лиганда в этом эксперименте равняется 0.1 M.
Влияние времени электрополимеризации
Толщина полипирроловой мембраны на поверхности электрода влияет на характеристики электрода, поэтому время процесса электрополимеризации весьма критично, так как именно оно контролирует толщину мембраны. Подбирая время полимеризации, можно оптимизировать толщину мембраны. При изготовлении модифицированных электродов мы использовали различное время полимеризации. Затем для каждого электрода после предварительного концентрирования определяли пик тока анодной дифференциальной импульсной вольтамперометрии. На рис. 5 представлено соотношение между временем полимеризации и пиком тока. Как видно из рисунка, оптимальное время полимеризации, обеспечивающее наилучшее поведение электрода и его максимальный пиковый ток, равняется 7 с. Если время полимеризации меньше 7 с, то на поверхности электрода образуется слишком тонкая мембрана, лиганд не может быть зафиксирован в полимере, и число ионов меди, вошедшее в полимер, снижается; соответственно, эффективность такого электрода невелика. Если время полимеризации больше 7 с, то электропроводность такой слишком толстой мембраны уменьшается, и пиковый ток снижается (рис. 5).
Влияние лиганда
Большое число мест, способных к ионизации в молекуле лиганда, главным образом фенольных и карбоксильных групп, обеспечивает ему возможность образовывать стойкие комплексы и хелатные соединения с катионами тяжелых металлов. Салициловая кислота играет очень важную роль в аналитической химии, а также и в других областях химии и в биологии и медицине [35, 36], благодаря тому, что многие важные функции салициловой кислоты связаны с комплексообразованием с ионами металлов. С точки зрения координационной химии, салициловая кислота – это универсальный лиганд для хелатирования ионов металлов, поскольку она предлагает два жестких, сильно основных O-донорных центра – либо в виде карбоксильной и гидроксильной групп, либо только карбоксильной группы, как бидентатный хелатный агент. Эта карбоксильная группа способна связывать ион металла различными способами, как монодентатный, бидентатный или мостиковый агент [37]. Например, оказалось, что салициловая кислота в димерном комплексе тербия координирована сразу тремя способами [38]. Салициловая кислота, как универсальный хелатообразующий агент, может выступать в качестве катализатора [39].
Мы продемонстрировали влияние лиганда путем выбора другого лиганда – додецилсульфата, который, в отличие от сульфосалициловой кислоты, не является координирующим лигандом в электрополимеризации пиррола; условия полимеризации были такими же, как и в случае сульфосалициловой кислоты. Модифицированный электрод на основе додецилсульфата после сверхокисления и стадии предварительного концентрирования был протестирован методом анодной дифференциальной импульсной вольтамперометрии, и был измерен его пиковый ток. Как показано на рис. 6, сравнение пиковых токов обоих лигандов – сульфосалициловой кислоты и додецилсульфата – показало, что пиковый ток в случае лиганда додецилсульфата намного меньше, чем в случае сульфосалициловой кислоты, потому что сульфосалициловая кислота является более сильным комплексующим агентом по отношению к иону меди; додецилсульфат же не обладает свойством связывания.
Влияние сверхокисления
Сверхокисление модифицированного электрода с помощью 0.1 M раствора гидроксида натрия – это очень важный момент в определении ионов меди. Для сверхокисления электрода мы использовали метод циклической вольтамперометрии; соответствующая циклическая вольтамперограмма представлена на рис. 7. На первом цикле вольтамперограммы (a), при развертке потенциала в сторону положительных значений, мы видим пик тока, относящийся к процессу окисления полипирролловой мембраны. Но на следующем цикле (б), мы уже не видим пика тока, потому что мембрана уже сверхокислена.
Рис. 7.
Циклические вольтамперограммы сверхокисления: a – на первом скане есть пик тока, связанного со сверхокислением; б – на втором скане такого пика нет.
Для того чтобы сравнить сверхокисленный модифицированный электрод с не окисленным, мы протестировали оба этих электрода после стадий предварительного концентрирования методом анодной дифференциальной импульсной вольтамперометрии; соответствующие пиковые токи показаны на рис. 8.
Рис. 8.
Влияние сверхокисления: a – пиковый ток сверхокисленного электрода; б – пиковый ток электрода, не подвергнутого сверхокислению.

Видно, что пиковый ток сверхокисленного электрода намного больше, чем ток не окисленного электрода. На опыте процесс сверхокисления может дать первоначальный зародыш меди в порах полимера, и такие зародыши меди могут притягивать в поры другие ионы меди. Многократное изменение напряжения с отрицательного на положительное в ходе снятия циклических вольтамперограмм меняет морфологию полимерной мембраны электрода на пористую структуру. Поэтому процесс зародышеобразования протекает более интенсивно, и больше ионов меди может войти в поры; как результат, можно достичь более низкой наименьшей определяемой концентрации, к тому же повышается электропроводность мембраны. С другой стороны, модифицированный электрод, приготовленный с помощью сверхокисления, демонстрирует более низкий фоновый ток и является предпочтительным для создания модифицированного электрода на основе углеродных нанотрубок для аналитических целей [40, 41]. На рис. 9 представлены SEM-микрофотографии морфологии поверхности электрода. Рисунок 9a показывает электрод с чистой поверхностью при увеличении 5000; на рис. 9б видна гладкая однородная морфология с маленьким микросферическим зерном полимерной (полипиррол/сульфосалициловая кислота) мембраной, не подвергнутой сверхокислению. Врезка на рис. 9б показывает изображение пленки, снятое при увеличении 2000.
Рис. 9.
SEM-микрофотографии морфологии поверхности полимерной мембраны на электроде: (a) электрод с чистой поверхностью, (б) без сверхокисления, (в) после сверхокисления и (г) сверхокисленный электрод после предварительного концентрирования определяемого вещества. Увеличение 500 (кроме (a)). Врезки: увеличение 2000.

На рис. 9в показан модифицированный электрод, подвергнутый сверхокислению. После сверхокисления полимерной пленки поверхность стала более пористой, благодаря образованию дополнительных функциональных групп (‒COO−/–COOH).
На рис. 9г показана SEM-микрофотография электрода после накопления меди из 1.0 × 10–5 M раствора меди(II) в течение 200 с на пленке полипиррол/сульфосалициловая кислота.
Такое сверхокисление матрицы полипиррол/сульфосалициловая кислота образует первичные центры зародышеобразования через взаимодействие ионов Cu2+ с комплексообразующими центрами сульфосалициловой кислоты и сверхокисленного полипиррола. Все микрофотографии получены при увеличении 500 (кроме рис. 9a). Врезки на рисунках – изображения соответствующих объектов, сделанные при увеличении 2000.
Катион меди входит в полимерную мембрану многими путями. Как показывают SEM-изображения, медь накапливается в полимере, и это подтверждается рентгеноспектральным электронно-зондовым микроанализом (EDAX), см. рис. 10.
Рис. 10.
Эксперимент по методу рентгеноспектрального электронно-зондового микроанализа (EDAX), демонстрирующий Cu, C, N, O и S в полимерной мембране.

Из рисунка видно, какая часть мембраны выбрана для EDAX-эксперимента (сверху справа на рисунке). Пики при 8.90, 8.0, 0.94 и 0.92 кэВ относятся к Cu, 2.30 и 2.46 кэВ к S; сильный пик слева и находящиеся рядом с ним два маленьких пика принадлежат, соответственно, C, N и O.
Миграция ионов в полимерную мембрану
Когда полипиррол окисляется, небольшие анионы могут входить в полимер для нейтрализации положительных зарядов, которые возникают в процессе окисления. С другой стороны, когда полипиррол восстанавливается обратно в нейтральное состояние, эти небольшие анионы выходят из полимера.
Это справедливо для небольших анионов, таких как хлориды. Однако, для больших анионов, таких как анион сульфосалициловой кислоты, ситуация иная, и эти большие анионы могут застревать в порах полимера; они более электроактивны, и окислительно-восстановительные процессы с их участием более обратимы и идут с большей скоростью [42, 43]. В этом случае для нейтрализации отрицательных зарядов ион Cu2+ из раствора входит в полимерную мембрану и улучшает наименьшую определяемую на этом электроде концентрацию. В случае анионов среднего размера ускоряется как катионный, так и анионный обмен [29].
Избирательность электрода
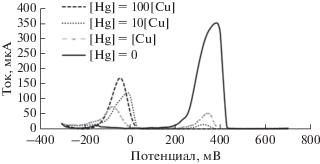
Электроды на основе полипирроловой мембраны избирательны по отношению к анионам; однако, после сверхокисления полипирроловой мембраны анионная избирательность сменяется на катионную. Причина этого заключается в том, что на полимерных цепочках образуются кислородсодержащие группы, такие как карбонильные, гидроксильные и карбоксильные, которые нейтрализуют заряды [29]. Некоторые ионы металлов, таких как Ni, Ag, Al, Zn, Ba, Hg, Mn, Co, Cd и P, создают помехи определению Cu в 1-, 10- и 100-кратном избытке. Среди них пики тока ионов двух металлов – Ag и Hg – втрое превосходят относительное стандартное отклонение для иона Cu при измерениях в отсутствие помех со стороны других металлов. Для ионов других металлов даже 100-кратный избыток по отношению к определяемому иону Cu не создает сколько-нибудь существенных помех определению. С ростом концентраций Ag или Hg сигнал Cu уменьшается, так что при концентрациях как Ag, так и Hg, равных 1.0 × 10–3 M пик тока Cu снижается до нуля, как показано на рис. 11. Помехи со стороны Ag и Hg имеют одинаковый характер.
Модифицированные электроды на основе электрополимеризации полипиррола/сульфосалициловой кислоты обладают способностью к ионному обмену, потому что такая полимерная мембрана электропроводна. Поэтому открывается возможность использовать такие модифицированные электроды в качестве ион-селективных электродов в потенциометрических измерениях ионов Cu2+. При этом может быть использован процесс оптимизации, разработанный в вольтамперометрии. Был записан потенциометрический отклик модифицированного электрода для ряда растворов разных концентраций (от 1.0 × 10–11 до 1.0 × 10–3 M) Cu2+. На рис. 12 представлен график зависимости потенциала от логарифма концентрации. Он имеет линейный характер в интервале концентраций от 1.0 × 10–8 до 1.0 × 10–3 M Cu2+ с нернстовским наклоном 28.75 мВ.
Было изучено влияние pH на потенциометрическое определение иона меди и найден оптимальный интервал pH для таких потенциометрических измерений: 4.0–6.0. При pH ниже 4 ион водорода конкурирует с ионом меди, а при более высоких pH медь осаждается в форме гидроксида меди.
Время потенциометрического отклика электрода измеряли после последовательного погружения электрода в ряд растворов, каждый из которых отличался 10-кратно по концентрации. Получено статическое время отклика между 8 и 40 с в интервале концентраций от 1.0 × 10–9 до 1.0 × 10–3 M Cu2+. Стабильность электрода тестировали, периодически погружая его в растворы Cu2+ различной концентрации. Получено относительное стандартное отклонение ≤0.4 мВ (n = 20) для 1.0 × 10–4 M раствора Cu2+. Исследование долговременной стабильности не выявило сколько-нибудь значительных изменений в поведении электродов в течение по крайней мере одного месяца непрерывного вымачивания в воде.
Предел определения (LOD) вычисляли, используя оба метода, графический (утроенное относительное стандартное отклонение холостого опыта, деленное на наклон калибровочной кривой) и отношение сигнал:шум, превышающее 5. В вольтамперометрическом анализе LOD равняется 1.5 × 10–9 M Cu2+, а при потенциометриом определении LOD равняется 4.0 × 10–9 M Cu2+; эта величина вычислена путем экстраполяции точки пересечения двух линейных сегментов калибровочной кривой (рис. 12) на базовую линию.
Вольтамперометрическое определение меди в реальных образцах проводили на воде из скважины. Стандартные образцы Cu2+ различной концентрации были приготовлены на воде из скважины, после чего к ним добавляли Cu2+, и каждый образец измеряли методом анодной дифференциальной импульсной вольтамперометрии. Сравнивали добавленное и измеренное количества Cu2, точность измерений определяли, как процент обратного извлечения. Результат представлен в табл. 1.
ЗАКЛЮЧЕНИЕ
Устройство модифицированного электрода на основе мембраны, полученной допированием и электрополимеризацией на поверхности электрода, – это перспективная методика для легко реализуемого и точного определения ионов меди. Такая пленка полипиррол/сульфосалициловая кислота может быть превращена в непроводящую катион-селективную мембрану с иммобилизованными центрами ионофора путем простого процесса электрохимического “сверхокисления” и использована как для вольтамперометрических, так и для потенциометрических измерений, отличающихся хорошей чувствительностью, избирательностью, воспроизводимостью и достоверностью. Действительно, в создании катионных ионофоров широко используют в качестве катионных ионофоров карбонилы и карбоксилаты. Серьезное ограничение в использовании электродов, покрытых проводящими полимерами, – это помехи со стороны окислительно-восстановительных систем. Однако, отклик электродов на основе пленок сверхокисленного полипиррола на окислительно-восстановительные системы улучшается, если в качестве индифферентного электролита используется сульфосалициловая кислота, а пленка полипиррола сверхокислена в растворе NaOH. Такие сверхокисленные электроды могут быть применены для определения ионов Cu2+ методами потенциометрии в интервале концентраций 4.0 × 10−9–1.0 × × 10−3 M и вольтамперометрии с предварительным концентрированием в интервале концентраций 1.5 × 10−9–1.0 × 10−3 M. Их избирательность улучшена по сравнению с электродами, не подвергнутыми сверхокислению. Электроды на основе электрополимеризации и сверхокисления – это хорошее орудие электроаназиза, которое может быть использовано в промышленности, биологии и медицине.
Список литературы
Flato, J.B., Renaissance in polarographic and voltammetric analysis, Anal. Chem., 1972, vol. 44, p. 75A.
Abdollahi, S., Hreconcentration and determination of Pb2+ at an AlP04 containing carbon paste electrode, Anal. Chim. Acta, 1995, vol. 304, p. 381.
Baldwin, R.P. and Thomsen, K.N., Chemically modified electrodes in liquid chromatography detection: A review, Talanta, 1991, vol. 38, p. 1.
Prabhu, S.Y., Baldwin, R.P., and Kryger L., Предварительно концентрировани and determination of lead(II) at crown ether and cryptand containing chemically modified electrodes, Electroanalysis, 1989, vol. 1, p. 13.
Agraz, R., Sevilla, M.T., and Hernandez, L., Chemically modified electrode for the simultaneous determination of trace metals and speciation analysis, Anal. Chim Acta, 1993, vol. 273, p. 205.
Satyanarayana, M., Goud, K.Y., and Gobi, K.V., Conducting Polymer-Layered Carbon Nanotube as Sensor Interface for Electrochemical Detection of Dacarbazine In-Vitro, Electrocatalysis, 2017, vol. 8, p. 214.
Asghari, E. and Malekian, S., Improvement of the electrocatalytic performance of platinum-free hierarchical Cu/polypyrrole/NiO anode for methanol oxidation via changing the morphology of polypyrrole sublayer by selfassembled pyrrole monomers and overoxidation, Synthetic Metals, 2017, vol. 229, p. 57.
Otero, T.F. and Beaumont, S., Chemical sensors from the cooperative actuation of multistep electrochemical molecular machines of polypyrrole: Voltammetric study, Sens. Act. B, 2017, vol. 253, p. 958.
Price, J.F. and Baldwin, R.P., Preconcentration and determination of ferrocene carboxaldehyde at a chemically modified platinum electrode. Anal. Chem., 1980, vol. 52, p. 1940.
Cheek, G.T. and Nelson, R.F., Applications of Chemically Modified Electrodes to Analysis of Metal Ions, Anal. Lett., 1978, vol. 11, p. 393.
Situ, Bo, Zhao, J., and Lv, W., Naked-eye detection of copper(II) ions by a “clickable” fluorescent sensor, Sensors Actuators B, 2017, vol. 240, p. 560.
Zhou, X., Li, G., and Yang, P., A switching sensor of C‒H bond breakage/formation regulated by mediating copper(II)’s complexation, Sensors Actuators B, 2017, vol. 242, p. 56.
Farajollahi, M., Woehling, V., and Plesse, C., Self-contained tubular bending actuator driven by conducting polymers, Sensors Actuators A, 2016, vol. 249, p. 45.
Li, P., Gao, Z., and Xu Y., Determination of trace amounts of silver with a chemically modified carbon paste electrode. Anal. Chim. Acta, 1990, vol. 229, p. 213.
Yan, R., Qiu, S., and Tong, L., Review of progresses on clinical applications of ion selective electrodes for electrolytic ion tests: from conventional ISEs to graphene-based ISEs, Chem. Spec. Bioavailab., 2016, vol. 28, p. 72.
Salles, M.O., Araujo, W.R., and Paixão, T.R.L.C., Development of a Molecularly Imprinted Modified Electrode to Evaluate Phenacetin Based on the Предварительно концентрировани of Acetaminophe, J. Braz. Chem. Soc., 2016, vol. 27, p. 54.
Rahman, S.F., Min, K., and Park, S.H., Selective determination of dopamine with an amperometric biosensor using electrochemically pretreated and activated carbon/tyrosinase/Nafion-modified glassy carbon electrode, Biotechnol. Bioproc. E., 2016, vol. 21, p. 627.
Attia, A.K., Frag, E.Y.Z., and Ahmed, H.E., Validated electroanalytical determination of flavoxate hydrochloride and tolterodine tartrate drugs in bulk, dosage forms and urine using modified carbon paste electrodes, Arab. J. Chem., 2016, vol. 11, p. 483.
Borazjani, M., Mehdinia, A., and Ziaei, E., Enantioselective electrochemical sensor for Rmandelic acid based on a glass carbon electrode modified with multi-layers of biotin-loaded overoxidized polypyrrole and nanosheets of reduced grapheme oxide, Microchim. Acta, 2016, vol. 184, p. 611.
Alizadeh, N., Kamalabadi, M., and Mohammadi, A., Determination of Histamine and Tyramine in Canned Fish Samples by Headspace Solid-Phase Microextraction Based on a Nanostructured Polypyrrole Fiber Followed by Ion Mobility Spectrometry, Food Anal. Method., 2017, vol. 10, p. 3001.
Zhao, Y., Lv, Z., and Wang, Y., Combination of Fe–Mn based Li-rich cathode materials and conducting polymer polypyrrole nanowires with high rate capability, Ionics, 2017, vol. 24, p. 51.
Genova, F.K.M., Premalatha, M., and Selvasekarapandian, S., Lithium ionconducting polymer electrolytes based on PVA–PAN doped with lithium triflate, Ionics, 2017, vol. 23, p. 2727.
Oyama, N. and Anson, F.C., Polymeric ligands as anchoring groups for the attachment of metal complexes to graphite electrode surfaces, J. Am. Chem. Soc., 1979, vol. 101, p. 3450.
Oyama, N. and Anson, F.C., Electrostatic Binding of Metal Complexes to Electrode Surfaces Coated with Highly Charged Polymeric Films, J. Electrochem. Soc., 1980, vol. 127, p. 247.
Prabhu, S.Y. and Baldwin, R.P., Chemical preconcentration and determination of copper at a chemically modified carbon-paste electrode containing 2,9-dimethyl-1,10-phenanthroline, Anal. Chem., 1987, vol. 59, p. 1074.
Zanganeh, A.R. and Amini, M.K., Polypyrrole-modified electrodes with induced recognition sites for potentiometric and voltammetric detection of copper(II) ion, Sens. Act. B, 2008, vol. 135, p. 358.
Beck, F., Braun, P., and Oberst, M., Organic Electrochemistry in the Solid State-Overoxidation of Polypyrrole, Berichte Bunsen-Gesellschaft Phys. Chem. Chem. Phys., 1987, vol. 91, p. 967.
Ge, H.L., Qi, G.J., and Kang, E.T., Study of overoxidized polypyrrole using X-ray photoelectron spectroscopy, Polymer, 1994, vol. 35, p. 504.
Ersoz, A., Gavalas, V.G., and Bachas, L.G., Potentiometric behavior of electrodes based on overoxidized polypyrrole film, Anal. Bioanal. Chem., 2002, vol. 372, p. 786.
Bobacka, J., Ivaska, A., and Lewenstam, A., Potentiometric Ion Sensors, Chem. Rev., 2008, vol. 108, p. 329.
Liu, A.S. and Oliveira, M.A.S., Electrodeposition of polypyrrole films on aluminum from tartrate aqueous solution, J. Braz. Chem. Soc., 2007, vol. 18, p. 143.
Prissanaroon-Ouajai, W., Pigram, P.J., and Jones, R., A sensitive and highly stable polypyrrole-based pH sensor with hydroquinone monosulfonate and oxalate co-doping, Sensors Actuators. B, 2009, vol. 138, p. 504.
Tietje-Girault, J., de León, C.P., and Walsh, F.C., Electrochemically deposited polypyrrole films and their characterization, Surf. Coat. Technol., 2007, vol. 201, p. 6025.
Otero, T.F. and Delarreta, E., Electrochemical control of morphology adherence, appearance and growth of pplprrole films, Synthetic Metals, 1988, vol. 26, p. 79.
Randjelović, P., Veljković, S., and Stojiljković, N., The Beneficial Biological Properties of Salicylic Acid, Acta Fac. Med. Nais., 2015, vol. 32, p. 259.
Madan, R.K. and Levitt, J., A review of toxicity from topical salicylic acid preparations, J. Am. Acad. Dermatol., 2014, vol. 70, p. 788.
Praveen, K., Madhavi, D.S.S., and Anil Kumar, K., Coordination Chemistry of Salicylic Acid, Int. J. Eng. Sci. Inv., 2016, vol. 05, p. 08.
Yin, M.C., Ai, C.C., and Yuan, L.J., Synthesis, structure and luminescent property of a binuclear terbium complex [Tb2(Hsal)8(H2O)2][(Hphen)2] · 2H2O, J. Mol. Struct., 2004, vol. 691, p. 33.
Chen, H.J., Lin, Z.Y., and Li, M.Y., A new, efficient, and inexpensive copper(II)/salicylic acid complex catalyzed Sonogashira-type cross-coupling of haloarenes and iodoheteroarenes with terminal alkynes, Tetrahedron., 2010, vol. 66, p. 7755.
Wenb, J., Zhoua, L., and Jinb, L., Overoxidized polypyrrole/multi-walled carbon nanotubes composite modified electrode for in vivo liquid chromatography–electrochemical detection of dopamine, J. Chrom. B, 2009, vol. 877, p. 1793.
Li, Y., Wang, P., and Wang, L., Overoxidized polypyrrole film directed single-walled carbon nanotubes immobilization on glassy carbon electrode and its sensing applications, Biosens. Bioelectron., 2007, vol. 22, p. 3120.
Ansari Khalkhali, R., Price, W.E., and Wallace, G.G., Quartz crystal microbalance studies of the effect of solution temperature on the ion-exchange properties of polypyrrole conducting electroactive polymers, React. Function. Polym., 2003, vol. 56, p. 141.
Brânzoi, V., Brânzoi, F., and Pilan, L., Electrochemical characterization of polypyrrole modified electrodes doped with large organic anions, Rev. Roum. Chim., 2007, vol. 52, p. 169.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия