Электрохимия, 2020, T. 56, № 6, стр. 494-499
Механизм электроосаждения хрома – частный случай механизма индуцированного соосаждения металлов
В. Л. Красиков a, *, А. В. Красиков b, **
a АО “Российский институт радионавигации и времени”
Санкт-Петербург, Россия
b НИЦ “Курчатовский институт” – ЦНИИ КМ “Прометей”
Санкт-Петербург, Россия
* E-mail: elchkras@yandex.ru
** E-mail: krasikov.av@mail.ru
Поступила в редакцию 14.03.2019
После доработки 06.06.2019
Принята к публикации 11.08.2019
Аннотация
Рассмотрен процесс восстановления хрома из стандартного проработанного электролита хромирования, содержащего соединения трехвалентного и шестивалентного хрома и серную кислоту. Показано, что основным электрохимическим процессом является восстановление ионов Cr(III) с образованием промежуточных адсорбированных частиц Cr(II), которые далее могут либо электрохимически восстановиться до металла, либо химически взаимодействовать с частицами Cr(VI) с образованием кластерного соединения, стадийно восстанавливающегося до металлического состояния с замедленным переносом первого электрона. Механизм восстановления хрома полностью подчиняется механизму индуцированного соосаждения металлов, предложенному ранее.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Механизм электрохимического восстановления хромовой кислоты до металлического хрома по-прежнему является дискуссионным. Большинство исследователей считает, что осаждение металлического хрома непосредственно связано с образованием у поверхности электрода так называемой катодной пленки, строение и состав которой определяют структуру покрытия и основные кинетические закономерности электродного процесса [1–3]. Между тем исследования, проведенные рядом авторов, позволяют заключить, что образование катодной пленки не является определяющим фактором кинетики электрохимической реакции. Было найдено, что порядок реакции восстановления хрома по аниону хромовой кислоты равен +1, а зависимость потенциала катода от логарифма парциальной плотности тока восстановления хрома составляет 0.12 В [4–7]. Это позволило сделать вывод, что восстановление аниона хромовой кислоты до металлического хрома лимитируется стадией присоединения первого электрона:
Из уравнения (1) формально следует, что в результате протекания замедленной электрохимической стадии должна появиться частица со степенью окисления хрома (+5), однако поскольку образование таких частиц маловероятно и экспериментально не зарегистрировано, предполагается [5], что разряжается частица, содержащая три атома хрома в степени окисления (+6), в которой только один атом хрома восстанавливается.
Для осуществления процесса осаждения хрома необходимо присутствие в электролите ионов-активаторов: сульфат-ионов, фторида, кремнефторида или некоторых других, однако их роль не совсем понятна и разными исследователями трактуется по-разному. Авторами [4] было найдено, что порядок реакции восстановления хрома по иону ${\text{SO}}_{4}^{{2 - }}$ равен +1. Первый порядок реакции показывает, что роль иона ${\text{SO}}_{4}^{{2 - }}$ заключается не только в активировании поверхности хромового катода, но и в непосредственном участии в электродном процессе, однако уравнение реакции восстановления ионов ${\text{CrO}}_{4}^{{2 - }}$ с участием сульфат-анионов написать затруднительно.
Осаждение хрома сопровождается электрохимической реакцией неполного восстановления хромовой кислоты до трехвалентного состояния, которая начинается при более положительном потенциале, чем осаждение хрома, имеет первый порядок по ионам ${\text{CrO}}_{4}^{{2 - }}$ и характеризуется смешанной кинетикой – диффузией разряжающегося иона к поверхности электрода и замедленным присоединением первого электрона [8]. Попытка объяснить восстановление аниона хромовой кислоты одновременно до металла [Cr(VI) → Cr0] и до ионов трехвалентного хрома [Cr(VI) → Cr(III)] приводит к противоречиям и требует допустить, что в этих процессах разряжаются различные по природе частицы Cr(VI) [5], что чрезвычайно запутывает общую картину процесса.
Известно, что осаждение металлического хрома возможно из электролитов на основе трехвалентного хрома. Процесс протекает в две стадии: сначала к иону Cr(III) присоединяется один электрон:
а затем к образовавшейся промежуточной частице одновременно присоединяются два электрона:По данным ряда авторов [9, 10], вторая двухэлектронная стадия является замедленной. Таким образом, при восстановлении ионов Cr(III) на поверхности электрода появляется промежуточная частица Cr(II)ads, дальнейшее превращение которой может идти несколькими независимыми путями.
Публикаций по механизму электроосаждения хрома из растворов Cr(III) относительно немного, тем не менее последовательность стадий в этом процессе более понятна, чем при электроосаждении хрома из электролитов на основе Cr(VI). Разобраться в последнем механизме удалось только после выяснения механизма индуцированного соосаждения никеля и вольфрама в сплав [11]. В этой работе нами было показано, что причиной катодного восстановления ионов тугоплавких металлов, например ${\text{WO}}_{4}^{{2 - }}$, в присутствии в растворе ионов металла-осадителя, например ионов Ni2+, является химическое взаимодействие адсорбированной промежуточной частицы восстановления никеля NiOHads с анионом тугоплавкого металла с образованием гетерометаллической кластерной частицы с непосредственной химической связью никель-вольфрам. На этот процесс расходуется только часть частиц NiOHads, зависящая от концентрации ионов ${\text{WO}}_{4}^{{2 - }}$ в электролите, вторая часть частиц восстанавливается непосредственно до никеля, принимая второй электрон [11, 12]. Предложенный нами механизм индуцированного соосаждения металлов основан на порядках реакции восстановления никеля и вольфрама, найденных классическим методом, по всем компонентам электролита, не привязан к какому-либо определенному комплексообразователю и существенным образом отличается от механизма, предложенного Е. Подлахой и Д. Ландольтом [13–15].
В соответствии с нашим механизмом индуцированного соосаждения сплавов тугоплавких металлов [11, 12], с учетом особенностей свойств соединений хрома и закономерностей катодного восстановления хрома, полученных другими авторами, механизм процесса можно представить следующим образом. В стандартном проработанном электролите хромирования ионы ${\text{CrO}}_{4}^{{2 - }}$ выполняют функцию тугоплавкого металла, а ионы Cr(III) – металла–осадителя. Из электролитов, содержащих только ионы Cr(VI), восстановления хрома до металла не происходит, так же как ни при каких условиях не происходит восстановления до металла молибдена или вольфрама из водных растворов молибдатов или вольфраматов. Восстановление до металла ионов тугоплавких металлов Me(VI) может осуществляться только при наличии в электролите катионов металла-осадителя, в качестве которого могут выступать, в частности, ионы Cr(III), позволяя осаждать покрытия сплавом хром-молибден [16] и хром-вольфрам [17]. При включении тока в стандартном электролите хромирования на катоде на чужеродной подложке сначала происходит восстановление ионов трехвалентного хрома с образованием зародышей металла. Процесс протекает через стадию образования адсорбированных промежуточных частиц Cr(II)ads:
(3a)
${\text{CrSO}}_{{4\,{\text{ads}}}}^{0} + 2{\text{e}} \to {\text{C}}{{{\text{r}}}^{0}}\,\,{\text{ + }}\,\,{\text{SO}}_{4}^{{2 - }}.$Далее часть промежуточных частиц ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ одновременно с процессом (3а) по параллельному пути реакции (4) химически взаимодействует с анионами ${\text{CrO}}_{4}^{{2 - }}$ с образованием кластерной двуядерной частицы с непосредственной химической связью Cr–Cr, более короткой, чем в кристалле металлического хрома, что очень характерно для соединений хрома [18], а также других тугоплавких металлов – молибдена, технеция, рения, титана и т.д.:
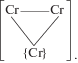
Это быстрая предшествующая химическая реакция образования разряжающейся частицы; реакция происходит на поверхности и с участием предварительно сформированного металлического кластера (зародыша) хрома, который можно обозначить символом {Cr}. Кластер состоит из ограниченного числа атомов, имеет упорядоченное расположение атомов, как в массивном металле, и связан с атомами хрома в ионах Cr(III) и Cr(VI) так, что структуру кластерной частицы можно представить следующим образом:
При этом поверхностные атомы кластера металла могут входить во внутреннюю координационную сферу частиц ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ и ${\text{CrO}}_{4}^{{2 - }}$, образуя ядро кластера:
Кластерная частица стадийно восстанавливается. Первой стадией является присоединение одного электрона:
По аналогии с механизмом индуцированного соосаждения сплава никель-вольфрам [11, 12] реакция (5) является лимитирующей стадией процесса восстановления хромовой кислоты, отсюда тафелевский наклон парциальной поляризационной кривой восстановления хрома составляет 0.12 В, а скорость реакции прямо пропорциональна концентрации анионов хромовой кислоты CCr(VI) и степени заполнения θCr(II) поверхности электрода адсорбированными частицами ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$, что обуславливает первый порядок реакции восстановления хрома по сульфат-ионам:
(6)
$i = K{{c}_{{{\text{Cr(VI)}}}}}{{\theta }_{{{\text{Cr(II)}}}}}\exp \left( { - {{\alpha FE} \mathord{\left/ {\vphantom {{\alpha FE} {RT}}} \right. \kern-0em} {RT}}} \right).$Присоединение первого электрона и отрыв сульфат-аниона по реакции (5) приводят к перераспределению электронной плотности в кластерной частице, резкому снижению энергии связи хром–кислород. Вероятнее всего, в образовавшейся частице атомы хрома уравниваются по степени окисления, а кислород равномерно распределяется между атомами хрома:
Нестабильная кластерная частица с ослабленной связью хром–кислород далее быстро восстанавливается до металла по суммарной реакции:
(7)
$\left[ {{\text{Cr}}{{{\text{O}}}_{2}}{\text{--}}\left\{ {{\text{Cr}}} \right\}{\text{--Cr}}{{{\text{O}}}_{2}}} \right]_{{{\text{ads}}}}^{ - } + 8{{{\text{H}}}^{ + }} + 7{\text{e}} \to 2{\text{Cr}} + \left\{ {{\text{Cr}}} \right\} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Возможно, состав участвующих частиц несколько иной, но принципиального влияния на описание механизма процесса это не имеет.
Подводя итог сказанному, процесс электроосаждения хрома из электролита на основе Cr(VI) в присутствии ионов Cr(III) и ${\text{SO}}_{4}^{{2 - }}$ упрощенно можно представить следующей схемой:
Схема процесса восстановления хрома.
В соответствии ${\text{c}}$ этой схемой электроосаждение металлического хрома осуществляется одновременно по двум независимым механизмам на разных участках поверхности: во-первых, происходит стадийное катодное восстановление ионов Cr(III) до металла по реакциям (2а), (3а) через стадию образования промежуточной частицы ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ во-вторых, осаждение хрома идет через стадию взаимодействия части адсорбированных частиц ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ с частицами Cr(VI) из раствора (реакция (4)) c образованием кластерного соединения и его последующего стадийного восстановления до металла с замедленным переносом первого электрона по реакции (5). Сульфат-анион обеспечивает условия стабильного существования ионов Cr(III) и Cr(II)ads в растворе, содержащем сульфат хрома (III) и серную кислоту, а также создает условия для образования и катодного восстановления кластерного соединения. Из этого механизма следует, что восстановление шестивалентного хрома до металла начинается тогда, когда достигается потенциал образования промежуточной частицы ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ восстановления трехвалентного хрома. Без образования частицы ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ электроосаждение металлического хрома не происходит ни по одному из возможных путей реакции, поэтому ионы Cr(III) – необходимый компонент электролита. Исходя из наших представлений порядок реакции восстановления хрома по ионам трехвалентного хрома должен быть равен +1, однако работ, в которых была бы экспериментально определена эта величина, мы не нашли.
Тафелевский наклон электрохимического восстановления хрома по реакциям (2а), (3а) должен составлять примерно 0.06 В, по реакциям (2а), (4), (5), (6) – 0.12 В. Поскольку экспериментально найденный наклон составляет примерно 0.12 В [4–7], можно сказать, что последний механизм восстановления хрома из стандартного электролита является превалирующим, а вклад реакции (3а) незначителен.
Из представленного механизма также следует, что хромовое покрытие будет радиоактивным независимо от того, вводится ли радиоактивный изотоп в виде хромовой кислоты или в виде сульфата хрома(III), поскольку оба вида ионов участвуют в образовании покрытия.
Проследить быстрые химические и электрохимические стадии восстановления кластерной частицы [Cr–{Cr}–CrO4$]_{{{\text{ads}}}}^{{2 - }}$ до металла по суммарной реакции (7) не представляется возможным, однако ясно, что соотношение скоростей восстановления хрома по двум различным путям реакции (2а), (3а) и (2а), (4), (5), (6) определяет структуру и свойства хромового покрытия и сложным образом зависит от плотности тока, температуры, pH и концентрации компонентов электролита.
“Побочным” процессом реакции восстановления хрома, в результате которого образуются ионы “металла-осадителя”, является реакция (8) восстановления Cr(VI) до Cr(III). При малых катодных потенциалах, когда потенциал образования Cr(II)ads не достигается, эта реакция является преобладающей. Предложенная нами схема восстановления хрома показывает, в частности, что природа частиц Cr(VI), из которых происходит восстановление металла и образование ионов Cr(III), действительно различна, а также объясняет другие закономерности и явления, описанные в литературе.
Существующие трудности в понимании механизма электроосаждения хрома обусловлены тем, что ионы хрома одновременно выступают как в роли тугоплавкого металла, так и в роли металла-осадителя, помимо этого часть тугоплавкого металла непрерывно трансформируется в металл-осадитель. Именно различие функций ионов одного и того же металла, но разной химической природы, их химическое взаимодействие между собой и превращение одних ионов в другие являлось причиной того, что до настоящего времени не было достаточно полного понимания процессов, происходящих в стандартном электролите хромирования.
Предположение о существовании катодной пленки не лишено оснований, поскольку при плотностях тока осаждения хрома в десятки и сотни А/дм2 и выходе по току хрома 10–15% львиная доля тока идет на выделение водорода и на подщелачивание прикатодного пространства. В этих условиях вблизи катода в сильнощелочной среде могут образовываться нерастворимые гидроксосоединения Cr(II) и Cr(III) в виде коллоидной пленки, но они электрохимически неактивны и уносятся в объем электролита интенсивным потоком водорода. Визуальное подтверждение существования катодной пленки в интенсивно окрашенном электролите хромирования едва ли возможно, и о ее образовании мы можем судить лишь косвенно. В любом случае для объяснения механизма восстановления хрома (и сплавов тугоплавких металлов) нет необходимости вводить понятие “катодная пленка”.
В то же время мы визуально наблюдали образование пленки на катоде при выделении водорода в бесцветном слабокислом растворе хлорида алюминия [19] и отмечали аномалии, вызванные образованием пленки, в частности независимость предельного тока восстановления ионов гидроксония от перемешивания электролита и значительный гистерезис поляризационных кривых при смене направления развертки потенциала. В этом случае существование тонкой плотной пленки нами было доказано и показано ее влияние на кинетику процессов.
ВЫВОДЫ
Восстановление хрома из стандартного электролита хромирования подчиняется механизму индуцированного соосаждения тугоплавких металлов с металлами группы железа
Электроосаждение хрома идет одновременно по двум различным механизмам, в обоих случаях через стадию образования адсорбированной промежуточной частицы Cr(II)ads.
Восстановление шестивалентного хрома до металла начинается тогда, когда достигается потенциал образования промежуточной частицы ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ восстановления трехвалентного хрома.
Причиной восстановления хромовой кислоты до металла является химическое взаимодействие промежуточной частицы ${\text{CrSO}}_{{4\,{\text{ads}}}}^{0}$ с анионом хромовой кислоты. Перенос первого электрона к образовавшейся кластерной частице определяет скорость восстановления хромовой кислоты.
Список литературы
Солодкова, Л.Н., Кудрявцев, B.H. Электролитическое хромирование. Москва: Глобус, 2007. 192 с. [Solodkova, L.N. and Kudryavtsev, V.N. Electrolytic chromium plating (in Russian), Moscow: Globus, 2007. 191 p.]
Соловьева, З.А., Кондратов, Ю.В., Ващенко, С.В. Изучение электрохимических характеристик электрода при электровосстановлении хромовой кислоты. Электрохимия. 1994. Т. 30. С. 230. [Solov’eva, Z.A., Kondratov, Yu.V., and Vashchenko, S.V., Study of the electrochemical electrode characterization under the chromium acid electroreduction, Russ. J. Electrochem. (in Russian), 1994. vol. 30. p. 230.]
Матулис, Ю.В. Блестящие электрохимические покрытия. Вильнюс: Минтис, 1969. 613 с. [Matulis, Yu.V., Bright electrolytic coatings (in Russian), Vilnius: Mintis, 1969. 613 p.]
Ефимов, Е.А., Ток, Л.Д. Кинетические параметры реакции электровосстановления хромовой кислоты до металлического хрома. Электрохимия. 1991. Т. 27. С. 111. [Efimov, E.A. and Tok L.D., The kinetic parameters of chromium acid electrochemical reduction to metal chromium, Russ. J. Electrochem. (in Russian), 1991. vol. 27. P. 111.]
Ефимов, Е.А. О механизме электроосаждения хрома из стандартного электролита хромирования. Электрохимия. 1996. Т. 32. С. 776. [Efimov, E.A., Mechanism of chromium electrodeposition from the standard chromium-plating electrolyte, Russ. J. Electrochem. (in Russian), 1996, vol. 32, p. 776.]
Ефимов, Е.А. О механизме электроосаждения хрома из стандартного электролита хромирования. Гальванотехника и обработка поверхности. 1992. № 1–2. С. 14. [Efimov, E.A., On the mechanism of chromium electrodeposition from the standard electrolyte, Electroplating and surface treatment (in Russian), 1992, nos. 1–2, p. 14.]
Александрова, Г.С., Буркат, Г.К., Долматов, В.Ю., Гмызин, Е.В. Об осаждении хрома в присутствии модифицированных бором детонационных наноалмазов в стандартном электролите хромирования. Хим. промышленность. 2016. Т. 43. № 1. С. 15. [Aleksandrova, G.S., Burkat, G.K., Dolmatov, V.Y., and Gmyzin, E.V., The electrodeposition of chromium in the presence of boron doped detonation nanodiamonds in the standard chromium electrolyte, Chem. Industry (in Russian), 2016, vol. 43, no. 1, p. 15.]
Ефимов, Е.А., Ток, Л.Д., Твердынина, Т.Б. Механизм восстановления аниона хромовой кислоты до трехвалентных ионов хрома. Электрохимия. 1989. Т. 25. С. 1398. [Efimov, E.A., Tok, L.D., and Tverdynina, T.B., Mechanism of electroreduction of chromic acid anions to trivalent chromium ions, Russ. J. Electrochem. (in Russian), 1989, vol. 25, p. 1398.]
Проценко, В.С. Кинетические закономерности электроосаждения хрома на вращающемся дисковом электроде . Вопросы химии и хим. технологии. 2012. № 4. С. 174. [Protsenko, V.S., Kinetic regularities of chromium electrodeposition on the rotating disk electrode, Voprosy khimii i khim. tekhnologii (in Russian), 2012, no. 4, p. 174.]
Nguyen, Van, Phuong, Sik-Chol, Kwon, Joo-Yul, Lee, Junyoung, Shin, Bui, The, Huy, and Yong-Ill, Lee., Mechanistic study on the effect of PEG molecules in a trivalent chromium electrodeposition process, Microchemical J., 2011, vol. 99, p. 7.]
Красиков, А.В., Красиков, В.Л. Механизм электроосаждения сплава никель-вольфрам из пирофосфатного электролита. Изв. СПбГТИ (Технический университет). 2016. № 36(62). С. 12. [Krasikov, A.V. and Krasikov, V.L., Mechanism of nickel-tungsten alloy electrodeposition from pyrophosphate electrolyte, Bull. Saint Petersburg State Institute of Technology (Technical University) (in Russian), 2016, no. 36 (62), p. 12.]
Krasikov, V.L., Krasikov, A.V. Mechanism for induced codeposition of alloys and some single refractory metals. Изв. СПбГТИ (Технический университет). 2016. № 37(63). С. 8. [Krasikov, V.L. and Krasikov, A.V., Mechanism for induced codeposition of alloys and some single refractory metals // Bull. Saint Petersburg State Institute of Technology (Technical University), 2016, no. 37 (63), p. 8.]
Podlaha, E.J. and Landolt, D., Induced Codepositon. I. An Experimental Investigation of Ni–Mo Alloys, J. Electrochem. Soc., 1996, vol. 143, p. 885.
Podlaha, E. J. and Landolt D., Induced Codepositon. II. A Mathematical Model Describing the Electrodeposition of Ni–Mo Alloys, J. Electrochem. Soc., 1996, vol. 143, p. 893.
Podlaha, E.J. and Landolt, D., Induced Codepositon. III. Molybdenum Alloys with Nickel, Cobalt and Iron, J. Electrochem. Soc., 1997, vol. 144, p. 1672.
Кузнецов, В.В., Матвеев, Д.В. Электроосаждение сплава хром–молибден из электролита на основе сульфата хрома(III). Электрохимия. 2008. Т. 44. С. 796. [Kuznetsov, V.V. and Matveev, D.V., Electrodeposition of chromium-molybdenum alloys from the electrolyte based on chromium (III) sulfate, Russ. J. Electrochem., 2008, vol. 44, p. 740.]
Кузнецов, В.В., Павлов, Л.Н., Винокуров, Е.Г., Филатова, Е.А., Кудрявцев, В.Н. Электроосаждение сплава хром-вольфрам из водноорганических растворов, содержащих диметилформамид. Электрохимия. 2015. Т. 51. С. 205. [Kuznetsov, V.V., Pavlov, L.N., Vinokurov, E.G., Filatova, E.A., and Kudryavtsev, V.N., Electrodeposition of chromium-tungsten alloy from organo-aqueous solutions containing dimethyl formamide, Russ. J. Electrochem., 2015, vol. 51, p. 174.]
Федоров, В.Е., Миронов, Ю.В., Наумов, Н.Г., Соколов, М.Н., Федин, В.П. Халькогенидные кластеры металлов 5–7 групп. Успехи химии. 2007. Т. 76. С. 571. [Fedorov, V.E., Mironov, Yu.V., Naumov, N.G., Sokolov, M.N., and Fedin V.P., Chalcogenide clusters of group 5–7 metals, Russ. Chem. Reviews, 2007, vol. 76, p. 529.]
Красиков, В.Л., Александрова, Г.С. Особенности катодного выделения водорода из слабокислых растворов, содержащих соль алюминия. Изв. СПбГТИ (Технический университет). 2012. № 17(43). С. 31–34. [Krasikov, V.L. and Aleksandrova, G.S., Specific features of cathode hydrogen evolution reaction from weak acid solutions containing aluminum ions, Bull. Saint Petersburg State Institute of Technology (Technical University) (in Russian), 2012, no. 17 (43), p. 31.]
Дополнительные материалы отсутствуют.