Электрохимия, 2020, T. 56, № 7, стр. 649-658
Разряд литий-кислородного источника тока: влияние толщины активного слоя на характеристики положительного электрода
Ю. Г. Чирков a, *, В. И. Ростокин b, **, В. Н. Андреев a, ***, В. А. Богдановская a, ****, О. В. Корчагин a, *****
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
b Национальный исследовательский ядерный университет (МИФИ)
115409 Москва, Каширское шоссе, 31, Россия
* E-mail: olga.nedelina@gmail.com
** E-mail: viktor.rostockin@yandex.ru
*** E-mail: vandr@phyche.ac.ru
**** E-mail: bogd@elchem.ac.ru
***** E-mail: oleg-kor83@mail.ru
Поступила в редакцию 22.08.2019
После доработки 03.10.2019
Принята к публикации 10.12.2019
Аннотация
Характерной особенностью процесса разряда катода литий-кислородного аккумулятора (ЛКА) с неводным электролитом является закупорка пор положительного электрода нерастворимым в электролите и неэлектропроводным веществом – пероксидом лития. Li2O2 “забивает” поры катода и препятствует поступлению в них кислорода. Это, в свою очередь, затрудняет дальнейшее протекание реакции. Тема данной статьи – исследование двух вопросов, представляющих значительный интерес для теории разряда литий-кислородных источников тока. Первый вопрос: почему допустимая толщина активного слоя катода крайне низка? Второй вопрос: чем обусловлено снижение удельной емкости при увеличении толщины активного слоя? С помощью метода компьютерного моделирования рассчитаны основные характеристики потенциостатического разряда ЛКА: плотность тока, продолжительность разряда, удельная емкость и константа процесса расхода кислорода k*. Показано, что необходимость использования низких величин плотности тока при разряде обусловлена малой толщиной области катода, примыкающей к границе раздела с газовой фазой, в которой преимущественно происходит образование Li2O2. Увеличение толщины катода приводит к уменьшению плотности тока, что, в свою очередь, обуславливает возрастание параметра k* и снижение разрядной емкости.
1. ПОСТАНОВКА ЗАДАЧИ ИССЛЕДОВАНИЯ
Одним из наиболее перспективных направлений развития литиевых источников тока является разработка литий-кислородных (воздушных) аккумуляторов и первичных элементов, удельная энергия которых значительно превосходит характеристики современных литий-ионных аккумуляторов [1]. Однако реализация теоретических преимуществ Li–O2-системы осложняется целым рядом факторов, среди которых определяющее значение имеют транспортные и омические потери на положительном электроде.
В настоящее время переход от первичных элементов к литий-кислородному аккумулятору (ЛКА) большинство исследователей связывает с использованием апротонных электролитов, обеспечивающих стабильность литиевого анода. В отличие от водных электролитов, которые позволяют сохранить протяженную систему газовых пор на кислородном электроде, апротонный электролит полностью затапливает поровое пространство электрода. В этих условиях поступление кислорода к электроннодоступным участкам поверхности ограничивается коэффициентом диффузии кислорода, его растворимостью, а также вязкостью электролита [2].
Омическое перенапряжение Li–O2-системы обусловлено не только сопротивлением электролита, но также экстремально низкой проводимостью осадка пероксида лития, осаждающегося в порах электрода при разряде. При накоплении пероксида также затрудняется транспорт кислорода в объем положительного электрода. С точки зрения практической реализации ЛКА, важным показателем является емкость, отнесенная к геометрической поверхности электрода. В настоящее время лучшие показатели для ЛКА с неводным электролитом соответствуют ~30 мА ч/см2 [3], что существенно уступает характеристикам первичных литий-кислородных элементов с водным электролитом, использующих защищенный литиевый анод [4].
Одной из центральных проблем повышения емкости ЛКА является оптимизация загрузки активного материала на положительном электроде. В работах [3, 5–9] среди прочих вопросов исследовано влияние толщины положительного электрода на емкость. При этом общей тенденцией является снижение емкости с ростом толщины электрода. Согласно [9], последний показатель достигает максимальных значений при загрузке активного материала 0.96 мг/см2 и практически не изменяется при дальнейшем увеличении загрузки. Напротив, авторы [7] наблюдали выраженный рост емкости (мА ч/см2) при увеличении загрузки от 5 до 15 мг/см2 и затем трехкратное снижение емкости при повышении загрузки до 25 мг/см2. Данные работы [3] близки к результатам [7], однако характеризуются значительным разбросом в широком интервале загрузок активного материала. В работе [8] показано, что если толщину активного слоя (АС) катода увеличивать в последовательности 19.7, 65.5 и 219.2 мкм, то для величины снимаемой емкости получается такая убывающая последовательность значений: 2550, 1580, 350 мА ч/г.
Качественное объяснение подобного рода фактов, на наш взгляд, достаточно простое. Ионам лития в межэлектродном пространстве с ростом толщины АС катода из-за возрастающих омических ограничений становится все труднее пробиться к тонкому слою у поверхности АС катода, разделяющей катод и газовую фазу. В этом слое в основном и идет образование пероксида лития. Очевидно, что дополнительно двигаться по кластеру из мелких пор уже не в электролите, заполняющем сепаратор, а в АС катода, к тому же в порах, частично заполненных нерастворимым пероксидом лития, становиться все труднее. В результате, в узкой зоне протекания процесса образования пероксида лития концентрация ионов лития падает. Это и обуславливает неизбежное уменьшение разрядной емкости с ростом толщины АС катода.
Отдельного обсуждения требуют максимумы емкости, наблюдаемые экспериментально. Если толщина АС очень мала, то, очевидно, нехватка поступления ионов лития, необходимых для проведения сложного процесса образования пероксида лития, практически не наблюдается. Поэтому небольшое постепенное наращивание толщины АС, слабо влияя на плотность тока, все еще приводит к увеличению емкости катода. Однако это увеличение емкости может продолжаться лишь до некоторой критической толщины АС катода, когда начнут проявляться трудности с обеспечением процесса образования Li2O2 ионами лития. И тогда, после достижения небольшого максимума, начнется понятное снижение величины емкости.
В настоящей статье мы будем анализировать только процессы, идущие в ЛКА на положительном электроде при разряде. Толщина АС катода мала – всего десятки мкм. Ввиду этого оказывается малой и величина емкости, рассчитанная на геометрическую поверхность катода. В свою очередь, все это естественным образом приводит к необходимости работать с малыми величинами плотности токов ионов лития. Цель данного исследования – дать уже не качественное, а количественное объяснение причин снижения удельной емкости по мере увеличения толщины АС катода, что обуславливает необходимость работать лишь с малыми толщинами АС с получением низких значений удельной разрядной емкости.
2. ПРОЦЕСС ОБРАЗОВАНИЯ ПЕРОКСИДА ЛИТИЯ В АС КАТОДА
Процесс образования Li2O2 при восстановлении кислорода в Li+-содержащем апротонном электролите в общем случае можно описать следующей последовательностью реакций [10–13]:
(1)
$\begin{gathered} {{{\text{O}}}_{2}} + {\text{e}} \to {\text{O}}_{2}^{ - }\,\,({\text{супероксид - анион}}), \\ {\text{O}}_{2}^{ - } + {\text{L}}{{{\text{i}}}^{ + }} \to {\text{Li}}{{{\text{O}}}_{2}}, \\ {\text{Li}}{{{\text{O}}}_{2}} \to {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{2}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}}, \\ {\text{Li}}{{{\text{O}}}_{2}} + {\text{e}} + {\text{L}}{{{\text{i}}}^{ + }} \to {\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Пероксид лития, накопленный в порах положительного электрода, может быть окислен при наложении анодного тока, что позволяет рассматривать литий-кислородный источник тока с неводным электролитом не только как первичный источник тока, но и в качестве перспективного аккумулятора. При заряжении ЛКА на положительном электроде образуются ионы лития, молекулы кислорода и электроны:
(2)
${\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{2}} \to 2{\text{L}}{{{\text{i}}}^{ + }} + {{{\text{O}}}_{2}} + 2{\text{e}}.$Термодинамическая ЭДС реакции 2Li + O2 ↔ ↔ Li2O2 составляет 2.96 В [14], что приблизительно соответствует установившемуся значению напряжения разомкнутой цепи ЛКА, согласно экспериментальным данным [15]. Разряд ЛКА можно проводить в гальваностатическом (наиболее часто используется на практике) или потенциостатическом режиме. В первом случае регистрируется снижение напряжения ЛКА во времени, во втором – падение разрядного тока. При этом в обоих случаях уменьшение характеристических показателей обусловлено преимущественно сопротивлениями протекания процесса (1) на положительном электроде. В условиях гальваностатического разряда важным параметром является среднее (установившееся) напряжение, на основании которого оцениваются удельная мощность разряда и эффективность функционирования ЛКА [15]. Это напряжение соответствует установившимся значениям составляющих поляризации (электрохимических, омических и транспортных) вплоть до их резкого увеличения при исчерпании возможности поддержания заданной скорости процесса. Разряд ЛКА обычно заканчивают после снижения напряжения до 2 В. При потенциостатическом разряде на зависимости тока от времени также может наблюдаться площадка, которая сменяется участком резкого падения тока [16].
В настоящей работе разряд ЛКА рассматривается как процесс, протекающий при постоянном значении напряжения. Это позволяет упростить расчеты по сравнению со случаем постоянного тока, в котором для интерпретации потерь напряжения требуется раздельное определение составляющих поляризации [17]. Анализ Li–O2 системы, работающей в режиме гальваностатического разряда, будет проведен в следующих сообщениях.
3. ТЕОРЕТИЧЕСКОЕ ОПИСАНИЕ ПРОЦЕССА РАЗРЯДА
В работе рассматривается простейший вариант модели пористого катода – монопористая модель. Эта модель предполагает, что в катоде имеется набор извилистых и непересекающихся капилляров с постоянным начальным радиусом rpo, которые берут начало на фронтальной поверхности АС катода.
Положим толщину АС катода как L, его начальную пористость g0. Таким образом, мы фактически рассматриваем процессы, идущие в отдельной поре катода. Растворенный в электролите кислород (или воздух) путем диффузии поступает в поры АС катода с фронтальной поверхности при координате x = 0. С тыльной поверхности (x = L) в АС подаются ионы лития. Они мигрируют частично в межэлектродном пространстве, частично в порах АС катода.
Эксперименты показывают, что образование пероксида лития совершается в очень тонком (десятки мкм) слое, поэтому дальнейшее увеличение толщины АС катода не имеет смысла. Ввиду этого было принято следующее упрощение: предполагается, что концентрация ионов лития в заполняющем поры АС катода электролите остается практически постоянной [18].
При проведении компьютерного моделирования, следуя работам [18–22], будем полагать концентрацию кислорода в порах a(х, t) основной величиной, определяющей процесс разряда катода. С учетом того, что при заполнении пор пероксидом лития в сечении каждой поры меняется не только доля объема свободного пространства g, но и реального, отличного от начального, радиуса поры rp, можно составить систему уравнений, которые описывают ход процессов, протекающих в монопористом АС катода при разряде ЛКА.
Учитывая, что эффективный коэффициент диффузии кислорода D в электролите непостоянен и пропорционален пористости g, имеем следующее соотношение:
(3)
$D = {{D*{\kern 1pt} g} \mathord{\left/ {\vphantom {{D*{\kern 1pt} g} \tau }} \right. \kern-0em} \tau },\,\,\tau = {{g}^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$(4)
$\frac{{\partial (ga)}}{{\partial {{t}_{{\text{p}}}}}} = \frac{\partial }{{\partial x}}\left( {D\frac{{\partial a}}{{\partial x}}} \right) + R(a,g,{{r}_{{\text{p}}}}),$где R (а, g, rp) – это убыль кислорода в результате образования пероксида лития в данном сечении поры с пористостью g и радиусом поры rp.
Обычно предлагается характеризовать сложный процесс убыли кислорода одним параметром интегрального характера – константой процесса расхода кислорода k [20, 21]. А именно, будем полагать, что
(5)
$R(a,g,{{r}_{{\text{p}}}}) = {{ - 2gka(x,{{t}_{{\text{p}}}})} \mathord{\left/ {\vphantom {{ - 2gka(x,{{t}_{{\text{p}}}})} {{{r}_{{\text{p}}}}}}} \right. \kern-0em} {{{r}_{{\text{p}}}}}}.$В правой части условия (5) 2g/rp представляет собой удельную поверхность в поре, на которой совершается первая стадия процесса (1), а(х, tp) – концентрация кислорода в данном сечении поры х в данный момент времени tp, а k – играет роль коэффициента пропорциональности, его размерность см/с.
Также приведем следующее уравнение, дополняющее условия (4), (5):
(6)
${{\partial g} \mathord{\left/ {\vphantom {{\partial g} {\partial {{t}_{{\text{p}}}} = R\left( {a,g,{{r}_{{\text{p}}}}} \right)}}} \right. \kern-0em} {\partial {{t}_{{\text{p}}}} = R\left( {a,g,{{r}_{{\text{p}}}}} \right)}}\left( {{{{{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right).$Смысл уравнения (6), описывающего изменение пористости катода g во времени, очевиден, если учесть, что M/ρ – молярный объем. При этом M, г/моль – мольная масса и ρ, г/см3 – плотность пероксида лития.
Суть происходящих в порах АС катода во времени процессов состоит в следующем. С фронтальной поверхности в монопористое пространство катода подается кислород. На стенках пор он присоединяет электрон, восстанавливается и затем вступает во взаимодействие с ионами лития. Образующийся в итоге всего процесса (1) конечный продукт Li2O2 откладывается в порах, постепенно заполняя их начальный объем (уменьшаются rp и g).
Для определенности будем полагать, что процесс разряда (подачи кислорода в поры катода) будет считаться законченным, когда на фронтальной поверхности АС катода остается незаполненным продуктом реакции всего 10% начального объема поры. В этих условиях кислород уже практически перестает поступать в пору, процесс образования пероксида лития в ней прекращается.
Пока у нас имеются фактически два уравнения с тремя неизвестными – а, g и rp. Однако очевидно, что последние две величины связаны соотношением:
(7)
${{\left( {{g \mathord{\left/ {\vphantom {g {{{g}_{0}}}}} \right. \kern-0em} {{{g}_{0}}}}} \right)}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}} = {{\left( {{{{{r}_{{\text{p}}}}} \mathord{\left/ {\vphantom {{{{r}_{{\text{p}}}}} {{{r}_{{{\text{po}}}}}}}} \right. \kern-0em} {{{r}_{{{\text{po}}}}}}}} \right)}^{2}},$(8)
${{{{r}_{{\text{p}}}}} \mathord{\left/ {\vphantom {{{{r}_{{\text{p}}}}} {{{r}_{{{\text{po}}}}}}}} \right. \kern-0em} {{{r}_{{{\text{po}}}}}}} = 1\,\,\,{\text{и}}\,\,a\left( {z,t} \right) = 0.$При этом на фронтальной поверхности АС катода для приведенной концентрации в поре, обозначим ее как с, имеем условие:
(9)
$c = {a \mathord{\left/ {\vphantom {a {a{\text{*}}}}} \right. \kern-0em} {a{\text{*}}}} = 1\,\,\,\,{\text{при}}\,\,\,\,z = 0,$(10)
${{{\text{d}}c} \mathord{\left/ {\vphantom {{{\text{d}}c} {{\text{d}}z}}} \right. \kern-0em} {{\text{d}}z}} = 0\,\,{\text{при}}\,\,z = 1.$Для проведения конкретных численных расчетов полезно теперь провести полное обезразмеривание системы уравнений и условий (4)–(6). Итак, положим
(11)
$t = \frac{{{{t}_{{\text{p}}}}D{\text{*}}g_{0}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}{{L{}^{2}}},\,\,\,\,r = \frac{{{{r}_{{\text{p}}}}}}{{{{r}_{{{\text{po}}}}}}},\,\,\,\,z = \frac{x}{L},\,\,\,\,c = \frac{a}{{a{\text{*}}}},$Тогда в области приведенных величин 0 ≤ r, z и с ≤ 1 можно переписать выражения (4)–(6) в виде системы двух уравнений относительно двух главных переменных с и r:
(12)
${{\partial {{r}^{{{4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3}}}}c} \mathord{\left/ {\vphantom {{\partial {{r}^{{{4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3}}}}c} {\partial t}}} \right. \kern-0em} {\partial t}} = \partial \left( {{{{{r}^{2}}\partial c} \mathord{\left/ {\vphantom {{{{r}^{2}}\partial c} {\partial z}}} \right. \kern-0em} {\partial z}}} \right)\partial z - \beta {{r}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}c,$(13)
${{\partial r} \mathord{\left/ {\vphantom {{\partial r} {\partial t}}} \right. \kern-0em} {\partial t}} = - \gamma c,$(14)
$\begin{gathered} \beta = k\left[ {{{2{{L}^{2}}} \mathord{\left/ {\vphantom {{2{{L}^{2}}} {D*{{g}_{0}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}{{r}_{{{\text{po}}}}}}}} \right. \kern-0em} {D*{{g}_{0}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}{{r}_{{{\text{po}}}}}}}} \right], \\ \gamma = k\left[ {\left( {3{{L}^{2}}{{a*} \mathord{\left/ {\vphantom {{a*} {2D*{{g}_{0}}{{r}_{{{\text{po}}}}}}}} \right. \kern-0em} {2D*{{g}_{0}}{{r}_{{{\text{po}}}}}}}} \right)\left( {{M \mathord{\left/ {\vphantom {M \rho }} \right. \kern-0em} \rho }} \right)} \right]. \\ \end{gathered} $Конечный итог проводимых дальше расчетов – оценка изменений во времени величины габаритного тока I(t), А/см2. Это суммарное количество накопленного в порах катода пероксида лития в данный момент времени, которое можно рассчитать согласно формуле:
(15)
$I\left( t \right) = k\left[ {{{4F{{g}_{0}}aL} \mathord{\left/ {\vphantom {{4F{{g}_{0}}aL} {{{r}_{{{\text{po}}}}}}}} \right. \kern-0em} {{{r}_{{{\text{po}}}}}}}} \right]\int\limits_{z = 0}^{z = 1} {\left[ {{{r}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}\left( {z,t} \right)c\left( {z,t} \right)} \right]{\text{d}}z} .$Конечную величину удельной емкости катода С (Кл/см2) можно определить по формуле:
в которой приведенное конечное время:(17)
$t* = {T \mathord{\left/ {\vphantom {T {{{t}_{{{\text{po}}}}}}}} \right. \kern-0em} {{{t}_{{{\text{po}}}}}}},$(18)
${{t}_{{{\text{po}}}}} = \frac{{{{L}^{2}}}}{{D{\text{*}}g_{0}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}.$Необходимо уточнить физический смысл фигурирующей в выражении (5) константы процесса расхода кислорода k. Этот множитель показывает, какая доля в схеме процесса (1) из множества молекул кислорода, присоединивших на поверхности поры электрон и превратившихся в супероксид-анион ${\text{O}}_{2}^{ - }$, способно соединиться затем с ионом лития (вторая строчка в схеме (1) ) с образованием пероксида лития. Таким образом, величина k становится фактически пропорциональной концентрации ионов лития в поре. При нулевой концентрации ионов лития, очевидно, процесс образования пероксида лития(1) останавливается, и в этом случае следует считать, что k = 0. Отсюда следует, что при заданной толщине катодного АС константу k можно считать симбатной плотности тока i, мА/см2, в ЛКА.
Вывод аналитического выражения, связывающего k и i, является сложной задачей. Для ее решения необходимо учесть множество факторов: толщину монопористого АС катода, радиус пор, физико-химические свойства растворителя, величину плотности тока i и др. На данном этапе исследований абсолютная величина одного из важнейших параметров, входящих в расчетные уравнения, – константы процесса расхода кислорода k – остается определенной не строго. Однако, изменяя параметр k в сторону уменьшения или увеличения, мы фактически меняем величину плотности тока i в том же направлении.
Кроме того, отметим, что все же имеется возможность примерной численной оценки параметра k. Если рассчитанную величину емкости С, Кл/см2 (формула (16)) разделить на время разряда T, с (формулы (17) и (18)), то результат этого деления C/T, А/см2, уже можно будет сопоставлять с плотностью тока i, A/см2. В процессе разряда ионы лития необходимо постоянно подавать в АС катода, чтобы в нем шло непрерывное образование молекул пероксида лития. Таким образом, поскольку емкость C и плотность тока I(t) (формулы (15)–(16)) пропорциональны параметру k, это обстоятельство и позволяет количественно оценить величину константы процесса расхода кислорода.
4. СВЯЗЬ ПЛОТНОСТИ ТОКА С ТОЛЩИНОЙ АКТИВНОГО СЛОЯ
Эффективная удельная проводимость электролита в межэлектродном пространстве $\varkappa $ заметно больше, чем проводимость электролита в порах АС катода. Если обозначить степень уменьшения проводимости ионов лития в АС катода через множитель η, то очевидно, что с увеличением толщины АС катода L плотность тока iL, зависящая от толщины активного слоя в межэлектродном пространстве, частично заполненном АС катода, начнет убывать.
Введем следующие обозначения: V – заданная разность потенциалов между электродами, Δ – суммарная ширина катода и слоя электролита, (Δ – L) – толщина межэлектродного пространства, заполненного электролитом с проводимостью ϰ. АС катода толщиной L из-за присутствия мелких пор характеризуется меньшей проводимостью, равной η$\varkappa $. Плотность тока в такой комбинированной системе может быть рассчитана по формуле:
(19)
${{i}_{L}} = {{\eta V\varkappa } \mathord{\left/ {\vphantom {{\eta V\varkappa } {\left[ {\eta {{\left( {\Delta - L} \right)} \mathord{\left/ {\vphantom {{\left( {\Delta - L} \right)} \Delta }} \right. \kern-0em} \Delta } + {L \mathord{\left/ {\vphantom {L \Delta }} \right. \kern-0em} \Delta }} \right]}}} \right. \kern-0em} {\left[ {\eta {{\left( {\Delta - L} \right)} \mathord{\left/ {\vphantom {{\left( {\Delta - L} \right)} \Delta }} \right. \kern-0em} \Delta } + {L \mathord{\left/ {\vphantom {L \Delta }} \right. \kern-0em} \Delta }} \right]}}.$Положим начальную плотность тока iL = 0 = = 0.1 мА/см2 и V = 1 В.
Из формулы (19) следует, что при отсутствии АС катода в межэлектродном пространстве (при L = 0 и η = 1) плотность тока максимальна, iL = 0 = = $V\varkappa $. Это позволяет определить величину проводимости $\varkappa $, которая составит 10–4 Ом–1 см–2. Другой предельный случай – все межэлектродное пространство заполнено АС катода, тогда L = Δ. В этом случае эффективная проводимость снижается до величины $\eta \varkappa $ (Ом–1 см–2), а величина плотности тока уменьшается до значения iL=Δ = = η0.1 мА/см2.
5. МЕТОДИКА РЕШЕНИЯ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ
При расчетах в качестве растворителя был выбран тетраглим, растворимость кислорода с0 = = 4.43 × 10–6 моль см–3, коэффициент диффузии D = 2.17 × 10–6 см2 с–1 [12, 13]. Начальный радиус пор в пористых слоях r0 = 2 нм, начальная пористость слоев g0 = 0.73, ${{M}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 45.8768 г/моль, плотность пероксида лития ${{\rho }_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 2.3 г/см3.
Дифференциальные уравнения в частных производных (12)–(13) решались численным методом с помощью программного пакета Maple [23–25]. Предварительно, чтобы выделить явно искомые переменные с(x, t) и r(x, t), эти уравнения были заменены эквивалентной системой из трех уравнений:
(20)
$\begin{gathered} \frac{\partial }{{\partial t}}c\left( {z,t} \right) = r{{\left( {z,t} \right)}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}\frac{{{{\partial }^{2}}}}{{\partial {{x}^{2}}}}c(z,t) + \frac{2}{{r{{{\left( {z,t} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}}} \times \hfill \\ \times \,\,\frac{\partial }{{\partial z}}r\left( {z,t} \right)\frac{\partial }{{\partial z}}c\left( {z,t} \right) + \frac{{c\left( {z,t} \right)\left( {\beta - \frac{4}{3}\gamma c\left( {z,t} \right)} \right)}}{{r\left( {z,t} \right)}}, \hfill \\ \frac{\partial }{{\partial z}}r\left( {z,t} \right) = v(z,t),\,\,\, \hfill \\ \,\frac{\partial }{{\partial t}}r\left( {z,t} \right) = - \gamma c\left( {z,t} \right), \hfill \\ \end{gathered} $6. РАСЧЕТ РАЗРЯДНЫХ ХАРАКТЕРИСТИК
Главный параметр проводимых дальше расчетов – толщина АС катода L. Проведем расчет iL в интервале значений L от 0.005 до 0.03 см по формуле (19) при Δ = 0.03 см. При разности потенциалов V = 1 В и начальной плотности тока iL = 0 = = 0.1 мА/см2 построим зависимости iL(L) для значений параметра η = 0.1 и 0.3 (рис. 1).
Рисунок 1 демонстрирует снижение плотности тока с ростом толщины АС катода. При этом пока остаются неопределенными константа процесса расхода кислорода k (см/c), емкость катода С (Кл/см2) и время разряда Т (с). Для нахождения искомых показателей оценим с помощью формул, приведенных в разделе 3, влияние константы процесса расхода кислорода k на С, k- и Т, k-зависимости. Величину параметра k будем свободно варьировать в интервале от 10–9 до 10–7 см/с. Это необходимо для получения зависимости величины I* от k. Величина I* представляет собой среднее количество пероксида лития, накопленное в порах АС катода, и определяемое формулой:
(23)
$I*\,\left( {{{{\text{мА}}} \mathord{\left/ {\vphantom {{{\text{мА}}} {{\text{с}}{{{\text{м}}}^{2}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{2}}}}} \right) = {C \mathord{\left/ {\vphantom {C T}} \right. \kern-0em} T}.$Отметим, что для поддержания этой величины в процессе разряда необходим постоянный подвод ионов лития, который соответствует плотности тока iL (мА/см2). Таким образом, имеем
Это условие дает возможность найти все основные параметры процесса разряда, которые бы соответствовали выбранной толщине АС катода L и величине плотности тока iL.
Зависимость отношения С/T от k представлена на рис. 2. Ось ординат на рис.2 служит для отсчета не только величины С/Т, но также и плотности тока iL. Пересечение пунктирных горизонтальной и вертикальной линий с С/T, k – кривой определяет искомую величину k = k* для заданного значения iL.
Рис. 2.
Расчетная С/Т,k-кривая, позволяющая связать толщину АС катода L с величиной константы процесса расхода кислорода k = k* (L = 100 мкм, для пересечения, обозначенного цифрой 1, параметр η = 0.1, а С/Т = 2.5 × 10–5 мА/см2, для пересечения 2 η = 0.3, а С/Т = 5.625 × 10–5 мА/см2).

На рис. 2 выбрана толщина АС катода L = = 100 мкм и два значения параметра η – 0.1 (нижнее пересечение пунктирных кривых) и 0.3 (верхнее пересечение пунктирных кривых).
Две вертикальные пунктирные линии указывают два значения для k*, см/с – 3.459 × 10–7 и 10.112 × 10–7, соответствующие η = 0.1 и 0.3. В свою очередь, это дает возможность оценить величины двух основных параметров разряда ЛКА – времени разряда Т и полученной емкости С. Совокупность всех параметров, определенных при изменении толщины АС катода от L = 0 до максимально возможного значения L = 300 мкм представлена в табл. 1 и на рис. 3–5.
Таблица 1.
Зависимость основных характеристик процесса разряда ЛКА – плотности тока iL, времени разряда Т, удельной емкости С и константы процесса расхода кислорода k* – от толщины АС катода L для начальной плотности тока i = 0.1 мА/см2 и двух значений параметра η – 0.1 и 0.3
| L, мкм | iL, мА/см2 | T, с | С, Кл/см2 | k* × 107, см/с | ||||
|---|---|---|---|---|---|---|---|---|
| η = 0.1 | η = 0.3 | η = 0.1 | η = 0.3 | η = 0.1 | η = 0.3 | η = 0.1 | η = 0.3 | |
| 50 | 4.00 × 10–5 | 7.20 × 10–5 | 14 376.5 | 5054.7 | 0.573 | 0.358 | 0.950 | 2.725 |
| 75 | 3.08 × 10–5 | 6.32 × 10–5 | 5873.6 | 2038.7 | 0.185 | 0.128 | 2.245 | 6.733 |
| 100 | 2.50 × 10–5 | 5.63 × 10–5 | 3927.4 | 1128.5 | 0.098 | 0.057 | 3.459 | 10.112 |
| 150 | 1.82 × 10–5 | 4.62 × 10–5 | 2721.6 | 760.7 | 0.049 | 0.032 | 4.995 | 14.334 |
| 200 | 1.43 × 10–5 | 3.91 × 10–5 | 2358.2 | 628.9 | 0.034 | 0.023 | 5.763 | 16.797 |
| 250 | 1.18 × 10–5 | 3.40 × 10–5 | 2206.5 | 764.7 | 0.026 | 0.025 | 6.158 | 18.466 |
| 300 | 1.00 × 10–5 | 3.00 × 10–5 | 2129.2 | 553.0 | 0.021 | 0.017 | 6.405 | 19.719 |
Рис. 3.
Зависимость константы процесса расхода кислорода k* от толщины активного слоя катода L для двух значений параметра η – 0.1 (кривая 1) и 0.3 (кривая 2).
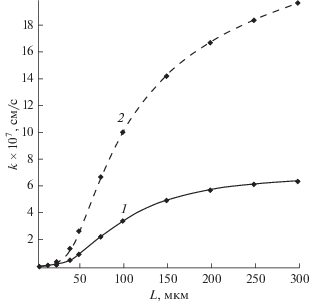
Рис. 4.
Зависимость продолжительности времени разряда Т, с от толщины активного слоя катода L для двух значений параметра η – 0.1 (кривая 1) и 0.3 (кривая 2).

Рис. 5.
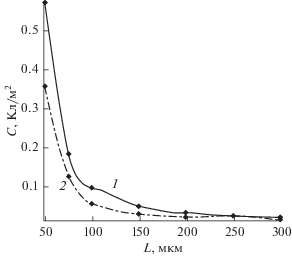
Зависимость емкости разряда С, Кл/см2 от толщины активного слоя катода L для двух значений параметра η – 0.1 (кривая 1) и 0.3 (кривая 2).
При расчете данных в табл. 1 рассматривались две величины проводимости электролита в АС катода. В сравнении с проводимостью электролита в межэлектродном пространстве $\varkappa $ = 10–4 Ом–1 см–2 она составляла $\varkappa $ = 10–5 Ом–1 см–2 (вариант η = = 0.1) и $\varkappa $ = 3 × 10–5 Ом–1 см–2 (вариант η = 0.3). При возрастании толщины АС катода, как показывают данные 2 и 3 столбцов, плотность тока iL снижалась до конечных значений iL = 10–5 мА/см2 (вариант η = 0.1) и iL = 3 × 10–5 мА/см2 (вариант η = 0.3).
При каждом фиксированном значении L определяли величину константы процесса расхода кислорода k = k* (данные 8 и 9 столбцов табл. 1), соответствующую достигнутой величине плотности тока iL (данные 2 и 3 столбцов табл. 1), согласно приведенному выше описанию. Для найденных значений k* уже можно было восстановить значения времени разряда Т (данные 4 и 5 столбцов табл. 1) и удельной емкости С (данные 6 и 7 столбцов табл. 1).
Как следует из данных, представленных в табл. 1, с увеличением толщины АС катода L плотность тока в межэлектродном пространстве iL падает. При этом величина константы процесса расхода кислорода k* возрастает примерно на порядок, а время разряда Т и емкость С значительно снижаются. Последний факт соответствует данным работы [21], в которой было показано, что с ростом параметра k величина емкости С и время разряда Т убывают.
Проведем анализ влияния параметра η на основные характеристики ЛКА при разряде. На основании данных табл. 1 построим рис. 3–5, на которых приведены зависимости константы процесса расхода кислорода k = k*, времени проведения разряда ЛКА Т и величины полученной емкости С от толщины АС катода.
Данные, приведенные на рис.3, показывают, что для очень тонких активных слоев катода различие в величинах параметра k* незначительно. При увеличении L параметр k* начинает расти, и этот рост происходит быстрее при большем значении η.
Как было показано в работе [22], рост параметра k* приводит к уменьшению времени разряда Т. Поэтому кривая 2 на рис.4, отвечающая большим величинам k* (рис. 3), лежит ниже кривой 1.
Согласно расчетам, проведенным в [21], емкость ЛКА также должна снижаться при возрастании параметра k*, что подтверждается зависимостями, приведенными на рис. 5. Таким образом, увеличение толщины АС катода приводит к уменьшению плотности тока (рис. 1), что, в свою очередь, обуславливает, как было показано в предыдущем разделе, возрастание параметра k* и снижение разрядной емкости.
Отметим, что на рис. 5 не показана зависимость удельной емкости С от толщины АС катода L в области от L = 0 до L = 50 мкм. Расчет С, L-кривых в этой области требует существенных изменений в разработанной методике расчета и выходит за рамки настоящей работы. При этом, как показывают экспериментальные данные, в области малых значений толщины АС катода наблюдается возрастание удельной емкости ЛКА при разряде [26, 27]. Затем С, L-зависимость проходит через максимум и приобретает убывающий характер. Участок спада емкости удалось количественно оценить в данной статье.
7. ЗАКЛЮЧЕНИЕ
С помощью компьютерного моделирования исследованы причины снижения разрядной емкости ЛКА, работающего в режиме потенциостатического разряда, с ростом толщины АС катода L. Показано, что потери в емкости ЛКА обусловлены снижением плотности тока при увеличении L. Скорость этого снижения замедляется при увеличении размера межэлектродного пространства, что может быть количественно показано с помощью формулы (19).
Проведенное исследование позволяет объяснить необходимость использования при разряде ЛКА плотностей тока, обычно не превышающих десятых долей мА/см2. Низкая величина плотности тока обусловлена малой толщиной области АС катода, примыкающей к границе раздела с газовой фазой, в которой в основном и происходит образование пероксида лития. Снижение емкости при плотностях тока, больших, чем 0.1 мА/см2, можно объяснить ускорением процесса образования пероксида лития преимущественно в устьях пор у границы с газовой фазой. Это приводит к быстрому закрыванию пор для поступления в них кислорода. Как результат, с увеличением плотности тока емкость при разряде ЛКА начинает уменьшаться.
С другой стороны, использование плотностей тока значительно ниже 0.1 мА/см2 при возрастании толщины АС катода приведет при разряде ЛКА, во всяком случае при реализации потенциостатического режима, к более раннему и резкому уменьшению тока ионов лития (iL), что не позволяет получить значения емкости, которые достигаются при более высоких плотностях тока.
Результаты данной работы позволили объяснить экспериментальные факты снижения величины емкости с ростом толщины АС катода, наблюдаемые для случая проведения разряда ЛКА в потенциостатическом режиме. Что же касается режима гальваностатического разряда, то в этом случае установление количественного соответствия между экспериментальными и расчетными данными осложнено необходимостью определения составляющих напряжения при работе ЛКА. Подходы к решению этой задачи будут обсуждаться в следующих сообщениях.
Еще одно крайне важное замечание общего характера. Очевидно, что только достаточная работоспособность отрицательного (металлического литиевого) электрода позволяет добиться полноценного функционирования ЛКА. Поэтому в теоретических расчетах в явном виде обязательно должна фигурировать плотность тока i (в нашей статье роль плотности тока фактически берет на себя константа процесса расхода кислорода k). На деле этого не происходит (см., к примеру, работы [28, 29]). Обычно утверждается [30], что при разряде ЛКА самое важное обеспечить диффузию кислорода, распространяющуюся на как можно большую толщину активного слоя катода. А концентрация ионов лития в зоне, где в основном происходит генерация пероксида лития, всегда достаточна для поддержания этого процесса.
Список литературы
Тарасевич, М.Р., Андреев, В.Н., Корчагин, О.В., Трипачев, О.В. Литий-кислородные (воздушные) источники тока (современное состояние и перспективы), Физикохимия поверхности и защита материалов. 2017. Т. 53. № 1. С. 3.
Mohazabrad, F., Wang, F., and Li, X., Experimental Studies of Salt Concentration in Electrolyte on the Performance of Li–O2 Batteries at Various Current Densities, J. Electrochem. Soc., 2016, vol. 163, no. 13, p. A2623.
Nomura, A., Ito, K., Kubo, Y., CNT Sheet Air Electrode for the Development of Ultra-High Cell Capacity in Lithium–Air Batteries, Scientific Reports, 2017, vol. 7, p. 45596.
The Lithium-Air Battery: Fundamentals, Ed. Imanishi, N., Luntz, A.C., Bruce, P.G., Springer, New York, 2014.
Abraham, K.M., and Jiang, Z., A Polymer Electrolyte-Based Rechargeable lithium/Oxygen Battery, J. Electrochem. Soc., 1996, vol. 143, p. 1.
Beattie, S.D., Manolescu, D.M., and Blair, S.L., High-Capacity Lithium–Air Cathodes, J. Electrochem. Soc, 2009, vol. 156, p. A44.
Xiao, J., Wang, D., Xu, W., Wang, D., Williford, R.E., Liu, J., and Zhang, J.-G., Optimization of Air Electrode for Li/Air Batteries, J. Electrochem. Soc., 2010, vol. 157, p. A487.
Zhang, G.Q., Zheng, J.P., Liang, R., Zhang, C., Wang, B., Hendrickson, M., and Plichta, E.J., Lithium–Air Batteries Using SWNT/CNF Buck papers as Air Electrodes, J. Electrochem. Soc., 2010, vol. 157, p. A953.
Landa-Medrano, I., Pinedo, R., Ruiz de Larramendi, I., Ortiz-Vitoriano, N., and Rojo, T., Monitoring the Location of Cathode-Reactions in Li–O2 Batteries, J. Electrochem. Soc., 2015, vol. 162, p. A3126.
Tran, C., Yang, X.-Q., and Qu, D., Investigation of the gas-diffusion-electrode used as lithium/air cathode in non-aqueous electrolyte and the importance of carbon material porosity, J. Power Sources, 2010, vol. 195, no. 7, p. 2057.
Yang, X.-h., He, P., and Xia, Y.-y., Preparation of mesocellular carbon foam and its application for Lithium/Air Battery, Electrochem. Commun. 2009, vol. 11, no. 6, p. 1127.
Laoire, C.O., Mukerjee, S., Abraham, K.M., Plichta, E.J., and Hendrickson, M.A., Elucidating the mechanism of oxygen reduction for lithium-air battery applications, J. Phys. Chem. C, 2009, vol. 113, no. 46, p. 20127.
Laoire, C.O., Influence of nonaqueous solvents on the electrochemistry of oxygen in the rechargeable lithium-air, J. Phys. Chem. C, 2010, vol. 114, no. 19, p. 9178.
Chase, M.W., NIST-JANAF, Jr., Thermochemical Tables, J. Phys. Chem. Ref. Data, Monogr. 1998, 9, 1510.
Богдановская, В.А., Корчагин, О.В., Тарасевич, М.Р., Андреев, В.Н., Нижниковский, Е.А., Радина, М.В., Трипачев, О.В., Емец, В.В. Мезопористые наноструктурированные материалы для положительного электрода литий-кислородного аккумулятора. Физикохимия поверхности и защита материалов. 2018. Т. 54. С. 232. [Bogdanovskaya, V.A., Korchagin, O.V., Tarasevich, M.R., Andreev, V.N., Nizhnikovskii, E.A., Radina, M.V., Tripachev O.V., and Emets V.V. Mesoporous Nanostructured Materials for the Positive Electrode of a Lithium–Oxygen Battery. Prot. Met. Phys. Chem. Surf., 2018, vol. 54, p. 373.]
Hase, Y., Komori, Y., Kusumoto, T., Harada, T., Seki, J., Shiga, T., Kamiya, K., and Nakanishi, S., Negative differential resistance as a critical indicator for the discharge capacity of lithium-oxygen batteries, Nat. Comm., 2019, vol. 10, p. 596.
Tan, P., Ni, M., Shao, Z., Chen, B., and Kong, W., Numerical investigation of a non-aqueous lithium-oxygen battery based on lithium superoxide as the discharge product, Appl. Energy, 2017, vol. 203, p. 254.
Sandhu, S.S., Diffusion-limited model for a lithium/air battery with an organic electrolyte, J. Power Sources, 2007, vol. 164, no. 1, p. 365.
Read, J., Mutolo, K., Ervin, M., Behl, W., Wolfenstine, J., Driedger, A., and Foster, D., Oxygen Transport Properties of Organic Electrolytes and Performance of Lithium/Oxygen Battery, J. Electrochemical Society, 2003, vol. 150, p. A1351.
Dabrowski, T., Struck, A., Fenske, D., Maaß, P., and Ciacchi, L.C., Optimizatio of Catalytically Active Sites Positioning in Porous Cathodes of Lithium/Air Batteries Filled with Different Electrolytes, J. Electrochem. Soc., 2015, vol. 162, no. 14, p. A2796.
Chirkov, Yu.G., Andreev, V.N., Rostokin, V.I., and Bogdanovskaya, V.A., Discharge of Lithium-Oxygen Power Source:Monoporous Cathode Theory and Role of Constant of Oxygen Consumption Process, Alternative Energy and Ecology (ISJAEE), 2018, no. 4–6, p. 95.
Богдановская, В.А., Чирков, Ю.Г., Ростокин, В.И., Емец, В.В., Корчагин, О.В., Андреев, В.Н., Трипачев, О.В. Влияние структуры положительного электрода на процесс разряда литий-кислородного (воздушного) источника тока. Теория монопористого катода, Физикохимия поверхности и защита материалов. 2018. Т. 54. С. 549. [Bogdanovskaya, V.A., Andreev, V.N., Chirkov, Yu.G., Rostokin, V.I., Emets, V.V., Korchagin, O.V., Tripachev, O.V. Effect of Positive Electrode Structure on Process of Discharge of Lithium–Oxygen (Air) Power Source. Theory of Monoporous Cathode, Prot. Met. Phys. Chem. Surf., 2018, vol. 54, p. 549.]
Дьяконов В. П. Maple 10/11/12/13/14in mathematical calculations. М.: ДМК-Press-Пресс, 2011, p. 800.
Davis, Jon H., Differential Equations with Maple: An Interactive Approach. ISBN.
Edwards, Charles Henry, Penny, David E., Differential Equations and Boundary Value Problems: Computing and Modeling. 2008. 3-e ed. M.: Williams Publ.g House, 1104 p.
Xiao, J., Wang, D., Xu, W., Wang, D., Williford, R.E., Liu, J., and Zhang, J.-G., Optimization of Air Electrode for Li/Air Batteries, J. Electrochem. Soc., 2010, vol. 157, p. A487.
Landa-Medrano, I., Pinedo, R., Ruiz de Larramendi I., Ortiz-Vitoriano, N., and Rojo, T., Monitoring the Location of Cathode-Reactions in Li–O2 Batteries, Electrochem. Soc., 2015, vol. 162, p. A3126.
Bao, J., Hu, W., Bhattacharya, P., Stewart, M., Zhang, J.-G., and Pan, W., Discharge performance of Li–O2 batteries using a multiscale modeling approach, J. Phys. Chem. C., 2015, vol. 119, no. 27, p. 14851.
Pan, W., Yang, X., Bao, J., and Wang, M., Optimizing discharge capacity of Li-O2 Batteries dy design of air-electrode porous structure: Multifidelity modeling and optimization, J. Electrochem. Soc., 2017, vol. 164, no. 11, p. E3499.
Gaya, C., Yin, Y., Torayev, A., and Mammeri, Y., Franco Investigation of bi-porous electrodes for lithium oxygen batteries, Electrochim. Acta, 2018, vol. 279, p. 118.
Дополнительные материалы отсутствуют.



