Электрохимия, 2020, T. 56, № 7, стр. 659-665
Редокс-реакция биядерного оксохлоридного комплекса рутения(IV) с литиевыми противокатионами в окислении воды
В. Ю. Ткаченко a, *, З. М. Джабиева b, Л. И. Ткаченко b, Л. В. Авдеева b, Т. С. Джабиев b, **
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
b Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
* E-mail: virineya_lam@mail.ru
** E-mail: timur@cat.icp.ac.ru
Поступила в редакцию 20.03.2019
После доработки 25.09.2019
Принята к публикации 10.12.2019
Аннотация
Исследована реакция восстановления биядерного оксохлоридного комплекса рутения(IV) с литиевыми противокатионами Li4Ru2OCl10 в растворах HCl электрохимическим и спектрофотометрическим методами. Результаты согласуются с процессом, включающим необратимое восстановление димера в слабокислой среде (0.2–0.8 М HCl) в смешанно-валентный интермедиат, который далее распадается на мономеры Ru(IV) и Ru(III). Повышение концентрации HCl до 2.0 М и выше исключает его образование. Кинетика восстановления Ru(IV)–Ru(IV) координированной водой в 3 М HCl происходит по бимолекулярному закону. Биядерные комплексы самоорганизуются в тетраядерный катализатор, окисляющий воду четырехэлектронно до молекулы кислорода. Состав тетраядерного катализатора определен с помощью электро-спрей-масс-спектрометрического метода.
ВВЕДЕНИЕ
Известно, что комплексы переходных металлов (Mn, Co, Fe, Ru) широко используются в искусственном фотосинтезе: каталитическом разложении воды на H2 – экологически чистое топливо и как реагент в химической промышленности, и O2 – для создания фотокаталитических преобразователей световой энергии в энергию химических топлив [1–6]. Наиболее распространенными и эффективными катализаторами являются многоядерные комплексы рутения [7–11]. Уникальность рутения связана с тем, что он имеет широкий спектр состояний окисления по сравнению с другими переходными металлами, поэтому в его присутствии можно осуществлять различные важные селективные реакции превращения субстрата в продукты. Каталитически активными формами катализаторов в окислении воды являются тетра- или октаядерные кластерные комплексы рутения, образованные из исходных (би-три и четырехъядерных соединений in situ [12, 13]). Известно, что на активность и стабильность катализаторов оказывает влияние не только природа переходного металла и его лигандное окружение, но и противокатионы, и кислотность среды. Электрохимическое поведение комплексов Ru(IV) вызывает большое внимание в некомплексообразующих средах, таких как HCl, HClO4, H2SO4. В работах по электрохимическому окислению солей калия хлоридов рутения(IV) K2[RuOCl5], K2[RuCl6] показано существование восстановленных интермедиатов [14–16], причем, как показало потенциометрическое титрование, частицы рутения восстанавливаются на половину эквивалента TiCl3 и являются, наиболее вероятно, димерами в растворе (как в твердой калиевой соли [17]).
В настоящей работе изучена редокс-реакция биядерного комплекса Li4Ru2OCl10 (Ru(IV)–Ru(IV)) с литиевыми противокатионами в растворах HCl различной концентрации электрохимическим и спектрофотометрическим методами с использованием циклической вольтамперометрии и спектрофотометрического титрования, а также реакция восстановления комплекса коордированными молекулами воды с образованием O2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклические вольтамперограммы (ЦВА) комплексов снимали на стеклоуглеродном электроде, d = 5 мм в термостатируемой (22°С) герметичной трехэлектродной ячейке в атмосфере азота. Вспомогательным электродом была Pt пластина (1 см2). Все потенциалы, приведенные в работе, определены относительно хлоридсеребряного электрода сравнения. Скорость изменения потенциала (v) варьировали в диапазоне от 5 до 167 мВ с–1. Диапазон развертки потенциала составлял 0…–1.0 В. ЦВА снимали на компьютеризированном потенциостате IPC-CompactP-8 (ООО “Эллинс”, Россия). Перед измерениями через раствор в течение 15 мин пропускали азот высокой чистоты. При проведении экспериментов объем рабочего раствора был равен 5 мл, а концентрация субстрата 0.5 × 10–3 М. Для исследуемого комплекса анодные токи пиков растут с увеличением скорости развертки потенциалов. Установлена линейная зависимость IA от v1/2. Зависимость lg IA от lg v1/2 также имеет линейный характер. Полученные данные указывают на протекание диффузионно-контролируемого процесса.
Спектрофотометрическое титрование проводили на спектрофотометре Specord M-40 (Carl Zeiss, Германия) с программным обеспечением. При спектрофотометрическом титровании определяли точку эквивалентности при добавлении разных количеств SnCl2 и измеряли плотность. Анализируемый раствор помещали в кювету, через которую проходил монохроматический поток света, попадающий затем на фотоэлемент, и затем приступали к титрованию. На основании результатов титрования строили кривую спектрофотометрического титрования, откладывая на оси ординат оптическую плотность (пропускание, %), а на оси абсцисс объем титранта (SnCl2, мл). Проводили измерения в нескольких точках, достаточно удаленных от точки эквивалентности, где реакция проходила количественно, и, проведя через них прямые, графически нашли точку эквивалентности. Поскольку реакция проходит количественно, кривая титрования имеет вид двух прямых, пересекающихся в точке эквивалентности.
Кинетику восстановления Ru(IV)–Ru(IV) изучали на спектрофотометре Specord M-40 (Carl Zeiss, Германия) с программным обеспечением на длине волны λ = 380 нм в кварцевой кювете с l = 1 см. Газообразные продукты реакции регистрировали на масс-спектрометре МИ-1201 (ООО “Селми”, Россия). Количество выделившегося кислорода рассчитывали по формуле для идеального газа μ = pV/RT моль. Для установления состава и строения образованного in situ тетраядерного катализатора окисления воды использовали метод ESI-масс-спектрометрии. Масс-спектр получен на жидкостном хромато-масс-спректрометре LCM-2020 (Shimadzu Corporation, Япония), оснащенном автодозатором SIL-20 AC. Водные растворы вводили в электроспрей-источник ионизации с использованием автодозатора со скоростью потока 20 мкл/мин. Объем вводимой пробы варьировали от 0.1 до 3 мкл. При приложении к капилляру напряжения (от 0.5 до 4.5 кВ) происходит тонкодисперсное распыление анализируемого раствора, конечной стадией которого является полевое испарение ионов, содержащихся в пробе. Часть этих ионов через вакуумный интерфейс поступает в масс-анализатор (измеряются m/z от 10 до 2000). Рассчитанный масс-спектр получен с использованием программы Molecular Weight Calculator for Windows in Version 6.49.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез литиевого биядерного комплекса рутения(IV) Li4Ru2OCl10 и РСА описаны в работе [18]. Биядерная структура комплекса сохраняется и в растворе, именно ее наличием объясняется прочность комплекса. Для подтверждения этого предположения мы сравнили ИК-спектры исходного комплекса и вещества, полученного выпариванием при комнатной температуре в роторном испарителе его раствора, выдержанного в течение двух суток. Сравнение частот колебаний показало, что νas(Ru–O–Ru) = 888 см–1, νs(Ru–O–Ru) = 240 см–1 и νконц(Ru–Oконц) = 1063 см–1 присутствуют в ИК-спектрах обоих веществ.
Реакция восстановления Ru(IV)–Ru(IV) → → Ru(III)–Ru(III) изучалась лишь в связи с установлением валентного состояния в соединении Li4Ru2OCl10.
Циклическая вольтамперометрия
На рис. 1 представлена ЦВА для свежеприготовленной 0.52 мМ димерной соли в 0.5 М HCl при скорости развертки потенциала 20 мВ/с. На 1-м цикле при развертке потенциала в катодную область наблюдается один пик восстановления Ек1 = 170 мВ (пик I). При обратном ходе в анодной области появляется только один пик реокисления (пик II) при ЕаII = 756 мВ. При дальнейшем циклировании в катодной области наряду с пиком I появляется широкий пик III в области 470 мВ, свидетельствующий, по-видимому, об образовании промежуточного смешанно-валентного интермедиата Ru(IV)–Ru(III). Пик III на катодной ветви растет со скоростью, сравнимой с ростом пика II. При этом потенциал пика II смещается на 24 мВ в анодную область. Это указывает, что окисляемые соединения претерпевают некоторые изменения, затрудняющие их реокисление. Ток пика I уменьшается в последующих циклах до достижения стационарного состояния. Заряд, используемый при восстановлении соли практически равен заряду при реокислении.
Спектрофотометрическое титрование
При подробном исследовании реакции восстановления Ru(IV)–Ru(IV) методом спектрофотометрического титрования SnCl2 было установлено, что при концентрации 0.5 М HCl восстановление протекает, действительно, через довольно устойчивую промежуточную стадию – комплексное соединение, в состав которого входит Ru(IV) и Ru(III). На кривых спектрофотометрического титрования (рис. 2) наблюдалось резкое изменение характера светопоглощения в точке, соответствующей 1/2 эквивалента SnCl2, что указывает также на образование промежуточного комплекса при этом соотношение Ru(IV) : Ru(III) = 1 : 1.
Влияние концентрации HCl на устойчивость промежуточного соединения
Концентрация водородных ионов существенно влияет на устойчивость промежуточного соединения Ru(IV)–Ru(III). На рис. 3 показана зависимость оптической плотности раствора интермедиата от концентрации HCl. Измерение оптической плотности проводили на длинах волн, соответствующих двум максимумам на кривой поглощения (λ = 380 и 505 нм). Наибольшая оптическая плотность наблюдается в 0.3 М HCl.
Рис. 3.
Зависимость оптической плотности промежуточного соединения Ru(IV)–Ru(III) (3.79 × 10–5 М) от концентрации HCl: 1 – λ = 380 нм, 2 – λ = 505 нм.
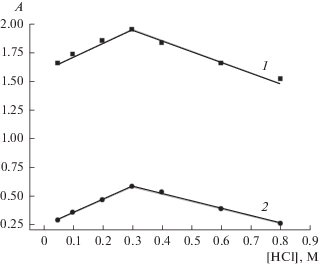
Сопоставление спектров поглощения комплекса в 0.3 и 2 М растворах HCl показало, что в последнем случае характерный пик промежуточного соединения с максимумом при λ = 505 нм исчезает.
Таким образом, на основании полученных экспериментальных данных методом ЦВА, спектрофотометрического титрования можно представить механизм восстановления Li4Ru2OCl10 в 0.5 М HCl в виде следующей схемы:
(1)
$\begin{gathered} {{\left[ {{{{\left( {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{5}}} \right)}}_{2}}{\text{O}}} \right]}^{{4 - }}}\xrightarrow{{1{\bar {e}}}} \\ \to {{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{5}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{Ru}}\left( {{\text{III}}} \right){\text{C}}{{{\text{l}}}_{5}}} \right]}^{{5 - }}}, \\ \end{gathered} $(2)
$\begin{gathered} {{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{5}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{Ru}}\left( {{\text{III}}} \right){\text{C}}{{{\text{l}}}_{5}}} \right]}^{{5 - }}} + {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }} \to \\ \to {{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{5}}{\text{OH}}} \right]}^{{2 - }}} + {{\left[ {{\text{Ru}}\left( {{\text{III}}} \right){\text{C}}{{{\text{l}}}_{5}}} \right]}^{{2 - }}}, \\ \end{gathered} $(3)
$\begin{gathered} {{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{5}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{Ru}}\left( {{\text{III}}} \right){\text{C}}{{{\text{l}}}_{5}}} \right]}^{{5 - }}} \to \\ \to {{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{x}}{\text{O}}{{{\text{H}}}_{{5 - x}}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{Ru}}\left( {{\text{III}}} \right){\text{C}}{{{\text{l}}}_{x}}{\text{O}}{{{\text{H}}}_{{5 - x}}}} \right]}^{{5 - }}}{\text{,}} \\ \end{gathered} $(4)
$\begin{gathered} {{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\text{C}}{{{\text{l}}}_{5}}{\text{O}}{{{\text{H}}}_{{5 - x}}}} \right]}^{{2 - }}}\xrightarrow{{ + 1{\bar {e}}}} \\ \to {{\left[ {{\text{Ru}}\left( {{\text{III}}} \right){\text{C}}{{{\text{l}}}_{x}}{\text{O}}{{{\text{H}}}_{{5 - x}}}} \right]}^{{3 - }}}. \\ \end{gathered} $Первый перенос электрона включает одноэлектронный процесс на димерную молекулу и он необратим (1). Восстановленная частица – смешанновалентный интермедиат взаимодействует с протонами в слабокислом растворе HCl и распадается с образованием двух мономерных частиц, одна из которых Ru(III) – электронно неактивна, а другая, Ru(IV) – восстанавливается при всех потенциалах, при которых восстанавливается исходный димерный комплекс (2). В разбавленных растворах HCl смешанновалентные частицы участвуют в быстрых обменах лигандов, что затрудняет их более обратимое реокисление (3). Ru(IV) мономер восстанавливается обратимо в Ru(III) мономер (4).
При повышении концентрации HCl до 2.0 М и выше картина меняется. Из ЦВА, снятых во времени (рис. 4), видно, что при втором и третьем циклировании в катодную область пик III при Ek = 470 мВ, характерный для промежуточного комплекса Ru(IV)–Ru(III) (см. рис. 1), исчезает, но спустя ~20 ч при следующем циклировании появляется более широкий пик восстановления, который смещается от 200 до 340 мВ в анодную область. По-видимому, это связано с обменом лигандов (замещение хлора в исходном комплексе Ru(IV)–Ru(IV) на H2O и OH–), что приводит к соединениям, которые более легко и обратимо восстанавливаются по сравнению с исходным комплексом.
Рис. 4.
Изменения ЦВА 0.52 мМ комплекса Li4Ru2OCl10 в 2.0 М HCl в зависимости от времени: 1 – исходная, 2 – через 1 ч 40 мин, 3 – 2 ч 40 мин, 4 – 19 ч 40 мин, v = 20 мВ/с.
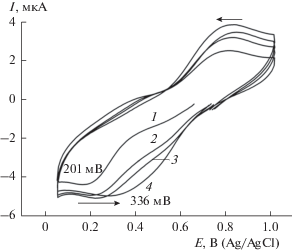
На ЦВА для свежеприготовленной 0.55 мМ димерной соли в 3 М HCl при скорости развертки потенциала 167 мВ/с наблюдается пик в катодной области при Ек = 336 мВ и в анодной один пик при 495 мВ (рис. 5).
Рис. 5.
ЦВА 0.55 мМ комплекса Li4Ru2OCl10 в 3 М HCl, скорость сканирования потенциала v = 167 мВ с–1.

При уменьшении скорости сканирования потенциала до 5 мВ/с (рис. 6) наблюдается сдвиг потенциала восстановления в анодную область от 336 до 394 мВ, при этом реокисление происходит при меньшем потенциале: 495 мВ при v = 167 мВ/с и 453 мВ при v = 5 мВ/с. На ЦВА комплекса, снятого при v = 5 мВ/с, разница в потенциалах окисления и восстановления (Еа – Ек = 59 мВ) соответствует одноэлектронному обратимому процессу.
Кинетика самовосстановления Li4Ru2OCl10 в 3 М HCl
Для лучшего понимания механизма каталитического окисления воды соединениями Ce(IV) или квантом света предварительно была изучена реакция восстановления комплекса координированной водой с образованием О2 в отсутствие экзогенного окислителя.
Кинетику восстановления Ru(IV)–Ru(IV) изучали спектрофотометрически. В кислом растворе при комнатной температуре комплекс Ru(IV)–Ru(IV) медленно восстанавливается в Ru(III)–Ru(III). При повышении температуры скорость восстановления возрастает. На рис. 7 приведена кинетика восстановления Ru(IV)–Ru(IV) в 3 М растворе HCl при 80°С. Кинетика исчезновения Ru(IV)–Ru(IV) описывается законом бимолекулярной реакции (рис. 7 – кривая 1, кружочки). Таким образом, для осуществления реакции восстановления необходимо участие двух комплексов Ru(IV)–Ru(IV).
Рис. 7.
Кинетика самовосстановления Li4Ru2OCl10 в 3 М HCl при 80°С. Обозначения: ⚪ – экспериментальная кривая, 1 – рассчитанная кривая, 2, ⚫ – линейная анаморфоза экспериментальной кривой. Условия: [Li4Ru2OCl10] = 4.43 × 10–4 М.
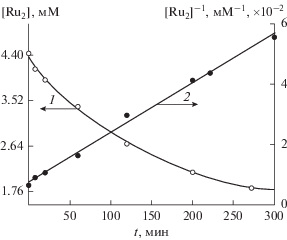
Из линейной анаморфозы 2 кинетической кривой 1 в соответствующих координатах определенна константа скорости реакции второго порядка κ2 = 0.22 M–1 мин–1. Подставив это значение в дифференциальное уравнение второго порядка $\frac{{ - {\text{d}}\left[ {{\text{R}}{{{\text{u}}}_{2}}} \right]}}{{{\text{d}}t}} = {{K}_{2}}{{\left[ {{\text{R}}{{{\text{u}}}_{2}}} \right]}^{2}},$ получаем рассчитанное кинетическое уравнение реакции (сплошная кривая 1 на рис. 7), которая хорошо согласуется с экспериментальной кривой 1 (кружочки). Из рис. 7 видно, что бимолекулярная реакция идет, как минимум, до 80% превращения.
Биядерные комплексы Ru(IV)–Ru(IV) самоорганизуются in situ в тетраядерный катализатор, окисляющий воду четырехэлектронно до молекулы О2. Процесс самовосстановления биядерного оксохлоридного комплекса в 3 М HCl можно представить следующим уравнением:
(5)
$\begin{gathered} 2{{\left[ {{\text{Ru}}\left( {{\text{IV}}} \right){\kern 1pt} - {\kern 1pt} {\text{Ru}}\left( {{\text{IV}}} \right)} \right]}^{{2 + }}} + 2{{{\text{H}}}_{2}}{\text{O}} = \\ = 2\left[ {{\text{Ru}}\left( {{\text{III}}} \right){\kern 1pt} - {\kern 1pt} {\text{Ru}}\left( {{\text{III}}} \right)} \right] + {{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }}. \\ \end{gathered} $Масс-спектрометрический анализ газовой фазы показывает, что единственным продуктом реакции является О2. Образование тетраядерного рутениевого комплекса было подтверждено методом ESI-масс-спектрометрии (рис. 8). Так в масс-спектре раствора в изотопном распределении присутствует максимальный пик m/z = 553.29, соответствующий тетрамерному комплексу рутения 2H2O ⋅ Ru4O6(OH)]3+ (рис. 8б) который согласуется с рассчитанным масс-спектром (m/z = 553.31) (рис. 8а). В этом тетрамере степень окисления рутения меняется только на единицу. В соответствии с уравнением (5) в координационной сфере этого тетрамера из двух молекул воды образуется одна молекула кислорода.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проведенных исследований установлено, что электрохимическое восстановление/окисление, а также спектрофотометрическое титрование комплекса в слабокислых средах (0.2–0.8 М HCl) приводит к образованию промежуточного смешанно-валентного интермедиата Ru(IV)–Ru(III) при этом соотношение Ru(IV) : Ru(III) = 1 : 1. Показано, что максимальная устойчивость промежуточного соединения наблюдается в 0.3 М HCl. Повышение концентрации HCl до 2.0 М и более исключает его образование. Восстановление комплекса координированными молекулами воды в 3 М HCl приводит к образованию активированного тетраядерного катализатора, способного окислить воду четырехэлектронно с образованием молекулы О2.
Состав тетраядерного комплекса, определенный методом ESI, согласуется с кинетическими данными.
Список литературы
Karkas, M.D., Verho, O., Johnston, E.V., and Akermark, B., Artificial photosynthesis: molecular systems for catalytic water oxidation, Chem. Rev., 2014, vol. 114, p. 11863.
Джабиев, Т.С., Шилов, А.Е. Биохимическая утилизация солнечной энергии, Успехи химии. 2012. Т. 31. № 12. С. 1146. [Dzhabiev T.S. and Shilov A.E., Biomimetic utilization of solar energy, Russ. Chem. Rev., 2012, vol. 81, no. 12, p. 1146.]
Sartorel, A., Bonchio, M., Campagna, S., and Scandola F., Tetrametallic molecular catalysts for photochemical water oxidation, Chem. Soc. Rev., 2013, vol. 42, p. 2262.
Keita, B., Mbomekalle, I.M., Nadjo, L., Anderson, T.M., and Hill, C.L., Multi-iron Wells-Dawson heteropolytungstates. Electrochemical probing of siderophoric behavior in sandwich-type complexes, Inorg. Chem., 2004, vol. 43, no. 10, p. 3257. https://doi.org/10.1021/ic035495i
Джабиев, Т.С., Денисов, Н.Н., Моисееев, Д.И., Шилов, А.Е. Многоэлектронное окисление воды в химической модели активного центра фотосистемы-2 природного фотосинтеза, Докл. АН. 2004. Т. 396. № 2. С. 263. [Dzhabiev, T.S., Denisov, N.N., Moiseev, D.N., and Shilov, A.E., Multielectron water oxidation in a chemical model of the active center of the photosystem II of natural photosynthesis, Dokl. Biochem. Biophys., 2004, vol. 396, no. 1-6, p. 151.]
Джабиев, Т.С., Куркина, Г.А., Шилов, А.Е. Концертное окисление воды кластерами кобальта(III). Альтернат. энергетика и экология. 2007. Т. 48. № 4. С. 77. [Dzhabiev T.S., Kurkina G.A., and Shilov A.E., Concert water oxidation by cobalt(III) clusters, Al’ternat. Energetika i Ekologiya (in Russian), 2007, no. 4 (48), p. 77.]
Geletii, Y.V., Botar, B., Koegerler, P., Hillesheim, D.A., Musaev, D.G., and Hill, C.L., An all – inorganic, stable and highly active tetra-ruthenium homogeneous catalyst for water oxidation, Angew. Chem. Int. Ed., 2008, vol. 47, p. 3896.
Hurst, I.K., Water oxidation catalyzed by dimeric µ-oxo bridged ruthenium dimine complexes, Coord. Chem. Rev., 2005, vol. 249, p. 313.
Джабиева, З.М., Якуткина, О.В., Джабиев, Т.С., Шилов, А.Е. Кинетика окисления воды соединениями церия(IV), катализированного четырехъядерным комплексом рутения. Кинетика и катализ. 2014. Т. 55. № 4. С. 444. [Dzhabieva, Z.M., Yakutkina, O.V., Dzhabiev, T.S., and Shilov A.E., Kinetics of water oxidation with cerium(IV) compounds catalyzed by a tetranuclear ruthenium complex, Kinetics and catalysis, 2014, vol. 55, no. 4, p. 422. https://doi.org/10.1134/S002315841404003X]
Binstead, R.A., Chromister, C.W., and Meyer T.J., Mechanism of water oxidation by the µ-oxo-dimer [(bpy)2(H2O)RuIIIORuIII(OH2)(bpy)2]4+, J. Am. Chem. Soc., 2000, vol. 122, no. 35, p. 8464.
Liu, F., Cardolaccia, T., and Hornstein, B.J., Electrochemical oxidation of water by an adsorbed µ-oxo-bridged Ru complex, J. Am. Chem. Soc., 2007, vol. 129, no. 9, p. 2446.
Джабиева, З.М., Мартыненко, В.М., Темнова, М.Л. Якуткина, О.В., Джабиев, Т.С., Шилов, А.Е. Хромато-масс-спектрометрическое изучение рутениевых катализаторов окисления воды в искусственном фотосинтезе. Журн. физ. химии. 2014. Т. 88. № 5. С. 772. [Dzhabieva, Z.M., Martynenko, V.M., Temnova, M.L., Yakutkina, O.V., Dzhabiev, T.S., and Shilov, A.E., LC-MS study of ruthenium catalysts of water oxidation in artificial photosynthesis., Russ. J. Phys. Chem. A, 2014, vol. 88, no. 5, p. 765. https://doi.org/10.1134/S0036024414050069]
Джабиева, З.М., Авдиенко, О.Р., Ткаченко, В.Ю., Джабиев, Т.С. Концертное окисление воды в тетраядерный и октаядерный кластеры рутения(IV). Журн. физ. химии. 2015. Т. 89. № 10. С. 1777. [Dzhabieva, Z.M., Avdienko, O.P., Tkachenko, V.Yu., and Dzhabiev, T.S., Concerted water oxidation by tetranuclear and octanuclear ruthenium (IV) clasters, Russ. J. Phys. Chem. A, 2015, vol. 89, no. 10, p. 1777.]
Wallace, R.M. and Propst R.C., Studies of ruthenium(IV) and it`s reduction products in perchlorate solutions, J. Am. Chem. Soc., 1969, vol. 91, p. 3779.
Пшеницын, Н.К., Езерская, Н.А. Полярографическое изучение восстановления и окисления комплексных хлоридов рутения на платиновом электроде. Журн. неорган. химии. 1960. Т. 5. № 5. С. 1068. [Pshenizin, N.K. and Ezerskaj, H.A., Polarographic study of reduction and oxidation of complex ruthenium chlorides on platinum electrode, Russ. J. Inorg. Chem., 1960, vol. 5, no. 6, p. 1068.]
Пшеницын, Н.К., Езерская, Н.А. Синтез и полярографическое исследование комплексных хлоридов рутения. Журн. неорган. химии. 1961. Т. 6. № 3. С. 613. [Pshenizin, N.K. and Ezerskaj, H.A., Synthesis and polarographic study of complex ruthenium chlorides, Russ. J. Inorg. Chem., 1961, vol. 6, no. 3, p. 613.]
Mathieson and Mellor D., The crystal structure of potassium hydroxy-chlororuthenate, K4Ru2OCl10 ⋅ H2O, Acta Crystallogr., 1952, vol. 5, p. 185.
Джабиева, З.М., Шилов, Г.В., Ткаченко В.Ю., Ткаченко, В.Ю., Авдеева Л.В., Джабиев, Т.С. Синтез, структурная организация и каталитические свойства в реакции окисления воды кластерного комплекса рутения(IV) Li8Ru2OCl14. Журн. неорган. химии. 2016. Т. 61. № 6. С. 724. [Dzhabieva, Z.M., Shilov, G.V., Tkachenko, V.Yu., Avdeeva, L.V., and Dzhabiev, T.S., Synthesis and structural organization of ruthenium (IV) cluster Li8Ru2Ocl14 and it`s catalytic properties in the water oxidation reaction, Russ. J. Inorg. Chem., 2016, vol. 61, no. 6, p. 688].https://doi.org/10.1134/S003602361606005X
Дополнительные материалы отсутствуют.






