Электрохимия, 2020, T. 56, № 7, стр. 604-618
Исследование образования продуктов присоединения рифампицина к мягким нуклеофилам цистеину и глутатиону методами вольтамперометрии, ИК-спектроскопии с преобразованием Фурье и термического анализа
a Университет Ондокуз Майис
55139 Атакум-самсун, Турция
* E-mail: ebicer@omu.edu.tr
Поступила в редакцию 08.07.2019
После доработки 14.10.2019
Принята к публикации 10.12.2019
Аннотация
Равновесия образования продуктов присоединения рифампицина к цистеину и глутатиону при различных pH исследованы методами циклической и квадратно-волновой вольтамперометрии. С ростом концентрации рифампицина резко снижаются токи восстановления тиолатов ртути(I) [Hg2(RS)2] – основных продуктов восстановления цистеина и глутатиона на Hg-электроде, а потенциалы их восстановления сдвигаются в сторону менее отрицательных значений благодаря межмолекулярному взаимодействию. В то же время вольтамперометрические сигналы (и прежде всего значения Epa и Epc обратимого окислительно-восстановительного процесса с участием α-гидроюглонового остатка) рифампицина в присутствии цистеина или глутатиона сдвигаются в сторону положительных значений. Предложен правдоподобный механизм, объясняющий образование продуктов присоединения (аддуктов) в данном процессе взаимодействия. Именно, цистеин и глутатион ведут себя, как нуклеофилы, и участвуют в реакции присоединения с рифампицином. Это образование продуктов присоединения подтверждено также методом ИК-спектроскопии с преобразованием Фурье и может быть прослежено через исчезновение полосы валентных колебаний свободной тиольной группы. Стехиометрическое отношение для этой реакции составляет 1 : 1; оценка констант связывания была проведена на основе экспериментальных данных квадратно-волновой вольтамперометрии. Влияние величины pH на константы связывания исследовано при варьировании pH (4.5, 7.4, 9.0). Показано, что на данную реакцию оказывает сильное влияние величина pH. Эта реакция нуклеофильного присоединения наиболее эффективна при pH 9. Константа реакции присоединения глутатиона выше, чем константа реакции присоединения цистеина, при всех изученных значениях pH. Термическое поведение этих продуктов присоединения охарактеризовано методом термического анализа (термогравиметрический анализ/дифференциальный термогравиметрический анализ/дифференциальный термический анализ). Термограммы, записанные для продуктов присоединения, не накладываются на термические кривые исходных материалов, и такое поведение можно рассматривать как дополнительное подтверждение образования аддуктов.
ВВЕДЕНИЕ
Глутатион (γ-глутамил цистеинил глицин), обычно обозначаемый как GSH (схема 1 ) – трипептид, присутствующий почти во всех эукариотических и прокариотических клетках [1]. Глутатион связывается с электрофильными [1–3], эндогенными и экзогенными химическими реактивами [1, 3–5], благодаря имеющемуся в нем цистеиновому остатку. Этот остаток также отвечает за такие свойства, как устойчивость против окислительного разрушения, сохранение структуры белка и обезвреживание токсичных реактивов [1, 6].
Схема 1 . Молекулярное строение глутатиона.
Цистеин (CySH, схема 2 ) – это тиолсодержащая аминокислота, которая играет существенную роль в антиоксидантной защите и клеточном метаболизме [7–9]. Известно, что изменения в уровне цистеина биологически важны, так как могут служить указанием на ряд болезней [7–9]. Более того, для поддержания здоровья важна способность цистеина и глутатиона захватывать свободные радикалы [8, 9].
Схема 2 . Молекулярное строение цистеина.
Рифампицин (RIF, схема 3 ) – это лекарство, которое используется главным образом при лечении туберкулеза [10, 11]. Взаимодействия между лекарствами очень важны для биологических процессов [12]. В то же время эти взаимодействия отражают действие лекарства на организм [12]. Поэтому изучение взаимодействий между лекарствами привлекает внимание в связи с выявлением механизма физиологического воздействия лекарств. О трансмембранных белках известно, что это молекулы-рецепторы для лекарств [12]. Однако, изучать взаимодействия белок–лекарство затруднительно из-за сложного строения молекул белков [12]. Поэтому во многих исследованиях часто используют аминокислоты или небольшие белки в качестве модельных соединений белков для более полного понимания взаимодействий белок–лекарство [12–15].
Схема 3 . Молекулярное строение рифампицина.
Хотя в литературе были опубликованы результаты ряда исследований взаимодействия рифампицина с бовином [16–19] и сывороточным альбумином человека [20–23], с аминокислотными остатками фермента РНК полимераза [24], рецептора Pregnane X (PXR) [25] и основой белка изоцитрат-лиаза [26], но до сих пор не было сделано попыток исследовать его взаимодействие с тиолированными аминокислотами, цистеином или трипептидом, глутатионом. Для исследования взаимодействий тиольных соединений были с успехом применены электрохимические методы [27–32]. В настоящей работе вольтамперометрическими методами впервые исследован механизм реакций связывания при взаимодействии рифампицина с цистеином или глутатионом. Главная цель настоящей работы – определить стехиометрические коэффициенты, константы связывания и процесс взаимодействия рифампицина с этими тиольными соединениями. Рифампицин в настоящей работе был использован в качестве биомаркера при идентифицировании тиольных соединений. Полученные результаты могут дать вклад в развитие новых датчиков и механизмов воздействия лекарств в клинических и молекулярных биологических исследованиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и растворы
L-глутатион получен от фирмы Sigma. L-цистеин был приобретен у компании Merck. Рифампицин был приобретен у компании Fluka. Исходный раствор рифампицина готовили, растворяя необходимое количество в этаноле. Другие исходные растворы готовили на особо чистой воде (удельная электропроводность: 18.2 MΩ cм). Однако, для солюбилизации нужного количества рифампицина в воде потребовалось добавить несколько капель раствора NaOH. Буферный раствор Бриттона–Робинсона получали, растворяя необходимые количества H3BO3, CH3COOH и H3PO4 в особо чистой воде и устанавливая нужное значение pH с помощью 0.2 M раствора NaOH.
Оборудование
В электрохимических экспериментах использовали полярографический анализатор EG&G PAR 384B в комбинации с ячейкой PARC 303A SMDE. Вольтамперометрическая ячейка имела три электрода: ртутный электрод в виде висящей капли (рабочий электрод), электрод сравнения Ag | AgCl | KClнасыщ и платиновый противоэлектрод. Электрохимические эксперименты проводили с использованием программного пакета ECDSOFT [33], установленного на ноутбук, управлявший полярографическим анализатором. Значение pH буферного раствора измеряли рН‑метром Jenway 3010, укомплектрованным стеклянным электродом.
ИК-спектры с преобразованием Фурье образцов снимали на рамановcком модульном спектрометре Thermo Scientific Nicolet 6700/NXR FT. Измерения охватывали интервал волновых чисел от 4000 до 400 cм–1.
Термоаналитические измерения (динамики потери массы (TGA) при нагревании, изменения температуры в зоне реакции (DTA) и скорости разложения образца (DrTGA) в единицу времени) проводили на анализаторе Shimadzu DTG-60 Simultaneous TG–DTA. Образцы нагревали в области температур 24–700°C со скоростью 10°C мин–1. Измерения вели в подвижной атмосфере с расходом газа 40 мл мин–1, используя приблизительно 5 мг образца, который взвешивали в открытом платиновом тигле.
Методика
Вначале записывали вольтамперограммы цистеина, глутатиона и рифампицина в буферных растворах Бриттона–Робинсона. Затем получали вольтамперограммы цистеина или глутатиона при возрастающей концентрации рифампицина. Перед снятием вольтамперограмм растворы освобождали от растворенного воздуха (в течение приблизительно 5 мин), пропуская через них газ N2 (который во время измерений пропускали над поверхностью раствора). Если не указано иное, использовали следующие условия: при циклической вольтамперометрии – скорость развертки потенциала 500 мВ/с, при квадратно-волновой вольтамперометрии – высота импульса 25 мВ, частота 100 Гц, время установления равновесия 5 с, средний размер ртутной капли, шаг развертки 4 мВ. Вольтамперометрические измерения выполнялись при комнатной температуре. Константы образования продуктов присоединения цистеин–рифампицин или глутатион–рифампицин вычисляли по снижению высоты главного пика тока цистеина или глутатиона с ростом концентрации рифампицина.
Синтез продуктов присоединения
Горячий раствор рифампицина (1 ммоль, 0.823 г) в этаноле (25 мл) медленно, по каплям добавляли к раствору цистеина (1 ммоль, 0.121 г) или глутатиона (1 ммоль, 0.307 г) в воде (25 мл). Смесь нагревали в стеклянном стакане при непрерывном помешивании до тех пор, пока раствор не выпарился наполовину. После этого раствор охлаждали до комнатной температуры и ждали, пока не получался твердый продукт. Полученный продукт присоединения отфильтровывали и сушили на воздухе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вольтамперометрия
На рис. 1 приведены циклические вольтамперограммы рифампицина, снятые при pH 4.5, 7.4 и 9.0. Из рис. 1 видно, что необратимые пики тока при относительно отрицательных потенциалах и обратимый пик при менее отрицательном потенциале (близком к 0 В) относятся к электродной реакции с участием рифампицина. Полярографическое и вольтамперометрическое поведение рифампицина на ртутном электроде уже изучалось ранее рядом авторов [34–37].
Рис. 1.
Циклические вольтамперограммы 4.98 × 10–6 M раствора рифампицина при pH 4.5 (сплошные линии), 7.4 (точечные линии) и 9.0 (пунктир). 1U: пик восстановления остатка юглона до гидроюглона; 2U и 3U: пики необратимого восстановления различных карбонильных групп.

Необратимые пики тока (рис. 1, 2U и 3U) можно приписать восстановлению различных карбонильных групп [бетенолид (фуранон) и амид] [34, 35, 38, 39]. В предшествующей работе [35] утверждалось, что на квадратно-волновой вольтамперограмме рифампицина, снятой в буферном растворе Бриттона–Робинсона (pH 7.0), имеется два пика тока при –0.674 и –1.354 В, относящихся, соответственно, к восстановлению азометина и карбонильных групп. Однако, как видно из циклических вольтамперограмм рифампицина (рис. 1), исчезновение небольшого пика тока восстановления иминной группы при –0.674 В можно объяснить на основе таутометрического равновесия энолимин–кетоэнамин (рис. 2) [40]. Также сообщалось, что кетоэнамин – преобладающее вещество в воде [41]. С другой стороны, циклическая вольтамперометрия – менее чувствительный метод, чем квадратно-волновая вольтамперометрия [42–44]. Поэтому на циклических вольтамперограммах пик тока восстановления иминной группы может и не проявляться достаточно ясно.
Рис. 2.
Таутомерные формы рифампицина и окислительно-восстановительный процесс с участием его α-гидроюглонового остатка.

Рис. 3.
(a) Циклические вольтамперограммы 4.98 × × 10–6 M раствора цистеина при pH 4.5 (сплошные линии), 4.98 × 10–6 M раствора цистеина при pH 7.4 (точечные линии) и 1.96 × 10–5 M раствора цистеина при pH 9.0 (пунктир). (б) Циклические вольтамперограммы 4.98 × 10–6 M раствора глутатиона при pH 4.5 (сплошные линии), 9.90 × 10–6 M раствора глутатиона при pH 7.4 (точечные линии) и 1.48 × 10–5 M раствора глутатиона при pH 9.0 (пунктир). 1U: восстановление тиолата ртути(II) до тиолата ртути(I); 2U: восстановление тиолата ртути(I) до металлической ртути и тиола.

Разность потенциалов (ΔEp = Epa– Epc) анодного и катодного обратимых пиков тока рифампицина (рис. 1, 1U) составляет около 34 мВ, что близко к теоретическому значению (около 30 мВ) для двухэлектронной обратимой волны. С другой стороны, в опубликованных работах [34–37] обратимый пик тока не был обнаружен. Однако, этот обратимый двухэлектронный процесс можно приписать окислению α-гидроюглонного остатка до юглона (рис. 2) [45–51].
Циклические вольтамперограммы цистеина и глутатиона, записанные при различных значениях pH, представлены на рис. 3. Обычно на этих циклических вольтамперограммах имеется только один пик тока, но в некоторых случаях (высокая концентрация или высокая скорость развертки потенциала) при более положительных потенциалах наряду с основным пиком (2U) может появляться второстепенный пик (1U). При низких концентрациях тиола этот второстепенный пик едва заметен [52, 53]. В литературе имеются многочисленные статьи об электрохимическом поведении цистеина и глутатиона [42–45]. Таким образом, эти окислительно-восстановительные пики можно приписать образованию и восстановлению тиолатов ртути(I) и (II) [52–55]. Это образование тиолатов ртути(I) и (II) в результате анодных реакций можно представить следующим образом [52–55]:
(2)
${\text{Hg}}_{{\text{2}}}^{{{\text{2}} + }} + {\text{2RSH}} \rightleftarrows {\text{H}}{{{\text{g}}}_{{\text{2}}}}{{\left( {{\text{SR}}} \right)}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{ + }},$(3)
${\text{H}}{{{\text{g}}}_{{\text{2}}}}{{\left( {{\text{SR}}} \right)}_{{\text{2}}}} + {\text{2RSH}} \rightleftarrows {\text{2Hg}}{{\left( {{\text{SR}}} \right)}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{ + }} + {\text{2e}}.$Для того, чтобы проследить взаимодействие рифампицина с цистеином и глутатионом, был выбран пик тока восстановления тиолата ртути(I) потому, что это основной сигнал. После добавления рифампицина к растворам тиола потенциал пика тиолата ртути(I) сдвигается в сторону положительных значений, а ток в пике снижается (рис. 4 и 5).
Рис. 4.
Квадратно-волновые вольтамперограммы (a) 4.98 × 10–6 M раствора цистеина в присутствии a – 0, б – 4.95 × 10–6, в – 9.85 × 10–6, г – 1.47 × 10–5, д – 1.95 × 10–5, е – 2.43 × 10–5, ж – 2.89 × 10–5, з – 3.82 × × 10–5 M рифампицина при pH 4.5; (б) 4.98 × 10–6 M цистеина в присутствии a – 0, б – 4.95 × 10–6, в – 9.85 × 10–6, г – 1.47 × 10–5, д – 1.95 × 10–5, е – 2.43 × × 10–5 M рифампицина при pH 7.4; (в) 1.96 × 10–5 M цистеина в присутствии a – 0, б – 4.88 × 10–6, в – 9.71 × 10–6, г – 1.45 × 10–5, д – 1.92 × 10–5, е – 2.39 × × 10–5 M рифампицина при pH 9.0.

Рис. 5.
Квадратно-волновые вольтамперограммы (a) 4.98 × 10–6 M раствора глутатиона в присутствии a – 0, б – 4.74 × 10–6, в – 9.05 × 10–6, г – 1.30 × 10–5, д – 1.66 × 10–5, е – 1.83 × 10–5, ж – 1.99 × 10–5 M рифампицина при pH 4.5; (б) 9.90 × 10–6 M раствора глутатиона в присутствии a – 0, б – 2.42 × 10–6, в – 4.72 × 10–6, г – 6.91 × 10–6, д – 9.01 × 10–6, е – 1.10 × × 10–5, ж – 1.29 × 10–5 M рифампицина при pH 7.4; (в) 1.48 × 10–5 M раствора глутатиона в присутствии a – 0, б – 4.69 × 10–6, в – 6.88 × 10–6, г – 8.97 × 10–6, д – 1.10 × 10–5, е – 1.29 × 10–5 M рифампицина при pH 9.0.

Хорошо известно, что добавленное вещество, способное к адсорбции, обычно играет роль ингибитора по отношению к электродной реакции и сдвигает процесс восстановления к отрицательным потенциалам [56, 57]. Однако как “положительный” сдвиг потенциала восстановления тиолата ртути(I), так и уменьшение пикового тока его восстановления в присутствии рифампицина имеют источником равновесие, установившееся вблизи Hg-электрода, а именно:
(4)
$\begin{gathered} {\text{H}}{{{\text{g}}}_{{\text{2}}}}{{\left( {{\text{SR}}} \right)}_{{\text{2}}}} + {\text{рифампицин}}\,\,{\text{(форма нафтогидрохинона)}} \rightleftarrows \\ \rightleftarrows {\text{Hg}}_{{\text{2}}}^{{{\text{2}} + }} + {\text{RSH - рифампицин,}} \\ \end{gathered} $где RSH-рифампицин является аддуктом – продуктом присоединения. Количество тиолатов ртути, электрохимически генерируемых в процессе в присутствии цистеина, зависит от концентрации свободного цистеина в среде (см. уравнения (2) и (3)). С другой стороны, при постепенном увеличении концентрации рифампицина в присутствии тиолов катодный пик тока тиолата ртути(I) уменьшается благодаря образованию аддукта (уравнение (4)). Другими словами, связывание тиолов с рифампицином понижает концентрацию свободного цистеина.
С другой стороны, присоединение тиолов к рифампицину облегчает восстановление электроактивных групп на молекуле рифампицина, но затрудняет окисление гидроюглоновой группы. Быстрая необратимая химическая реакция, следующая за обратимой электродной реакцией, позволяет сдвинуть электровосстановление к положительным потенциалам [56, 57]. Для очень быстрых последующих реакций потенциал пика тока может сдвинуться даже на 120 мВ при постоянной скорости развертки потенциала [56, 57]. К тому же образование аддукта между рифампицином и тиолами приводит к уменьшению концентрации свободных тиолов в реакционной среде. Это приводит к снижению пикового тока. Для аддукта можно предположить, на основе других реакций присоединения тиолов, существование в двух формах (схема 4 ) [58, 59]:
Схема 4 . Предлагаемое строение аддукта (цистеин–рифампицин).
ИК-спектроскопический анализ
Образование аддуктов между рассматриваемыми в настоящей работе тиольными соединениями и рифампицином подтверждается ИК-спектроскопическим анализом с преобразованием Фурье. На рис. 6 приведены ИК-спектры с преобразованием Фурье аддуктов и исходных соединений. Как видно из рис. 6, при 2550 и 2522 cм–1 наблюдаются характерные пики –SH-валентных колебаний, соответственно, цистеина и глутатиона [60–62].
Рис. 6.
(a) ИК-спектры с преобразованием Фурье цистеина (пунктир), рифампицина (точечные линии) и аддукта CySH–рифампицин (сплошные линии). (б) ИК-спектры с преобразованием Фурье глутатиона (пунктир), рифампицина (точечные линии) и аддукта глутатион–рифампицин (сплошные линии).

При сравнении ИК-спектров с преобразованием Фурье аддуктов со спектрами цистеина и глутатиона мы видим полное исчезновение валентных колебаний S–H-групп (рис. 6). Эту ситуацию можно объяснить расщеплением связей S‒H при нуклеофильном замещении тиольных групп рифампицином, что подтверждает образование аддуктов [63, 64].
Более того, в спектрах аддуктов исчезают цвиттерионные N–H-валентные колебания цистеина и глутатиона при 2075 cм–1 (рис. 6). Это наблюдение можно объяснить превращением $--{\text{NH}}_{3}^{ + }$-остатка тиольных соединений в –NH2-остаток в аддуктах [63].
Термический анализ
На рис. 7 и 8 даны термограммы цистеина, глутатиона, рифампицина, рифампицин–цистеина и рифампицин–глутатиона. Кривые термогравиметрического анализа L-CysH (рис. 7) представляют термическое разрушение, происходящее в две стадии, включающее общую потерю массы 97.3% в температурном интервале 177.6–663.4°C. Главный процесс термического разрушения отмечен в интервале температур 177.6–420.3°C с потерей массы 87.8% (табл. 1). Эндотермический пик при 230°C соответствует плавлению цистеина [61, 65–67].
Рис. 7.
Кривые дифференциального термического анализа (DTA) (1), термогравиметрического анализа (TGA) (2) и дифференциального термогравиметрического анализа (DrTGA) (3) (a) цистеина, (б) глутатиона, (в) рифампицина.

Рис. 8.
Кривые дифференциального термического анализа (DTA) (1), термогравиметрического анализа (TGA) (2) и дифференциального термогравиметрического анализа (DrTGA) (3) аддуктов (a) цистеин–рифампицин и (б) глутатион–рифампицин.

Таблица 1.
Термоаналитические данные для исследованных соединений
| Соединение | Процесс | Tstart, °C | Tend, °C | Δm, % |
|---|---|---|---|---|
| Цистеин | I | 177.6 | 420.3 | 87.8 |
| II | 420.3 | 663.4 | 9.5 | |
| Глутатион | I | 189.2 | 455.9 | 59.0 |
| II | 455.9 | 700.0 | 35.0 | |
| Рифампицин | I | 173.1 | 465.7 | 42.9 |
| II | 465.7 | 700.0 | 53.2 | |
| Цистеин–рифампицин | I | 24.2 | 115.5 | 11.4 |
| II | 115.5 | 265.9 | 18.0 | |
| III | 265.9 | 664.4 | 56.2 | |
| Глутатион–рифампицин | I | 24.0 | 169.2 | 15.1 |
| II | 169.2 | 565.5 | 46.2 | |
| III | 565.5 | 700.0 | 16.7 |
Как видно из рис. 7, чистый глутатион дает эндотермический пик при 204°C. Этот пик отвечает процессу плавления, связанному с термическим разрушением [68–71]. Вторая стадия разрушения глутатиона происходит в интервале температур 455.9–700.0°C с потерей массы 35.0% (табл. 1).
Кривая дифференциального термогравиметрического анализа рифампицина (рис. 7) содержит эндотермический пик при 193°C, связанный с процессом плавления. Дополнительно видны экзотермические пики при 209 и 257°C, связанные, соответственно, с рекристаллизацией и фазовым переходом [72–75]. Термограмма рифампицина содержит две главных стадии разрушения. Первая потеря веса 42.9% происходит в интервале температур 173.1–465.7°C. Вторая, главная потеря веса 53.2% имеет место в интервале 465.7–700.0°C (табл. 1).
Термогравиметрические кривые образовавшихся аддуктов отличаются от кривых чистых CysH, глутатиона и рифампицина температурными интервалами процессов, связанных с потерями массы (рис. 8). Как видно из табл. 1, термическое разрушение аддуктов рифампицина – это сложные процессы, состоящие из трех стадий. В случае аддуктов кривые указывают на то, что между рифампицином и тиольными соединениями происходит химическая реакция, поскольку не наблюдается пиков при температурах, близких к тем, что определяются чистыми цистеином, глутатионом и рифампицином. На термограммах цистеин–рифампицина и глутатион–рифампицина имеется только один широкий пик с центром у 60°C, связанный с высвобождением физически адсорбированной воды из образца [76, 77]. Таким образом, можно утверждать, что эти аддукты имеют сродство к воде.
Для этих тиольных аддуктов наблюдается исчезновение эндотермических пиков плавления чистых CysH и глутатиона (рис. 8). Это указывает на то, что цистеин и глутатион связаны с молекулой рифампицина ковалентной связью. Однако, хорошо известно, что термический анализ физической смеси с глутатионом выявляет пик плавления глутатиона благодаря свободному глутатиону с несколькими степенями сдвига [69].
Константы связывания и стехиометрия
Равновесие образования аддуктов дается уравнением (4). В принципе, хорошо выраженный катодный сигнал рифампицина приблизительно при –1.1 В (рис. 1) должен быть чувствительным к образованию аддуктов, за исключением осложнений, связанных с образованием Hg-тиолатных комплексов. Но этот катодный сигнал не использовался для оценки константы образовавшегося равновесия. Причина этого в том, что изменения этого токового отклика с ростом концентрации цистеина непригодны для определения константы образования аддуктов цистеин–рифампицин. Однако, в соответствии с этими вольтамперометрическими измерениями, определение константы образования аддуктов цистеин–рифампицин основано на уменьшении катодного пикового тока восстановления комплекса Hg2(SR)2 в присутствии возрастающей концентрации рифампицина в растворе цистеина. Стехиометрия и константы образования аддуктов определяются следующим уравнением [78–84]:
(5)
$\begin{gathered} \left( {{1 \mathord{\left/ {\vphantom {1 {\Delta {{I}_{{\text{p}}}}}}} \right. \kern-0em} {\Delta {{I}_{{\text{p}}}}}}} \right) = \\ = \left( {{1 \mathord{\left/ {\vphantom {1 {\Delta {{I}_{{{\text{p,max}}}}}}}} \right. \kern-0em} {\Delta {{I}_{{{\text{p,max}}}}}}}} \right) + \left( {{1 \mathord{\left/ {\vphantom {1 {\beta \Delta {{I}_{{{\text{p,max}}}}}}}} \right. \kern-0em} {\beta \Delta {{I}_{{{\text{p,max}}}}}}}} \right) \times \left( {{1 \mathord{\left/ {\vphantom {1 {{{{\left[ {{\text{рифампицин}}} \right]}}^{n}}}}} \right. \kern-0em} {{{{\left[ {{\text{рифампицин}}} \right]}}^{n}}}}} \right), \\ \end{gathered} $Рис. 9.
Графики зависимости 1/ΔIp (нA–1) от 1/[рифампицин] (M–1) для (a) 3.98 × 10–6 M раствора глутатиона при pH 4.5, (б) 4.78 × 10–6 M раствора цистеина при pH 7.4, (в) 4.78 × 10–6 M раствора цистеина при pH 9.
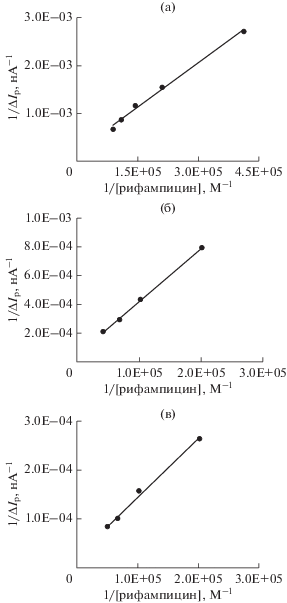
Таблица 2.
Логарифм констант образования аддуктов рифампицина с цистеином и глутатионом при различных рН
| Аддукт | lg β [M–1] | ||
|---|---|---|---|
| pH 4.5 | pH 7.4 | pH 9.0 | |
| Цистеин–рифампицин | 3.84 ± 0.04 | 4.18 ± 0.07 | 4.33 ± 0.05 |
| Глутатион–рифампицин | 4.52 ± 0.10 | 5.53 ± 0.09 | 6.06 ± 0.12 |
В то же время пики тока восстановления рифампицина в присутствии цистеина и глутатиона сдвинулись к менее отрицательным потенциалам. Это касается в особенности окислительно-восстановительной пары гидроюглон–юглон, которая оказалась вблизи потенциала 0 В (рис. 10). Уменьшение пиковых токов, принадлежащих электроактивным группам рифампицина, можно объяснить меньшим коэффициентом диффузии аддукта, чем свободного рифампицина. Это заставляет говорить о более медленной диффузии аддукта из объема раствора к поверхности ртути [85].
Рис. 10.
Циклические вольтамперограммы (a) 9.85 × × 10–6 M раствора рифампицина в отсутствие (точечные линии) и в присутствии (сплошные линии) 4.98 × × 10–6 M раствора цистеина при pH 7.4; (б) 4.95 × × 10‒6 M раствора рифампицина в отсутствие (точечные линии) и в присутствии (сплошные линии) 4.98 × 10–6 M раствора цистеина при pH 9; (в) 9.76 × × 10–6 M раствора рифампицина в отсутствие (точечные линии) и в присутствии (сплошные линии) 1.48 × 10–5 M раствора глутатиона при pH 9.

Так как и анодный, и катодный токи обратимой электродной реакции рифампицина уменьшаются в присутствии цистеина и глутатиона, мы сравнили отношения токов в присутствии и в отсутствие этих тиолов, с целью прояснить процесс присоединения. Ожидалось, что первоначальный электродный продукт рифампицин (юглоновая форма) расходуется в последующей химической реакции с образованием новых электроактивных аддуктов с цистеином и глутатионом (схема 5 ), и потому отношение катодного и анодного токов (Ipc/Ipa) этого обратимого процесса для аддуктов превысит отношение для окислительно-восстановительной пары гидроюглон–юглон со свободным рифампицином (табл. 3).
Схема 5 . Вероятный окислительно-восстановительный процесс с участием свободного и связанного с цистеиом рифампицина.
Таблица 3.
Изменения отношения катодного тока к анодному току (Ipc/Ipa) и формальный потенциал (E0') окислительно-восстановительного процесса гидроюглон–юглон в присутствии цистеина и глутатиона при pH 7.4 и 9
| Добавленное соединение | E0′, В | Ipc/Ipa | Kox/Kred | |||
|---|---|---|---|---|---|---|
| pH 7.4 | pH 9.0 | pH 7.4 | pH 9.0 | pH 7.4 | pH 9.0 | |
| – | –0.254 | –0.362 | 1.122 | 1.081 | – | – |
| Цистеин | –0.178 | –0.282 | 1.235 | 1.298 | 4.10 × 102 | 5.63 × 102 |
| Глутатион | –0.130 | –0.204 | 1.511 | 2.241 | 1.84 × 104 | 2.71 × 105 |
Полученные на основе вышеупомянутого процесса значения формального потенциала (E0') обратимого окислительно-восстановительного процесса с участием рифампицина в присутствии и в отсутствие цистеина и глутатиона даны в табл. 3. Величина E0' определена из (Epa + Epc)/2 [86]. Более того, отношение (Kox/Kred) констант связывания рифампицина в окисленной (Kox) и восстановленной (Kred) формах можно получить из следующего уравнения [87]:
(6)
$\Delta {{E}^{{0{\kern 1pt} '}}} = E_{{\text{b}}}^{{0{\kern 1pt} '}}--E_{{\text{f}}}^{{0{\kern 1pt} '}} = {{RT} \mathord{\left/ {\vphantom {{RT} {(nF)}}} \right. \kern-0em} {(nF)}}{\text{ln}}\left( {{{{{K}_{{{\text{ox}}}}}} \mathord{\left/ {\vphantom {{{{K}_{{{\text{ox}}}}}} {{{K}_{{{\text{red}}}}}}}} \right. \kern-0em} {{{K}_{{{\text{red}}}}}}}} \right),$Из табл. 3 видно, что окисленная форма рифампицина (структура юглона) сильнее взаимодействует с цистеином и глутатионом, чем его восстановленная форма (структура гидроюглона). Если принять, что значения pKa сульфгидрильной группы цистеина и глутатиона в воде равны, соответственно, 8.10 и 8.72 [88, 89], то константа образования аддукта глутатион–рифампицин больше, чем аддукта цистеин–рифампицин, при всех значениях pH (табл. 2). Подобно другим реакциям нуклеофильного замещения тиолов цистеина и глутатиона [90], можно утверждать, что константа образования аддукта здесь также возрастает с ростом основности функциональной группы SH-тиольного соединения. Такой результат можно объяснить ростом электронной плотности на атоме серы [90]. С другой стороны, рост констант образования с ростом pH может быть следствием роста относительного процента депротонированного тиолат-аниона. Как результат, тиолатная форма более реакционноспособна, чем тиольная [91].
ЗАКЛЮЧЕНИЕ
В настоящей работе с помощью вольтамперометрических методов подробно исследованы взаимодействия цистеина и глутатиона с рифампицином при различных pH (4.5, 7.4 и 9.0). Интересно, что константа реакции аддукта глутатиона с рифампицином больше, чем аддукта цистеина с рифампицином, при всех исследованных значениях pH. Этот результат можно прояснить через основность сульфгидрильных групп. С другой стороны, константы образования аддуктов, как цистеин–рифампицина, так и глутатион–рифампицина, растут с ростом pH. По изменениям формального потенциала обратимой реакции рифампицина с системой гидроюглон–юглон в присутствии цистеина и глутатиона установлено, что окисленная форма рифампицина сильнее реагирует как с цистеином, так и с глутатионом, чем его восстановленная форма.
Список литературы
Basu, S., Majumder, S., Chatterjee, S., Ganguly, A., Efferth, T., and Choudhuri, S.K., Detection and characterization of a glutathione conjugate of a novel copper complex, In Vivo, 2009, vol. 23, p. 401.
Meister, A. and Anderson, M.E., Glutathione, Annu. Rev. Biochem., 1983, vol. 52, p. 711. https://doi.org/10.1146/annurev.bi.52.070183.003431
Tew, K.D., Glutathione-associated enzymes in anticancer drug resistance, Cancer Res., 1994, vol. 54, p. 4313.
Sharma, R., Awasthi, S., Zimniak, P., and Awasthi, Y.C., Transport of glutathione-conjugates in human erythrocytes, Acta Biochim. Pol., 2000, vol. 47, p. 751.
Létourneau, I.J., Nakajima, A., Deeley, R.G., and Cole, S.P.C., Role of proline 1150 in functional interactions between the membrane spanning domains and nucleotide binding domains of the MRP1 (ABCC1) transporter, Biochem. Pharmacol., 2008, vol. 75, p. 1659. https://doi.org/10.1016/j.bcp.2008.01.009
Kosower, N.S. and Kosower, E.M., The glutathione status of cells, Int. Rev. Cytol., 1978, vol. 54, p. 109. https://doi.org/10.1016/S0074-7696(08)60166-7
Lee, P.T., Thomson, J.E., Karina, A., Salter, C., Johnston, C., Davies, S.G., and Compton, R.G., Selective electrochemical determination of cysteine with a cyclotricatechylene modified carbon electrode, Analyst, 2015, vol. 140, p. 236. https://doi.org/10.1039/C4AN01835D
White, P.C., Lawrence, N.S., Davis, J., and Compton, R.G., Electrochemical determination of thiols: A perspective, Electroanalysis, 2002, vol. 14, p. 89. https://doi.org/10.1002/1521-4109(200201)14:2<89:: AID-ELAN89>3.0.CO;2-Y
White, P.C., Lawrence, N.S., Davis, J., and Compton, R.G., Electrochemically initiated 1,4 additions: A versatile route to the determination of thiols, Anal. Chim. Acta, 2001, vol. 447, p. 1. https://doi.org/10.1016/S0003-2670(01)01297-1
Nadejde, C., Ursu, L., Creanga, D., and Dorohoi, D., Solvatochromic behaviour of rifampicin in diluted solutions, Rev. Chim. (Bucharest), 2015, vol. 66, p. 360.
Ferreira, D.A., Ferreira, A.G., Vizzotto, L., Neto, A.F., and Oliveira, A.G., Analysis of the molecular association of rifampicin with hydroxypropyl-β-cyclodextrin, Rev. Bras. Cienc. Farm., 2004, vol. 40, p. 43. https://doi.org/10.1590/S1516-93322004000100008
Chauhan, S., Singh, K., Kumar, K., Neelakantan, S.C., and Kumar, G., Drug–amino acid interactions in aqueous medium: Volumetric, compressibility, and viscometric studies, J. Chem. Eng. Data, 2016, vol. 61, p. 788. https://doi.org/10.1021/acs.jced.5b00549
Chauhan, S., Chaudhary, P., Sharma, K., Kumar, K., and Kiran, Temperature-dependent volumetric and viscometric properties of amino acids in aqueous solutions of an antibiotic drug, Chem. Pap., 2013, vol. 67, p. 1442. https://doi.org/10.2478/s11696-013-0404-y
Pal, A. and Chauhan, N., Interactions of amino acids and peptides with the drug pentoxifylline in aqueous solution at various temperatures: A volumetric approach, J. Chem. Thermodyn., 2012, vol. 54, p. 288. https://doi.org/10.1016/j.jct.2012.05.009
Kumar, H. and Kaur, K., Interaction of antibacterial drug ampicillin with glycine and its dipeptides analyzed by volumetric and acoustic methods at different temperatures, Thermochim. Acta, 2013, vol. 551, p. 40. https://doi.org/10.1016/j.tca.2012.10.018
Kamat, B.P. and Seetharamappa, J., Mechanism of interaction of vincristine sulphate and rifampicin with bovine serum albumin: A spectroscopic study, J. Chem. Sci., 2005, vol. 117, p. 649. https://doi.org/10.1007/BF02708294
Yu, O.-Y., Cheng, Y.-F., Huang, S.-Y., Bai, A.-M., and Hu, Y.-J., Probing the binding of rifampicin to bovine serum albumin in aqueous solution, J. Solution Chem., 2011, vol. 40, p. 1711. https://doi.org/10.1007/s10953-011-9747-6
Sharifi, M., Dolatabadi, J.E.N., Fathi, F., Rashidi, M., Jafari, B., Tajalli, H., and Rashidi, M.-R., Kinetic and thermodynamic study of bovine serum albumin interaction with rifampicin using surface plasmon resonance and molecular docking methods, J. Biomed. Opt., 2017, vol. 22, 037002. https://doi.org/10.1117/1.JBO.22.3.037002
Assandri A. and Semenza G., Protein binding of rifampicin to bovine serum albumin as measured by gel filtration, J. Chromatogr., 1977, vol. 135, p. 25. https://doi.org/10.1016/S0021-9673(00)86298-6
Boman, G. and Ringberger, V.-A., Binding of rifampicin by human plasma proteins, Europ. J. Clin. Pharmacol., 1974, vol. 7, p. 369. https://doi.org/10.1007/BF00558209
Polasa, K. and Krishnaswamy, K., In vitro studies on protein binding of rifampicin, Indian J. Pharmac., 1987, vol. 19, p. 225.
Chen, X.-B., Kang, D.-G., Li, S., Zhao, C.-Y., Chen, X.-S., and Ding, H.-P., Fluorescence spectroscopy study of human serum albumin quenched by rifampicin capsules, Guang Pu Xue Yu Guang Pu Fen Xi / Spectrosc. Spect. Anal., 2006, vol. 26, p. 674.
Lachau, S., Rochas, M.A., Tufenkji, A.E., Martin, N., Levillain, P., and Houin, G., First-derivative spectroscopic determination of binding characteristics of rifampicin to human albumin and serum, J. Pharm. Sci., 1992, vol. 81, p. 287. https://doi.org/10.1002/jps.2600810319
Scotti, L., de Oliveira Lima, E., da Silva, M.S., Ishiki, H., de Oliveira Lima, I., de Oliveira Pereira, F., Junior, F.J.B.M., and Scotti, M.T., Docking and PLS studies on a set of thiophenes RNA polymerase inhibitors against Staphylococcus aureus, Curr. Top. Med. Chem., 2014, vol. 14, p. 64. https://doi.org/10.2174/1568026613666131113151347
Selvaraj, S., Ramanathan, R., Vasudevaraja, V., Rajan, K.S., Krishnaswamy, S., Pemiah, B., Sethuraman, S., Ramakrishnan, V., and Krishnan, U.M., Transcriptional regulation of the pregnane-X receptor by the Ayurvedic formulation Chandraprabha Vati, RSC Adv., 2014, vol. 4, p. 64967. https://doi.org/10.1039/C4RA13553A
Murthy, N.V.S.V., Sastry, V.G., and Basha, S.H., 3,5‑dinitrophenyl clubbed azoles against latent tuberculosis- a theoretical mechanistic study, J. PeerScientist, 2018, vol. 1, e1000001. https://doi.org/10.5281/zenodo.3371841
Lawrence, N.S., Davis, J., and Compton, R.G., Electrochemical detection of thiols in biological media, Talanta, 2001, vol. 53, p. 1089. https://doi.org/10.1016/S0039-9140(00)00579-8
White, P.C., Lawrence, N.S., Tsai, Y.C., Davis, J., and Compton, R.G., Electrochemically driven derivatisation-detection of cysteine, Microchim. Acta, 2001, vol. 137, p. 87. https://doi.org/10.1007/s006040170033
Hignett, G., Threlfell, S., Wain, A.J., Lawrence, N.S., Wilkins, S.J., Davis, J., Compton, R.G., and Cardosi, M.F., Electroanalytical exploitation of quinone–thiol interactions: Application to the selective determination of cysteine, Analyst, 2001, vol. 126, p. 353. https://doi.org/10.1039/b008616i
Biçer, E. and Özdemir, N., In vitro study of the interaction of cysteine with a thiazide diuretic (hydrochlorothiazide) at different pH by voltammetric and spectroscopic techniques, Russ. J. Electrochem., 2013, vol. 49, p. 948. https://doi.org/10.1134/S1023193513100042
Biçer, E. and Çınar, E., Voltammetric and spectroscopic studies on the interaction of pentoxifylline with cysteine in the presence and absence of UV irradiation, Z. Phys. Chem., 2005, vol. 219, p. 817. https://doi.org/10.1524/zpch.219.6.817.65709
Biçer, E. and Çetinkaya, P., A voltammetric study on the interaction of novobiocin with cysteine: pH effect, J. Chil. Chem. Soc., 2009, vol. 54, p. 46. https://doi.org/10.4067/S0717-97072009000100011
Omanović, D. and Branica, M., Automation of voltammetric measurements by polarographic analyser PAR 384B, Croat. Chem. Acta, 1998, vol. 71, p. 421.
Hahn, Y. and Shin, S., Electrochemical behavior and differential pulse polarographic determination of rifampicin in the pharmaceutical preparations, Arch. Pharm. Res., 2001, vol. 24, p. 100. https://doi.org/10.1007/BF02976475
Biçer, E. and Özdemir, S., Voltammetric and spectroscopic studies on the interaction of anti-cancer herbal drug rutin with an anti-tuberculosis agent rifampicin, Russ. J. Electrochem., 2010, vol. 46, p. 896. https://doi.org/10.1134/S1023193510080069
Leandro, K.C., de Carvalho, J.M., Giovanelli, L.F., and Moreira, J.C., Development and validation of an electroanalytical methodology for determination of isoniazid and rifampicin content in pharmaceutical formulations, Braz. J. Pharm. Sci., 2009, vol. 45, p. 331. https://doi.org/10.1590/S1984-82502009000200019
Asadpour-Zeynali, K. and Soheili-Azad, P., Simultaneous polarographic determination of isoniazid and rifampicin by differential pulse polarography method and support vector regression, Electrochim. Acta, 2010, vol. 55, p. 6570. https://doi.org/10.1016/j.electacta.2010.06.018
Latypova, L.Z., Yanilkin, V.V., Kurbangalieva, A.R., Berdnikov, E.A., and Chmutova, G.A., Electrochemical reduction of mucochloric acid and its 5-alkoxy derivatives, Russ. Chem. Bull., 2012, vol. 61, p. 568. https://doi.org/10.1007/s11172-012-0083-9
Sulaiman, S.T. and Razzak, F.H.A., Differential-pulse polarographic determination of doxycycline in serum and urine, Raf. Jour. Sci., 2008, vol. 19, p. 52.
Zbačnik, M. and Kaitner, B., Supramolecular influence on keto-enol tautomerism and thermochromic properties of o-hydroxy Schiff bases, Croat. Chem. Acta, 2016, vol. 89, p. 125. https://doi.org/10.5562/cca2881
Jovanović, Lj.S., Electrochemistry of vitamin b6 vitamers, their derivatives and metal complexes, in: Physical Chemistry 2006: Proceedings of the 8th International Conference on Fundamental and Applied Aspects of Physical Chemistry. Antić-Jovanović, A. (Ed.), E–2–SL, p. 292.
Xu, L., Xiao, Y., Xu, Q., van Sandwijk, A., Li, J., Zhao, Z., Song, Q., and Yang, Y., Electrochemical behavior of zirconium in molten LiF–KF–ZrF4 at 600°C, RSC Adv., 2016, vol. 6, p. 84472. https://doi.org/10.1039/C6RA17102H
Noori, J.S., Dimaki, M., Mortensen, J., and Svendsen, W.E., Detection of glyphosate in drinking water: A fast and direct detection method without sample pretreatment, Sensors, 2018, vol. 18, p. 2961.
Jain, R., Tiwari, D.C., and Karolia, P., Highly sensitive and selective polyaniline–zinc oxide nanocomposite sensor for betahistine hydrochloride in solubilized system, J. Mol. Liq., 2014, vol. 196, p. 308. https://doi.org/10.1016/j.molliq.2014.03.048
Amidi, S., Hosseinzadeh Ardakani, Y., Amiri-Aref, M., Ranjbari, E., Sepehri, Z., and Bagheri, H., Sensitive electrochemical determination of rifampicin using gold nanoparticles/poly-melamine nanocomposite, RSC Adv., 2017, vol. 7, p. 40111. https://doi.org/10.1039/C7RA04865C
Kawde, A.-N., Temerk, Y., and Farhan, N., Adsorptive stripping voltammetry of antibiotics rifamycin SV and rifampicin at renewable pencil electrodes, Acta Chim. Slov., 2014, vol. 61, p. 398.
Tokunaga, T., Takada, N., and Ueda, M., Mechanism of antifeedant activity of plumbagin, a compound concerning the chemical defense in carnivorous plant, Tetrahedron Lett., 2004, vol. 45, p. 7115. https://doi.org/10.1016/j.tetlet.2004.07.094
Michelitsch, A., Wurglics, M., Schubert-Zsilavecz M., and Likussar, W., Determination of 5-hydroxynaphthoquinones in phytotherapeutic drosera preparations by differential pulse polarography, Phytochem. Anal., 1999, vol. 10, p. 64. https://doi.org/10.1002/(SICI)1099-1565(199903/04) 10:2<64::AID-PCA434>3.0.CO;2-T
Perrin, C.L., Mechanisms of organic polarography, in: Organic polarography, Zuman, P. and Perrin, C.L. (Eds.), New York: Wiley, 1969, p. 197–198.
Munir, S., Shah, A., Rauf, A., Badshah, A., Hussain, H., Zia-ur-Rehman, and Ahmad, Z., Redox behavior of juglone in buffered aq.: Ethanol media, C.R. Chimie, 2013, vol. 16, p. 1140. https://doi.org/10.1016/j.crci.2013.04.011
Pietrzykowski, A.D., Oxidation-reduction couples bearing chelating groups, Ph.D. Thesis, Iowa State University of Science and Technology, Iowa, 1963, p. 77.
Heyrovský, M. and Vavřička, S., Adsorption effects of electroactive species in d.c. polarography demonstrated in the case of the anodic waves of cysteine, J. Electroanal Chem., 1997, vol. 423, p. 125. https://doi.org/10.1016/S0022-0728(96)04691-8
Heyrovský, M., Mader, P., Vavřička, S., Veselá, V., and Fedurco, M., The anodic reactions at mercury electrodes due to cysteine, J. Electroanal. Chem., 1997, vol. 430, p. 103. https://doi.org/10.1016/S0022-0728(97)00103-4
Jin, W., Zhao, X., and Xiao, L., Mechanism of the electrochemical reaction of glutathione at a mercury electrode, Electroanalysis, 2000, vol. 12, p. 858. https://doi.org/10.1002/1521-4109(200007)12:11<858:: AID-ELAN858>3.0.CO;2-1
Fang, C. and Zhou, X., Electrochemical properties of glutathione monolayer on mercury surface, Electroanalysis, 2002, vol. 14, p. 711. https://doi.org/10.1002/1521-4109(200205)14:10<711:: AID-ELAN711>3.0.CO;2-7
Heyrovský, M. and Proková, B., Heterogeneous physico-chemical interactions following electrode reaction: Interaction of folates with thiols, Collect. Czech. Chem. Commun., 1997, vol. 62, p. 172. https://doi.org/10.1135/cccc19970172
Proková, B. and Heyrovský, M., Voltammetric evidence of interfacial interactions between folates and thiols, Bioelectroch. Bioener., 1996, vol. 41, p. 209. https://doi.org/10.1016/S0302-4598(96)05099-4
Oliveira-Brett, A.M., Goulart, M.O.F., and Abreu, F.C., Reduction of lapachones and their reaction with L-cysteine and mercaptoethanol on glassy carbon electrodes, Bioelectrochemistry, 2002, vol. 56, p. 53. https://doi.org/10.1016/S1567-5394(02)00011-7
Esterbauer, H., Zöllner, H., and Scholz, N., Reaction of glutathione with conjugated carbonyls, Z. Naturforsch. C, 1975, vol. 30, p. 466. https://doi.org/10.1515/znc-1975-7-808
Demetrescu, I., Dumitriu, C., Totea, G., Nica, C.I., Dinischiotu, A., and Ionita, D., Zwitterionic cysteine drug coating influence in functionalization of implantable Ti50Zr alloy for antibacterial, biocompatibility and stability properties, Pharmaceutics, 2018, vol. 10, p. 220. https://doi.org/10.3390/pharmaceutics10040220
Biçer, E. and Nuertayi, P., Voltammetric, spectroscopic and thermal investigations of the interaction of levofloxacin with cysteine at physiological pH, Russ. J. Electrochem., 2017, vol. 53, p. 469. https://doi.org/10.1134/S1023193517050044
Singh, B.K., Mishra, P., and Garg, B.S., Nickel(II) complexes of biologically active glutathione: Spectroscopic, kinetics of thermal decomposition and XRPD studies, Spectrochim. Acta A, 2007, vol. 67, p. 719. https://doi.org/10.1016/j.saa.2006.08.024
Li, L., Liao, L., Ding, Y., and Zeng, H., Dithizone-etched CdTe nanoparticles-based fluorescence sensor for the off–on detection of cadmium ion in aqueous media, RSC Adv., 2017, vol. 7, p. 10361. https://doi.org/10.1039/C6RA24971J
Nagarjuna, R., Saifullah, M.S.M., and Ganesan, R., Oxygen insensitive thiol–ene photo-click chemistry for direct imprint lithography of oxides, RSC Adv., 2018, vol. 8, p. 11403. https://doi.org/10.1039/C8RA01688G
Fuliaş, A., Vlase, G., Ledeţi, I., and Şuta, L.-M., Ketoprofen–cysteine equimolar salt: Synthesis, thermal analysis, PXRD and FTIR spectroscopy investigation, J. Therm. Anal. Calorim., 2015, vol. 121, p. 1087. https://doi.org/10.1007/s10973-015-4516-1
Paukov, I.E., Kovalevskaya, Y.A., and Boldyreva, E.V., Low-temperature thermodynamic properties of DL-cysteine, J. Therm. Anal. Calorim., 2010, vol. 100, p. 295. https://doi.org/10.1007/s10973-009-0457-x
Kamble, S.R., Molecular interactions in pharmaceutical preformulation and supramolecular complexes, PhD Thesis, University of Bradford, 2018.
Montenegro, L., Trapani, A., Fini, P., Mandracchia, D., Latrofa, A., Cioffi, N., Chiarantini, L., Picceri, G.G., Brundu, S., and Puglisi, G., Chitosan nanoparticles for topical co-administration of the antioxidants glutathione and idebenone: characterization and in vitro release, Br. J. Pharm. Res., 2014, vol. 4, p. 2387. https://doi.org/10.9734/bjpr/2014/8641
Alobaidy, Z.A., Enhancing oral delivery of glutathione using chitosan nanoparticles, MSc Thesis, University of Petra, Amman, Jordan, 2013, p. 36.
Alanazi, A.M., Mostafa, G.A.E., and Al-Badr, A.A., Glutathione, in: Profiles of Drug Substances, Excipients and Related Methodology, Brittain, H.G. (Ed.), vol. 40, Ch. 2, 1st Edition, Oxford: Academic, 2015, p. 43.
Wonisch, W. and Schaur, R.J., Chemistry of glutathione, in: Significance of Glutathione to Plant Adaptation to the Environment, Grill, D., Tausz, M.M., and de Kok, L.J. (Eds.), Dordrecht: Springer, Ch. 2, 2001, p. 14.
Henwood, S.Q., Liebenberg, W., Tiedt, L.R., Lötter, A.P., and de Villiers, M.M., Characterization of the solubility and dissolution properties of several new rifampicin polymorphs, solvates, and hydrates, Drug Dev. Ind. Pharm., 2001, vol. 27, p. 1017. https://doi.org/10.1081/DDC-100108364
Bhise, S.B., More, A.B., and Malayandi, R., Formulation and in vitro evaluation of rifampicin loaded porous microspheres, Sci. Pharm., 2010, vol. 78, p. 291. https://doi.org/10.3797/scipharm.0910-09
Alves, R., da Silva Reis, T.V., da Silva, L.C.C., Storpírtis, S., Mercuri, L.P., do Rosário Matos, J., Thermal behavior and decomposition kinetics of rifampicin polymorphs under isothermal and non-isothermal conditions, Braz. J. Pharm. Sci., 2010, vol. 46, p. 343. https://doi.org/10.1590/S1984-82502010000200022
Freire, F.D., Aragão, C.F.S., de Lima e Moura, T.F.A., and Raffin, F.N., Thermal studies of isoniazid and mixtures with rifampicin, J. Therm. Anal. Calorim., 2009, vol. 97, p. 333. https://doi.org/10.1007/s10973-009-0084-6
Manna, B.R., Dey, S., Debnath, S., and Ghosh, U.C., Removal of arsenic from groundwater using crystalline hydrous ferric oxide (CHFO), Water Qual. Res. J. Canada, 2003, vol. 38, p. 193. https://doi.org/10.2166/wqrj.2003.013
Maldonado, C.S., De la Rosa, J.R., Lucio-Ortiz, C.J., Hernández-Ramírez, A., Barraza F.F.C., and Valente, J.S., Low concentration Fe-doped alumina catalysts using sol–gel and impregnation methods: The synthesis, characterization and catalytic performance during the combustion of trichloroethylene, Materials, 2014, vol. 7, p. 2062. https://doi.org/10.3390/ma7032062
Yao, X.R. and Zhang, L.Q., Polarographic Catalytic Wave Atlas, Bejing: Geology Publishing House, 1988, p. 16–20.
Li, N.Q. and Gao, X.X., fan ji pu cui hua bo de yan jiu. fan – lin suan yan ti xi zhong guo yang hua qing ji pu cui hua bo de yan jiu, Chinese J. Anal. Chem., 1973, vol. 2, p. 40.
Gao, X.X. and Yao, X.R., Polarographic Catalytic Wave of the Element of Group Pt, Beijing: Science Press, 1977, p. 120–127.
Li, Y-Q., Guo, Y.-J., Li, X.-F., and Pan, J.-H., Electrochemical studies of determination of Basic Brown G and its interaction with cyclodextrins, Dyes Pigments, 2007, vol. 74, p. 67. https://doi.org/10.1016/j.dyepig.2006.01.012
Mohandoss, S. and Stalin, T., Study on inclusion complex behaviours of L-tyrosine and β-cyclodextrin by cyclic voltammetric technique using glassy carbon electrode, Int. J. Advanced Res., 2013, vol. 1, p. 381.
Mohandoss, S. and Stalin, T., Photochemical and computational studies of inclusion complexes between β-cyclodextrin and 1,2-dihydroxyanthraquinones, Photochem. Photobiol. Sci., 2017, vol. 16, p. 476. https://doi.org/10.1039/C6PP00285D
Shehatta, I.S. and Ibrahim, M.S., Binding of anti-inflammatory drug indomethacin with cyclodextrin and DNA: Solubility, spectroscopic, and voltammetric studies, Can. J. Chem., 2001, vol. 79, p. 1431. https://doi.org/10.1139/v01-105
Ragazzon, G., Baroncini, M., Ceroni, P., Credi, A., and Venturi, M., Electrochemically controlled supramolecular switches and machines: in Comprehensive Supramolecular Chemistry II, Atwood, J.L., Gokel, G.W., and Barbour, L., (Eds.), London: Elsevier, 2017, vol. 2, p. 351.
Rezaei-Zarchi, S., Javed, A., Mirjalili, H., Abarghouei, H.B., and Hashemizadeh, S.A., Characterization and electrochemical study of nano-composition based methylene blue- and riboflavin-nafion on the surface of gold electrode, Turk. J. Chem., 2009, vol. 33, p. 411.
Arguelho, M.L.P.M., Alves, J.P.H., Stradiotto, N.R., Júnior, V.L., Pires, J.M, and Beatriz, A., Electrochemical and theoretical evaluation of the interaction between DNA and amodiaquine. Evidence of the guanine adduct formation, Quim. Nova, 2010, vol. 33, p. 1291. https://doi.org/10.1590/S0100-40422010000600014
García-Beltrán, O., Santos, J.G., Fuentealba, S., De la Torre, P., Pavez, P., Mena, N., Nuñez, M.T., and Aliaga, M.E., Mechanism study of the thiol-addition reaction to benzothiazole derivative for sensing endogenous thiols, Tetrahedron Lett., 2015, vol. 56, p. 2437. https://doi.org/10.1016/j.tetlet.2015.03.083
Andrade-Acuña, D., Santos, J.G., Tiznado, W., Cañete, Á., and Aliaga, M.E., Kinetic study on the aromatic nucleophilic substitution reaction of 3,6-dichloro-1,2,4,5-tetrazine by biothiols, J. Phys. Org. Chem., 2014, vol. 27, p. 670. https://doi.org/10.1002/poc.3316
Bianchi, D.H.A. and Haenen, G.R.M.M., The paradoxical influence of the pKa on the reactivity of thiols and its biological relevance, Maastricht Research Based Learning Project (MaRBLe) Research Papers: Biomedical and Health Sciences Research, 2014, vol. 2, p. 222. https://doi.org/10.26481/marble.2014.v2.316
Wall, S.B., Oh, J.-Y., Diers, A.R., and Landar, A., Oxidative modification of proteins: an emerging mechanism of cell signaling, Front. Physiol., 2012, vol. 3, article 369, 9 pages. https://doi.org/10.3389/fphys.2012.00369
Дополнительные материалы отсутствуют.