Электрохимия, 2020, T. 56, № 7, стр. 619-628
Интенсифицированное окисление мочевой кислоты в щелочных средах на золотом электроде, модифицированном тиомочевиной
Т. Ф. Манни a, Р. Миах a, *, Ф. Ислам a, Д. Сен a, Р. Махмуд a
a Шахъялалский научно-технический Университет
Силхет-3114, Бангладеш
* E-mail: mrmche@yahoo.com
Поступила в редакцию 23.07.2019
После доработки 24.10.2019
Принята к публикации 10.12.2019
Аннотация
Поверхность поликристаллического золотого электрода модифицировали ex situ с помощью самоорганизованного монослоя тиомочевины, имея в виду применить полученный электрод для электрохимического окисления мочевой кислоты в щелочных средах. Мочевая кислота претерпевает усиленное электрохимическое окисление на поликристаллическом золотом электроде, модифицированном самоорганизованным монослоем тиомочевины. Оно протекает при значительно более низком потенциале и более высокой плотности тока по сравнению с поликристаллическим золотым электродом с чистой поверхностью. Эта повышенная электроактивность достигается благодаря эффективной блокировке вредоносной адсорбции мочевой кислоты, имеющей место на поликристаллическом золотом электроде с чистой поверхностью. Модифицированный поликристаллический золотой электрод оказался весьма эффективным по отношению к окислению мочевой кислоты, аскорбиновой кислоты и допамина в их смеси, с хорошим разрешением пиков тока индивидуальных соединений. Предложенный метод может быть успешно использован при разработке сенсора для определения мочевой кислоты.
ВВЕДЕНИЕ
Мочевая кислота – важный маркер в клинической диагностике, благодаря тому, что повышение ее уровня в крови связано с рядом болезней, таких как подагра, синдром инсулинорезистентности, повышенное кровяное давление и почечная недостаточность [1, 2]. Повышенная концентрация мочевой кислоты в сыворотке крови также рассматривается как фактор риска инфаркта миокарда и инсульта [3]. Поэтому жизненно необходимо разработать быстрый, чувствительный и избирательный метод определения мочевой кислоты в жидкости в организме человека. Электрохимическое окисление мочевой кислоты уже давно привлекает большое внимание исследователей. Совсем недавно окисление мочевой кислоты изучали на целом ряде электродных материалов, таких как графен с закрепленными на его поверхности Pd−Pt-наночастицами [4], нанопористые PtTi-сплавы с иерархической структурой [5], слой углерода на Ta-проволоке [6], допированные марганцем SnO2-наночастицы [7], обогащенные азотом углеродистые вещества [8], трехмерные нанокомпозиты графенового гидрогеля с золотыми наночастицами [9], новая полимерная пленка поли[глиоксаль-бис(2-гидроксианила)] [10], проводящий полимер β-циклодекстрин на восстановленном оксиде графена [11], графит, модифицированный многостенными углеродными нанотрубками “свернутого” сульфоната полистирола [12], модифицированный графеном стеклоуглерод [13] и др. Определение мочевой кислоты на основе ее окисления исследовали главным образом в нейтральных средах. Исследования в сильнокислых и щелочных средах встречаются редко. Окисление мочевой кислоты на поликристаллическом золотом (поли-Au)-электроде с чистой поверхностью в нейтральном растворе протекает с образованием хорошо выраженного вольтамперометрического пика тока [14]. В щелочных средах мочевая кислота существует в анионной форме и претерпевает прочную адсорбцию на поверхности золотого электрода, что ведет к сильному загрязнению электрода, и поэтому окисление мочевой кислоты имеет место при таком высоком потенциале, при котором поверхность электрода сама по себе подвергается окислению [15–17]. К тому же на электроде с чистой поверхностью окисление аскорбиновой кислоты протекает при потенциалах, близких к потенциалу окисления мочевой кислоты, и потому пики тока этих индивидуальных соединений не разрешаются. Быстрый и легкий метод определения мочевой кислоты, в особенности в присутствии аскорбиновой кислоты и некоторых других сопутствующих веществ, еще нуждается в проработке.
Электроды, модифицированные адсорбционным слоем атомов или молекул веществ, дают хорошо разрешающиеся и устойчивые вольтамперометрические сигналы, благодаря защите поверхности электрода от вредоносной адсорбции мочевой кислоты и продуктов ее окисления. Например, мы показали, что поли-Au-электрод с монослойным покрытием из иода [16] или серы [17] дает в высшей степени воспроизводимый и устойчивый отклик при одновременном окислении аскорбиновой кислоты и мочевой кислоты в щелочной среде. Также сообщалось [18] об устойчивом электрохимическом окислении аскорбиновой кислоты и допамина в щелочном растворе на палладиевом электроде, модифицированном адсорбционным слоем иода. Избирательное окисление мочевой кислоты в присутствии большого избытка аскорбиновой кислоты наблюдали на золотом электроде, модифицированном монослоем меркаптобензимидазола [19]. Был разработан [20] новый метод избирательного окисления мочевой кислоты в присутствии аскорбиновой кислоты с применением золотого электрода с самоорганизованным монослоем пеницилламина, отличающийся прекрасной чувствительностью, хорошей избирательностью и не страдающий от загрязнения электрода.
Хорошо охарактеризованные самоорганизованные монослои серосодержащих молекул, таких как алкантиол, тиомочевина и т.п., на металлических электродах широко применяются в качестве новой стратегии модифицирования электродных поверхностей для иммобилизации, ориентирования и организации биомолекул на границах раздела, в электрокатализе [21–31] и т.п. Стратегия самоорганизованного монослоя триумфально показала свое превосходство по отношению к другим способам модифицирования поверхностей, благодаря своей простоте, многосторонности и хорошей организованности в масштабах молекул. Тиомочевина дешевле и удобнее в употреблении для пользователя, чем другие тиолы, и потому ее можно выбрать для получения самоорганизованного монослоя в практических целях.
С целью разработать вольтамперометрический метод избирательного и чувствительного окисления мочевой кислоты, в настоящей работе описано ex situ модифицирование поверхности поли-Au-электрода монослоем самопроизвольно адсорбированной тиомочевины. Главная задача настоящей работы – изучение интенсивного электрокаталитического окисления мочевой кислоты на модифицированном тиомочевиной поли-Au-электроде в щелочных средах. Электрохимические измерения проводили методами вольтамперометрии [измеряя потенциал разомкнутой цепи (Eocp)] и амперометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для электрохимических измерений в качестве рабочего электрода был использован поли-Au-электрод (диаметр 1.6 мм), заделанный в тефлоновый корпус; площадь рабочей поверхности составила 2.01 × 10–2 cм2. Фактор шероховатости этого электрода оценили в 1.1, используя сравнительное значение заряда, необходимого для восстановления монослоя оксида золота (386 мкКл cм–2 [32]). Соответственно, истинная площадь поверхности электрода составила 2.21 × × 10–2 cм–2. Противоэлектродом служила спираль из платиновой проволоки, а электродом сравнения – Ag | AgCl | KCl(насыщ.)-электрод. Реакционным сосудом являлась двухкамерная ячейка из стекла Пирекс. Для удаления воздуха через раствор в ячейке пропускали газ N2 в течение приблизительно 30 мин. Все измерения проводили при температуре 25°C. Раствором электролита служил насыщенный азотом 0.1 M водный раствор NaOH. Образование самоорганизованного монослоя тиомочевины на поверхности поли-Au-электрода проводили, погружая электрод в насыщенный азотом 0.1 M водный раствор NaOH, содержащий 10 мM тиомочевины, на 10 мин, чего было достаточно для получения самоорганизованных монослоев других тиоловых и серосодержащих соединений [16, 33, 34]. Перед экспериментами электрод несколько раз промывали водой, очищенной в установке Milli-Q, для удаления избытка тиомочевины. При измерениях Eocp электрод выдерживали в насыщенном N2 0.1 M растворе NaOH в условиях разомкнутой цепи; затем в этот раствор инжектировали раствор тиомочевины. Раствор мочевой кислоты по своей природе кислый; мочевая кислота хорошо растворима в щелочных средах. Раствор мочевой кислоты готовили непосредственно перед экспериментом, добавляя ее к 0.1 M раствору NaOH и слегка взбалтывая в течение нескольких секунд. При амперометрических измерениях потенциал меняли ступенчатым образом от 0 до 0.25 В. Одновременное окисление мочевой кислоты, аскорбиновой кислоты и допамина проводили в растворе, содержащем по 2 мM мочевой кислоты, аскорбиновой кислоты и допамина. Модифицированный тиомочевиной поли-Au-электрод ниже будет обозначаться “тиомочевина/поли-Au-электрод”. Электрохимические измерения вели на электрохимическом анализаторе CHI-602D.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изготовление тиомочевина/поли-Au-электрода
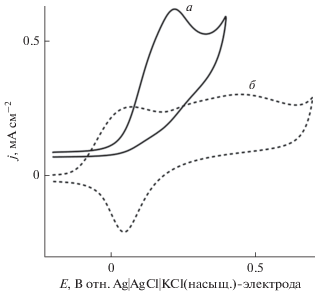
Образование самоорганизованного монослоя тиомочевины на поверхности поли-Au-электрода поверяли электрохимически путем вольтамперометрических измерений при развертке потенциала до такого отрицательного значения, при котором молекулы самоорганизованного монослоя десорбируются под действием наложенного потенциала. Соответственно, поли-Au-электрод погружали в 0.1 M водный раствор NaOH, содержащий 10 мM тиомочевины, на 10 мин. Затем электрод удаляли из этого раствора, тщательно промывали водой, очищенной в установке Milli-Q, и помещали в насыщенный азотом 0.1 M раствор NaOH, не содержавший ранее добавленной тиомочевины. Затем снимали циклические вольтамперограммы в интервале потенциалов от 0.2 до ‒1.3 В. Полученные результаты представлены на рис. 1. Циклическая вольтамперограмма (a), полученная на тиомочевина/поли-Au-электроде, содержит многочисленные катодные пики тока при –0.90, –0.95 и –1.06 В. Эти катодные пики, очевидно, отвечают индуцированной потенциалом десорбции самоорганизованного монослоя тиомочевины, самопроизвольно образовавшегося на поверхности поли-Au-электрода в то время, когда его “вымачивали” в растворе, содержавшем тиомочевину. Этот результат похож на описанную в литературе индуцированную потенциалом десорбцию самоорганизованного монослоя меркаптоуксусной кислоты в аналогичных условиях [34]. Поли-Au-электрод с чистой поверхностью дает широкий катодный отклик приблизительно при –0.18 В (циклическая вольтамперограмма (б)), который можно объяснить десорбцией ионов OH– [35]. На тиомочевина/поли-Au-электроде этот отклик не наблюдается, потому что OH– не может адсорбироваться на поверхности этого электрода, где уже существует адслой тиомочевины. Это также означает, что тиомочевина адсорбируется прочнее, чем ион OH–, и не может быть вытеснена им. Образование самоорганизованного монослоя тиомочевины подтверждается также вольтамперометрическими измерениями в кислом растворе при развертке потенциала в направлении к положительным значениям, при которых следует ожидать электрохимического окисления этого самоорганизованного монослоя тиомочевины. Соответственно, поли-Au-электрод со свежеобразованным самоорганизованным монослоем тиомочевины погружали в насыщенный азотом 0.05 M раствор H2SO4 и развертывали его потенциал от −0.2 до 1.5 В; результаты опыта представлены на рис. 2. Пунктирная кривая – это характеристическая циклическая вольтамперограмма поли-Au-электрода с чистой поверхностью в кислом растворе. Сплошные кривые 1–3 – циклические вольтамперограммы, записанные на тиомочевина/поли-Au-электроде, соответственно, в 1-м, 2-м и 3-м циклах развертки потенциала.
Рис. 1.
Циклические вольтамперограммы, снятые на (а) тиомочевина/поли-Au-электроде и (б) поли-Au-электродe с чистой поверхностью в насыщенном азотом 0.1 M растворе NaOH. Скорость развертки потенциала: 0.1 В с–1.

Рис. 2.
Циклические вольтамперограммы, снятые на (а) тиомочевина/поли-Au-электроде (сплошные линии: циклические вольтамперограммы, снятые на первом, втором и третьем циклах (сверху вниз)) и (б) поли-Au-электроде (пунктир) в насыщенном азотом 0.05 M растворе H2SO4. Скорость развертки потенциала: 0.1 В с–1.

Эти результаты показывают, что вымачивание электрода в растворе тиомочевины существенно модифицирует характеристические циклические вольтамперограммы поли-Au-электрода с чистой поверхностью. Изменение его токового отклика, несомненно, связано с образованием адслоя тиомочевины на его поверхности во время его вымачивания в растворе тиомочевины. Заметное изменение в случае тиомочевина/поли-Au-электрода – это замена характеристических многочисленных анодных пиков, возникающих в интервале потенциалов от 1.0 до 1.4 В из-за окисления поверхности поли-Au-электрода, на единственный пик анодного тока при 1.23 В с гораздо большей плотностью тока [36]. Этот анодный пик при 1.23 В, возникающий на тиомочевина/поли-Au-электроде, связан с одновременным электрохимическим окислением адсорбированной тиомочевины и собственно поверхности поли-Au-электрода. Адсорбированная на поверхности электрода тиомочевина подвергается последовательному совместному окислению с образованием дисульфида формамидина, согласно следующему уравнению реакции [37]:
При непрерывном циклировании потенциала пиковый ток быстро снижается (см. кривые 2 и 3) и в конце концов совпадает с током циклической вольтамперограммы поли-Au-электрода с чистой поверхностью, что указывает на полную индуцированную потенциалом десорбцию адслоя тиомочевины. Величина заряда, потребленного при окислении адсорбированной тиомочевины, может быть получена вычитанием заряда, пошедшего на окисление “чистой” поверхности поли-Au-электрода, из полного заряда одновременного окисления адсорбированной тиомочевины и поверхности поли-Au-электрода. Теперь можно вычислить поверхностное заполнение электрода тиомочевиной по следующему уравнению [38]:
где θТМ – поверхностное заполнение тиомочевиной, n – число электронов, необходимых для окисления адсорбированной тиомочевины (n = 2, согласно вышеприведенному уравнению реакции), e – заряд электрона (1.60217 × 10–19 Кл), a A – истинная площадь поверхности (2.2 × 10−2 cм2) поли-Au-электрода. Вычисленное значение θТМ равняется 5.85 × 1015 молекул/cм2.Стабильность тиомочевина/поли-Au-электрода
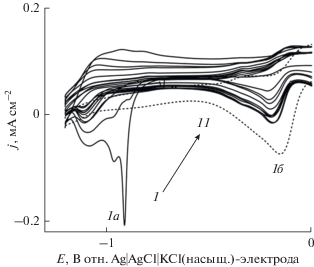
Тиомочевина/поли-Au-электрод погружали в насыщенный азотом 0.1 M раствор NaOH, не содержащий тиомочевины, и последовательно развертывали его потенциал между 0 и −1.3 В; полученные кривые приведены на рис. 3. Они ясно демонстрируют многочисленные катодные пики тока в интервале потенциалов от −0.9 до 1.2 В, которые можно приписать быстро уменьшающейся индуцированной потенциалом десорбции тиомочевины, а пик тока приблизительно при −0.18 В – адсорбции ионов OH−, которая быстро растет при последовательном циклировании потенциала. Циклические вольтамперограммы, полученные на 11-м цикле, практически идентичны тем, что были записаны на поли-Au-электроде с чистой поверхностью. В результате непрерывного циклирования потенциала в не содержащем тиомочевины растворе самоорганизованный монослой тиомочевины непрерывно десорбируется с поверхности электрода на катодном ходе кривых, так что тиомочевина диспергируется в объем раствора. Соответственно, заполнение поверхности самоорганизованным монослоем тиомочевины постепенно уменьшается, и поэтому уже на 11-м цикле наблюдается циклическая вольтамперограмма, характерная для поверхности, практически свободной от самоорганизованного монослоя тиомочевины. Поэтому можно утверждать, что поли-Au-электрод может быть модифицирован с помощью самоорганизованного монослоя тиомочевины и что можно снова получить поли-Au-электрод с чистой поверхностью для дальнейшего использования без какого-нибудь повреждения его поверхности. Такая устойчивость самоорганизованного монослоя тиомочевины на поверхности поли-Au-электрода сильно зависит от использованного интервала потенциалов. В настоящей работе окисление мочевой кислоты исследовали в интервале потенциалов от −0.2 до 0.4 В. Устойчивость самоорганизованного монослоя тиомочевины в этой области потенциалов очень высока, и потому модифицированный электрод с успехом применим для целей окисления мочевой кислоты.
Рис. 3.
Циклические вольтамперограммы, снятые на тиомочевина/поли-Au-электроде в насыщенном азотом 0.1 M растворе NaOH на 11 последовательных циклах (снизу вверх). Пунктирные линии – циклические вольтамперограммы, снятые на поли-Au-электроде с чистой поверхностью в тех же условиях. Скорость развертки потенциала: 0.1 В с–1.
Измерения Eоср в ходе адсорбции тиомочевины
На рис. 4 показано изменение величины Eocp поли-Au-электрода с чистой поверхностью (предварительно обработанного в 0.1 M растворе H2SO4 циклированием потенциала от –0.2 до 1.5 В, а затем до –0.2 В) при инжектировании тиомочевины в насыщенный азотом 0.1 M раствор NaOH. Концентрация приготовленного исходного раствора тиомочевины была такова, что его окончательная концентрация составила 10 мM после инжектирования в ячейку 1 мл приготовленного раствора тиомочевины. Эта инжекция раствора тиомочевины приводит к резкому отрицательному изменению величины Eocp. Этот сдвиг Eocp служит указанием либо на накопление отрицательного заряда на поверхности электрода, либо на удаление положительного заряда с его поверхности [16, 17, 39, 40]. Резкий отрицательный сдвиг Eocp в нашем случае можно объяснить накоплением отрицательного заряда в результате частичной окислительной адсорбции тиомочевины на поверхности поли-Au-электрода [16, 17]. Величина Eocp в ходе адсорбции тиомочевины на поверхности поли-Au-электрода стабилизируется приблизительно через 200 с; это говорит о том, что образование самоорганизованного монослоя тиомочевины на поли-Au-электроде – быстрый процесс.
Усиленное окисление мочевой кислоты
На рис. 5 приведены циклические вольтамперограммы, полученные на (a) тиомочевина/поли-Au-электроде и (б) поли-Au-электроде с чистой поверхностью в насыщенном азотом 0.1 M растворе NaOH, содержащем 2 мM мочевой кислоты. Циклическая вольтамперограмма (б) ясно показывает, что на поли-Au-электроде с чистой поверхностью не происходит окисления мочевой кислоты в исследуемом интервале потенциалов. Наблюдается лишь незначительный пик тока при ~0 В, который обычно называют предволной. Такой пик тока характерен для прочной адсорбции растворенного вещества на поверхности электрода [41]. В наших прежних исследованиях мы описали эту предволну при 0 В, как связанную с адсорбцией мочевой кислоты на поверхности поли-Au-электрода [16, 17]. Вольтамперометрическое окисление мочевой кислоты на поли-Au-электроде с чистой поверхностью протекает очень вяло и заметно лишь при высоких потенциалах, где поверхность электрода покрыта монослоем оксида. Медленная кинетика переноса электрона на поли-Au-электроде с чистой поверхностью, очевидно, связана с загрязнением поверхности электрода в результате прочной адсорбции как собственно мочевой кислоты, так и продуктов ее окисления [16, 17]. В отличие от поли-Au-электрода с чистой поверхностью, на тиомочевина/поли-Au-электроде появляется хорошо выраженный, резкий и интенсивный пик тока при 0.23 В, связанный с окислением мочевой кислоты на этом электроде. Ясно видно, что предволна, появившаяся на поли-Au-электроде с чистой поверхностью из-за адсорбции мочевой кислоты на чистой поверхности, снижается на поли-Au-электроде, покрытом адслоем тиомочевины. Несомненно, это означает, что самоорганизованный монослой тиомочевины весьма эффективно ингибирует адсорбцию мочевой кислоты. Активность такого электрода, бесспорно, возрастает благодаря блокировке адсорбции мочевой кислоты и продуктов ее окисления. Ингибирование адсорбции мочевой кислоты на поверхности поли-Au-электрода, покрытой адслоями серы или иода, уже было продемонстрировано ранее [16, 17].
Влияние скорости развертки потенциала
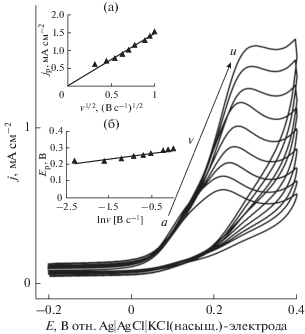
Мы исследовали влияние скорости развертки потенциала на анодный пиковый ток мочевой кислоты на тиомочевина/поли-Au-электроде в насыщенном азотом 0.1 M растворе NaOH, содержащем 2 мM мочевой кислоты, в области скоростей развертки потенциала от 0.1 до 1 В с–1. На врезке (a) к рис. 6 анодный пиковый ток отложен, как функция корня квадратного из скорости развертки потенциала v. В результате для всех исследованных скоростей развертки потенциала получилась прямая (R2 = 0.97), проходящая через начало координат. Это означает, что полная реакция окисления мочевой кислоты контролируется массопереносом мочевой кислоты к поверхности электрода. На врезке (б) к рис. 6 отложены потенциалы пиков тока, как функция ln v. Все точки ложатся на прямую с наклоном 0.0344 В/декада; отсюда был вычислен коэффициент переноса анодной реакции, равный 0.37.
Рис. 6.
Циклические вольтамперограммы, снятые на тиомочевина/поли-Au-электроде в насыщенном азотом 0.1 M растворе NaOH, содержащем 2 мМ мочевой кислоты, при различной скорости развертки потенциала: (а) 0.1, (б) 0.2, (в) 0.3, (г) 0.4, (д) 0.5, (е) 0.6, (ж) 0.8, (з) 0.9 и (и) 1 В с–1 (снизу вверх). Врезка (a): линейный график зависимости плотности анодного пикового тока от корня квадратного из скорости развертки потенциала для окисления мочевой кислоты на тиомочевина/поли-Au-электроде. Врезка (б): график зависимости Ep от ln v. Пиковые токи и потенциалы пиков тока взяты из рис. 6.
Влияние концентрации мочевой кислоты
На рис. 7 представлены типичные циклические вольтамперограммы, снятые на тиомочевина/поли-Au-электроде в насыщенном азотом 0.1 M растворе NaOH, содержащем мочевую кислоту в концентрации 2–26 мM. На врезке к рис. 7 отложена плотность пикового тока как функция концентрации мочевой кислоты. В области концентраций 2–12 мM точки прекрасно ложатся на прямую с коэффициентом корреляции 0.995 и наклоном 0.241 мA cм–2 мM–1, или 0.010 мкA мкM–1. Для концентраций, превышающих 12 мM, пиковые токи постепенно отклоняются от линейности в сторону отрицательных значений и стремятся к насыщению. В табл. 1 проведено сравнение чувствительности данного электрода со значениями, опубликованными в литературе.
Рис. 7.
Типичные циклические вольтамперограммы, снятые на тиомочевина/поли-Au-электроде в насыщенном азотом 0.1 M растворе NaOH, содержащем (а) 2, (б) 4, (в) 6, (г) 8, (д) 10, (е) 12 и (ж) 14 мM мочевой кислоты. Скорость развертки потенциала: 0.1 В с–1.

Таблица 1.
Сравнение чувствительности тиомочевина/поли-Au-электрода с другими электродами
| Электрод | Электролит | Метод | Чувствительность, мкA мкM–1 | Ссылка |
|---|---|---|---|---|
| Тиомочевина/поли-Au- электрод | 0.1 M NaOH | Циклическая вольтамперометрия | 0.010 | Настоящая работа |
| Меркаптобензимидазол-Au | Фосфатный буферный раствор, pH 7.2 | Дифференциальная импульсная вольтамперометрия | 0.015 | [14] |
| Полимерная пленка N,N-диметиланилина/ стеклоуглерод | Фосфатный буферный раствор, pH 7.0 | Квадратно-волновая вольтамперометрия | 0.027 | [15] |
| Никелированный Cu-электрод | 0.02 M NaOH | Циклическая вольтамперометрия | 0.014 | [42] |
| Графен-флавинмононуклеотид /Au-контакт к тыльной поверхности | Фосфатный буферный раствор, pH 7.0 | Циклическая вольтамперометрия | 0.065 | [43] |
| Pt-графен-флавинмононуклеотид/Au-контакт к тыльной поверхности | Фосфатный буферный раствор, pH 7.0 | Циклическая вольтамперометрия | 0.100 | [43] |
| ZnO/графен/электрод, изготовленный методом трафаретной печати | Фосфатный буферный раствор, pH 7.0 | Дифференциальная импульсная вольтамперометрия | 0.033 | [44] |
Амперометрические измерения
Активность тиомочевина/поли-Au-электрода по отношению к усиленному электрохимическому окислению мочевой кислоты исследовали амперометрическим методом. Снимали амперограммы на поли-Au-электроде с чистой поверхностью и на тиомочевина/поли-Au-электроде в насыщенном азотом 0.1 M растворе NaOH, содержащем 2 мM мочевой кислоты, меняя потенциал ступенчатым образом от 0 до 0.25 В. Амперограммы, снятые на тиомочевина/поли-Au-электроде, ясно демонстрируют более высокие токи окисления мочевой кислоты (кривая б на рис. 8) по сравнению с поли-Au-электродом с чистой поверхностью (кривая а на рис. 8). Это наблюдение хорошо коррелирует с вольтамперометрическими измерениями. Полученный результат показывает, что создание самоорганизованного монослоя тиомочевины на поверхности поли-Au-электрода существенно повышает активность поли-Au-электрода по отношению к электрохимическому окислению мочевой кислоты в щелочных средах путем ингибирования вредоносной адсорбции мочевой кислоты.
Одновременное окисление аскорбиновой кислоты, допамина и мочевой кислоты
На рис. 9 показаны циклические вольтамперограммы, снятые на (a) тиомочевина/поли-Au-электроде и (б) поли-Au-электроде с чистой поверхностью в насыщенном азотом 0.1 M растворе NaOH, содержащем по 2 мM аскорбиновой кислоты, допамина и мочевой кислоты. Окисление этой смеси аскорбиновой кислоты, допамина и мочевой кислоты на поли-Au-электроде с чистой поверхностью протекает весьма вяло, причем пики тока индивидуальных веществ оказываются неразличимы. Эти соединения не претерпевают существенного электрохимического окисления, так как поверхность электрода загрязнена в результате адсорбции мочевой кислоты [14, 15]. Напротив, окисление аскорбиновой кислоты, допамина и мочевой кислоты на тиомочевина/поли-Au-электроде протекает с хорошо выраженными и ясно разделяющимися пиками тока индивидуальных веществ. Поэтому этот электрод хорошо приспособлен для одновременного определения электроактивных веществ в их смесях. Глюкоза не взаимодействует с процессом окисления мочевой кислоты в щелочной среде на тиомочевина/поли-Au-электроде.
ЗАКЛЮЧЕНИЕ
В настоящей работе описан простой способ ex situ получения самоорганизованного монослоя тиомочевины на поверхности поли-Au-электрода и его применение в усиленном электрохимическом окислении мочевой кислоты в щелочных средах. В присутствии самоорганизованного монослоя тиомочевины эффективно ингибируется адсорбция мочевой кислоты и продуктов ее окисления. В отличие от поли-Au-электрода с чистой поверхностью, на тиомочевина/поли-Au-электроде электрохимическое окисление мочевой кислоты протекает при более низком перенапряжении и дает резко выраженный интенсивный пик тока. К тому же вольтамперометрический отклик окисления мочевой кислоты на изготовленном нами электроде оказался в высшей степени воспроизводимым. Амперометрические измерения окисления мочевой кислоты также продемонстрировали бóльшую чувствительность тиомочевина/поли-Au-электрода. На этом электроде исследовано совместное окисление мочевой кислоты, аскорбиновой кислоты и допамина в единой смеси, с хорошим разрешением пиков тока индивидуальных компонентов. Таким образом, настоящее исследование может иметь важное применение при определении мочевой кислоты.
Список литературы
Lin, K.C., Lin, H.Y., and Chou, P., The interaction between uric acid level and other risk factors on the development of gout among asymptomatic hyperuricemic men in a prospective study, J. Rheumatol., 2001, vol. 27, p. 1501.
Johnson, R.J., Kang, D.-H., Feig, D., and Kivlighn, S., Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension, 2003, vol. 41, p. 1183.
Bos, M.J., Koudstaal, P.J., and Hofman, A., Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study, Stroke, 2006, vol. 37, p. 1503.
Yan J., Liu, S., and Zhang, Z., Simultaneous electrochemical detection of ascorbic acid, dopamine and uric acid based on graphene anchored with Pd−Pt nanoparticles, Colloids Surf. B: Biointerfaces, 2013, vol. 111, p. 392.
Zhao, D., Yu, G., Tian, K., and Xu, C., A highly sensitive and stable electrochemical sensor for simultaneous detection towards ascorbic acid, dopamine, and uric acid based on the hierarchical nanoporous PtTi alloy, Biosens. Bioelectron., 2016, vol. 82, p. 119.
Luping, S., Hongji, L., and Mingji, L., Simultaneous determination of ascorbic acid, dopamine, uric acid, tryptophan, and nitrite on a novel carbon electrode, J. Electroanal. Chem., 2016, vol. 783, p. 167.
Lavanya, N., Fazio, E., and Neri, F., Electrochemical sensor for simultaneous determination of ascorbic acid, uric acid and folic acid based on Mn–SnO2 nanoparticles modified glassy carbon electrode, J. Electroanal. Chem., 2016, vol. 770, p. 23.
Anju, J., Wolfgang, S., and Tharamani, N.C., Mesoporous nitrogen containing carbon materialsfor the simultaneous detection of ascorbic acid, dopamine and uric acid, Sens. Actuators B:, 2016, vol. 230, p. 544.
Qing, Z., Jing, B., and Danqun, H., 3D Graphene hydrogel-gold nanoparticles nanocomposite modified glassy carbon electrode for the simultaneous determination of ascorbic acid, dopamine and uric acid, Sens. Actuators B, 2017, vol. 238, p. 1316.
Eser, E., Şerife, K., Derya, K.Z., and Bülent, Z., Simultaneous electrochemical determination of ascorbic acid and uric acid using poly(glyoxal-bis(2-hydroxyanil)) modified glassy carbon electrode, Sens. Actuators B, 2016, vol. 224, p. 55.
Qin, Q., Xue, B., and Zulin, H., Electropolymerization of a conductive cyclodextrin polymer on reduced graphene oxide modified screen-printed electrode for simultaneous determination of ascorbic acid, dopamine and uric acid, J. Electroanal. Chem., 2016, vol. 782, p. 50.
Kumar, S.P., Manjunatha, R., Venkatesha, T.V., and Suresh, G.S., Polystyrene sulphonate wrapped multiwalled carbon nanotubes modified graphite electrode for simultaneous determination of ascorbic acid, dopamine and uric acid, Russ. J. Electrochem., 2013, vol. 49, p. 299.
Ma, X., Chao, M., and Chen, M., Simultaneous electrochemical determination of norepinephrine, ascorbic acid and uric acid using a graphene modified glassy carbon electrode, Russ. J. Electrochem., 2014, vol. 50, p. 154.
Retna Raj C. and Ohsaka, T., Voltammetric detection of uric acid in the presence of ascorbic acid at a gold electrode modified with a self-assembled monolayer of heteroaromatic thiol, J. Electroanal. Chem., 2003, vol. 540, p. 69.
Protiva, R.R., Takeyoshi, O., and Ohsaka, T., Simultaneous electrochemical detection of uric acid and ascorbic acid at a poly(N,N-dimethylaniline) film-coated GC electrode, J. Electroanal. Chem., 2004, vol. 561, p. 75.
Miah, Md.R., Masud, J., and Ohsaka, T., In situ fabricated iodine-adlayer assisted selective electrooxidation of uric acid in alkaline media, Electrochim. Acta, 2008, vol. 54, p. 316.
Miah, Md.R., Alam, M.T., and Ohsaka, T., Sulfur-adlayer-coated gold electrode for the in vitro electrochemical detection of uric acid in urine, Anal. Chim. Acta, 2010, vol. 669, p. 75.
Emad, A.K. and Aysha, A.A., Electrochemical oxidation of dopamine and ascorbic acid at a palladium electrode modified with in situ fabricated iodine-adlayer in alkaline solution, Talanta, 2010, vol. 80, p. 1919.
Raj, C.R., Kitamura, F., and Ohsaka, T., Square wave voltammetric sensing of uric acid using the self-assembly of mercaptobenzimidazole, Analyst, 2002, vol. 9, p. 1155.
Liang, W., Jun, Y.B., and Peng, F.H., Selective determination of uric acid in the presence of ascorbic acid using a penicillamine self-assembled gold electrode, Microchim. Acta, 2007, vol. 158, p. 73.
Jie, Z. and Guofeng, C., Study on Adsorption and Complexation Behavior of Thiourea on Copper Surface, Int. J. Electrochem. Sci., 2011, vol. 6, p. 4048.
Mouang, M. and Berçot, P., Electrochemical Analysis of Thiourea on Platinum in Non-Aqueous Electrolyte, Int. J. Electrochem. Sci., 2011, vol. 6, p. 1007.
Vitali, G., Heili, K., Silvar, K., and Enn, L., Adsorption of thiourea on Bi(1 1 1) electrode surface, J. Electroanal. Chem., 2014, vol. 712, p. 103.
Gonzalo, G., Vicente, A.M., and Gabriela, I.L., Study of thiourea adsorption onto polycrystalline gold electrodes, Electrochim. Acta, 2003, vol. 48, p. 1273.
Magali, Q., Fabrice, L., and Laurence, R., Adsorption of thiourea on polycrystalline platinum: Influence on electrodeposition of copper, Surf. Coat. Technol., 2010, vol. 204, p. 3108.
Patrito, E.M., Cometto, F.P., and Paredes-Olivera, P., Quantum Mechanical Investigation of Thiourea Adsorption on Ag(111) Considering Electric Field and Solvent Effects, J. Phys. Chem. B, 2004, vol. 108, p. 15755.
Ulman, A., An introduction to Ultrathin Organic Films from Langmuir-Blodgett to Self-Assembly, New York: Academic, 1991.
Swalen, J.D., Allara, D.L., and Andrade, J.D., Molecular monolayers and films. A panel report for the Materials Sciences Division of the Department of Energy, Langmuir, 1987, vol. 3, p. 932.
Gonzalez-Granados, Z., Sa’nchez-Obrero, G., and Madueno, R., Formation of mixed monolayers from 11-mercaptoundecanoic acid and octanethiol on Au(111) single crystal electrode under electrochemical control, J. Phys. Chem. C., 2013, vol. 117, p. 24307.
Ahmad, A. and Moore, E., Electrochemical immuneosensor modified with self-assembled monolayer of 11-mercaptoundecanoic acid on gold electrodes for detection of benzo[a]pyrene in water, Analyst, 2012, vol. 137, p. 5839.
Warakorn, L., Proespichaya, K., and Bo, M.A., comparative study of capacitive immunosensors based on self-assembled monolayers formed from thiourea, thioctic acid, and 3-mercaptopropionic acid, Biosens. Bioelectron., 2006, vol. 22, p. 233.
Xinxin, X., Jens, U., Hui, L., Meng’en, W., and Jingdong, Z., Nanoporous gold assembly of glucose oxidase for electrochemical biosensing, Electrochim. Acta, 2014, vol. 130, p. 559.
Mohamed, S.E.-D. and Ohsaka, T., Molecular-level design of binary self-assembled monolayers on polycrystalline gold electrodes, Electrochim. Acta, 2004, vol. 49, p. 2189.
El-deab, M.S., Arihara, K., and Ohsaka, T., Fabrication of Au(111)-like polycrystalline gold electrodes and their applications to oxygen reduction J. Elctrochem. Soc., 2004, vol. 151, p. E213.
Miah, Md.R. and Ohsaka, T., Electrochemical oxidation hydrogen peroxide at a bromine adatom-modified gold electrode in alkaline media, Electrochim. Acta, 2009, vol. 54, p. 1570.
Chang, C.C., Yau, S.L., Tu, J.W., and Yang, J.S., Examination of the electrified interfaces of Au(111) in 0.1 M HClO4 containing organic iodide compounds with cyclic voltammetry and in situ scanning tunneling microscopy, Surf. Sci., 2003, vol. 523, p. 59.
Hongguang, Z., Ian, M.R., and Steve, R.L.B., Electrochemical Oxidation of Gold and Thiourea in AcidicThiourea Solutions, J. Electrochem. Soc., 2001, vol. 148, p. D146.
Miah, Md.R. and Ohsaka, T., Cathodic Detection of H2O2 Using Iodide-Modified Gold Electrode in Alkaline Media, Anal. Chem., 2006, vol. 78, p. 1200.
Zhong, C.-J., Woods, N.T., Dawson, G.B., and Porter, M.D., Formation of thiol-based monolayers on gold: implications from open circuit potential measurements, Electrochem. Commun., 1999, vol. 1, p. 17.
Cohen-Atiya, M. and Mandler, D., Studying thiol adsorption on Au, Ag and Hg surfaces by potentiometric measurements, J. Electroanal. Chem., 2003, vol. 550–551, p. 267.
Bard, A.J. and Faulkner, L.R., Electrochemical Methods: Fundamental and Applications, New York: Wiley, 2001 (Chapters 3 and 14).
Riyanto and Imaylina R., Preparation and Application of Nickel Plating on Copper Electrode (NPCE) for Uric Acid Analysis in Human Urine Using Cyclic Voltammetry, Int. J. Electrochem. Sci., 2019, vol. 14, p. 2290.
Abellán-Llobregat, A., Ayán-Varela, M., Vidal, L., Paredes, J.I., Villar-Rodil, S., Canals, A., and Morallón, E., Flavin mononucleotide-exfoliated graphene flakes as electrodes for the electrochemical determination of uric acid in the presence of ascorbic acid, J. Electroanal. Chem., 2016, vol. 783, p. 41.
Rezaei, R., Foroughi, M.M., Beitollahi, H., and Alizadeh, R., Electrochemical Sensing of Uric Acid Using a ZnO/Graphene Nanocomposite Modified Graphite Screen Printed, Russ. J. Electrochem. 2018, vol. 54, p. 860.
Дополнительные материалы отсутствуют.