Электрохимия, 2020, T. 56, № 7, стр. 666-669
Электрохимическое осаждение сплава NiFe при температуре 70°С
Р. Д. Тихонов *
Государственный научный центр России федеральное государственное бюджетное научное учреждение
“Научно-производственный комплекс “Технологический центр”
Зеленоград, Москва, Россия
* E-mail: R.Tikhonov@tcen.ru
Поступила в редакцию 29.03.2019
После доработки 08.11.2019
Принята к публикации 17.12.2019
Аннотация
Нагрев хлоридного электролита до температуры 70°С исключает аномальное соосаждение компонентов сплава NiFe в результате изменения природы разряжающихся ионов железа с однозарядных (Fe2+Cl–)+ на двухзарядные. Хлоридный электролит с коррекцией рН соляной кислотой обеспечивает электрохимическое осаждение пермаллоя при соотношении концентраций cNi/cFe = 4.26. Обычное (не аномальное) совместное осаждение никеля и железа наблюдается также в разбавленных растворах при комнатной температуре в силу их практически полной диссоциации.
ВВЕДЕНИЕ
При получении сплава никель–железо в [1] путем электроосаждения при 24°С, рН 3.1, токе 5, 10, 20 мА/см2 из хлоридного электролита с суммарной концентрацией хлористых железа(II) и никеля c(Ni + Fe) = 1 моль/л и различных отношениях cFe/c(Fe + Ni) происходило преимущественное осаждение железа. Содержание железа в сплаве зависело от плотности тока. Аномальность осаждения, т.е. меньшая скорость осаждения более благородного никеля по отношению к железу обычно объясняется исходя из концепции влияния гидроксидов железа на осаждение никеля, хотя эта точка зрения, на наш взгляд, не имеет достаточных подтверждений.
В данной работе приведены результаты изучения электрохимического осаждения пермаллоя из хлоридного электролита с молярным отношением Ni/Fe, равным 4.26, при температуре 70°С, соответствующим отношению концентраций никеля к железу в пермаллое.
1. ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
При растворении FeCl2 в воде имеет место гидролиз этой соли [2]:
Аномальность процесса осаждения пермаллоя, т.е. преимущественное выделение железа, рассматривается как результат образования гидроксидных соединений железа, которые, адсорбируясь на поверхности катода, тормозят осаждение никеля. Эта концепция рассматривается как основная, варьируются только детали образования гидроксидов. В работе [3], анализируя растворимость Fe(OH)2 и Ni(OH)2 и константы диссоциации FeOH+ и NiOH+, авторы, однако, приходят к выводу, что механизмы, предполагающие образование тормозящих осаждение никеля веществ, не работают в случае осаждения сплава NiFe.
В работе [4], где рассматриваются ионные равновесия в электролите FeCl2 по результатам термодинамических расчетов констант равновесия, уравнений баланса массы и заряда, и коэффициентов активности было показано следующее. Раствор FeCl2 при комнатной температуре содержит однозарядные ионы (Fe2+Cl–)+, несколько меньшую концентрацию ионов Fe2+, а также незначительные количества нейтральных молекул и ионов (Fe2+OH–)+. Добавление в раствор соляной кислоты смещает равновесие, увеличивая содержание однозарядных ионов (Fe2+Cl–)+, нейтральных молекул FeCl2 и уменьшая количество Fe2+.
При используемой для осаждения пермаллоя концентрации FeCl2 порядка 0.1 М растворы содержат в основном (Fe2+Cl–)+ и несколько меньше Fe2+, причем при добавлении соляной кислоты разница между этими концентрациями увеличивается. Содержание нейтральных молекул FeCl2 и ионов (Fe2+OH–)+ значительно меньше.
При нагреве электролита происходит усиление ионизации, и потому количество ионов (Fe2+Cl–)+, образуемых по первой ступени диссоциации, может стать меньше количества ионов Fe2+. Поэтому можно ожидать, что нагрев электролита до достаточно высокой температуры приведет к практически полной ионизации хлорида железа на Fe2+ и хлорид.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для осаждения пермаллоя состава Ni81Fe19 использован хлоридный электролит, содержащий, г/л: FeCl2 – 11, NiCl2 – 56, борной кислоты H3BO3 – 25, гидрата сахарината натрия C7H4NaNO3S – 3. Добавлением соляной кислоты в электролит регулировалась величина рН в пределах 1.5–3.5. Пермаллой из указанного электролита осаждали в электролитической ванне объемом 2 л с графитовым анодом. Неподвижный катод в виде пластины кремния располагается вертикально. Пленки пермаллоя получали локально через фоторезистивную маску на металлизированной с помощью слоев NiCr, Ni поверхности кремниевой пластины диаметром 100 мм, покрытой слоем SiO2. Электролит нагревали до 60 или 70°С погружным нагревателем и перемешивали магнитной мешалкой. Катодную плотность тока регулировали в пределах 10–30 мА/см2.
Установлено, что повышение температуры хлоридного электролита от 60 до 70°С улучшало смачиваемость катода раствором, адгезию покрытия к кремниевой основе и уменьшало внутренние механические напряжения в слое осадка сплава. Соляная кислота стабилизирует электролит и очищает его от шлама, сахарин снижает напряжения и обеспечивает получение мелкодисперсной структуры пленок. Борная кислота служит комплексообразователем, стабилизирует рН и повышает катодный выход по току. Данная технология обеспечивает локальное получение пленок пермаллоя толщиной до 40 мкм без механических напряжений и с хорошей адгезией на кремниевых пластинах. Очистка электролита от гидроксидов железа и стабилизация соляной кислотой позволили получить состав пленки, близкий по соотношению компонентов к таковому в растворе.
Толщина пленок измерялась с помощью микроинтерферометра анализатора микросистем MSA-500. Исследование состава пленок проведено с помощью энергодисперсионного рентгеновского микроанализатора Philips XL 40. Намагниченность пленок на пластинах определялась по потоку магнитного поля на анализаторе магнитных свойств пленок МЕSA-200.
В работе [5] показано, что при электрохимическом осаждении пермаллоя состав сильно зависит от температуры электролита.
В данной работе получена зависимость состава пленок от температуры для электролита с составом, г/л: FeCl2 – 11; NiCl2 – 56; Н3ВО3 – 25; C7H5NaNO3S – 1.5, HCl – 2.7 мл/л. По данным рис. 1 видно, что состав сплава определялся только температурой и не зависел от плотности тока и порядка проведения процессов. В пленках пермаллоя, осажденных при 60°С, содержалось 39.4% железа, в то время как в случае температуры 70°С – 19.2% железа, т.е. примерно вдвое меньше.
Рис. 1.
Зависимость содержания железа Fe в пленках пермаллоя от величины тока I в хлоридном электролите c cNi/cFe = 4.26 при температуре 60 и 70°С, рН 1.9.
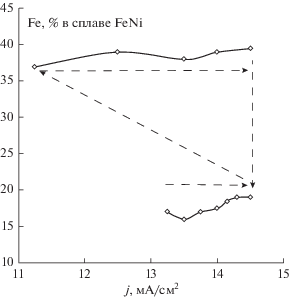
Такое изменение содержания железа можно связать с тем, что, в соответствии с вышесказанным, при повышении температуры происходит изменение природы разряжающегося иона железа: если при 60°С это ион (Fe2+Cl–)+, то при более высокой температуре это ион Fe2+. В этом случае аномального осаждения не наблюдается, а имеет место преимущественное выделение никеля.
Содержание железа в пленках сплава NiFe при электрохимическом осаждении из хлоридного электролита с переменной концентрацией NiCl2 0.048–0.064 М, при постоянной концентрации FeCl2 0.015 М представлено на рис. 2. Анализ результатов показывает, что при содержании никеля и железа в электролите, соответствующем соотношению никеля и железа 4.26, происходит преимущественное осаждение никеля.
Рис. 2.
Зависимость содержания железа в осадке при разбавлении электролита с концентрацией NiCl2 0.064 М, FeCl2 0.015 М.

Измерения состава сплавов, получаемых из сильно разбавленного (т.е. также полностью диссоциированного) раствора при комнатной температуре, подтверждают этот вывод.
Содержание железа в сплаве, как и следовало ожидать, уменьшается при простом разбавлении раствора, как показано на рис. 3. Из зависимости содержания железа в пленках пермаллоя от разбавления хлоридного электролита следует, что пленки пермаллоя с составом Fe19Ni81 получаются при электрохимическом осаждении из простого хлоридного электролита с отношением СNi/СFe = 4.26 и концентрации Fe+2 – 0.004 М. Следовательно, при этих концентрациях хлоридов никеля и железа в электролите заряды ионов никеля и железа Ni2+, (Fe+3Cl–)2+, Fe+2 имеют при разряде на катоде одинаковую величину два.
Рис. 3.
Содержание железа в пленках сплава NiFe при электрохимическом осаждении из хлоридного электролита с концентрацией NiCl2 0.048–0.064 М, FeCl2 0.015 М.

Разбавление электролита позволяет изменить температуру процесса на комнатную. Поскольку нас интересовало получение пленок пермаллоя, содержащих 19% железа, то была получена зависимость температуры растворов с различным содержанием железа, обеспечивающая получение таких осадков.
На рис. 4 представлена для выбранных концентраций атомов железа в электролите корреляция температуры электролита для получения пленок пермаллоя, содержащих 19% железа.
Рис. 4.
Электрохимическое осаждение пленок сплава FeNi, содержащих 19% железа из электролитов с отношением Ni/Fe = 4.26 при концентрации атомов железа Fe: (1) 0.0037 М при температуре 21°С, (2) 0.034 М при температуре 65°С, (3) 0.11 М при температуре 70°С, (4) 0.22 М при температуре 60°С.

Итак, при проведении процесса осаждении пермаллоя при температуре 70°С или в разбавленных растворах аномальное осаждение не имеет места, и наблюдается преимущественное выделение никеля, что позволяет получить сплав необходимого состава из электролита с близким соотношением компонентов.
В разбавленных растворах электролита для осаждения сплава повышается не только электролитическая диссоциация солей, но также увеличивается содержание двухзарядных ионов по сравнению с однозарядными ионами. В разбавленных простых хлоридных электролитах для осаждения сплава NiFe с отношением cNi/cFe = = 4.26 подтверждается влияние заряда ионов железа на состав пленок пермаллоя.
ЗАКЛЮЧЕНИЕ
Аномальность осаждения, т.е. меньшая скорость осаждения более благородного никеля по отношению к железу обычно объясняется исходя из концепции влияния гидроксидов железа на осаждение никеля. В данной работе приведены результаты изучения электрохимического осаждения пермаллоя из хлоридного электролита с молярным отношением Ni/Fe, равным 4.26, при температуре 70°С, соответствующим отношению концентраций никеля к железу в пермаллое.
Термодинамические расчеты ионных равновесий в электролите FeCl2 показывают, что при комнатной температуре преобладают однозарядные ионы (Fe2+Cl–)+ по сравнению с двухзарядными ионами Fe2+.
При повышении температуры электролита происходит усиление ионизации, и потому количество ионов (Fe2+Cl–)+ может стать меньше количества ионов Fe2+. Результаты экспериментов с осаждением сплава Ni81Fe19 из хлоридного электролита показали, что при 60°С преобладает ион (Fe2+Cl–)+, а при температуре 70°С преобладает ион Fe2+. В этом случае аномального осаждения не наблюдается, а имеет место преимущественное выделение никеля.
Измерения состава сплавов, получаемых из сильно разбавленного (т.е. также полностью диссоциированного) раствора при комнатной температуре, подтверждают этот вывод.
Осаждение из электролита соответствует нормальному, общепринятому осаждению сплава никель–железо [6–8].
Нормальное осаждение за счет температурного режима 70°С и состава хлоридного электролита с соотношением концентраций cNi/cFe = 4.26 проведено впервые, что не делал никто из исследователей, как это видно из публикаций последнего времени [9–11].
Список литературы
Коровин, Н.В. О катодном процессе при электроосаждении сплава железо-никель. Журн. неорган. химии. 1957. Т. 2. Вып. 9. С. 2259.
Коровин, Н.В. Общая химия. М. Высш. шк.1998. С. 559.
Nakano, H., Matsuno, M., Oue, S., Yano, M., Kobayashi, Sh., and Fukushima, H., Mechanism of Anomalous Type Electrodeposition of Fe–Ni Alloys from Sulfate Solutions, The Japan Institute of Metals, Materials Transactions, 2004, vol. 45, no. 11, p. 3130.
Man-Seung, Lee, Use of the Bromley Equation for the Analysis of Ionic Equilibria in Mixed Ferric and Ferrous Chloride Solutions at 25°C, Metallurgical and materials transections B, 2006, vol. 37B, p. 173.
Тихонов, Р.Д. Электроосаждение сплава NiFe для производства интегральных микросхем. Гальванотехника и обработка поверхности. 2015. № 4. С. 13.
Tikhonov, R.D., Normal Electrochemical Deposition of NiFe Films, Advances in Research, 2017, vol. 11, no. 2, p. 1.
Тихонов, Р.Д., Поломошнов, С.А., Костюк, Д.В. Спектрофотометрический контроль хлоридного электролита для электрохимического осаждения пермаллоя. Изв. вузов. Электроника. 2019. Т. 24. № 2. С. 129.
Tikhonov, Robert, Congruent electrochemical deposition of NiFe alloy, Lambert Academic Publ., 2019, p. 193.
Schiavone, G., Murray, J., Perry, R., Mount, A.R., Marc, P., Desmulliez, Y., Tang, F., and Walton, A.J., Integration of Electrodeposited Ni-Fe in MEMS with Low-Temperature Deposition and Etch Processes, Materials (Basel), 2017, vol. 10, no. 3, p. 323. Published online 2017 Mar 22. https://doi.org/10.3390/ma10030323
Wang, F., Li, L., Qiu, Sh., and Wang, H., Ferronickel preparation using Ni-Fe co-deposition process, J. Central South Univer., 26 January 2017.
Torabinejad, V., Aliofkhazraei, M., S. Assareh, Allahyarzadeh, M.H., and Rouhaghdam S., Electrodeposition of Ni–Fe alloys, composites, and nano coatings—A review, J. Alloys and Compounds, 2017, no. 691, p. 841.
Дополнительные материалы отсутствуют.


