Электрохимия, 2020, T. 56, № 8, стр. 737-748
Электрохимическое исследование литий-ионного аккумулятора, содержащего катодные материалы LiCo0.8Ni0.2O2, Li2MnO3, LiNiO2
М. Монаджеми a, b, *, Ф. Моллаамин b, П. Т. Ту b, М. Отади a, А. Алихоссейни a, Д. Т. М. Дунг b, Д. М. Чиен b
a Отделение химической технологии, Центральный Тегеранский филиал, Исламский Университет Азад
Тегеран, Иран
b Институт нанотехнологии (ИН), Вьетнамский национальный университет Хошимин (ВНУ ХШМ)
Хошимин, Вьетнам
* E-mail: Maj.monajjemi@iauctb.ac.ir
Поступила в редакцию 10.11.2018
После доработки 27.05.2019
Принята к публикации 29.07.2019
Аннотация
Систему (1 – n – m)LiCo0.8Ni0.2O2 синтезировали золь–гель методом. Стехиометрические количества LiNO3, Mn(Ac)2 ∙ 4H2O, Co(Ac)2 ∙ 4H2O, Ni(NO3)2 ∙ 6H2O были использованы в качестве исходных материалов лития, магния, кобальта и никеля для получения 28 образцов (1 – n – m)LiCo0.8Ni0.2O2, соответственно. Показано, что “Li1.333Ni0.4Co0.267Mn0.333O2” является лучшим составом для катодного материала среди этих составов. Очевидно, что используемое количество кобальта в этом образце ниже по сравнению с LiCoO2, что является преимуществом с точки зрения проблемы стоимости и токсичности. Зарядно-разрядные характеристики упомянутых катодных материалов были исследованы путем проведения циклических испытаний в диапазоне 2.2–4.5 В. Наши результаты подтвердили, что эти системы могут помочь устранить такие недостатки кобальта, как его стоимость и токсичность, при этом рабочие характеристики таких систем аналогичны катодному материалу LiCoO2.
ВВЕДЕНИЕ
Переходные элементы катодных материалов, включая никель, марганец, кобальт (НМК), являются особенными металлами для литий-ионных аккумуляторов (ЛИА) из-за их потенциалов, обеспечивающих работу при высоких напряжениях и накопление большого количества энергии в небольшом объеме. Хотя Ni в НМК дает высокую способность к накоплению энергии, он также пассивен и нестабилен, со склонностью к разрушительным реакциям с электролитом. Как видно из табл. 1, НМК ЛИА имеют как преимущества, так и недостатки [1–5]. Основным недостатком кобальта является его стоимость и токсичность, и как правило его производство в два раза дороже, чем никеля. Это один из важных факторов при рассмотрении вопроса об использовании его в массовых потребительских товарах, поскольку любая дополнительная стоимость является основной проблемой. Фактор безопасности также имеет решающее значение для литий-ионных аккумуляторов, эта проблема проявляется в аккумуляторах большого размера по сравнению с аккумуляторами небольшого размера, то есть аккумуляторы для электромобиля имеют больший риск возгорания по сравнению с аккумуляторами для сотовых телефонов. Когда в качестве катодного материала используется смешанный твердый раствор, взрыв аккумуляторов можно контролировать, особенно при легировании других элементов, таких как Mg и Al. Кроме того, LiNixCoyMnzO2 безопасен для окружающей среды по сравнению с изолированным катодом, таким как LiCoO2 [4, 5].
Таблица 1.
Характеристики коммерческих катодных материалов для литий-ионных аккумуляторов [5]
| Материал | Потенциал относительно Li/Li+ | Емкость, мА ч г–1 | Энергия, Вт ч кг–1 | Преимущества | Недостатки |
|---|---|---|---|---|---|
| LiCoO2 | 3.9 | 140 | 546 | Низкие | Высокие |
| НКА (никель, кобальт, алюминий) | 3.8 | 180–200 | 680–760 | Медленная реакция с электролитом Высокая емкость, высокое напряжение Отличная производительность |
Высокая стоимость Ni и Co |
| НМК (никель, марганец, кобальт) | 3.8 | 160–170 | 610–650 | Высокая емкость, высокое рабочее напряжение Медленная реакция с электролитом Невысокая безопасность (выделение кислорода) |
Высокая стоимость Ni и Co |
| LiMn2O4 (ЛМО) | 4.1 | 100–120 | 410–492 | Низкая стоимость, невысокая безопасность (выделение кислорода), отличная способность работать при высоких скоростях заряда–разряда, высокое рабочее напряжение | Низкая емкость, влияющая на срок службы при циклировании |
| LiFePO4 (LFP) | 3.45 | 150–170 | 518–587 | Низкая стоимость, отличная способность работать при высоких скоростях заряда–разряда, медленная реакция с электролитом, отличная безопасность (выделение кислорода) | Низкое
напряжение Низкая емкость |
Цель данного исследования заключается в том, чтобы найти тройной твердый раствор катодного материала на основе литированного НМК, который является выгодной заменой дорогого и токсичного LiCoO2. Поэтому была рассмотрена комбинация тройной диаграммы состава, включающей (1 – x – y)LiNi0.7Co0.3O2, xLi2MnO3 и yLiCoO2. ЛИА на основе НМК оказались наиболее интересными для ученых в целях замены LiCoO2, о чем впервые сообщили Rossen et al. в 1992 г. [6] для состава LiNi0.5Mn0.5O2.
Подобную статье Россена [6] работу опубликовали в 1998 г. Saphr et al. [7], которые исследовали электрохимическое поведение и выяснили, что Ni в качестве активного иона и Mn присутствовали в степени окислении “+2” и “+4”, а не “+3”. Они проявляются при температуре 750°C, при этом наблюдается большое снижение емкости: от 150 до 125 мА ч/г после 25 циклов и до 75 мА ч/г после 50 циклов. Никель, который имеет степени окисления от +2 до +4, является активным материалом в составе этого катода, в то время как степень окисления марганца равна +4, и отсутствует искажение Яна–Теллера для марганца со степенью окисления +3 (Mn+3). Makimura и соавторы [8] представили начальный разряд около 150.5 мА ч/г в течение 30 циклов при 4.35 В, и снова в 2003 г. [9] их результаты показали 200 мА ч/г обратимой емкости LiNi1/2Mn1/2O2 для напряжения 2.5–4.5 В после 30 циклов [9].
Очевидно, что смешение в правильных мольных долях различных переходных элементов [8, 9] для получения преимуществ по эффективности каждого привело к открытию материалов такого типа. Поэтому эти материалы относятся к классу Li(Ni(1 –x–y)MnxCoy)O2, о которых впервые написали в 1999 и 2000 гг. Liu и Yoshio соответственно [10, 11]. Они показали, что увеличение кобальта стабилизирует состав, блокирует поступление Ni в слои лития. Между тем никель и марганец обеспечат структурную стабильность и высокую емкость соответственно. Поскольку слишком большое количество кобальта вызывает снижение емкости, а большое количество никеля и марганца создает проблемы при смешивании катионов и шпинельных структур, то смешивание этих элементов должно быть оптимизировано в подходящих мольных долях.
Makimura и его коллеги в 2001 г. синтезировали слоистое соединение LiNi1/3Mn1/3Co1/3O2 [12] и показали, что этот катод имеет обратимую разрядную емкость около 205 мА ч/г в диапазоне 2.6–4.5 В, включая способность работать на больших скоростях и термическую стабильность.
Для соответствующей стехиометрии Li(NixCo(1 – 2x)Mnx)O2, x = 1/3, средние степени окисления должны составлять +3, например Mn+4, Co+3 и Ni+2, при этом электрохимическая реакция будет протекать в диапазоне потенциалов 2.5 до 4.4 В относительно литиевого электрода сравнения (посредством реакции двухэлектронного переноса между Co+3/Co+4 и Ni+2/ Ni+4) [13]. В дополнение к такому электрохимическому явлению, было показано еще несколько исследований катодов на основе LiNi0.4Mn0.4Co0.2O2 [14], Li(Ni0.8Co0.2)O2 и LiNi0.8Co0.15Al0.05O2 [15]. Хотя способность работать при высоких скоростях заряда–разряда этого материала меньше, чем у LiCoO2, термическая стабильность намного лучше.
Данная работа сосредоточена на различных составах двойных и тройных твердых растворов, содержащих Li2MnO3, LiNiO2 и (1 – n – m)LiCo0.8Ni0.2O2 (схема 1 ). В настоящее время Li2MnO3 отличается своей подходящей емкостью, лучшей безопасностью, нетоксичностью и меньшей стоимостью по сравнению с LiCoO2 [16].
Схема 1 . Двойная и тройная диаграмма составов (1 – n – m) LiCo0.8Ni0.2O2, mLi2MnO3 и nLiNiO2.
Li2MnO3, который можно представить как Li(Li1/3Mn2/3)O2, имеет структуру, аналогичную LiCoO22, но в слоях переходных металлов наблюдается сверхрешеточное упорядочение Li+ и Mn4+. Li2MnO3 имеет слоистую структуру, которая состоит из чередующихся ионов лития и марганца (в соотношении 1 : 2 соответственно), и эти слои разделены слоями, состоящими из атомов кислорода.
Поскольку марганец присутствует в степени окисления +4, дальнейшее окисление при низких напряжениях невозможно, поэтому Li2MnO3 может быть электрохимически неактивным, тогда как при более высоких напряжениях, т.е. больше 4.4 В, ионы лития будут экстрагироваться из этого материала (с образованием Li2O) сквозь слои MnO2. Между тем, упомянутый механизм является односторонним и необратимым, поэтому только один ион Li+ может вернуться во время разряда в структуру LiMnO2, которая является активным материалом. Дополнительный атом лития, который необратимо извлекается в процессе заряда, приписывают более высокой емкости. Использование катодов с Li2MnO3 важно из-за упрощения механизма интеркаляции, а также обеспечения структурной стабильности во время этой интеркаляции [17].
Твердые растворы были в основном выбраны с точки зрения получения катодной композиции с превосходной эффективностью циклируемости, емкости и структурной стабильности, а также с низкими затратами. В нескольких работах твердые растворы были использованы в качестве катодного материала, включая как двойные, так и тройные системы [18, 19]. Твердые растворы, содержащие Li2MnO3, были сочтены пригодными для двух основных целей: одной – извлечения двух ионов Li+ при напряжениях больше 4.4 В, что дает дополнительное количество начальных зарядных емкостей, и второй – того факта, что MnO2 при извлечении лития обеспечивает хорошую структурную стабильность в этом составе.
Примечательно, что исходные кристаллические структуры катодного материала не только определяют начальную характеристическую емкость, но и подразумевают стабильность. Состав делитированных катодных материалов является важным для любого увеличения срока службы при циклировании. Во время экстракции ионов лития никель и кобальт будут окисляться, изменяя степени окисления от +3 до +4, поэтому объем кристаллической ячейки будет меняться. Следовательно, в композиционной системе (1 ‒ n – m)LiCo0.8Ni0.2O2 (табл. 2) высокое содержание никеля обычно дает более высокие начальные удельные емкости, в то время как кобальт улучшает структурную стабильность и циклируемость. Ni не только значительно улучшает сохранение емкости [20], но также способствует диффузии Li+ в составе (1 – n – m)LiCo0.8Ni0.2O2, mLi2MnO3, nLiNiO2. Кроме того, при этом подавляются фазовые переходы, которые обычно происходят в LiNiO2 во время циклирования, и улучшается обратимость заряда–разряда соответствующего состава.
Таблица 2.
28 различных точек состава в соответствии с использованием правила рычага, стехиометрических весов и мольных долей треугольной диаграммы
| Образец | Состав | Образец | Состав |
|---|---|---|---|
| 1 | LiNi0.2Co0.8O2 | 15 | LiNi0.733Co0.267O2 |
| 2 | Li1.167Ni0.167Co0.666Mn0.167O2 | 16 | Li1.835Ni0.033Co0.132Mn0.835O2 |
| 3 | LiNi0.334Co0.666O2 | 17 | Li1.667Ni0.2Co0.132Mn0.667O2 |
| 4 | Li1.333Ni0.133Co0.533Mn0.333O2 | 18 | Li1.5Ni0.368Co0.132Mn0.5O2 |
| 5 | Li1.167Ni0.3Co0.533Mn0.167O2 | 19 | Li1.333Ni0.535Co0.132Mn0.333O2 |
| 6 | LiNi0.467Co0.533O2 | 20 | Li1.167Ni0.7Co0.132Mn0.167O2 |
| 7 | Li1.5Ni0.1Co0.4Mn0.5O2 | 21 | LiNi0.868Co0.132O2 |
| 8 | Li1.333Ni0.267Co0.4Mn0.333O2 | 22 | Li2MnO3 |
| 9 | Li1.167Ni0.433Co0.4Mn0.167O2 | 23 | Li1.833Ni0.167Mn0.833O2 |
| 10 | Li Ni0.6Co0.4O2 | 24 | Li1.667Ni0.333Mn0.667O2 |
| 11 | Li1.667Ni0.o66Co0.267Mn0.667O2 | 25 | Li1.5Ni0.5Mn0.5O2 |
| 12 | Li1.5Ni0.233Co0.267Mn0.5O2 | 26 | Li1.333Ni0.667Mn0.333O2 |
| 13 | Li1.333Ni0.4Co0.267Mn0.333O2 | 27 | Li1.167Ni0.833Mn0.167O2 |
| 14 | Li1.167Ni0.567Co0.267Mn0.167O2 | 28 | LiNiO2 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Композиты были синтезированы золь–гель методом с помощью простой химической реакции с низкой температурой и высокой степенью гомогенности. Стехиометрические весовые количества LiNO3, Mn(Ac)2 ∙ 4H2O, Co(Ac)2 ⋅ 4H2O, Ni(NO3)2 ⋅ ⋅ 6H2O были использованы в качестве исходных материалов лития, магния, марганца, кобальта и никеля в 28 образцах (1 ‒ n – m)LiCo0.8Ni0.2O2 соответственно. Эти смеси сначала растворяли в 50 мл деионизованной воды, а затем добавляли эквивалентную молярную массу лимонной кислоты (количество лимонной кислоты было равно общему количеству молей Co, Ni и Mn). Все смеси нагревали на водяной бане при 100°С, и в процессе нагревания образовывался прозрачный розовый раствор без каких-либо осадков. Наконец, прозрачный раствор медленно высушили и превращали в гель. Этот раствор непрерывно перемешивали в течение около 20 мин для образования гомогенной гелеобразной смеси, а затем выдерживали на плитке в течение 12–14 ч при температуре около 100°C, чтобы вся дистиллированная вода испарилась. Обычно для получения правильной фазы ацетату требуются две температуры нагрева (низкая и высокая). Стакан, содержащий гель, затем выдерживали в печи и нагревали до 400°C в течение 4–6 ч. Первый нагрев осуществляли при низкой температуре. По существу, на этой стадии все присутствующие ацетаты сгорают, но желаемая фаза не образуется. Термообработанные продукты измельчали в агатовой ступке для получения порошков, а затем порошок прокаливали при 750–800°С в течение 8–10 ч. Примечательно, что второй нагрев проводили при столь высоких температурах из-за наличия широкого диапазона материалов, присутствующих в композиции, а также, что более важно, для обеспечения формирования правильной кристаллической структуры. После этого материал, извлеченный из печи, хранили в сухом месте до тех пор, пока из него не изготавливали катоды. Для изготовления катодов полученные продукты сначала смешивали с ацетиленовой сажей и поливинилиденфторидом в N-метилпирролидоне (NMP).
Ацетиленовую сажу добавляли для улучшения электропроводности, а NMP добавляли, главным образом чтобы сохранить целостность смеси. Для систем использовали перчаточный бокс модели kk-011AD (серийный номер: kk-1760) (схема 2 ).
Схема 2 . Перчаточный бокс модели kk-011AD в Институте нанотехнологий, Вьетнамский национальный университет (Хошимин, Вьетнам).
Электрохимические исследования проводили с использованием дисковых ячеек типоразмера CR2032, которые состоят из катода, литиевой фольги в качестве анода. Элементы заряжали и разряжали при комнатной температуре в диапазоне напряжений 2.4–4.6 В (относительно Li/Li+). Циклические вольтамперограммы Li1.333Ni0.4Co0.267Mn0.333O2 были получены с помощью IM6 в диапазоне напряжений 2.4–4.6 В со скоростью сканирования 0.1 мВ с–1. Электрод сравнения и противоэлектрод были изготовлены из металлического лития.
Изготовление катода
Фазовую идентичность и кристаллическую структуру материалов исследовали путем измерения дифракции рентгеновских лучей (Bruker, Германия), а морфологию поверхности наблюдали с помощью сканирующей электронной микроскопии (СЭМ) (схемы 3 и 4). Эти виды исследований были выполнены для проверки состава и анализа морфологии синтезированных образцов. На схемах 3 и 4 изображения морфологии, полученные с помощью СЭМ, представлены для частиц размером от 1 до 10 микрон, что важно для повышения эксплуатационных качеств аккумулятора. Образцы были сделаны по методике изготовления катодов, которая обычно используется в лабораторных испытаниях. Было подтверждено, что ни один из электродов не показал видимых дефектов, таких как трещины, присутствующие на поверхности электрода, и что все они имели одинаковую толщину, а также условия синтеза для всех образцов были одинаковыми. Основываясь на наших предыдущих работах, данные были проанализированы на наномолекулярном уровне [21–25].
Схема 3 . Изображения морфологии, полученные с помощью СЭМ для LiCo0.8Ni0.2O2.
Схема 4 . Изображения морфологии, полученные с помощью СЭМ для Li2MnO3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Это исследование используется для определения наилучших составов катодных материалов, включая системы (1 – n – m)LiCo0.8Ni0.2O2, nLi2MnO3, mLiNiO2 с высокой начальной разрядной емкостью, высокой циклируемостью и низкой стоимостью по сравнению с существующими катодными материалами литий-ионных аккумуляторов. Изначально было выбрано 28 различных точек состава в соответствии с правилом рычага, стехиометрические веса и мольные доли, чтобы найти оптимальный материал с хорошими электрохимическими характеристиками. Эти 28 точек были выделены на фазовой диаграмме треугольника определенной системы (схема 1 и таблицы 2 и 3) и были синтезированы с помощью золь–гель методов. Фотографии сканирующей электронной микроскопии были сделаны для характеризациии приблизительного размера частиц и морфологии поверхности для различных составов, и, как показано на схеме 3 и 4 , материалы LiCo0.8Ni0.2O2 и Li2MnO3, по-видимому, имеют однородное распределение по размерам с субмикронными размерами частиц. Фактически такие частицы этих материалов, синтезированные с помощью золь–гель-методов, могут иметь больше преимуществ для механизма интеркаляции и деинтеркаляции электродов во время процессов заряда–разряда, и могут обеспечить большую емкость.
Таблица 3.
Обзор емкости и циклируемости для 28 образцов системы (1 – n – m)LiCo0.8Ni0.2O2
| Образец | Состав | Li2MnO3 | LiNiO2 | (1 – n – m) LiCo0.8Ni0.2O2 | Емкость, мА ч г–1 | Циклируемость |
|---|---|---|---|---|---|---|
| 1 | Чистый | 0 | 0 | 1 | 172.5 | 49 |
| 2 | Двойной | 0.167 | 0 | 0.833 | 112.3 | 47 |
| 3 | Двойной | 0 | 0.167 | 0.833 | 109.5 | 48 |
| 4 | Двойной | 0.333 | 0 | 0.667 | 125.5 | 51 |
| 5 | Тройной | 0.167 | 0.167 | 0.667 | 149.5 | 58 |
| 6 | Двойной | 0 | 0.333 | 0.667 | 79.5 | 69 |
| 7 | Двойной | 0.500 | 0 | 0.500 | 173.5 | 71 |
| 8 | Тройной | 0.333 | 0.167 | 0.500 | 155.2 | 51 |
| 9 | Тройной | 0.167 | 0.333 | 0.500 | 159.8 | 71 |
| 10 | Двойной | 0 | 0.500 | 0.500 | 149.5 | 70 |
| 11 | Двойной | 0.667 | 0 | 0.333 | 258.5 | 69 |
| 12 | Тройной | 0.500 | 0.167 | 0.333 | 256.5 | 97 |
| 13 | Тройной | 0.333 | 0.333 | 0.333 | 255.5 | 99 |
| 14 | Тройной | 0.167 | 0.500 | 0.333 | 253.5 | 89 |
| 15 | Двойной | 0 | 0.667 | 0.333 | 140.6 | 99 |
| 16 | Двойной | 0.833 | 0 | 0.167 | 171.5 | 70 |
| 17 | Тройной | 0.667 | 0.167 | 0.167 | 151.5 | 98 |
| 18 | Тройной | 0.500 | 0.333 | 0.167 | 210.2 | 99 |
| 19 | Тройной | 0.333 | 0.5 | 0.167 | 247.5 | 99 |
| 20 | Тройной | 0.167 | 0.667 | 0.167 | 201.5 | 50 |
| 21 | Двойной | 0 | 0.833 | 0.167 | 179.5 | 95 |
| 22 | Чистый | 1 | 0 | 0 | 140.5 | 90 |
| 23 | Двойной | 0.833 | 0.167 | 0 | 199.5 | 95 |
| 24 | Двойной | 0.667 | 0.333 | 0 | 255.5 | 94 |
| 25 | Двойной | 0.500 | 0.500 | 0 | 249.5 | 99 |
| 26 | Двойной | 0.333 | 0.667 | 0 | 175.5 | 45 |
| 27 | Двойной | 0.167 | 0.833 | 0 | 155.5 | 74 |
| 28 | Чистый | 0 | 1 | 0 | 223.2 | 90 |
Аналогичные распределения по размеру и морфологии наблюдаются для легированных Mn материалов с различной мольной долей, что свидетельствует о том, что Mn хорошо проникает в чистый LiCo0.8Ni0.2O2 для получения идеального состава Li1.333Ni0.4Co0.267Mn0.333O2 и образования твердого раствора (схема 5 ), это указывает, что ионы Mn гомогенно растворяются в коллоидном прекурсоре перед последующей тепловой обработкой методом прокаливания.
Схема 5 . Изображения морфологии, полученные с помощью СЭМ для Li1.333Ni0.4Co0.267Mn0.333O2.
Кроме того, размеры этого вида частиц Li1.333Ni0.4Co0.267Mn0.333O2 необходимы для повышения электрохимического КПД электродов за счет уменьшения ионной диффузии при ионном механизме интеркаляции и деинтеркаляции лития. Электрохимическая эффективность этих систем была оценена при комнатной, а также при высоких температурах, поэтому зарядно-разрядные кривые кажутся довольно монотонными, и в ходе реакций экстракции/внедрения лития не происходит значительных структурных переходов.
Как видно из табл. 2 и схемы 1 , содержание кобальта уменьшается в направлении треугольника вниз, в то время как образец 22 имеет нулевой процент содержания Ni. Высокое значение Mn обнаружено в образце 22, и его содержание уменьшается в противоположных конечных точках треугольника. Процентное содержание никеля находится в широкой области в треугольнике и также уменьшается вблизи Li2MnO3 или Li(Li0.33Mn0.66)O2. Предсказано, у каких композиций емкость и циклируемость напрямую связаны с количеством Mn, Co и Ni. Примечательно, что удельная емкость определяется как величина энергии, которая может быть отнесена к объему или массе (Ач), в то время как способность к быстрому заряду и разряду (которая связана с их конструкцией и значительно варьируется между различными производителями) может быть определена как скорость, с которой заряжается ячейка. Поэтому показатель C представляет собой емкость аккумулятора, деленную на скорость заряда, выраженную в часах. Кривые разрядной емкости этой работы сравнивались с результатом аккумулятора системы C/LiCoO2 типоразмера 18650 фирмы Sony, который был модифицирован в работе Ehrlich [26].
Поскольку катод LiCoO2 имеет начальную емкость разряда около 145 мА ч/г [27], то могут быть рассмотрены любые материалы этих составов с начальной емкостью, превышающей это количество (конечно, с подходящей циклируемостью). Образцы тестировались на приборе для циклрования (система тестирования аккумуляторов Arbin BT 2000), в диапазоне напряжений от 2.4 до 4.6 В с низкой скоростью заряда–разряда, составляющей C/10. Первоначальные результаты указывают на широкий разброс и беспорядочность в циклируемости и емкости. Начальная емкость разряда варьировалась от 172.5 до 258.5 мА ч/г. Как емкость, так и циклируемость возрастают от LiCo0.8Ni0.2O2 к двойному составу Li2MnO3 и LiNiO2.
В этой работе программное обеспечение SATISTICA использовалось для анализа данных, где Var1, Var2, Var3 представляют собой Li2MnO3, Li2NiO2 и (1 – n – m)LiCo0.8Ni0.2O2, соответственно, в то время как Var4 поочередно представляет собой емкость и циклируемость (табл. 3 и рис. 1–3).
Рис. 1.
Тройная зависимость емкости от Var1, Var2 и Var3 для 28 образцов Li2MnO3, Li2NiO2 и (1 – n – m) LiCo0.8Ni0.2O2Li2MnO3 соответственно.

Рис. 3.
Тройная зависимость циклируемости от Var1, Var2 и Var3 для 28 образцов Li2MnO3, Li2NiO2 и (1 ‒ n – m)LiCo0.8Ni0.2O2Li2MnO3 соответственно.

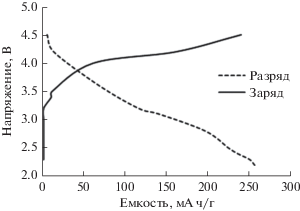
На рис. 2 представлены профили зависимости напряжения от емкости некоторых образцов для составов (1 – n – m) LiCo0.8Ni0.2O2, mLi2MnO3 и nLiNiO2 катодных материалов для начальных циклах заряда/разряда. Хотя образец (11) демонстрирует высокую емкость (около 258.5 мА ч г–1), он обладает низкой циклируемостью. Образцы 13, 25 и 19 демонстрируют хорошую емкость 255.5, 249.5 и 247.5 мА ч/г соответственно, с высокой циклируемостю, в то время как из-за присутствия иона Mn4+ образец 22 имеет низкую емкость. Хотя данные такого рода недостаточны для определения подходящего катодного материала с точки зрения значений емкости и циклируемости, статистический анализ может быть полезен для нахождения области наилучшего состава по данным 28 составов. Поэтому необходимо любое исследование в отношении как емкости, так и циклируемости для всех точек треугольника.
В этой работе различные составы используются для исследования новых катодных материалов с двумерной слоистой структурой на диаграмме тройного состава среди изоструктурных материалов.
Хотя Li2MnO3 или Li(Li1/3Mn2/3)O2 имеет структуру, аналогичную LiCoO2, существует сверхрешеточное упорядочение Mn4+ и Li+ в переходных слоях. (1 – n – m)LiCo0.8Ni0.2O2, который может быть представлен как твердый раствор между LiCoO2 и LiNiO2, представляет собой весьма перспективный катодный материал из-за его улучшенной стабильности и электрохимических характеристик.
В результате анализа среди этих составов были отобраны три образца, которые впоследствии были синтезированы, охарактеризованы и испытаны с высокой точностью. Сравнивая начальную разрядную емкость и некоторые дополнительные характеристики получены номера 11, 12, 13 и 14 (рис. 4 и 5, табл. 2 и 3). Поскольку номер 11 представляет собой двойной состав, его нельзя рассматривать в качестве подходящего кандидата катодного материала. Как видно на рис. 6, между двумя числами от 0.1 до 0.22 по оси X для (1 – n – m)LiCo0.8Ni0.2O2 может наблюдаться перекрывающийся диапазон между емкостью и циклируемостью.
Рис. 4.
Три образца композитов (1 – n – m)LiCo0.8Ni0.2O2Li2MnO3 (Var3), mLi2MnO3 (Var1), nLiNiO2 (Var2) с высокой точностью определения производительности по сравнению с Var1, Var2 и Var3.

Рис. 5.
Три образца композитов (1 – n – m)LiCo0.8 Ni0.2O2Li2MnO3 (Var3), mLi2MnO3 (Var1), nLiNiO2 (Var2) с высокой точностью циклической обработки по сравнению с Var1, Var2 и Var3.

Между тем, как видно на рис. 7 номера 13 и 14 полностью расположены на линиях, и, как видно на рис. 8, номер 13 (Li1.333Ni0.4Co0.267Mn0.333O2) имеет наибольшую эффективность среди 28 катодных материалов для литий-ионного аккумулятора и предлагается в качестве наилучшего состава для катодного материала в настоящей работе. Очевидно, что используемое количество кобальта в этих образцах ниже по сравнению с LiCoO2, что является преимуществом, с точки зрения стоимости и токсичности, в этом исследовании.
Зарядно-разрядные характеристики Li1.333Ni0.4Co0.267Mn0.333O2 были исследованы путем проведения циклических испытаний в диапазоне напряжений 2.4–4.6 В. Увеличение удельной емкости для Li1.333Ni0.4Co0.267Mn0.333O2 можно было бы связать с усилением слоистых характеристик с Mn. Повторный образец 13 был использован для сборки ячейки и подвергнут электрохимическому испытанию с использованием аналогичных условий, циклирование было выполнено в диапазоне напряжений 2.4–4.6 В с постоянной скоростью заряда–разряда C/10 при комнатной температуре (рис. 9). Повторный образец демонстрирует лучшую зарядную и разрядную емкость, чем исходный образец. Это улучшение связано с условиями синтеза.
ВЫВОДЫ
Катоды на основе (1 – n – m)LiCo0.8Ni0.2O2, mLi2MnO3, nLiNiO2 с субмикронными частицами были успешно синтезирован золь–гель методом. Структурные и электрохимические свойства были систематически исследованы, чтобы изучить влияние на зарядно-разрядную емкость, а также сохранение емкости. Результаты показывают, что все подготовленные слоистые структуры типа “Li1.333Ni0.4Co0.267Mn0.333O2” независимо от содержания никеля характеризуются повышенными значениями сохранения емкости. Кроме того, подавляются фазовые переходы, которые обычно происходят в LiNiO2 во время циклирования, и улучшается обратимость заряда–разряда композиции со структурой Li1.333Ni0.4Co0.267Mn0.333O2. Хотя такие системы могут помочь устранить недостаток кобальта, которые в основном связаны с его стоимостью и токсичностью, рабочие характеристики таких систем аналогичны катодному материалу LiCoO2. Поэтому изготовление литий-ионных аккумуляторов с использованием еще нескольких переходных элементов, таких как Mn, Al и Mg, предлагается для любых дальнейших исследований.
Список литературы
Nishi, Y., Van Schalkwijk, W.A., and Scrosati, B., Advances in lithium-ion batteries, Eds., Kluwer/Plenum, 2002, pp. 233.
Yoshio, M., Brodd R.J., and Kozawa,A., Lithium-ion batteries, Sci. and Tech., 2009.
Scrosati, B. and Garche, J., Lithium batteries: status, prospects and future, J. Pow. Sour., 2010, vol. 195, no. 9, p. 2419.
Daniel, C. and Besenhard, J.O., Handbook of battery materials, Wiley-VCH, 2011, 2nd edition.
Meyers, R.A., Encyclopedia of sustainability science and technology, Springer, 2012, New York.
Rossen, E., Jones, C.D.W., and Dahn, J.R., Structure and electrochemistry of LixMnyNi1 –yO2, Solid State Ionics, 1992, vol. 57, no. 3–4, p. 311.
Spahr, M.E., et al., Characterization of layered lithium nickel manganese oxides synthesized by a novel oxidative co-precipitation method and their electrochemical performance as lithium insertion electrode materials, J. Elec. Soc., 1998, vol. 145, no. 4, p. 1113.
Ohzuku, T. and MakimuraY., Layered lithium insertion material of LiNi1/2Mn1/2O2: a possible alternative to LiCoO2 for advanced lithium-ion batteries, Chem. Lett., 2001, vol. 30, no. 8, p. 744.
Makimura, Y. and Ohzuku, T., Lithium insertion material of LiNi1/2Mn1/2O2 for advanced lithium-ion batteries, J. Pow. Sour., 2003, vol. 119-121, p. 156.
Liu, Z., Yu, A., and Lee, J.Y., Synthesis and characterization of LiNi1 –x–yCoxMnyO2 as the cathode materials of secondary lithium batteries, J. Pow. Sour., 1999, vol. 81–82, p. 416.
Yoshio, M. et al., Preparation and properties of LiCoyMnxNi1 –x–yO2 as a cathode for lithium ion batteries, J. Pow. Sour., 2000, vol. 90, no. 2, p. 176.
Ohzuku T. and Makimura,Y., Layered lithium insertion material of LiCo1/3Ni1/3Mn1/3O2 for lithium-ion batteries, Chem. Lett., 2001, vol. 30, no. 7, p. 642.
Belharouak, I. et al., Li(Ni1/3Co1/3Mn1/3)O2 as a suitable cathode for high power applications, J. Pow. Sour., 2003, vol. 123, no. 2, p. 247.
Ngala, J.K. et al., The synthesis, characterization and electrochemical behavior of the layered LiNi0.4Mn0.4Co0.2O2 compound, J. Mat. Chem., 2004, vol. 14, no. 2, p. 214.
Yoon, W.S., et al., A comparative study on structural changes of LiCo1/3Ni1/3Mn1/3O2 and LiNi0.8Co0.15Al0.05O2 during first charge using in situ XRD, Electrochem. Commun., 2006, vol. 8, no. 8, p. 1257.
Ammundsen, B. et al., Local structure and first cycle redox mechanism of layered Li1.2Cr0.4Mn0.4O2 cathode material, J. Elec. Soc., 2002, vol. 149, no. 4, p. A431.
Thackeray, M.M. et al., Advances in manganese-oxide composite electrodes for lithium-ionbatteries, J. Mat. Chem., 2005, vol. 15, no. 23, p. 2257.
Zhang, L., Noguchi, H., and Yoshio, M., Synthesis and electrochemical properties of layered Li–Ni–Mn–O compounds, J. Pow. Sour., 2002, vol. 110, no. 1, p. 57.
Shin, S.S., Sun, Y.K., and Amine, K., Synthesis and electrochemical properties of Li[Li(1 – 2x)/3NixMn(2 –x)/3]O2 as cathode materials for lithium secondary batteries, J. Pow. Sour., 2002, vol. 112, no. 2, p. 634.
Hailang, Z. and Wen-Hua, S., Synthesis and characterization of LiNi0.7 –xMgxCo0.3O2(0 ≤ x ≤ 0.1) cathode materials for lithium-ion batteriesprepared by a sol-gel method, Adv. in Mat. Sci. and Eng., 2014, p. 1–7.
Monajjemi, M., Mahdavian, L., and Mollaamin, F., Characterization of nanocrystalline silicon germanium film and nanotube in adsorption gas by Monte Carlo and Langevin dynamic simulation, Bull. Chem. Soc. Ethiopia, 2008, 22(2), p. 277.
Ли, В.С., Нимманпипуг, П., Моллаамин, Ф., Танасанворакун, С., Монаджейми, М. Исследование электрических свойств одностенных углеродных нанотрубок и анализ нормальных мод: диэлектрические эффекты. Журн. физ. химии A. 2009. Т. 83. № 13. С. 2288. [Lee, V.S., Nimmanpipug, P., Mollaamin, F., Thanasanvorakun, S., and Monajjemi, M., Investigation of single wall carbon nanotubes electrical properties and normal mode analysis: Dielectric effects, Russ. J. Phys. Chem. A, 2009, 83(13), p. 2288.]
Monajjemi, M. and Ahmadianarog, M., Carbon nanotube as a deliver for sulforaphane in Broccoli vegetable in point of nuclear magnetic resonance and natural bond orbital specifications, J. Computat. and Theoret. Nanosci., 2014, 11(6), p. 1465.
Monajjemi, M., Farahani, N., and Mollaamin, F., Thermodynamic study of solvent effects on nanostructures: Phosphatidylserine and phosphatidylinositol membranes, Phys. and Chem. Liquids, 2012, 50(2), p. 161.
Monajjemi, M., Mahdavian, L., Mollaamin, F., and Honarparvar, B., Thermodynamic investigation of enolketotautomerism for alcohol sensors based on carbon nanotubes as chemical sensors, Fullerenes Nanotubes and Carbon Nanostructures, 2010, 18(1), p. 45.
Ehrlich, G.M. and Linden,D., Handbook of Lithium-ion batteries, McGraw-Hill, 2002, N.Y., pp. 35.
Yang,Z., Zhang, J., Kintner-Meyer, C.W., Lu, X., Choi, D., Lemmon, J.P., and Liu J., Electrochemical energy storage for green grid, Chem. Reviews, 2011, vol. 111, p. 3577.
Дополнительные материалы отсутствуют.