Электрохимия, 2020, T. 56, № 8, стр. 749-759
Электрохимический синтез однородной пленки Сu2О и ее фотоэлектрохимические свойства
Г. Хейдари a, *, А. Пордел a, М. Ройнфард a
a Технологический университет Эсфарайен
Эсфарайен, Иран
* E-mail: g.heidari@aut.ac.ir
Поступила в редакцию 17.07.2018
После доработки 11.07.2019
Принята к публикации 29.07.2019
Аннотация
Пленки Сu2О в качестве фотокатодов синтезированы методом электроосаждения постоянного тока. Использование циклической вольтамперометрии (ЦВА) перед потенциостатическим электрооcаждением повысило однородность и прозрачность пленки Сu2О. Оптическая ширина запрещенной зоны пленки Cu2O, полученной путем электроосаждения в течение 7200 с, составляла 2.1 эВ, в то время как одна из электроосажденных в течение 1000 с демонстрировала синий сдвиг (2.4 эВ). Высокая прозрачность пленки Сu2О, электроосажденной после ЦВА, и увеличенная толщина электроосажденной пленки в течение 7200 с не влияли иа значение плотности фототока. Плотность фототока электроосажденных пленок за периоды времени более 200 с существенно не изменилась. Измеренная толщина пленки Сu2О, электроосажденной в течение 200 с, составила 70 нм. Электроосаждение в течение более 200 с привело к получению пленок Сu2О с толщинами, превышающими длину сбора электронов, т.е. 20–100 нм, что и стало причиной того, что плотность фототока не была улучшена. Электрохимическая импедансная спектроскопия (ЭИС) была использована для объяснения характеристик переноса заряда фотокатода Сu2О. График Найквиста показал два полукруга, которые можно отнести к процессу пepeнoca заряда через поверхность раздела электрод/электролит и внутри электрода. Данные ЭИС были снабжены эквивалентной схемой, и было получено значение параметров. Используя график Мотта–Шоттки, потенциал плоской зоны и плотность носителей были получены равными 0,19 В относительно Ag/AgCl и 1.3 × 1018 см–3 соответственно.
ВВЕДЕНИЕ
Истощение традиционных энергетических ресурсов и загрязнение окружающей среды в результате их сжигания являются основными вопросами, которые должны быть решены в ближайшем будущем [1]. Крайне важно создать чистый, возобновляемый, дешевый и устойчивый источник энергии для удовлетворения нашего растущего спроса на энергию [2]. Фотоэлектрохимическое расщепление воды с использованием солнечной энергии и полупроводников может потенциально использоваться для генерации водорода в качестве чистого и возобновляемого источника энергии [3, 4]. До настоящего времени для фотоэлектрохимического расщепления воды было исследовано множество полупроводников, таких как ТiO2 [5], Fe2O3 [6] и Сu2О [7].
Сu2О, как важный полупроводник р-типа, в последнее время привлекает значительное внимание во многих областях, таких как фотокаталитическое преобразование СO3 [8], суперконденсатор [9], фотокатализ [10], батарея [11], солнечный элемент [12], оптоэлектронные устройства [13] и фотоэлектрохимическое расщепление воды [14]. Он имеет идеальную ширину запрещенной зоны от 1.9 до 2 эВ, что гарантирует эффективный сбор солнечного света, особенно в видимой области [15]. Кроме того, он содержит много доступных на Земле, недорогих и нетоксичных элементов. Край зоны проводимости хорошо подходит при отрицательном потенциале выделения водорода 0.7 В, обеспечивая достаточное перенапряжение для реакции восстановления водорода, хотя его валентная зона не очень хорошо расположена для окисления воды. Поэтому использование внешнего смещения или поглотителя дырок необходимо для фотоэлектрохимического производства водорода полупроводником Сu2О [16]. Нестабильность в воде при освещении является основным недостатком, ограничивающим применение Сu2О в качестве фотокатода [17]. Были предприняты многочисленные усилия для преодоления этой основной проблемы путем нанесения защитных слоев на поверхность электрода [16, 18].
Несколько исследовательских групп занимались синтезом Сu2О различными методами, такими как аэрозольный пиролиз [19], полиол [20], магнетронное распыление [21], выращивание из раствора [22] и электроосаждение [7]. Среди всех методов электроосаждение, самый простой и самый недорогой метод, представляет собой практичный и масштабируемый метод [23]. Для синтеза Сu2О в качестве фотокатода использовались два подхода, а именно электроосаждение с использованием постоянного тока и импульсного тока. Неоднородное осаждение и сильное растрескивание, обычно наблюдаемое при электроосаждении постоянным током, были устранены путем электроосаждения импульсным током [24]. Hu и соавторы использовали электроосаждение импульсным током для устранения недостатков электроосаждения постоянным током [25], однако этот метод имеет недостаток, связанный с ограничением толщины осадка. В данной работе прозрачная и однородная пленка Сu2О была синтезирована методом электроосаждения при постоянном токе. Применение циклической вольтамперометрии (ЦВА) перед электроосаждением было использовано для устранения недостатков электроосаждения при постоянном токе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пленки Сu2О выращивали на легированных фтором подложках из оксида олова (FTO) методом электроосаждения. Электроосаждение проводилось при температуре 25°С и значении рН 12 с использованием электролита, содержащего 0.1 М пентагидрат сульфата меди (CuSO4 ∙ 5H2O) и 3 М молочную кислоту (C3H6O3). Значение рН электролита регулировали добавлением гидроксида натрия. Все реагенты, использованные в экспериментах, были аналитического качества. Электроосаждение проводилось с использованием потенциостата/гальваностата (Sama 500). Для электроосаждения использовалась трехэлектродная система, включающая подложку FTO (сопротивление листа 15 Ом/квадрат), Ag/AgCl (насыщенный КСl) и лист Pt в качестве рабочего электрода, электрода сравнения и противоэлектрода соответственно. Перед электроосаждением подложки FTO (1 × 1 см2) очищали ультразвуком с помощью ацетона и дистиллированной воды в течение 10 минут.
Для приготовления пленок Сu2О в потенциостатическом режиме использовались два подхода: 1) электроосаждение при постоянном потенциале –0.4 В относительно Ag/AgCl; 2) перед потенциостатическим электрооcаждением применение метода ЦВА в диапазоне потенциалов 0…–800 мВ со скоростью сканирования 0.1 В/с.
Морфология поверхности пленок была охарактеризована с помощью полевой эмиссионной сканирующей электронной микроскопии (ПЭСЭМ) (MIRA3TESCAN-XMU) и атомно-силовой микроскопии (AFM, Femto Scan). Кристаллическая структура электроосажденной пленки была идентифицирована с помощью дифракции рентгеновских лучей (X’PertPro, Panalytical). Оптическую ширину запрещенной зоны пленок определяли с помощью УФ-видимого спектрофотометра (APEL, PD-303UV).
Фотоэлектрохимический эксперимент проводили с использованием потенциостата/гальваностата (Autolab, PGSTAT204) в трехэлектродной электрохимической ячейке, содержащей 1 М раствор Na2SO, при значении рН 7.5. Пленка Сu2О, нанесенная на подложку FTO, использовалась в качестве рабочего электрода, а Pt-лист и Ag/AgCl с насыщенным КС1 использовались в качестве противоэлектрода и электрода сравнения соответственно. Для измерения фототока был проведен тест линейной развертки вольтамперометрии при скорости сканирования 10 мВ c–1 при прерывистом освещении видимого света (ксеноновая дуговая лампа 150 Вт, λ ≥ 420 нм). Рабочий электрод с открытой площадью 6.15 мм2 освещался с лицевой стороны. Электрохимическую импедансную спектроскопию (EIS) проводили в темноте с использованием потенциостата/гальваностата (Autolab, PGSTAT204) при амплитуде переменного тока 10 мВ в диапазоне частот от 100 кГц до 0.1 Гц. Импеданс в зависимости от частотного спектра был получен при потенциале смещения ‒0.6 В относительно Ag/AgCl и температуре 25°С в растворе 1 М Na2SO4. Емкость пленки Сu2О была получена при фиксированной частоте 1 кГц в диапазоне потенциалов от 0.3 В до –0.3 В (относительно Ag/AgCI). Кривая Мотта–Шоттки (М‒Ш) (1/С2 в зависимости от потенциала) была получена для оценки концентрации носителей и потенциала плоской зоны в соответствии со следующим уравнением:
(1)
$\frac{1}{{{{C}^{2}}}} = \frac{2}{{{\theta }\varepsilon {{\varepsilon }_{0}}{{N}_{{\text{A}}}}}}\left( {E - {{E}_{{\text{b}}}} - \frac{{kT}}{e}} \right),$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Молочная кислота была использована в качестве стабилизирующего агента для предотвращения осаждения Сu(ОH)2 и образования CuLac2 в качестве преобладающего комплекса. Электрохимические реакции образования Cu2O заключаются в следующем [27]:
(2)
${\text{CuLa}}{{{\text{c}}}_{2}} + {\text{O}}{{{\text{H}}}^{--}} + {\text{e}} \to {\text{CuOH}} + {\text{ }}2{\text{La}}{{{\text{c}}}^{--}},$(3)
$2{\text{CuOH}} \to {\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Пленки Cu2O получали при постоянном потенциале –0.4 В в разные периоды времени. Чтобы получить начальные зародыши, до электроосаждения при постоянном потенциале, были зарегистрированы циклические вольтамперограммы между 0 и –0.8 В со скоростью сканирования 0.1 В с–1 (вставка на рис. 1). В другой стратегии пленка Сu2О была электроосаждена при постоянном потенциале ‒0.4 В без ЦВА. Пленки Cu2O, полученные этими двумя способами, сравнивали с точки зрения морфологии поверхности, оптического поглощения и фотоэлектрохимического отклика. Пленки, электроосажденные в течение периода 7200 с, и соответствующие им отклики по току показаны на рис. 1. Как видно, значения откликов по току не были одинаковыми в этих двух подходах. Кроме того, фотографии пленок, электроосажденных в течение 1000 и 7200 c, показаны на рис. 1. Пленки, электроосажденные в течение 1000 и 7200 с были желтого и красного цвета соответственно. Пленка, электроосажденная при постоянном потенциале без применения ЦВА, была непрозрачной и неоднородной, тогда как пленка, полученная после ЦВА, была однородной с высокой прозрачностью. Разница во внешнем виде пленок и их текущих реакциях может быть связана с различием их механизмов зарождения и роста. Moharam и соавторы сообщили о потенциостатическом осаждении прозрачной тонкой пленки Сu2О с использованием щелочного электролита, содержащего нитрат меди(II) и цитрат натрия. Сообщалось, что механизм зарождения и роста был трехмерным (3D) и следовал модели Шарифкера и Хиллса [28]. Кроме того, Ху и соавт. сообщили о изготовлении прозрачной тонкой пленки Сu2О с использованием формы волны обратного потенциала в кислотном растворе, содержащем NaAc и Сu(Ас)2. По этой методике можно получить ограниченную толщину тонкой пленки за счет растворения в каждом цикле [25]. Циклическая вольтамперограмма на вставке к рис. 1 показывает кроссовер, указывающий на 3D зарождение [29]. Смещение потенциала до –0.8 В дает больше начальных зародышей, для последующего потенциостатического осаждения, и в результате может быть получена однородная и тонкая микроструктура. Обе кривые хроноамперометрии демонстрируют практически одинаковую тенденцию, что можно объяснить моделью зарождения и роста, которую предложили Scharifker и Hills [28]. После применения ступени потенциала от потенциала разомкнутой цепи к потенциалу, при котором произошло электроосаждение, можно выделить три ступени, в том числе: падение тока из-за двухслойной зарядки, увеличение тока из-за увеличения площади поверхности всякий раз, когда происходило зародышеобразование, а затем затухание тока из-за перекрытия ядер и изменения трехмерной диффузии в плоскую диффузию [30]. Как видно из кривых хроноамперометрии двух подходов, начальный ток электроосаждения после ЦВА (–100 мкА см–2) был выше по сравнению с таковым без ЦВА (‒30 мкА см–2), применение ЦВА перед электроосаждением привело к появлению большего количества начальных ядер и, следовательно, более высокому значению начального тока. Как видно из рис. 1, использование ЦВА перед электроосаждением уменьшило tmax (время, соответствующее jmax на кривой хроноамперометрии) (20 с) по сравнению с тестом без ЦВА (1000 с). Снижение tmax означает, что изменение трехмерной диффузии на плоскую диффузию происходило быстрее. Если имеется больше начальных ядер, требуется меньшее время роста, чтобы вызвать перекрытие трехмерных диффузионных нолей и преобразовать их в плоскую диффузию. Следовательно, применение ЦВА перед потенциостатическим электроосаждением может привести к получению более мелких зерен с низкой шероховатостью поверхности и, следовательно, к повышению прозрачности тонких пленок.
Рис. 1.
Кривые хроноамперометрии (ХА) электрохимического осаждении при постоянном потенциале –0.4 В с использованием исследования ЦВА (а) и –0.4 В без использования исследования ЦВА (б). Вставка: исследование ЦВА.

На рис. 2 показаны изображения ПЭСЭМ электроосажденных пленок в течение 7200 с при постоянном потенциале –0.4 В. Заметно, что морфология поверхности, и форма зерна полученных пленок не были одинаковыми с (а) и (б) без предварительной ЦВА. Как видно из изображения ПЭСЭМ, размер зерна был меньше, а шероховатость поверхности была ниже в пленке Сu2О, полученной после применения ЦВА, по сравнению с полученной без использования ЦВА. Морфологию поверхности и шероховатость электроосажденных пленок также анализировали с помощью атомно-силового микроскопа (АСМ). На рис. 3 показаны трехмерные АСМ-микрофотографии пленок Сu2О, электроосажденных в течение 1000 с при постоянном потенциале –0.4 В после применения ЦВА (а) и без использования ЦВА (б) на площади 1 мкм × 1 мкм. Как видно на этом рисунке, применение ЦВА перед электроосаждением повлияло на морфологию поверхности пленки Сu2О. Очевидно, что размер частиц пленки, полученной после предварительной ЦВА является более мелким по сравнению с размером пленки, полученной без использования ЦВА. Среднеквадратичная (RMS) шероховатость поверхности – это стандартное отклонение профиля высоты поверхности от средней высоты [31]. Среднеквадратичная шероховатость была получена равной приблизительно 12 и 39 нм для пленок, полученных с использованием и без использования ЦВА соответственно. Результаты показывают, что полученная пленка после нанесения исследования ЦВА имеет гладкую поверхность. Более низкая шероховатость поверхности и более высокая однородность могут быть причиной того, что пленка Сu2О, полученная после применения ЦВА, была прозрачной.
Рис. 2.
Изображения ПЭСЭМ пленок Сu2O, электроосажденных в течение 7200 с при постоянном потенциале –0.4 В с использованием ЦВА (а) и –0.4 В без ЦВА (б).

Рис. 3.
Изображения АСМ пленок Сu2О, электроосажденных в течение 1000 с при постоянном потенциале –0.4 В с использованием ЦВА (а) и –0.4 В без использования ЦВА (б).

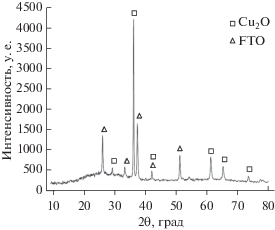
Согласно литературным данным [32], пленка, электроосажденная при постоянном потенциале –0.4 В, давала чистую фазу Сu2О. Для определения фазовой и кристаллической структуры электроосажденной пленки после ЦВА использовалась рентгенограмма. На рис. 4 представлена рентгенограмма пленки Сu2О, электроосажденной на подложке FTO после применения ЦВА. Помимо характерных пиков, принадлежащих фторированному оксиду олова, обнаружены характерные дифракционные пики тонкой пленки Cu2O при значениях 2θ, равных 29.6°, 36.5°, 42.5°, 61.5°, 65.5° и 73.7°, соответствующие отражениям от граней (110), (111), (200), (220), (221) и (311) (код ссылки: 01-075-1531). Рентгенограмма показала только пики Cu2O без каких-либо наблюдаемых пиков CuO или Сu. Пленка Cu2O, выращенная на подложке FTO после применения ЦВА, показала (111) преимущественную ориентацию, что позволяет предположить, что направление роста Cu2O было вдоль направления (111) [33].
Рис. 4.
Рентгенограмма электроосажденной пленки Сu2О при постоянном потенциале –0.4 В после применения ЦВА.
Измерения оптического поглощения проводились для сравнения оптической плотности и определения оптической ширины запрещенной зоны электроосажденных пленок. Спектры поглощения всех образцов и соответствующие им графики Тауца приведены на рис. 5. Электроосажденный Cu2O после применения ЦВА показал меньшее оптическое поглощение по сравнению с полученным без использования ЦВА, что согласуется с их фотографиями на рис. 1. Пленка, электроосажденная в течение 7200 с, показала более высокое поглощение по сравнению с пленкой, электроосажденной в течение 1000 с. Более высокое оптическое поглощение пленки, электроосажденной в течение 7200 с по сравнению с пленкой, электроосажденной в течение 1000 с, было обусловлено их различной толщиной. Толщина электроосажденного Cu2O со временем увеличивалась и приводила к различным внешним видам и оптическому поглощению. Это заметно из рис. 5, который показывает, что края поглощения электроосажденного Cu2O в течение двух разных периодов времени не были одинаковыми. Кроме того, отношение Тауца было использовано для оценки оптической ширины запрещенной зоны пленок. (ahν) n была построена, в зависимости от энергии фотонов (hν), где n = 2 для прямого оптического перехода, как показано на вставке рис. 5. Оптическая ширина запрещенной зоны была получена путем расширения прямой части (ahν)2 относительно кривой энергии фотонов (hν) до (ahν)2 = 0. Оптическая ширина запрещенной зоны пленки, электроосажденной в течение 7200 с, была получена равной 2.1 эВ, что согласуется со значениями, приведенными в литературе [34]. Интересно отметить, что оптическая ширина запрещенной зоны пленки Cu2O, электроосажденной в течение 1000 с, была определена равной 2.4 эВ, которая показала голубой сдвиг. Этот голубой сдвиг может быть вызван меньшим размером зерна выращенной пленки в течение 1000 с.
Рис. 5.
Спектры поглощения пленок Cu2O, электроосажденных без и с использованием ЦВА в течение 7200 и 1000 с. Вставка: графики Тауца спектров поглощения.

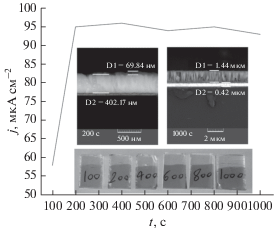
Измерения фотоотклика фотокатодов Cu2O проводились с помощью потенциостата/гальваностата в трехэлектродной ячейке с Ag/AgCl в качестве электрода сравнения и Pt в качестве противоэлектрода. Регистрирование линейной развертки вольтамперограммы было сделано при прерывистом освещении, которое одновременно показывало темновой ток и фототок пленок Cu2O в качестве фотокатода. Скорость сканирования составляла 10 мВ/с. На рис. 6 показана зависимость плотности тока от потенциала при прерывистом освещении для пленок Cu2O, выращенных в течение 1000 и 7200 с, как с использованием, так и без использования ЦВА. Плотность фототока при потенциале смещения ‒0.5 В была получена путем вычитания тока, когда освещение было выключено, из тока, когда освещение было включено. Наблюдалось, что плотность фототока составляла 98, 93, 104 и 98 мкА см–2 соответственно для пленок Cu2O, электроосажденных в течение 1000 и 7200 с, каждый без и с использованием ЦВА. Был сделан вывод, что значения фототока были практически одинаковыми для всех пленок Cu2O. Повышенная прозрачность электроосажденных пленок после нанесения ЦВА не привела к снижению значений фототока. Кроме того, увеличение толщины пленок, полученных за 7200 с, не привело к более высоким значениям фототока. Для исследования влияния толщины на плотность фототока пленки Cu2O подвергали электроосаждению в течение разных периодов времени. На рис. 7 представлена плотность фототока пленок Cu2O, электроосажденных в течение разных периодов времени при потенциале смещения –0,5 В. Все пленки были электроосаждены после применения ЦВА. Плотность фототока достигла своего максимального значения через 200 с, а затем почти выровнялась. После электроосаждения в течение 200 с плотность фототока существенно не изменилась. Рисунок 7 также показывает поперечное сечение пленок, электроосажденных в течение 200 и 1000 с. Толщина пленки Cu2O, электроосажденной в течение 200 и 1000 с, была получена равной 70 нм и 1,4 мкм соответственно. Глубина сбора электронов Cu2O, которая является суммой длины диффузии электронов и толщины слоя объемного заряда, составляет менее 100 нм, а глубина поглощения света вблизи запрещенной зоны составляет примерно 10 мкм [17, 35, 36]. Поэтому фотоэлектроны, созданные на глубине, превышающей длину сбора электронов, будут рекомбинировать до достижения поверхности электрода. Постоянный фототок пленок Cu2O, электроосажденных более 200 с, мог быть связан с их толщиной, которая превышала длину сбора электронов.
Рис. 6.
Вольтамперометрия с линейной разверткой пленок Cu2О, электроосажденных в течение 1000 с (а) и 7200 с (б) при прерывистом освещении (время выключения: 10 с, по времени: 10 с) в водном растворе Na2SO4 (1 М, рН 7.5).

Рис. 7.
Плотность фототока пленок Cu2О, электроосажденных в течение разных периодов времени, при потенциале смещения –0.5 В.
ЭИС является эффективным методом исследования характеристик переноса заряда фотокатодов. В этом исследовании ЭИС проводилась в темноте при постоянном потенциале –0.6 В относительно Ag/AgCl. Как показано на рис. 8а, график Найквиста, покрывающий частоту 105–0.1 Гц, проявляет две полуокружности, соответствующие процессу переноса заряда через границу раздела электрод/электролит и переносу электрона внутри электрода [37]. Полуокружность в области высоких частот связана с полным сопротивлением объема Cu2O, а в области низких частот – с полным сопротивлением границы раздела Cu2O/электролит [38]. Чтобы получить количественную информацию, график Найквиста также был описан эквивалентной схемой с использованием программного обеспечения NOVA (вставка рис. 8a). Эквивалентная схема состояла из последовательного сопротивления (Rs), объемного сопротивления (Rbulk) и сопротивления переноса заряда на границе раздела электрод/электролит (Rct), а также включала два конденсаторных элемента: объемную емкость (CPEbulk) и емкость двойного слоя на границе раздела электрод/электролит (СРЕdl). Rbulk и CPEbulk могут представлять сопротивление переноса заряда и емкость двойного слоя на границе раздела FTO/Cu2O [39], или сопротивление области пространственного заряда и емкость области пространственного заряда, соответственно. Установленные значения Rs, Rbulk, Rct, CPEbulk и СРЕdl были получены из данных импеданса как 32.9 Ом, 143 Ом, 36 кОм, 16.7 мкФ (N = 0.658) и 31 мкФ (N = 0.806) соответственно. График Мотта–Шоттки использовался для определения типа проводимости, потенциала плоской зоны и плотности носителей. Обратный квадрат емкости был построен в зависимости от потенциала на фиксированной частоте 1 кГц [40]. Рисунок 8б показывает график Мотта–Шоттки для Cu2O, электроосажденного после ЦВА. График Мотта–Шоттки для Cu2O в 1 M растворе Na2SO4 демонстрирует отрицательный наклон, указывая на то, что Cu2O является полупроводником р-типа. Потенциал плоской зоны Cu2O был получен из точки пересечения х линейной области как 0.19 В относительно Ag/AgCl. Используя наклон графика, плотность носителей была рассчитана как 1.3 × 1018 см–3. Полученные значения потенциала плоской зоны и плотности носителей соответствовали значениям, приведенным в литературе [34].
Рис. 8.
График Найквиста при потенциале смещения –0.6 относительно Ag/AgCl (а) и график Мотта–Шоттки (б) пленки Cu2О, электроосажденной в течение 1000 с после ЦВА.

Графики Мотта–Шоттки пленок Cu2O, электроосажденных в течение 1000 с при постоянном потенциале –0.4 В после применения исследования ЦВА (рис. 9а) и без использования исследования ЦВА (рис. 9б), получены при разных частотах. Дисперсия частоты обусловлена шероховатостью поверхности и более медленным откликом ионов с низкой подвижностью электролита на границе раздела между полупроводником и электролитом на переменнотоковый сигнал. Когда поверхность абсолютно гладкая, общая емкость является емкостью пространственного заряда (CSC). Увеличение шероховатости поверхности приводит к ситуации, когда емкостью двойного слоя (CDL) уже нельзя пренебречь в общей емкости, что приводит к дисперсии частоты [41]. Как показано на рис. 9а и 9б, частотная дисперсия электроосажденной пленки Cu2O после ЦВА ниже, чем электроосажденная без использования ЦВА. Более низкая шероховатость поверхности и более высокая однородность пленки Cu2O, полученной после применения ЦВА, что подтверждается изображениями АСМ, привели к ее более низкой частотной дисперсии.
ВЫВОДЫ
Пленка Cu2O в качестве фотокатода была электроосаждена: 1) при постоянном потенциале –0.4 В относительно Ag/AgCl и 2) при постоянном потенциале –0.4 В относительно Ag/AgCl после применения ЦВА, и были получены следующие результаты.
1. Электроосажденная пленка Cu2O, нанесенная после ЦВА была однородной с высокой прозрачностью. В то время как пленка Cu2O, электроосажденная без использования ЦВА, была неоднородной и непрозрачной.
2. Электроосаждение в течение периода времени 1000 с привело к желтой пленке, в то время как пленка для периода времени 7200 с была красной.
3. Оптическое поглощение пленок, электроосажденных за 7200 с, было больше, чем у пленок, электроосажденных за 1000 с, что связано с увеличением толщины со временем. Кроме того, пленка Cu2O, электроосажденная после применения ЦВА, приводила к низкому оптическому поглощению по сравнению с пленкой, электроосажденной без использования ЦВА.
4. Было установлено, что плотность фототока образцов, подвергнутых электроосаждению без и с использованием ЦВА в течение 7200 и 1000 с, была практически одинаковой. Плотность фототока увеличивалась со временем электроосаждения, а затем выравнивалась при 95 мкА см–2 через 200 с.
5. Для подбора данных ЭИС была использована эквивалентная схема и было получено значение параметров. Используя график Мотта–Шоттки, потенциал плоской полосы и плотность носителей были оценены как 0.19 В относительно Ag/AgCl и 1.3 × 1018 см–3 соответственно.
Список литературы
Ahmad, H, Kamarudin, S., Minggu, L., and Kassim, M., Hydrogen from photo-catalytic water splitting process: A review, Renewable and Sustainable Energy Reviews, 2015, vol. 43, p. 599.
Cen, J., Wu, Q., Liu, M., and Orlov, A., Devoloping new understanding of photoelectrochemical water splitting via in-situ techniques: A review on recent progress, Green Energy& Envwomnent, 2017, vol. 2, p. 100.
Bak, T., Novotny, J., Rekas, M., and Sorrell, C., Photo-electrochemical hydrogen generation from water using solar energy. Materials-related aspects, Iiitern. J. Hydrogen Energy, 2002, vol. 27, p. 991.
Heidari, G., Rabani, M., and Ramezanzadeh, Application of CuS–ZnS PN junction for photoelectrochemical water splitting, lniern. J. Hydrogen Energy, 2017, vol. 42, p. 9545.
Сулейманов, А.С. Фотоэлектрохимическое поведение гетеросистемы AIIBVI/TiO2–RuO2 при электролизе водных электролитов. Электрохимия. 2003. Т. 39. С. 39. С. 298. [Suleiraanov, A.S., Photoelectrochemical Behavior of Heterosystem AIlBVI/TiO2–RuO2 Electrolysis of Aqueous Electrolytes, Russ. J. EIectmchem., 2003, vol. 39, p. 298.
Арутюнян, B.M., Аракелян, Г.Е., Шахназарян Г.М. Степанян, Я.А., Тернер, Хаселев, O. Керамические фотоэлектроды Fe2О3:Ta для фотоэлектрохимических солнечных элементов. Электрохимия. 2002. Т. 38. С. 378. [Arutyunyan, V.M., Arakelyan, G.E., Shakhnazaryan, G.M., Stepanyan, J.A., Turner, Khaselev, O., Ceramic Fe2O3:Ta Photoelectrodes for Photoelectrochemical Solar Cells, Russ. J. Electrochem., 2002, vol. 38, p. 378.]
Paracchino, A., Maihews, N., Hisatomi, T., Stefic, M., Tillry, S.D., and Grätzel, M., Ultrathin films on copper(I) oxide water splitting photocathodes: a study on performance and stability. Energy & Environmental Sci., 2012, vol. 5, p. 8673.
An, X., Li, K., and Tang, J., Cu2O/Reduced Graphene Oxide Composites for the Photocatalytic Conversion of CO2, ChernSusChem, 2014, vol. 7, p. 1086.
Dong, X., Wang, K., Zhao, C., Qian, X., Chen, S., Li, Z., Liu, H., and Dou, S., Direct synthesis of RGO/Cu2O composite films on Cu foil foil supercapacitors, J. Alloys and Compounds, 2014, vol. 586, p. 745.
Liu, S.-H. and Yang, S.-W., Highly Efficient Cuprous Oxide Nanocrystals Assisted with Graphene for Decolorization Using Visible Light, Water, Air, & Soil Pollution, 2018, vol. 229, p. 67.
Qiu, X. -y., Liu, S.-j., and Xu, D.-z., Yolk-shell structured Cu2O as a high-performance cathode catalyst for the rechargeable Li–O2 batteries, J. Mater. Sci., 2018, vol. 53. p. 1318.
Kristin, B., Heine, N.R., Sandeep, G., Per, F.L., Indvild, J.T.I., Anette, E.G., Augustinas, G., Spuros, D., Bengt, G.S., and Edouard, M., Improving carrier transport in Cu2O thin films by rapid thermal annealing, J. Physics: Condensed Matter, 2018, vol. 30, p. 075702.
Rajesh Kumar, B, Hymavathi, B., and Subba Rao, T., Structural and Optical Properties of Nanostructured Cu2O Thin Films for Optoelectronic Devices, Materials Today: Proceedings, 2017, vol. 4. p. 3903.
Ma, Q.-B., Hofmann, J.P., Litke, A., and Hensen, E.J.M., Cu2O photoelectrodes for solar water splitting: Tuning photoelectrochemical by controlled faceting, Solar Energy Materials and Solar Cells, 2015, vol. 141, p. l78.
Deng, X., Zhang, Q., Zhao, Q., Ma, L., Ding, M., and Xu, X., Effects of architectures and H2O2 additions on the photocatalytic performance of hierarchical Cu2O nanostructures, Nanoscale res. letters, 2015, vol. 10. p. 8.
Paracchino, A., Laporte, V., Sivula, K., Grätzel, M., and Thimsen, E., Highly active oxide photocathode for photoelectrochemical water reduction, Nature materials, 2011, vol. 10. p. 456.
Luo, J., Steier, L., Son, M.-K., Schreier, M., Mayer, M.T., and Grätzel, M., Cu2O Nanowire Photocathodes for Efficient and Durable Solar Water Splitting, Nano Letters, 2016, vol. 16, p. 1848.
Azevedo, J., Tilley, S.D., Schreier, M., Stefik, M., Sousa, C., Araújo J.P., Mendes, A., Grätzel, M., and Mayer, M.T., Tin oxide as stable protective layer for composite cuprous oxide water-splitting photocathodes, Nano Energy, 2016, vol. 24, p. 10.
Pavan, M., Rühle, S., Ginsburg, A., Keller, D.A., Barad, H.-N., Sberna, P.M., Nunes, D., Martins, R., Anderson, A.Y., Zaban, A., and Fortunato, E., TiO2/Cu2O all-oxide heterojunction solar cells produced by spray pyrolysis, Solar Energy Materials and Solar Cells, 2015, vol. 132, p. 549.
Wang, W., Huang, X., Wu, S., Zhou, Y., Wang, L., Shi, H., Liang, Y., and Zou, B., Preparation of p–n junction Cu2O/BiVO4 heterogeneous nanostructures with enhanced visible-light photocatalytic activity, Appl. Catal. B: Environmental, 2013, vol. 134, p. 293.
Liu, Y., Zhang, W., Bian, L., Liang, W., Zhang, J., and Yu, B., Structure, morphology and photocatalytic activity of Cu2O/Pt/TiO2 three-layered nanocomposite films, Mater. Sci. in Semiconductor Proc., 2014, vol. 21, p. 26.
Kargar, A., Partokia, S.S., Niu, M.T., Allameh, P., Yang, M., May, S., Cheung, J.S., Sun, K., Xu, K., and Wang, D., Solution-grown 3D Cu2O networks for efficient solar water splitting, Nanotechnology, 2014, vol. 25, p. 205401.
Wu, G., Zhai, W., Sun, F., Chen, W., Pan, Z., and Li, W., Morphology-controlled electrodeposition of Cu2O microcrystalline particle films for application in photocatalysis under sunlight, Mater. Res. Bull., 2012, vol. 47, p. 4026.
Mahalingam, T., Chitra, J., Ravi, G., Chu, J., and Sebastian, P., Characterization of pulse plated Cu2O thin films, Surface and Coatings Technology, 2003, vol. 168, p. 111.
Hu, F., Chan, K., Yue, T., and Surya, C., Electrochemical synthesis of transparent nanocrystalline Cu2O films using a reverse potential waveform, Thin Solid Films, 2014, vol. 550, p. 17.
Dubale, A.A., Su, W.-N., Tami.rat, A.G., Pan, C.-J., Aragaw, B.A., Chen, H.-M., Chen, C.-H., and Hwang, B.-J., The synergetic effect of graphene on Cu2O nanowire arrays as a highly efficient hydrogen evolution photocathode in water splitting, J. Mater. Chem. A, 2014, vol. 2, p. 18383.
Yang, Y., Li, Y., and Pritzker, M., Control of Cu2O Film Morphology Using Potentiostatic Pulsed Electrodeposition, Electrochimica Acta, 2016, vol. 213, p. 225.
Moharam, M., Elsayed, E., Nino, J., Abou-Shahba, R., and Rashad, M., Potentiostatic deposition of Cu2O films as p-type transparent conductors at room temperature, Thin Solid Films, 2016, vol. 616, p. 760.
Grujicic, D. and Pesic, B., Electrodeposition of copper: the nucleation mechanisms, Electrochimica Acta, 2002, vol. 47, p. 2901.
Lai, Y., Liu, F., Li, J., Zhai1g, Z., and Liu, Y., Nucleation ai1d growth of selenium electrodeposition onto tin oxide electrode, J. Electroanalyt. Chem., 2010, vol. 639, p. 187.
Messaoudi, O., Gannouni, M., Souissi, A., Makhlouf, H., Bardaoui, A., and Chtourou, R., Structural, morphological and electrical characteristics of electrodeposited Cu2O: effect of deposition time, Appl. Surface Sci., 2016, vol. 366, p. 383.
Yang, Y., Li, Y., and Pritzker, M., Control of Cu2O Film Morphology Using Potentiostatic Pulsed Electrodeposition, Electrochim. Acta, 2016, vol. 213, p. 225.
Liu, Y., Liu, Y., Mu, R., Yang, H., Shao, C., Zhang, J., Lu, Y., Shen, D., and Fan, X., The structural and optical prope1iies of Cu2O films electrodeposited on different substrates, Semiconductor science and technology, 2004, vol. 20, p. 44.
Cao, D., Nasori, N., Wang, Z., Wen, L., Xu, R., Mi, Y., and Lei, Y., Facile surface treatment on Cu2O photocathodes for enhancing the photoelectrochemical response, Appl. Catal. B: Enviromnental, 2016, vol. 198, p. 398.
Shi, W., Zhang, X., Li, S., Zhang, B., Wang, M., and Shen, Y., Carbon coated Cu2O nanowires for photo-electrochemical water splitting with enhanced activity, Appl. Surface Sci., 2015, vol. 358, p. 404.
Paracchino, A., Brauer, J.C., Moser, J.-E., Thimsen, E., and Graetzel, M., Synthesis and characterization of high-photoactivity electrodeposited Cu2O solar absorber by photoelectrochemistry and ultrafast spectroscopy, The J. Phys. Chem., C, 2012, vol. 116, p. 7341.
Rajendran, R., Yaakob, Z., Teridi, M.A.M., Rahaman, M.S.A., and Sopian, K., Preparation of nanostrnctured p-NiO/n-Fe2O3 heterojunction and study of their enhanced photoelectrochemical water splitting performance, Mater. Letters, 2014, vol. 133, p. 123.
Badia-Bou, L., Mas-Marza, E., Rodenas, P., Barea, E.M., Fabregat-Santiago, F., Gimenez, S., Peris, E., and Bisquert, J., Water oxidation at hematite photoelectrodes with an iridium-based catalyst, J. Phys. Chem., C, 2013, vol. 117, p. 3826.
Annamalai, A., Kannan, A.G., Lee, S.Y., Kim, D.-W., Choi, S.H., and Jang, J.S., Role of graphene oxide as a sacrificial interlayer for enhanced photoelectrochemical water oxidation of hematite nanorods, J. Phys. Chem., C, 2015, vol. 119, p. 19996.
Grez, P., Herrera, F., Riveros, G., Henriquez, R., Ramirez, A., Mufioz, E., Dalchiele, E., Celedon, C., and Schrebler, R., Synthesis and characterization of p‑Cu2O nanowires arrays, Mater. Letters, 2013, vol. 92, p. 413.
Das, V.D. and Damodare, L., A study of substrate variation effects on the prope1iies of n-CdSe0.TTe0.3 thin film/polysulphide photoelectrochemical solar cells, Mater. Chem. and Phys., 1998, vol. 56, p. 48.
Дополнительные материалы отсутствуют.



