Электрохимия, 2020, T. 56, № 8, стр. 760-768
Высокопроизводительный наноструктурированный катодный материал LiFePO4/C, синтезированный из недорогого сырья на основе железа(III) с использованием полимера
В. Пу a, b, В. Лю a, *, **, Ж. Чен a, К. Сие c, Ч. Жен c
a Анхойский Университет
230601 Хефей, КНР
b Академия артиллерии и ПВО Народной армии КНР
230031 Хефей, КНР
c Национальный Университет оборонных технологий
410073 Чангша, КНР
* E-mail: wenjingpu@outlook.com
** E-mail: weilu0818@ahu.edu.cn
Поступила в редакцию 22.04.2019
После доработки 02.07.2019
Принята к публикации 29.07.2019
Аннотация
Наноструктурированный композит LiFePO4 со сферической морфологией был синтезирован из недорогого сырья на основе железа(III) с использованием полимера и покрыт углеродом. Процесс синтеза включал две стадии: (1) композит нано-FePO4/полианилин со структурой core–shell был синтезирован методом in situ полимеризации анилина; (2) композит LiFePO4/C был приготовлен методом карботермического восстановления с использованием в качестве сырья нано-FePO4/полианилин и сахарозы. Структуру, морфологию поверхности материалов и свойства углеродного покрытия исследовали методами рентгенодифракционного анализа, рамановской спектроскопии, сканирующей электронной микроскопии и просвечивающей электронной микроскопии высокого разрешения. Полученный наноструктурированный композит LiFePO4/углерод имел сферическую морфологию, упорядоченную оливиновую структуру, был покрыт слоем аморфного углерода толщиной 2 нм. В то же время этот аморфный углерод, образовавшийся при разложении сахарозы, скреплял частицы материала между собой. Анилин играл важную роль в процессе синтеза. Электрохимические свойства материалов испытывали методом снятия кривых заряда–разряда. Полученный наноструктурированный композит LiFePO4/углерод продемонстрировал прекрасные электрохимические свойства, в особенности хорошую способность работать при больших токах заряда–разряда. Он показал первоначальную разрядную емкость 138, 136, 118, 103 и 92 мA ч г–1 при нормированных токах, соответственно, 0.2, 1, 10, 20 и 30 C, в интервале потенциалов 3.65–2.0 В. Это делает его перспективным катодным материалом для применения в особо мощных литий-ионных аккумуляторах. Эти прекрасные электрохимические свойства можно связать с присутствием двух типов аморфного углерода. Углеродное покрытие LiFePO4 эффективно уменьшает вероятность образования агломератов между частицами LiFePO4. Углеродные связи между частицами композита повышают электронную проводимость. Это укорачивает путь диффузии ионов лития и улучшает электрический контакт между частицами LiFePO4.
ВВЕДЕНИЕ
Все возрастающая озабоченность сохранением окружающей среды и экономией энергии привела к тому, что перезаряжаемые литий-ионные аккумуляторы все шире используются в многочисленных портативных приборах, благодаря их высокой удельной энергии, высокому напряжению и компактности [1–3]. В последнее время их исследования и коммерциализация пережили огромный рост [3–7]. Однако эти аккумуляторы все еще нуждаются в усовершенствовании, прежде чем их можно будет использовать в специальных устройствах, требующих большой энергии и мощности, таких как инструменты с механическим приводом, электромобили и гибридные средства передвижения и другие устройства с встроенными источниками электропитания [8–12]. У фосфата лития–железа (LiFePO4) со структурой оливина много преимуществ по сравнению с обычными катодными материалами, такими как LiCoO2, LiNiO2 и LiMn2O4. Внедрение и экстрагирование лития в применении к LiFePO4-электроду – это двухфазная обратимая электродная реакция [13–15]:
На кривых заряда–разряда имеется плато приблизительно при 3.5 В (по отношению к литиевому электроду сравнения), а теоретическая разрядная емкость достигает 170 мА ч г–1. Такой электрод отличается прекрасной структурной и химической стабильностью в ходе интеркаляции и термического циклирования. Однако у LiFePO4 есть большой недостаток – это его плохая электронная проводимость и низкий коэффициент диффузии иона лития, что оказывает самое неблагоприятное действие на способность аккумулятора работать при больших токах заряда–разряда. Все это затрудняет применение LiFePO4 в области больших мощностей, как, например, в электромобилях.
Что касается перечисленных выше недостатков, то применялись различные методы для увеличения электронной проводимости материала, такие как переход к наноразмерным частицам [8, 16–20], поверхностное углеродное покрытие [11, 19–25], проводящие полимеры и допирование в Li+-позиции ионами Mg2+, Mn3+, Ce3+, Zr4+, Ti4+ и Ni2+ [12, 26]. Дополнительно, некоторые исследователи сосредоточились на изучении электрохимической кинетики и механизма процесса интеркаляции лития в катодные материалы на основе LiFePO4, что, конечно, углубило и расширило исследования в этой области. Среди упомянутых методов, покрытие нанокристаллов LiFePO4 углеродом может повысить проводимость и ограничить размер кристаллитов LiFePO4, что необходимо для решения задачи работы аккумулятора при больших мощностях [10, 11, 25, 27]. В литературе имеется много сообщений о синтезе структур LiFePO4/C различными методами. Однако эти методы обычно включают высокотемпературную обработку для придания результирующим углеродистым материалам электропроводности. Но в ходе такой высокотемпературной обработки неизбежно увеличивается размер кристаллитов. Также и углерод не покрывает полностью поверхность материалов, как это описано, например, в работах [19, 20, 22, 25, 28, 29].
Добавим, что для получения чистой фазы LiFePO4 в ходе синтеза необходимо избежать окисления Fe2+ до Fe3+. Но, поскольку Fe2+ легко окисляется при такой обработке, обычно не удается получить чистую фазу LiFePO4 при использовании сырья, содержащего Fe2+. Притом, необходимые для этого соли намного дороже солей Fe3+. Согласно литературным данным [30], H2 и CO способны восстанавливать железо до более низкой степени окисления в процессе синтеза. А это говорит о том, что гораздо дешевле использовать в синтезе LiFePO4 непосредственно материалы на основе Fe(III). В 2015 г. был разработан метод на основе процесса окисления полимерного геля, для образования которого используют различные количества анилина в качестве мономера. Окончательный размер частиц LiFePO4/C зависит от первоначального количества мономера, используемого в процессе синтеза. Приготовленный таким образом катодный материал LiFePO4/C обладает лучшей способностью работать при больших токах заряда–разряда, благодаря малому размеру частиц, более низкому сопротивлению переноса заряда и более высокому коэффициенту диффузии иона Li+ [31].
В настоящей работе наноструктурированный катодный композит LiFePO4 с углеродным покрытием и сферической морфологией был синтезирован из недорогого сырья на основе железа(III) с использованием полимера. Процесс синтеза, в котором анилин играл важную роль, включал две стадии. Свежеприготовленный композит LiFePO4/C содержал два типа аморфного углерода, и это существенно улучшило электронную проводимость материала. Композит показал высокую разрядную емкость (около 118 мA ч г–1) при режиме заряда–разряда 10 C и прекрасную циклируемость. Это делает его перспективным катодным материалом для применения в особо мощных электрохимических устройствах, таких как литий-ионные аккумуляторы и суперконденсаторы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катодных материаов FePO4/ПАНИ и LiFePO4/С
NH4H2PO4 (Aldrich, 99%) и (NH4)2HPO4 (Aldrich, 99%) с мольным отношением 1 : 1 растворяли в деионизованной воде. Затем к раствору добавляли анилин (Aldrich, 99.5%) и небольшое количество эмульгатора tween-60 (обозначим его, как раствор A). Fe(NO3)3 (Aldrich, 99.9%) в эквимолярном количестве по отношению к [PO4]3– растворяли в деионизованной воде (обозначим его, как раствор Б). Затем раствор Б медленно приливали к раствору A при помешивании. Величину рН регулировали с помощью насыщенного раствора NH4HCO3 (Sinopharm Group Co., Ltd., 99%). Реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Образовавшийся FePO4/ПАНИ (ПАНИ = полианилин) отфильтровывали и несколько раз промывали деионизованной водой.
Эквимолярную смесь CH3COOLi ⋅ 2H2O (Alfa Aesar, 99.9%) с FePO4/ПАНИ, содержащую некоторое количество сахарозы (Sigma–Aldrich, 99.5%), диспергировали в этаноле и использовали в качестве прекурсора. После размола в течение приблизительно 1 ч прекурсор нагревали при 400°C в течение 4 ч в атмосфере Ar с примесью 5% H2 (Jingxiang, 99.999%) для того, чтобы разложить органические соединения. Затем прекурсор вновь размалывали в течение приблизительно 1 ч и в конце концов прокаливали при 700°C в течение 10 ч в атмосфере Ar с примесью 5% H2 для получения композита.
Структурные характеристики
Прекурсор характеризовали методами дифференциальной сканирующей калориметрии–термогравиметрического анализа на термогравиметрическом анализаторе TA SDT Q600 (США) в смешанной атмосфере (Ar : H2 = 95 : 5). Рамановские спектры образцов снимали на рамановском спектрометре Bruker RAM, Германия. Кристаллическую структуру порошка LiFePO4/C идентифицировали методом рентгенодифракционного анализа на приборе D/Max-2500 (Япония) в CuKα-излучении при сканировании в интервале углов 20°–45°. Размер частиц и их морфологию изучали методом автоэлектронной сканирующей микроскопии (SEM) на приборе S-4800 (Hitachi, Япония). Природу и толщину углеродного покрытия изучали по изображениям, полученным с помощью просвечивающей электронной микроскопии высокого разрешения (HRTEM) на микроскопе JEM-2100 JEOL (Япония).
Электрохимические измерения
Электрохимические свойства полученных материалов исследовали в двухэлектродном испытательном элементе с литиевой фольгой в качестве отрицательного электрода. Положительный электрод готовили, намазывая пасту из наноструктурированного композита LiFePO4, ацетиленовой сажи и поливинилиденфторида (связующее) в отношении 80 : 10 : 10 (вес. %) на коллектор тока из алюминиевой фольги. Фольга с пленкой из этой пасты подвергалась вальцовке, затем из нее вырубали электроды диаметром 10 мм. Положительные электроды сушили при 120°C в течение 12 ч в вакуумной печи. Для сравнения готовили положительные электроды также из коммерческого порошка LiFePO4 с зерном микронного размера (в дальнейшем обозначен, как образец A), приобретенного у компании Hao Run Technology Co., Ltd., с той же поверхностной плотностью, что и электроды из композита LiFePO4/C. Элементы собирали в перчаточном боксе в атмосфере аргона с электролитом 1 М LiPF6 в смеси диэтилкарбонат–диметилкарбонат (1 : 1 по объему) и сепаратором Celgard 2400. Кривые заряда–разряда снимали на многоканальном приборе для тестирования аккумуляторов LAND CT2001A (КНР) в гальваностатическом режиме при различных скоростях между напряжениями 2.0 и 3.85 В.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структурные, морфологические и физические свойства
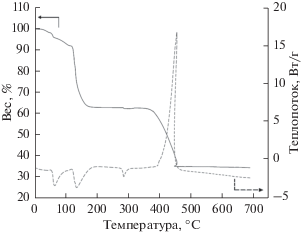
Рисунок 1 показывает кривые дифференциальной сканирующей калориметрии и термогравиметрического анализа прекурсора, снятые в смешанной атмосфере (Ar : H2 = 95 : 5). Видно, что потеря веса на участке от комнатной температуры до 120°C составляет приблизительно 12 вес. % и связана с испарением воды. В интервале от 120 до 150°C потеря веса составляет 29 вес. %, что вызвано пиролизом сахарозы и полианилина, сопровождающимся декалесценцией (поглощением тепла при аллотропических превращениях веществ). В интервале от 360 до 450°C Fe3+ восстанавливается до Fe2+ и образует LiFePO4 с потерей веса 26 вес. %. В то же время на кривой дифференциальной сканирующей калориметрии наблюдается экзотермический пик при 400–450°C. Он показывает, что LiFePO4 может образоваться и при температуре выше 450°C. Рентгеновские дифрактограммы показывают, что элемент железо существует главным образом, как FePO4, Fe7(PO4)6 и Fe3(PO4)2, а небольшое количество – в форме LiFePO4. С ростом температуры образуется кристаллический LiFePO4. Углерод, образовавшийся в результате пиролиза сахарозы и полианилина, в ходе синтеза производит два действия. Он может восстанавливать Fe3+ до Fe2+, а также сдерживать рост кристаллитов LiFePO4.
Рис. 1.
Кривые дифференциальной сканирующей калориметрии и термогравиметрического анализа прекурсора, снятые в смешанной атмосфере (Ar : H2 = = 95 : 5).
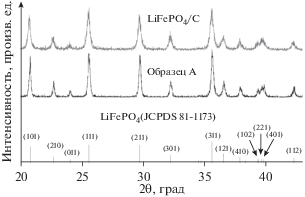
На рис. 2 даны рентгеновские дифрактограммы коммерческого образца A и наноструктурированного композита LiFePO4/C. Ясно видно, что на дифрактограмме образца А (наноструктурированный композит LiFePO4/C) имеются четыре сильных дифракционных пика при 2θ = 20.68° (101), 25.50° (111), 29.69° (211) и 35.54° (311). Кроме того, при 2θ = 22.63°, 23.99°, 32.18°, 36.46°, 37.83°, 39.24° и 42.16° появляется слабый пик. Все эти пики согласуются со стандартом LiFePO4 (JCPDS 81-1173), что доказывет присутствие фазы LiFePO4 в упорядоченной структуре оливина. Согласно уравнению Шеррера, размер кристаллов наноструктурированного композита LiFePO4/C равен приблизительно 50.2 нм, что указывает на высокую степень кристалличности. В то же время на дифрактограмме отсутствуют пики, относящиеся к углероду, скорее всего, из-за того, что в наноструктурированном композите LiFePO4/C может присутствовать аморфный углерод или небольшое количество кристаллического.
На рис. 3 показан рамановский спектр наноструктурированного композита LiFePO4/C. Рамановская спектроскопия – важный способ исследования свойств углерода. Типичные характеристики углерода в рамановском спектре – это две широких полосы при 1350 и 1582 cм–1, называемые соответственно, D-полосой (разупорядоченная/дефектная, disorder/defect) и G-полосой (графитовая, graphitic). Именно эти две полосы наблюдаются в рамановском спектре наноструктурированного композита LiFePO4/C. Это указывает на то, что углерод состоит из аморфной фазы и небольшой примеси графитизированного углерода. Электронная проводимость композита коррелирует сложным образом с интенсивностью отношения пиков и полос D и G. Это отношение (ID/IG) для синтезированного порошка равняется 0.92, указывая на то, что углеродное покрытие может состоять из аморфной фазы. Данный результат согласуется с данными рентгенофазового анализа, показавшего отсутствие в дифрактограммах наноструктурированного композита LiFePO4/C дифракционных полос, принадлежащих графитизированному углероду.
Морфологию поверхности частиц прекурсора и образца LiFePO4/C, а также форму частиц углеродного покрытия исследовали методами сканирующей электронной микроскопии и просвечивающей электронной микроскопии высокого разрешения, как показано на рис. 4. Рисунок 4a показывает, что порошок прекурсора FePO4/ПАНИ имеет сферическую морфологию, а диаметр частиц составляет приблизительно 30 нм. Как показано на рис. 4б, диаметр частиц наноструктурированного композита LiFePO4/C – около 55 нм. В отличие от прекурсора FePO4/ПАНИ, диаметр частиц наноструктурированного композита LiFePO4/C оказался больше. Изображения, полученные методом просвечивающей электронной микроскопии высокого разрешения (рис. 4в), показывают, что FePO4 аморфный и что между FePO4 и ПАНИ нет четкой границы. На рис. 4г ясно видны регулярные кристаллические грани частиц LiFePO4 и слабо закристаллизованный слой покрытия. Видно, что толщина углеродного покрытия составляет около 2 нм. Эти результаты в совокупности с данными рентгенофазового анализа и рамановской спектроскопии могут помочь нам убедиться в том, что эти зерна имеют структуру core–shell с кристаллическим ядром из LiFePO4 и оболочкой – углеродным покрытием. Зерна LiFePO4 имеют сферическую форму, они полностью покрыты слоем углерода. Результирующий композит LiFePO4/C способен работать при больших токах заряда–разряда благодаря своей улучшенной электронной проводимости, обеспечиваемой углеродным покрытием.
Рис. 4.
SEM-микрофотографии (a) частиц прекурсора и (б) наноструктурированного композита LiFePO4/C; HRTEM-микрофотографии (в) порошка прекурсора FePO4/ПАНИ и (г) частиц LiFePO4 и углеродного слоя.

Энергодисперсионный рентгено-спектральный микроанализ показал, что различные участки композита LiFePO4/C отличаются различным содержанием углерода. Как видно из рис. 4б, содержание углерода в точке “b” намного больше, чем в точке “а”. Их отношение составляет приблизительно 4 : 1, вероятнее всего, из-за того, что углерод в точке “b” происходит от разложения сахарозы, а углерод в точке “а” – от разложения ПАНИ. Эти результаты помогают понять распределение углерода в наноструктурированном LiFePO4 и причину того, что этот композит способен работать при больших токах заряда–разряда.
Электрохимическое поведение
Для того чтобы оценить возможные применения наноструктурированного композита LiFePO4/C в качестве катодного материала в литий-ионных аккумуляторах, мы исследовали его электрохимическое поведение в отношении внедрения–экстракции Li. На рис. 5 даны циклические вольтамперограммы композита LiFePO4/C при различных скоростях развертки потенциала. На вольтамперограммах видна пара окислительно-восстановительных пиков тока: на кривой, снятой при скорости развертки потенциала 0.1 мВ с–1, они лежат между 3.3 и 3.5 В (отн. Li/Li+-электрода сравнения). Эти пики соответствуют экстракции и внедрению ионов лития. Эти же пики ясно наблюдаются при скорости развертки потенциала 0.9 мВ с–1. Они говорят о том, что композит хорошо работает в режиме большой мощности. Этот результат согласуется с тестом в двухэлектродной ячейке, как видно из рис. 6 и табл. 1.
Рис. 5.
Циклические вольтамперограммы наноструктурированного композита LiFePO4/C, снятые при различных скоростях развертки потенциала.

Рис. 6.
4-е кривые заряда–разряда наноструктурированного композита LiFePO4/C, снятые при различных режимах.

Таблица 1.
Разрядная емкость и сохранение разрядной емкости при различных значениях QnC/Q0.2C для наноструктурированного композита LiFePO4/C при различных режимах заряда–разряда
| Режим разряда | Разрядная емкость, мА ч г–1 | QnC/Q0.2C, % |
|---|---|---|
| 0.2 C | 138 | 100 |
| 1 C | 136 | 98.6 |
| 10 C | 118 | 85.5 |
| 20 C | 103 | 74.6 |
| 30 C | 92 | 66.7 |
Чтобы исследовать рабочее напряжение и работу при больших токах заряда–разряда, LiFePO4/C-электроды подвергали разряду различными нормированными токами, как показано на рис. 6. На каждой ступени заряда электрод заряжали током 0.2 C, а затем разряжали с все увеличивающимися токами. При низких токах разряда (0.2, 1 C) кривые заряда–разряда наноструктурированного композита LiFePO4/C почти не изменялись, как и разрядная емкость (138.0, 142.5 мА ч г–1); сохранялось и плоское плато. Это плоское плато наблюдается при каждом C-режиме. Даже при 20 C плато разряда остается выше 3.0 В (отн. Li/Li+-электрода сравнения), а измеряемая емкость превышает 103 мА ч г–1. Более того, разность напряжений плато заряда и плато разряда составила, соответственно, 0.1, 0.15, 0.5 и 0.7 В при режимах заряда–разряда 0.2, 1.0, 10 и 20 C. Этот результат показывает, что электрод из наноструктурированного композита LiFePO4/C отличается низкой поляризацией, хорошей электропроводностью и способен работать при больших токах заряда–разряда.
Сохранение разрядной емкости (QnC/Q0.2C, n = = 0.2, 1, 10, 20, 30) для LiFePO4/C при различных разрядных токах продемонстрировано в табл. 1. Видно, что наноструктурированный композит LiFePO4/C способен работать при больших токах заряда–разряда. При режимах заряда–разряда 10, 20 и 30 C разрядная емкость сохраняется на 85.5, 74.6 и 66.7%; она равняется, соответственно, 118, 103 и 92 мА ч г–1. На основании этих результатов можно заключить, что наноструктурированный композит LiFePO4/C обладает способностью работать при больших токах заряда–разряда, что можно объяснить его оптимальной структурой.
На рис. 7 показана разрядная емкость, измеренная при различных токах заряда–разряда (0.2, 1.0, 10 , 20 , 30 и 40 C) как функция числа циклов для наноструктурированного композита LiFePO4/C и для коммерческого образца A. В режиме 0.2 C наноструктурированный композит и коммерческий образец A достигли разрядной емкости, соответственно, 138 и 158 мА ч г–1. После 50 циклов при различных токах заряда–разряда обратимая емкость этих двух материалов остается равной 138 и 158 мА ч г–1, что говорит о хорошем сохранении обратимой емкости и хорошей циклируемости даже в условиях больших токов заряда–разряда. Но из рисунка можно видеть, что при более высоких токах заряда–разряда обратимая емкость наноструктурированного композита LiFePO4/C выше, чем емкость образца A. Видно, что у наноструктурированного композита LiFePO4/C хорошие эксплуатационные характеристики.
Рис. 7.
Циклирование наноструктурированного композита LiFePO4/C при различных режимах заряда–разряда: сравнение с коммерческим образцом A.

Причину этих хороших эксплуатационных характеристик наноструктурированного композита LiFePO4/C следует приписать углероду, покрывающему поверхность LiFePO4, а также обеспечивающему промежуточное сцепление его частиц, как показано на рис. 8. Согласно литературным данным, хотя проводящий углерод и добавляется к электродным материалам в ходе их приготовления, он не может образовать эффективной пространственной структуры вследствие дисперсии. Поэтому при интеркаляции LiFePO4 электронам не удается достичь всех возможных позиций, в которых находятся интеркалированные ионы Li+, и это приводит к поляризации электрода, в особенности при условиях больших токов заряда–разряда. А в композите, приготовленном методом с использованием полимера, LiFePO4 полностью покрыт проводящим углеродом, который происходит от разложения ПАНИ. Ионы лития могут легко интеркалироваться в LiFePO4 сквозь углеродную оболочку (толщиной около 2 нм). Более того, между полностью покрытыми углеродом частицами LiFePO4 углерод, происходящий от разложения сахарозы, обеспечивает промежуточное сцепление, образуя в композите проводящую сетчатую структуру. Когда происходит интеркаляция ионов Li+, электроны могут достичь всех возможных позиций в этой проводящей сети. Это снимает явления поляризации и обеспечивает работоспособность при любых токах заряда–разряда.
ЗАКЛЮЧЕНИЕ
Наноструктурированный композит LiFePO4, покрытый углеродом со сферической морфологией, синтезирован методом с использованием полимера из недорогого сырья на основе железа(III). Этот катодный материал имеет разрядную емкость 138, 136, 118, 103 и 92 мA ч г–1 при режимах заряда–разряда, соответственно, 0.2, 1, 10, 20 и 30 C. Наноструктурированный композит LiFePO4 демонстрирует хорошую работоспособность при различных токах заряда–разряда и хорошую циклируемость. Эти прекрасные эксплуатационные характеристики композита следует приписать углероду, покрывающему поверхность LiFePO4, а также обеспечивающему промежуточное сцепление его частиц. Предложенный метод синтеза с использованием недорогого сырья на основе Fe(III) в комбинации с сахарозой в качестве органического источника углерода представляет собой легкий и энергосберегающий путь к синтезу высокопроизводительного наноструктурированного композита LiFePO4/С для литий-ионных аккумуляторов.
Список литературы
Chen, S.e, Zheng, J., Mei, D., Han, K.S., Engelhard, M.H., Zhao, W., Xu, W., Liu, J., and Zhang, J., High-Voltage Lithium-Metal Batteries Enabled by Localized High-Concentration Electrolytes, Adv. Mater., 2018, vol. 30(21), p. 1706102.
Liu, Y., Xie, K., Pan, Y., Li, Y., Wang, H., Lu, W., and Zheng, C., LiPON as a protective layer on graphite anode to extend the storage life of Li-ion battery at elevated temperature, Ionics, 2018, vol. 24, p. 723.
Lu, W., Xiong, S., Pu, W., Xie, K., and Zheng, C., Carbonate-Grafted Polysilane as a New Additive for Elevated-Temperature Lithium-Ion Batteries, ChemElectroChem, 2017, vol. 4, p. 2012.
Lu, W., Xie, K., Chen, Z., Pan, Y., and Zheng, C., Preparation and characterization of trifluoroethyl aliphatic carboxylates as co-solvents for the carbonate-based electrolyte of lithium-ion batteries, J. Fluorine Chem., 2014, vol. 161, p. 110.
Lu, W., Xiong, S., Xie, K., Pan, Y., and Zheng, C., Identification of solid electrolyte interphase formed on graphite electrode cycled in trifluoroethyl aliphatic carboxylate-based electrolytes for low-temperature lithium-ion batteries, Ionics, 2016, vol. 22(11), p. 2095.
Lu, W., Xie, K., Pan, Y., Chen, Z., and Zheng, C., Effects of carbon-chain length of trifluoroacetate co-solvents for lithium-ion battery electrolytes using at low temperature, J. Fluorine Chem., 2013, vol. 156, p. 136.
Lu, W., Xie, K., Chen, Z., Xiong, S., Pan, Y., and Zheng, C., A new co-solvent for wide temperature lithium ion battery electrolytes: 2,2,2-Trifluoroethyl-n-caproate, J. Power sources, 2015, vol. 274, p. 676.
Chen, Y., Xiang, K., Zhou, W., Zhu, Y., Bai, N., and Chen, H., LiFePO4/C ultra-thin nano-flakes with ultra-high rate capability and ultra-long cycling life for lithium ion batteries, J. Alloys Compounds, 2018, vol. 749, p. 1063.
Tsuda, T., Ando, N., Matsubara, K., Tanabe, T., Itagaki, K., Soma, N., Nakamura, S., Hayashi, N., Gunji, T., Ohsaka, T., and Matsumoto, F., Improvement of high-rate charging/discharging performance of a lithium ion battery composed of laminated LiFePO4 cathodes/graphite anodes having porous electrode structures fabricated with a pico-second pulsed laser, Electrochim. Acta, 2018, vol. 291, p. 267.
Feng, J. and Wang, Y., High-rate and ultralong cycle-life LiFePO4 nanocrystals coated by boron-doped carbon as positive electrode for lithium-ion batteries, Appl. Surf. Sci., 2016, vol. 390, p. 481.
Guo, H. and Gao, Q., High-performance LiFePO4/C nanocomposites prepared from a micro-reactor based on an unusual water–oil system, RSC Advances, 2013, vol. 3, p. 7245.
Kim, S., Mathew, V., Kang, J, Gim, J., Song, J., Jo, J., and Kim, J., High rate capability of LiFePO4 cathodes doped with a high amount of Ti, Ceramics Int., 2016, vol. 42, p. 7230.
Takahashi, I., Mori, T., Yoshinari, T., Orikasa, Y., Koyama, Y., Murayama, H., Fukuda, K., Hatano, M., Arai, H., Uchimoto, Y., and Terai, T., Irreversible phase transition between LiFePO4 and FePO4 during high-rate charge-discharge reaction by operando X-ray diffraction, J. Power Sources, 2016, vol. 309, p. 122.
Kuei-Feng Hsua, B. S. H. B. Tsay, S., Chou, T., Sheu, H., Lee, J., and Hwang, B., Formation mechanism of LiFePO4/C composite powders investigated by X-ray absorption spectroscopy, J. Power Sources, 2009, vol. 192, p. 660.
Yi, X., Zhang, F., Zhang, B., Yu, W., Dai, Q., Hu, S., He, W., Tong, H., Zheng, J., and Liao, J., (010) facets dominated LiFePO4 nano-flakes confined in 3D porous graphene network as a high-performance Li-ion battery cathode, Ceram. Internat., 2018, vol. 44, p. 18181.
Shang, H., Chu, W., Cheng, J., Pan, F., Cheng, D., Xia, D., Wang, W., and Wu, Z., Surface Phase Composition of Nanosized LiFePO4 and Their Enhanced Electrochemical Properties, J. Materi. Chem. A, 2013.
Zhang, L. and Liang, H., Rapid Synthesis of LiFePO4 Nanoparticles by Microwave-Assisted Hydrothermal Method, Russ. J. Electrochem., 2013, vol. 49(5), p. 492.
Liu, J., Zhang, X., Wang, R., and Zhang, J., Facile Synthesis of LiFePO4 Nanoparticles Coated by Few Layers of PAS with Quasi-Graphene Structure, Int. J. Electrochem. Sci., 2012, vol. 7, p. 12983.
Chen, M., Kou, K., Tu, M., Hu, J., Du, X., and Yang, B., Conducting reduced graphene oxide wrapped LiFePO4/C nanocrystal as cathode material for high-rate lithium secondary batteries, Solid State Ionics, 2017, vol. 310, p. 95.
Xie, G., Zhu, H., Liu, X., and Yang, H., A Core–shell LiFePO4/C nanocomposite prepared via a sol–gel method assisted by citric acid, J. Alloys Compounds, 2013.
Hu, Z., Yang, D., Yin, K., Liu, J., Li, F., Gao, W., Qin, Y., and Liu, H., The effect of Lithium source on the electrochemical performance of LiFePO4/C cathode materials synthesized by Sol–gel method, Advanced Mater Res, 2013, vol. 669, p. 311.
Cech, O., Thomas, J.E., Sedlarikova, M., Fedorkova, A., Vondrak, J., Moreno, M.S., and Visintin, A., Performance Improvement on LiFePO4/C Composite Cathode for Lithium-ion Batteries, Solid State Sci., 2013.
Li, X., Shao, Z., Liu, K., Zhao, Q., Liu, G., and Xu, B., Influence of Li : Fe molar ratio on the performance of the LiFePO4/C prepared by high temperature ball milling method, J. f Electroanal. Chem., 2017, vol. 801, p. 368.
Shangguan, E., Fu, S., Wu, S., Wan, Q., Wu, C., Li J., Cai, X., Chang, Z., Wang, Z., Li, Q., and Jiang, K., Evolution of spent LiFePO4 powders into LiFePO4/C/FeS composites: A facile and smart approach to make sustainable anodes for alkaline Ni–Fe secondary batteries, J. Power Sources, 2018, vol. 403, p. 38.
Zhou, N., Uchaker, E., Liu, Y., Liu, S., Liu, Y., and Cao, G., Effect of Carbon Content on Electrochemical Performance of LiFePO4/C Thin Film Cathodes, Int. J. Electrochem. Sci., 2012, vol. 7, p. 12633.
Zhao, N., Li, Y., Zhi, X., Wang, L., Zhao, X., Wang, Y., and Liang, G., Effect of Ce3+ doping on the properties of LiFePO4 cathode material, J. Rare Earths, 2016, vol. 34(2), p. 174.
Zhao, C, Wang, L., Chen, J., and Gao, M., Environmentally benign and scalable synthesis of LiFePO4 nanoplates with high capacity and excellent rate cycling performance for lithium ion batteries, Electrochim. Acta, 2017, vol. 255, p. 266.
Li, X., Shao, Z., Liu, K., Zhao, Q., Liu, G., and Xu, B., A facile ultrasound assisted high temperature ball milling synthesis of LiFePO4/graphene with enhanced electrochemical performance, Int. J. Hydrogen Energy, 2018, vol. 43, p. 18773.
Wang, Q., Peng, D., Chen, Y., Xia, X., Liu, H., He, Y., and Ma, Q., A facile surfactant-assisted self-assembly of LiFePO4/graphene composites with improved rate performance for lithium ion batteries, J. Electroanal. Chem., 2018, vol. 818, p. 68.
Wang, Y., Wang, Y., Hosono, E., Wang, K., and Zhou, H., The Design of a LiFePO4/Carbon Nanocomposite With a Core–Shell Structure and Its Synthesis by an in situ Polymerization Restriction Method, Angew. Chem., 2008, vol. 47, p. 7461.
Sehrawat, R. and Sil, A., Polymer gel combustion synthesis of LiFePO4/C composite as cathode material for Li-ion battery, Ionics, 2015, vol. 21(3), p. 673.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия