Электрохимия, 2020, T. 56, № 8, стр. 692-700
Воздуходиффузионный катод LaMnOx для первичных щелочных батарей
М. С. Язичи *
Исследовательский центр TUBITAK, Marmara, Институт энергетики
41470 Гебзе, Турция
* E-mail: suha.yazici@tubitak.gov.tr
Поступила в редакцию 23.07.2019
После доработки 24.10.2019
Принята к публикации 10.12.2019
Аннотация
Электрохимические характеристики сильноточного воздушного катода нового типа сравниваются с готовыми воздушными электродами (серия Alupower-A; Eltech-B; Duracell-C) в растворе 35% KOH. LaMnOx (LAM) изготавливается методом осаждения с образованием частиц размером менее микрона. Электрод однослойный и очень устойчив к утечке KOH. Площадь поверхности около 65 м2 г–1 является благоприятной для эффективного распределения катализатора и использования электрохимической активной области. Электрод на катализаторе типа LaMnOx работает сопоставимо или лучше, чем многие промышленные образцы. Электрод показывает падение напряжения менее 200 мВ при плотности тока 150 мА см–2. Структура электрода не имеет каких-либо признаков ограничения массообмена до 250 мА см–2.
ВВЕДЕНИЕ
Металло-воздушные батареи накапливают больше энергии на единицу массы, чем первичные батареи любого другого типа, и поддерживают постоянное напряжение в течение всего периода разряда [1]. Однако саморазряд, процесс активации и утечка электролита из воздушного электрода ограничивают широкое использование металлической воздушной батареи в приложениях с высоким током и требуют дальнейших улучшений производительности и конструкции. Способность эксплуатировать воздушно-цинковые элементы при высоких плотностях тока при сохранении приемлемой долговечности может быть достигнута главным образом путем разработки современного газодиффузионного электрода с активным управлением воздухом и достаточной каталитической активностью. Пористые электроды используются для реакции восстановления кислорода для достижения гораздо более высоких плотностей тока. Электрод состоит из композиционной структуры, которая содержит электрокатализатор на углеродной саже с большой площадью поверхности и связующий материал, представляющий собой политетрафторэтилен (PTFE), в качестве средства для защиты от влаги. Каждый компонент вносит свой вклад в трехфазный контакт посредством газопроницаемости, переноса жидкости и электронной проводимости [2]. Трехфазная граница раздела устанавливается в области пористого электрода между газом, электролитом и реагентом [3]. Природа этого интерфейса играет решающую роль в электрохимических характеристиках, особенно в системах с жидким электролитом. В таких системах газообразные реагенты (воздух или кислород) диффундируют через тонкую пленку электролита, которая смачивает части пористых электродов, в гидрофобную часть катода, и затем она достигает гидрофильной части, содержащей электролит, катализатор восстановления кислорода и электронно-проводящую среду. В этой области он электрохимически реагирует на поверхность электрода путем переноса электронов. Когда пористый электрод содержит избыточное количество электролита, электрод может быть “затоплен” и ограничивать транспорт газообразных частиц в фазе электролита. Чтобы обеспечить эффективную работу этого процесса, катод должен иметь средства, достаточную адекватную подачу кислорода в области, где происходит реакция восстановления кислорода, а также средство предотвращения затопления катода [4, 5]. Электродная структура важна для улучшения поляризационных характеристик. Баланс должен поддерживаться между электродной, электролитной и газообразной фазами в пористой электродной структуре с целью получения более высоких и более стабильных электрохимических характеристик.
Чтобы преодолеть некоторые из проблем, такие как испарение электролита, водозабор и отток воды, большинство работ сосредоточено на многослойных структурах с определенными гидрофобными и гидрофильными свойствами внутри токосъемника. Даже когда этого недостаточно, внешний пористый слой PTFE помещают для обеспечения физического барьера, который разделяет объемную газовую фазу и электролит. Чтобы увеличить скорость реакций, материал электрода должен быть каталитическим, а также проводящим и пористым, а не сплошным. В то же время важно, чтобы пористые электроды были проницаемыми как для электролита, так и для газов, но не такими, чтобы среда могла быть легко “затоплена” электролитом или “высушена” газами в одностороннем порядке [6]. Поэтому желательно иметь эффективный и оптимизированный способ обеспечения каталитически активных пористых электродов [7].
При разработке электрода тип комбинации углеродного носителя и катализатора выбирается на основании текущих требований применения. Например, для батарей слухового аппарата не требуется большой ток и они не ограничены диффузией кислорода или каталитической активностью. Следовательно, нет необходимости в дорогостоящем катализаторе или оптимизации для таких систем. В воздушных катодах газодиффузионного типа в основном используется платина в качестве катализатора для снижения ее относительно высокого перенапряжения [8–10]. Кинетика восстановления кислорода более быстрая в щелочных электролитах, чем в кислотных электролитах, и возможно использование электрокатализаторов из неблагородных металлов в щелочных электролитах. Оксиды металлов составляют ключевой ингредиент в большинстве первичных и вторичных батарей в форме порошков с большой площадью поверхности в сочетании с углеродом, поскольку более мелкие частицы обычно имеют более короткие пути диффузии, что приводит к более высокому использованию активного материала и более высокой плотности тока [11, 12]. Типичными примерами являются Ni, Ag, Pt, NiO, CoO, MnO2 и т.д. Они используются в качестве покрытия или легирования для проводящей устойчивой подложки [13, 14].
Предпринимаются попытки найти высокоэффективные и недорогие катализаторы для воздушных электродов, такие как шпинели и смешанные оксиды. Некоторые оксиды перовскитного типа, такие как La1 –xAxCoO3 (A = Ca, Sr), могут проявлять высокую каталитическую активность в реакции катодного восстановления кислорода [15]. К сожалению, эти кобальтиты могут быть нестабильными в катодных условиях. Смешанные оксиды с более высокой удельной площадью поверхности могут усиливать каталитическую активность при восстановлении кислорода. Ожидается, что благодаря смешанной проводимости смешанные оксиды перовскитного типа будут лучшими катализаторами реакции восстановления кислорода при комнатной температуре [16–18].
Низкотемпературная процедура осаждения органических веществ обеспечивала меньшие размеры частиц с очень большими активными площадями по сравнению с обычными электродами [19, 20]. Это важно для эффективного распределения и использования катализатора в качестве активной электрохимической области. Эти методы основаны на процессе сгорания и могут обеспечить смеси углерод–катализатор, очень подходящие как для пропитки катализатора, так и для изготовления электродов.
Это исследование описывает эффективность недавно разработанного катализатора для основных электродов батареи аккумулятора и сравнение с некоторыми другими, доступными через коммерческие источники. Эти коммерческие электроды не оптимизированы для различных сред, но специфичны для первичного применения в зависимости от требований тока.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При получении LaMnOx (LAM) сначала нитрат лантана и нитрат марганца медленно смешивали стехиометрически с Igepal CO-520 и Vulcan XC72R. Наконец, добавляли 10%-ный раствор раствора гидроксида тетраметиламония для инициирования и полного осаждения. Раствор высушивали и промывали водой до окончательной сушки и прокаливания (рис. 1). Трубчатая печь и печь использовались для термической обработки и синтеза порошков. Смесь углерода и катализатора обрабатывали 30% PTFE и подвергали горячему прессованию до конечной толщины 0.5 мм с никелевой сеткой в середине. Поверхностные и структурные характеристики материала были выполнены с помощью сканирующей электронной микроскопии (СЭМ).
Эксперименты проводили в растворе 35% КОН при комнатной температуре с использованием фольги Pt в качестве противоэлектрода и Hg/HgO в качестве электрода сравнения. Во время измерений поляризации не применяли коррекцию внутреннего сопротивления (падения напряжения). Тефлоновая ячейка была изготовлена с активной зоной электрода и корпусом для электрода сравнения и противоэлектрода (рис. 1). Электрод площадью около 1 см2 был подвержен воздействию воздуха с одной стороны и KOH с другой стороны. Воздух подавался в атмосферных условиях без принудительной конвекции. Использовали условия комнатной температуры и влажности. Для электрохимического исследования были использованы методы поляризации и импеданса переменного тока. Потенциостат/гальваностат Solartron с импедансной системой был использован для сбора данных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полная структура электрода для воздушного катода требует воздухораспределительной мембраны, гидрофобной воздуходиффузионной мембраны, гидрофобного проводящего слоя, воздушного электрода и сепаратора, как показано на рис. 2. Этот первый слой обеспечивает диффузию воздуха. В зависимости от требований к слабому или сильному току, размер отверстия для доступа воздуха на “распределителе воздуха” будет контролировать количество кислорода в катоде. Перекрестная функциональность (низкий и высокий ток одновременно) в одном источнике питания практически невозможна из-за саморазряда, если не применяются механические средства для регулировки воздушных отверстий в соответствии с требованиями тока. Второй слой, который пропускает воздух, но не жидкий электролит, является гидрофобным и непроводящим. В основном это кусок пористого PTFE. Толщина от 50.8 до 508 мкм обеспечивает желательные гидрофобные свойства, обеспечивая при этом эффективную диффузию газообразного топлива. Если мембрана имеет ограниченную проницаемость, это будет мешать диффузии кислорода. Третий слой представляет собой токосъемное углеродное волокно, пропитанное смесью углеродных частиц и неволокнистого полимерного вещества для удержания углеродных частиц в полотне с помощью гидрофобного фторированного этилена или пропилена в форме частиц и волокон. Полимерный связующий материал должен быть неполярным, чтобы полученный катод был гидрофобным. Тефлонизированный проводящий слой позволяет газам диффундировать из ячейки, а также предотвращает утечку электролита. Если используется менее 20% полимерного материала, слой остается гидрофильным и происходит затопление электрода, а при использовании более 40% полимерный материал будет мешать границе раздела электрод/электролит. Четвертый слой представляет собой смесь углерода, тефлона и катализатора, нанесенных на никелевый экран. В обычной катодной структуре слой катализатора затем ламинируют тефлоновым слоем с одной стороны и разделительной мембраной с другой, они должны быть частично проницаемыми как для газа-реагента, так и для электролита. Наконец, сепаратор представляет собой микропористую пластиковую мембрану, обычно полипропиленовую. Сепаратор позволяет проходить гидроксильным ионам и воде, но предотвращает контакт частиц анодного цинка с катодными материалами.
Свойства промышленных и недавно разработанных воздушных электродов приведены в табл. 1. Электроды серии A были разработаны для металлических воздушных батарей с щелочными или солевыми электролитами с различным катализатором на них. Эти электроды представляют собой 4-слойные (тефлоновый слой–углеродное волокно–Ni-токосъемник–углеродное волокно) ламинаты, которые составляют (а) токосъемник из никелевой вспененной сетки, (б) два реактивных слоя, по одному на каждой стороне токосъемника, состоящие из нетканого углеродного волокна, пропитанного смесью сажи, катализатора и добавок, и (в) микропористая пленка PTFE на воздушной стороне. Электроды были гибкими, прочными и химически стойкими к широкому спектру веществ. Электрод В был изготовлен вручную с использованием оксидов типа Mn и использован для щелочного процесса. Электрод С был извлечен из батареи слухового аппарата с целью сравнения. В этом исследовании электрод LAM был разработан как однослойная структура. Этот электрод имел большую площадь поверхности, чем другие электроды.
Таблица 1.
Список электродов, испытанных в растворе 35% КОН
| Наименование электрода | Катализатор | Диапазон плотности тока, мА см–2 | Свойства | Площадь поверхности, м2 г–1 |
|---|---|---|---|---|
| A1 (Alupower) | Марганцевый катализатор | ~10–50 | Толщина 0.5 мм; 4 слоя; солевые электролиты и морская вода | 28.6 |
| A2 (Alupower) | Серебряный катализатор | ~150 | Толщина 0.5 мм; 4 слоя | |
| A3 (Alupower) | Кобальтовая шпинель | ~150 | Толщина 0.5 мм; 4 слоя; щелочной металловоздушный | |
| A4(Alupower) | COTMPP | ~150 | ||
| A5(Alupower) | Платиновый катализатор | ~150 | ||
| B1 (Eltech) | Оксиды на основе Mn | 80–100 | Ячейки Cl2/NaOH и Al-воздушные батареи | 29.9 |
| C1 (Duracell) | Оксиды на основе Mn | ~10 | Толщина ~0.35 мм | |
| LAM (настоящая работа) | LaMnOx | 100–150 | Толщина 0.5 мм | 64.9 |
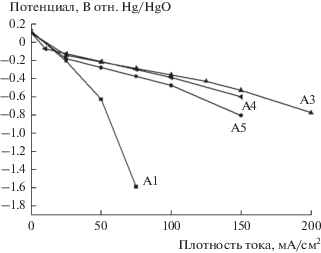
Рисунок 3 сравнивает СЭМ-изображение электрода A3 с электродом B1. А3 имеет случайно распределенные углеродные волокна, которые обеспечивают каталитический центр для реакции. В системе с жидким электролитом диффузия частиц реагента через электролит обычно является процессом, ограничивающим скорость транспорта для электрохимической реакции. Высокие плотности тока при разумной поляризации достигаются, когда слой жидкости на поверхности электрода является достаточно тонким, так что он существенно не препятствует переносу реагентов к электроактивным участкам. Когда в пористой электродной структуре присутствует избыточное количество электролита, поляризация концентрации увеличивается до большого значения, и электрод считается “затопленным”. Поверхность A3 не является однородной и может не обеспечивать оптимизированных массообменных свойств. В отличие от A3, электрод B1 имеет очень однородную поверхность и распределение частиц.
Электрод LAM был разработан, как описано в экспериментальном разделе, как однослойный электрод. СЭМ-изображения порошка углерода/катализатора показаны на рис. 4. Мелкие частицы и пористая структура распознаются при увеличении 2 мкм.
Рис. 4.
Изображения СЭМ электрода LAM при двух различных увеличениях до (сверху) и после (снизу) термической обработки.

Первый набор измерений был выполнен на этом и других электродах методом импедансной спектроскопии. Поскольку это неразрушающий метод, он не влияет на результаты измерений поляризации. На рис. 5а показан типичный импедансный отклик электрода А1. На высоких частотах (небольшая вставка) расстояние от Zre = 0 до точки, где значение импеданса режет ось х, было сопротивлением KOH между рабочим электродом и электродом сравнения. Небольшой полукруг на высоких частотах соответствовал кинетическому сопротивлению за счет переноса заряда. Поскольку эта область была чисто кинетически контролируемой, поляризационной зависимости не было. По мере того как частоты продолжали уменьшаться, начали появляться ограничения массопереноса. A3 имел самый низкий импедансный отклик среди всех электродов серии A (рис. 5б). Кинетическая устойчивость была незначительной по сравнению с А1. Этот тип электрода обеспечивал наилучшие поляризационные характеристики для серии А при комнатной температуре и влажности в 35% КОН. Импедансная характеристика электрода A3 при поляризации 150 мВ (A3 – 150 мВ) была типичным отражением пористого электрода с конечным диффузионным слоем. Поскольку электроды серии A имели одинаковую структуру, различия в импедансной характеристике могут быть связаны с типом катализатора, используемого в электродах. По сравнению с электродами серии A, у B1 был самый низкий импедансный отклик в измерениях из-за низкой массы и кинетических ограничений (рис. 5в).
Рис. 5.
Отклики импеданса переменного тока электродов A1 (a), A3 (б) и B1 (в) при различных смещениях постоянным током (при потенциале разомкнутой цепи –100 и –150 мВ). Приложенная амплитуда 10 мВ напряжения переменного тока.

Поляризация серии промышленных электродов показана на рис. 6. Все электроды серии A показали одинаковый отклик поляризации в диапазоне плотности тока менее 50 мА/см2. Очень резкое падение поляризации с A1 при более высоких плотностях тока было вызвано не массопереносом, а кинетическими ограничениями. Тип катализатора и структура электрода были наиболее определяющим фактором падения напряжения при различных плотностях тока. КОН смачивал электрод, в то время как кислород пытался диффундировать в каталитическую зону. Поскольку требовалось все больше и больше тока, уровень падения напряжения зависел от типа катализатора и структуры пор. Марганцевый катализатор, диспергированный на углеродных волокнах в A1, оказался недостаточным для поддержания плотности тока выше 50 мА см–2. Поскольку все электроды серии А имеют одинаковую структуру, лучший отклик поляризации с другими электродами серии А обусловлен лучшей кинетикой с использованием катализатора. Все электроды серий А5, А4 и А3 выполнены с плотностью тока свыше 150 мА см–2.
Электрод типа B1 показал лучшую производительность по сравнению с электродом серии A3 (рис. 7). Этот электрод содержал оксиды марганцевого типа в качестве катализатора и мог давать плотности тока выше 100 мА/см2 при поляризации 200 мВ. Это будет преобразовывать суммарный ток от 1.5 до 2 А для разрядно-воздушной батареи типа АА. Как видно на рис. 3, электрод B1 имел явное структурное отличие от электродов серии A. Его импедансный отклик был самым низким из-за низкой массы и кинетических ограничений.
Рис. 7.
Сравнение поляризации наиболее эффективных электродов серии A и электродов серий C1 и B1 для 35% KOH и атмосферного воздуха.

Электрод С был разработан для аккумуляторов слуховых аппаратов, которым требуется ток менее 10 мА. Согласно рентгеновской информации, в этих воздушных катодах использовался катализатор типа марганца, что приемлемо для слаботочных применений. Следовательно, они не могли работать выше 25 мА см–2. Несмотря на то, что электроды А1, В1 и С имели катализаторы одинакового или сходного типа, из-за их структурных различий они проявляли различные отклики при приложении тока.
Однослойная электродная структура на основе катализатора типа LaMnOx (толщиной 0.5 мм) на никелевой сетке была собрана в держатель для испытаний, упомянутый в экспериментальной части, и испытана в среде с 35% КОН при комнатной температуре. Хотя этот электрод был однослойным, он был очень устойчив к утечке. Как показано на рис. 8а, новый электрод (LAM) показал лучшие результаты, чем все электроды серии А. В кинетической области при падении 50–100 мВт все электроды показали одинаковый отклик. Реальные различия между электродами проявились в области массопереноса при средних и высоких плотностях тока, где использование катализатора и его структура становятся важными. Эти электроды были предназначены для газожидкостного взаимодействия при плотностях тока около 100–150 мА см–2. Это дало немного более высокую кривую поляризации, чем электрод B1. Однако все эти электроды все еще давали большую поляризацию выше 50 мА см–2. Экспериментальные данные для электрода B1 показали большую поляризацию, чем данные, предоставленные производителем. Эта разница была в основном связана с тем, что к данным не применялась коррекция напряжения. Чтобы устранить омические потери, капиллярную трубку прикрепляли к электроду сравнения и подводили ближе к поверхности воздушного электрода. Это дало значительно лучший отклик поляризации, как показано для всех электродов на рис. 8б, наряду с данными 60°C для электрода LAM.
Рис. 8.
Поляризация наиболее эффективных электродов для 35% KOH и атмосферного воздуха в условиях (a) отсутствия поправки на падение IR, (б) после прикрепления капилляра для устранения падения IR.

Поляризация электрода LAM была лучше, чем у электродов серии A и C. Электрод, разработанный в этом исследовании, имел более высокую площадь поверхности по сравнению с этими коммерческими электродами. Однако производительность электрода B1 с площадью поверхности 29.9 м2 г–1 была выше, чем у электрода LAM с 65 м2 г–1. Это были не только характеристики, определяющие поверхность, но также электрокаталитические характеристики катализатора и характеристики смачивания в структуре. Электрод был сформирован путем добавления 30% PTFE в композицию, чтобы иметь гидрофобные свойства, вызывающие устойчивость к КОН. Длительность этого сопротивления не измерялась, но в ходе эксперимента утечки не наблюдалось. Дальнейшая структурная оптимизация для электрода LAM может привести к лучшей производительности при адекватной подаче кислорода в области, где происходит реакция восстановления кислорода, а также в средство предотвращения затопления катода электролитом. Если слой слишком тонкий, электроды может “затопить”, что будет ограничивать транспорт газообразных частиц в фазе электролита. Это вызывает большую поляризацию ячеек. Двухслойная конфигурация не применялась для исследования кратковременных высоких токовых характеристик. Двухслойная структура, не оптимизированная, может помочь предотвратить затопление, но вызывает ограничения по массообмену. Следствием этого является снижение электрохимических характеристик пористого электрода. Негативный эффект этих крайних случаев может быть компенсирован конструированием ячеек с надлежащей толщиной слоя, гидрофобностью и контролем пористости.
ВЫВОДЫ
Собственные и готовые к выпуску воздушные электроды показали резкое падение напряжения выше 50 мА см–2 в 35%-ном растворе КОН без компенсации напряжения. Поляризация из-за падения напряжения была устранена с помощью капиллярного подхода. Электрод типа B1 показал лучшие характеристики среди экспериментально проверенных электродов. Недавно разработанный электрод LaMnOx мог легко достигать плотностей тока 100–150 мА см–2 с поляризацией менее 200 мВ. В отличие от промышленных двухслойных электродов, однослойного подхода с содержащим 30% PTFE электрода LAM было достаточно для предотвращения утечки с приемлемыми электрохимическими характеристиками. Электрод был стабильным в течение нескольких часов. Дальнейшая структурная оптимизация электрода LAM может снизить поляризационные потери.
Список литературы
Vincent, C.A. and Scrosati, B., Modern Batteries, Arnold, 1997, 368 p.
Doughty, D.H., Vyas, B., Takamura, T., and Huff, J.R., (Eds), Materials for Electrochemical Energy Storage and Conversion: Batteries, Capacitors and Fuel Cells, Mater. Res. Soc., 1995, 449 p.
Brandon, N.N.P. and Brett, D.D.J., Engineering porous materials for fuel cell applications, Math. Phys.Eng. Sci., 2006, vol. 364, p. 147.
EG&G Technical Services, Inc., Fuel Cell Handbook, 7th Edition, U.S. Department of Energy, 2004.
Pletcher, D. and Walsh, F.C., Industrial Electrochemistry, Chapman & Hall, 1993.
Tomantschger, K. and Kordesch, K.V., Structural analysis of alkaline fuel cell electrodes and electrode materials, J. Power Sources, 1989, vol. 25, p. 195.
Kiros, Y., Quatrano, T., and Bjornbom, P., Determination of the thicknesses of the active layer and cathode limiting currents in AFC, Electrochem. Commun., 2004, vol. 6, p. 526.
Hyodo, T., Miura, N., and Yamazoe, N., Gas diffusion-type oxygen electrode using perovskite-type oxides for metal-air batteries, MRS Proceedings, 1995, vol. 393, p. 79.
Anastasijevic, N.A., Dimitrijevic, Z.M., and Adzic, R.R., Oxygen reduction on a ruthenium electrode in alkaline electrolytes, J. Electroanal. Chem., 1986, vol. 199, p. 351.
Bianchi, G., Mazza, F., and Mussini, T., Catalytic decomposition of acid hydrogen peroxide solutions on platinum, iridium, palladium and gold surfaces, Electrochim. Acta, 1962, vol. 7, p. 457.
Martinovic, J.M., Sepa, D.B., Vojnovic, et al., A., Kinetics of electrochemical reduction of oxygen at rhodium, Electrochim. Acta, 1988, vol. 33, p. 1267.
Sugawara, M., Ohno, M., and Matsuki, K., Novel preparation method of manganese(II) manganese(IV) oxide (Mn2Mn3O8, Mn5O8) by citrate process, Chem. Lett., 1991, p. 1465.
Lee, C.K., Striebel, K.A., McLarnon, F.R., and Cairns, E.J., Thermal treatment of La0.6Ca0.4CoO3 perovskites for bifunctional air electrodes, J. Electrochem. Soc., 1997, vol. 144, p. 3801.
Kiros, Y. and Schwartz, S., Pyrolyzed macrocycles on high surface area carbons for the reduction of oxygen in alkaline fuel cells, J. Power Sources, 1991, vol. 36, p. 547.
Yang, J. and Xu, J.J., Nanoporous amorphous manganese oxide as electrocatalyst for oxygen reduction in alkaline solutions, Electrochem. Commun., 2003, vol. 5, p. 306.
Weidenkaff, A., Ebbinghaus, S.G., Lippert, T., et al., Phase formation and phase transition of Ln1 –xCaxCoO3 – δ (Ln = La, Er) applied for bifunctional air electrodes, Cryst. Eng., 2002, vol. 5, p. 449.
Hayashi, M., Uemura, H., Shimanoe, K., et al., Enhanced electrocatalytic activity for oxygen reduction over carbon-supported LaMnO3 prepared by reverse micelle method, Electrochem. and Solid-State Letters, 1998, vol. 1 (6), p. 268.
Hayashi, M., Uemura, H., and Shimanoe, K., Reverse micelle assisted dispersion of lanthanum manganite on carbon support for oxygen reduction cathode, J. Electrochem. Soc., 2004, vol. 151, p. A158.
Munnik, P., de Jongh, P.E., de Jong, K.P., Recent developments in the synthesis of supported catalysts, Chem. Rev. 2015, vol. 115, p. 6687.
Védrine, J.C., Heterogeneous catalysis on metal oxides, Catalysts, 2017, vol. 7, p. 341.
Дополнительные материалы отсутствуют.