Электрохимия, 2020, T. 56, № 8, стр. 687-691
Синтез и электрохимический анализ фазы Li3Ti0.75(MoO4)3 с лионситовой структурой
Д. Сарита *
Химический факультет, Технологический институт Чайтанья Бхарати
500075 Хайдарабад, Индия
* E-mail: sarithaiitm@gmail.com
Поступила в редакцию 19.07.2019
После доработки 10.10.2019
Принята к публикации 10.12.2019
Аннотация
Соединение Li3Ti0.75(MoO4)3 кристаллизуется в структуре типа лионсита. Структура была получена методом твердофазной реакции. Впервые в образец было выполнено электрохимическое введение лития. Предварительные исследования были проведены для анализа образца в качестве электродного материала для литий-ионных аккумуляторов. Зарядно-разрядные кривые показывают, что в образец внедряется 4.8 Li при разряде до 1.5 В и при заряде наблюдается выделение 3.3 Li. Обратимая емкость 112 мА ч/г наблюдается после 25 циклов.
ВВЕДЕНИЕ
LiCoO2 и LiMn2O4 являются известными катодными материалами для литий-ионных батарей [1, 2]. Низкая цена, лучшие электрохимические результаты вдохновляют ученых исследовать полианионные соединения в качестве опции для материалов положительного электрода. Оливин LiFePO4, насикон Li3Fe2(PO4)3, Li2Ni2(MoO4)3 и Li2Co2(MoO4)3, Fe2(MoO4)3 представляют собой известные примеры слоистых анионных соединений, которые рассматриваются как электродные материалы [3–6]. Преимущество использования молибдатных и ванадатных групп в полианионных соединениях достигается благодаря окислительно-восстановительным парам Mo6+/Mo4+ и V5+/V4+, а также благодаря стабилизации структуры при циклировании по сравнению с сульфатными и фосфатными группами. Следовательно, молибдатные и ванадатные группы способны обеспечивать емкость [7–9]. Это приводит к высокой теоретической удельной емкости. Разнообразные электродные материалы на основе титана считаются достойным материалом отрицательного электрода для литий-ионных аккумуляторов благодаря хорошей обратимости окислительно-восстановительной пары Ti4+/3+ [10, 11]. Исходя из вышеизложенных соображений, оксиды на основе титана и молибдена рассматриваются в качестве эффективных положительных электродов [7–11]. Li3Ti0.75(MoO4)3 кристаллизуется в структуре лионитового типа с ромбической системой. Он имеет четыре атома на элементарную ячейку. Лионситная структура относится к последней категории оксидов. Рассчитанные параметры решетки этого соединения хорошо согласуются с литературой. Кристаллическая структура Li3Ti0.75(MoO4)3 показана на рис. 1. Структура состоит из одного тригонального призматического узла LiO6, окруженного двумя разнородными изолированными тетраэдрами MoO4 [12, 13]. Псевдогексагональные туннели создаются путем соединения краевых тригональных призм LiO6 и октаэдров (Li/Ti)O6 вдоль оси а. В последнее время полианионные соединения, такие как Li3V(MoO4)3 [14], Li3Fe(MoO4)3 [15] и Li2Ni2(MoO4)3 [16], были описаны в качестве электродных материалов для литий-ионных батарей.
Рис. 1.
Изображение кристаллической структуры Li3Ti0.75(MoO4)3 в плоскости bc (взято из программного обеспечения Diamond).

Поведение Li при внедрении в Li3Ti0.75(MoO4)3, новое соединение лионсита нового типа, будет обсуждаться в этой рукописи впервые. Структура Li3Ti0.75(MoO4)3 и окислительно-восстановительных пар Ti4+/Ti3+, Mo6+/Mo5+ и Mo5+/Mo4+ побудили авторов изучить это соединение в качестве материала электрода для литий-ионных батарей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Твердофазная реакция (SSR)
Li3Ti0.75(MoO4)3 получали методом твердофазной реакции, используя необходимое количество Li2CO3 (Merck, 99%), TiO2 (Sigma-Aldrich, 99.9%) и MoO3. Исходные вещества измельчали в агатовой ступке в течение получаса и нагревали при 550°С в течение 24 ч для разложения карбоната. Полученный продукт снова хорошо измельчали и нагревали при 600°С в течение 6 ч. Избыток 3 мол. % Li2CO3 был добавлен с учетом стехиометрии для компенсации потери летучего Li2O при высокой температуре [12]. После термообработки продукт охлаждали до комнатной температуры. Процесс повторяли до тех пор, пока не была получена одна фаза.
Исследование
Рентгеновский дифрактометр Rigaku Miniflex (CuKα-излучение) был использован для регистрации порошковой рентгенограммы (PXRD) Li3Ti0.75(MoO4)3 в диапазоне 2θ от 10° до 70°. На рис. 2 показана рентгенограмма Li3Ti0.75(MoO4)3. Он индексируется на основе литературных данных (JCPDS). Li3Ti0.75(MoO4)3 кристаллизуется в орторомбической пространственной группе Pnma (Z = 4) с параметрами ячейки a = 5.047 Å, b = 10.454 Å, c = 17.538 Å. Параметры ячейки хорошо соответствовали опубликованным значениям.
Ячейки типа Swagelok были использованы для проведения электрохимических исследований внедрения/извлечения лития. Для электрохимических исследований электроды изготавливали из смеси Li3Ti0.75(MoO4)3 в качестве активного материала, ацетиленовой сажи (M/s. Denka Singapore Pvt. Ltd.) и поливинилиденфторида (PVDF) (Sigma-Aldrich) в массовом соотношении 70 : 20 : 10. Растворитель N-метил-2-пирролидон (99.5%) использовали для приготовления суспензии, которую наносили на фольгу из нержавеющей стали (токоотвод) и сушили при 80°С в течение ночи. В качестве электролита использовали 1 М LiPF6, растворенный в смеси 1 : 1 этиленкарбоната и диметилкарбоната. Металлический литий (Sigma-Aldrich, 99.9%), поверхность которого была механически очищена, использовали в качестве анода. Оба электрода были разделены полиэтиленом в качестве сепаратора. Сборка ячеек типа Swagelok проводилась в атмосфере Ar в перчаточном боксе (mBRAUN, Германия).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Электрохимическое внедрение лития в Li3Ti0.75(MoO4)3 типа лионзита
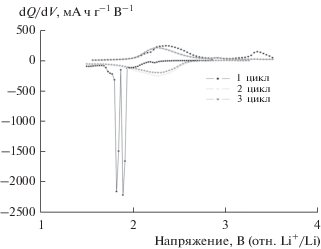
Профиль заряда–разряда Li3Ti0.75(MoO4)3, синтезированного методом SSR в режиме C/10, показан на рис. 3. Последовательные графики дифференциальной емкости показаны на рис. 4. В целом 4.8 Li соответствует емкости 242.06 мА ч–1 после полного разряда до 1.5 В. Во время заряда потенциал постепенно увеличивается до 3.5 В. Начальная зарядная емкость составляет 165.61 мА ч–1. Это эквивалентно извлечению 3.31 Li. График дифференциальной емкости четко показывает формирование плато на кривой заряда–разряда (рис. 4). Во время второго разряда плато при ~1.88 и 1.82 В исчезают. Это указывает на то, что механизм реакции Li3Ti0.75(MoO4)3 с Li во время первого разряда отличается от механизма при последующем циклировании. Изменение характера зарядных и разрядных профилей наблюдалось после первого цикла. На последующих циклах разрядная емкость хорошо согласуется с соответствующей зарядной емкостью. Различие профилей потенциалов для первого и последующих циклов предполагает наличие фазового перехода в структуре активного материала. Исчезновение первого профиля разряда по сравнению со вторым разрядом происходит по существу из-за структурного фазового перехода, происходящего в материале после первого цикла. Подобное поведение наблюдается в других соединениях на основе молибдата [14, 15, 17]. Первый разряд состоит из трех плато около 2.24, 1.88 и 1.82 В. Соответствующий первый заряд состоит только из одного плато около 2.31 В. Одно плато обратимо только со второго цикла. Обратимость структуры подтверждает плато при 2.24 В. Плато при 2.24 В обусловлено восстановлением Ti4+/Ti3+, а плато при 1.88 и 1.82 В обусловлено восстановлением Mo6+/Mo5+ и Mo5+/Mo4+ [14, 15, 17]. Потенциалы, соответствующие этим трем плато, находятся в хорошем согласии с потенциалами, описанными для Li3Fe(MoO4)3, Li3V(MoO4)3 и TiNb(PO4)3 [14, 15, 17], и соответствуют восстановлению Mo6+/Mo5+, Mo5+/Mo4+ и Ti4+/Ti3+ соответственно. Таким образом, из реакции 4.8 Li, внедренного в первом разряде, 3 Li можно объяснить восстановлением Mo6+/Mo5+, а 0.75 Li – за счет восстановления Ti4+/Ti3+. Остальное объясняется частичным восстановлением Mo5+/Mo4+. Изменение разрядной емкости в зависимости от числа циклов электрода Li3Ti0.75(MoO4)3 показано на рис. 5 для первых 25 циклов. Емкость разряда поддерживается практически постоянной после первых двух циклов. Соединение показывает хорошую емкость 112 мА ч/г после 25 циклов.
Из дифференциального графика рис. 4 видно, что частицы Мо окисляются во время начального заряда. После трех циклов показана хорошая обратимая емкость 112.21 мА ч–1. Как показано на рис. 4, восстановление Mo6+ является необратимым, главным образом из-за нестабильности окислительно-восстановительной пары Mo5+/Mo4+ в тетраэдрической кислородной координации [16], и другой причиной было разложение Li3Ti0.75(MoO4)3 в другую фазу путем взаимодействия лития, причем аналогичное поведение наблюдается и у других полианионных соединений [14–16]. Необратимое изменение фазы ранее сообщалось в различных молибдатах во время разряда и приводило к образованию аморфного литированного материала [14–16]. Трудно поддерживать пониженную степень окисления Mo4+ или Mo5+ в тетраэдрической координации из-за его большого размера, что приводит к медленной структурной дезинтеграции. Это приводит к потере емкости.
На рис. 5 показана циклическая характеристика Li3Ti0.75(MoO4)3 типа лионита, полученного методом твердофазной реакции при режимах заряда/разряда C/10. Потеря емкости была уменьшена после первого цикла. Емкость стабилизировалась со второго цикла. Образец показывает приемлемую емкость 112 мА ч/г после 25 циклов.
КРАТКИЕ ИТОГИ И ВЫВОДЫ
Li3Ti0.75(MoO4)3 был получен методом твердофазной реакции, и электрохимические свойства были изучены в диапазоне напряжения от 1.5 до 3.5 В по отношению к литию. Во время первоначального разряда наблюдается большая емкость (242.06 мА ч–1), что соответствует внедрению 4.84 лития. Наблюдается большая необратимость, которая указывает на образование другой новой фазы. После 25 циклов он показал хорошую обратимость на 112.61 мА ч–1. Емкость и циклическое поведение при различных токах С могут быть улучшены путем синтеза соединения в нанофазе.
Список литературы
Mizushima, K., Jones, P.C., Wiseman, P.J., and Goodenough, J.B., LixCoO2 (0 < x < 1): a new cathode material for batteries of high energy density, Mat. Res. Bull., 1980, vol. 15, p. 783.
Tsumura, T., A. Shimizu, A., and Inagaki, M., Lithium extraction/insertion form LiMn2O4 effect of crystallinity, Solid State Ionics., 1996, vol. 90, p. 197.
Shirakawa, J., Nakayama, M., Wakihara, M., and Uchimoto, Y., Changes in electronic structure upon lithium insertion into Fe2(SO4)3 and Fe2(MoO4)3 investigated by X-ray absorption spectroscopy, J. Phys. Chem. B., 2007, vol. 111, p. 1424.
Alvarez-Vega, M., Amador, U., and Arroyo De Dompablo, M.E., Electrochemical study of Li3Fe(MoO4)3 as positive electrode in lithium cells, J. Electrochem. Soc., 2005, vol. 152(7), p. A1306.
Begam, K.M. and Prabaharan,S.R.S., Improved cycling performance of nano-composite Li2Ni2(MoO4)3 as a lithium battery cathode material, J. Power Sources., 2006, vol. 159, p. 319.
Michael, M.S., Begam, K.M., Michael Cloke, and Prabaharan, S.R.S., New nasicon type oxyanion high capacity anode, Li2Co2(MoO4)3, for lithium-ion batteries: preliminary studies, J.Solid State Electrochem., 2008, vol. 12, p. 1025.
Morcrette, M., Rozier, P., dupont, L., Mugnier, E., Sannier, L., Galy, J., and Tarascon, J.M., A reversible copper extrusion-insertion electrode for rechargeable Li batteries, Nat. Mater., 2003, vol. 2, p. 755.
Begam, K.M., Michael, M.S., Yap, Y.H.T., and Prabaharan, S.R.S., New lithiated nasicon-type Li2Ni2(MoO4)3 for rechargeable lithium batteries, Electrochem.Solid-StateLett., 2004, vol. 7, p. A242.
Prabaharan, S.R.S., Michael, M.S., and Begam, K.M., Synthesis of a polyanion cathode material, Li2Co2(MoO4)3, and its electrochemical properties for lithium batteries, Electrochem. Solid-State Lett., 7, 2004a, vol. 7, p. A416.
Armstrong, A.R., Armstrong, G., Canales, J., Garcia, R., and Bruce, P.G., Lithium–ion Intercalation into TiO2-B Nanowires, Adv. Mater., 17, 2005, vol. 17, p. 862.
Patoux, S. and Masquelier, C., Lithium insertion into titanium phosphates, silicates and sulfates, Chem. Mater., 14, 2002a, vol. 14, p. 5057.
Smit, J.P., Stair, P.C., and Poeppelmeier, K.R., The Adoptable Lyonsite structure, Chemistry-A Europ. J., 2006, vol. 12, p. 5944.
Ibers, J.A. and Smith, G.W., Crystal structure of Sodium Molybdate, Acta Crystallography, 1964, vol. 17, p. 190.
Mikhailova, D., Sarapulova, A., Voss, A., Thomas, A., Oswald, S., Gruner, W., Trots, D.M., Bramnik, N.N., and Ehrenberg, H., Li3V(MoO4)3 : A New material for both Lithium extraction and insertion, Chem. Mater., 2010, vol. 22(10), p. 3165.
Arroyoy de Dompablo, M.E. and Alvarez-Vega, M., Structural evolution of Li3 +xFe(MoO4)3 upon lithium insertion in the composition range 0 ≤ x ≤ 1, J. Electrochem. Soc., 2006, vol. 153, p. A275.
Begam, K.M., Micheal, M.S., Tafiuq Yap, Y.H., and Prabhaharan, S.R.S., New Lithiated NASICON type Li2Ni2(MoO4)3-for Rechargeable batteries, Electrochem. and Solidstate letters., 2004, vol. 7(8), p. A242.
Manickam, M., Minato, K., and Takata, M., Synthesis and electrochemical properties of TiNb(PO4)3 cathode materials for lithium secondary batteries, J. Electroanal. Chem., 2004, vol. 562, p. 1.
Дополнительные материалы отсутствуют.