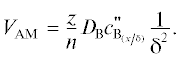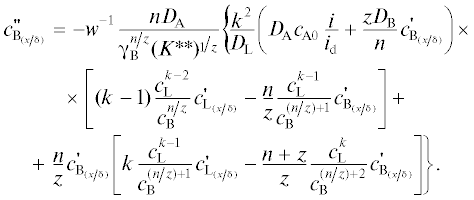Электрохимия, 2020, T. 56, № 9, стр. 771-781
Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 1. Вывод базовых уравнений для модели процесса
А. П. Храмов a, *, А. А. Чернышёв a, b, **, А. В. Исаков a, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. Академическая, 20, Россия
b Уральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Химико-технологический институт
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: a.khramov@ihte.uran.ru
** E-mail: aac-vp@yandex.ru
Поступила в редакцию 17.07.2019
После доработки 21.11.2019
Принята к публикации 31.01.2020
Аннотация
Представлена модель стационарного процесса вторичного восстановления ионов тугоплавкого металла щелочным или щелочноземельным металлом, образующимся на гладком катоде в ходе электролиза солевого расплава. Вторичное восстановление локализуется около катода. Модель учитывает молекулярную диффузию исходных компонентов и термодинамику вторичной химической реакции, первый закон Фика, закон Фарадея, уравнение Нернста. Получены выражения для расчета профилей концентраций, профиля скорости реакции вторичного восстановления внутри диффузионного слоя, профиля распределения тока вторичного восстановления по толщине диффузионного слоя.
ВВЕДЕНИЕ
Развитие электрохимических технологий в расплавах солей связано с процессами получения металлов различной структуры. Здесь могут быть получены катодные продукты от сплошных покрытий [1–3] до дендритных осадков и порошков [4, 5]. Развиваются процессы металлотермического восстановления в среде расплавов галогенидов щелочных и щелочноземельных металлов [6–9]. Щелочные металлы способны растворяться в солевых расплавах [10, 11], эти растворы обладают высокой восстановительной способностью, а процессы химического восстановления зачастую протекают с большой скоростью [9]. Таким образом, при высокотемпературном электролизе солевых расплавов в той или иной степени происходит растворение металлов в расплавленных электролитах, а также распыление металлов при катодном осаждении. Эти явления тесно связаны, ‒ образование мелкодисперсных, слабо сцепленных с катодом осадков металлов при электролизе с высокими плотностями тока обусловлено вторичным восстановлением ионов осаждаемого металла щелочным металлом, растворенным в электролите [12]. Вторичное восстановление приводит к снижению выхода по току на катоде. С другой стороны, похожие процессы при электролизе были использованы для получения мелкодисперсных порошковых материалов различного назначения [13–16].
Процесс катодного осаждения тугоплавкого металла из раствора его соли в щелочно-галогенидных расплавах изучают, помимо прочего, методом регистрации стационарных поляризационных кривых. Эти исследования всегда дают важную информацию, и электролиз в условиях вторичного восстановления не исключение. Для корректного построения, кривая должна быть зарегистрирована по точкам, – каждая точка регистрируется для поверхности катода, очищенной от осадка металла, восстановленного при регистрации предыдущей точки. Эта методика позволяет избежать неконтролируемого увеличения поверхности, то есть избежать уменьшения плотности тока и искривления фронта диффузии. Такая кривая всегда имеет чрезвычайно нечеткий предельный ток, при смещении потенциала в отрицательную сторону, плотность тока плавно увеличивается на большом интервале потенциалов шириной до 1 В и более [17]. При линейной шкале на оси тока предельный ток по такой кривой определить невозможно. Использование логарифмической шкалы сомнительно и также малопродуктивно. Все, что можно сделать, – это сравнивать плотности тока в разных растворах при одном потенциале, выбранном из каких-то соображений. Эта ситуация не является проблемой, однако заставляет предположить, что устойчивый процесс вторичного восстановления до твердого тугоплавкого металла жидким раствором щелочного металла, восстановленного на катоде, возникает при потенциалах катода, гораздо более положительных, чем область потенциалов, близких к стандартному потенциалу щелочного металла. При этом придется предположить, что при достаточно большой плотности тока на единицу площади чистой подложки первоначальный период электролиза на чистой поверхности протекает исключительно по механизму вторичного восстановления, − в начале процесса это происходит даже в случае, когда продуктом длительного электролиза становится дендритный осадок на катоде с выходом по току, близким к 100%. Это означает, что продуктом вторичного восстановления может быть не только металл, распыленный в виде шлама, но и металл, захваченный поверхностью. В свою очередь это означает, что зона вторичного восстановления может находиться не только за пределами диффузионного слоя в объеме, но и чрезвычайно близко к поверхности катода, на расстоянии гораздо меньше толщины диффузионного слоя.
Принимая во внимание упомянутый выше интерес к процессу вторичного восстановления, мы решили проанализировать эту ситуацию с точки зрения представлений диффузионной кинетики, получить способ расчета, следующий из ее уравнений, и применить этот способ для анализа результатов одного из экспериментов. Другими словами, интерес представляет как диффузионная модель стационарного процесса вторичного восстановления на гладком катоде в первоначальный период электролиза (до момента разрастания поверхности за счет осажденного металла), так и численное воспроизведение по этой модели соответствующего натурного эксперимента.
В литературе имеется работа [12], в которой представлена система уравнений, описывающих процессы вторичного восстановления: в ходе электролиза расплава галогенида щелочного металла, содержащего ионы тугоплавкого металла, при достаточно большой плотности тока щелочной металл восстанавливается на катоде и растворяется в электролите; далее в растворе вблизи катода происходит химическая реакция вторичного восстановления ионов тугоплавкого металла щелочным металлом, диффундирующем от катода в объем электролита, с образованием порошка вторично восстановленного тугоплавкого металла. Взят предельно простой случай, который позволил авторам значительно упростить конечные выражения, – электролиз бинарного расплава с общим анионом X‒ со степенью окисления –1, AX–BX (металл A – восстанавливаемый, B – щелочной). Таким образом, это случай, когда степень окисления восстанавливаемого металла +1. Теоретическое рассмотрение процесса в такой системе позволяет провести расчет именно для такой системы, но не позволяет для всех реальных систем, поскольку A – это почти всегда металл со степенью окисления >+1. В работе не развита тема согласования граничных условий (при x = 0 и при x = δ) при решении стационарной диффузионной задачи, также и по этой причине результаты не могут быть применены для расчетов в реальных случаях, когда толщина диффузионного слоя δ становится величиной переменной от плотности тока [17].
В настоящей работе сделан упор на другие случаи электролиза, которые не позволяют делать упрощения, поэтому описывать распределение концентраций компонентов и распределение скорости вторичной реакции вдоль оси расстояний можно только численно. В данной работе представлена модель, в работе [18] приведены ход расчетов и результаты расчетов по нескольким гипотетическим экспериментам, а в [17] сделаны расчеты по результатам натурного эксперимента.
МОДЕЛЬ ВТОРИЧНОГО ВОССТАНОВЛЕНИЯ НА ГЛАДКОМ КАТОДЕ В ОБЩЕМ ВИДЕ
Условия и допущения
Здесь взят стационарный процесс при электролизе в общем случае тройного расплава с двумя анионами X‒, L‒ и катионом фонового электролита Bm+, AXn–BXm–BLm, при этом n – любое, m – любое, концентрация An+ значительно меньше концентрации Bm+. Такая схема расплавленной системы позволяет учесть случаи вторичного восстановления металла A при электролизе расплава на основе галогенида как щелочного металла, так и щелочноземельного (B). Кроме того, такая схема позволяет учесть возможность химической реакции образования комплексов частиц An+ и L‒. Предполагается, что в случае образования таких комплексов количество анионов L– в расплаве не меньше, чем необходимо для образования комплексов с соответствующим количеством лигандов со всеми частицами An+. Представленная модель учитывает коэффициент активности разбавленного раствора металла B0, но ограниченно учитывает изменение этого коэффициента от концентрации [B0]. Это ограничение обсуждено в [17, 18].
Перечисленные усложнения по сравнению с работой [12] не ограничат применимость полученных результатов для более простых случаев, – схему системы и процесса можно упростить, выбрав соответствующие значения некоторых коэффициентов в конечных уравнениях.
В модели принято, что все процессы идут в условиях локальных равновесий во всей зоне электрохимической и химической реакций, то есть затруднения связаны только со стадией доставки/отвода компонентов путем молекулярной диффузии; диффузия линейного типа.
Расчет константы равновесия реакции вторичного восстановления
Будем считать, что все ионы металла An+ связаны в комплексные группировки ${\text{AL}}_{k}^{{(k - n) - }}$ (например ${\text{NbF}}_{7}^{{ - 3}}$, k = 7, n = 4), и их концентрация много меньше, чем концентрация ионов Bm+ щелочного металла (m = 1) или щелочноземельного (m = 2). Первый будем называть далее металл A, последний – B. Пусть плотность тока выше предельной диффузионной для осаждения металла A по реакции:
Очевидно, что в этом случае будет идти разряд катионов металла B. Щелочные и щелочноземельные металлы растворяются в расплавах их солей. Таким образом, в области определенных плотностей тока на катоде будет идти электрохимическое восстановление катионов металла B с образованием истинного раствора B:
В случае восстановления на катоде щелочного металла m = z = 1. В случае хлоридов магния, кальция и бария m = 2, z = 1 [19, 20], и восстановленный щелочноземельный металл переходит в раствор-расплав в виде однозарядных ионов B+. Растворенный металл B диффундирует от поверхности катода и, встречаясь с ионами металла A, восстанавливает их до твердого металла:
Считаем далее, что реакция (3) при высоких температурах никак не лимитирует процесс восстановления тугоплавкого металла A, и локальное равновесие (3) не нарушено при любой плотности тока в любой точке в зоне вторичного восстановления, несмотря на градиенты концентраций. Таким образом, концентрации ионов ${\text{AL}}_{k}^{{(k - n) - }}$, L‒ и раствора металла B в виде частиц B(m‒z)+ можно связать через константу равновесия. Разбавленный раствор B имеет высокий коэффициент активности [10], и его необходимо учесть, если он известен. Коэффициенты активности форм ${\text{AL}}_{k}^{{(k - n) - }}$, L‒ и Bm+ считаем постоянными и не учитываем:
В дальнейшем не учитываем изменений мольного объема при изменении концентраций в зоне вторичного восстановления. Можно записать для константы:
Выше принято, что Bm+ – это катионы фонового электролита, и их концентрация много больше, чем An+; поскольку других катионов нет, при расчете $K_{c}^{{{\text{*}}{\kern 1pt} {\text{*}}}}$ считаем, что ${{N}_{{{{{\text{B}}}^{{m + }}}}}}$ = 1. Могут быть другие варианты: например, если фоновый электролит состоит из эквимольной смеси галогенидов двух разных щелочных металлов, то интересует более электроположительный из них, при этом, поскольку коэффициент активности Bm+ не известен, принимаем ${{N}_{{{{{\text{B}}}^{{m + }}}}}}$ = ${{a}_{{{{{\text{B}}}^{{m + }}}}}}$ = 0,5.
Величину $K_{c}^{{{\text{*}}{\kern 1pt} {\text{*}}}}$ можно найти, воспользовавшись результатами соответствующей экспериментальной работы, выполненной по методу электрохимической потенциометрии интересующего металла A. В случае образования комплексов, результаты таких работ могут быть опубликованы в форме эмпирической зависимости, подобной (9):
Учитывая (6) и (8), получим
В случае электролиза бинарного расплава с одним анионом, когда нет необходимости учитывать реакцию образования комплексов, в выражениях выше k надо принять за ноль, а в выражении (11) вместо const поставить условный стандартный потенциал металла A:
Стационарная диффузионная задача при вторичном восстановлении в диффузионном слое катода
Когда в объеме электролита задана концентрация соли металла А и на катоде превышена предельная плотность тока по ионам этого металла, возникает ситуация вторичного восстановления в диффузионном слое катода. Размеры электрода обычно очень велики по сравнению с толщиной диффузионного слоя, поэтому диффузия в этом слое будет практически линейной. Заряды с катода либо напрямую участвуют в первичном восстановлении металла A, либо уносятся растворенным металлом B и в дальнейшем оказываются в осадке вторично восстановленного металла A. Учитывая это, а также уравнения (1) и (2) в случае линейной диффузии, для каждого значения расстояния от катода x в пределах диффузионного слоя можно записать соотношение для потоков массы диффундирующих форм, An+ – к катоду, B(m‒z)+ – от катода:
где jA – плотность потока An+ (свободные или в виде комплексов); jB – плотность потока B(m‒z)+. Здесь j – функция от градиента c по первому закону Фика:Соотношение между плотностями потоков металла A (в виде комплексов ${\text{AL}}_{k}^{{(k - n) - }}$) и свободных частиц L‒, образующихся в зоне реакции (3) после разрушения комплексов:
Из уравнений (13) и (15) можно записать:
Интегрируя (14) и (16), получим:
Постоянные интегрирования α1 и α2 найдем из граничных условий а):
а) При x = δ (на границе диффузионного слоя) cA = cA0 (cA0 это [An+] в объеме);
для других концентраций соответственно cB = = cB0, cL = cL0.
Подставляя α1 и α2 в (17) и (18), получим
Для предельного диффузионного тока id восстановления форм An+ по реакции (1) можно записать:
Комбинируя (21) с выражениями (19) и (20), получим соответственно:
Постоянные интегрирования можно найти также из других граничных условий б):
б) При x = 0 (на границе катода) cA = cASCat (cASCat это [An+] на поверхности катода);
для других концентраций соответственно cB = = cBSCat, cL = cLSCat.
В этом случае аналогичным путем получим другие выражения для концентраций:
(22а)
${{c}_{{\text{A}}}} = {{c}_{{{\text{ASCat}}}}} - \tfrac{{z{{D}_{{\text{B}}}}}}{{n{{D}_{{\text{A}}}}}}\left( {{{c}_{{{\text{BSCat}}}}} - {{c}_{{\text{B}}}}} \right) + {{c}_{{{\text{A0}}}}}\tfrac{i}{{{{i}_{{\text{d}}}}}}\tfrac{x}{{\delta }},$(23а)
$\begin{gathered} {{c}_{{\text{L}}}} = {{c}_{{{\text{LSCat}}}}} + \tfrac{{zk{\kern 1pt} {{D}_{{\text{B}}}}}}{{n{{D}_{{\text{L}}}}}}\left( {{{c}_{{{\text{BSCat}}}}} - {{c}_{{\text{B}}}}} \right) - \\ - \,\,{{c}_{{{\text{A0}}}}}\tfrac{{k{{D}_{{\text{A}}}}}}{{{{D}_{{\text{L}}}}}}\tfrac{i}{{{{i}_{{\text{d}}}}}}\tfrac{x}{{\delta }}. \\ \end{gathered} $При расчете профилей концентраций в зависимости от x можно пользоваться как уравнениями (22), (23), так и (22а), (23а). Результат получится одинаково правильный. Однако нельзя считать, что количество уравнений избыточно. Приравняем правые части уравнений (22) и (22а), (23) и (23а) и сделаем некоторые преобразования, учитывая выражение (21), получим:
Соотношение (24) получено из разных граничных условий, то же самое можно сказать о (25). В этих соотношениях есть только постоянные и нет переменных от x. Одинаковый правильный результат расчета профиля концентраций по уравнениям (22) и (22а) получится только при соблюдении равенства (24), одинаковый расчет по (23) и (23а) – при соблюдении равенства (25). Эти равенства надо использовать для согласования постоянных величин с целью согласования граничных условий. При численном экспериментировании с моделью используются константы DA, DB, DL, а также условно постоянные величины cASCat, cBSCat, cLSCat, cA0, cB0, cL0, i, δ или id (21). Некоторые из них берутся из литературных данных, другие получены путем вычислений (см. ниже) или взяты из натурного эксперимента, какие-то варьируются в интересующем диапазоне. Однако соотношения (24) и (25) между ними должны соблюдаться с той точностью, которая потребуется из логики вычислений. Добиваться этого надо путем подгонки одного из параметров. Полученное значение подгоночного параметра не может быть произвольным, поскольку оно соответствует обоим граничным условиям, реализованным совокупностью значений всех параметров, – в итоге это значение будет одним из результатов эксперимента с моделью. Сказанное относится в первую очередь к уравнению (24), поскольку (25) используется для определения параметра cLSCat (см. ниже).
Определение постоянных величин для согласования граничных условий стационарной диффузионной задачи
Учтем, что в выражениях (24), (25) концентрации cA0, cL0 задаются при выборе состава раствора. Параметры i и δ либо варьируемые, либо используются для подгонки при согласовании граничных условий [17, 18]. Таким образом, перечислим условно постоянные концентрации (не зависящие от x), которые надо определить: cASCat, cBSCat, cLSCat, cB0.
Возьмем концентрацию B на поверхности катода, cBSCat. Для ее определения надо воспользоваться результатами экспериментальной работы, устанавливающей количественное соотношение между концентрацией металла B и окислительно-восстановительным потенциалом соответствующего раствора, [B0]−Eox/red. Далее надо задать или измерить потенциал катода относительно соответствующего электрода сравнения при интересующей плотности тока в условиях вторичного восстановления и определить концентрацию. Такой способ определения cBSCat из поляризационных кривых возможен в случае исключительно концентрационной поляризации процесса (2). Только тогда потенциал электрода под током является термодинамически равновесным относительно приэлектродного слоя электролита.
Приведем пример имеющихся в литературе данных по упомянутой зависимости для шести индивидуальных галогенидов: раствор Na в NaCl, NaBr, NaI и раствор K в KCl, KBr, KI. Результаты получены по измеренным парциальным давлениям щелочного металла в парах этих растворов. Далее вычислены коэффициенты активности щелочного металла при разных концентрациях и температурах. Результаты представлены в виде эмпирических зависимостей в работе Чебыкина с соавторами [10]:
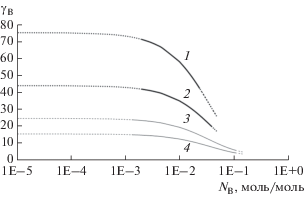
Рис. 1.
Зависимость коэффициента активности щелочного металла от его мольно-долевой концентрации [B0] в растворе, тонкие линии – раствор K–KCl, жирные линии ‒ Na–NaCl; 1, 3 – 800°C; 2, 4 – 900. Расчет по (26), сплошные линии ‒ аппроксимация области эксперимента, пунктир ‒ экстраполяция, табл. 1 [10].
Другой пример литературных данных для растворов калия в бинарных смесях его галогенидов для шести систем: KF–KCl, KF–KBr, KF–KI, KCl–KI, KCl–KBr, KBr–KI, ‒ работа Ивенко с соавторами [22]. Эти результаты также получены по измеренным парциальным давлениям калия в парах этих растворов. Приведены эмпирические выражения для политерм, позволяющих рассчитать коэффициент активности калия при любой температуре и концентрации из исследованного диапазона.
Таблица 1.
Эмпирические коэффициенты выражения (26) [10]*
| Раствор | T, K | ${{N}_{{\text{B}}}}$ | ${{a}_{{\text{0}}}}$ | ${{a}_{{\text{1}}}}$ | ${{b}_{{{\text{10}}}}}$ | ${{b}_{{{\text{11}}}}}$ | ${{b}_{{{\text{20}}}}}$ | ${{b}_{{{\text{21}}}}}$ | S | n | $\Sigma \Delta {{{\gamma }}_{{\text{B}}}}$, % |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Na–NaCl | 1068–1330 | 0–0.05 | –0.823 | 2899 | 6.06 | 0 | 0 | 0 | 0.065 | 61 | 9.5 |
| Na–NaBr | 1013–1350 | 0–0.25 | –0.967 | 2757 | 7.85 | –0.00330 | –3.02 | 0.00119 | 0.045 | 137 | 8.6 |
| Na–NaI | 929–1310 | 0–0.15 | –0.755 | 2465 | 6.99 | –0.00166 | –8.45 | 0 | 0.031 | 96 | 8.4 |
| K–KCl | 1024–1330 | 0–0.15 | –0.883 | 2453 | 5.48 | 0.00198 | –4.15 | –0.01019 | 0.040 | 67 | 8.6 |
| K–KBr | 1007–1380 | 0–0.40 | –1.043 | 2248 | 5.57 | –0.00176 | 0 | 0 | 0.058 | 106 | 8.7 |
| K–KI | 954–1340 | 0–0.25 | –0.979 | 2126 | 7.62 | –0.00323 | –7.50 | 0.00298 | 0.030 | 109 | 8.1 |
Найденные коэффициенты активности позволяют рассчитать окислительно-восстановительные потенциалы растворов:
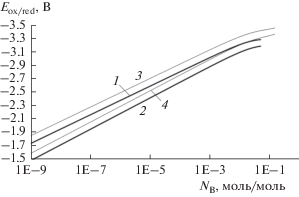
Отсюда при T = 800°C в системе Na–NaCl: $E_{{{\text{ox/red}}}}^{0}$ = –3.259 В; K–KCl: $E_{{{\text{ox/red}}}}^{0}$ = –3.474 В. На рис. 2 приведены расчеты окислительно-восстановительного потенциала растворов. Коэффициент активности раствора металла B остается постоянным при изменении его концентрации [B0] в интервале 0–10–3 моль/моль, рис. 1. Можно сказать, что это коэффициент активности γ∞ при бесконечном разбавлении: γNa(NaCl)≈ 75, γK(KCl)≈ ≈ 25 при 800°C. Этот интервал концентраций B соответствует интервалу окислительно-восстановительных потенциалов ${{E}_{{{\text{ox/red}}}}}$ относительно хлорного электрода при 800°C для раствора Na–NaCl: от более положительного до ‒3.02 В; для K–KCl: до ‒3.13 В, рис. 2.
Рис. 2.
Зависимость окислительно-восстановительного потенциала раствора от мольно-долевой концентрации щелочного металла, тонкие линии – раствор K–KCl, жирные линии ‒ Na–NaCl. 1, 3 – 800°C; 2, 4 – 900. Расчет по (26) табл. 1 [10], (27), (28), (29).
Параметр cBSCat можно найти путем преобразования выражения (27):
После оценки параметра cBSCat можно оценить cLSCat с помощью уравнения (25), если принять, что параметр δ известен либо оценен, исходя из каких-то соображений:
При этом cB0 можно найти путем преобразования выражения (8), записанного для объема раствора:
Далее можно найти cASCat путем преобразования выражения (8), записанного для поверхности катода:
Возможные расчеты по модели
Представляет интерес построение профилей концентраций активных форм в зоне вторичного восстановления. Строить такие профили удобно для безразмерного расстояния в единицах толщины диффузионного слоя x/δ при безразмерной плотности тока в единицах плотности предельного диффузионного тока i/id. Комбинируя уравнения (8), (22), (23), получим неявное выражение для зависимости cB–x/δ:
Решая (34) численным методом, можно построить профиль концентрации cB–x/δ. В ходе этих вычислений одновременно выстраиваются профили cA–x/δ (22) и cL–x/δ (23).
Для дальнейших заключений важно построить не только профили концентраций, но и профиль скорости реакции вторичного восстановления. Для раствора ионов An+ и раствора восстановленной формы металла B на расстоянии от электрода x в пределах диффузионного слоя, изменения концентраций за единицу времени выражаются уравнениями типа:
В стационарном состоянии
Отсюда запишем
Скорость VAM образования вторично восстановленного металла A в ходе реакции (3) противоположна по знаку скорости расхода исходных веществ реакции (3):
Для получения кривой VAM в зависимости от безразмерного расстояния x/δ запишем соотношение между вторыми производными концентрации cB по переменной x и x/δ:
Учитывая (39) и (40) запишем:
Найдем первую производную концентрации cB по переменной x/δ. Для этого продифференцируем выражение (34), при этом будем учитывать, что выражение в квадратных скобках в (34) – это cL:
Запишем вторую производную:
Используем выражение, вытекающее из (42):
Продифференцируем выражения u и w по переменной x/δ и сделаем некоторые алгебраические преобразования, получим
В выражение (44) вошла первая производная cL по переменной x/δ. Найдем ее путем дифференцирования выражения (23):
В модели предполагается, что на восстановление металла A в пределах диффузионного слоя идет ток первичного восстановления, который расходуется на границе катода, а также в общем случае часть тока вторичного восстановления. Под током вторичного восстановления здесь понимается поток отрицательных зарядов, переносимых в виде потока массы восстановленного металла B в направлении от катода. Другая часть потока восстановленного металла B может выйти за пределы диффузионного слоя. Такую ситуацию можно представить в случае, когда катодный ток слишком велик для того, чтобы ему мог соответствовать поток массы ионов металла A за счет исключительно молекулярной диффузии в пределах диффузионного слоя. В этом случае к реакции вторичного восстановления должен подключиться поток массы ионов металла A за счет конвективной диффузии за пределами диффузионного слоя в объеме. Такая ситуация возникает тем легче, чем меньше концентрация ионов металла A в объеме, чем больше плотность тока и чем ближе стандартные потенциалы металлов A и B (то есть, чем меньше $K_{c}^{{{\text{**}}}}$ и, соответственно, реакция (3) идет “не до конца”). Итак, запишем:
где i1, i2 – плотность тока первичного и вторичного восстановления соответственно, А/см2; i2Cat – суммарный ток вторичного восстановления, израсходованный в пределах диффузионного слоя у катода, на единицу площади катода; i2V – ток вторичного восстановления, израсходованный в объеме, на единицу площади катода.Для того чтобы судить о локализации процесса вторичного восстановления, полезно рассчитать не только профиль VAM–x/δ. Вторично восстановленный металл A, приходящийся на ток i2Cat, распределяется между границей диффузионного слоя (x/δ = 1) и границей катода (x/δ = 0). Точкой отсчета может быть и та и другая граница, – выберем границу катода. Нужно построить профиль доли β восстановленного металла A, выделяющегося суммарно на участке от точки отсчета до данного значения x/δ. В этом случае на границе диффузионного слоя должно оказаться 100% металла, выделяемого током i1 + i2Cat. Рассчитать эту зависимость можно путем численного интегрирования зависимости VAM от расстояния. Уточним, что при этом надо умножать на приращение размерной величины и интегрировать зависимость VAM–x. Удобно представлять, что существует распределение израсходованного тока вторичного восстановления вдоль оси расстояний внутри диффузионного слоя:
где i2x – ток вторичного восстановления металла A, суммарно израсходованный в объеме диффузионного слоя на участке толщиной от 0 до x и площадью 1 см2, А/см2. На границе диффузионного слоя должно оказаться суммарное значение плотности тока вторичного восстановления, израсходованного у катода, i2Cat:Перейдем к распределению суммарных долей восстановленного металла вдоль оси расстояний относительно общего количества восстановленного металла, %:
Определим ток i1 первичного восстановления (осаждения) металла A. Очевидно, что он равен:
Продифференцируем выражение (22) и найдем первую производную cA по переменной x:
Учитывая, что $c_{{{{{\text{B}}}_{{(x)}}}}}^{'} = ({1 \mathord{\left/ {\vphantom {1 {\delta }}} \right. \kern-0em} {\delta }})c_{{{{{\text{B}}}_{{({x \mathord{\left/ {\vphantom {x {\delta }}} \right. \kern-0em} {\delta }})}}}}}^{'}$, а также выражения (21) и (51), получим
Расчет $c_{{{{{\text{B}}}_{{({x \mathord{\left/ {\vphantom {x {\delta }}} \right. \kern-0em} {\delta }})}}}}}^{'}$ при x = 0 по выражению (42) через концентрации cBSCat, cLSCat (30), (31) при данной плотности тока.
Определим ток i2V вторичного восстановления металла A в объеме. Очевидно, что он равен
Отсюда получим
Расчет $c_{{{{{\text{B}}}_{{({x \mathord{\left/ {\vphantom {x {\delta }}} \right. \kern-0em} {\delta }})}}}}}^{'}$ при x = δ по выражению (42) через концентрации cB0, cL0 при данной плотности тока.
В представленных выражениях не учитывается концентрационная зависимость коэффициента
активности металла B, – мы не стали учитывать выражение (26), поскольку это привело бы к значительному
усложнению выражений для $c_{{{{{\text{B}}}_{{({x \mathord{\left/ {\vphantom {x {\delta }}} \right. \kern-0em} {\delta }})}}}}}^{'}$ и 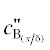 . Кроме того эмпирическое выражение (26) пригодно только в нескольких конкретных случаях,
табл. 1. Тем не менее, учесть значительное отклонение γ от γ∞ при больших отрицательных потенциалах катода необходимо. В наших следующих работах
обсуждается этот момент. В них приведены расчеты для гипотетических и одного натурного
эксперимента и обсуждены следствия, к которым приводят модельные расчеты [17, 18].
. Кроме того эмпирическое выражение (26) пригодно только в нескольких конкретных случаях,
табл. 1. Тем не менее, учесть значительное отклонение γ от γ∞ при больших отрицательных потенциалах катода необходимо. В наших следующих работах
обсуждается этот момент. В них приведены расчеты для гипотетических и одного натурного
эксперимента и обсуждены следствия, к которым приводят модельные расчеты [17, 18].
ЗАКЛЮЧЕНИЕ
В работе представлена модель стационарного процесса вторичного восстановления ионов тугоплавкого металла A щелочным или щелочноземельным металлом B, образующемся на гладком катоде в ходе электролиза солевого расплава. Вторичное восстановление локализуется около катода. Взят процесс при электролизе в общем случае тройного расплава с двумя анионами X‒, L‒ и катионом фона Bm+, AXn–BXm–BLm, при этом n – любое, m – любое. Учтена возможность химической реакции образования комплексов частиц An+ и L‒.
Получены выражения для расчетов тока первичного восстановления, тока вторичного восстановления в объеме, профилей концентраций внутри диффузионного слоя, профиля скорости реакции вторичного восстановления и профиля распределения тока вторичного восстановления по толщине диффузионного слоя. Все перечисленные величины и профили относятся к первоначальному периоду электролиза на гладкой поверхности катода, до момента разрастания поверхности за счет осажденного металла.
Список литературы
Huang, Y., Bai, S., Zhang, H., Ye, Y., and Zhu, L., Electrochemical studies of Ir coating deposition from NaCl–KCl–CsCl molten salts, Surface and Coatings Technology, 2017, vol. 322, p. 76. https://doi.org/10.1016/j.surfcoat.2017.05.032
Zhuk, S.I., Isakov, A.V., Apisarov, A.P., Grishenkova, O.V., Isaev, V.A., Vovkotrub, E.G., Zaykov, Yu.P., Electrodeposition of continuous silicon coatings from the KF–KCl–K2SiF6 melts. J. Electrochem. Soc., 2017, vol. 164, no. 8, p. H5135. https://doi.org/10.1149/2.0171708jes
Kuznetsov, S.A., Kuznetsova, S.V., Rebrov, E.V., Mies, M.J.M., de Croon, M.H.J.M., and Schouten, J.C., Synthesis of molybdenum borides and molybdenum silicides in molten salts and their oxidation behavior in an air–water mixture, Surface and Coatings Technology, 2005, vol. 195, p. 182. https://doi.org/10.1016/j.surfcoat.2004.05.021
Kushhkov, H.B. and Adamokova, M.N., Electrodeposition of tungsten, molybdenum and double carbides of tungsten (molybdenum) and nickel (cobalt) from low-temperature halide-oxide melts, ECS Transactions, 2007, vol. 3, no. 35, p. 399. https://doi.org/10.1149/1.2798684
Li, H., Song, Q., Xu, Q., Chen, Y., and Meng, J., Electrochemical synthesis of NbC-Sn composite powder in molten chloride, Trans. Nonferrous Met. Soc. China, 2017, vol. 27, no. 10, p. 2310. https://doi.org/10.1016/S1003-6326(17)60257-7
Lei, X., Xu, B., Yang, G., Shi, T., Liu, D., and Yang, B., Direct calciothermic reduction of porous calcium titanate to porous titanium, Mater. Sci. & Engineering C, 2018, vol. 91, p. 125. https://doi.org/10.1016/J.MSEC.2018.05.027
Lin, N., Han, Y., Zhou, J., Zhang, K., Xu, T., Zhu, Y., and Qian, Y., A low temperature molten salt process for aluminothermic reduction of silicon oxides to crystalline Si for Li-ion batteries, Energy Environ. Sci., 2015, vol. 8, no. 11, p. 3187. https://doi.org/10.1039/C5EE02487K
Gostishchev, V.V., Physicochemical aspects of the fabrication of tungsten powder by the metallothermy of the scheelite concentrate in ionic melts, Russ. J. Non-Ferrous Metals, 2015, vol. 56, no. 4, p. 387. https://doi.org/10.3103/S1067821215040045
Choi, E. and Lee, J., Complete reduction of high-density UO2 to metallic U in molten Li2O–LiCl, J. Nuclear Mater., 2017, vol. 494, p. 439. https://doi.org/10.1016/J.JNUCMAT.2017.07.036
Smirnov, M.V., Chebykin, V.V., and Tsiovkina, L.A., The thermodynamic properties of sodium and potassium dissolved in their molten chlorides, bromides, and iodides, Electrochim. Acta, 1981, vol. 26, no. 9, p. 1275. https://doi.org/10.1016/0013-4686(81)85111-0
Smirnov, M.V. and Ivenko, V.M., Saturation vapour pressure and thermodynamic properties of potassium solutions in molten binary mixtures of its halides, Electrochim. Acta, 1990, vol. 35, no. 2, p. 529. https://doi.org/10.1016/0013-4686(90)87040-9
Барабошкин, А.Н., Смирнов, М.В., Салтыкова, Н.А. Катодные процессы при плотностях тока выше предельной диффузионной. Труды института электрохимии УФАН СССР. 1961. № 2. С. 41. [Baraboshkin, A.N., Smirnov, M.V., and Saltykova, N.A., Cathodic processes at current densities above the limiting diffusion. Trudy instituta elektrohimii UFAN USSR (in Russian), 1961, no. 2, p. 41.]
Yuan, B. and Okabe, T.H., Niobium powder production by reducing electrochemically dissolved niobium ions in molten salt, J. Alloys and Compounds, 2008, vol. 454, p. 185. https://doi.org/10.1016/J.JALLCOM.2006.12.121
Yuan, B. and Okabe, T.H., Electrochemically assisted formation of fine niobium powder in molten salt, J. Electrochem. Soc., 2007, vol. 154, no. 1, p. E1. https://doi.org/10.1149/1.2364842
Zaykov, Yu.P., Isakov, A.V., Apisarov, A.P., and Nikitina, A.O., Electrochemical synthesis of an iridium powder with a large specific surface area, Russ. Metallurgy (Metally), 2017, vol. 2017, no. 2, p. 106. https://doi.org/10.1134/S003602951702015X
Чернышев, А.А., Аписаров, А.П., Зайков, Ю.П. Вторичное восстановление тантала в расплавах NaCl–KCl и KCl–CaCl2. Цвет. металлы. 2017. № 11. С. 43. [Chernyshev, A.A., Apisarov, A.P., and Zaykov, Yu.P., Secondary reduction of tantalum in NaCl–KCl and KCl–CaCl2 molten salts, Tsvetnye Metally (in Russian), 2017, no. 11, p. 43.] https://doi.org/10.17580/tsm.2017.11.08
Храмов, А.П., Чернышев, А.А., Исаков, А.В., Суздальцев, А.В., Зайков, Ю.П. Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 3. Численное воспроизведение натурного эксперимента при катодном восстановлении Nb в расплаве KNaCl2–NaF–K3NbF7. Электрохимия. 2020. Т. 56. [Khramov, A.P., Chernyshev, A.A., Isakov, A.V., Suzdal’tsev, A.V., and Zaykov, Yu.P., Secondary reduction of a refractory metal near a smooth cathode during electrolysis of molten salt. 3. Numerical reproduction of a natural experiment with cathode reduction of Nb in the melt KNaCl2–NaF–K3NbF7, Russ. J. Electrochem. 2020, vol. 56.]
Храмов, А.П., Чернышев, А.А., Исаков, А.В., Зайков, Ю.П. Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 2. Расчеты для некоторых гипотетических экспериментов. Электрохимия. 2020. Т. 56. № 9. [Khramov, A.P., Chernyshev, A.A., Isakov, A.V., and Zaykov, Yu.P., Secondary reduction of a refractory metal near a smooth cathode during electrolysis of molten salt. 2. Calculations for some hypothetical experiments, Russ. J. Electrochem. 2020, vol. 56, no. 9.]
Сычев, А.Г., Никулин, Н.А., Зайков, Ю.П., Ивановский, Л.Е. Исследование катодных процессов в расплаве хлорида кальция. Расплавы. 1992. № 6. С. 32. [Sychev, A.G., Nikulin, N.A., Zaykov, Yu.P., and Ivanovskiy, L.Ye., Study of cathodic processes in the melt of calcium chloride, Rasplavy (in Russian), 1992, no. 6, p. 32.]
Ковалевский, Р.А. Электродные процессы на индифферентном электроде в разбавленных растворах щелочных и щелочноземельных металлов в их расплавленных хлоридах. Автореферат диссертации на соискание ученой степени кандидата химических наук, Екатеринбург: Институт Высокотемпературной Электрохимии УрО РАН, 1992. 18 с. [Kovalevsky, R.A., Electrode processes on an indifferent electrode in dilute solutions of alkali and alkaline earth metals in their molten chlorides. Abstract of thesis for the degree of Candidate of Chemical Sciences (in Russian), Ekaterinburg: Institute of High Temperature Electrochemistry, Ural Branch, Russian Academy of Sciences, 1992. 18 p.]
Смирнов, М.В. Электродные потенциалы в расплавленных хлоридах, М.: Наука, 1973. С. 212. [Smirnov, M.V., Electrode potentials in molten chlorides (in Russian), Moscow: Nauka, 1973, p. 212.]
Ивенко, В.М., Чебыкин, В.В., Циовкина, Л.А. Коэффициенты активности калия, растворенного в расплавленных смесях его галогенидов. Расплавы. 2017. № 6. С. 500. [Ivenko, V.M., Chebykin, V.V., and Tsiovkina, L.A., The activity coefficients of potassium dissolved in molten mixtures of its halides, Rasplavy (in Russian), 2017, no. 6, p. 500.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия