Электрохимия, 2020, T. 56, № 9, стр. 782-787
Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 2. Расчеты для некоторых гипотетических экспериментов
А. П. Храмов a, *, А. А. Чернышёв a, b, **, А. В. Исаков a, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. Академическая, 20, Россия
b Уральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Химико-технологический институт
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: a.khramov@ihte.uran.ru
** E-mail: aac-vp@yandex.ru
Поступила в редакцию 17.07.2019
После доработки 13.12.2019
Принята к публикации 06.03.2020
Аннотация
Приведены результаты расчетов для нескольких гипотетических экспериментов в рамках модели стационарного процесса вторичного восстановления ионов тугоплавкого металла щелочным металлом, образующимся на гладком катоде в ходе электролиза солевого расплава. Приведены упрощенные выражения для приблизительных расчетов профилей концентраций внутри диффузионного слоя.
ВВЕДЕНИЕ
В работе [1] представлена модель процесса вторичного восстановления ионов тугоплавкого металла у катода. В настоящей работе предложен простой путь расчета всех величин, фигурирующих в модели. Эти величины рассчитаны для некоторых гипотетических случаев и сделаны соответствующие выводы.
В первую очередь надо отметить, что мы исходили из того, что толщина диффузионного слоя δ изменяется при изменении плотности тока i. Модельные расчеты для натурного эксперимента это подтвердили, и в следующей работе мы подробно остановились на этом [2]. Здесь достаточно отметить, что градиент концентрации ионов тяжелого тугоплавкого металла в растворе у границы катода приводит к градиенту плотности жидкой фазы. Это в свою очередь ведет к возникновению конвективного перемешивания. Вероятно, процесс вторичного восстановления до твердых частиц металла внутри диффузионного слоя усиливает перемешивание, так как эти частицы затем распыляются. При усилении перемешивания δ уменьшается. При увеличении i увеличиваются градиенты концентрации и плотности, а также увеличивается интенсивность выделения твердых частиц, поэтому δ уменьшается. Эти изменения неизбежно отражаются на ходе стационарной поляризационной кривой, которая используется при численном воспроизведении натурного эксперимента.
Надо отличать численный гипотетический эксперимент от численного воспроизведения натурного эксперимента. Речь здесь о значениях трех величин: E, i, δ, − которые должны быть выбраны перед расчетом всех возможных профилей от координаты расстояния. Поскольку потенциал E фактически задает концентрации на границе катода cBSCat, cASCat, а концентрации в объеме уже заданы cA0, cB0, то требуется согласование граничных условий для каждого значения E, то же для i и для δ, ‒ видно из уравнения (24) в [1]. Таким образом, процедура согласования граничных условий ‒ это выбор значений E, i, δ.
Каждый численный эксперимент начинается с выбора любых значений для любых двух величин из этих трех. Выбор делается из каких угодно соображений, уместных с точки зрения исследования. Этот выбор может быть определен условиями в экспериментальной ячейке в случае исследования процесса путем численного воспроизведения натурного эксперимента; в другом случае выбор будет сделан с целью моделирования процесса в технологическом аппарате, когда при проектировании аппарата исследуются результаты гипотетических экспериментов, и т.д. Значение третьей величины необходимо согласовать с тем, что было выбрано:
1. Сначала задается значение E и проводятся вычисления условно постоянных концентраций по уравнениям (30), (31), (32), (33) в [1]; если есть возможность учесть зависимость γB от концентрации, то для области высоких концентраций В на поверхности катода (при больших отрицательных значениях E) в систему добавляется эмпирическое уравнение типа (26) в [1].
2. Далее искомое значение третьей величины вычисляется по (24) в [1]; если искомая третья величина это E, то на шаге 2 проверяется равенство (24) в [1] и, если необходимо, делается приращение ±ΔE и вычисления повторяются сначала с шага 1, и т.д. вплоть до соблюдения равенства (24) в [1].
В итоге можно получить множество согласованных вариантов E, i, δ. Например, при неизменном значении E или i (или δ). В натурном эксперименте принципиально то же самое – можно задать любое значение E с помощью потенциостата. Для получения разных значений i при неизменном E надо изменять режим конвективного перемешивания в ячейке, тогда для каждого значения δ установится соответствующее значение i. Для натурного эксперимента это можно назвать “процедурой согласования” трех упомянутых величин в случае исследования с условием: E = = const.
Итак, каждая пара значений E, i – это отдельный численный эксперимент. Пары E, i, полученные при поляризационных измерениях в условиях вторичного восстановления, в расчетах приводят к численному воспроизведению натурных экспериментов. Любая другая пара E, i приводит к гипотетическому эксперименту, который мог бы стать натурным только при соответствующем перемешивании в натурном эксперименте (δ). Однако надо понимать, что не любой гипотетический эксперимент может быть реализован в виде натурного. Здесь два ограничения − сверху и снизу: δ в гипотетическом эксперименте слишком велика, и естественная конвекция в натурном эксперименте не позволит диффузионному слою увеличиться до этого значения; δ в гипотетическом эксперименте слишком мала, и даже принудительная конвекция в натурном эксперименте (с помощью мешалки либо с помощью вибрации самого катода или вращения на максимальных оборотах) не сможет усилить массообмен до нужной интенсивности и не сможет в достаточной степени уменьшить толщину диффузионного слоя. Тем не менее, с помощью мешалки с регулируемой интенсивностью перемешивания можно реализовать в виде натурного эксперимента многие гипотетические варианты.
РАСЧЕТЫ ПО МОДЕЛИ ВТОРИЧНОГО ВОССТАНОВЛЕНИЯ НА ГЛАДКОМ КАТОДЕ
Ход расчетов
Расчеты сделаны в среде Excel, при этом сначала задавали константы DA, DB, DL (см2/с), выбирали или вычисляли значения $E_{{{\text{о/в}}}}^{0}$, const (В), γ∞, ${{a}_{{{\text{B}}{}^{{m + }}}}}$, k, n, z, после этого рассчитывали константу $K_{c}^{{{\text{*}}{\kern 1pt} {\text{*}}}}$ и условно постоянные величины cASCat, cBSCat, cLSCat, cA0 , cB0 , cL0 (моль/см3). Все расчетные величины находились в своих запрограммированных ячейках.
Далее выбирали и согласовывали E, i, δ. При согласовании параметра E путем подбора проверяли на равенство нулю разницы между левой и правой частью уравнения (24) в [1]. Подбор делали с использованием инструмента Excel Подбор параметра. Во всех вычислениях здесь и далее применяли максимально возможную для персонального компьютера точность. Инструмент Подбор параметра не всегда справляется с согласованием параметра E. Иногда он останавливал вычисления на значении проверяемой разницы, например 10‒15. В этом случае подбор заканчивали вручную. В редких случаях останавливаться приходилось на значении разницы 10‒22, но зачастую это был ноль. В случае согласования параметра i или δ процедура подбора не нужна. В случае численного воспроизведения натурного эксперимента процедура подбора не нужна, так как надо согласовывать δ.
Далее для каждого значения x/δ рассчитывали одновременно cB , cA , cL , w, $c_{{{{{\text{B}}}_{{({x \mathord{\left/ {\vphantom {x \delta }} \right. \kern-0em} \delta })}}}}}^{'}$, $c_{{{{{\text{L}}}_{{({x \mathord{\left/ {\vphantom {x \delta }} \right. \kern-0em} \delta })}}}}}^{'}$,  , VAM, а также i1 для x/δ = 0 и i2V для x/δ = 1. Для этого все величины программировали в своих ячейках по соответствующим
выражениям и со ссылками друг на друга, а значение в ячейке, предназначенной для величины
cB для данной точки на оси x/δ, было подбираемым параметром. Подбор делали, начиная со значения cB для предыдущей выбранной точки на оси x/δ. Подбор делали всегда с использованием инструмента Подбор параметра. При подборе проверяли на равенство нулю разницы:
, VAM, а также i1 для x/δ = 0 и i2V для x/δ = 1. Для этого все величины программировали в своих ячейках по соответствующим
выражениям и со ссылками друг на друга, а значение в ячейке, предназначенной для величины
cB для данной точки на оси x/δ, было подбираемым параметром. Подбор делали, начиная со значения cB для предыдущей выбранной точки на оси x/δ. Подбор делали всегда с использованием инструмента Подбор параметра. При подборе проверяли на равенство нулю разницы:
(1)
$K_{c}^{{*{\text{*}}}}\tfrac{{c_{{\text{A}}}^{z}c_{{\text{B}}}^{n}{\gamma }_{{\text{B}}}^{n}}}{{c_{{\text{L}}}^{{zk}}}} - 1 = 0$(2)
$K_{c}^{{*{\kern 1pt} *}} - \tfrac{{c_{{\text{L}}}^{{zk}}}}{{c_{{\text{A}}}^{z}c_{{\text{B}}}^{n}{\gamma }_{{\text{B}}}^{n}}} = 0.$Точность, с которой добивались для разницы (1) или (2) значения, равного нулю, сильно зависит от участка на оси расстояний x/δ и от рассчитываемой системы, а также от формулы для разницы: для формулы (2) разница больше. В основном разница составляла 10‒2‒10‒15, очень часто ноль. В одном случае эта разница доходила до 10+13 (случай со значением $K_{c}^{{*{\kern 1pt} *}}$ = 6 × 1021, n = 4, k = 7, при i = 5 А/см2, на участке x/δ < 0.4 (при этом xm/δ = 0.93)). После расчета значений всех функций для всех выбранных значений x/δ вычисляли значения i2x.
При работе с инструментом Подбор параметра приходилось постоянно менять количество итераций, ‒ необходимо задавать свое количество итераций для каждого следующего значения x/δ. Для этого первоначально расчет проводили вручную с использованием кнопок Пауза, Продолжить и Шаг внутри процедуры Подбор параметра. Когда становилось понятно, на какой итерации следовало остановить вычисления, нужное количество итераций устанавливали в настройках Excel. Для того чтобы Excel корректно выполнил такое задание, количество итераций должно быть больше 100.
Для случаев, когда k = 0, мы не переписывали в упрощенном виде формулы, приведенные в [1]. В тот же шаблон Excel-файла вставляли ничтожное значение концентрации cL0, например 10‒40 или 10‒50, а для k брали значение 0.
Результаты расчетов для некоторых гипотетических экспериментов
Результаты расчетов нескольких гипотетических экспериментов представлены в табл. 1 и на рис. 1.1–1.7 . Даны, в частности, кривые распределения израсходованного тока вторичного восстановления по толщине диффузионного слоя, i2x ‒ x/δ. По этим кривым определяли ширину зоны Δx, в которой расходуется 95% тока вторичного восстановления i2Cat, расходуемого в пределах диффузионного слоя у катода. Для достаточно высокой точности интегрирования каждый раз определяли интервалы x/δ, где нужно было делать вычисления с достаточно мелким шагом вдоль оси x/δ.
Таблица 1.
Условия и результаты численных гипотетических экспериментов*
| № | Вариант системы: DA = 2 × 10‒5, DL = 5 × 10‒5 DB = 5 × 10‒3, $E_{{{\text{о/в}}}}^{0}$= ‒3.474 γ∞= 25, T = 1073 cA0 = 1 × 10‒4 |
Выбор эксперимента и согласование величин: E = ‒3.000 i = 0.200 |
Результат | Рис. | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| $K_{c}^{{**}}$ | n | k | ${{c}_{{{\text{L0}}}}}$ | δ | ${{i}_{1}}$ | ${{i}_{{2{\kern 1pt} {\text{Cat}}}}}$ | ${{i}_{{2{\kern 1pt} V}}}$ |  |
${\kern 1pt} {\kern 1pt} {{{{x}_{m}}} \mathord{\left/ {\vphantom {{{{x}_{m}}} {\delta }}} \right. \kern-0em} {\delta }}$ | ||
| 1 | 1 × 1010 | 1 | 0 | ‒ | 1.24 × 10‒2 | 1.4 × 10‒4 | 0.182 | 0.018 | 0.18 | 0.93 | 1.1 |
| 2 | 1 × 1010 | 4 | 7 | 5.6 × 10‒3 | 1.66 × 10‒2 | 1.8 × 10‒7 | 0.194 | 0.006 | 0.15 | 0.746 | 1.2 |
| 3 | 1 × 1015 | 2 | 0 | ‒ | 1.32 × 10‒2 | 4.7 × 10‒5 | 0.185 | 0.015 | 0.26 | 0.842 | 1.3 |
| 4 | 1 × 1018 | 2 | 0 | ‒ | 1.35 × 10‒2 | 4.7 × 10‒8 | 0.1996 | 5.0 × 10‒4 | 0.045 | 0.854 | 1.4 |
| 5 | 7 × 1023 | 4 | 7 | 5.6 × 10‒3 | 1.70 × 10‒2 | 0 | 0.200 | 2.1 × 10‒6 | 4.0 × 10‒4 | 0.7726 | 1.5 |
| 6 | DA = 5 × 10‒5 DB = 7.5 × 10‒5, γ∞ = 25 |
E = ‒3.269 i = 1.200 |
1.6 | ||||||||
| 1 × 1010 | 1 | 0 | ‒ | 1 × 10‒3 | 3.2 × 10‒4 | 1.20 | 7.2 × 10‒4 | 0.11 | 0.598 | ||
| 7 | DA = 5 × 10‒5 DB = 7.5 × 10‒5, γ∞ = 1 |
E = ‒2.972 i = 1.200 |
1.7 | ||||||||
| 1 × 1010 | 1 | 0 | ‒ | 1 × 10‒3 | 7.8 × 10‒3 | 1.174 | 0.018 | 0.48 | 0.604 | ||
Пять экспериментов проведены при одинаковой плотности тока и одинаковом потенциале, то есть при одинаковой мольно-долевой концентрации NBSCat (табл. 1, № 1–5). Константы $K_{c}^{{*{\kern 1pt} *}}$, n, k менялись, а также cBSCat менялась за счет изменения V, поэтому менялось и значение δ (подбираемый параметр при согласовании). Увеличение n и k и увеличение cBSCat (на ≈13%) при прочих равных привело к увеличению δ и к уменьшению i1, i2V, Δx/δ , xm/δ (табл. 1, № 1, 2).
Два эксперимента проведены при одинаковых i и δ (табл. 1, № 6, 7). Константа γ∞ изменилась, поэтому изменилось и значение E (подбираемый параметр при согласовании). Уменьшение γ∞ при прочих равных привело к увеличению i1, i2V, Δx/δ, а также к значительному уменьшению пика скорости реакции VAM (рис. 1, эксперименты 1.6, 1.7).
Рис. 1.
Результаты численных гипотетических экспериментов. Условия и численные результаты приведены в табл. 1.
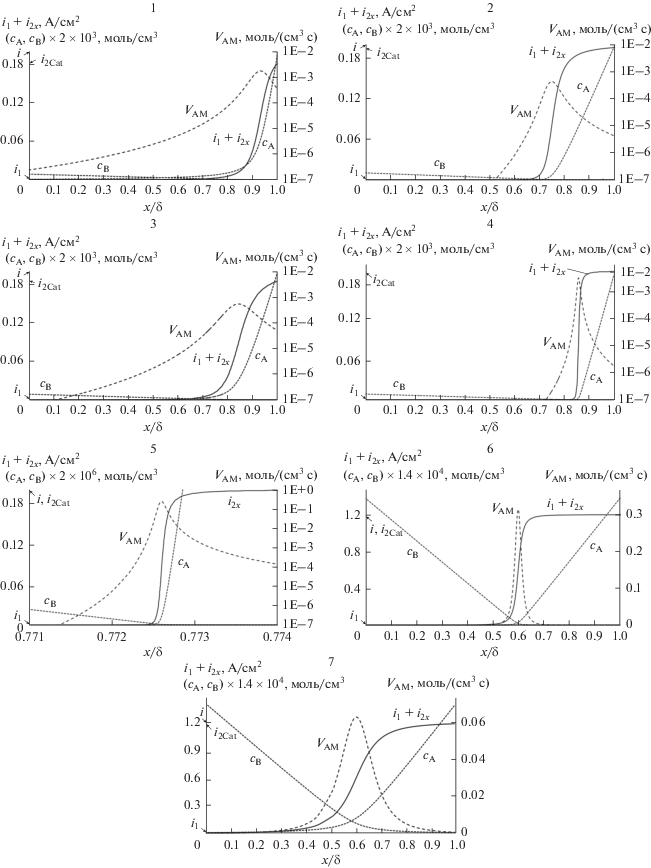
Из табл. 1 видно, что ширина зоны вторичного восстановления Δx/δ быстро уменьшается с увеличением $K_{c}^{{*{\kern 1pt} *}}$. Это означает, что в случае достаточно большого значения $K_{c}^{{*{\kern 1pt} *}}$ некоторые расчеты по модели можно проводить, выстраивая профили концентраций по упрощенной методике. Для этого надо принять, что на оси расстояний вдоль нормали к поверхности катода внутри диффузионного слоя существует только одна точка, где объемная скорость вторичного восстановления существенно больше нуля. Это точка максимума скорости вторичного восстановления xm. При этом надо принять, что весь металл A восстанавливается по механизму вторичного восстановления внутри диффузионного слоя. Конечно, это не точка, а поверхность внутри диффузионного слоя, огибающая катод и пересекающая ось расстояний в точке xm. В итоге получится два участка на оси расстояний: 1 – от поверхности катода до точки xm, 2 – от точки xm до границы диффузионного слоя. На обоих участках будет линейная зависимость концентрации от расстояния x. На участке 1 – для cB(x), на участке 2 – для cA(x). Таким образом, можно записать для участка диффузионного слоя 0 ≤ x ≤ xm :
для участка xm ≤ x ≤ δ:Учитывая выражения (21) в [1] и (4) получим:
Также сделаны расчеты для случая, когда $K_{c}^{{*{\kern 1pt} *}}$ существенно превышает значения из табл. 1, – взяли значение 1056. Например, в случае вторичного восстановления при электролизе иридия в хлоридном расплаве эта константа >1050. Оказалось, что при этом по расчетам протяженность зоны вторичного восстановления вдоль оси x чрезвычайно мала, – меньше размеров одного атома. Понятно, что размер этой зоны больше, но в данном случае он определяется теми факторами, которые модель не учитывает: отклонение системы от термодинамического равновесия в зоне вторичного восстановления, процесс кристаллизации. Именно в подобных случаях, в рамках данной простой модели нет смысла подробно рассчитывать профили концентраций и величин VAM, i2x в очень узкой зоне вторичного восстановления, – вполне достаточно ограничиваться расчетами по упрощенной методике.
Об учете концентрационной зависимости коэффициента активности металла B
В заключение отметим, что в представленных расчетах не учитывалась концентрационная
зависимость коэффициента активности раствора металла B, ‒ отсутствуют выражения для $c_{{{{{\text{B}}}_{{({x \mathord{\left/ {\vphantom {x \delta }} \right. \kern-0em} \delta })}}}}}^{'}$ и 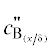 с учетом такой зависимости. С другой стороны, большая концентрация металла B при больших отрицательных значениях E, когда γB заметно отклоняется от γ∞, возникает только у границы катода. При этом i1 = 0, и его не надо рассчитывать. При приближении к узкой зоне вторичного восстановления
концентрация металла B уже значительно падает и можно не учитывать отклонения γB от γ∞.
с учетом такой зависимости. С другой стороны, большая концентрация металла B при больших отрицательных значениях E, когда γB заметно отклоняется от γ∞, возникает только у границы катода. При этом i1 = 0, и его не надо рассчитывать. При приближении к узкой зоне вторичного восстановления
концентрация металла B уже значительно падает и можно не учитывать отклонения γB от γ∞.
При больших отрицательных значениях E профиль концентрации cB(x) вблизи поверхности катода имеет вид линейной зависимости от расстояния x (дробь в выражении (3) ‒ это наклон зависимости cB(x)), а концентрация cA очень низкая и скорость реакции VAM здесь чрезвычайно мала. Поэтому построение профилей на этом участке расстояний не представляет интереса, ‒ все профили от расстояния при больших отрицательных значениях E надо начинать строить гораздо ближе к зоне восстановления, используя γ∞.
Однако в некоторых расчетах учитывать концентрационную зависимость γB при больших концентрациях металла B все же нужно, ‒ от точности определения cBSCat (концентрация металла B при x = 0) в области больших отрицательных значений E сильно зависит результат расчета толщины диффузионного слоя. Это следует из уравнения (24) в [1], и это понятно из общих соображений, изложенных нами в работе [2]. Имея в виду то, что сказано выше, учесть при этом концентрационную зависимость γB просто.
При расчетах, соответствующих разным точкам на E,i-кривой, двигаясь к более отрицательным значениям E, при расчете cBSCat надо использовать значение γ∞, (30) в [1]. Начиная с определенного значения E (‒3.02 В для раствора Na–NaCl [1]), cBSCat надо рассчитывать, используя два уравнения, (26) и (30) в [1].
ЗАКЛЮЧЕНИЕ
В работе приведен алгоритм расчетов в рамках модели стационарного процесса вторичного восстановления ионов тугоплавкого металла щелочным металлом, образующемся на гладком катоде в ходе электролиза солевого расплава.
Приведены результаты расчетов для нескольких гипотетических экспериментов.
Приведены упрощенные выражения для приблизительных расчетов профилей концентраций внутри диффузионного слоя при достаточно больших константах равновесия реакции вторичного восстановления.
Список литературы
Храмов, А.П., Чернышев, А.А., Исаков, А.В., Зайков, Ю.П. Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 1. Вывод базовых уравнений для модели процесса. Электрохимия. 2020. Т. 56. № 9. [Khramov, A.P., Chernyshev, A.A., Isakov, A.V., and Zaykov, Yu.P., Secondary reduction of a refractory metal near a smooth cathode during electrolysis of molten salt. 1. Derivation of basic equations for the process model, Russ. J. Electrochem. 2020, vol. 56, no. 9.
Храмов, А.П., Чернышев, А.А., Исаков, А.В., Суздальцев, А.В., Зайков, Ю.П. Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 3. Численное воспроизведение натурного эксперимента при катодном восстановлении Nb в расплаве KNaCl2–NaF–K3NbF7. Электрохимия. 2020. Т.56. [Khramov, A.P., Chernyshev, A.A., Isakov, A.V., Suzdal’tsev, A.V., and Zaykov, Yu.P., Secondary reduction of a refractory metal near a smooth cathode during electrolysis of molten salt. 3. Numerical reproduction of a natural experiment with cathode reduction of Nb in the melt KNaCl2–NaF–K3NbF7, Russ. J. Electrochem. 2020, vol. 56.
Дополнительные материалы отсутствуют.


