Электрохимия, 2021, T. 57, № 1, стр. 47-58
Электрохимическое определение тирозина на стеклоуглеродном электроде, модифицированном композитом графена и наночастицами золота
М. Лиу a, *, Ж. Лао b, Х. Ван a, З. Су a, Ж. Лиу a, Л. Вен a, З. Йин a, К. Луо b, **, Х. Пен b, c
a Хэнъянский педагогический университет
421008 Хэнъян, КНР
b Восточно-Китайский педагогический университет
200241 Шанхай, КНР
c Университет Шаньси
030006 Тайюань, КНР
* E-mail: liumengqin2013@163.com
** E-mail: chluo@ee.ecnu.edu.cn
Поступила в редакцию 03.01.2020
После доработки 30.04.2020
Принята к публикации 11.06.2020
Аннотация
Изготовлен электрохимический сенсор на основе стеклоуглеродного электрода, модифицированного графеном и наночастицами золота, для определения тирозина. Стеклоуглеродный электрод, модифицированный графеном и наночастицами золота, (графен/Au-наночастицы/стеклоуглерод) был приготовлен потенциостатическим осаждением наночастиц золота на стеклоуглерод, покрытый графеном. Электрохимическое поведение тирозина на этом модифицированном электроде было изучено методами циклической вольтамперометрии и вольтамперометрии с линейной разверткой потенциала. Было показано, что электрокаталитическое поведение электрода по отношению к окислению тирозина после модифицирования улучшается, что видно по значительному увеличению пикового тока. Отмечена линейная зависимость пикового тока от концентрации тирозина в области 100 нM–100 мкM; наименьшая определяемая концентрация (при S/N = 3) равняется 47 нM. Легкость приготовления и хорошая чувствительность делают такой стеклоуглеродный электрод, модифицированный графеном и наночастицами золота, очень перспективным для определения тирозина в реальных образцах.
ВВЕДЕНИЕ
L-тирозин – это заменимая аминокислота. С одной стороны, он играет важную роль в пищевом балансе человеческого тела. Для поддержания азотного баланса тирозин иногда используют в качестве пищевой добавки, а также в фармацевтических препаратах. С другой стороны, тирозин – важный прекурсор в синтезе нейротрансмиттеров и гормонов, включая допамин, норэпинефрин и эпинефрин [1, 2]. Поэтому нарушение баланса тирозина в человеческом теле можно связать с различными психологическими нарушениями (болезнями). Например, дефицит тирозина может вызывать альбинизм, депрессию, алкаптонурию и другие болезни психики, в то время как высокий уровень тирозина может приводить к росту сестринских хроматидных обменов [3–5]. Поэтому важно определять точное содержание тирозина в человеческом теле. В настоящее время методы определения тирозина включают жидкостную хроматографию высокого разрешения [6], молекулярную флуоресцентную спектрометрию [7], усиленное поверхностью рамановское рассеяние (SERS) [8] и электрохимический анализ [9, 10]. Среди них электрохимические методы имеют преимущество удобства, дешевизны, высокой скорости и хорошей чувствительности.
Электрохимические методы имеют также следующие преимущества: простота подготовки образцов, дешевое оборудование, быстрый отклик, высокая чувствительность и избирательность. Их используют для анализов в биологии и медицине для определения таких соединений, как теофилин [11], витамин C [12] и противоонкологические лекарства [13]. Однако использованию электрохимических сенсоров препятствует ограниченное число пригодных электродных материалов с чистой поверхностью, что сильно ограничивает круг веществ, которые можно определять электрохимически с высокой чувствительностью и избирательностью [14]. Поэтому для создания электрохимических сенсоров очень важно модифицировать электроды. Благодаря быстрому прогрессу в нанотехнологии, электроды, модифицированные наноматериалами, широко раздвинули рамки электрохимических методов, применяемых в аналитической химии [15–19].
Начиная с первых сообщений (2004 г.), графен привлекает широкое внимание и используется в различных областях, таких как суперконденсаторы, аккумуляторы, фотокатализ и сенсоры, благодаря таким его преимуществам, как большая площадь поверхности, прекрасная электропроводность, высокая термопроводимость и биосовместимость [20, 21]. Однако, благодаря π–π-взаимодействию в стопке и ван-дер-ваальсовым взаимодействиям, графеновые нанолисты проявляют тенденцию “штабелеваться” в графит, что не способствует практическим применениям графена. Для того чтобы решить эту проблему и использовать синергический эффект компонентов в композитах, графен сочетают с металлами, оксидами металлов, биомолекулами и полимерами [22–24]. Среди них наночастицы золота отличаются хорошей электропроводностью и биосовместимостью. Гибрид наночастиц золота и графена возник как новый функциональный материал; он используется в качестве биосенсора для определения биологически активных материалов [25, 26]. Однако насколько нам известно, не имеется сообщений об определении тирозина с использованием в качестве сенсора стеклоуглеродного электрода, модифицированного графеном и Au-наночастицами.
В настоящей работе описан стеклоуглеродный электрод, модифицированный композитом графен–Au-наночастицы, приготовленный путем покрытия стеклоуглерода графеном, на который затем осаждаются наночастицы золота из водного раствора HAuCl4/H2SO4. Полученный электрод продемонстрировал однородное распределение наночастиц золота по графену. Мы применили этот модифицированный стеклоуглеродный электрод, как электрохимический сенсор, для определения тирозина. Он показал низкую наименьшую определяемую концентрацию и хорошую чувствительность. Этот электрод весьма перспективен для определения тирозина в реальных образцах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реактивы
Вольтамперограммы с линейной разверткой потенциала и циклические вольтамперограммы снимали на электрохимическом комплексе CHI660D (Shanghai Сhenhua Сo., Ltd., Шанхай). Во всех электрохимических опытах была использована трехэлектродная система со стеклоуглеродным или модифицированным стеклоуглеродным рабочим электродом, насыщенным каломельным электродом сравнения и платиновым вспомогательным электродом.
Золотохлористоводородная кислота (HAuCl4 · · 3H2O, AR) была приобретена у компании Shanghai Institute of fine chemical materials (Шанхай), порошок графита (AR) – у компании Aladdin Co., Ltd. (Шанхай), тирозин (BR) – у компании Sinopharm Chemical Reagent Co., Ltd. (Шанхай). Использовалась дважды перегнанная вода.
Приготовление стандартного раствора тирозина
Стандартный раствор тирозина (1 мM) готовили, добавляя 0.0453 г тирозина к 0.1 M раствору NaOH; полученный раствор переносили в мерную колбу на 250.0 мл и доводили до метки 0.1 M раствором NaOH. Полученный стандартный раствор хранили в банке темного стекла до использования.
Приготовление раствора графена
Оксид графена синтезировали по усовершенствованному методу Хаммерса [27]. Его восстанавливали гидразингидратом и получали однородный раствор графена.
Изготовление модифицированного электрода
Стеклоуглеродный электрод полировали порошком Al2O3 до зеркального блеска. Затем его промывали в ультразвуковой ванне с дистиллированной водой, с абсолютным этанолом и дистиллированной водой (по 3 мин каждый раз) и сушили на воздухе. На чистую поверхность стеклоуглерода капали 8 мкл свежеприготовленного однородного раствора графена, сушили под лампой инфракрасного света и получали модифицированный графеном стеклоуглеродный электрод (графен/стеклоуглерод). Стеклоуглеродный электрод, модифицированный наночастицами Au, готовили, погружая стеклоуглеродный электрод в 1 мM раствор HAuCl4, приготовленный путем смешивания 1 мл 10 мM раствора HAuCl4 с 2 мл 0.5 M раствора H2SO4 и 7 мл дистиллированной воды, и осаждая Au-наночастицы при постоянном потенциале –0.4 В в течение 60 с. В результате получали стеклоуглеродный электрод, модифицированный наночастицами Au (Au-наночастицы/стеклоуглерод).
Стеклоуглеродный электрод, модифицированный композитом графена и наночастицами Au (графен/Au-наночастицы/стеклоуглерод), готовили следующим образом. Электрод графен/стеклоуглерод погружали в 1 мM раствор HAuCl4, приготовленный, как указано выше, и проводили осаждение Au-наночастиц при постоянном потенциале –0.4 В в течение 60 с. Получали электрод графен/Au-наночастицы/стеклоуглерод.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологические характеристики графена и композита графен/Au-наночастицы
Морфологию графена и композита графен/Au-наночастицы исследовали методами просвечивающей электронной микроскопии (TEM) и сканирующей электронной микроскопии (SEM); соответствующие микрофотографии показаны на рис. 1. Из рис. 1a видно, что приготовленный графен носит планарный характер и имеет складчатую структуру. SEM-микрофотография (рис. 1б) показывает, что наночастицы Au имеют сферическую форму со средним диаметром около 25 нм; они равномерно распределены по поверхности графена. Это равномерное распределение Au-наночастиц на плоской гибкой поверхности графена предполагает суммирование индивидуальных положительных качеств обоих компонентов и улучшение эксплуатационных характеристик результирующего электрода.
Циклическая вольтамперометрия различных электродов в системе K3Fe(CN)6
Электрохимическое поведение электродов стеклоуглерод, графен/стеклоуглерод, Au-наночастицы/стеклоуглерод и графен/Au-наночастицы/стеклоуглерод было исследовано методом циклической вольтамперометрии в 5 мM растворе K3Fe(CN)6, приготовленном смешиванием 0.0165 г K3Fe(CN)6 с 1.011 г KNO3 и 10.00 мл H2O. Вольтамперограммы снимали в области потенциалов от –0.1 до 0.7 В при скорости развертки потенциала 100 мВ с–1. На рис. 2 представлены эти циклические вольтамперограммы. Хорошо видно, что модифицирование электрода существенно улучшает его каталитическую активность. На всех циклических вольтамперограммах этих электродов имеется пара симметричных пиков окислительного и восстановительного тока, что свидетельствует о квазиобратимом электрохимическом поведении ионов феррицианида. Пиковый ток восстановления равен Ipc1 = 29.63 мкA, Ipc2 = 58.33 мкA,Ipc3 = 43.28 мкА и Ipc4 = 67.16 мкA, соответственно, для электродов: стеклоуглерод, графен/стеклоуглерод, Au-наночастицы/стеклоуглерод и графен/Au-наночастицы/стеклоуглерод. Пиковые токи ${\text{Fe}}({\text{CN}})_{6}^{{{{3 - } \mathord{\left/ {\vphantom {{3 - } {4 - }}} \right. \kern-0em} {4 - }}}}$ на модифицированных электродах выше, чем на стеклоуглеродном электроде с чистой поверхностью. Электрод графен/Au-наночастицы/стеклоуглерод демонстрирует самый большой пиковый ток, возможно, вследствие синергического каталитического эффекта графена и наночастиц Au и увеличения площади поверхности электрода.
Электрохимическое окисление тирозина на различных электродах
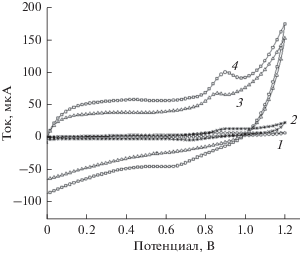
Электрохимический отклик тирозина на различных электродах был исследован методом циклической вольтамперометрии в 10 мкM растворе тирозина в ацетатном (HAc–NaAc) буферном растворе с pH 4.0 при скорости развертки потенциала 200 мВ с–1; соответствующие кривые приведены на рис. 3. На циклических вольтамперограммах исследованных электродов наблюдаются пики тока окисления разной интенсивности, без соответствующего пика тока восстановления на обратном ходе кривой. Это указывает на то, что электрохимическое окисление тирозина – необратимый процесс. Эти пики токов окисления находятся при потенциалах, В: 0.863, 0.903, 0.860 и 0.905, соответственно, для электродов: стеклоуглерод с чистой поверхностью, Au-наночастицы/стеклоуглерод, графен/стеклоуглерод и графен/Au-наночастицы/стеклоуглерод. Добавим, что пиковый ток окисления на стеклоуглероде с чистой поверхностью сильно возрастал (почти в 6 раз) при модифицировании: с 4.683 до 32.49 мкA при переходе к электроду графен/Au-наночастицы/стеклоуглерод. Этот результат показывает, что нанокомпозит графен/Au-наночастицы может эффективно катализировать окисление тирозина.
Рис. 3.
Циклические вольтамперограммы электродов: стеклоуглерод с чистой поверхностью, Au-наночастицы/стеклоуглерод, графен/стеклоуглерод и графен/Au-наночастицы/стеклоуглерод в 10 мкM растворе тирозина. Скорость развертки потенциала: 200 мВ с–1, индифферентный электролит: буферный раствор HAc–NaAc с pH 4.0.
Оптимизация условий аналитического определения
Влияние количества графена на электроде графен/Au-наночастицы/стеклоуглерод. Мы исследовали влияние количества графена на характеристики электрода графен/Au-наночастицы/стеклоуглерод (рис. 4). Количество графена варьировали, используя от 2, 4, 6, 8 до 10 мкл раствора графена при покрытии стеклоуглеродного электрода. Измерения проводили в 10 мкM растворе тирозина в ацетатном (HAc–NaAc) буферном растворе с pH 4.0 при скорости развертки потенциала 200 мВ с–1. Как показано на рис. 4, пиковый ток постепенно возрастает с ростом количества графена и достигает своего максимального значения при объеме раствора графена 8 мкл. Поэтому именно 8 мкл раствора графена было использовано при изготовлении электродов графен/Au-наночастицы/стеклоуглерод для последующих экспериментов.
Влияние скорости развертки потенциала на электрохимическое поведение тирозина. Для выяснения механизма окисления тирозина на модифицированном электроде мы исследовали соотношение между пиковым током окисления и скоростью развертки потенциала в измерениях по методу циклической вольтамперометрии. Измерения проводили на электроде графен/Au-наночастицы/стеклоуглерод в 10 мкM растворе тирозина в ацетатном (HAc–NaAc) буферном растворе с pH 4.0. Полученные результаты (рис. 5) показывают, что при скоростях между 20 и 200 мВ с–1 пиковый ток Ip растет с ростом скорости развертки потенциала и зависит от корня квадратного из этой скорости по линейному закону. Уравнение линейной регрессии таково: Ip (мкA) = 76.69v1/2 + + 0.1938 (R = 0.992). Это говорит о том, что реакция окисления контролируется главным образом диффузией. Более того, с ростом скорости развертки потенциала потенциал пика тока окисления сдвигается к положительным значениям. Если эта скорость становится чересчур высока, окислительный пик уширяется, и пиковый ток становится слишком большим, что не благоприятствует аналитическому определению тирозина. Поэтому в дальнейшем исследовании мы использовали в эксперименте скорость развертки потенциала 200 мВ с–1.
Рис. 5.
Циклические вольтамперограммы 10 мкМ раствора тирозина на электроде графен/Au-наночастицы/стеклоуглерод при различной скорости развертки потенциала (от черного цвета к светло-серому: 20, 40, 80, 120, 160, 200 мВ с–1). Врезка: график зависимости Ip от v1/2.

Влияние pH раствора. Мы исследовали влияние значения pH буферного раствора на электрохимическое поведение тирозина на модифицированном электроде. Значение рН буферного раствора мы выбирали между 3 и 7. Результаты показывают, что пиковый ток максимален, когда буферный раствор HAc–NaAc имеет pH 4 (рис. 6a). Поэтому в последующих экспериментах мы использовали в качестве индифферентного электролита буферный раствор (HAc–NaAc) с pH 4.
Рис. 6.
(a) Зависимость пикового тока 10 мкM раствора тирозина от величины pH буферного раствора HAc–NaAc; (б) зависимость потенциала пика тока 10 мкM раствора тирозина от величины pH буферного раствора HAc–NaAc. Скорость развертки потенциала: 200 мВ с–1.

Исследовалась также связь между потенциалом пика тока окисления Ep и значением pH электролита; результаты представлены на рис. 6б. Видно, что между потенциалом пика тока Ep и величиной pH индифферентного электролита существует линейное соотношение: Ep(мВ) = 1065.3 – 54.7 pH (R = 0.9939), с наклоном 54.7 мВ/pH. Согласно уравнению Николсона, электрод избирательный по отношению к иону водорода должен показывать наклон равный –59.0 m/n [28], где m – число ионов водорода, участвующих в электродной реакции, а n – число электронов, переносимых в этой реакции. Полученный в настоящей работе результат показывает, что протоны участвуют в реакции, и что число протонов, участвующих в процессе окисления, и число переносимых электронов одинаковы, т.е. m = n.
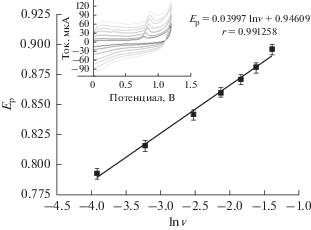
Далее, наблюдается линейное соотношение между потенциалом пика тока окисления тирозина и натуральным логарифмом скорости развертки потенциала. Уравнение линейной регрессии таково: Ep(В) = 0.03997ln v(В/с) + 0.9461 (R = = 0.9916) (рис. 7). Согласно предшествующей работе [28], Ep= E0 + 2.303lg v1/2RT/(1 – α)nF, где E0 – формальный стандартный потенциал (В), α – коэффициент переноса заряда, n – число переносимых электронов, а R, T и F имеют свое обычное значение. Отсюда получаем число переносимых электронов n = 0.92 ≈ 1 (α = 0.5, T = 300 K). Это означает, что в реакции окисления тирозина в HAc–NaAc-растворе участвует один электрон и один протон. Соответственно, механизм реакции окисления может быть передан схемой 1.
Схема 1. Механизм электрохимического окисления тирозина.
Рис. 7.
Линейная связь между EP и ln v для тирозина. Врезка: циклические вольтамперограммы тирозина в буферном растворе HAc–NaAc (pH 4.0) при различной скорости развертки потенциала v.
Влияние времени накопления. Время накопления – важный фактор, влияющий на чувствительность определения. Связь между временем накопления и пиковым током окисления исследовали при постоянном потенциале накопления –0.4 В на электроде графен/Au-наночастицы/стеклоуглерод в 10 мкM растворе тирозина. Рисунок 8 показывает, что пиковый ток вначале подрастает с ростом времени накопления и достигает максимума при времени накопления 60 с, а при дальнейшем увеличении времени накопления следует спад тока. Поэтому в дальнейшем исследовании мы выбрали время накопления равное 60 с.
Рис. 8.
Влияние времени накопления на пиковый ток окисления 10 мкM раствора тирозина в буферном растворе HAc–NaAc (рН 4.00).
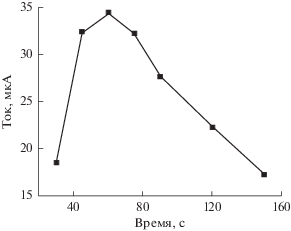
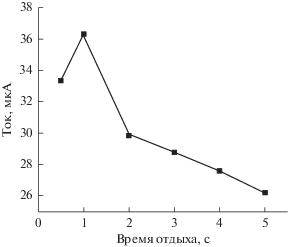
Влияние времени выдержки (отдыха). Влияние времени выдержки на пиковый ток окисления исследовали методом вольтамперометрии с линейной разверткой потенциала. Были выбраны времена выдержки, равные, с: 0.5, 1, 2, 4 и 8. Согласно результатам эксперимента (рис. 9), пиковый ток окисления максимален при времени выдержки равном 1 с. Таким образом, в дальнейшем исследовании время выдержки составляло 1 с.
Выбор начального потенциала. Было исследовано электрохимическое окисление тирозина (10 мкM) в буферном растворе HAc–NaAc при различных начальных потенциалах. Полученные результаты показывают, что пиковый ток окисления максимален, если начальный потенциал равняется приблизительно 0 В (рис. 10). Поэтому мы выбрали для дальнейшего начальный потенциал равный 0 В.
Повторяемость и стабильность электрода
Повторяемость – это важный фактор при оценке надежности результатов определения. Для того чтобы обеспечить повторяемость, мы провели 6 параллельных экспериментов в 10 мкM растворе тирозина на электроде графен/Au-наночастицы/стеклоуглерод в оптимальных экспериментальных условиях. Относительное стандартное отклонение составило 1.68% (табл. 1, S1 ), что указывает на хорошую повторяемость электрода (рис. 11a).
Таблица 1.
Сравнение аналитических характеристик различных электрохимических биосенсоров для определения тирозина
| Электрохимический сенсор | Метод анализа | Область линейности, мкM | Наименьшая определяемая концент-рация, нM | Чувствитель-ность, мкA мкM−1 | Коэффициент корреляции | Ссылка |
|---|---|---|---|---|---|---|
| Одностенные углеродные нанотрубки /стеклоуглерод | Вольтамперометрия с линейной разверткой потенциала | 2–30 | 400 | 0.430 | 0.996 | [27] |
| Многостенные углеродные нанотрубки /стеклоуглерод | Квадратно-волновая вольтамперометрия | 2–500 | 400 | 0.052 | 0.9967 | [29] |
| Нафион/TiO2-графен/стеклоуглерод | Дифференциальная импульсная вольтамперометрия | 5–140 10–160 |
700 2300 |
0.0759 0.0228 |
0.9971 0.9941 |
[30] |
| Углеродные нановолокна/угольно-пастовый электрод | Амперометрия при постоянном потенциале | 0.2–109 | 100 | 0.0107 | 0.9985 | [31] |
| Электрохимически восстановленный оксид графена/стеклоуглерод | Дифференциальная импульсная вольтамперометрия | 0.5–80 | 200 | 0.0261 | 0.999 | [32] |
| Допированный бором алмаз | Дифференциальная импульсная вольтамперометрия | 100–700 | 1000 | 0.00419 | 0.9972 | [33] |
| Оксид графена/многостенные углеродные нанотрубки/стеклоуглерод | Дифференциальная импульсная вольтамперометрия | 0.05–1.0; 1.0–650.0 |
4.4 | 0.5905; 0.3933 |
0.9996; 0.9979 |
[34] |
| β-циклодекстрин-графеновые квантовые точки/стеклоуглерод | Циклическая вольтамперометрия | 6–100 200–1500 |
6.07 | 3.523 0.02626 |
0.9999 0.9975 |
[35] |
| Таурин/реактивный голубой 4-поли-тертиофен–парабензойная кислота/Au-наночастицы/стеклоуглерод | Дифференциальная импульсная вольтамперометрия | 0.02–5.0 5.0–300.0 |
0.88 | 0.00606 0.00044 |
0.994 0.968 |
[36] |
| Допированный Ce гидроксиапатит/стеклоуглерод | Дифференциальная импульсная вольтамперометрия | 0.1–200 | 72 | 0.0078 | 0.9985 | [37] |
| Графен/Au-наночастицы/стеклоуглерод | Вольтамперометрия с линейной разверткой потенциала | 0.10–100 | 47 | 0.9181 | 0.9984 | Настоящая работа |
Рис. 11.
Оценка электрода графен/Au-наночастицы/стеклоуглерод в 10 мкM растворе тирозина в оптимальных условиях эксперимента: (a) повторяемость и (б) стабильность.

Для оценки стабильности приготовленного электрода графен/Au-наночастицы/стеклоуглерод его хранили в холодильнике при температуре 4°C. Стабильность модифицированного электрода проверяли ежедневно в 10 мкM растворе тирозина. Не наблюдалось сколько-нибудь заметного падения пикового тока в течение первых двух дней. Затем пиковый ток со временем уменьшался и через 5 дней уменьшился до 79% от своего начального значения. Этот результат означает, что модифицированный электрод графен/Au-наночастицы/стеклоуглерод обладает умеренной стабильностью (рис. 11б).
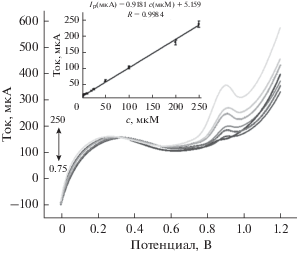
Область линейности и наименьшая определяемая концентрация
В оптимальных экспериментальных условиях мы определяли концентрацию тирозина методом вольтамперометрии с линейной разверткой потенциала. Пиковый ток окисления тирозина демонстрирует хорошую линейную зависимость от его концентрации в области 100 нM–100 мкM. Уравнение линейной регрессии таково: Ip (мкA) = = 0.9181c (мкM) + 5.159, с коэффициентом корреляции R = 0.9984. Наименьшая определяемая концентрация равняется 47 нM (рис. 12). Полученные в настоящей работе результаты сравнимы с опубликованными в литературе для определения тирозина: они сведены в табл. 1. Эти результаты показывают, что электрод графен/Au-наночастицы/стеклоуглерод представляет собой подходящую основу для определения тирозина.
Помехи определению
Воздействие различных соединений – потенциальных помех определению тирозина – мы исследовали методом вольтамперометрии с линейной разверткой потенциала в оптимальных экспериментальных условиях. Эти потенциальные помехи были выбраны из круга соединений, которые обычно сопутствуют тирозину в биологических жидкостях. Концентрация стандартного раствора тирозина составляла 1.00 × 10–5 М, а допустимая ошибка определения – менее ±5.0%. Полученные результаты показывают, что в пределах этой допустимой ошибки 100-кратный избыток Cl–, 50-кратный избыток сальбутамола, Fe3+, Cu2+, 15-кратный избыток эмодина и 10-кратный избыток триптофана не мешает определению тирозина.
ЗАКЛЮЧЕНИЕ
Изготовлен стеклоуглеродный электрод, модифицированный композитом графен/Au-наночастицы, для определения тирозина. Детально исследовано электрохимическое поведение тирозина и найдены оптимальные условия его определения. Благодаря синергическому каталитическому эффекту графена и наночастиц Au, электрохимический отклик сенсора на тирозин очень сильно улучшен по сравнению с сенсорами на основе чистого графена и наночастиц Au. Измерения методами циклической вольтамперометрии и вольтамперометрии с линейной разверткой потенциала показали, что пик тока окисления растет с концентрацией тирозина по линейному закону в области 100 нM–100 мкM, а наименьшая определяемая концентрация составляет 47 нM (S/N = 3). Эти результаты указывают на то, что приготовленный электрод графен/Au-наночастицы/стеклоуглерод весьма перспективен для определения тирозина и может быть использован при количественном определении тирозина в реальных образцах.
Список литературы
Liang, H.J., Ling, T.R., Rick, J.F., and Chou, T.C., Molecularly imprinted electrochemical sensor able to enantroselectivly recognize D and L-tyrosine, Anal. Chim. Acta, 2005, vol. 542, no. 1, p. 83.
Jin, G.P. and Lin, X.Q., The electrochemical behavior and amperometric determination of tyrosine and tryptophan at a glassy carbon electrode modified with butyrylcholine, Electrochem. Commun., 2004, vol. 6, no. 5, p. 454.
Lorrain, B., Dangles, O., Genot, C., and Dufour, C., Chemical Modeling of Heme-Induced Lipid Oxidation in Gastric Conditions and Inhibition by Dietary Polyphenols, J. Agr. Food Chem., 2010, vol. 58, no. 1, p. 676.
Vlasova, I.I., Sokolov, A.V., and Arnhold, J., The free amino acid tyrosine enhances the chlorinating activity of human myeloperoxidase, J. Inorg. Biochem., 2012, vol. 106, no. 1, p. 76.
Vasjari, M., Merkoçi, A., Hart, J.P., and Alegret, S., Amino Acid Determination Using Screen-Printed Electrochemical Sensors, Microchim. Acta, 2005, vol. 150, no. 3, p. 233.
Sanchez-Machado, D.I., Chavira-Willys, B., and Lopez-Cervantes, J., High-performance liquid chromatography with fluorescence detection for quantitation of tryptophan and tyrosine in a shrimp waste protein concentrate, J. Chromatogr. B, 2008, vol. 863, no. 1, p. 88.
Ma, Q., Yu, W., Huang, H., and Su, X., Determination of L-tyrosine Based on Luminescence Quenching of Mn-Doped ZnSe Quantum Dots in Enzyme Catalysis System, J. Fluoresc.,2011, vol. 21, no. 1, p. 125.
Cheng, M.-L., Tsai, B.-C., and Yang, J., Silver nanoparticle-treated filter paper as a highly sensitive surface-enhanced Raman scattering (SERS) substrate for detection of tyrosine in aqueous solution, Anal. Chim. Acta, 2011, vol. 708, nos. 1–2, p. 89.
Liu, X., Luo, L., Ding, Y., Kang, Z., and Ye, D., Simultaneous determination of L-cysteine and L-tyrosine using Au-nanoparticles/poly-eriochrome black T film modified glassy carbon electrode, Bioelectrochemistry, 2012, vol. 86, p. 38.
Labib, M., Sargent, E.H., and Kelley, S.O., Electrochemical Methods for the Analysis of Clinically Relevant Biomolecules, Chem. Rev., 2016, vol. 116, no. 16, p. 9001.
Ganjali, M.R., Dourandish, Z., Beitollahi, H., Tajik, S., Hajiaghababaei, L., and Larijani, B., Highly sensitive determination of theophylline based on graphene quantum dots modified electrode, Int. J. Electrochem. Sci., 2018, vol. 13, no. 3, p. 2448.
Motaghi, M.M., Beitollahi, H., Tajik, S., and Hosseinzadeh, R., Nanostructure electrochemical sensor for voltammetric determination of vitamin C in the presence of vitamin B6: application to real sample analysis,Int. J. Electrochem. Sci., 2016, vol. 11, no. 9, p. 7849.
Tajik, S., Taher, M.A., Beitollahi, H., and Torkzadeh-Mahani, M., Electrochemical determination of the anticancer drug taxol at a ds-DNA modified pencil-graphite electrode and its application as a label-free electrochemical biosensor, Talanta, 2015, vol. 134, p. 60.
Mazloum-Ardakani, M., Beitollahi, H., Amini, M.K., Mirkhalaf, F., Mirjalili, B.-F., and Akbari, A., Application of 2-(3,4-dihydroxyphenyl)-1,3-dithialone self-assembled monolayer on gold electrode as a nanosensor for electrocatalytic determination of dopamine and uric acid, Analyst,2011, vol. 136, no. 9,p. 1965.
Ganjali, M.R., Salimi, H., Tajik, S., Beitollahi, H., Rezapour, M., and Larijani, B., Application of Fe3O4@SiO2/MWCNT Film on glassy carbon electrode for the sensitive electroanalysis of levodopa, Int. J. Electrochem. Sci., 2017, vol. 12, no. 6, p. 5243.
Khalilzadeh, M.A., Tajik, S., Beitollahi, H., and Venditti, R.A., Green Synthesis of Magnetic Nanocomposite with Iron Oxide Deposited on Cellulose Nanocrystals with Copper (Fe3O4@CNC/Cu): Investigation of Catalytic Activity for the Development of a Venlafaxine Electrochemical Sensor, Ind. Eng. Chem. Res., 2020, vol. 59, no. 10, p. 4219.
Mahmoudi-Moghaddam, H., Tajik, S., and Beitollahi, H., Highly sensitive electrochemical sensor based on La3+‑doped Co3O4 nanocubes for determination of sudan I content in food samples, Food Chem., 2019, vol. 286, p. 191.
Tajik, S., Beitollahi, H., and Biparva, P., Methyldopa electrochemical sensor based on a glassy carbon electrode modified with Cu/TiO2 nanocomposite, J. Serb. Chem. Soc., 2018, vol. 83, nos. 7–8, p. 863.
Tajik, S., Taher, M.A., Beitollahi, H., Hosseinzadeh, R., and Ranjbar, M., Preparation, Characterization and Electrochemical Application of ZnS/ZnAl2S4 Nanocomposite for Voltammetric Determination of Methionine and Tryptophan Using Modified Carbon Paste Electrode, Electroanalysis, 2016, vol. 28, no. 4, p. 656.
Liu, Y., Dong, X., and Chen, P., Biological and chemical sensors based on graphene materials, Chem. Soc. Rev., 2012, vol. 41, no. 6, p. 2283.
Xu, J., Wang, Y., and Hu, S., Nanocomposites of graphene and graphene oxides: Synthesis, molecular functionalization and application in electrochemical sensors and biosensors. A review, Microchim. Acta, 2017, vol. 184, no. 1, p. 1.
Du, Y.-C., Huang, L.-J., Wang, Y.-X., Yang, K., Tang, J.-G., Wang, Y., Cheng, M.-M., Zhang, Y., Kipper, M.J., Belfiore, L.A., and Ranil, W.S., Recent developments in graphene-based polymer composite membranes: Preparation, mass transfer mechanism, and applications, J. Appl. Polym. Sci., 2019, vol. 136, no. 28, p. 47761.
Ehsani, A., Heidari, A.A., and Asgari, R., Electrocatalytic Oxidation of Ethanol on the Surface of Graphene Based Nanocomposites: An Introduction and Review to it in Recent Studies, Chem. Rec., 2019. https://doi.org/10.1002/tcr.201800176
Meng, X., Zhao, S., Zhang, Z., Zhang, R., Li, J., Leng, J., Cao, D., Zhang, G., and Sun, R., Nacre-inspired Highly Stretchable Piezoresistive Cu–Ag Nanowires/Graphene Synergistic Conductive Network for Strain Sensor and Beyond, J. Mater. Chem. C, 2019. https://doi.org/10.1039/c9tc00943d
Li, C., Zhao, J., Yan, X., Gu, Y., Liu, W., Tang, L., Zheng, B., Li, Y., Chen, R., and Zhang, Z., Tremella-like graphene–Au composites used for amperometric determination of dopamine, Analyst, 2015, vol. 140, no. 6, p. 1913.
Pan, D., Gu, Y., Lan, H., Sun, Y., and Gao, H., Functional graphene–gold nanocomposite fabricated electrochemical biosensor for direct and rapid detection of bisphenol A, Anal. Chim. Acta, 2015, vol. 853, p. 297.
Zhu, S., Zhang, J., Zhao, X.-E., Wang, H., Xu, G., and You, J., Electrochemical behavior and voltammetric determination of L-tryptophan and L-tyrosine using a glassy carbon electrode modified with single-walled carbon nanohorns, Microchim. Acta, 2014, vol. 181, nos. 3–4, p. 445.
Zheng, M., Gao, F., Wang, Q., Cai, X., Jiang, S., Huang, L., and Gao, F., Electrocatalytical oxidation and sensitive determination of acetaminophen on glassy carbon electrode modified with graphene–chitosan composite, Mat. Sci. Eng. C-Mater., 2013, vol. 33, no. 3, p. 1514.
Xu, Q. and Wang, S.F., Electrocatalytic oxidation and direct determination of L-tyrosine by square wave voltammetry at multi-wall carbon nanotubes modified glassy carbon electrodes, Microchim. Acta, 2005, vol. 151, nos. 1–2, p. 47.
Fan, Y., Liu, J.-H., Lu, H.-T., and Zhang, Q., Electrochemistry and voltammetric determination of L-tryptophan and L-tyrosine using a glassy carbon electrode modified with a Nafion/TiO2-graphene composite film, Microchim.Acta, 2011, vol. 173, nos. 1–2, p. 241.
Tang, X., Liu, Y., Hou, H., and You, T., Electrochemical determination of L-Tryptophan, L-tyrosine and L‑Cysteine using electrospun carbon nanofibers modified electrode, Talanta, 2010, vol. 80, no. 5, p. 2182.
Deng, K.-Q., Zhou, J.-H., and Li, X.-F., Direct electrochemical reduction of graphene oxide and its application to determination of L-tryptophan and L-tyrosine. Colloid Surfaces B, 2013, vol. 101, p. 183.
Zhao, G.H., Qi, Y., and Tian, Y., Simultaneous and direct determination of tryptophan and tyrosine at boron-doped diamond electrode, Electroanalysis, 2006, vol. 18, no. 8, p. 830.
Li, J., Kuang, D., Feng, Y., Zhang, F., Xu, Z., Liu, M., and Wang, D.J.M.A., Electrochemical tyrosine sensor based on a glassy carbon electrode modified with a nanohybrid made from graphene oxide and multiwalled carbon nanotubes, 2013, vol. 180, no. 1–2, p. 49.
Dong, S., Bi, Q., Qiao, C., Sun, Y., Xia, Z., Lu, X., and Liang, Z.J.T., Electrochemical sensor for discrimination tyrosine enantiomers using graphene quantum dots and β-cyclodextrins composites, Talanta, 2017, vol. 173, p. 94.
Lee, W.-C., Noh, H.-B., Hussain, K.K., Min, S.-J., and Shim, Y.-B., Nicotine and tyrosine detection in blood and urine samples using taurine/reactive blue-immobilized conducting polymer composite, Sensor Actuat. B-Chem., 2018, vol. 275, p. 284.
Kanchana, P., Navaneethan, M., and Sekar, C., Fabrication of Ce doped hydroxyapatite nanoparticles based non-enzymatic electrochemical sensor for the simultaneous determination of norepinephrine, uric acid and tyrosine. Mater. Sci. Eng. B, 2017, vol. 226, p. 132.
Дополнительные материалы
- скачать ESM.docx
- Figure S1. Potentiostatic deposition curve of Au NPs
Table S1. Determination repeatability of 10 μM Tyr under optimum experimental conditions at GR/Au NPs/GCE