Электрохимия, 2021, T. 57, № 1, стр. 3-18
Электрохимическое поведение 1-нитро-6-сульфокислоты нафталина
А. А. Конарев *
Федеральное государственное унитарное предприятие “Государственный научный центр “НИОПИК””
123995 Москва, ул. Большая Садовая, 1, корп. 4ГСП-5, Россия
* E-mail: konarev.niopik@gmail.com
Поступила в редакцию 26.02.2020
После доработки 22.04.2020
Принята к публикации 15.05.2020
Аннотация
Исследовано электрохимическое поведение 1-нитро-6-сульфокислоты нафталина методами полярографии, вольтамперометрии на стеклоуглероде, электролизом при контролируемом потенциале и в гальваностатическом режимах. Показано, что 1-нитро-6-сульфокислота нафталина подобно α‑нитронафталину и 1-нитро-3,6,8-трисульфокислоте нафталина полярографически восстанавливается в сильнокислой среде на фоне 0.1 N H2SO4 в единую шестиэлектронную стадию до соответствующей аминосульфокислоты нафталина через промежуточно образующийся гидроксиламин. Торможение полярографического восстановления 1-нитро-6-сульфокислоты при этом в виде спада тока на полярограмме, а также сильная зависимость параметров и формы поляризационных кривых от состава фонового раствора и рН в нейтральных и щелочных растворах связаны с анионным характером восстанавливающейся частицы, обусловленной присутствием кислой сульфогруппы в ее молекуле. Для препаративного электросинтеза 1-амино-6-сульфокислоты нафталина определены технологические параметры: плотность тока 5–10 А/дм2, температура 30–32°С и концентрация исходного нитросоединения 10–13%, которые на катоде из никеля марки Н3 и нержавеющей стали Х18Н10Т в аммиачном буферном растворе с рН 7.0–8.2 обеспечивают выход целевого продукта по веществу 87.0–93.5%, по току 38.0–42.4% и по выделению из раствора 69.0–80.0%. Для повышения эффективности электровосстановления технической изомерной смеси нитро-Клеве-кислот рекомендуется ее предварительная очистка и создание инертной атмосферы как при электролизе, так и при выделении целевых Клеве-кислот из раствора.
ВВЕДЕНИЕ
Изомерная смесь 1,6- и 1,7-нафтиламиносульфокислот (Клеве-кислоты) находит широкое применение в производстве красителей [1]. Клеве-кислоты получают восстановлением соответствующих нитросульфокислот нафталина, используя различные химические реагенты:
В промышленности Клеве-кислоты получают восстановлением смеси нитросульфокислот нафталина чугунной стружкой [2]. При этом производство отягощено большим количеством сточных вод и твердых неутилизируемых отходов в виде угольно-железного шлама (на 1 т продукта образуется 4.0–4.5 т твердых отходов). Кроме того, выход Клеве-кислот нестабилен и определяется качеством чугунной стружки и ее подготовкой перед восстановлением.
Данные, касающиеся электрохимического восстановления изомерной смеси нафтилнитросульфокислот (ННСК), в литературе весьма ограничены [3]. В работе [3] показано, что электрохимическое восстановление 1,6- и 1,7-нафтилнитросульфокислот нафталина на свинцовом катоде в кислой среде протекает лишь до образования нафтилгидроксиламиносульфокислот. Повышение температуры и активности электрода путем осаждения цинка или меди на свинцовом катоде позволило повысить скорость реакции, но не обеспечило дальнейшее превращение гидроксиламинопроизводных в амин.
В работе [4] исследовано электрохимическое восстановление технической изомерной смеси 1,6- и 1,7-нафтилнитросульфокислот в соответствующие аминосульфокислоты нафталина (Клеве-кислоты) в сильнокислой и аммиачно-буферной средах на различных катодных материалах. На никелевом катоде в аммиачно-буферной среде в условиях препаративного электролиза выход Клеве-кислот по веществу в растворе составляет 88–93%, выход по току – 58–60%. Однако выход Клеве-кислот по выделению из растворов, полученных после электролиза, составляет 39.0–43.0% против 52.0–60.0% при химическом восстановлении. Кроме того, выделенные из реакционных масс по методике действующего производства Клеве-кислоты в отличие от Клеве-кислот, полученных химическим путем, обогащены изомером 1,7-Клеве-кислоты. Так, соотношение изомерных аминосульфокислот нафталина в пасте составляет: 1,6-Клеве-кислота – 8–9%, 1,7‑Клеве-кислота – 80–90%, 1,8-Пери-кислота – 6–8%. Поэтому разработка технологии электровосстановления технической изомерной смеси 1,6- и 1,7-нафтилнитросульфокислот в соответствующие аминосульфокислоты нафталина потребовала предварительного обстоятельного изучения электрохимического поведения 1-нитро-6-сульфокислоты нафталина (НСКН), как модельного соединения для установления причины более низкого выхода Клеве-кислот по выделению из раствора, полученного после электролиза, и уменьшения концентрации 1-амино-6-сульфокислоты нафталина в выделенном продукте по сравнению с химическим восстановлением изомерной смеси 1,6- и 1,7-нитросульфокислот нафталина.
МЕТОДИКА ЭКСПЕРИМЕНТА
Полярограммы снимали с помощью полярографа ПУ-1. Ртутный капающий электрод (р. к. э.) с принудительным отрывом капли лопаточкой имел следующие характеристики, определенные в 0.1 N растворе КС1 при разомкнутой цепи и высоте столба ртути 50 см: m = 1.0 мг/с, t = 0.65 с. Потенциалы приведены относительно насыщенного каломельного электрода.
Фоновыми электролитами служили растворы Бриттона–Робинсона со значениями рН от 2.0 до 11.0 и постоянной ионной силой 0.5 М, растворы НС1, Н2SO4 и NaOH с концентрацией 0.1–1.0 N и аммиачно-буферные растворы с рН 5.0–9.0, а также растворы хлорида аммония с концентрацией 0.1–1.0 N.
Циклические вольт-амперные кривые на стеклоуглероде марки СУ-2000 (СУ) регистрировали с помощью полярографа ПУ-1 в дифференциальном режиме. Применявшийся в работе стационарный электрод представлял собой торец стеклоуглеродного стержня диаметром 2 мм [8].
Ячейка представляла собой конический стеклянный сосуд объемом 20 см3 с термостатируемой рубашкой. Электродом сравнения служил насыщенный каломельный полуэлемент, относительно которого и приведены значения потенциалов. В качестве вспомогательного электрода использовали также насыщенный каломельный полуэлемент.
Для получения воспроизводимых результатов СУ шлифовали на мелкой шкурке, полировали до зеркального блеска фетром, пропитанным глицерином с оксидом алюминия. После промывки дистиллированной водой электрод выдерживали в концентрированной серной кислоте и снова тщательно промывали. Непосредственно перед записью каждой вольт-амперной кривой электрод промывали водой и протирали фильтровальной бумагой. Электролит, в который погружали электрод, продували инертным газом для удаления растворенного кислорода.
С целью идентификации продуктов восстановления НСКН, а также оценки его эффективности проводили электролиз при контролируемых потенциалах с использованием электронного потенциостата П-5848. Электролиз на электродах из различных материалов осуществляли в стеклянной цилиндрической ячейке с термостатируемой рубашкой с разделенными катионообменной мембраной МК-40 анодным и катодным пространствами. Анодом служила платиновая пластинка, анолитом – 10%-ный раствор серной кислоты. Объем католита составлял 70 мл. Термостатированная ячейка имела пришлифованную крышку со штуцерами для токоподводов, отбора проб, установки капилляра Луггина и подачи азота. Катод из исследуемого металла с поверхностью 0.15 дм2 устанавливали на дне ячейки. Токоподвод осуществляли с помощью ножки, впаянной в стеклянную трубку. Для перемешивания католита использовали магнитную мешалку.
Потенциалы задавали в соответствии с данными, полученными из поляризационных измерений на твердых электродах.
В ходе электролиза полярографически и вольтамперометрически контролировали изменение концентрации исходного нитросоединения и продуктов реакции [8].
Восстановление НСКН в гальваностатическом режиме проводили в такой же стеклянной цилиндрической ячейке, что и электролиз при контролируемом потенциале.
Для полярографических и вольтамперометрических исследований НСКН и АСКН очищали двойной перекристаллизацией из деионизованной воды. НСКН в виде аммонийной соли выделяли из технической изомерной смеси нафтилнитросульфокислот с концентрацией 0.5–0.7 М и составом: 40.5% 1-нитро-6-сульфокислоты нафталина, 51.0% 1-нитро-7-сульфокислоты нафталина и 3.5% 1-нитро-8-сульфокислоты нафталина, полученной с действующего производства. Чистоту выделенной НСКН оценивали методом ТСХ, используя в качестве элюента систему: уксусная кислота : бутанол : дистиллированная вода в соотношении 1 : 4 : 5. Кроме того, соотношение изомеров аминосульфокислот нафталина в растворе и в выделенном продукте анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ), приведенном в [4].
α-Нитронафталин, используемый для полярографических исследований, дважды перекристаллизовывали из этилового спирта.
Концентрацию промежуточно образующейся гидроксиламиносульфокислоты нафталина определяли вольтамперометрически на фоне 1 М раствора NaOH в дифференциальном режиме [5], а концентрацию АСКН – методом диазотирования, считая на диазотирующиеся продукты с молекулярной массой 223.
Выделение целевой АСКН из раствора, полученного после электролиза, проводили его подкислением серной кислотой до рН реакционной массы 3.9–4.1 при температуре 50–55°С, с последующим охлаждением до 20–25°С и подкислением до рН 2.0 при перемешивании, а затем при этой температуре давали выдержку в течение 18–20 ч при остановленной мешалке с периодическим размешиванием реакционной массы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полярографическое восстановление НСКН
В сильнокислой среде на фоне 0.1 N серной и соляной кислот наблюдается одна волна со слабовыраженным спадом тока (рис. 1), аналогичным для полярографического восстановления 1‑нитро-3,6,8-трисульфокислоты нафталина и обусловленным анионным характером восстанавливающегося нитросоединения [6]. При рН выше 1.96 спад тока исчезает и в растворах с рН 1.96–5.3, на полярограммах наблюдаются две волны, причем высота второй волны составляет 1/3 от суммарного предельного тока. При увеличении рН фона высота второй волны уменьшается, а при рН 6.2 полностью исчезает и на полярограммах регистрируется одна волна. Зависимость предельного тока первой волны от рН в интервале от 1.96 до 4.5 носит сложный характер, а выше 4.5 перестает зависеть от величины рН (рис. 1).
Рис. 1.
Полярограммы НСКН на фоне 0.1 N Н2SO4 (1) и буферных растворов Бриттона–Робинсона при рН: 2 – 2.7; 3 – 5.3; 4 – 8.3; 5 – 10.3; 6 – 0.1 N NaOH. Концентрация НСКН – 2.8 × 10–4 М, температура 20°С.
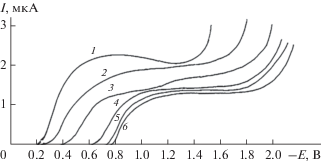
Потенциал полуволны первой волны, как видно из рис. 1, с ростом рН сдвигается в область более отрицательных значений, а Е1/2 второй волны практически не изменяется и составляет –1.0…–1.05 В. Зависимость Е1/2 от рН имеет S-образный характер. В интервале рН 3.0–8.0 ∆Е1/2/∆рН составляет 70 мВ/ед. рН. В растворах с рН выше 8.0 Е1/2 первой волны сохраняется постоянным и составляет –0.80 В.
Прямые, характеризующие зависимости Id первой волны на фоне 0.1 N раствора серной кислоты от корня квадратного из высоты ртутного столба и от концентрации нитросоединения, линейны и проходят через начало координат, а температурный коэффициент предельного тока первой волны в кислых растворах составляет 1.3–1.6%/град, что указывает на диффузионную природу тока первой волны.
В аммиачных буферных растворах с рН 4.95–8.6 НСКН восстанавливается, образуя на полярограмме одну волну. При этом предельный ток и Е1/2 в исследованном интервале рН практически не изменяются (табл. 1).
Таблица 1.
Влияние рН на полярографическое восстановление НСКН в аммиачных буферных (0.1 N NH4Cl + + NH4OH) растворах. Концентрация НСКН – 2.8 × × 10–4 М
| рН | –Е1/2, В | Id, мкА |
|---|---|---|
| 4.95 | 0.75 | 1.46 |
| 6.30 | 0.75 | 1.50 |
| 7.30 | 0.75 | 1.50 |
| 8.60 | 0.76 | 1.50 |
Для предельного тока волны восстановления НСКН в аммиачном буферном растворе с рН 8.6 наблюдается линейная зависимость от концентрации вещества, проходящая через начало координат, зависимость Id от корня квадратного из высоты ртутного столба отсекает отрезок на оси абсцисс, а температурный коэффициент составляет 0.7–0.8%/град. Эти данные свидетельствуют о наличии адсорбционной составляющей тока волны восстановления НСКН.
Число электронов, принимающих участие в электродном процессе, оценивали сравнением высоты волны α-нитронафталина, восстанавливающегося в сильнокислой среде аналогично другим нитросульфопроизводным нафталина [6, 7] до соответствующего аминосоединения с наблюдаемой одной шестиэлектронной стадией через промежуточно образующийся гидроксиламин, а в щелочной среде – четырех электронов до гидроксиламиносоединения с высотой волны НСКН в идентичных условиях. При этом высота волн НСКН как в сильнокислой, так и в щелочной средах равна высоте волны α-нитронафталина. Поэтому можно полагать, что полярографическое восстановление НСКН также протекает в сильнокислой среде в одну единую шестиэлектронную стадию до соответствующей АСКН, а в щелочной среде с затратой четырех электронов до соответствующей гидроксиламиносульфокислоты нафталина.
Наличие неразделенной шестиэлектронной волны восстановления α-нитронафталина [7], 1‑нитро-3,6,8-трисульфокислоты нафталина [6], а также НСКН, вероятно, можно объяснить образованием в сильнокислой среде активного электрофильного промежуточного продукта – мезомерного карбониевого иона, возникающего в результате поверхностной протонизации нафтилсульфогидроксиламина и последующей его дегидратации, напоминающего структуру хинонимина:
который восстанавливается при тех же потенциалах, что и исходное нитросоенинение.Подобный промежуточный продукт образуется в результате дегидратации N-гидроксиламинофенола и восстанавливается легче исходного соединения [8], в результате чего о- и п-нитрофенолы полярографически восстанавливаются непосредственно до амина, образуя единую шестиэлектронную волну. В то же время полярографическое восстановление 2-нитро-4,8-дисульфокислоты нафталина, как показали наши исследования, на фоне 0.1 N серной и соляной кислот протекает в две стадии аналогично нитробензолу и его производным [9] с суммарным потреблением шести электронов: сначала наблюдается четырехэлектронная волна, приводящая к образованию нафтилсульфогидроксиламина, а затем регистрируется при более отрицательных потенциалах двухэлектронная волна его последующего восстановления в соответствующее аминосоединение. Наблюдаемое отличие в полярографическом поведении 2‑нитро-4,8-дисульфокислоты нафталина от α‑нитронафталина и других его сульфозамещенных в сильнокислой среде, видимо, можно объяснить невозможностью образования мезомерного карбониевого иона, связанной со строением молекулы нитродисульфокислоты нафталина.
Электровосстановление НСКН на СУ
На катодной ветви циклических поляризационных кривых в 0.1 N растворе серной кислоты, а также в буферных растворах Бриттона–Робинсона с рН 1.96–11.0 наблюдается один необратимый пик восстановления НСКН (табл. 2), как и на р. к. э. При увеличении рН раствора высота пика уменьшается, а на фоне 0.1 N раствора NaOH пик разделяется на два приблизительно равной высоты.
Таблица 2.
Влияние рН на электровосстановление НСКН на СУ в буферных растворах Бриттона–Робинсона. Концентрация НСКН – 2 × 10–4 М, температура 20°С
| рН | Катодный пик | Анодный пик | ||
|---|---|---|---|---|
| –Еp, В | Ip, мм | Еp, В | Ip, мм | |
| 0.1 N Н2SO4 | 0.39 | 120 | +0.24 | 31 |
| 1.96 | 0.42 | 102 | +0.20 | 29 |
| 2.70 | 0.47 | 100 | +0.15 | 30 |
| 4.50 | 0.56 | 98 | +0.10 | 30 |
| 5.30 | 0.59 | 94 | +0.03 | 30 |
| 6.20 | 0.63 | 91 | 0.00 | 30 |
| 7.20 | 0.66 | 82 | –0.02 | 29 |
| 8.30 | 0.71 | 68 | –0.10 | 25 |
| 9.40 | 0.73 | 64 | –0.15 | 24 |
| 10.30 | 0.76 | 57 | –0.20 | 24 |
| 11.00 | 0.77 | 54 | –0.23 | 24 |
| 0.1 N NaOH | 0.80 | 35 | –0.35 | 18 |
| 1.04* | 26* | |||
При реверсе развертки от потенциала –1.3 В регистрируется анодный пик при потенциалах ‒0.35…+0.24 В в зависимости от рН фонового раствора, связанный с окислением промежуточного продукта – 1-гидроксиламино-6-сульфокислоты нафталина, образующегося в результате восстановления НСКН. К тому же, окисление конечного продукта восстановления нитросоединения – АСКН на фоне 0.1 N Н2SO4 наблюдается при более положительном потенциале, составляющем +0.65 В, а с увеличением рН фонового раствора Еp сдвигается в катодную сторону, что указывает на облегчение процесса окисления АСКН в щелочной среде (рис. 2).
Рис. 2.
Дифференциальные вольтамперограммы окисления АСКН на СУ на фоне различного состава: 1 – 0.1 N H2SO4; 2 – буферный раствор Бриттона–Робинсона с рН 5.2; 3 – 0.1 N NaOH. Концентрация АСКН – 3.8 × 10–4 М.

Потенциал пика восстановления НСКН, как видно из табл. 2, сдвигается в область более отрицательных значений, а в интервале рН 8.3–14.0 мало зависит от рН и составляет –0.71…–0.80 В. Подобная зависимость наблюдается на р. к. э. (рис. 1). При этом как на р. к. э., так и СУ электровосстановление НСКН протекает при близких значениях потенциалов.
В табл. 3 приведены результаты исследования влияния рН на электровосстановление НСКН на СУ в аммиачных буферных растворах с рН 7.45–10.30 при постоянной ионной силе.
Таблица 3.
Влияние рН на электровосстановление НСКН на СУ в аммиачных буферных растворах при постоянной ионной силе. Концентрация НСКН – 2 × 10–4 М
| рН | Состав фона | Катодный пик | Анодный пик | ||
|---|---|---|---|---|---|
| –Еp, В | Ip, мм | –Еp, В | Ip, мм | ||
| 7.45 | 0.01 N NH4OH + 1.99 N NH4Cl | 0.67 | 87 | 0.11 | 37 |
| 8.40 | 0.1 N NH4OH + 1.9 N NH4Cl | 0.70 | 87 | 0.16 | 37 |
| 9.30 | 0.5 N NH4OH + 1.5 N NH4Cl | 0.72 | 85 | 0.21 | 37 |
| 9.70 | 1.0 N NH4OH + 1.0 N NH4Cl | 0.74 | 81 | 0.23 | 37 |
| 10.30 | 1.5 N NH4OH + 0.5 N NH4Cl | 0.77 | 70 | 0.26 | 34 |
| ~12.0 | 2 N NH4OH | 0.79 | 32 | 0.35 | 29 |
| 1.00* | 22* | ||||
Из данных, представленных в табл. 2 и 3, следует, что электровосстановление НСКН в слабощелочных аммиачных буферных растворах протекает при близких потенциалах, что и в буферных растворах Бриттона–Робинсона. Однако высота пиков восстановления в последних заметно ниже по сравнению с аммиачными буферными растворами, и эта разница увеличивается с повышением рН фона. Так, предельный ток восстановления НСКН в буферном растворе Бриттона–Робинсона с рН 10.3 составляет 57 мм, а в аммиачном буферном растворе с той же величиной рН – 70 мм.
Ароматические сульфокислоты являются сильными кислотами (по силе сульфокислоты близки к серной и соляной кислотам [3]) и в объеме раствора находятся в диссоциированном состоянии. Поэтому было исследовано влияние ионной силы раствора на электровосстановление НСКН в растворе 0.1 N NH4OH с добавкой NH4Cl (рис. 3).
Рис. 3.
Циклические вольтамперограммы восстановления НСКН на СУ на фоне 0.1 N NH4OH с добавкой NH4Cl, N: 1 – 1.0; 2 – 0.1; 3 – 0.01. Концентрация НСКН – 2 × 10–4 М, температура 20°С.

Как видно из рис. 3, с увеличением ионной силы раствора необратимый пик восстановления НСКН сдвигается в область менее электроотрицательных значений потенциала. Так, с увеличением концентрации электролита с 0.01 до 1.0 N раствора Еp сдвигается на 100 мВ в анодную сторону. При этом существенно увеличивается высота катодного пика, а продуктами восстановления НСКН являются, видимо, соответствующий нафтилсульфогидроксиламин, на что указывают анодные пики его окисления в соответствующее нитрозосоединение [4, 5] при потенциалах ‒0.14…–0.25 В (пики А2), и анион-радикал (пики А1), обратимо окисляющийся в исходное соединение при потенциалах, близких к Ер НСКН, наблюдающиеся при развертке потенциала в анодном направлении от –1.4 В. При этом образование АСКН не регистрируется.
Однако как в сильнокислом растворе на фоне 0.1 N Н2SO4 (рис. 4), так и в аммиачном буферном растворе (0.7 N NH4Cl + NH4OH) с рН 8.4 (рис. 5) при микроэлектролизе на СУ при потенциалах ‒1.0…–1.2 и –1.2…–1.4 В соответственно в течение 10–30 мин и при последующей развертке потенциала в анодном направлении на вольтамперограмме регистрируются не только пики окисления нафтилсульфогидроксиламинопроизводного (пик А2) и анион-радикала (пики А1), но и пик окисления АСКН, что подтверждается введением в раствор последней (кривая 6 на рис. 4, кривая 5 на рис. 5). Из рис. 4 и 5 видно, что соотношение образующихся гидроксиламино- и аминосоединений зависит от задаваемого потенциала восстановления НСКН. При потенциалах предельных токов как в кислых, так и аммиачно-буферных растворах восстановление НСКН протекает с образованием нафтилсульфогидроксиламина, а при потенциалах, близких к разряду фона, – с образованием нафтилсульфогидроксиламина и АСКН. Причем с увеличением катодного потенциала концентрация нафтилсульфогидроксиламина уменьшается, а концентрация АСКН увеличивается. Так как электровосстановление НСКН протекает с участием протонов, то были проведены исследования ее восстановления на СУ в растворах различной кислотности в присутствии доноров протонов разной химической природы. Результаты электровосстановления НСКН на фоне различных электролитов на СУ и потенциостатического режима микроэлектролиза при потенциалах предельных токов приведены в табл. 4.
Рис. 4.
Классическая вольтамперограмма восстановления НСКН(1), циклическая дифференциальная вольтамперограмма восстановления НСКН (2), а также дифференциальные вольтамперограммы окисления продуктов восстановления НСКН, образующихся при различных потенциалах в течение 30 мин: Е = –0.7 (3); Е = –1.0 (4); Е = –1.2 В (5) и дифференциальная вольтамперограмма АСКН (6) на фоне 0.1 N Н2SO4. Концентрация НСКН 2.5 × 10–4 М, концентрация АСКН 1.9 × 10–4 М, скорость развертки потенциала – 20 мВ/с.

Рис. 5.
Классическая вольтамперограмма восстановления НСКН (1), циклическая дифференциальная вольтамперограмма восстановления НСКН (2), а также дифференциальные вольтамперограммы окисления продуктов восстановления НСКН, образующихся при различных потенциалах в течение 30 мин: Е = –1.2 В (3); Е = –1.6 В (4) и дифференциальная вольтамперограмма АСКН (5) на фоне аммиачного буферного раствора (0.7 N NH4Cl + NH4OH) c рH 8.4. Концентрация НСКН – 2.5 × 10–4 М, концентрация АСКН – 1.9 × 10-4 М, скорость развертки потенциала 20 мВ/с.
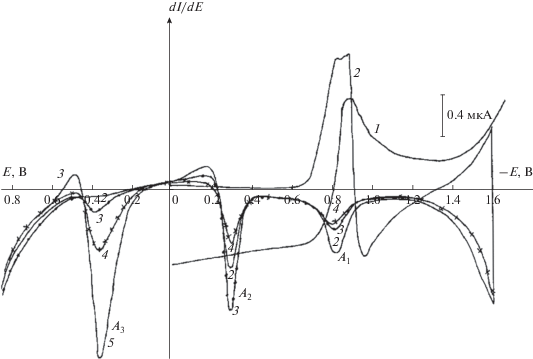
Таблица 4.
Электровосстановление НСКН на СУ на фоне различных электролитов при потенциостатическом режиме. Концентрация НСКН – 2 × 10–4 М, продолжительность микроэлектролиза 30 мин, температура 20–22°С
| Состав фонового раствора | Еp, В | Ip, мкА | Потенциал электрода, В | Продукты электролиза |
|---|---|---|---|---|
| 0.1 N H2SO4, рН 0.15 | –0.65 | 1.16 | –0.7 | Гидроксиламин |
| –1.0…–1.2 | Гидроксиламин и амин | |||
| 1 N КСl, рН 6.9 | –0.83 | 1.16 | –0.9 | Гидроксиламин |
| –1.6 | Гидроксиламин | |||
| 1 N NH4Cl, рН 4.4 | –0.75 | 1.32 | –0.9 | Гидроксиламин |
| –1.6 | Гидроксиламин и амин | |||
| 1 N NH4Cl + NH4ОН, рН 7.5 | –0.80 | 1.3 | –0.85 | Гидроксиламин |
| –1.6 | Гидроксиламин и амин |
Из данных, приведенных в табл. 4, следует, что в исследованных фоновых растворах продуктами электровосстановления НСКН на СУ при потенциалах, соответствующих предельному току регистрируемой волны, является соответствующее гидроксиламинопроизводное. При потенциалах, близких к разряду фона (–1.6…–1.7 В), наряду с последним образуется АСКН. Аналогичные результаты получены на фоне 0.1 N H2SO4. Однако на фоне 1 N раствора КСl даже при потенциале ‒1.6 В дальнейшее восстановление гидроксиламиносульфокислоты нафталина в соответствующее аминосоединение не наблюдается.
В растворах NH4Cl и аммиачно-буферных растворах с рН 7.5–8.6 процесс электровосстановления м-НСКН не только сдвинут в область более положительных потенциалов по сравнению с растворами KCl, но и при этом облегчается дальнейшее восстановление гидроксиламинопроизводного в амин. По-видимому, это обусловлено высокой протонодонорной способностью ${\text{NH}}_{4}^{ + }$ по сравнению с водой (роль доноров протонов в растворах KCl выполняют молекулы воды), обеспечивающей протонирование нитро- и гидроксиламиновой групп, рекомбинацию анионов НСКН с донорами протонов, а также возможное участие ${\text{NH}}_{4}^{ + }$ в образовании электроактивных частиц с анионами НСКН (ионных пар) [9].
При химическом восстановлении в присутствии хлорида аммония нитробензол восстанавливается в анилин с большим выходом, чем в присутствии других электролитов (MgCl2, CaCl2, Na2SO4, KCl), а в случае восстановления α-нитронафталина положительный эффект усиливается [10]. В этих условиях в присутствии хлорида аммония рН раствора лежит в пределах 7.6–8.4, а с хлоридом кальция – 11.0–11.75.
Как показано в [4], более эффективно препаративное электровосстановление технической изомерной смеси нитро-Клеве-кислот протекает на катодах из свинца, меди, титана и никеля, поэтому для электровосстановления НСКН в потенциостатическом режиме были использованы эти же металлы в качестве катодов. Предварительно были измерены поляризационные кривые восстановления НСКН на этих катодах в аммиачном буферном растворе (0.22 N NH4Cl + NH4ОН) с рН 8.3 (рис. 6).
Рис. 6.
Поляризационные кривые восстановления НСКН в аммиачном буферном растворе (0.22 N NH4Cl + + NH4ОН) с рН 8.3 на титановом (1), медном (2), никелевом (3) и свинцовом (4) катодах. Концентрация НСКН – 4 × 10–2 М.

Как видно из рис. 6, поляризационные кривые восстановления НСКН, измеренные на титановом, медном, никелевом и свинцовом электродах, имеют только одну волну восстановления с Е1/2 –0.93, –0.72 , –0.48 и –0.45 В соответственно. Высота наблюдаемых волн восстановления НСКН примерно одинакова.
Потенциостатическое восстановление НСКН проводили в аммиачном буферном растворе с рН 8.3 на никелевом катоде, так как на нем восстановление НСКН протекает с меньшей поляризацией и с лучшей эффективностью электровосстановления технической смеси нитро-Клеве-кислот в этой среде [4]. Результаты исследования приведены в табл. 5. При электролизе на никелевом катоде в потенциостатическом режиме в зависимости от задаваемого потенциала электрода в реакционных растворах после электролиза наряду с АСКН обнаружен соответствующий нафтилсульфогидроксиламин. Последний, как видно из табл. 5 и рис. 7, образуется с высоким выходом (84.0–84.7%) при потенциалах электрода ‒0.5…‒0.70 В, близких к потенциалу полуволны.
Таблица 5.
Результаты электровосстановления НСКН при контролируемом потенциале на никелевом электроде в аммиачном буферном растворе (0.22 N NH4Cl + + NH4ОН) с рН 8.3. Концентрация НСКН – 4 × 10–2 М, температура 25°С
| Потенциал катода, В | Выход по веществу, % | |
|---|---|---|
| АСКН | 1-гидроксиламино-6-сульфокислота нафталина | |
| –0.50 | – | 84.0 |
| –0.70 | – | 84.7 |
| –1.10 | 78.2 | 15.0 |
| –1.30 | 92.5 | – |
Рис. 7.
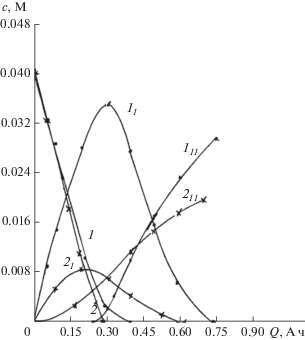
Зависимость изменения концентраций НСКН (1–4), 1-гидроксиламино-6-сульфокислоты нафталина (11, 21, 31, 41) и АСКН (311, 411) от продолжительности электролиза в аммиачном буферном растворе (0.22 N NH4Cl + NH4ОН) с рН 8.3 при различных потенциалах никелевого катода: 1 – –0.50; 2 – –0.70; 3 – –1.1; 4 – –1.3 В. Концентрация НСКН – 4 × 10–2 М.

При более отрицательных потенциалах катода (–1.1…–1.3 В) сначала в растворе наблюдается накопление гидроксиламинопроизводного, достигая максимума при полной конверсии НСКН, которое в ходе электролиза превращается в АСКН. Причем чем отрицательнее потенциал электрода, тем меньше концентрация гидроксиламиносульфокислоты нафталина в растворе в процессе электролиза, а АСКН образуется с самого начала процесса.
Результаты восстановления исследуемых нитросульфокислот нафталина в гальваностатическом режиме приведены в табл. 6, из которых следует, что восстановление разбавленных растворов НСКН в гальваностатическом режиме в аммиачной буферной среде с рН 8.3 при плотности тока 1.0 А/дм2 и температуре 25°С протекает с выходом АСКН по веществу 93.3% и выходом по току 71%, как и в случае электролиза при контролируемом потенциале. Однако при восстановлении технической изомерной смеси нитро-Клеве-кислот достигаются более низкий выход аминосульфокислот нафталина по веществу, составляющий 77.8%, и выход по току – 58.2%. Кроме того, в реакционном растворе, полученном после электролиза, остается непрореагировавший промежуточно образующийся нафтилсульфогидроксиламин с выходом по веществу 11.2%.
Таблица 6.
Восстановление НСКН в аммиачном буферном растворе (0.22 N NH4Cl + NH4ОН) с рН 8.2 в гальваностатическом режиме. Катод – никель, плотность тока 1.0 А/дм2, температура 25°С, концентрация НСКН – 0.05 М
| Нитросульфокислота нафталина | Выход АСКН, % | Выход нафтилсульфогидроксиламина, % | ||
|---|---|---|---|---|
| по веществу | по току | по веществу | по току | |
| 1-Нитро-6-сульфокислота нафталина | 93.3 | 71.0 | – | – |
| Техническая изомерная смесь нитро-Клеве-кислот* | 77.8 | 58.2 | 11.2 | 7.7 |
Препаративное электровосстановление НСКН
Результаты, приведенные в табл. 6, послужили основанием для более подробного исследования влияния различных технологических параметров на процесс восстановления НСКН, в частности материала катода, рН среды, плотности тока и температуры.
В качестве катодных материалов использовали медь, никель, свинец и нержавеющую сталь марки Х18Н10Т. Результаты этого исследования приведены в табл. 7 и на рис. 8 и 9.
Таблица 7.
Влияние материала катода на выход АСКН по веществу и по току. Концентрация НСКН – 4 × × 10–2 М, плотность тока 1.0 А/дм2, температура 25°С; фон – аммиачный буферный раствор (0.2 N NH4Cl + + NH4ОН) с рН 8.2
| Материал катода | Выход по веществу, % | Выход по току, % |
|---|---|---|
| Никель | 86.5–90.3 | 56.2–71.0 |
| Медь | 80.0–85.0 | 33.0–40.4 |
| Сталь Х18Н10Т | 84.5 | 60.0 |
| Свинец | 54.8 | 31.0 |
Рис. 8.
Зависимость потенциала катода от количества затраченного электричества для различных катодных материалов: 1 – свинец; 2 – никель; 3 – медь; 4 – нержавеющая сталь Х18Н10Т. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, температура 25°С, фон – аммиачный буферный раствор (0.2 N NH4Cl + NH4ОН) с рН 8.2.

Рис. 9.
Зависимость изменения концентраций НСКН (1), нафтилсульфогидроксиламина (2), АСКН (3) и потенциала электрода (4) от количества пропущенного электричества. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, температура 25°С, катод – никель марки Н3, фон – аммиачный буферный раствор (0.2 N NH4Cl + NH4ОН) с рН 8.2.
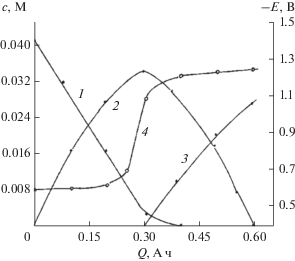
Как видно из представленных данных табл. 7, выход АСКН по веществу и по току зависит от природы катодного материала. Самый низкий выход целевого продукта по веществу и по току получен на свинцовом катоде. Низкая эффективность процесса восстановления НСКН на этом катоде, вероятно, связана с уменьшением фактической плотности тока в результате коррозии свинцового электрода в щелочном растворе, приводящая к увеличению поверхности катода. Уменьшение плотности тока приводит к смещению потенциала катода в область менее электроотрицательных значений, как видно из рис. 8, что затрудняет дальнейшее восстановление промежуточно образующегося гидроксиламинопроизводного в АСКН. При этом выход гидроксиламиносульфокислоты нафталина составляет около 41.0%.
Для всех электродных материалов, как видно из рис. 8, отмечается постепенный сдвиг потенциала в область более отрицательных значений по мере расходования исходной НСКН. Однако при пропускании количества электричества, близкого к теоретическому (~0.3 А ч), для исследованных катодных материалов потенциал электродов изменяется незначительно (50–100 мВ) и составляет –0.50…–0.75 В. При этом конверсия исходного НСКН составляет 75–80%, а продуктом восстановления является 1-гидроксиламино-6-сульфокислота нафталина, выход которой достигает 82–88% (рис. 9). Дальнейшее восстановление образовавшегося нафтилсульфогидроксиламина в АСКН протекает при более электроотрицательных значениях потенциала –1.1…–1.3 В.
Из полученных результатов следует, что на никелевом катоде восстановление НСКН в соответствующий амин протекает с большей эффективностью, что послужило основанием его выбора для дальнейших исследований.
Принимая во внимание нестабильность α‑нафтилгидроксиламина в кислой и щелочных средах [11], приводящую в кислой среде к перегруппировке Гаттермана, а в щелочной среде к образованию димерных продуктов, было исследовано влияние рН среды в аммиачных буферных растворах (0.2 N NH4Cl + NH4ОН) и в 0.2 N NH4Cl с добавкой соляной кислоты до определенного значения рН раствора на выход АСКН. Результаты исследования приведены в табл. 8 и на рис. 10.
Таблица 8.
Влияние рН католита на выход АСКН по веществу и по току. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, температура 25°С, катод – никель марки Н3
| рН католита | Выход по веществу, % | Выход по току, % |
|---|---|---|
| 1.5 | 61.2 | 26.7 |
| 5.0 | 76.0 | 40.7 |
| 8.2 | 86.5 | 56.2 |
| 10.0 | 76.6 | 43.6 |
Рис. 10.
Зависимость изменения концентраций НСКН (1–4), нафтилсульфогидроксиламина (11, 21, 31и 41) и АСКН (111, 211, 311 и 411) от количества пропущенного электричества при различных рН раствора: 1, 11, 111 – 1.5; 2, 21, 211 – 5.0; 3, 31, 311 – 8.2; 4, 41, 411 – 10.0. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, температура 25°С, катод – никель марки Н3.

Из данных, представленных в табл. 8, видно, что с увеличением рН раствора с 1.5 до 8.2 выход целевой АСКН по веществу и по току повышается соответственно с 61.2 до 86.5% и с 26.7 до 56.2%. Дальнейшее увеличение рН раствора приводит к снижению выхода АСКН как по веществу, так и по току.
Скорость превращения исходного НСКН, как видно из рис. 10, практически не зависит от величины рН раствора в исследованном интервале, и при пропускании теоретически необходимого количества электричества (0.3 А ч) степень конверсии НСКН составляет около 85.0–90.0%.
В то же время концентрация образующегося промежуточного соединения – нафтилсульфогидроксиламина зависит от рН раствора и достигается наибольшей в интервале рН 5.0–8.2. В этом интервале рН католита получен максимальный выход АСКН по веществу.
Как в кислой (рН 1.5), так и в щелочной (рН 10.0) средах концентрация нафтилсульфогидроксиламина резко снижается и его выход не превышает 30%, что приводит к снижению выхода АСКН по веществу. Наблюдаемая неустойчивость нафтилсульфогидроксиламина в кислых и щелочных растворах, как и в случае α-нафтилгидроксиламина [11], вероятно, связана в кислой среде с протеканием гаттермановской перегруппировки, а в щелочной среде – с образованием, вероятно, побочных димерных продуктов.
Таким образом, в аммиачных буферных растворах с рН 7.0–8.2 обеспечивается стабильность промежуточного нафтилсульфогидроксиламина, а следовательно, более высокий выход АСКН по веществу, образующейся в результате дальнейшего восстановления нафтилсульфогидроксиламина.
В табл. 9 представлены результаты исследования влияния плотности тока на процесс восстановления НСКН.
Таблица 9.
Влияние плотности тока на выход АСКН по веществу и по току. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, температура 25°С, катод – никель, фон – аммиачный буферный раствор (0.2 N NH4Cl + NH4ОН) с рН 8.2
| Плотность тока, А/дм2 | Выход по веществу, % | Выход по току, % |
|---|---|---|
| 1.0 | 86.5 | 56.2 |
| 2.5 | 89.7 | 42.4 |
| 5.0 | 93.5 | 39.0 |
Из табл. 9 видно, что с повышением плотности тока с 1.0 до 5.0 А/дм2 выход АСКН увеличивается с 86.5 до 93.5%, а выход по току при этом снижается с 56.2 до 39.0%. С увеличением плотности тока происходит более резкий сдвиг потенциала электрода до –1.4…–1.5 В, что увеличивает долю тока на выделение водорода. Кроме того, при плотности тока 5.0 А/дм2 в процессе электролиза образуется α-нафтиламин. Очевидно, при более отрицательных потенциалах электрода протекает реакция десульфирования, приводящая к снижению выхода аминосульфокислоты нафталина при длительном электролизе.
Результаты исследования влияния температуры на процесс электровосстановления НСКН приведены в табл. 10.
Таблица 10.
Влияние температуры на выход АСКН по веществу и по току. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, катод – никель Н3, фон – аммиачный буферный раствор (0.2 N NH4Cl + + NH4ОН) с рН 8.2
| Температура, °С | Выход по веществу, % | Выход по току, % |
|---|---|---|
| 25 | 86.5 | 56.2 |
| 40 | 62.0 | 31.5 |
| 60 | 57.3 | 29.0 |
Как видно из табл. 10, при изменении температуры от 25 до 60°С выход АСКН по веществу и по току снижается с 86.5 до 57.3% и с 56.2 до 29.0% соответственно. Потенциал электрода с повышением температуры становится менее электроотрицательным, что затрудняет дальнейшее восстановление нафтилсульфогидроксиламина в АСКН и создаются благоприятные условия для протекания побочных реакций конденсации с участием исходных и промежуточных продуктов (рис. 11) [12, 13]. На образование димерных продуктов конденсации указывают окрашенные растворы, полученные после электролиза при повышенной температуре, а также в аммиачном буферном растворе с рН 10.0.
Рис. 11.
Зависимость потенциала катода от количества пропущенного электричества при различной температуре, °С: 1 – 25; 2 – 40; 3 – 60. Концентрация НСКН – 4 × 10–2 М, плотность тока – 1.0 А/дм2, катод – никель марки Н3, фон – аммиачный буферный раствор (0.2 N NH4Cl + NH4ОН) с рН 8.2.

На рис. 12 приведены данные по распределению продуктов реакции в ходе электровосстановления НСКН при различной температуре. Из рис. 12 видно, что концентрация исходного нитросоединения до высокой степени превращения снижается пропорционально времени электролиза и незначительно зависит от температуры. В то же время концентрация промежуточно образующегося нафтилсульфогидроксиламина сначала линейно увеличивается, достигает максимума, а после исчерпывания в реакционной массе нитросоединения быстро снижается.
Рис. 12.
Зависимость изменения концентраций НСКН (1, 2), нафтилсульфогидроксиламина (11, 21) и АСКН (111, 211) от количества пропущенного электричества при различной температуре: 1, 11, 111 – 25°С, 2, 21, 211 – 60°С. Концентрация НСКН – 4 × × 10–2 М, плотность тока – 1.0 А/дм2, катод – никель марки Н3, фон – аммиачный буферный раствор (0.2 N NH4Cl + NH4ОН) с рН 8.2.
Концентрация нафтилсульфогидроксиламина существенно зависит от температуры и резко снижается с повышением ее до 60°С. При этом его выход не превышает 25.0%, а выход АСКН по веществу составляет 57.3%. По-видимому, при повышенной температуре, а также в аммиачной буферной среде с рН 10.0 наблюдается одновременное электровосстановление нитросоединения и превращение соответствующего нафтилсульфогидроксиламина в АСКН, что подтверждается образованием последней с самого начала электролиза (рис. 10 и 12). Одновременность этих превращений можно объяснить, по-видимому, протеканием реакции диспропорционирования нафтилсульфогидроксиламина с образованием нитрозо- и аминосоединения. Эта реакция, открытая Бамбергером, характерна для ароматических гидроксиламинопроизводных и зависит от среды (катализируется кислотой и щелочью), природы заместителя и температуры [14–16], а также инициируется следами кислорода и соединениями железа [17].
Таким образом, восстановление разбавленных растворов НСКН в гальваностатическом режиме приводит к тем же продуктам, что и при электролизе с контролируемым потенциалом. Наиболее эффективно восстановление НСКН протекает на никелевом электроде и электроде из стали Х18Н10Т в аммиачном буферном растворе с рН 7.0–8.2 при температуре 25–30°С и плотности тока 5.0 А/дм2.
Найденные условия электросинтеза НСКН и изомерной смеси Клеве-кислот [4] были апробированы на укрупненной лабораторной установке с фильтр-прессным электролизером (табл. 11).
Таблица 11.
Препаративное восстановление нитросульфокислот нафталина в аммиачных буферных растворах (0.4 N NH4Cl + NH4OH) в фильтр-прессном электролизере. Концентрация нитросульфокислот нафталина 0.4…–0.48 М, катод – нержавеющая сталь Х18Н10Т, линейная скорость католита – 0.06 м/с
| Нитросоединение | рН | Температура, °С | Плотность тока, А/дм2 | Выход по веществу, % | Выход по току, % | Выход по выделению, % |
|---|---|---|---|---|---|---|
| НСКН | 8.0 | 30–32 | 10.0 | 92.0 | 42.0 | 76.0 |
| 7.5 | 30–32 | 10.0 | 90.0 | 38.0 | 75.5 | |
| 7.5 | 30–32 | 10.0 | 87.6 | 38.0 | 69.0 | |
| 7.0 | 50–55 | 10.0 | 72.8 | 30.0 | 80.0 | |
| Техническая изомерная смесь нитро-Клеве-кислот | 8.0 | 25–30 | 10.0 | 94.0 | 27.0 | 43.7 |
| 7.5 | 30–32 | 10.0 | 89.6 | 44.0 | 43.0 | |
| 7.5 | 30–32 | 5.0 | 94.0 | 48.4 | 40.3 | |
| 7.5 | 50–55 | 10.0 | 85.6 | 34.0 | 39.5 | |
| 7.4 | 60–62 | 5.0 | 85.0 | 44.7 | 39.0 | |
| 7.0 | 60–62 | 10.0 | 93.8* | 30.5 | 41.3 | |
| 8.5 | 60–62 | 10.0 | 93.6* | 32.5 | 41.0 |
Из данных, представленных в табл. 11, видно, что НСКН восстанавливается в условиях препаративного электролиза с выходом АСКН по веществу 87.0–92.0% и выходом по току 38.0–42.0%. С повышением температуры с 30 до 55°С выход АСКН по веществу снижается до 72.8%. Выход АСКН, выделенной из раствора после электролиза, не зависит от условий восстановления и составляет 69.0–80.0%.
Препаративное восстановление смеси нитро-Клеве-кислот протекает с выходом Клеве-кислот по веществу 85.0–94.0%. Более низкий выход аминосульфокислот нафталина достигается при температуре 50–60°С. Однако при порциальной загрузке нитро-Клеве-кислот в ходе процесса восстановления, как это производится при химическом восстановлении [1, 18, 19], выход Клеве-кислот повышается до 93.6–93.8% при температуре 60–62°С. В растворе, полученном после электролиза, соотношение изомерных аминосульфокислот нафталина составляет: 1,6-Клеве-кислота 44–45%, 1,7-Клеве-кислота 40–45%, 1,8‑Пери-кислота 8–10%, установленное методом ВЭЖХ в расчете на сумму аминов. Такой же изомерный состав имеют реакционные смеси после химического восстановления нитро-Клеве-кислот.
Однако выход Клеве-кислот по выделению из растворов, полученных после электролиза, как показано в табл. 11, составляет 39.0–43.7% против 52.0–56.0% при химическом восстановлении [19], а выделенная паста Клеве-кислот из реакционных масс по методике действующего производства обогащена изомером 1,7-Клеве-кислоты (80–90% по отношению к сумме аминов). Сравнительно низкий выход Клеве-кислот по выделению из раствора и измененный изомерный состав аминосульфокислот нафталина в выделенном продукте, вероятно, обусловлен побочными продуктами, образующимися в процессе электролиза и регистрируемыми на циклических вольтамперограммах полученных растворов после электролиза [4], а также побочными продуктами, образующимися на предыдущих стадиях сульфирования и нитрования нафталина, в частности α‑нитронафталином, восстанавливающимся при электролизе до α-нафтиламина. Это подтверждается восстановлением НСКН, выделенной из изомерной смеси нитро-Клеве-кислот и очищенной перекристаллизацией из воды, которое протекает с выходом по выделению из раствора АСКН 69.0–80.0%. Кроме того, к снижению выхода Клеве-кислот по выделению из раствора могут приводить продукты их окисления, а также побочные соединения. Раствор с аминосоединениями, полученный после электролиза, на воздухе мгновенно темнеет с образованием смолообразных продуктов. Результаты по окислению исследуемых аминосульфокислот нафталина на СУ показали, что АСКН окисляется значительно легче по сравнению с 2-амино-4,8-дисульфокислотой нафталина и 1-амино-3,6,8-трисульфокислотой нафталина, выделяющимися из раствора с выходом 88–90% [20] и 70–80% [21]. Так, в буферном растворе Бриттона–Робинсона с рН 5.2 Еp окисления АСКН на СУ составляет +0.50 В, для 2-амино-4,8-дисульфокислоты нафталина – +0.83 В, а для 1-амино-3,6,8-трисульфокислоты нафталина – +0.77 В. К тому же, промежуточно образующийся нафтилсульфогидроксиламин, являющийся нестабильным продуктом, который накапливается в ходе электролиза в зависимости от условий процесса (рис. 10 и 12), может оставаться в реакционных растворах после электролиза (табл. 6) [4]. Как видно из рис. 3–5, нафтилсульфогидроксиламин окисляется до соответствующего нитрозосоединения еще легче, чем АСКН, как в кислой, так и слабощелочной средах. При этом могут образовываться димерные побочные продукты [12], которые, по-видимому, также могут затруднять выделение целевых изомерных аминосульфокислот нафталина из раствора.
В то же время α-нафтиламин – один из побочных продуктов, содержащийся в технической изомерной смеси, окисляется легче, чем АСКН. Так, на фоне аммиачного буферного раствора (0.4 N NH4Cl + NH4OH) с рН 8.4 Еp окисления на СУ для АСКН и α-нафтиламина составляют соответственно +0.23 и +0.10 В.
Полученные результаты указывают на то, что важными факторами для эффективного электрохимического восстановления технической изомерной смеси нитро-Клеве-кислот и выделения Клеве-кислот из реакционных растворов являются предварительная очистка исходного раствора нитро-Клеве-кислот и создание условий, исключающих окисление образующихся аминосульфокислот нафталина, промежуточных и побочных продуктов в ходе электролиза и на стадии выделения Клеве-кислот из раствора, в частности проведение этих технологических стадий под азотом.
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно сделать следующие основные выводы:
1. Методами полярографии, вольтамперометрии на СУ, микроэлектролиза в потенциостатическом режиме на СУ, электролиза при контролируемом потенциале и в гальваностатическом режимах установлены закономерности электрохимического восстановления НСКН в кислых, а также в хлоридоаммонийных и аммиачных буферных растворах.
2. Установлено, что НСКН подобно α-нитронафталину и 1-нитро-3,6,8-трисульфокислота нафталина полярографически восстанавливаются в сильнокислой среде в единую шестиэлектронную стадию до соответствующей АСКН через промежуточно образующийся гидроксиламин. Наличие единой шестиэлектронной волны предположительно объясняется легкостью восстановления карбониевого иона, образующегося в результате дегидратации протонированного гидроксиламинопроизводного, имеющего иминохиноидную структуру.
3. Полярографическое восстановление нитрогруппы НСКН в сильнокислой среде протекает с предшествующей поверхностной протонизацией и начинается при положительных зарядах поверхности р. к. э. Торможение процесса при отрицательных зарядах поверхности р. к. э., проявляющееся в виде спада тока, связано с анионным характером восстанавливающихся частиц, обусловленным присутствием кислой сульфогруппы в ее молекуле.
4. Показано, что анионная природа НСКН в нейтральных и щелочных растворах как на р. к. э., так и на СУ проявляется сложной формой поляризационных кривых и изменением их характеристик в зависимости от концентрации и природы фонового электролита, а также рН последнего.
5. Методом микроэлектролиза в потенциостатическом режиме на СУ, электролизом при контролируемом потенциале и в гальваностатическом режимах, а также электроокислением аминосульфокислот на СУ установлена природа отдельных стадий катодного процесса для НСКН, обнаружены и идентифицированы промежуточные и конечные продукты реакции: анион-радикалы НСКН, гидроксиламино- и аминосульфокислоты нафталина.
6. Аммиачные буферные растворы с рН 7.0–8.2, плотность тока 5–10 А/дм2, температура 30–32°С и концентрация НСКН 10–13% могут быть рекомендованы для препаративного электросинтеза АСКН, так как в этих растворах в гальваностатическом режиме электролиза на катоде из никеля марки Н3 и нержавеющей стали Х18Н10Т АСКН получена с выходом по веществу 87.0–93.5% и выходом по току 38.0–42.4%. При этом выход АСКН, выделенной из раствора после электролиза, не зависит от условий восстановления и составляет 69.0–80.0%.
7. Для повышения выхода Клеве-кислот по выделению из раствора, полученного после электролиза, требуется предварительная очистка исходной технической изомерной смеси нитро-Клеве-кислот и создание условий, исключающих окисление образующихся промежуточных, конечных и побочных продуктов восстановления как при электролизе, так и при выделении целевых Клеве-кислот из раствора.
Список литературы
Ворожцов, Н.Н. Основы синтеза промежуточных продуктов и красителей, М.: Госхимиздат, 1955. 839 с. [Vorozhtsov, N.N., The fundamentals of synthesis of intermediate products and dyes (in Russian), Moscow: Goskhimizdat, 1955. 839 p.]
Венкатараман, К. Химия синтетических красителей, Л.: Госхимиздат, 1956. 803 с. [Venkataraman, K., Chemistry of synthetic dyes (in Russian), Leningrad: Goskhimizdat, 1956. 803 p.]
Fierz, H.E. and Weissenbuch, P., Uber die Reduktion von Nitronaphtalinssulfosauren, Helv. Chim. Acta, 1920, Bd 3, S. 305.
Конарев, А.А. Электрохимический синтез Клеве-кислот. Электрохимия. 1998. Т. 34. С. 1166. [Konarev, A.A., Electrochemical synthesis of Cleves-acids, Russ. J. Electrochem., 1998, vol. 34, p. 1160.]
Конарев, А.А. Способ определения ароматических нитросоединений и продуктов их восстановления, Пат. 2159424 (Россия). 2000. [Konarev, A.A., Method for detection of aromatic nitrocompounds and products of their reduction, Pat. 2159424 (Russia), 2000.]
Конарев, А.А., Авруцкая, И.А. Особенности электрохимического восстановления 1-нитро-3,6,8-трисульфокислоты нафталина. Электрохимия. 1988. Т. 24. С. 1548. [Konarev, A.A. and Avrutskaya, I.A., Features of electrochemical reduction of 1-nitro-3,6,8-trisulfonic acid of naphthalene, Russ. J. Electrochem., 1988, vol. 24, p. 1548.]
Jubault, M. and Peltier, D., Reduction electrochimique a potentiel controle des nitronaphtalenes substitues. Etudes preliminaries, Bull. Soc. Chem. France, 1972, no. 4, p. 1544.
Страдынь, Я.П. Полярография органических нитросоединений, Рига.: Из-во АН Латв. ССР, 1961. 163 с. [Stradyn, Ya.P. Polarography of organic nitrocompounds, Riga: the AN publisher, Latvian SSR, 1961. 163 p.]
Кварацхелия, Р.К., Кварацхелия, Е.Р. Об особенностях электрохимического поведения соединений I(5+) и I(7+) в растворах солей аммония. Электрохимия. 1996. Т. 32. С. 868. [Kvaratskheliya, R.K. and Kvaratskheliya, E.R., On peculiarities of electrochemical behavior of I(5+) and I(7+) compounds in ammonium salt solutions, Russ. J. Electrochem., 1996, vol. 32, p. 868.]
Лукашевич, В.О. Органические полупродукты и красители, М.: Госхимиздат, 1959. 40 c. [Lukashe-vich, V.O., Organic semi-products and dyes (in Russian), Moscow: Goskhimizdat, 1959. 40 p.]
Jubault, M. and Peltier, D., Reduction electrochimique a potentiel controle des nitronaphtalenes substitues. Influence des substituants, Bull. Soc. Chim. France, 1972, no. 4, p. 1551.
Томилов, А.П., Майрановский, С.Г., Фиошин, М.Я., Смирнов, В.А. Электрохимия органических соединений, Л.: Химия, 1968. 592 с. [Tomilov, A.P., Mayranovsky, S.G., Fioshin, M.Ya., and Smirnov, V.A., Electrochemistry of organic compounds (in Russian), Leningrad: Chemistry, 1968. 592 p.]
Bamberger, E., Arylhydroxylamine und Arylazideeine Parallele, Ann., 1921, Bd 424, S. 233.
Heller, H.E., Hughes, E.D., and Ingold, C.K., A New View of the Arylhydroxylamine Rearrangement, Nature, 1951, vol. 168, p. 909.
Bamberger, E. and Lagutt, G., Uber das Verhalten des Phenylhudroxylamins gegen alkoholische Schwefelsaure und gegen Anilin, Ber., 1898, Bd 31, S. 1500.
Симонов, В.Д., Денисенко, Т.В., Савченко, В.И. Исследование реакции разложения фенилгидроксиламина и его производных в присутствии катализаторов гидрирования. ЖОХ. 1976. Т. 12. С. 1036. [Simonov, V.D., Denisenko, T.V., and Savchenko, V.I., Study of decomposition reaction of phenylhydroxylamine and its derivatives in presence of hydrogenation catalysts, Russ. J. Organic Chem., 1976, vol. 12, p. 1036.]
Мизуч, К.Г. Побочные окислительные процессы при восстановлении нитросоединений ароматического ряда. ДАН СССР. 1937. Т. 15. № 1. С. 37. [Mizuch, K.G., Collateral oxidation processes in reduction of aromatic nitrocompounds, Russ. The USSR Academy Sci. J., 1937, vol. 15, no. 1, p. 37.]
Фирц-Давид, Г.Э., Бланже, Л. Основные процессы синтеза красителей, М.: Изд. иностр. литературы, 1957. 382 с. [Fierz-David, H.E. and Blangey, L. Grundlegende Operationen der Farbenchemie (in Russian), Moscow: Publishing House of Foreign Literature, 1957. 382 p.]
Дональдсон, Н. Химия и технология соединений нафталинового ряда, М.: Госхимиздат, 1963. 655 с. [Donaldson, N., The Chemistry and Technology of Naphthalene Compounds (in Russian), Moscow: Goskhimizdat, 1963. 655 p.]
Конарев, А.А., Помогаева, Л.С., Воротникова, Е.Ю. и др. Способ получения кислой натриевой соли 2‑амино-4,8-дисульфокислоты нафталина. Пат. 2009125 (Россия). 1994. [Konarev, A.A., Pomogaeva, L.S., Vorotnikova, E.Yu., et al., Method for preparation of acidic sodium salt of naphthalene 2-amino-4,8-disulfonic acid, Pat. 2009125 (Russia), 1994.]
Конарев, А.А., Катунин, В.Х., Сухинина, Н.Г. и др. Способ получения 1-амино-3,6,8-трисульфокислоты нафталина. А.с. 1369232 (СССР). 1987. [Konarev, A.A., Katunin, V.Kh., and Sukhinina, N.G., Method for preparation of naphthalene 1-amino-3.6.8-trisulfonic acid, Copyright certificate 1369232 (USSR), 1987.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия