Электрохимия, 2021, T. 57, № 10, стр. 579-586
Исследование реакции выделения водорода на сплавах системы (TiCr1.8)xV100 – x методом импедансной спектроскопии
А. А. Миронова a, *, Н. А. Медведева a, **, В. И. Кичигин a, Н. Е. Скрябина a, Д. Фрушар b
a Пермский национальный исследовательский университет
Пермь, Россия
b Институт Л. Нееля
Гренобль, Франция
* E-mail: milissochka@mail.ru
** E-mail: nata-kladova@yandex.ru
Поступила в редакцию 01.12.2020
После доработки 15.02.2021
Принята к публикации 12.03.2021
Аннотация
Изучено поведение интерметаллической системы (TiCr1.8)xV100– x в реакции выделения водорода в 1 М КОН методами поляризационных измерений и импедансной спектроскопии. Получены катодные поляризационные кривые и спектры импеданса в диапазоне потенциалов, соответствующих линейной области зависимости lg i–E. Установлено, что для всех исследуемых сплавов характерно наличие двух линейных участков на катодных поляризационных кривых. Два участка зависимости от потенциала прослеживаются и в других электрохимических параметрах системы. Импедансная спектроскопия позволила установить, что на поверхности исследуемых сплавов отсутствует плотная оксидная пленка. Для анализа полученных спектров импеданса выбраны три эквивалентные электрические схемы, используемые при описании электрохимического выделения водорода, и рассчитаны параметры фарадеевского импеданса. Сделаны предположения о протекании реакции выделения водорода согласно механизму Фольмера–Гейровского при выполнении изотермы адсорбции Тёмкина.
ВВЕДЕНИЕ
Разработка и поиск эффективных материалов для сорбции и электрохимического выделения водорода является одной из важнейших задач электрохимии. В последние десятилетия особый интерес привлекают исследования различных интерметаллических систем, обладающих значительной водородной емкостью и демонстрирующих высокую электрохимическую активность в реакции выделения водорода (РВВ) [1, 2]. Изучение подобных систем привело к обнаружению структурного типа, обладающего определенным соотношением атомных радиусов – так называемых фаз Лавеса. Данные фазы относятся к многочисленному классу интерметаллических соединений, обладающих стехиометрическим составом AB2. Сплавы на основе фаз Лавеса продолжительное время рассматриваются в качестве перспективных материалов для металлогидридного хранения водорода. Так, о поглощении водорода сплавами со структурой фазы AB2 сообщалось в работах [3, 4] (ZrFe2, ZrCo2), [5, 6] (TiCr2) и т.д. Однако для них установлены достаточно жесткие условия сорбции/десорбции (высокие температуры и давления) водорода, что существенно ограничивает возможности их применения [6].
Особое внимание привлекают интерметаллические системы Ti–V–Cr (особая группа сплавов, которая в англоязычной литературе получила название bcc-сплавы), способные не только поглощать большое количество водорода со значительной скоростью сорбции/десорбции при умеренных температурах и давлениях, но и обладающие высокой активностью в РВВ [7–10], что указывает на возможность их использования в качестве электродных материалов и для металлогидридного хранения водорода. Варьируя соотношение компонентов в этой системе и добавляя такие элементы, как никель, медь и цирконий, можно повысить электрохимическую активность, в том числе улучшить их сорбционную способность к электролитическому водороду [11, 12].
В данной работе исследовали эффект увеличения концентрации ванадия от 20 до 80 ат. % с шагом в 20 ат. % на изменение электрохимических свойств композиции (TiCr1.8)xV100 – x. Классическим методом изучения материалов, предназначенных для хранения водорода, является построение диаграмм “давление–состав–температура” в процессе газофазного взаимодействия водорода с материалами [11, 13]. К достоинствам этого метода можно отнести возможность оценить максимально возможное содержание водорода (при определенной температуре и давлении), определить стабильность гидрида и, при сложном составе сплава, увидеть комплементарные гидридные превращения. Электрохимические методы исследования не являются альтернативой при изучении свойств гидридообразующих материалов, но существенно их дополняют. Например, они позволяют реализовать процесс взаимодействия с водородом при комнатной температуре и оценить сплав как потенциальный электродный материал для РВВ. Кроме того, электрохимические методы позволяют объективно учесть состояние поверхности материала и ее влияние на сорбционные и кинетические характеристики сплава к водороду [14]. Одним из наиболее эффективных способов определения кинетических характеристик и механизма электрохимического процесса является изучение зависимости спектров импеданса от электродного потенциала [15]. Данный метод позволяет оценить не только кинетику отдельных стадий происходящей электрохимической реакции, но также установить дефектность структуры электродного материала, присутствие оксидной пленки на поверхности, протекание абсорбционных процессов и т.д. [15]. Целью настоящей работы стало установление параметров протекания реакции выделения водорода на сплавах (TiCr1.8)xV100– x с увеличением концентрации ванадия от 20 до 80 ат. % методом импедансной спектроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалом для исследования служила интерметаллическая система (TiCr1.8)xV100– x, где значение x варьировали в диапазоне 20–80 ат. % с шагом 20 ат. % (соответственно образцы обозначены в работе V20, V40, V60, V80). Сплавы, изготовленные в лаборатории CRETA (Центр национальных научных исследований, Гренобль, Франция), получены из исходных компонентов чистотой ~99.99%, методом высокочастотного нагрева в охлаждаемой изложнице в атмосфере аргона.
Электрохимические исследования, представленные в работе, осуществляли в стандартной трехэлектродной ячейке ЯСЭ-2 в 1 М КОН. Рабочий раствор электролита (1 М КОН) готовили из деионизованной воды (Milli-Q, удельное сопротивление 18.2 МOм см, содержание окисляемого углерода 3–5 мкг/л) и гранулированного КОН марки “х. ч.”. Рабочими электродами являлись исследуемые композиции, электродом сравнения служил насыщенный хлоридсеребряный электрод, вспомогательным – платиновый. Потенциалы электродов в работе приведены относительно стандартного водородного электрода.
Диапазон потенциалов регистрации импеданса соответствовал прямолинейному участку катодной поляризационной кривой (–1.21…–1.53 В) с шагом смещения потенциала 30 мВ в катодную сторону. Регистрацию спектров импеданса осуществляли при помощи универсального автоматизированного прибора для электрохимических исследований фирмы Solartron Analytical, модель 1280C в диапазоне частот 20 кГц–0.01 Гц (10 точек на декаду) в термостатируемой ячейке при температуре 25 ± 1°С. Электролит перед испытанием деаэрировали аргоном в течение часа. Для анализа полученных спектров использовали программное обеспечение ZView-2 (Scribner Associates, Inc).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Спектры импеданса регистрировали в диапазоне потенциалов, отвечающих уравнению Тафеля. Графики зависимости логарифма плотности тока от потенциала, полученные в потенциостатическом режиме, представлены на рис. 1. Установлено наличие двух линейных участков зависимости lg i–E: –1.21…–1.33 и –1.39…–1.53 В.
Рис. 1.
Катодные поляризационные кривые образцов сплавов (TiCr1.8)xV100 –x при 298 К в 1 М КОН (1‑й участок – сплошная заливка; 2-й участок – без заливки).
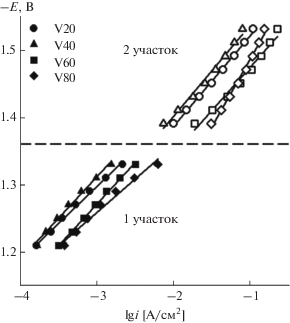
Рассчитанные коэффициенты уравнения Тафеля приведены в табл. 1. Для всех образцов, за исключением второго линейного участка V80 (в области потенциалов –1.39…–1.53 В), значения угловых коэффициентов bk находятся в диапазоне 0.09–0.14 В, при переходе ко второму участку наклон возрастает. Такие значения bk, согласно литературным данным [16, 17], близки к значениям для металлов платиновой группы в щелочной среде. Так, для платины в щелочном растворе значение углового коэффициента равно 0.10 В, для палладия 0.13 В [18]. Полученные результаты поляризационных измерений не позволяют однозначно судить о механизме или лимитирующей стадии процесса.
Таблица 1.
Параметры катодного процесса для образцов сплавов (TiCr1.8)xV100– x
| Образец | 1-й участок | 2-й участок | ||
|---|---|---|---|---|
| ak, В | bk, В | ak, В | bk, В | |
| V20 | 0.805 | 0.109 | 0.838 | 0.134 |
| V40 | 0.864 | 0.123 | 0.856 | 0.136 |
| V60 | 0.825 | 0.123 | 0.787 | 0.129 |
| V80 | 0.741 | 0.099 | 0.872 | 0.201 |
Величина коэффициента ak, связанного с величиной перенапряжения выделения водорода (η = ak при lgi = 0, согласно уравнению Тафеля), для исследуемой системы лежит в диапазоне 0.7–0.9 В. Перенапряжение в начале исследуемого участка потенциалов выше 0.4 В. Это существенно превышает значения для металлов платиновой группы, что указывает на затруднение электрохимического процесса и снижение эффективности данного электродного материала [19].
На рис. 2 представлены годографы импеданса, которые для всех исследованных сплавов имеют одну емкостную дугу, близкую к полуокружности с несколько смещенным ниже оси абсцисс центром. Из представленных графиков видно, что увеличение содержания ванадия в сплаве приводит к определенной закономерности, за исключением сплава, содержащего 20 ат. % ванадия, – последовательному и существенному снижению полного сопротивления, и, следовательно, положительно влияет на электрохимическое выделение водорода. Причина, по которой величина полного сопротивления образца сплава V20 не подчиняется общей закономерности, связана, на наш взгляд, со структурно-фазовыми особенностями этого сплава [9]. Ранее, нами было показано [20], что в отличие от образцов сплавов с бóльшим, чем 20 ат. % ванадия, существуют две особенности в микроструктуре сплавов: наличие незначительного количества фазы TiCr2 и отсутствие гомогенного распределение компонентов сплава, и, по мнению авторов [21], именно вторая особенность оказывает преимущественное влияние на взаимодействие сплава с водородом.
Непосредственно перед анализом спектров импеданса проведена проверка возможного наличия оксидных пленок на поверхности исследованных материалов, поскольку в состав сплавов входят легко окисляемые компоненты и, несмотря на использование защитной атмосферы аргона в ходе экспериментов, нельзя полностью исключить окисление рабочей поверхности образцов. Присутствие оксидов может оказать влияние на результаты обработки спектров и должно быть учтено при подборе эквивалентной электрической схемы (ЭЭС). Нами использован метод построения кривых дифференциальной емкости.
Значение дифференциальной емкости рассчитывали согласно уравнению [22]:
где Z " – мнимая составляющая импеданса, ω = = 2πf, f – частота (10 кГц). На рис. 3 приведены графики для исследуемых сплавов.Рис. 3.
Кривые дифференциальной емкости при f = = 10 кГц для образцов сплавов (TiCr1.8)xV100– x: 1 – V20, 2 – V40, 3 – V60, 4 – V80.
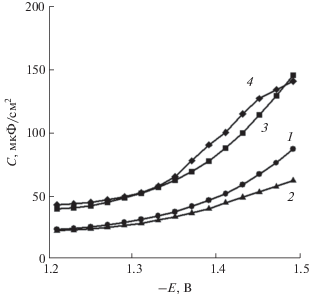
Согласно литературным данным, низкие значения емкости (ниже 20 мкФ/см2 для твердых электродов [22]) могут быть обусловлены наличием оксидной пленки на электроде, которая полностью не восстанавливается при невысокой катодной поляризации [23]. Из данных, представленных на рис. 3, следует, что значения дифференциальной емкости для всех исследуемых сплавов превышают величину 20 мкФ/см2, что, вероятно, указывает на отсутствие плотных оксидных пленок на поверхности во всем исследуемом диапазоне потенциалов.
Три классические эквивалентные электрические схемы, используемые для исследования РВВ на различных материалах (рис. 4), выбраны для анализа полученных спектров импеданса. Схема А описывает двухстадийную РВВ с адсорбцией промежуточного вещества при отсутствии влияния стадии массопереноса и допущении о малой степени заполнения поверхности адсорбированным молекулярным водородом [15]. В данную ЭЭС входят такие элементы, как сопротивление раствора (Rs, Ом см2), сопротивления электрохимического процесса (R1 и R2, Ом см2), которые зависят от кинетических параметров обеих стадий реакции выделения водорода, емкость электрохимического процесса (C2, мкФ/см2) и емкость двойного электрического слоя (Cdl, мкФ/см2).
Схема А была использована для моделирования спектров импеданса, однако полученные результаты показали низкую сходимость экспериментальных и расчетных спектров. Значение приведенной суммы квадратичных отклонений χ2 для расчетов в ZView2 по схеме А лежали в диапазоне 1 × 10–3–9 × 10–2. Схема А характеризуется двумя нераспределенными временными константами R1Cdl и R2C2 и не может с достаточной точностью описать экспериментальный спектр импеданса, если он включает распределенную временную константу.
В схему Б введен элемент постоянной фазы (CPE1), который позволяет описать двойной электрический слой на неоднородных поверхностях. Схема показала достаточно высокое соответствие теоретической модели экспериментально полученным данным. Значения приведенной суммы квадратичных отклонений χ2 для схемы Б составляли 9 × 10–5–1 × 10–3, ошибки определения величин всех параметров эквивалентной схемы, как правило, не превышали 10%. В качестве примера, на рис. 5 и 6 приведены результаты моделирования для сплава V20 по схеме А и Б. Представленные на рис. 6 результаты хорошо согласуются с заключением о необходимости принять во внимание факт структурной неоднородности сплава V20, сделанным выше.
Рис. 5.
График Найквиста и Боде для V20 при –1.21 В: точки – экспериментальные данные, сплошная линия – моделирование по схеме А.

Рис. 6.
График Найквиста и Боде для V20 при –1.21 В: точки – экспериментальные данные, сплошная линия – моделирование по схеме Б.

На основании полученных данных рассчитаны зависимости элементов фарадеевского импеданса (R1, R2, C2) от потенциала электрода. На рис. 7 показаны графики зависимости lg X (X = R1, R2, C2) от E для образца V20. На приведенных зависимостях хорошо видно наличие двух прямолинейных участков, соответствующих участкам на катодных поляризационных кривых (КПК). Такая закономерность наблюдается для всех образцов системы: первый участок лежит в диапазоне потенциалов –1.21…–1.33 В, второй –1.39…–1.53 В. В табл. 2 также приведены теоретические значения наклонов dlg X/dE с учетом предполагаемого механизма РВВ и изотермы адсорбции водорода (Ленгмюра (энергетически однородная поверхность) и Тёмкина (энергетически неоднородная поверхность)).
Рис. 7.
Зависимость lg X (X = R1 – круг, R2 – треугольник, C2 – квадрат) от потенциала для сплава V20 (1‑й участок – сплошная заливка; 2-й участок – без заливки).

Таблица 2.
Величины наклонов dlg X/dE (В–1) для образцов системы (TiCr1.8)xV100– x по схеме Б
| Образец | 1-й участок | 2-й участок | ||||
|---|---|---|---|---|---|---|
| dlg R1/dE | dlg R2/dE | dlg C2/dE | dlg R1/dE | dlg R2/dE | dlg C2/dE | |
| V20 | 0.75 | 10.25 | –1.72 | 1.64 | 9.27 | –3.31 |
| V40 | 0.62 | 9.44 | –0.76 | 2.76 | 9.02 | –3.81 |
| V60 | –0.25 | 9.55 | –0.49 | 2.70 | 10.78 | –8.14 |
| V80 | 1.83 | 11.99 | –2.81 | 1.99 | 4.72 | –3.46 |
| Теор. значения при изотерме Ленгмюра | 8.47 | 25.40 | –16.93 | 8.47 | 25.40 | –16.93 |
| Теор. значения при изотерме Тёмкина | 0 | 16.93 | 0 | 0 | 16.93 | 0 |
Для простоты расчетов предполагали равенство коэффициентов переноса α1 = α2 = 0.5 реакций Фольмера и Гейровского. Возможная реализация механизма Фольмера–Гейровского обусловлена несколькими факторами:
1. Значительные перенапряжения выделения водорода, выше 0.4 В.
2. Тафелевский наклон bk, близкий к 0.12 В.
3. Сравнительно малый наклон зависимости lg R2–E при высоких перенапряжениях (dlg R2/dE ≤ ≤ 14 В–1).
Из представленных данных (табл. 2) видно значительное отклонение параметров dlg X/dE от теоретически рассчитанных величин (особенно для изотермы Ленгмюра), что может быть обусловлено недостаточным соответствием ЭЭС происходящим процессам. Одна из причин этого может быть связана с особенностью поверхности, наличием абсорбции выделяемого водорода, образованием гидридов и другими процессами. Из табл. 2 видно слабую зависимость параметров R1 и C2 от потенциала, что может объясняться протеканием РВВ, в большей степени при выполнении изотермы Тёмкина [26]. Для сплава V60 наклон dlg R1/dE отрицателен, но величина наклона очень мала и практически соответствует теоретическому значению 0 для изотермы Тёмкина.
Значение емкости C2 в случае изотермы Тёмкина имеет теоретическое выражение:
(2)
${{C}_{2}} = {{{{q}_{1}}F} \mathord{\left/ {\vphantom {{{{q}_{1}}F} {\left( {fRT} \right)}}} \right. \kern-0em} {\left( {fRT} \right)}},$При q1 = 200 мкКл/см2 (значение, близкое к q1 для платины), даже при сравнительно высоком значении f = 20 расчетное значение C2 составит 390 мкФ/см2, что значительно больше среднего значения C2 в области слабой зависимости от потенциала (около 20 мкФ/см2, рис. 7). Поэтому, чтобы получить согласие с экспериментальными C2, кроме значительной величины f (сильная энергетическая неоднородность поверхности сплавов (TiCr1.8)xV100– x) следует предположить меньшую величину q1. Величина q1 < 200 мкКл/см2 отмечалась в литературе для щелочных растворов, малые q1 означают, что не вся поверхность активна по отношению к адсорбции водорода [27].
Важным фактором, влияющим на зависимость параметров ЭЭС от потенциала, является абсорбция атомарного водорода электродным материалов [28]. Данный факт обсуждался во многих исследованиях [29, 30]. Процесс поглощения водорода часто протекает с диффузионным контролем, и для описания спектров в схему вводится элемент Варбурга параллельно сопротивлению R2 (схема В), которая позволяет описывать процесс выделения водорода с учетом проникновения водорода в электродный материал [15]. Однако это не привело к заметному улучшению точности аппроксимации экспериментальных спектров (несмотря на большее число параметров по сравнению со схемой Б) и к существенному изменению наклонов dlg X/dE (табл. 3).
Таблица 3.
Величины наклонов dlg X/dE (В–1) для образцов системы (TiCr1.8)xV100– x по схеме В
| Образец | 1-й участок | 2-й участок | ||||
|---|---|---|---|---|---|---|
| dlg R1/dE | dlg R2/dE | dlg C2/dE | dlg R1/dE | dlg R2/dE | dlg C2/dE | |
| V20 | 1.63 | 11.11 | –3.56 | 0.59 | 7.99 | –3.71 |
| V40 | 1.32 | 10.37 | –3.04 | 0.55 | 6.26 | –1.98 |
| V60 | 0.64 | 10.09 | –1.56 | 1.8 | 8.50 | –3.38 |
| V80 | 1.64 | 14.92 | –2.22 | 0.43 | 5.72 | –2.53 |
ЗАКЛЮЧЕНИЕ
Результаты исследования методами поляризационных измерений и импедансной спектроскопии системы сплавов (TiCr1.8)xV100 – x в реакции выделения водорода в 1 М КОН (защитная атмосфера аргона) показали, что для всех исследуемых сплавов на катодных поляризационных кривых характерно наличие двух линейных участков зависимости плотности тока от потенциала. Установлено значительное перенапряжение выделения водорода, выше 0.4 В. Угловой коэффициент уравнения Тафеля bk близок к 0.12 В.
Анализ спектров импеданса показал снижение величины полного сопротивления электрохимического процесса с увеличением содержания ванадия в сплаве, за исключением V20, для которого преимущественное влияние оказывает неоднородность структуры. Определено, что реакция выделения водорода на исследуемых материалах протекает по механизму Фольмера–Гейровского при выполнении изотермы адсорбции Тёмкина.
Список литературы
Anik, M., Akay, I., Ozdemir, G., and Baksan, B., Electrochemical hydrogen storage performance of Mg–Ti–Zr–Ni alloys, Int. J. Hydrogen Energy, 2009, vol. 34, p. 9765.
Balcerzak, M., Structure and hydrogen storage properties of mechanically alloyed Ti–V alloys, Int. J. Hydrogen Energy, 2017, vol. 42, no. 37, p. 23698.
Pebler, A. and Gulbransen, E.A., Thermochemical and structural aspects of the reaction of hydrogen with alloys and intermetallic compounds of zirconium, Electrochem. Technol., 1966, vol. 4, p. 211.
Shaltiel, A.D., Jacob, I., and Davidov, D., Hydrogen absorption and desorption properties of AB2 laves-phase pseudobinary compounds, J. Less Common Met., 1977, vol. 53, no. 1, p. 117.
Johnson, J.R. and Reilly, J.J., Reaction of hydrogen with the low-temperature form (C15) of titanium–chromium (TiCr2), Inorganic Chemistry, 1978, vol. 17, no. 11, p. 3103.
Johnson, J.R., Reaction of hydrogen with the high temperature (C14) form of TiCr2, J. Less Common Met., 1980, vol. 73, no. 2, p. 345.
Skryabina, N.E. et al, Correlation between the Hydrogen Absorption Properties and the Vanadium Concentration of Ti–V–Cr Based Alloy, Solid State Phenomena, 2017, vol. 257, p.165.
Tamura, T., Kazumi, T., Kamegawa, A., Takamura H., and Okada, M., Protium absorption properties and protide formations of Ti–Cr–V alloys, J. Alloys. Compd., 2003, vol. 356, p. 505.
Cho, S.-W., Han, Ch.-S., Park, Ch.-N., and Akiba, E., The hydrogen storage characteristics of Ti–Cr–V alloys, J. Alloys and Comp., 1999, vol. 288, p. 294.
Huang, T., Wu, Z., Xia, B., and Huang, T., Influence of V content on structure and hydrogen desorption performance of TiCrV-based hydrogen storage alloys, Mater. Chem. and Phys., 2005, vol. 93, p. 544.
Akiba, E. and Iba, H., Hydrogen absorption by Laves phase related BCC solid solution, Intermetallics, 1998, vol. 6, p. 461.
Iba, H. and Akiba, E., Hydrogen absorption and modulated structure in Ti–V–Mn alloys, J. Alloys Comp., 1997, vol. 253–254, p. 21.
Seo, C., Kim, J., Lee, P.S., and Lee, J., Hydrogen storage properties of vanadium-based b.c.c. solid solution metal hydrides, J. Alloys Comp., 2003, vol. 348, p. 252.
Вигдорович, В.И., Цыганкова, Л.Е., Зарапина, И.В, Шель, Н.В., Матвеева, М.В. Некоторые вопросы реакции выделения водорода и его диффузии через стальную мембрану. Изв. вузов. Хим. хим. технологии. 2006. Т. 49. № 11. С. 86. [Vigdorovich, V.I., Tsygankova, L.E., Zarapina, I.V., Shel, N.V., and Matveyeva, M.V., Some questions of the reaction of hydrogen evolution and its diffusion through a steel membrane, News of Higher Schools. Chem. and Chem. Technology, 2006, vol. 49, no. 11, p. 86.]
Lasia, A., Electrochemical Impedance Spectroscopy and its Applications, N.Y.: Springer Science + Business Media, 2014. 367 p.
Кулешов, В.Н., Коровин, Н.В., Кулешов, Н.В., Удрис, Е.Я., Бахин, А.Н. Разработка новых электрокатализаторов для низкотемпературного электролиза воды. Электрохим. энергетика. 2012. Т. 12. № 2. С. 51. [Kuleshov, V.N., Korovin, N.V., Kuleshov, N.V., Udris, E.Ya., and Bakhin, A.N., Development of new electrocatalysts for low-temperature electrolysis of water, Electrohem. Energetika (in Russian), 2012, vol. 12, no. 2, p. 51.]
Антропов, Л.И. Теоретическая электрохимия, М.: Высш. школа, 1975. 568 с. [Antropov, L.I., Theoretical electrochemistry (in Russian), Moscow: High school, 1975. 560 p.]
Wilhelmsen, W. and Grande, A.P., Electrochemical and SIMS studies of cathodically formed hydride layers on titanium, Electrochim. Acta, 1990, vol. 35, no. 11–12, p. 1913.
Якименко, Л.М., Модылевская, И.Д., Ткачек, З.А. Электролиз воды, М.: Химия, 1970. 264 с. [Yakimenko, L.M., Modylevskaya, I.D., and Tkachek, Z.A., Electrolysis of water (in Russian), Moscow: Chemistry, 1970. 264 p.]
Габов, А.Л., Медведева, Н.А., Скрябина, Н.Е., Фрушар, Д. Сорбционная способность сплавов системы (TiCr1.8)1– xVx в условиях электролитического насыщения водородом. Химия в интересах устойчивого развития. 2014. Т. 22. С. 509. [Gabov, A.L., Medvedeva, N.A., Skryabina, N.E., and Fruchart, D., Sorption capacity of alloys of the (TiCr1.8)1– xVx system under conditions of electrolytic saturation with hydrogen, Chemistry for sustainable development, 2014, vol. 22, P. 509.
Arashima, H., Takahashi, F., Ebisawa, T., Itoh, H., and Kabutomori T., Correlation between hydrogen absorption properties and homogeneity of Ti–Cr–V alloys, J. Alloys Comp., 2003, vols. 356–357, P. 405.
Кичигин, В.И., Шеин, А.Б., Шамсутдинов, А.Ш. Кинетика катодного выделения водорода на моносилициде железа в кислых и щелочных средах. Конденсированные среды и межфазные границы. 2016. Т. 18. № 3. С. 326. [Kichigin, V.I., Shein, A.B., and Shamsutdinov, A.Sh., Kinetics of cathodic hydrogen evolution on iron monosilicide in acidic and alkaline media, Kondensirovannye sredy i mezhfaznye granitsy, 2016, vol. 18, no. 3, p. 326.]
Кичигин, В.И., Шеин, А.Б., Шамсутдинов, А.Ш. Кинетика реакции выделения водорода на моносилициде никеля в кислом и щелочном растворах. Конденсированные среды и межфазные границы. 2017. Т. 19. № 2. С. 222. [Kichigin, V.I., Shein, A.B., and Shamsutdinov, A.Sh., Kinetics of hydrogen evolution reaction on nickel monosilicide in acidic and alkaline solutions, Kondensirovannye sredy i mezhfaznye granitsy, 2017, vol. 19, no. 2, p. 222.]
Lim, C. and Pyun, S.I., Theoretical approach to faradaic admittance of hydrogen absorption reaction on metal membrane electrode, Electrochim. Acta, 1993, vol. 38, no. 18, p. 2645.
Harrington, D.A. and Conway, B.E., AC Impedance of Faradaic reactions involving electrosorbed intermediates. I. Kinetic theory, Electrochim. Acta, 1987, vol. 32, no. 12, p. 1703.
Kichigin, V.I. and Shein, A.B., Diagnostic criteria for hydrogen evolution mechanisms in electrochemical impedance spectroscopy, Electrochim. Acta, 2014, vol. 138, p. 325.
Martin, M.H. and Lasia, A., Hydrogen sorption in Pd monolayers in alkaline solution, Electrochim. Acta, 2009, vol. 54, p. 5292.
Kichigin, V.I. and Shein, A.B., Influence of hydrogen absorption on the potential dependence of the Faradaic impedance parameters of hydrogen evolution reaction, Electrochim. Acta, 2016, vol. 201, p. 233.
Lasia, A., On the mechanism of the hydrogen absorption reaction, J. Electroanal. Chem., 2006, vol. 593, nos. 1–2, p. 159.
Łosiewicz, B., Birry, L., and Lasia, A., Effect of adsorbed carbon monoxide on the kinetics of hydrogen electrosorption into palladium, J. Electroanal. Chem., 2007, vol. 611, nos. 1–2, p. 226.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




