Электрохимия, 2021, T. 57, № 10, стр. 587-599
Композитный электрод полианилин–MnO2 для электрохимического суперконденсатора
В. В. Абаляева a, *, О. Н. Ефимов a, Н. Н. Дремова a, Е. Н. Кабачков a
a Учреждение Российской академии наук Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. Академика Н.Н. Семенова, 1, Россия
* E-mail: avva@icp.ac.ru
Поступила в редакцию 20.06.2020
После доработки 07.10.2020
Принята к публикации 12.03.2021
Аннотация
Композитные электроактивные материалы (КЭАМ) полианилина (ПАни) и оксида марганца (MnOx) были получены путем послойного потенциодинамического осаждения MnOx из растворов MnSO4 в воде и последующим электросинтезм (ЭС) на поверхности MnOx полианилина (ПАни) из сульфата анилина в 1 М H2SO4 на электроде из нержавеющей стали (НС). КЭАМ продемонстрировали характерные окислительно-восстановительные свойства ПАни в кислом водном растворе. Характеристика КЭАМ методом XPS показала аморфную природу MnOx в пленках, в которых марганец находился в степени окисления +2, +3 и +4. КЭАМ показали высокие значения удельной емкости Сm до 2000 Ф/г из расчета на вес осажденного ПАни по сравнению с покрытием из чистого ПАни (228Ф/г), измеренной при 1.0 А/г в 1 М H2SO4 КЭАМ, полученные послойно, сохраняли 90–100% своей емкости после 2500 циклов циклирования и 500 циклов зарядки-разрядки, с кулоновской эффективностью 98%.
1. ВВЕДЕНИЕ
Окислительно-восстановительные суперконденсаторы состоят из электроактивных материалов с несколькими степенями окисления. Эти типы конденсаторов в последние годы тщательно исследуются из-за высокой емкости и стабильных энергетических характеристик. Их псевдоемкость зависит от обратимых окислительно-восстановительных переходов электроактивных материалов, таких как проводящие полимеры [1, 2] и переходные металл-оксиды [3, 4] с различными степенями окисления. ПАни является одним из самых перспективных электронопроводящих полимеров с потенциальным применением из-за его легкого синтеза, высокой стабильности и хорошей проводимости.
Два основных типа электрохимических конденсаторов могут быть реализованы с использованием различных накопителей заряда: электрические двухслойные конденсаторы, которые используют емкость, возникающую в результате разделения заряда на интерфейс электрод/электролит и окислительно-восстановительные суперконденсаторы, которые используют псевдоемкость с переносом заряда, возникающую из обратимых фарадеевских реакций, протекающих на поверхности электрода. Активное исследование последней группы потенциальных материалов на основе электроактивный полимер–оксид металла показало перспективность направления. В это исследование было вовлечено большое количество полимеров [5] и оксидов металлов [2, 6]. Оба компонента композита вносят аддитивный вклад в электрохимическую емкость КЭАМ, а оксид Mn, помимо увеличения фарадеевской псевдоемкости, может инициировать электрополимеризацию анилина [7]. Достоинствами MnO2 также являются его низкая стоимость и высокая теоретическая емкость (около 1370 Ф г–1) [8]. Также MnO2 обладает более высоким окислительным потенциалом по сравнению с другими оксидами переходных металлов (NiO и Co3O4). КЭАМ на основе ПАни и MnO2 можно синтезировать электрохимическим [9] и химическим [10] путем.
В литературе различные варианты КЭАМ на основе ПАни-MnO2 были охарактеризованы с помощью рентгеновской дифракции (XRD), сканирующей электронной микроскопии (SEM), рентгеновской фотоэлектронной спектроскопии (XPS), инфракрасной спектроскопии с преобразованием Фурье (FTIR) и так далее. Рентгеноструктурный анализ показал, что базальное расстояние составляло 1.47 нм, что соответствует бензольным кольцам ПАни, расположенным в зигзагообразной конформации и расположенным перпендикулярно неорганическим слоям. Растягивающая вибрация CN (νCN), которая появилась с ПАни при 1293 см–1, сместилась до 1306 см–1 для нанокомпозита ПАни-MnO2, что указывает на существование взаимодействий между интеркалированными слоями ПАни и оксида марганца [11].
Целью настоящей работы было исследование электрохимических характеристик полученных на электродах из НС электродных материалов на основе ПАни при введении в состав КЭАМ оксидных соединений марганца – доступного и эффективного модификатора с использованием метода послойного размещения компонентов: оксид Mn–полимер и т.д.
Сокращения, принятые в работе:
ПАни – полианилин, (Ан) анилин,
КЭАМ – композитные электроактивные материалы,
НС – электроды из нержавеющей стали,
АС – анилинсульфат,
СУ – стеклоуглерод,
ЭС – электросинтез,
Электролиты Э1 : 0.5 × 10–3 М раствор MnSO4 в дистиллированной воде,
Э2 – 0.2 М раствор сульфата анилина (АС) в 1М H2SO4, Э3 – 1 М H2SO4.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Характеристика рабочего электрода
Электрод из нержавеющей стали (НС) марки 12Х18Н10Т (с содержанием хрома, никеля и титана) имел форму круговой пластины ∅ = 1 см, толщиной 0.3 мм с отводом для контакта 5 см × 2 мм. До осаждения каждый электрод был отполирован наждачной бумагой средней отделки, отмыт от наждачных частиц, высушен на воздухе и взвешен.
2.2. Электрохимические синтез (ЭС) и исследования ПАни и ПАни с MnOx на НС
ЭС и электрохимические исследования проводили в потенциодинамическом или в гальваностатическом режиме в интервале потенциалов ‒0.3…+1 В (относительно Ag/AgCl) в трехкамерной стеклянной электрохимической ячейке (используемый объем электролита 20 мл) при комнатной температуре на потенциостате PS-7 (фирма Элинс, Россия) с программным обеспечением. Все потенциалы приведены относительно указанного электрода сравнения. Пространства рабочего и вспомогательного электродов были разделены пористой стеклянной перегородкой. Рабочим электродом служила пластина НС указанного размера, вспомогательным электродом служила чистая стеклоуглеродная (СУ) пластина размером 1 × 5 см. Все композитные материалы выращивались в течение указанного в каждом случае количества циклов потенциодинамического циклирования в указываемом в каждом ЭС интервале потенциалов со скоростью 20 мВ с–1. Слои MnОx наносились из 0.5 × 10–3 М раствора MnSO4 в дистиллированной воде (электролит 1 (Э1)). ЭС ПАни проводился из 0.2 М раствора сульфата анилина (АС) (электролит 2 (Э2)) в 1 М H2SO4. Все исследования проводились в 1 М H2SO4 (электролит 3 (Э3)).
Электроактивность КЭАМ изучалась в Э3 циклическим вольтамперометрическим сканированием при разных скоростях (мВ с–1) и гальваностатическим разрядом-зарядом.
Удельную электрохимическую емкость (Ф/г) рассчитывали по формуле Сm = it/ΔV, где i – удельная плотность тока (А/г), рассчитанная на единицу веса композитной пленки на электроде; t – время разряда (с); ΔV – область потенциалов (В), в которой происходит разряд.
2.3. Классификация, ЭС и веса полученных КЭАМ (К1, К2(1), К2(2), К2(3) и К3)
К1 получен в ЭС ПАни на НС из Э2. После ЭС электрод был тщательно промыт дистиллированной водой, высушен и взвешен. Получено 0.01 г ПАни (табл. 1).
Таблица 1.
Вес нанесенных MnОx и ПАни для электродов К1, К2(1), К2(2), К2(3), К3 и рассчитанные Сm
| Элект-род | Слой | MnОх вес, г | ПАни вес, г | Вес, г КЭАМ, общий | Вес, г MnОх, общий | Вес, г ПАни, общий | Сm,Ф/г относительно КЭАМ | Сm, Ф/г относительно ПАни |
|---|---|---|---|---|---|---|---|---|
| К1 | 10 × 10–3 | 178 (0.2 А/г) | ||||||
| К2(1) | 1 | 1.5 × 10–4 | 0.5 × 10–4 | 2 × 10–4 | 1.5 × 10–4 | 0.5 × 10–4 | 100 (0.2 А/г) | 365 (0.2 А/г) |
| К2(2) | 2 | 2 × 10–4 | 1.5 × 10–4 | 5.5 × 10–4 | 3.5 × 10–4 | 2 × 10–4 | 256 (0.36 А/г) | 948 (0.36 А/г) |
| К2(3) | 3 | 4 × 10–4 | 3.5 × 10–4 | 13 × 10–4 | 7.5 × 10–4 | 5.5 × 10–4 | 592 (0.77 А/г) | 2158 (0.77 А/г) |
| К3 | 4 × 10–4 | 320 (0.7 А/г) | 1476 (0.7 А/г) |
К2 состоит из трех слоев: каждый слой образовывали двумя составляющими: сначала наносили MnOx, потом ПАни. Все три слоя получали по одинаковой методике: первый слой MnOx наносился на НС из Э1, промывался, сушился, взвешивался, затем на нем проводился ЭС ПАни из Э2, после чего электрод промывался, сушился и взвешивался. Готовый электрод с нанесенным первым слоем (К2(1)) исследовался в Э3 и рассчитывалась его СУД. Электроды со вторым (К2(2)) и третьим (К2(3)) слоями получались нанесением второго и третьего слоев на предыдущие слои по описанной методике. Интервал потенциалов для нанесения MnOx был –0.3…+1.0 В, циклированием при v = 20 мВ/с в Э1 в течение указанного в каждом случае количества циклов. Далее (после взвешивания полученного слоя) электрод помещался в ячейку с Э2, ПАни наносился на поверхность MnOx в ЭС циклированием в основном интервале потенциалов –0.2…+0.75 В при v = 20 мВ/с в течение указанного в каждом случае количества циклов. Электрод К3 был получен нанесением описанным способом MnOx на К2(3) без последующего ЭС ПАни.
2.4. Физико-химические исследования КЭАМ
Электронномикроскопические исследования осуществляли на растровом электронном автоэмиссионном микроскопе Supra 25 производства Zeiss с рентгеноспектральной энергодисперсионной приставкой INCAEnergy производства OxfordInstruments. Разрешение на получаемых изображениях составляет величину 1–2 нм.
Рентгенофотоэлектронные спектры (РФЭС) высокого разрешения Mn2p, С1s, O1s и N1s регистрировали на электронном спектрометре для химического анализа Specs PHOIBOS 150 MCD, рентгеновская трубка с магниевым анодом (MgKα-излучение 1253.6 эВ). При съемке спектров вакуум в камере спектрометра не превышал 3 × 10–9 мбар. Мощность источника составляла 225 Вт. Спектры регистрировались в режиме постоянной энергии пропускания (10 эВ для отдельных линий, спектры отдельных линий записывались – с шагом 0.05 эВ).
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
3.1. ЭС и исследование К1 на электроде из НС
Окисление анилина (Ан) на электроде из НС в Э2 начинается при E = 0.85 В. После начала ЭС при указанном потенциале было проведено 3 серии циклирований по 10 циклов каждая в интервале потенциалов –0.2…+0.8 В, затем –0.2…+0.75 В и последняя серия в интервале –0.2…+0.7 В (рис. 1а). Такое снижение анодного потенциала во время ЭС было применено для того, чтобы уменьшить возможность переокисления образующегося полимера. В данном ЭС было получено 10 мг ПАни. Все дальнейшие электрохимические исследования К1 проведены в Э3.
Рис. 1.
(а) ЭС К1 из Э2, 20 мВ/с; (б) зарядно-разрядные кривые в Э3 электрода К1 при разных токах разряда (на вкладке зависимость CУД электрода К1 от плотности тока разряда); (в) ЦВА электрода К1 в Э3 при указанных на рисунке скоростях развертки (мВ/с) (на вкладке зависимость анодный ток–корень квадратный от скорости развертки); (г) 3 серии многоцикличных ЦВА К1 в Э3, v = 50 мВ/c.

После зарядно-разрядных испытаний (рис. 1б) были рассчитаны значения Cm. Абсолютное значение Cm составляет в измеряемом интервале потенциалов (–0.2…+0.7 В) 223–178 Ф/г для плотностей тока от 0.05 до 0.25 А/г. Для данного материала, согласно виду зарядно-разрядных кривых можно сделать вывод о том, что рабочий интервал эффективной работы с кулоновской эффективностью, близкой к 100%, сужается с увеличением плотности тока. На вкладке к рис 1б показана значительная зависимость Сm от плотности тока. Возможно, такое поведение объясняется морфологией полимера, полученного в конкретных условиях. ПАни, выращенный на НС, изначально представляет собой сыпучую смесь крупных гранул (рис. 2а), имеющих форму коротких трубок с достаточно большим диаметров выше 200 нм. После целой серии электрохимических испытаний, которые связаны с допированием-дедопированием ПАни во время циклирования при высоких скоростях, зарядно-разрядных испытаний и т.д. образец визуально кажется менее рассыпчатым, (рис. 2б). На рис. 1в приведены ЦВА образца К1, снятые при разных скоростях циклирования. Итог этого испытания приведен на вкладке к рис. 1в, из которого можно сделать вывод, что прямолинейная зависимость величины тока от корня из скорости циклирования свидетельствует о диффузионных ограничениях материала [7, 12]. Несмотря на внешне кажущуюся (из фото 2а) достаточно рыхлую структуру и доступность электролита для прохождения редокс-процессов в полимере, после определенного цикла работы полимера возможны его изменения. Так на рис. 2б структура ПАни, прошедшего ряд испытаний, имеет менее структурированный вид, местами напоминая гель, а размеры конгломератов, просматриваемых в структуре, достигают 300–350 нм. В процессе 300 циклирований (рис. 1г) в рабочем интервале ПАни электрод К1 потерял около 10% своей электрохимической емкости.
3.2. ЭС и исследование К2(1)
Нанесение 1-го слоя MnOx на поверхность НС проходило по описанным в литературе методикам [2, 13] из Э1 циклированием потенциала в рекомендуемом различными авторами интервале потенциалов. Мы использовали интервал ‒0.3…+1 В. Окисление при прохождении анодного потенциала приводит к осаждению на поверхности электрода различных окислов Mn (II, III, IV) и других возможных кислородных соединений [14]. Известно, что существенными недостатками MnO2 являются низкая электропроводность (10–5–10–6 См см–1) [15]. С другой стороны, высокие окислительные свойства MnO2, как свидетельствуют литературные данные [2], позволяют ему, активно окисляя молекулу Ан, инициировать его электрополимеризацию. Высокая координационная способность кислородных соединений Mn приводит к образованию достаточно жестких каркасов полимерной структуры благодаря образованию связей между полимерными цепями [11, 16]. Как следует из табл. 1, вес нанесенного в 1 слое количества окислов Mn равнялся 0.00015 г, и на этой поверхности предстояло провести ЭС ПАни. Как видно из рис. 3а, почти 30 циклов ЭС в интервале потенциалов –0.2…+0.8 В потребовалось для начала ЭС. За последующие 30 циклирований было наработано 0.5 × 10–4 г ПАни. Хотя, как следует из ЭС К1, ПАни на поверхности НС, не покрытой окислами Mn, образовалось за те же 30 циклов больше по весу на два порядка (раздел 3.1). В ЭС К2(1) важную роль играет предварительное образование на поверхности электрода НС пленки плохо проводящих окислов Mn. По окончании ЭС ПАни на электроде образовалась очень тонкое, едва заметное цветное покрытие. EА – EК (рис. 3а) = 0.1 В, что говорит о практическом отсутствии проблем в прохождении редокс-процессов. Расчеты Сm для разных плотностей тока (рис. 3б) дают одно значение 100 Ф/г. Циклирование электрода с разными скоростями приведено на рис. 3(в). Прохождение редокс-процессов в такой пленке при разных скоростях является практически безбарьерным. О чем говорит прямолинейная зависимость величины тока от скорости развертки (вкладка на рис. 3в). EА – EК (рис. 3в) = 0.14 В для v = 300 мВ/с, возрастая всего лишь на 40 мВ при увеличении скорости циклирования в 30 раз.
3.3. ЭС и исследование К2(2)
Второй слой (MnOx + ПАни) на поверхность К2(1) был нанесен аналогично 1-му слою (пункт 3.2). На вкладке рис. 4а показана ЦВА осаждения MnOx из Э1 на поверхность К2(1) в интервале ‒0.3…+1 В. Все 20 циклов наблюдается увеличение площади ЦВА 1 за счет роста токов на анодной и катодной ветвях ЦВА 1. Наблюдаются два редокс-пика 0.45 и 0.41 В. Осаждение MnOx происходит на поверхность К2(1), который имел два редокс-пика (рис. 3в) 0.275 и 0.22 В. Но этих редокс-пиков на ЦВА 1 не наблюдается. Пики на ЦВА 1(вкладка) 0.45 и 0.41 В могут означать прохождение редокс-процессов общей системы ПАни-MnOx, которая образуется в момент координации осаждающегося MnOx с полимерными цепями ПАни. Это равновесный процесс, в котором потенциалы анодного и катодного пиков показывают минимальное значение ∆E – всего 40 мВ. За 20 циклов было осаждено 2 × 10–4 г MnOx. Дальнейшие 30 циклов ЭС ПАни, в котором получено 1.5 × 10–4 г ПАни, показаны на рис. 4а (ЦВА 2). Перед снятием зарядно-разрядных кривых и расчетом Cm, проведено несколько ЦВА в Э3, одна из которых приведена на рис. 4а, ЦВА 3. На этой ЦВА по сравнению с последней ЦВА 2 в Э2 по окончанию ЭС значительно увеличено значение анодного тока и на 30 мВ уменьшается ∆E. Полученный КЭАМ с двумя слоями (общий вес двух слоев MnOx-ПАни 0.55 × 10–3 г) показал увеличение Cm по сравнению с 1-м слоем. Рассчитанные значения Сm приведены на рис. 4б. Циклирование К2(2) при разных скоростях показало хорошую устойчивость К2(2) к изменению скорости (рис. 4в, вкладка), что доказывает безбарьерное прохождение редокс-процессов в КЭАМ. Доказательством этому служит прямолинейная зависимость анодного тока от скорости циклирования в исследуемом интервале скоростей от 10 до 300 мВ/с (рис. 4в).
3.4. ЭС и исследование К2(3)
Третий слой (MnOx + ПАни) на поверхность К2(2) был нанесен аналогично описанным для предыдущих двух слоев. На рис. 5а ЦВА 1 отображает ход ЭС MnOx на поверхности К2(2). Здесь также как и в случае покрытия поверхности К2(1) оксидами Mn наблюдается процесс осаждения, подтверждаемый постепенным увеличением от цикла к циклу площади ЦВА 1. Анодный и катодный пики с разницей 30 мВ практически воспроизводят потенциалы прохождения редокс-процессов. Такой равновесный процесс говорит об образовании на поверхности К2(2) хорошо проводящей структуры и о том, что плохо проводящие окислы Mn проникают в структуру хорошо проводящего ПАни и координируются с ним в единую равновесную систему. За 20 проведенных циклирований в Э1 образовалось 0.4 × 10–3 г MnOx. После взвешивания проведено 30 циклирований в Э2. ЦВА ЭС ПАни приведена на рис 5а. Количество полученного ПАни составляло 0.35 × × 10–3 г. Сопоставляя скорости ЭС ПАни в композитах К2(1), К2(2) и К2(3) согласно количествам полученных продуктов за постоянные 30 циклов ЭС, можно наблюдать увеличение скорости ЭС и, соответственно, количества образующегося ПАни. Перед прохождением зарядно-разрядных процессов была снята ЦВА в Э3 (ЦВА 3 на рис. 5а), которая показывает более высокое значение анодного тока и снижение ∆E по сравнению с Э2. Значения Cm из расчета на всю массу образованного продукта во всех трех слоях показаны на рис 5а. К2(3) снижает значение Cm на 15% (от 592 до 503 Ф/г) при увеличении плотности тока в 3 раза (от 0.77 до 2.3 А/г). Длительное циклирование (2500 циклов в Э3, 100 мВ/с) показало снижение Cm на 12% (рис. 5в). Зависимость величины анодного тока от скорости развертки носит прямолинейный характер, что говорит об отсутствии диффузионных ограничений при прохождении редокс-процессов. Морфология К2(3) (рис. 6в, 6г) и ПАни (К1) (рис. 6а, 6б) значительно отличаются в любом масштабе. ПАни (рис. 2а, 6а) представляет набор отдельных гранул ∅ свыше 200 нм.
Рис. 5.
(а) ЦВА 1 – осаждение MnOx на поверхность К2(2) из Э1, 50 мВ/с; ЦВА 2 – ЭС ПАни из Э 2; ЦВА К2(3) после ЭС в Э3, 20 мВ/с; (б) зарядно разрядные кривые К2(3) и величины Cm; (в) 5 серий циклирований К2(3) в Э3, 150 мВ/с; на вкладке изменение Cm по ходу циклирования; (г) циклирование К2(3) с разными скоростями, на вкладке зависимость анодного тока от скорости циклирования.

ПАни в трехслойном материале (К2(3)) (рис. 6в, 6г) представляет собой трубки ∅50 нм, которые в отличие от К1, объединены, возможно, какими-то межцепочными связями. Особенно хорошо сетчатая структура видна при более грубом масштабе (рис. 6г). Как уже упоминалось выше, способность окисных соединений Mn легко образовывать координационные связи, находясь внутри полимерных цепей [11, 16], может в данном случае инициировать сетчатую структуру материала, значительно отличающуюся от чистого ПАни. Такая структура способна удлинять токопроводящую часть цепей ПАни.
3.5. ЭС и исследование К3
К3 получен нанесением последнего слоя MnOx на трехслойный материал К2(3) уже описанным способом из Э1. ЦВА этого ЭС на рис. 7, отображает прохождение 20 циклов ЭС MnOx, в котором получено 0.4 × 10–4 г покрытия. ЦВА этого ЭС (рис. 7, ЦВА 1 (первый цикл) и ЦВА 1.1 (второй и последующие циклы)) отличается от ЦВА ЭС MnOx на К2(2) и К2(3). Отличие, прежде всего, заключается в значительно большем значении ∆E (0.56 В). Во время ЭС заметно увеличение токов на анодной и катодной ветви ЦВА, но увеличение EА – EК при ЭС MnOx говорит о возникших затруднениях в этом процессе на поверхности К2(3). Возможно, это связано с достаточно большим количеством ПАни, синтезированным в последнем третьем слое К2(3). Также это может быть следствием большого количества исследований, которому был подвергнут К2(3), включая длительные циклирования, многочисленные зарядо-разрядные и другие испытания, которые изменили поверхность К2(3). Возможно, при этом возникают препятствия для проникновения внутрь полимера соединений Mn, что является препятствием к образованию внутренних координационных связей. При этом образующийся слой MnOx являясь плохим проводником, будет при прохождении редокс-процессов испытывать определенные трудности до тех пор, пока не станет частью проводящего полимера при образовании координационных связей. При циклировании полученного электрода в Э3 ЦВА 2 практически воспроизводит последнюю ЦВА многоцикличного испытания К2(3) после 2500 циклирований (рис. 5в) с ∆E = 0.15–0.17 В. При циклировании К3 с разными скоростями (рис. 7б) в Э3 зависимость анодного тока от скорости развертки потенциала носит прямолинейной характер. Эти факты говорят в пользу того, что вся трехслойная структура после покрытия ее четвертым слоем MnOx остается электрохимически активной на уровне показателей К2(3). Рассчитанные по зарядно-разрядным кривым значения Cm приведены на рис. 7г. Последний слой MnOx не был покрыт ПАни. В результате получилась упакованная в слои MnOx слоистая структура (cхема 1). Электрохимические исследования и приведенные на их основании расчеты показали, что создаваемый материал от слоя к слою увеличивал электрохимическую циклируемость, устойчивость и соответственно значение Сm. Также следует отметить, что по ходу изменения состава и конструкции КЭАМ от К1 до К3, выращенных в ЭС на НС, изменялась форма зарядно-разрядных кривых. На рис. 8 приведены примеры этих изменений: К1 (ПАни), серии К2 (К2(1)–К2(3)) и серии К3.
Схема 1 . Послойный состав К3.
Рис. 7.
(а) ЭС К3 в Э1: ЦВА 1 (первый цикл) и ЦВА 1.1 (второй и последующие циклы) ЭС MnOx на поверхности К2(3); ЦВА 2 – после ЭС циклирование в Э3, 20 мВ/с; (б): циклирование К3 с разными скоростями, (вкладка) кривая зависимости анодного тока от скорости развертки; (в) Итоговые ЦВА после циклирования К3 в течение 100, 200, 300 и 400 циклов, 150 мВ/с, Э3; (г) зарядно-разрядные кривые К3 после рис. 7(б) (кривые 1–5), после рис. 7(в) (кривые 6–9), 3 мА, Э3.
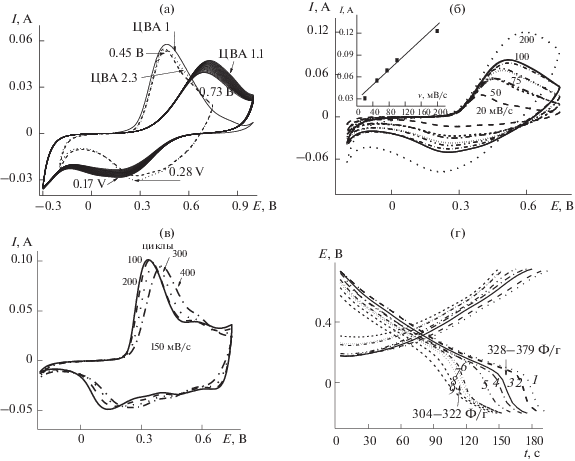
Для ПАни характерна часть кривой заряда с очень медленным приближением к интервалу заряжения (0.7 В). Для кривой разряжения, наоборот, после 0 В наблюдается очень резкий перелом кривой разрядки в сторону резкого роста тока восстановления лейкоэмеральдина. В этих условиях интервал, в котором кулоновская эффективность будет приближаться к 100%, сужается до 0.5 В (0.1–0.6 В). При образовании слоистой структуры К2 этот резкий перелом разрядной кривой проходит под менее крутым углом, а, приближаясь к –0.2 В, наблюдается для К3 попытка выйти на плато и уменьшить скорость роста катодного тока. После покрытия всей конструкции четвертым слоем MnOx резко изменились обе ветви зарядно-разрядной кривой. Практически исчезает перелом на разрядной кривой и увеличивается скорость роста тока на зарядной кривой. Интервал потенциалов, в которых наблюдается почти 100% кулоновская эффективность (для К3) приближается к 1.1 В (от –0.3 до +0.8 В). За время испытаний К3, включая все циклирования с разными скоростями и многоцикличные испытания, было потеряно около 20% первоначальной Cm. Но следует подчеркнуть, что структура К3 дала возможность сделать процесс зарядки-разрядки более равновесным и более предсказуемым.
3.6. РФЭ исследования КЭАМ
Согласно рис. 9 (спектр О1s), для К1 (ПАни на НС) и для первого слоя MnOx осажденного на НС для конструирования 1 слоя (К2(1)), основной пик О1s показывает энергию связи 531.8 эВ. Для слоистого композитного материала (К2(3)) кислородные связи сдвигаются в сторону более высоких энергий (532.6 эВ для К3). Эти спектры могут быть разложены на три составляющие: 531.7, 532.1 и 532.3 эВ. Согласно данным [16], правый склон пика характеризует наличие кислородных связей в соединениях Mn(II), Mn(III), Mn(IV). Это является следствием окисленияMn(II) в MnOx при электрохимическом циклировании электрода в среде MnSO4 и осаждении этих окислов на поверхности ПАни, и их координационном взаимодействии.
Считается, что средняя степень окисления Mn существенно не зависит от разных режимов [14] нанесения, последний факт определяет только степень аморфности (морфологию) образующейся смеси окислов. Область Mn 2p состоит из спин-орбитального дублета с Mn 2p 1/2, имеющего энергию связи 654 эВ и Mn 2p 3/2 с энергией связи 642 эВ, которая характерна для смешанной валентности (Mn4+ и Mn3+) [17]. Образование кислородных соединений Mn может быть доказано при расчете элементного состава К1 и К3 (табл. 2). Образование MnOx должно увеличить содержание кислорода Кислород содержится в анионах ${\text{SO}}_{4}^{{2 - }}$ и большей частью в образующихся MnOx. В К1 O/S = 2.5, в K3 O/S = 6. Избыточный кислород в К3 по сравнению с К1 принадлежит MnOx. Таким образом, и спектральный и элементный анализы доказывают включение MnOx в состав КЭАМ.
Таблица 2.
Элементный состав К1 и К3 по данным РФЭС
| Образец | Элемент | Ат. % | O/S | Образец | Элемент | Ат. % | О/S |
|---|---|---|---|---|---|---|---|
| K1 | C 1s | 61.71 | 2.5 | K3 | C 1s | 71.48 | 6 |
| N 1s | 5.38 | O 1s | 13.21 | ||||
| O 1s | 20.84 | N 1s | 7.03 | ||||
| F 1s | 3.85 | F 1s | 4.14 | ||||
| S 2p | 8.22 | Mn 2p | 1.94 | ||||
| S 2p | 2.20 |
Спектры N 1s приведены на рис. 9 (N1s). Широкие пики в спектрах указывают на то, что в пленках сосуществуют несколько структур, что явно является результатом более чем одного типа N. Каждый из этих спектров может быть разложен на четыре гауссовых пика с энергией связи 398.4; 399.5; 401.0 и 402.5 эВ. Склон пика с низкими энергиями характеризует присутствие аминного азота полимера, в то время как другой склон с энергиями 401–402 эВ соответствует положительно заряженному азоту. Пики на склонах спектров К1 и К3 могут быть приписаны иминоподобной структуре [N–] (399.7 эВ), аминоподобным атомам азота [–NH–] (399.9 эВ), протонированному имину [N+–] и протонированному амину [–NH+–] (401–402 эВ) соответственно [18]. Сообщалось, что в результате сшивания полимерных цепей возникают циклические виды азота, которые имеют энергию связи, близкую к протонированному имину (401.3 эВ [18]), поэтому пик при 401.2 эВ (рис. 9 N1s) должен перекрываться с сигналом протонированного имина и циклического азота. Взаимодействие цепочек происходит преимущественно в хиноидных фрагментах с помощью MnOx и может приводить к сшивке [11, 13]. Соответственно, больше протонирования происходит на иминном азоте полимерной цепи в гибридной пленке, чем в ПАни, что сравнимо с разным протонированием уровня аминного азота. С этим фактом связано уменьшение количества положительно заряженного азота на склоне высоких энергий в К3 (рис. 9, N 1s) по сравнению с К1. Координационные связи MnOx c положительно заряженными атомами N в К3 “гасят” на них положительный заряд, и их количество снижается по сравнению с К1. Спектры С1s для всех композитных материалов очень близки. Из этого следует, что образование координационных связей ПАни происходит в основном за счет взаимодействия атомов N (ПАни) и атомов О (MnOx), практически не затрагивая атомы С.
4. ВЫВОДЫ
Получен новый композитный электроактивный материал методом послойного потенциодинамического нанесения на электрод из нержавеющей стали ПАни и окислов Mn. Проведены исследования полученного композитного электрода на устойчивость при длительном циклировании, с разными скоростями циклирования и при разных плотностях тока. Все полученные результаты для КЭАМ (рис. 10, К2(1), К2(2), К(2)3) сравнили с электродом на основе чистого ПАни (рис. 10, ПАни)). Было доказано, что плохо проводящие окислы MnОx проникают в структуру хорошо проводящего ПАни и координируются с ним в единую равновесную систему. Такая система становится более устойчивой при длительном циклировании и процессах заряда–разряда благодаря образованию более жесткой структуры вследствие сшивки цепей ПАни. Новая структура позволяет значительно улучшить все исследованные возможности композитного электрода, в том числе значительно повысить CУД до 592 Ф/г для К2(3) по сравнению с 178 Ф/г (для К1). Из расчета на чистый ПАни, входящий в состав КЭАМ, CУД К2(3), например, превышает CУД К1 в 12 раз от 2158 Ф/г для К2(3) до 178 Ф/г для К1 (табл. 1).
Список литературы
Frackowiak, E., Jurewicz, K., Delpeux, S., and Beguin, F., Nanotubular materials for supercapacitors, J. Power Sources, 2001, vol. 97, p. 822.
Prasada, K.R. and Miura, N., Polyaniline–MnO2 Composite Electrode for High Energy Density Electrochemical Capacitor, Electrochemical and Solid-State Letters, 2004, vol. 7, p. A425.
Reddy, R.N. and Reddy, R.G., Sol–gel MnO2 as an electrode material for electrochemical capacitors, J. Power Sources, 2003, vol. 124, p. 330.
Miura, N., Onishi, S., and Prasad, K.R., Electrochemically deposited nanowhiskers of nickel oxide as a high-power pseudocapacitive electrode, Electrochem. Solid-State Lett. 2004, vol. 7, p. A247.
Reshetniak, O.V., Yatsyshym, M.M., and Bazilyak, L.I., Polyaniline: the role of particules of radical nature in obtaining of polymer/copolymers with system of conjugated π-bands, Mater. Lett., 2004, vol. 58, p. 3257.
Long, J.W., Young, A.L., and Rolison D.R., Spectroelectrochemical Characterization of Nanostructured, Mesoporous Manganese Oxide in Aqueous Electrolytes, J. Electrochem. Soc., 2003, vol. 150, p. A1161.
Xiea, Yi, Yanga, Ch., Chena, P., Yuana, D., and Guoa, K., MnO2-decorated hierarchical porous carbon composites for high performance asymmetric supercapacitors, J. Power Sources, 2019, vol. 425, p. 1.
Feng, X., Li, Y., Chen, G., Liu, Z., Ning, X., Hu, A., Tang, Q., and Chen, X., Free-standing MnO2/nitrogen-doped graphene paper hybrids as binder-free electrode for supercapacitor applications, Mater. Lett., 2018, vol. 231, p. 114. doi.org/https://doi.org/10.1016/j.matlet.2018.08.026
Prasad, K.R. and Miura, N., Potentiodynamically deposited nanostructured manganese dioxide as electrode material for electrochemical redox supercapacitors, J. Power Sources, 2004, V. 135, P. 354.
Jaidev, Razzak, I.J., Ashish, K.M., and Ramaprabhu, S., Polyaniline–MnO2 nanotube hybrid nanocomposite as supercapacitor electrode material in acidic electrolyte, J. Mater. Chem., 2011, vol. 21, p. 17601.
Zhang, X., Ji, L., Zhang, Sh., and Yang, W., Synthesis of a novel polyaniline-intercalated layered manganese oxide nanocomposite as electrode material for electrochemical capacitor, J. Power Sources, 2007, vol. 173, p. 1017. https://doi.org/10.1016/j.jpowsour.2007.08.083
Ghasemi, S., Hosseini, S.R., and Boore-Talari, O., Sonochemical assisted synthesis MnO2/RGO nanohybrid as effective electrode material for supercapacitor, Ultrason. Sonochem., 2018, vol. 40, p. 675. https://doi.org/10.1016/j.ultsonch.2017.08.013
Sun, L.-J., Liu, X.-X., Lau, K.K., Chen, L., and Gu, W.-M., Electrodeposited hybrid films of polyaniline and manganese oxide in nanofibrous structures for electrochemical supercapacitor, Electrochim. Acta, 2008, vol. 53, p. 3036.
Hu, C.-C. and Wang, C.-C., Nanostructures and Capacitive Characteristics of Hydrous Manganese Oxide Prepared by Electrochemical Deposition, J. Electrochem. Soc., 2003, vol. 150, p. A1079.
Radhamani, A.V., Surendra, M.K., and Ramachandra, Rao, M.S., Zn doped δ-MnO2 nano flakes: an efficient electrode material for aqueous and solid state asymmetric supercapacitors, Appl. Surf. Sci., 2018, vol. 450, p. 209. https://doi.org/10.1016/j.apsusc.2018.04.081
Sun, L.-J., Liu, X.-X., Lau, K.K.-T., Chen, L., and Gu, W.-M., Electrodeposited hybrid films of polyaniline and manganese oxide in nanofibrous structures for electrochemical supercapacitor, Electrochim. Acta, 2008, vol. 53, p. 3036.
Chigane, M. and Ishikawa, M., Manganese Oxide Thin Film Preparation by Potentiostatic Electrolyses and Electrochromism, J.Electrochem. Soc. 2000, vol. 147, p. 2246.
Cruz-Silva, R., Romero-García, J., Angulo-Sánchez, J.L., Flores-Loyola, E., and Díaz, J.A., Comparative study of polyaniline cast films prepared from enzymatically and chemically synthesized polyaniline, Polymer, 2004, vol. 45, p. 4711.
Дополнительные материалы отсутствуют.










