Электрохимия, 2021, T. 57, № 10, стр. 633-642
Транспортные свойства композитов LiClO4–наноалмазы
Д. В. Алексеев a, b, *, Ю. Г. Матейшина a, b, c, d, **, Н. Ф. Уваров a, b, c
a Институт химии твердого тела и механохимии СО РАН
Новосибирск, Россия
b Новосибирский государственный университет
Новосибирск, Россия
c Новосибирский государственный технический университет
Новосибирск, Россия
d Сургутский государственный университет
Сургут, Россия
* E-mail: d.alekseev1@list.ru
** E-mail: YuliaM@solid.nsc.ru
Поступила в редакцию 18.12.2020
После доработки 31.03.2021
Принята к публикации 05.04.2021
Аннотация
В работе представлены данные по исследованию транспортных свойств твердых композиционных электролитов (1 – x) LiClO4–xCНА (где СНА – нанодисперсные алмазы марки “УДА-С” c величиной удельной поверхности Sуд = 300 ± 20 м2/г, 0 < x < 1). Установлено, что добавление CНА приводит к увеличению электропроводности (σ) композита на 3–5 порядков величины до значения 8 × 10–4 См/см при T = 100°С при x = 0.9. Экспериментальные данные в диапазоне концентраций 0.1 < x < 0.8 при температурах 50–200°C описаны теоретическими зависмостями, полученными с помощью модифицированного уравнения смешения. Методом циклической вольтамперометрии в ячейках Э/0.2LiClO4–0.8CНА/Э (где Э = Ag, Cu, Ni и графит) показано, что указанный композиционный твердый электролит электрохимически стабилен в области напряжений до 3.5 В. Показана принципиальная возможность применения композиционных твердых электролитов с добавками наноалмазов в электрохимических устройствах на примере твердотельного суперконденсатора С/0.2LiClO4–0.8CНА/С и твердотельного литиевого аккумулятора LiMn2O4/0.2LiClO4–0.8CНА/LiMn2O4. Таким образом, было продемонстрировано, что нанодисперсные алмазы могут рассматриваться как эффективная неоксидная добавка в композитных твердых электролитах на основе перхлората лития.
ВВЕДЕНИЕ
Портативные электрохимические источники энергии, такие как топливные элементы, аккумуляторы, суперконденсаторы, широко востребованы в самых различных применениях. Для функционирования каждого конкретного электрохимического устройства необходимо использовать наиболее подходящие электролиты [1–3]. В качестве основных требований к электролитам следует отметить широкую область электрохимической стабильности, высокую проводимость и хорошую адгезию к электроду [4–6]. Электролиты, применяемые в таких устройствах, условно можно разделить на следующие группы: жидкие (водные, органические, ионные жидкости (расплавленные соли)), полимерные и твердые. Водные растворы кислот, щелочей, солей (например, H2SO4, KOH, Na2SO4) обладают высокой ионной проводимостью, однако характеризуются ограниченной областью электрохимической стабильности (до 1.2 В). По сравнению с водными, органические электролиты могут обеспечить рабочее напряжение электрохимического устройства до 3.5 В, однако, при этом возникают проблемы пожароопасности и утилизации [7, 8]. Ионные жидкости, обладающие такими многообещающими свойствами, как высокая проводимость, термическая и высокая электрохимическая стабильность (2–6 В) [9], пока не нашли широкого применения в связи с высокой стоимостью [10]. Частично указанные выше проблемы решаются при переходе от жидких к полимерным или твердым электролитам. Твердые полимерные электролиты отличаются хорошей механической прочностью и безопасностью [11], однако обладают достаточно высоким сопротивлением и существенным вкладом противоионов в общую ионную проводимость [12]. Последней проблемы лишены твердые неорганические электролиты [10, 13]. Ранее было показано, что одним из перспективных классов твердых электролитов являются композиционные твердые электролиты типа МХ – А, где МХ – ионная соль, А – инертная добавка [14]. В качестве ионных солей в композитах можно использовать различные соединения лития LiX (Х = = F–, Cl–, Br–, I–, ${\text{SO}}_{4}^{{2 - }},$ ${\text{PO}}_{4}^{{3 - }},$ ${\text{ClO}}_{4}^{ - }$), серебра AgX (Х = Cl, Br, I) и другие ионные соли MNO3 (М = = Li, Na, K, Rb, Cs), MHSO4 (М = Cs, Rb, K) и др. В качестве инертных добавок используются, как правило, высокодисперсные оксиды (MgO, Al2O3, SiO2, TiO2, Fe2O3, ZrO2, CeO2, SnO2 и т.д.) [15].
Для создания литиевых источников тока в качестве электролитов необходимо использовать системы на основе соединений лития. Одним из таких соединений является перхлорат лития LiClO4 [16–19], который ранее успешно применялся в качестве ионного компонента в жидких, полимерных и композиционных электролитах [20, 21]. Ранее было показано, что введение нанокристаллических или нанопористых оксидов в перхлорат лития LiClO4 приводит к росту проводимости электролита от значения σ = 1 × 10–5 См/см при 200°C для чистого соединения до величин порядка 10–3–10–2 См/см при 200°C в композитах LiClO4–α-Al2O3, LiClO4–SiO2 и LiClO4–MgO [22]. Так как ионный перенос в композиционных твердых электролитах МХ–А осуществляется преимущественно вдоль границ раздела фаз МХ/А, соединение А, используемое в качестве гетерогенной добавки, должно обладать высокой дисперсностью. Кроме этого, оно должно быть химически инертным по отношению к электролиту, термически стабильным и не дорогим [15]. В настоящей работе в качестве инертной добавки предлагается использовать частицы нанодисперсного алмаза (или наноалмазы, далее CНА), как уникальный объект с высоким значением удельной поверхности, высокой химической и термической стабильностью при температурах ниже 850°С. Проведенные нами ранее исследования системы LiClO4–CНА [23] показали, что длительная выдержка в течение 48 ч при температуре 160°С приводит к образованию изолирующего слоя LiCl, покрывающего поверхность наноалмазов и препятствующего дальнейшему прохождению возможной окислительно-восстановительной реакции. Такой промежуточный слой может блокировать электронную проводимость слоя аморфной фазы углерода на поверхности наноалмазов, возникающей в условиях синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза композиционных твердых электролитов (1 – x)LiClO4–xCНА (x – мольная доля, 0 < x < 1) были взяты перхлорат лития (LiClO4·3H2O, чистота 99.9%, производства ОАО “Завод редких металлов”, г. Новосибирск) и наноалмазы (детонационные наноалмазы марки “УДА-С” производства ФНПЦ “Алтай”, г. Бийск, с удельной поверхностью Sуд = 300 ± 20 м2/г). Синтез композиционных твердых электролитов осуществлялся по керамической методике, подробно описанной в работе [23]. Исследования электропроводности проводили на таблетках с диаметром 1.1–1.2 см и толщиной d = 0.3–0.9 мм, полученных прессованием при давлении 10–20 МПа с серебряными электродами. Плотность таблеток ρ уменьшалась с увеличением x: для составов с x < 0.8 плотность превышала значение ρ/ρр = 0.86, при x = 0.92 плотность уменьшалась до значения ρ/ρр = 0.63 (ρр – значение плотности, рассчитанное с помощью соотношения: ρр = (1 – f)ρ(LiClO4) + + fρ(СНА), где f – объемная доля СНА; ρ(LiClO4) = = 2.42 г/см3 и ρ(СНА) = 3.56 г/см3 – значения рентгеновской плотности фаз). Электрические измерения проводили в форвакууме в диапазоне температур 50–200°С в режиме ступенчатой изотермы по двухэлектродной схеме с помощью прецизионного измерителя LCR Hewlett Packard HP 4284A в диапазоне частот переменного тока 30 Гц–1 МГц при амплитуде сигнала 10 мВ. Значения электропроводности рассчитывали для каждой температуры путем анализа годографов импеданса –Zе'' = f(Zе'). Результаты обрабатывались в программе EIS Spectrum Analyser.
Электрохимическую стабильность композитов и электрохимические характеристики модельных электрохимических устройств исследовали с твердым электролитом 0.2LiClO4–0.8CНА на таблетках типа Э/электролит/Э (где Э – электродный материал, специфический для конкретного устройства), изготовленных с помощью метода горячего прессования в течение 1 ч под давлением 10 МПа, при температуре 150°С. Исследования электрохимической стабильности композитов проводили методом циклической вольтамперометрии (ЦВА) в симметричных ячейках с электродами, спрессованными из металлических порошков Ag, Cu, Ni, а также с графитовыми электродами в виде стержней, прижатых к торцевым поверхностям таблетки, при T = 100°С и скорости изменения напряжения v = 10 мВ/с.
В модельном твердотельном литиевом аккумуляторе (далее LiMn2O4/0.2LiClO4–0.8CНА/LiMn2O4) в качестве электродов использовалась смесь литий-марганцевой шпинели LiMn2O4 и электропроводящей сажи (Carbon black, Sigma-Aldrich), взятых в весовом соотношении 8 : 2. Зарядно-разрядные характеристики твердотельной ячейки исследовались при T = 180°С на анализаторе химических источников тока АСК 2.5.10.8. (ООО “Яростанмаш”) при токе 10 мкА.
В твердотельном суперконденсаторе (далее С/0.2LiClO4–0.8CНА/С) в качестве электродов использовалась смесь электролита 0.2LiClO4–0.8CНА с мезопористым углеродом (с величиной удельной поверхности Sуд ≈ 3000 м2/г), синтезированным в ООО “ТИТЦМ” при Тамбовском государственном техническом университете. При приготовлении электрода композиционный твердый электролит смешивали с мезопористым углеродом в объемном соотношении 1 : 1. Циклические вольтамперограммы суперконденсатора С/0.2LiClO4–0.8CНА/С были получены при T = = 100°С с помощью прецизионного измерительно-питающего устройства ИПУ-01 при значениях скорости развертки потенциала, равных 5, 10, 100 мВ/с, в диапазоне напряжений от –3 до 3 В.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Транспортные свойства
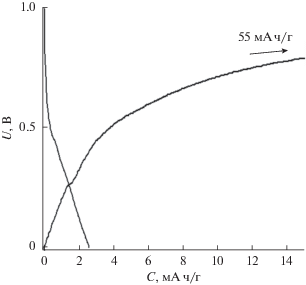
Полученные по керамической методике композиционные твердые электролиты состава (1 ‒ x)LiClO4–xCНА были исследованы методом импедансной спектроскопии. На рис. 1а и 1б представлены типичные годографы импеданса, полученные для композитов 0.9LiClO4–0.1CНА и 0.6LiClO4–0.4CНА при 150°C и 0.6LiClO4–0.4CНА при 100 и 150°C. Годографы импеданса имеют форму деформированного полукруга, в области низких частот наблюдается увеличение импеданса, характерное для эффектов электродной поляризации. Для расчета импеданса была выбрана оптимальная электрическая эквивалентная схема, представленная на рис. 1в и включающая последовательное соединение импеданса электролита, в который входят активное сопротивление Rb и элемент постоянной фазы (constant phase element) CPEb, и электродного импеданса, описываемого элементом постоянной фазы CPEel. На основании анализа годографов импеданса были рассчитаны значения сопротивления Rb, проводимости σ = $R_{{\text{b}}}^{{ - {\text{1}}}}$dS–1 (d – толщина таблетки; S – площадь поверхности электрода) при каждой температуре и построены температурные зависимости проводимости.
Рис. 1.
Годографы импеданса композитов (1 – x)LiClO4–xCНА, где x = 0.1, 0.4 при 150°C (a) и 0.6LiClO4–0.4CНА при 100 и 150°C (б). Эквивалентная схема, используемая для интерпретации данных, где Rb – объемное сопротивление, CPEb и CPEel – элементы постоянной фазы (в).
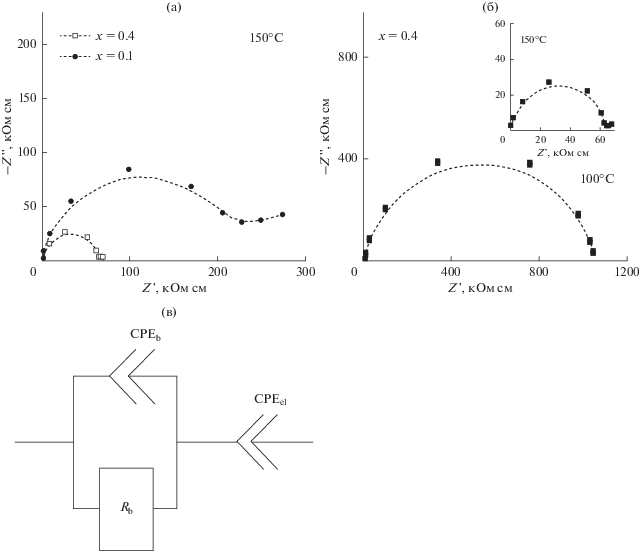
Аррениусовские зависимости электропроводности композитов (1 – x)LiClO4–xCНА представлены на рис. 2.
Рис. 2.
(а) Температурная зависимость проводимости композитов (1 – x)LiClO4–xCНА (x – мольная доля CНА); (б) экспериментальные значения проводимости отдельных образцов (символы) в сравнении с теоретическими кривыми (линии), полученными подгонкой с помощью уравнений (1)–(5).
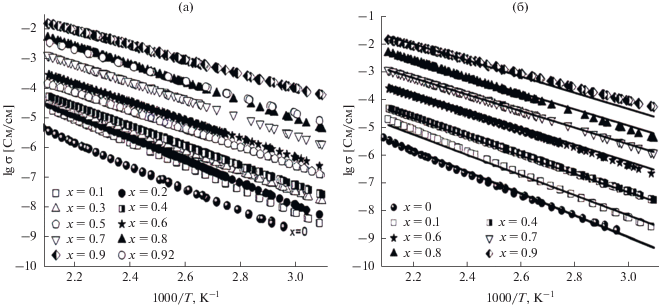
После предварительного прогрева в вакууме проводимость композитов монотонно возрастает с ростом температуры и хорошо воспроизводится в циклах нагрев–охлаждение (рис. 2а). На рис. 3а представлены зависимости проводимости композитов в зависимости от мольной доли СНА при температурах 100, 150, 200°С. При увеличении концентрации гетерогенной добавки до x = 0.9 происходит монотонное увеличение проводимости. Максимальным значением проводимости, σ = 1.5 × 10–2 См/см при 200°C, характеризуется состав 0.1LiClO4−0.9СНА. Дальнейшее увеличение концентрации гетерогенной добавки приводит к падению значений проводимости. Обычно максимум проводимости в композиционных твердых электролитах наблюдается у составов с концентрацией инертной оксидной добавки ~30–60 об. % [15]. Для сравнения на рис. 3б представлена зависимость проводимости композитов LiClO4–CНА от объемной доли f наноалмазов. Из рисунка видно, что экспериментально наблюдаемый максимум проводимости, соответствующий значению мольной доли x = 0.9, находится при f = 0.41. Такое значение объемной доли гетерогенной добавки типично композиционных твердых электролитов [23], проводимость которых обусловлена наличием границ раздела фаз ионная соль/оксид.
Рис. 3.
Изменение удельной проводимости композитов (1 – x)LiClO4–xCНА в зависимости от мольной (а) и объемной (б) доли наноалмазов СНА в композитах. Линиями показаны теоретические зависимости, полученные подгонкой уравнения (2) под экспериментальные значения (символы).

Концентрация областей соли fS, находящихся вблизи границ раздела фаз MX/A, проходит через максимум при увеличении содержания оксида, что приводит к появлению максимума проводимости. При равномерном распределении компонентов в композите значение fS можно приблизительно оценить с помощью соотношения [15]:
(1)
${{f}_{{\text{S}}}} = \beta \frac{\lambda }{L}f\left( {1 - f} \right) = \gamma f\left( {1 - f} \right),$(2)
${{\sigma }^{{{{\alpha }}\left( f \right)}}} = \sigma _{1}^{{{{\alpha }}\left( f \right)}}\left( {1 - f - {{f}_{{\text{S}}}}} \right) + \sigma _{{\text{S}}}^{{{{\alpha }}\left( f \right)}}{{f}_{{\text{S}}}} + \sigma _{2}^{{{{\alpha }}\left( f \right)}}f,$(4)
${{\sigma }_{1}} = \frac{{{{A}_{{\text{1}}}}}}{T}\exp \left( { - \frac{{{{E}_{{\text{1}}}}}}{{RT}}} \right),$(5)
${{\sigma }_{{\text{S}}}} = \frac{{{{A}_{{\text{S}}}}}}{T}\exp \left( { - \frac{{{{E}_{{\text{S}}}}}}{{RT}}} \right),$Таблица 1.
Значения параметров, используемых для описания проводимости композитов LiClO4–CНА, полученные подгонкой теоретических зависимостей (1)–(5) под экспериментальные значения проводимости
| Параметр | Значение |
|---|---|
| lg (A1, См/см) | 7.6 ± 0.4 |
| E1, эВ | 0.81 ± 0.02 |
| lg (AS, См/см) | 1.8 ± 0.4 |
| ES, эВ | 0.61 ± 0.02 |
| γ | 1.8 ± 0.1 |
| α1 | 0.20 ± 0.01 |
| α2 | 0.80 ± 0.02 |
Как видно из рис. 2б и 3 теоретические кривые (линии) удовлетворительно описывают экспериментальные данные (символы) в интервале температур 50–200°C при концентрации наноалмазов 0 ≤ x ≤ 0.92.
Анализ экспериментальных аррениусовских зависимостей показал, что эффективное значение энергии активации проводимости Ea уменьшается с увеличением x от Ea = 0.81 эВ – для чистого LiClO4 до 0.61 эВ при x = 0.8.
На рис. 4 представлено сравнение транспортных свойств чистого LiClO4 [25], композиционных электролитов, обладающих максимальной проводимостью с добавкой нанокристаллического оксида алюминия 0.5LiClO4–0.5Al2O3 [25] и композита с добавкой наноалмазов 0.1LiClO4–0.9CНА. Сравнение показывает, что проводимость композита с неоксидной добавкой выше во всем исследованном диапазоне температур, а при низких температурах отличие значений проводимости доходит до одного порядка величины (рис. 4). Увеличение значений проводимости может быть связано с более высоким значением удельной поверхности наноалмазов (Sуд = 300 м2/г) по сравнению с оксидом алюминия (Sуд = 200 м2/г). Таким образом, композиционные твердые электролиты с добавкой наноалмазов могут оказаться перспективными твердыми электролитами для применения в электрохимических устройствах.
Рис. 4.
Температурные зависимости композиционных электролитов с максимальной проводимостью 0.5LiClO4–0.5Al2O3 [24] и 0.1LiClO4–0.9CНА в сравнении с проводимостью чистого LiClO4.

Электрохимические свойства
Для возможного использования материала в твердотельных электрохимических устройствах необходимо знать область его электрохимической стабильности. Согласно литературным данным [25], напряжение разложения перхлората лития составляет E = 4.5 В. Изготовленные с помощью метода горячего прессования твердотельные электрохимические ячейки Э/0.2LiClO4–0.8CНА/Э, где Э = Ag, Cu, Ni и С (графит) были исследованы методом ЦВА при температуре 100°С при скорости развертки напряжения 10 мВ/с в диапазоне напряжений от 0 до 5 В для Э = С и от 0 до 4 В для Э = Ag, Cu, Ni.
По данным циклической вольтамперометрии, представленным на рис. 5а, в ячейке с графитовым электродом при увеличении напряжения выше 3.5 В наблюдается рост тока, по-видимому, связанный с электрохимическим разложением электролита. Таким образом, при использовании композитов в электрохимических устройствах не рекомендуется использовать напряжение, превышающее это значение.
Рис. 5.
Вольтамперограммы твердотельных электрохимических ячеек Э/0.2LiClO4–0.8CНА/Э, где Э = графит (а), Ni, Al, Cu (б) и Ag (в).
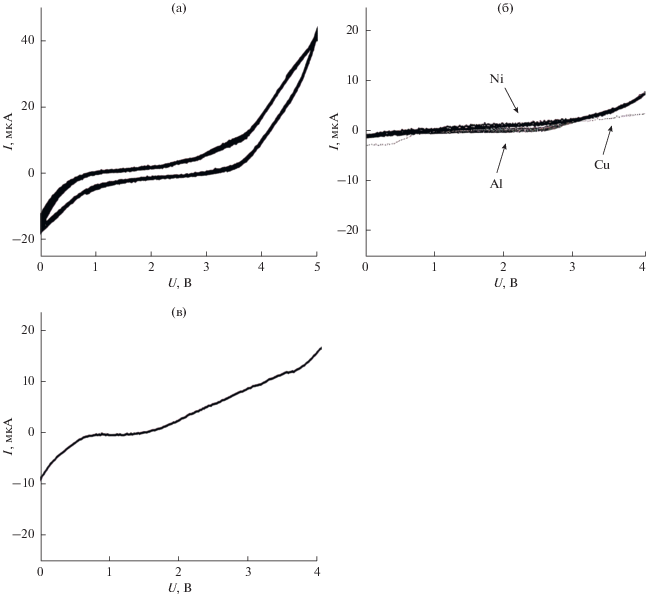
Была исследована электрохимическая устойчивость композита в контакте с различными металлическими электродами. Анализ вольтамперограмм, представленных на рис. 5б, 5в, показал, что при контакте с Ni, Al и Cu не наблюдается существенного роста тока, связанного с электрохимическим разложением электролита 0.2LiClO4–0.8CНА. Следовательно, эти металлические электроды можно применять в качестве токоотводов в устройствах с исследуемыми композитами. В ячейке с серебряными электродами наблюдается заметное увеличение тока в широкой области напряжений выше 1.5 В, что указывает на протекание фарадеевских процессов, причина которых пока не ясна.
Для подтверждения наличия ионной проводимости по ионам лития был изготовлен твердотельный аккумулятор LiMn2O4/0.2LiClO4–0.8CНА/LiMn2O4 и исследованы его зарядно-разрядные характеристики при температуре 180°С (рис. 6). При пропускании тока 5 мкА через ячейку на электродах протекали процессы:
в результате которых между электродами устанавливалась ЭДС около 1 В. Это значение сохранялось в течение нескольких часов, а затем медленно снижалось. При разряде током 5 мкА напряжение быстро уменьшалось, т.е. кулоновская эффективность процесса заряда–разряда оказалась малой. Установившееся значение напряжения соответствует ожидаемому значению для электрохимической ячейки Li1– xMn2O4/LiClO4/Li1– xMn2O4, что указывает на то, что заряд происходит за счет процессов (6) и (7). Так как эксперимент проводили в среде воздуха, то низкая кулоновская эффективность процесса заряда–разряда обусловлена протеканием паразитных процессов, вероятно, с участием молекул воды в газовой фазе.Для исследования возможности практического использования композитов в качестве электролита для твердотельных суперконденсаторов была изготовлена симметричная ячейка С/0.2LiClO4–0.8CНА/С. Для сравнения была собрана ячейка c жидким электролитом (1 М раствор LiClO4 в ацетонитриле) и электродами из того же электродного материала, и исследованы электрохимические характеристики обеих ячеек.
Для симметричной ячейки с идентичными электродами, одинаковыми по массе, величины накопленного заряда и емкости определялись по формулам (8) и (9):
где I (U) и I – реальное и среднее значения тока соответственно, m – масса электрода (г), v – скорость развертки (В/с).Ранее было показано [26], что значения поверхностной емкости углеродных материалов в жидких электролитах составляют ~0.1 Ф/м2. Таким образом, для используемого углеродного материала с Sуд ≈ 3000 м2/г максимальное значение удельной емкости не должно превышать ≈300 Ф/г. Экспериментальное значение емкости мезопористого углеродного материала, полученное методом ЦВА в ячейке с жидким электролитом (1 М раствор LiClO4 в ацетонитриле) при 25°С и скорости развертки напряжения 5 мВ/с, составляет около 200 Ф/г, вольтамперограммы представлены на рис. 7а. Для сравнения были исследованы электрохимические характеристики твердотельного суперконденсатора. Методом циклической вольтамперометрии были проведены исследования ячейки С/0.2LiClO4–0.8CНА/С при T = 100°C и скоростях развертки напряжения 5, 10, 100 мВ/с. Полученные вольтамперограммы представлены на рис. 7б. Значения удельной емкости, измеренные при разных скоростях развертки напряжения, представлены в табл. 2.
Рис. 7.
Сравнение вольтамперограмм, полученных для ячеек С/электролит/С с жидким электролитом (1 М раствор LiClO4 в ацетонитриле) и композиционным твердым электролитом 0.2LiClO4–0.8CНА, v = 5 мВ/с (а). Вольтамперограммы, полученные для симметричных ячеек С/0.2LiClO4–0.8CНА/С, при разных скоростях развертки напряжения (б).
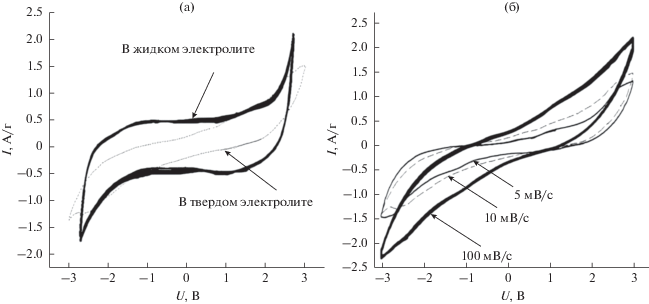
Таблица 2.
Зависимость удельной емкости от скорости развертки потенциала
| Скорость развертки потенциала v, мВ/с | Удельная емкость С, Ф/г |
|---|---|
| 100 | 5 ± 1 |
| 50 | 13 ± 2 |
| 10 | 40 ± 5 |
| 5 | 76 ± 10 |
Сравнение данных, полученных для ячеек с жидким и твердым электролитом (рис. 7а), показало, что значение емкости углеродного материала в твердотельном суперконденсаторе С/0.2LiClO4–0.8CHA/С составляет 76 Ф/г при v = 5 мВ/с, что в 2.5 раза ниже, чем соответствующее значение, полученное в ячейке с жидким электролитом. Относительно низкое значение, емкости, полученное для углеродного материала в твердотельных ячейках С/0.2LiClO4–0.8CНА/С, обусловлено недостаточно хорошим межфазным контактом между мезопористым углеродом и перхлоратом лития, вследствие конкуренции процессов смачивания ионной солью поверхности наноалмазов и растекания соли по внутренней поверхности пор углеродной матрицы. Для увеличения емкости необходимо улучшить адгезию ионной соли к поверхности наноалмазов, например, с помощью модификации поверхности наноалмазов полярными группами. Такие исследования планируется провести в ближайшее время.
ЗАКЛЮЧЕНИЕ
В ходе работы были впервые исследованы транспортные свойства твердых композиционных электролитов (1 – x)LiClO4–xCНА (0 < x ≤ 0.92) в широком диапазоне концентраций. Было показано, что значение проводимости проходит через максимум с ростом концентрации наноалмазов. Максимальным значением проводимости характеризуется состав 0.1LiClO4–0.9CНА (σ = 8 × 10–4 См/см при 100°C). Сравнение значений проводимости композиционных твердых электролитов 0.1LiClO4–0.9CНА и композиционного твердого электролита с оксидной добавкой 0.5LiClO4–0.5Al2O3 в широком интервале температур показало, что проводимость композита с неоксидной добавкой выше во всем исследованном диапазоне, что может быть связано с более высоким значением удельной поверхности наноалмазов по сравнению с Al2O3. Согласно исследованиям электрохимической стабильности твердого электролита в ячейках Э/0.2LiClO4–0.8CНА/Э (где Э = Ag, Cu, Ni и графит), проведенным с помощью метода ЦВА, показано, что при работе с графитовым и металлическими электродами, за исключением серебра, электролит стабилен в области напряжений до 3.5 В. Методом циклической вольтамперометрии был исследован твердотельный суперконденсатор С/0.2LiClO4–0.8CНА/С при скоростях v = 5–100 мВ/с при температуре T = 100°C. Значение емкости углеродного материала в твердотельном суперконденсаторе С/0.2LiClO4–0.8CНА/С составило 76 Ф/г при v = 5 мВ/с. Таким образом, в работе впервые были исследованы транспортные свойства, электрохимическая стабильность и проведены первые эксперименты, направленные на создание твердотельных устройств на основе нового типа твердых электролитов LiClO4–CНА с неоксидной добавкой наноалмазов. Продемонстрирована принципиальная возможность использования этих электролитов в твердотельных электрохимических устройствах.
Список литературы
Lukatskaya, M.R., Mashitalir, O., Ren, C.E., Dall’Agnese, Y., Rozier P., Taberna, P.L., Naguib, M., Simon, P., Barsoum, M.W., and Gogotsi, Y., Cation intercalation and high volumetric capacitance of two-dimensional titanium carbide, Science, 2013, vol. 341, p. 1502.
Torchala, K., Kierzek, K., and Machnikowski, J., Capacitane behavior of KOH activated mesocarbon microbeads in different aqueous electrolytes, Electrochim. Acta, 2012, vol. 86, p. 260.
Narayanan, R. and Bandaru, P.R., High rate capacity through redox electrolytes confined in macroporous electrodes, J. Electrochem. Soc., 2015, vol. 162, p. 86.
Gonzalez, A., Goikolea, E., Barrena, J.A., and Mysyk, R., Review on supercapacitors: technologies and materials, Renewable Sust. Energy Rev., 2016, vol. 58, p. 206.
Simon, P. and Gogotsi, Y., Capacitive energy storage in nanostructured carbon-electrolyte systems, Acc. Chem. Res., 2013, vol. 46, p. 1094.
Vellacheri, R., Al-Haddad, A., Zhao, H., Wang, W., Wang, C., and Lei, Y., High performance supercapacitor for efficient energy storage under extreme environmental temperatures, Nano Energy, 2014, vol. 8, p. 231.
Hikmet, R.A.M., Organic Electrolytes and Electrodes for Batteries, in Encyclopedia of Materials: Science and Technology, K.H. Jürgen Buschow and Merton C., Eds., Amsterdam: Elsevier Science Ltd., 2001, p. 6534.
Yarmolenko, O.V., Yudina, A.V., and Ignatova, A.A., The state-of-the-art and prospects for the development of electrolyte systems for lithium power sources, Electrochem. Energy, 2016, vol. 16, p. 155.
Van Aken, K.L., Beidaghi, M., and Gogotsi, Y., Formulation of ionic-liquid electrolyte to expand the voltage window of supercapacitors, Angew. Chem., 2015, vol. 54, p. 4806.
Abbas, Q., Mirzaeian, M., Olabi, A.G., and Gibson, D., Solid State Electrolytes, Paisley: Elsevier Reference Module in Materials Science and Materials Engineering, 2020, p. 1.
Yi, C., Liu, W., Li, L., Dong, H., and Liu, J., Polymer-in-salt solid electrolytes for lithium-ion batteries, Functional Mater. Letters, 2019, vol. 12, no. 6.
Жуковский, В.М., Бушкова, О.В., Лирова, Б.И., Тютюнник, А.П., Анимица, И.Е. Проблема быстрого ионного транспорта в твердых полимерных электролитах. Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2001. Т. 45. С. 35. [Zhukovskij, V.M., Bushkova, O.V., Lirova, B.I., Tyutyunnik, A.P., and Animitsa, I.E., Problem of fast ionic transport in solid polymer electrolytes, Russ. J. Gen. Chem., 2001, vol. 45, p. 35.]
Wu, Z., Xie, Z., Yoshida, A., Wang, Z., Hao, X., Abudula, A., and Guan, G., Utmost limits of various solid electrolytes in all-solid-state lithium batteries: A critical review, Renewable Sust. Energy Rev., 2019, vol. 109, p. 367.
Иванов-Шиц, А.К., Мурин, И.В. Ионика твердого тела Т. 2, СПб: Изд-во С.-Петерб. Ун-та, 2010. 1000 с. [Ivanov-Schitz, A.K. and Murin, I.V., Solid state ionics (in Russian), St. Petersburg: S.-Peterburg. Univ, 2010. 1000 p.]
Уваров, Н.Ф. Композиционные твердые электролиты. Новосибирск: Изд. СО РАН, 2008. 258 с. [Uvarov. N.F., Composite solid electrolytes (in Russian), Novosibirsk: Publishing House SB RAS, 2008. 258 p.]
Liang, C.C., Conduction characteristics of the lithium iodide–aluminum oxide solid electrolytes, J. Electrochem. Soc., 1973, vol. 120, p. 1289.
Chen, L., Composite Solid Electrolytes, in Materials for Solid State Batteries, B.V.R. Chowdhari, S. Radhakrishna, N.Y., Eds., World Sci. Publ., 1986, p. 69.
Uvarov, N.F., Strivastava, O.P., and Hairetdinov, E.F., Composite Solid Electrolytes in the Li2SO4–Al2O3 System, Solid State Ionics, 1989, vol. 36, p. 39.
Uvarov, N.F., Hairetdinov, E.F., and Skobelev, I.V., Composite Solid Electrolytes MeNO3–Al2O3 (Me = = Li, Na, K), Solid State Ionics, 1996, vol. 86, p. 577.
Bekaert, E., Buannic, L., Lassi, U., Llordés, A., and Salminen, J., Electrolytes for Li- and Na-Ion Batteries: Concepts, Candidates, and the Role of Nanotechnology, in Emerging Nanotechnologies in Rechargeable Energy Storage Systems, Lide M. Rodriguez-Martinez and Noshin Omar, Eds., Amsterdam: Elsevier Science Ltd., 2017, p. 43.
Улихин, А.С., Уваров, Н.Ф., Харламова, О.А., Исупов, В.П. Влияние оксидной добавки на физико-химические свойства композиционных твердых электролитов на основе LiClO4: Тез. докл. междунар. конф. “Фундаментальные проблемы электрохимической энергетики”, Саратов: Изд. Сарат. ун-та, 2005. С. 387. [Ulihin, A.S., Uvarov, N.F., Harlamova, O.A., and Isupov, V.P., Title, Conf. Proc. “Fundamental problems of electrochemical power engineering” (in Russian), Saratov: Publ. Cent. of the Sar. St. Un., 2005, p. 387.]
Uvarov, N.F., Ulihin, A.S., and Mateyshina, Yu.G., Advanced Nanomaterials for Catalysis and Energy Synthesis, Characterization and Applications, in A volume in Advanced Nanomaterials, Vladislav A. Sadykov Ed., Amsterdam: Elsevier Science Ltd., 2019, p. 587.
Alekseev, D.V., Mateyshina, Y.G., Komarov, V.Y., Sevast’yanova, E.V., and Uvarov, N.F., Synthesis and characterization of solid composite electrolytes LiClO4 – Nanodiamonds, Mater. Today: Proceedings, 2020, vol. 31, p. 576.
Maier, J., Heterogeneous solid electrolytes, Chandra, S. and Laskar, A., Eds, New York: Superionic Solids and Solid Electrolytes: Recent Trends Academic Press, 1989, p. 137.
Ulihin, A., Uvarov, N., Mateyshina, Y., Brezhneva, L., and Matvienko, A., Composite solid electrolytes LiClO4–Al2O3, Solid State Ionics, 2006, vol. 177, p. 2787.
Centeno, T.A., Hahn, M., Fernández, J.A., Kötz, R., and Stoeckli, F., Correlation between capacitances of porous carbons in acidic and aprotic EDLC electrolytes, Electrochem. Commun., 2007, vol. 9, p. 1242.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия