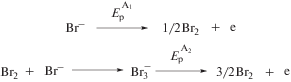Электрохимия, 2021, T. 57, № 2, стр. 110-118
Электрохимическое генерирование пиразолил-пиридильных N-гетероциклических карбеновых комплексов никеля
З. Н. Гафуров a, *, А. О. Кантюков b, А. А. Кагилев b, И. Ф. Сахапов a, Л. Лукони c, А. Россин c, Д. Джамбастиани b, c, В. М. Бабаев a, Д. Р. Исламов a, К. С. Усачев b, О. Г. Синяшин a, Д. Г. Яхваров a, b, **
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ “КазНЦ РАН”
420088 Казань, ул. Арбузова, 8, Россия
b Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
c Институт химии металлоорганических соединений (ICCOM-CNR), Polo Scientifico FI
50019 Флоренция, Via Madonna del Piano, 10, Италия
* E-mail: zufargo@gmail.com
** E-mail: yakhvar@iopc.ru
Поступила в редакцию 28.03.2020
После доработки 04.06.2020
Принята к публикации 29.06.2020
Аннотация
При использовании методов циклической вольтамперометрии и препаративного электролиза исследованы электрохимические свойства стерически загруженной имидазолиевой соли 3-(6-(1H-пиразол-1-ил)пиридин-2-ил)-1-(2,6-диизопропилфенил)-1H-имидазол-3-иум бромида, содержащей пиразолил-пиридильную группу, и осуществлено электрохимическое генерирование N-гетероциклических карбеновых комплексов никеля(II) в результате катодного восстановления данной соли в присутствии ионов никеля(II). Мониторинг препаративного электросинтеза методом масс-спектрометрии показал, что образующиеся никельорганические комплексы никеля могут содержать как один (в случае использования диафрагменного электролизера), так и два (при использовании ячейки без разделения анодного и катодного пространств, снабженной электрохимически растворимым никелевым анодом) N-гетероциклических карбеновых лиганда.
ВВЕДЕНИЕ
За последние десятилетия лиганды, содержащие N-гетероциклические карбеновые фрагменты, вызывают возрастающий интерес в области химии металлоорганических соединений [1, 2]. Благодаря уникальным свойствам N-гетероциклических карбенов (NHC), а именно их поразительному сходству с обогащенными электронами фосфинами (PR3), низкой токсичности, сильно выраженным σ-донорными свойствам, которые могут быть легко настроены при варьировании заместителей при атоме азота, а также электронным и стерическим эффектам, они являются незаменимыми лигандами в координационной химии и гомогенном катализе с участием комплексов переходных металлов [3–8]. Варьирование природы лиганда в комплексах переходных металлов путем использования соединений различной природы, в том числе хелатирующих, приводит к значительному изменению свойств металлокомплексов, включая их стабильность и реакционную способность. Интересно отметить, что на настоящий момент в современной химической науке наблюдается возрастающий интерес к использованию N-гетероциклических карбеновых комплексов никеля [2, 9–18], так как они являются существенно менее дорогими аналогами платины и палладия и при этом известны своей низкой токсичностью, а область их применения в катализе в последние годы стремительно увеличивается [19‒27]. Следует отметить, что на настоящий момент известны различные методы получения соединений данного класса, включая электрохимические [28]. Преимуществами электрохимического метода является то, что синтез протекает при комнатной температуре и вместо комплексов никеля в качестве прекурсора металла используется обычная металлическая пластина. В качестве растворителя обычно используется ацетонитрил, а растворенная в нем соль имидазолия несет функции как источника N-гетероциклического карбена, так и фонового электролита [2].
Целью настоящей работы явилось изучение электрохимических свойств стерически загруженной имидазолиевой соли 3-(6-(1H-пиразол-1-ил)пиридин-2-ил)-1-(2,6-диизопропилфенил)-1H-имидазол-3-иум бромида, содержащей пиразолил-пиридильную группу, и разработка методов электрохимического генерирования N-гетероциклических карбеновых комплексов никеля на ее основе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все эксперименты, связанные с подготовкой исходных реагентов и проведением электрохимических исследований, были выполнены в инертной атмосфере (азот) с использованием стандартной аппаратуры Шленка. Для проведения мониторинга электрохимического процесса, установления состава и строения продуктов электролиза использовался метод масс-спектрометрии с ионизацией электрораспылением (ESI). Образцы (объем 1 мл) для исследования методом масс-спектрометрии отбирались из рабочего раствора в противотоке азота. Ацетонитрил очищали трехкратной перегонкой в инертной атмосфере с добавлением небольшого количества перманганата калия. Имидазолиевую соль LHBr получали по ранее опубликованной методике [6]. Безводный дибромид никеля (Sigma Aldrich) использовался без дополнительной очистки.
Спектры ЯМР записаны на спектрометре высокого разрешения AVANCE-400 фирмы BRUKER на частоте 400.13 МГц. Элементный анализ соединений выполнен на CHNS-O высокотемпературном анализаторе EuroEA3028-HT-OM фирмы EUROVECTOR. Масс-спектры ESI получены на масс-спектрометре AmazonX (Bruker Daltonik GmbH, Бремен, Германия). Детектирование положительных и отрицательных ионов выполнено в интервале m/z от 100 до 2800. Напряжение на капилляре ±4500 В. В качестве газа-осушителя использовался азот с температурой 300°С и расходом 8 л/мин. Ввод образца осуществлялся со скоростью 10 мкл/мин при помощи шприцевого насоса. Данные ESI экспериментов обрабатывали с помощью программы DataAnalysis 4.0 (Bruker Daltonik GmbH, Бремен, Германия).
В исследованиях методом циклической вольтамперометрии (ЦВА) в качестве рабочего электрода использовали стационарный дисковый электрод из стеклоуглерода (СУ) с площадью рабочей поверхности 3.14 мм2. Вольтамперограммы (ЦВА-кривые) записывали при включении электрохимической ячейки по трехэлектродной схеме. Регистрацию ЦВА-кривых осуществляли в ацетонитриле на фоне 0.1 M (NBu4)BF4 при использовании потенциостата ПИ-50-1 при скорости линейной развертки потенциала 50 мВ/с. Программу развертки потенциала задавали с помощью компьютера при использовании аналогово-цифрового преобразователя Е14-440. Электродом сравнения служила система Ag/0.01 М AgNO3 в ацетонитриле (Е0(Fc/Fc+) = +0.20 B; относительно нас. к. э. +0.17 B). Все потенциалы в статье приведены относительно данного электрода сравнения. В качестве вспомогательного электрода использовали Pt-проволоку диаметром 1 мм. Измерения для имидазолиевой соли 3-(6-(1H-пиразол-1-ил)пиридин-2-ил)-1-(2,6-диизопропилфенил)-1H-имидазол-3-иум бромида (LHBr) проводили в термостатируемой (20°С) ячейке в атмосфере азота. При проведении эксперимента объем рабочего раствора был равен 5 мл, концентрация субстрата составляла 5 мМ. Для мониторинга протекания реакций методом ЦВА рабочий (СУ), вспомогательный (Pt-проволока) электроды и электрод сравнения (Ag/0.01 М AgNO3 в ацетонитриле) погружали в электрохимическую ячейку для препаративного электролиза. Значения потенциалов пиков, фиксируемых на ЦВА-кривых имидазолиевой соли и сгенерированного комплекса никеля на ее основе, приведены в табл. 1.
Таблица 1.
Потенциалы пиков (±0.01 В)* на ЦВА-кривых имидазолиевой соли LHBr в ацетонитриле (концентрация соли – 5 мМ, n-Bu4NBF4 – 0.1 M, рабочий электрод – СУ, скорость развертки – 50 мВ/с) и мониторинга препаративного электролиза LНBr в ацетонитриле в ячейке без разделения электродных пространств, снабженной электрохимически растворимым никелевым анодом (рабочий электрод – СУ, скорость развертки – 50 мВ/с)
| Катодные пики | $E_{{\text{p}}}^{{{\text{red}}}}$, В | Анодные пики | $E_{{\text{p}}}^{{{\text{ox}}}}$, В |
|---|---|---|---|
| С1 | –2.03 | А1 | +0.49 |
| С2 | +0.74 | А2 | +0.95 |
| С3 | –1.60 |
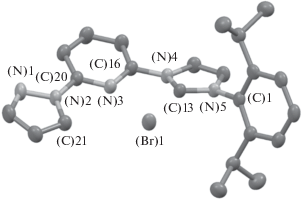
Бесцветные кристаллы соединения LHBr для рентгеноструктурного анализа (РСА) были получены перекристаллизацией из смеси ацетонитрил/гексан. Кристаллы (2C23H27${\text{N}}_{{\text{5}}}^{ + }$ × 2Br− × 0.25C6H14, M = = 197.70), триклинные, при 100 K a = 9.11201(19) Å, b = 15.3092(3) Å, c = 17.4661(4) Å, α = 77.5812(19)°, β = 83.7509(18)°, γ = 77.3230(18)°, V = 2316.60(9) Å3, Z = 2, пространственная группа P-1, dвыч = = 1.328 г см–3, μ = 2.559 мм–1, F(000) = 961. Параметры ячейки и экспериментальные данные получены при Т = 100 K на дифрактометре Rigaku XtaLab Synergy S [λ(CuKα) = 1.54184 Å], 2θ < < 153.37°, Rint = 0.037. Было измерено 65 817 отражений, из них 9273 независимых, число наблюдаемых отражений с I > 2σ(I) 8793. Использованные программы: CrysAlisPro, учет поглощения – ABSPACK, расшифровка структуры SHELXT [29], уточнение структуры методом наименьших квадратов SHELXL-2014 [30] в пакете программ Olex2 [31]. Кристаллографические данные структуры LHBr депонированы в Кембриджской базе кристаллоструктурных данных (http://www.ccdc.cam.ac.uk; номер депозита CCDC 2007790).
Электрохимическое генерирование N-гетероциклического карбенового комплекса никеля(II), содержащего два N-гетероциклических карбеновых лиганда ([Ni(Lc)2]2+), проводили в электрохимической ячейке без разделения электродных пространств рабочим объемом 40 мл. В качестве катода использовалась платина (площадь рабочей поверхности 50 см2), анод – никелевый стержень. Раствор для электролиза готовили растворением имидазолиевой соли LHBr (100 мг, 0.221 ммоль) в ацетонитриле (30 мл). После этого через электролит пропускали постоянный ток силой 50 мА (плотность тока 1 мА/см2) в течение 15 мин при комнатной температуре при постоянном перемешивании раствора. В процессе электролиза фиксировалось изменение цвета рабочего раствора от желтого до коричневого. После окончания электролиза раствор был отфильтрован для удаления образовавшегося осадка и растворитель был упарен в вакууме. Остаток представлял собой коричневый порошок комплекса [Ni(Lc)2]Br2 (выход по току 78%). Элементный анализ: найдено для C46H52Br2N10Ni (%): С, 57.34; Н, 5.44; N, 14.54; вычислено (%): С, 57.85; Н, 5.75; N, 14.25.
Электрохимическое генерирование N-гетероциклического карбенового комплекса никеля(II) с одним N-гетероциклическим карбеновым лигандом [Ni(Lc)Br]+ проводили в подобной электрохимической ячейке (рабочий объем 45 мл), но снабженной пористой керамической диафрагмой DURAN (пористость 3, 16–40 мкм) для разделения анодного и катодного пространств. Раствор для катодного пространства получали смешиванием раствора дибромида никеля (48.3 мг, 0.221 ммоль) в ацетонитриле (15 мл) с раствором имидазолиевой соли LHBr (100 мг, 0.221 ммоль) в ацетонитриле (15 мл). Анолит – раствор дибромида никеля (24.3 мг, 0.111 ммоль) в ацетонитриле (15 мл). После этого через электролит пропускали постоянный ток силой 50 мА (плотность тока 1 мА/см2) в течение 8 мин при комнатной температуре при постоянном перемешивании раствора. В процессе электролиза фиксировалось изменение цвета раствора катодного пространства от зеленого до коричнево-желтого. Цвет раствора анодного пространства (голубой) не изменялся.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
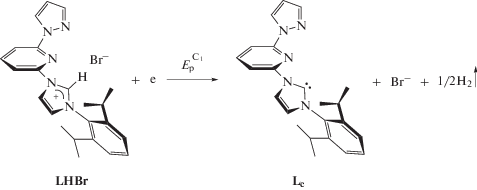
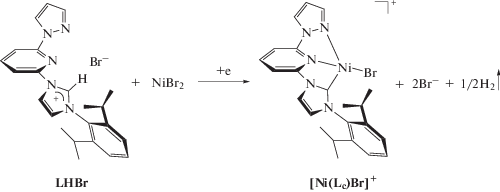
Для электрохимического генерирования N-гетероциклического карбена Lc использовалась полученная нами ранее имидазолиевая соль LHBr [6]. Исследование электрохимических свойств и механизма образования N-гетероциклических карбеновых комплексов никеля проводили при использовании метода ЦВА, препаративного электролиза и масс-спектрометрии. На ЦВА-кривой имидазолиевой соли LHBr (рис. 1) при сканировании потенциала рабочего электрода в сторону катодных значений наблюдается один необратимый пик восстановления С1, который, согласно литературным данным, соответствует образованию карбеновой частицы Lc и молекулярного водорода (схема 1 ) [28]. В то же время на ЦВА-кривой наблюдаются два анодных пика окисления А1 и А2, имеющие пик ревосстановления С2, соответствующие окислению бромид-анионов (схема 2 ) [32, 33].
Рис. 1.
ЦВА-кривая имидазолиевой соли (LНBr) (5 мМ) в ацетонитриле в присутствии n-Bu4NBF4 (0.1 M) (рабочий электрод – СУ, скорость развертки – 50 мВ/с). Развертка потенциала от 0.00 до –2.30 В, обратно до +1.20 В и далее до 0.00 В (сплошная линия); от 0.00 до +1.20 В, далее до –2.30 В и обратно до 0.00 В (пунктир).

Ранее нами был описан синтез палладиевых N‑гетероциклических комплексов на основе данной имидазолиевой соли [6]. Методика включала обработку LHBr оксидом серебра (Ag2O) для активации соли имидазолия с получением соответствующего соединения AgI‑NHC. Дальнейшее трансметаллирование с использованием PdCl2(PhCN)2 в качестве прекурсора палладия приводило к получению N-гетероциклического карбенового комплекса палладия [Pd(Lc)Cl]Cl в виде аналитически чистых светло-коричневых микрокристаллов с выходом 88% [6].
Интересно отметить, что, используя данную методику и NiCl2(DME), где DME = диметоксиэтан, в качестве прекурсора никеля, получить N‑гетероциклический комплекс никеля не удалось. Тогда было решено провести электрохимический синтез данного комплекса.
Схема 1 .
Схема 2 .
Электрохимическое генерирование N-гетероциклических карбеновых комплексов никеля на основе имидазолиевой соли LHBr и изучение динамики данного процесса было проведено при использовании ЦВА-мониторинга препаративного электролиза раствора LHBr в ацетонитриле в ячейке без разделения анодного и катодного пространств, снабженной электрохимически растворимым никелевым анодом. Так, на рис. 2 представлены ЦВА-кривые, соответствующие раствору LHBr в ацетонитриле (0 мин), рабочему раствору после 5 и 10 мин от начала электролиза (5 и 10 мин, соответственно) и конечной реакционной смеси после окончания электролиза (15 мин). Таким образом было обнаружено, что при пропускании электричества через раствор электролита на ЦВА-кривой наблюдается уменьшение тока при потенциале С1, что говорит об уменьшении концентрации LHBr в растворе; также через 5 мин от начала электролиза на ЦВА-кривой наблюдается образование нового необратимого катодного пика восстановления С3, который продолжает расти при дальнейшем пропускании электричества через раствор.
Рис. 2.
Мониторинг препаративного электролиза имидазолиевой соли (LНBr) в ацетонитриле в ячейке без разделения электродных пространств, снабженной растворимым никелевым анодом, методом ЦВА (рабочий электрод – СУ, скорость развертки – 50 мВ/с). Представлены ЦВА до начала электролиза (0 мин), 5, 10 и 15 мин от начала электролиза соответственно. Развертка потенциала от 0.00 до –2.40 В, обратно до +1.30 В и далее до 0.00 В.
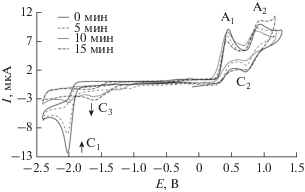
Для установления природы продуктов, образующихся в ходе электрохимического процесса, был использован метод масс-спектрометрии. Так, на рис. 3 представлен мониторинг электрохимического генерирования N-гетероциклического карбенового комплекса никеля. На представленных масс-спектрах реакционной смеси наблюдается уменьшающийся в интенсивности пик молекулярного иона m/z 372.2, который соответствует иону исходной имидазолиевой соли [LH]+. Также в масс-спектрах зарегистрирован увеличивающийся в интенсивности пик молекулярного иона m/z 400.2, соответствующий комплексу [Ni(Lc)2]2+.
Рис. 3.
Мониторинг препаративного электролиза имидазолиевой соли (LНBr) в ацетонитриле методом масс-спектрометрии с ионизацией электрораспылением (ESI). Представлены масс-спектры до начала электролиза (0 мин), 5, 10 и 15 мин от начала электролиза соответственно.
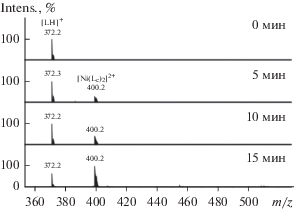
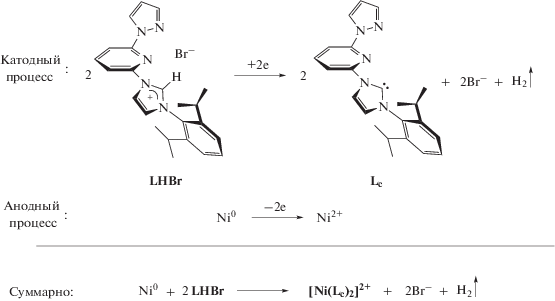
Таким образом, было установлено, что электролиз раствора LHBr в ацетонитриле в ячейке без разделения электродных пространств, с использованием растворимого никелевого анода, в качестве источника ионов никеля(II), приводит к образованию N-гетероциклического карбенового комплекса никеля(II), содержащего два N-гетероциклических карбеновых лиганда ([Ni(Lc)2]2+) по реакции, представленной на схеме 3 . На рис. 4а представлены теоретическое и экспериментально полученное изотопные распределения для данного соединения.
Схема 3 .
Рис. 4.
Теоретические и экспериментальные изотопные распределения для ионов [Ni(Lc)2]2+ (а) и [Ni(Lc)Br]+ (б).
Проведение мониторинга электрохимического процесса методом 1H ЯМР-спектроскопии с использованием дейтерированного ацетонитрила подтвердило исчезновение типичного сигнала имидазолиевого протона (δH = 10.11 м. д.), однако образование парамагнитного комплекса никеля [Ni(Lc)2]Br2 затрудняет подробный анализ полученных спектров.
Установлено, что образующийся в реакционной смеси комплекс никеля является нестабильным и разлагается в растворе со временем (полное разложение комплекса было зафиксировано через 24 ч методом масс-спектрометрии) с образованием исходной имидазолиевой соли LHBr. Таким образом, попытка кристаллизации полученного комплекса из раствора ацетонитрила привела к образованию кристаллов исходного соединения LHBr, для которых был проведен рентгеноструктурный анализ (рис. 5).
Было найдено, что соединение LHBr кристаллизуется в пространственной группе P-1 с 2 молекулами на элементарную ячейку. Стоит отметить короткие контакты C−H···Br в кристалле с участием пиразольного фрагмента и атома брома [d(C···Br) = 3.81 Å] и имидазолиевого фрагмента с бромом [d(C···Br) = 3.50 Å]. Избранные длины связей (d) и валентные углы (ω) соединения LHBr в кристалле представлены в табл. 2.
Таблица 2.
Избранные длины связей (d) и валентные углы (ω) в соединении LHBr
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| C1–N5 | 1.447(7) | C1–N5–C13 | 127.8(8) |
| N5–C13 | 1.334(1) | N5–C13–N4 | 107.3(1) |
| C13–N4 | 1.349(5) | C13–N4–C16 | 123.9(2) |
| N4–C16 | 1.427(2) | N3–C20–N2 | 114.9(5) |
| C20–N2 | 1.398(4) |
Интересно отметить, что в масс-спектрах реакционной смеси, полученных в ходе электрохимического восстановления соли LHBr в ячейке с разделением анодного и катодного пространств в присутствии одного эквивалента дибромида никеля наблюдается пик иона m/z 510.1, соответствующий N-гетероциклическому карбеновому комплексу никеля(II) с одним N-гетероциклическим карбеновым лигандом и одним бромидом в координационной сфере ([Ni(Lc)Br]+) (рис. 4б). Электрохимическим процессом окисления в данном случае также является образование ионов Ni2+ в результате растворения никелевого анода. Таким образом, было показано, что условия электролиза позволяют изменять стехиометрию процесса, давая возможность генерировать комплексы никеля с заданным числом N-гетероциклических карбеновых лигандов в координационной сфере (схема 4 ).
Схема 4 .
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проведенных исследований было установлено, что электрохимическое восстановление стерически загруженной пиразолил-пиридильной имидазолиевой соли 3‑(6-(1H-пиразол-1-ил)пиридин-2-ил)-1-(2,6-ди-изопропилфенил)-1H-имидазол-3-иум бромида на платиновом электроде приводит к образованию N-гетероциклического карбенового интермедиата, способного в присутствии ионов никеля(II) образовывать N-гетероциклические карбеновые комплексы никеля. Показано, что условия проведения эксперимента оказывают существенное влияние на природу продуктов электрохимических превращений. Так проведение препаративного электролиза в бездиафрагменном электролизере, снабженном электрохимически растворимым никелевым анодом, приводит к образованию никель-органических комплексов, содержащих два N‑гетероциклических карбеновых лиганда, а использование диафрагмы позволяет получить комплексы никеля(II) с одним N-гетероциклическим карбеновым лигандом. Полученные результаты позволяют использовать разработанный электрохимический метод генерирования N-гетероциклических карбеновых комплексов никеля для получения важных типов каталитических систем, которые нашли широкое применение в процессах олиго- и полимеризации ненасыщенных углеводородов, а также в реакциях кросс- и гомо-сочетания с образованием практически востребованных химических соединений.
Список литературы
Гафуров, З.Н., Кагилев, А.А., Кантюков, А.О., Балабаев, А.А., Синяшин, О.Г., Яхваров, Д.Г. Классификация и методы получения пинцерных комплексов никеля. Изв. Академии наук. Сер. химическая. 2018. № 3. С. 385. [Gafurov, Z.N., Kagilev, A.A., Kantyukov, A.O., Balabaev, A.A., Sinyashin, O.G., and Yakhvarov, D.G., Classification and synthesis of nickel pincer complexes, Russ. Chem. Bull., 2018, vol. 67, p. 385.]
Гафуров, З.Н., Кантюков, А.О., Кагилев, А.А., Балабаев, А.А., Синяшин, О.Г., Яхваров, Д.Г. N-Гетероциклические карбеновые комплексы никеля и палладия: синтез и каталитическое применение в реакциях сочетания. Изв. Академии наук. Сер. химическая. 2017. № 9. С. 1529. [Gafurov, Z.N., Kantyukov, A.O., Kagilev, A.A., Balabaev, A.A., Sinyashin, O.G., and Yakhvarov, D.G., Nickel and palladium N-heterocyclic carbene complexes. Synthesis and application in cross-coupling reactions, Russ. Chem. Bull., 2017, vol. 66, p. 1529.]
Mercs, L. and Albrecht, M., Beyond catalysis: N-heterocyclic carbene complexes as components for medicinal, luminescent, and functional materials applications, Chem. Soc. Rev., 2010, vol. 39, p. 1903.
Díez-Gonzlez, S., Marion, N., and Nolan, S.P., N‑heterocyclic carbenes in late transition metal catalysis, Chem. Rev., 2009, vol. 109, p. 3612.
Poyatos, M., Mata, J.A., and Peris, E., Complexes with poly(N-heterocyclic carbene) ligands: Structural features and catalytic applications, Chem. Rev., 2009, vol. 109, p. 3677.
Luconi, L., Gafurov, Z., Rossin, A., Tuci, G., Sinya-shin, O., Yakhvarov, D., and Giambastiani, G., Palladium(II) pyrazolyl–pyridyl complexes containing a sterically hindered N-heterocyclic carbene moiety for the Suzuki-Miyaura cross-coupling reaction, Inorg. Chim. Acta, 2018, vol. 470, p. 100.
Karaca, E.Ö., Akkoç, M., Yasar, S., and Özdemir, I., Pd-N-Heterocyclic carbene catalysed Suzuki-Miyaura coupling reactions in aqueous medium, Arkivoc, 2018, vol. 5, p. 230.
Şahin, N., PEPPSI-type 2-methyl-2-propenyl-functionalized N-heterocyclic carbene-palladium complexes: Synthesis, structural characterization and catalytic activity on Suzuki–Miyaura reaction, J. Mol. Struct., 2019, vol. 1177, p. 193.
McGuinness, D.S., Cavell, K.J., Skelton, B.W., and White, A.H., Zerovalent Palladium and Nickel Complexes of Heterocyclic Carbenes: Oxidative Addition of Organic Halides, Carbon-Carbon Coupling Processes, and the Heck Reaction, Organometallics, 1999, vol. 18, p. 1596.
Inamoto, K., Kuroda, J., Sakamoto, T., and Hiroya, K., Catalytic activities of a bis(carbene)-derived nickel(II)-pincer complex in Kumada-Tamao-Corriu and Suzuki-Miyaura coupling reactions for the synthesis of biaryl compounds, Synthesis, 2007, vol. 18, p. 2853.
Lee, C.C., Ke, W.C., Chan, K.T., Lai, C.L., Hu, C.H., and Lee, H.M., Nickel(II) complexes of bidentate N‑heterocyclic carbene/phosphine ligands: Efficient catalysts for suzuki coupling of aryl chlorides, Chem. Eur. J., 2007, vol. 13, p. 582.
Xi, Z.X., Zhang, X.M., Chen, W.Z., Fu, S.Z., and Wang, D.Q., Synthesis and structural characterization of nickel(II) complexes supported by pyridine-functionalized N-heterocyclic carbene ligands and their catalytic acitivities for suzuki coupling, Organometallics, 2007, vol. 26, p. 6636.
Han, F.S., Transition-metal-catalyzed Suzuki-Miyaura cross-coupling reactions: A remarkable advance from palladium to nickel catalysts, Chem. Soc. Rev., 2013, vol. 42, p. 5270.
Inamoto, K., Kuroda, J. I., Kwon, E., Hiroya, K., and Doi, T., Pincer-type bis(carbene)-derived complexes of nickel(II): Synthesis, structure, and catalytic activity, J. Organomet. Chem., 2009, vol. 694, p. 389.
Inamoto, K., Kuroda, J. I., Hiroya, K., Noda, Y., Watanabe, M., and Sakamoto, T., Synthesis and catalytic activity of a pincer-type bis(imidazolin-2-ylidene) nickel(II) complex, Organometallics, 2006, vol. 25, p. 3095.
Tu, T., Mao, H., Herbert, C., Xu, M., and Dötz, K.H., A pyridine-bridged bis-benzimidazolylidene pincer nickel(II) complex: Synthesis and practical catalytic application towards Suzuki-Miyaura coupling with less-activated electrophiles, Chem. Commun., 2010, vol. 46, p. 7796.
Xu, M., Li, X., Sun, Z., and Tu, T., Suzuki-Miyaura cross-coupling of bulky anthracenyl carboxylates by using pincer nickel N-heterocyclic carbene complexes: An efficient protocol to access fluorescent anthracene derivatives, Chem. Commun., 2013, vol. 49, p. 11539.
Zhou, Y., Xi, Z., and Chen, W., Dinickel(II) complexes of bis(N-heterocyclic carbene) ligands containing [Ni2(μ-OH)] cores as highly efficient catalysts for the coupling of aryl chlorides, Organometallics, 2008, vol. 27, p. 5911.
Chiu, P.L., Lai, C.L., Chang, C.F., Hu, C.H., and Lee, H.M., Synthesis, structural characterization, computational study, and catalytic activity of metal complexes based on tetradentate pyridine/N-heterocyclic carbene ligand, Organometallics, 2005, vol. 24, p. 6169.
Wolf, J., Labande, A., Daran, J.C., and Poli, R., Nickel(II) complexes with bifunctional phosphine-imidazolium ligands and their catalytic activity in the Kumada-Corriu coupling reaction, J. Organomet. Chem., 2006, vol. 691, p. 433.
Schneider, S.K., Rentzsch, C.F., Krueger, A., Raubenheimer, H.G., and Herrmann, W.A., Pyridin- and quinolinylidene nickel carbene complexes as effective catalysts for the Grignard cross-coupling reaction, J. Mol. Catal. A: Chem., 2007, vol. 265, p. 50.
Xi, Z.X., Zhou, Y.B., and Chen, W.Z., Efficient Negishi coupling reactions of aryl chlorides catalyzed by binuclear and mononuclear nickel-N-heterocyclic carbene complexes, J Org Chem., 2008, vol. 73, p. 8497.
Сахапов, И.Ф., Гафуров, З.Н., Бабаев, В.М., Курмаз, В.А., Мухаметбареев, Р.Р., Ризванов, И.Х., Синяшин, О.Г., Яхваров, Д.Г. Электрохимические свойства и реакционная способность никельорганического сигма-комплекса [NiBr(Mes)(bpy)] (Mes = 2,4,6-триметилфенил, bpy = 2,2'-бипиридил). Электрохимия. 2015. Т. 51. С. 1197. [Sakhapov, I.F., Gafurov, Z.N., Babaev, V.M., Kurmaz, V.A., Mukhametbareev, R.R., Rizvanov, I.Kh., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical properties and reactivity of organonickel sigma-complex [NiBr(Mes)(bpy)] (Mes = 2,4,6-trimethylphenyl, bpy = 2,2'-bipyridine), Russ. J. Electrochem., 2015, vol. 51, p. 1061.]
Гафуров, З.Н., Сахапов, И.Ф., Бабаев, В.М., Добрынин, А.Б., Курмаз, В.А., Метлушка, К.Е., Ризванов, И.Х., Шайхутдинова, Г.Р., Синяшин, О.Г., Яхваров, Д.Г. Исследование реакционной способности никельорганических сигма-комплексов по отношению к нитрилам. Изв. Академии наук. Сер. химическая. 2017. № 2. С. 254. [Gafurov, Z.N., Sakhapov, I.F., Babaev, V.M., Dobrynin, A.B., Kurmaz, V.A., Metlushka, K.E., Rizvanov, I.K., Shaikhutdinova, G.R., Sinyashin, O.G., and Yakhvarov, D.G., Study of the reactivity of organonickel sigma-complexes towards nitriles, Russ. Chem. Bull., 2017, vol. 66, p. 254.]
Gafurov, Z.N., Musin, L.I., Sakhapov, I.F., Babaev, V.M., Musina, E.I., Karasik, A.A., Sinyashin, O.G., and Yakhvarov, D.G., The formation of secondary arylphosphines in the reaction of organonickel sigma-complex [NiBr(Mes)(bpy)], where Mes = 2,4,6-trimethylphenyl, bpy = 2,2'-bipyridine, with phenylphosphine, Phosphorus, Sulfur Silicon Relat. Elem., 2016, vol. 191, p. 1475.
Sakhapov, I.F., Gafurov, Z.N., Babaev, V.M., Rizvanov, I.Kh., Dobrynin, A.B., Krivolapov, D.B., Khayarov, Kh.R., Sinyashin, O.G., and Yakhvarov, D.G., First example of organonickel complex bearing three cyclic substituents in the σ-bonded aromatic ring: Bromo[(2,2'-bipyridine)-2,4,6-tricyclohexylphenylnickel], Mendeleev Commun., 2016, vol. 26, p. 131.
Gafurov, Z.N., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical methods for synthesis of organoelement compounds and functional materials, Pure Appl. Chem., 2017, vol. 89, p. 1089.
Liu, B., Zhang, Y., Xu, D., and Chen, W., Facile synthesis of metal N-heterocyclic carbene complexes, Chem. Commun., 2011, vol. 47, p. 2883.
Sheldrick, G.M., SHELXT: Integrating space group determination and structure solution, Acta Crystallogr., 2015, vol. 71, p. 3.
Sheldrick, G.M., A Short History of SHELX, Acta Crystallogr., 2007, vol. 64, p. 112.
Dolomanov, O.V., Bourhis, L.J., Gildea, R.J., Howard, J.A.K., and Puschmann, H.J., OLEX2: A Complete Structure Solution, Refinement and Analysis Program, Appl. Cryst., 2009, vol. 42, p. 339.
Iwasita, T. and Giordano, M.C., Kinetics of the bromine-tribromide-bromide redox processes on platinum electrodes in acetonitrile solutions, Electrochim. Acta, 1969, vol. 14, p. 1045.
Khusnuriyalova, A.F., Petr, A., Gubaidullin, A.T., Sukhov, A.V., Morozov, V.I., Büchner, B., Kataev, V., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical generation and observation by magnetic resonance of superparamagnetic cobalt nanoparticles, Electrochim. Acta, 2018, vol. 260, p. 324.
Дополнительные материалы отсутствуют.