Электрохимия, 2021, T. 57, № 2, стр. 96-109
Электрохимические характеристики модифицированной гетерогенной биполярной мембраны и электромембранного процесса рекуперации азотной кислоты и гидроксида натрия из раствора нитрата натрия и борной кислоты
Н. В. Ковалев a, Т. В. Карпенко a, Н. В. Шельдешов a, *, В. И. Заболоцкий a, **
a Кубанский государственный университет
Краснодар, Россия
* E-mail: sheld_nv@mail.ru
** E-mail: vizab@chem.kubsu.ru
Поступила в редакцию 11.05.2020
После доработки 11.05.2020
Принята к публикации 19.06.2020
Аннотация
Методом частотного спектра электрохимического импеданса исследованы характеристики биполярной мембраны аМБ-2м, содержащей каталитически активный в реакции диссоциации воды ионполимер с фосфорнокислотными группами. Исследование выполнено в системе 0.1 М азотная кислота–0.1 М гидроксид натрия. Показано, что сопротивление биполярной области мембраны аМБ-2м более чем на порядок меньше, чем сопротивление биполярных областей промышленных мембран МБ-1 и МБ-2. Исследован процесс получения азотной кислоты и гидроксида натрия из 0.5 М раствора нитрата натрия, а также из 0.5 М раствора нитрата натрия в присутствии 0.75 М борной кислоты в электродиализном аппарате с трехкамерными элементарными ячейками, состоящими из катионообменной мембраны Ralex CMH, биполярной мембраны аМБ-2м и анионообменной мембраны Ralex AMH. Показано, что электрохимические характеристики (выход по току, удельные энергозатраты и удельная производительность) практически не изменяются в присутствии борной кислоты, а ее перенос в кислотные и щелочные камеры электродиализатора не превышает 7%. Предложен вероятный механизм переноса борной кислоты и боратных ионов через ионообменные мембраны в щелочную и кислотную камеры.
ВВЕДЕНИЕ
Бор в окружающей среде содержится в геотермальных водах, подземных водах, в морской и речной воде [1, 2]. Источниками поступлений соединений бора в гидросферу, атмосферу и биосферу являются как природные процессы, так и антропогенные факторы [2]. Являясь жизненно необходимым микроэлементом для человеческого организма, в больших количествах он токсичен, поэтому Всемирная организация здравоохранения, Российская Федерация и Европейский союз установили максимальное допустимое содержание бора в питьевой воде равным 0.5 мг/л [3], 0.5–0.3 мг/л [4, 5] и 1 мг/л соответственно [3]. Соединения бора применяются в различных отраслях промышленности: при производстве стекла, эмали, керамики, синтетических моющих средств, ингибиторов коррозии, микроудобрений, в атомной энергетике [2]. Его соединения содержатся в технологических отходах таких производств, особенно велика его концентрация в некоторых типах жидких радиоактивных отходов (ЖРО). Утечка соединений бора из хранилищ таких отходов в окружающую среду недопустима, так как избыточное содержание бора оказывает негативное влияние на экосистемы [6–10].
Анализ процессов удаления бора из вод с большим его содержанием с целью получения питьевой воды показал, что только традиционные методы удаления бора, такие как коагуляция, осаждение и фильтрация [11], для этого не достаточны. Использование мембранных методов (обратного осмоса, нанофильтрации, ультрафильтрации, электродиализа) в сочетании с традиционными методами [12–26] позволяет снизить концентрацию бора до безопасного уровня. Достичь снижения содержания бора в получаемой воде удается при условии регулирования рН воды для того, чтобы при рН в диапазоне 8.5–11, когда он находится в форме аниона, удалить его из воды электродиализом через анионообменную мембрану [13–16] или предотвратить его проникновение в пермеат при использовании баромембранных методов [14, 18–20]. Другим методом предотвращения переноса соединений бора в пермеат является связывание их в комплекс с гидроксилсодержащими полимерами [12, 24], сорбция на микросферических сорбентах с последующей микрофильтрацией [24], или в эфиры борной кислоты [23]. Для получения воды с малым содержанием бора из морской воды можно использовать мембранную дистилляцию [26]. Селективное выделение из воды однозарядных борсодержащих анионов возможно в случае применения однозарядно-селективных анионообменных мембран [15]. Снизить содержания бора в воде, обессоленной методом обратного осмоса, позволяет использование бор-селективных анионообменников [17, 20, 22, 25]. Борную кислоту можно удалять из раствора методом доннановского диализа [21].
Методы, применяемые для получения обессоленной и питьевой воды из природных вод используются и для переработки ЖРО, как не содержащих соединения бора [27–29], так и борсодержащих [30–33]. Борсодержащие ЖРО, образующиеся на АЭС с водо-водяными энергетическими реакторами, в отличие от природных вод имеют значительно более сложный состав, так как содержат изотопы и в значительно более высоких концентрациях минеральные соли и соединения бора [34]. Есть два подхода к извлечению бора из ЖРО с помощью электродиализа. Первый подход связан с применением биполярного электродиализа и позволяет выделить и сконцентрировать из исходного раствора бор [35–38]. Для этого вначале в исходном растворе с помощью биполярных мембран (БПМ) повышают pH для перевода молекулярной формы борной кислоты в бораты, затем боратные анионы переносятся через анионообменную мембрану в кислотную камеру, где они переходят при взаимодействии с ионами водорода, генерируемыми биполярной мембраной, снова в борную кислоту, которую можно вторично использовать. Недостатком такого метода является низкий выход по току боратных анионов из-за конкурентного переноса других анионов, присутствующих в ЖРО. Другой подход связан с понижением рН ЖРО, удалением солей, не содержащих бор, из ЖРО и, тем самым, с получением раствора борной кислоты. Такой процесс проводят в электродиализных аппаратах с биполярными мембранами, мембранный пакет которых образован трехкамерными элементарными ячейками [39, 40]. При этом из подкисленного раствора ЖРО, циркулирующего через солевые камеры аппарата, в котором бор находится в виде борной кислоты, удаляются соли, не содержащие бор. Из этих солей в соседних камерах каждой элементарной ячейки образуются кислоты и щелочи. В результате процесса получают полезные продукты (кислоты, щелочи, борную кислоту), которые можно повторно использовать. В основном технико-экономические характеристики такого процесса определяются электрохимическими характеристиками биполярных мембран.
Биполярные мембраны широко применяются в настоящее время для получения кислот и щелочей из солей [41]. Так процесс получения соляной кислоты и гидроксида натрия в электродиализаторе с гетерогенными биполярными мембранами был исследован в работах [42–47], серной кислоты и гидроксида натрия из сульфата натрия – в [48–51], азотной кислоты и гидроксида натрия из нитрата натрия – в [50, 52], азотной кислоты и аммиака из солей аммония – в [53, 54], смеси азотной и фтороводородной кислот из нейтрализованных стоков, образующихся при травлении стали – в [55–57]. Получение органических кислот и оснований из продуктов биохимического синтеза исследовано в [58, 59].
Биполярные мембраны состоят из катионообменного слоя, анионообменного слоя и биполярной области, где локализуется область пространственного заряда (ОПЗ) и происходит реакция диссоциации молекул воды. Биполярные мембраны подразделяются на гомогенные и гетерогенные. Гомогенные БПМ имеют более высокие электрохимические характеристики, однако они дороже, чем гетерогенные. Обзор методов их получения и характеристики даны в [60, 61]. Гетерогенные биполярные мембраны дешевле и доступнее. Их получают методом горячего прессования или вальцеванием катионообменных и анионообменных мембран [62–64], а также нанесением методом полива раствора ионполимера с противоположно заряженными ионогенными группами на промышленные монополярные мембраны [65–67]. Для улучшения электрохимических свойств биполярных мембран в их биполярную область вносят каталитические добавки, которые ускоряют реакцию диссоциации молекул воды, среди них наибольшей активностью обладают ион-полимеры [65–69], гидроксиды и соли тяжелых металлов [70], оксид графена [71, 72] и металлоорганические комплексы [73].
В данной работе исследованы электрохимические характеристики модифицированной биполярной мембраны, содержащей ионполимер с каталитически активными в реакции диссоциации молекул воды фосфорнокислотными группами [70], а также процесс рекуперации азотной кислоты и гидроксида натрия из раствора нитрата натрия и из раствора нитрата натрия, содержащего борную кислоту.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве биполярной мембраны в данной работе использовалась полученная авторами данной работы модифицированная гетерогенная биполярная мембрана аМБ-2м (табл. 1). Эта мембрана была изготовлена методом горячего прессования гетерогенных мембран – катионообменной Ralex CMH и анионообменной Ralex AMH, причем перед прессованием на поверхность катионообменной мембраны наносился слой порошка ионполимера – катионообменника КФ-1, содержащего фосфорнокислотные группы [70]. Фосфорнокислотные группы, находясь в биполярной области мембраны, ускоряют реакцию диссоциации молекул воды [69] и снижают напряжения на биполярной мембране. Без внесения в биполярную область порошка катионообменника КФ-1 горячим прессованием гетерогенных мембран Ralex CMH и Ralex AMH получали аналог промышленной биполярной мембраны МБ-2 – биполярную мембрану аМБ-2. Эти мембраны в катионообменных слоях имеют одни и те же ионогенные группы – сульфогруппы, как и в анионообменных слоях – одни и те же ионогенные группы – четвертичные аммониевые группы.
Таблица 1.
Типы исходных катионообменных и анионообменных мембран, используемых для производства промышленных биполярных мембран (МБ-1, МБ-2 и МБ-3), аналога промышленной мембраны МБ-2 (аМБ-2) и модифицированной биполярной мембраны аМБ-2м
| Марка БПМ | Слой БПМ [62, 74]: Катионообменный слой Анионообменный слой Каталитическая добавка |
Тип ионообмен-ника [74] | Ионообменные группы в слоях [62, 63] | Толщина, мм [63] | Полная обменная емкость ионообменника, мг-экв./мл [75, 76] |
|---|---|---|---|---|---|
| МБ-1 | МК-40 | KУ-2 | –SO3H | 1 | 1.8 |
| МА-40 | ЭДЭ-10П | ≡N, =NH, –NH2 | 2.3 | ||
| – | – | – | – | ||
| МБ-2 | МК-40 | KУ-2 | –SO3H | 0.9 | 1.8 |
| МА-41 | AВ-17 | –N+(CH3)3 | 1.0–1.2 | ||
| – | – | – | – | ||
| МБ-3 | МК-41 | KФ-1 | –PO3H2 | 1 | 5 мг-экв./г [77] |
| МА-41 | AВ-17 | –N+(CH3)3 | 1.0–1.2 | ||
| – | – | – | – | ||
| аМБ-2 | Ralex CМH | – | –SO3H | 0.66 | – |
| Ralex AMH | – | –N+(CH3)3 | – | ||
| – | – | – | – | ||
| аМБ-2м | Ralex CМH | – | –SO3H | 0.66 | – |
| Ralex AMH | – | –N+(CH3)3 | – | ||
| Каталитическая добавка | KФ-1 | –PO3H2 | 5 мг-экв./г [77] |
Для определения степени резкости перехода в модифицированной биполярной мембране аМБ-2м от катионообменного к анионообменному слою (биполярная область) были получены электронно-микроскопические снимки среза этой мембраны с помощью сканирующего электронного микроскопа JEOL 7502. Образец исследуемой мембраны охлаждали в жидком азоте в течение 3–5 мин и разрезали стальным лезвием при температуре жидкого азота. Далее на срез в вакууме напыляли тонкий слой хрома толщиной 10 нм методом магнетронного напыления для предотвращения накопления электрического заряда на поверхности образца в процессе его электронно-микроскопического исследования. Методом локального рентгеноспектрального микроанализа было определено распределение ионов натрия и хлора, которые являются противоионами в катионообменном и анионообменном слоях, и атомов фосфора, содержащихся в ионогенных группах каталитической добавки, которая находилась в водородной форме (рис. 1). В биполярной области определяются контакты между частицами катионообменника (в том числе частицами каталитической добавки с фосфорнокислотными группами (рис. 1)) и частицами анионообменника. В области таких контактов и происходит реакция диссоциации молекул воды. О резкости перехода от катионообменного к анионообменному слою в биполярной области свидетельствует отсутствие смешения зон, в которых находится катионообменник, каталитическая добавка и анионообменник (рис. 1).
Рис. 1.
Электронно-микроскопическое изображение скола биполярной мембраны аMБ-2м в области биполярной границы. Слева на снимке расположен катионообменный слой в натриевой форме, справа – анионообменный слой в хлоридной форме. В биполярной области расположены частицы ионполимера, содержащие фосфорнокислотные группы в водородной форме. Присутствие атомов натрия (квадраты), фосфора (треугольники) и хлора (круги) установлено локальным рентгеноспектральным микроанализом.

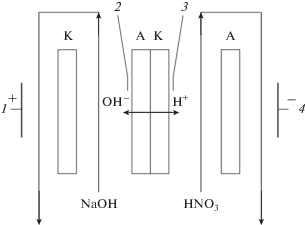
Электрохимические характеристики биполярной мембраны аMБ-2м (табл. 1) были исследованы в системе, содержащей 0.1 М HNO3 и 0.1 М NaOH, методом электрохимического импеданса в четырехэлектродной электрохимической ячейке (рис. 2). В качестве вспомогательных ионообменных мембран при измерении частотных спектров электрохимического импеданса использовались гетерогенные катионообменные мембраны МК-40 и анионообменные мембраны МА-41 [74].
Рис. 2.
Схема электрохимической ячейки для измерения частотных спектров электрохимического импеданса биполярной мембраны. К – катионообменная мембрана МК-40; А – анионообменная мембрана МА-41; АК – исследуемая биполярная мембрана, 1 и 4 – электроды, поляризующие исследуемую биполярную мембрану по постоянному и переменному току, 2 и 3 – потенциальные электроды для измерения разности потенциалов на мембране по переменному току.
Измерения проводились в стационарном режиме при температуре 25 ± 2°С, как в отсутствие наложенного постоянного электрического тока, так и при его протекании через БПМ в режиме генерации ионов водорода и гидроксила.
Спектры импеданса получали с помощью потенциостата-гальваностата AUTOLAB 100N с модулем измерения частотного импеданса FRA32M в гальваностатическом режиме при плотностях тока 0–2.6 А/дм2. Диапазон частот спектров электрохимического импеданса составлял от 0.1 до 1 000 000 Гц, распределенных равномерно в логарифмическом масштабе. Амплитуда переменного тока на мембране составляла 50 мВ.
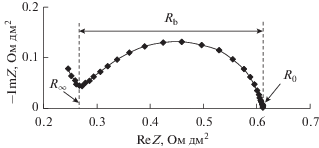
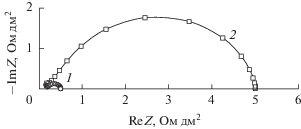
Частотный спектр электрохимического импеданса биполярной мембраны имеет вид искаженного полукруга (рис. 3), абсцисса минимума в левой (высокочастотной) части которого на оси абсцисс определяет сопротивление, равное сумме сопротивлений монополярных (катионообменной и анионообменной) областей биполярной мембраны и сопротивлений слоев растворов около мембраны (R∞). Точка пересечения правой (низкочастотной) части спектра с осью абсцисс определяет сопротивление всей мембраны, в которое вносят вклад все слои мембранной системы (R0).
Сопротивление биполярной области Rb находили по разнице сопротивлений R0 и R∞, используя формулу (1):
Перенапряжение биполярной области мембраны Ub находили по зависимости дифференциального сопротивления Rb от плотности электрического тока i, используя формулу (2) [78]:
Рассчитанные перенапряжения биполярной области использовали для построения парциальной по перенапряжению вольт-амперной характеристики биполярной области мембраны.
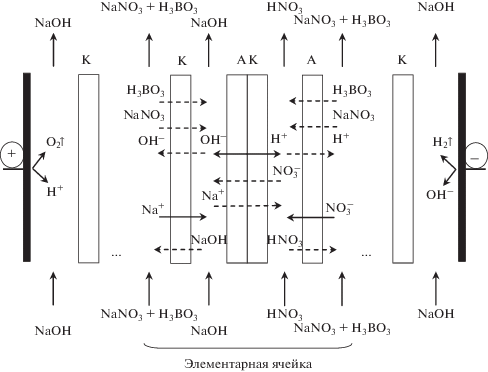
Исследование электродиализного процесса получения азотной кислоты и гидроксида натрия (рекуперация кислоты и щелочи) из нитрата натрия и раствора нитрата натрия, содержащего борную кислоту, проводилось в электродиализаторе-синтезаторе (ЭДС-1), мембранный пакет которого содержал пять трехкамерных элементарных ячеек (рис. 4). Каждая элементарная ячейка ЭДС-1 включала в себя солевую, щелочную и кислотную камеры, разделенные катионообменной мембраной Ralex CMH [62], биполярной мембраной аМБ-2м (табл. 1) и анионообменной мембраной Ralex AMH [62].
Рис. 4.
Схема мембранного пакета электродиализного аппарата, предназначенного для получения азотной кислоты и гидроксида натрия из нитрата натрия, а также из нитрата натрия в присутствии борной кислоты. На схеме также показаны потоки ионов и молекул, переносимых через мембраны при пропускании через аппарат электрического тока.
Рабочая площадь каждой мембраны и электродов равнялась 1 дм2, расстояние между мембранами задавалось толщиной рамок и сетчатыми прокладками и составляло 1 мм. В процессе исследований использовался циркуляционный гидравлический режим работы электродиализного аппарата, линейная скорость растворов через каждую камеру, равная 1 см/с, обеспечивалась перистальтическим насосом Heidolph PD 5001. Начальная концентрация нитрата натрия в солевом растворе была равна 0.48–0.50 М. Концентрация бора в исходном растворе составляла 0.75 М, а рН раствора был равен 7.2. Это значение рН соответствует области существования бора в виде борной кислоты, так как боратный ион преобладает в области рН 8.5–11 [13–16]. Начальный объем раствора соли составлял 4.2 л, а начальные объемы кислоты и щелочи были равными 1.2 л.
Процессы получения азотной кислоты и гидроксида натрия из нитрата натрия и из нитрата натрия в присутствии борной кислоты проводили в гальваностатическом режиме при плотности тока 2 А/дм2. Температура растворов соли, кислоты и щелочи составляла 29, 30 и 30°С соответственно.
Концентрации гидроксида натрия и азотной кислоты в пробах растворов определяли титрованием с помощью автоматического титратора Titroline 6000. Далее по найденным значениям концентраций и измеренным объемам растворов кислоты и щелочи, циркулирующих через ЭДС-1, рассчитывали текущее количество полученной кислоты и щелочи в растворах, циркулирующих через аппарат. Концентрацию нитрата натрия определяли по калибровочным графикам по измеренным значениям удельной электропроводности раствора и его рН.
По зависимости количеств кислоты и щелочи от времени рассчитывали основные электрохимические характеристики аппаратов.
Интегральные выходы по току кислоты и щелочи η в электродиализном аппарате рассчитывались по формуле (3):
где I – ток, подаваемый на аппарат; N – число элементарных ячеек в мембранном пакете электродиализного аппарата; n – число молей полученной кислоты или щелочи; τ – время, прошедшее с начала основного эксперимента; F – постоянная Фарадея.Интегральные удельные энергозатраты, необходимые для получения кислоты и щелочи, E рассчитывались по формуле (4):
где U1 – напряжение, подаваемое на электродиализный аппарат; U2 – напряжение, подаваемое на электродиализный аппарат, содержащий электродные камеры, разделенные катионообменной мембраной, при том же электрическом токе, при котором измерено напряжение U1; M – молярная масса азотной кислоты или гидроксида натрия.Интегральные удельные производительности аппарата по кислоте и щелочи P рассчитывались по формуле (5):
где S – активная площадь каждой мембраны.Концентрацию борной кислоты в растворах нитрата натрия, гидроксида натрия и азотной кислоты определяли титрованием с помощью автоматического титратора Titroline 6000. В пробы нитрата натрия и азотной кислоты для определения в них борной кислоты вводили сорбит, который образует с борной кислотой комплексное соединение [79], обладающее более сильными кислотными свойствами, чем борная кислота. Далее комплексное соединение титровали раствором гидроксида натрия. Борат натрия в растворе гидроксида натрия определяли прямым титрованием соляной кислотой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Частотные спектры электрохимического импеданса биполярной мембраны аМБ-2м в исследованном диапазоне частот близки по форме (рис. 5), а сопротивление биполярной области мембраны аМБ-2м слабо зависит от плотности постоянного тока. Увеличение сопротивления биполярной области при малых (0–0.04 А/дм2) плотностях постоянного электрического тока объясняется уменьшением концентраций подвижных ионов, удаляемых из области пространственного электрического заряда в катионообменный и анионообменный слои мембраны постоянным током, и увеличением ширины ОПЗ на межфазной границе катионит/анионит [69, 80, 81] с ростом плотности постоянного тока. При токах, больших, чем 0.04 А/дм2, это сопротивление уменьшается из-за повышения концентраций H+- и OH−-ионов в ОПЗ в результате ускорения реакции диссоциации молекул воды при увеличении напряженности электрического поля в ОПЗ из-за возрастания на нем перенапряжения. Присутствие максимума на зависимости сопротивления биполярной области от плотности тока является общей закономерностью и для биполярных мембран МБ-1, МБ-2 и МБ-3 [69].
Рис. 5.
Частотные спектры электрохимического импеданса биполярной мембраны аМБ-2м в системе 0.1 М HNO3|0.1 М NaOH в зависимости от плотности постоянного электрического тока (числа около кривых), А/дм2. Частотные спектры сдвинуты друг относительно друга по оси ординат на 0.1 Ом дм2.
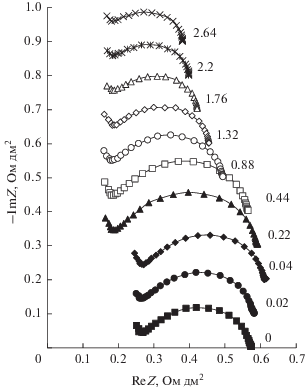
Частотные спектры электрохимического импеданса модифицированной гетерогенной мембраны аМБ-2м (рис. 5) показывают, что сопротивление ее биполярной области (Rb = R0 − R∞) на полтора порядка меньше, чем исходной МБ-2 ([82], рис. 7b), на порядок меньше, чем мембраны МБ-1 ([82], рис. 7a), и близко к сопротивлению биполярной области мембраны МБ-3 ([82], рис. 7c). Различие между мембраной аМБ-2м и промышленными мембранами МБ-1 и МБ-2 обусловлено присутствием в биполярной области аМБ-2м частиц ионполимера, содержащего фосфорнокислотные группы (табл. 1), которые обладают высокой каталитической активностью в реакции диссоциации молекул воды [69]. Мембрана МБ-1 содержит в катионообменном слое каталитически активные сульфокислотные группы, а в анионообменном слое – третичные и вторичные аминогруппы (табл. 1), однако их каталитическая активность намного ниже, чем каталитическая активность фосфорнокислотных групп [69]. Мембрана МБ-2 содержит в катионообменном слое каталитически активные сульфокислотные группы, а в анионообменном слое – следы предположительно третичных аминогрупп, образующихся при термической деструкции четвертичных аммониевых групп, которые преобладают в анионообменном слое. Более низкая концентрация аминогрупп в мембране МБ-2 по сравнению с концентрацией аминогрупп в мембране МБ-1 (табл. 1) обеспечивает еще более низкую скорость диссоциации молекул воды и большее сопротивление биполярной области, чем в мембране МБ-1.
Сопротивление биполярной области мембраны аМБ-2м близко к сопротивлению биполярной области мембраны МБ-3. Это связано с тем, что один и тот же ионполимер (КФ-1) содержится в качестве каталитической добавки в биполярной области мембраны аМБ-2м и в биполярной области мембраны МБ-3, так как входит в состав ее катионообменного слоя.
Доказательством того, что именно каталитическая добавка ионполимера в мембране аМБ-2м резко снижает сопротивление ее биполярной области, а не различие в составе катионообменных слоев мембран МБ-2 и аМБ-2 и их анионообменных слоев, является рис. 6. Без введения каталитической добавки сопротивление биполярной области мембраны аМБ-2 велико, хотя и меньше, чем в случае промышленной мембраны МБ-2 [82]. Именно содержащаяся в мембране аМБ-2м каталитическая добавка приводит к уменьшению на порядок сопротивления биполярной области мембраны аМБ-2.
Рис. 6.
Частотные спектры электрохимического импеданса биполярной мембраны аМБ-2м (1) и аМБ-2 (2) в системе 0.1 М HNO3|0.1 М NaOH при плотности постоянного электрического тока 0.88 А/дм2.
Парциальная вольт-амперная характеристика мембраны аМБ-2м (рис. 7) близка к соответствующей характеристике мембраны МБ-3 ([82], рис. 6, кривая 3) и также существенно отличается от характеристик биполярных мембран МБ-1 и МБ-2 ([82], рис. 6, кривые 1 и 2).
Рис. 7.
Парциальная по перенапряжению вольт-амперная характеристика биполярной области мембраны аМБ-2м в системе 0.1 М HNO3|0.1 М NaOH.
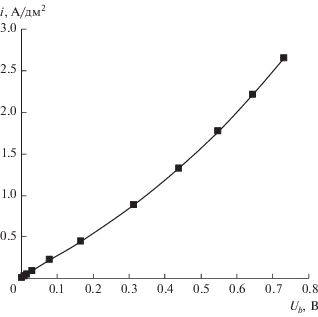
Таким образом, вследствие более низкого сопротивления биполярной области, модифицированная биполярная мембрана аМБ-2м превосходит по электрохимическим характеристикам промышленные гетерогенные биполярные мембраны МБ-1, МБ-2.
Результаты исследования процесса получения азотной кислоты и гидроксида натрия из раствора нитрата натрия, а также из раствора нитрата натрия, содержащего борную кислоту, показывают (рис. 8–13), что присутствие борной кислоты в растворе нитрата натрия существенно не изменяет характеристики процесса получении азотной кислоты и гидроксида натрия из нитрата натрия.
Рис. 8.
Зависимости концентраций получаемых азотной кислоты (1 и 2) и гидроксида натрия (1 ' и 2 ') в растворах от времени работы электродиализатора ЭДС-1. В растворе солевой камеры содержится: нитрат натрия (1 и 1 '); нитрат натрия и борная кислота (2 и 2 ').
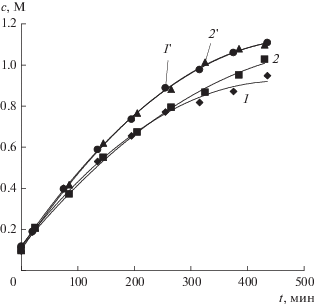
Рис. 9.
Зависимости концентраций нитрата натрия (1, 2) и борной кислоты (3) в солевой камере от времени работы электродиализатора ЭДС-1. В растворе солевой камеры содержится: нитрат натрия (1); нитрат натрия в присутствии борной кислоты (2).
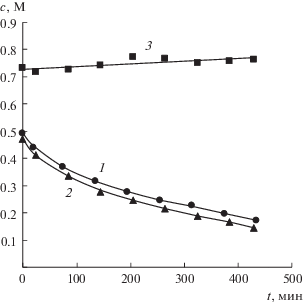
Рис. 10.
Зависимости концентраций боратных анионов $\left( {{\text{B}}({\text{OH}})_{{\text{4}}}^{ - }} \right)$ в щелочной камере (1) и борной кислоты в кислотной камере (2) от времени работы электродиализатора ЭДС-1.
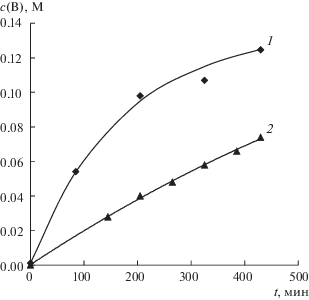
Рис. 11.
Зависимости интегральных выходов по току кислоты (a) и щелочи (б) от концентрации азотной кислоты и гидроксида натрия. В растворе солевой камеры содержится: нитрат натрия (1 и 1 '); нитрат натрия и борная кислота (2 и 2 ').
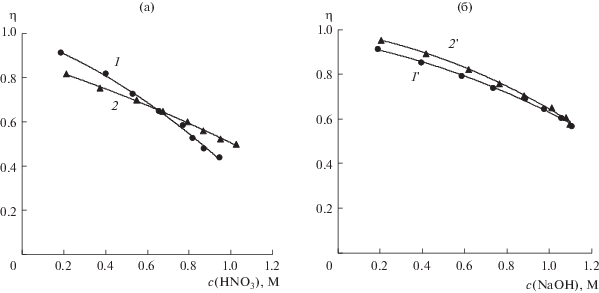
Рис. 12.
Зависимость интегральных удельных энергозатрат при получении азотной кислоты (1 и 2) и гидроксида натрия (1 ′ и 2 ′) из нитрата натрия от концентраций кислоты и щелочи в растворах. В растворе солевой камеры содержится: нитрат натрия (1 и 1 ′); нитрат натрия и борная кислота (2 и 2 ′).
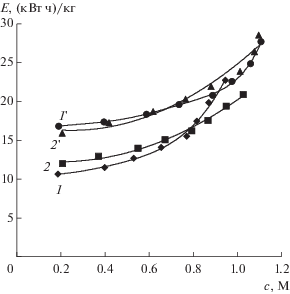
Рис. 13.
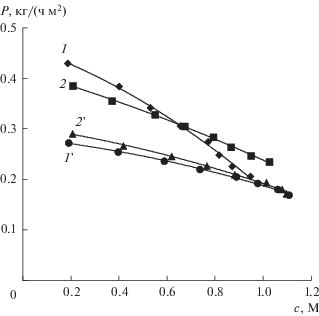
Зависимость интегральной удельной производительности по азотной кислоте (1 и 2) и гидроксиду натрия (1 ′ и 2 ′) от концентраций получаемых растворов кислоты и щелочи. В растворе солевой камеры содержится: нитрат натрия (1 и 1 ′); нитрат натрия и борная кислота (2 и 2 ′).
Получаемые концентрации азотной кислоты (рис. 8, кривые 1, 2) всегда меньше, чем щелочи (рис. 8, кривые 1 ′, 2 ′), вследствие большего неселективного переноса ионов водорода и азотной кислоты из раствора кислоты в раствор соли через анионообменную мембрану по сравнению с переносом гидроксильных ионов и гидроксида натрия из раствора щелочи в раствор соли через катионообменную мембрану (рис. 4). Это подтверждается и подкислением раствора соли в процессе эксперимента.
Зависимости концентраций нитрата натрия от времени (рис. 9, кривые 1, 2) с учетом того, что концентрации немного отличались в начальный момент времени, практически не зависят от присутствия борной кислоты.
Концентрация борной кислоты в солевом растворе (рис. 10) несколько увеличивается с течением времени, что связано с уменьшением объема раствора из-за переноса воды в гидратных оболочках ионов натрия и нитратных ионов соответственно в раствор щелочи и раствор кислоты. Концентрация борной кислоты и боратных ионов в растворе кислоты и щелочи соответственно нарастала с течением времени, вследствие их диффузионного, электромиграционного и сопряженного с потоками противоионов переноса через ионообменные мембраны.
Выходы по току кислоты и щелочи (рис. 11) уменьшаются с ростом их концентраций, что связано с увеличением при этом диффузионных потоков кислоты и щелочи и миграционных потоков анионов кислоты и катионов щелочи через биполярные мембраны, а также с электромиграцией ионов водорода и гидроксила и диффузией кислоты и щелочи через анионообменные и катионообменные мембраны из кислотной и щелочной камер в солевые камеры.
Вследствие снижения выходов по току кислоты и щелочи с увеличением их концентраций энергозатраты на их получение увеличиваются (рис. 12). Присутствие борной кислоты в солевой камере незначительно изменяет энергозатраты при получении кислоты и щелочи.
Интегральные удельные производительности аппарата ЭДС-1 по азотной кислоте и гидроксиду натрия уменьшаются с ростом их концентраций (рис. 13). Причины этого те же, что и причины падения выхода по току и удельных энергозатрат при получении кислоты и щелочи в аппарате ЭДС-1. Присутствие борной кислоты в солевой камере слабо влияет на удельные производительности.
Подкисление солевого раствора в процессе получения растворов азотной кислоты и гидроксида натрия из раствора нитрата натрия, а также из раствора нитрата натрия, содержащего борную кислоту, вызвано преобладающим переносом азотной кислоты из кислотной камеры в солевую по сравнению с переносом гидроксида натрия из щелочной камеры в солевую. Эта разница в переносе вызвана большей подвижностью ионов водорода в анионообменной мембране по сравнению с подвижностью ионов гидроксила в катионообменной мембране. Несмотря на то, что этот процесс является нежелательным, так как снижает выход по току кислоты и щелочи, увеличивает энергозатраты процесса и снижает его производительность, он препятствует переходу борной кислоты в борат натрия в растворе соли и миграционному переносу боратных анионов через анионообменные мембраны в кислотные камеры.
ЗАКЛЮЧЕНИЕ
Модифицированная биполярная мембрана аМБ-2м, полученная из монополярных гетерогенных мембран Ralex CMH и Ralex AMH с одновременным введением фосфорнокислотной модифицирующей добавки, имеет сравнимые с МБ‑3 значения сопротивления биполярной области и рабочего перенапряжения.
Присутствие борной кислоты существенно не влияет на технико-экономические характеристики процесса (на выход по току азотной кислоты и гидроксида натрия, на удельные энергозатраты при их получении и на удельную производительность электродиализатора). Потери борной кислоты в солевой камере вследствие ее переноса в кислотную и щелочную не превышают 7%, при этом концентрация нитрата натрия снижается более чем в 3 раза, с 0.5 до 0.15 М. Перенос бора в виде борной кислоты и боратных анионов из солевой камеры через катионообменные и анионообменные мембраны предположительно объясняется их диффузионным, электромиграционным и сопряженным переносом с потоками противоионов. В процессе биполярного электродиализа происходит подкисление раствора в солевой камере, которое препятствует появлению в заметных количествах боратных анионов и уменьшает их перенос через анионообменную мембрану в кислотную камеру.
Дальнейшее снижение концентрации нитрата натрия более целесообразно проводить с помощью традиционного электродиализа с возвратом образованного концентрата нитрата натрия на стадию конверсии в кислоту и щелочь. Таким образом биполярный электродиализ может быть использован для получения борной кислоты, минеральных кислот и щелочей из борсодержащих ЖРО.
Список литературы
International Programme on Chemical Safety. Environmental health criteria for Boron; Geneva: World Health Organization, 1998, vol. 204. 201 p.
Kot, F.S., Boron in the Environment, in Boron Separation Processes, Kabay, N., Bryjak, M., and Hilal, N., Eds., The Netherlands, Amsterdam: Elsevier Science Ltd., 2015, p. 1.
Weinthal, E., Parag, Y., Vengosh, A., Muti, A., and Kloppmann, W., The EU drinking water directive: The boron standard and scientific uncertainty, Eur. Environ., 2005, vol. 15, p. 1.
СанПиН 2.1.4.1074-01 Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения, М.: Минздрав России, 2002. 62 с. [Sanitary Rules and Regulations 2.1.4.1074-01. Drinking Water. Hygienic Requirements for Water Quality of Centralized Drinking Water Supply Systems. Quality Control. Hygienic Requirements for Ensuring the Safety of Hot Water Systems, M: Ministry of Health of Russia, 2002. 62 p.]
СанПиН 2.1.4.1116-02. Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества, М.: Минздрав России, 2002. 40 с. [Sanitary Rules and Regulations 2.1.4.1116-02. Potable Water. Hygienic Requirements for Quality of Bottled Water. Quality Control, M: Ministry of Health of Russia, 2002. 40 p.]
Princi, M.P., Lupini, A., Araniti, F., Longo, C., Mauceri, A., Sunseri, F., and Abenavoli, M.R., Boron toxicity and tolerance in plants: Recent advances and future perspectives, in Plant Metal Interaction, Parvaiz Ahmad, Eds., The Netherlands, Amsterdam: Elsevier Science Ltd., 2016, p. 115.
Roessner, U., Patterson, J., Forbes, M., Fincher, G., Langridge, P., and Bacic, A., An investigation of boron toxicity in barley using metabolomics, Plant Physiol., 2006, vol. 142, p. 1087.
Chatzissavvidis, C. and Antonopoulou, C., Boron toxicity in fruit crops: Agronomic and physiological implications, in Fruit Crops: Diagnosis and Management of Nutrient Constraints, Srivastava, A.K., Hu, C., Eds, The Netherlands, Amsterdam: Elsevier Science Ltd., 2020, p. 211.
Schoderboeck, L., Mühlegger, S., Losert, A., Gausterer, C., and Hornek, R., Effects assessment: Boron compounds in the aquatic environment, Chemosphere, 2011, vol. 82, p. 483.
Fail, P., Chapin, R., Price, C., and Heindel, J., General reproductive, developmental, and endocrine toxicity of boronated compounds, Reprod. Toxicol., 1998, vol. 12, p. 1.
Boron in Drinking-water. Background document for development of WHO Gu-idelines for Drinking-water Quality. World Health Organization. Geneva, 1998. 2009. 20 p.
Smith, B.M., Todd, P., and Bowman, C., Boron removal by polymer-assisted ultrafiltration, Separ. Sci. Technol., 1995, vol. 30, p. 3849.
Melnik, L., Vysotskaja, O., and Kornilovich, B., Boron behavior during desalination of sea and underground water by electrodialysis, Desalination, 1999, vol. 124, p. 125.
Melnyk, L., Goncharuk, V., Butnyk, I., and Tsapiuk, E., Boron removal from natural and wastewaters using combined sorption/membrane process, Desalination, 2005, vol. 185, p. 147.
Turek, M., Dydo, P., Ciba, J., Trojanowska, J., Kluczka, J., and Palka-Kupczak, B., Electrodialytic treatment of boron-containing wastewater with univalent permselective membranes, Desalination, 2005, vol. 185, p. 139.
Oren, Y., Linder, C., Daltrophe, N., Mirsky, Y., Skorka, J., and Kedem, O., Boron removal from desalinated seawater and brackish water by improved electrodialysis, Desalination, 2006, vol. 199, p. 52.
Jacob, C., Seawater desalination: boron removal by ion exchange technology, Desalination, 2007, vol. 205, p. 47.
Cengeloglu, Y., Arslan, G., Tor, A., Kocak, I., and Dursun, N., Removal of boron from water by using reverse osmosis, Sep. Purif. Technol., 2008, vol. 64, p. 141.
Tu, K.L., Ngheim, L.D., and Chivas, A.R., Boron removal by reverse osmosis membranes in seawater desalination applications, Sep. Purif. Technol., 2010, vol. 75, p. 87.
Hilal, N., Kim, G.J., and Somerfield, C., Boron removal from saline water: A comprehensive review, Desalination, 2011, vol. 273, p. 23.
Kir, E., Gurler, B., and Gulec, A., Boron removal from aqueous solution by using plasma-modified and unmodified anion-exchange membranes, Desalination, 2011, vol. 267, p. 114.
Wolska, J. and Bryjak, M., Methods for boron removal from aqueous solutions—a review, Desalination, 2013, vol. 310, p. 18.
Tagliabue, M., Reverberi, A.P., and Bagatin, R., Boron removal from water: needs, challenges and perspectives, J. Clean. Prod., 2014, vol. 77, p. 56.
Wang, B., Guo, X., and Bai, P., Removal technology of boron dissolved in aqueous solutions – A review, Colloids and Surfaces A: Physicochem. Eng. Aspects, 2014, vol. 444, p. 338.
Guan, Z., Lv, J., Bai, P., and Guo, X., Boron removal from aqueous solutions by adsorption—A review, Desalination, 2016, vol. 383, p. 29.
Tang, Y. P., Luo, L., Thong, Z., and Chung, T. S., Recent advances in membrane materials and technologies for boron removal, J. Membr. Sci., 2017, vol. 541, p. 434.
Демкин, В.И., Адамович, Д.В., Амелин, В.С., Пантелеев, В.И. Мембранная технология переработки солевых жидких радиоактивных растворов. Серия. Критические технологии. Мембраны. 2002. № 15. С. 10. [Demkin, V.I., Adamovich, D.V., Amelin, V.S., and Panteleev, V.I., Membrane technology for the processing of salt liquid radioactive solutions, Seriya. Kriticheskiye tekhnologii. Membrany (in Russian), 2002, no. 15, p. 10.]
Пантелеев, В.И, Демкин, В.И., Адамович, Д.В. Сорбционно-мембранные технологии переработки радиоактивных растворов. Безопасность окружающей среды. 2008. № 3. С. 82. [Panteleev, V.I., Demkin, V.I., and Adamovich, D.V., Sorption-membrane technologies for the processing of radioactive solutions, Bezopasnost’ okruzhayushchey sredy (in Russian), 2008, no. 3, p. 82.]
Watanabe, S., Ogi, H., Araia, Y., Aihara, H., Takahatake, Y., Shibata, A., Nomura, K., Kamiya, Y., Asanuma, N., Matsuura, H., Kubota, T., Seko, N., Arai, T., and Moriguchi, T., STRAD project for systematic treatments of radioactive liquid wastes generated in nuclear facilities, Progress in Nuclear Energy, 2019, vol. 117, p. 103090.
Чечельницкий, Г.М., Рабинович, С.М., Синявский, П.Н., Ким, В.В., Терещенко, Л.И., Бессонов, О.В. Способ обработки жидких радиоактивных отходов АЭС с борным регулированием, Пат. 2012076 (Россия). 1994. [Chechel’nitskij, G.M., Rabinovich, S.M., Sinjavskij, P.N., Kim, V.V., Tere-shchenko, L.I., and Bessonov, O.V., Method of processing of liquid radioactive waste of atomic power plants with boron control, Patent 2012076 (Russia). 1994.].
Asenov, V.V., Method and installation for the treatment of radioactive wastes, Patent 7323613 (US), 2008.
Zakrzewska-Trznadel, G., Advances in membrane technologies for the treatment of liquid radioactive waste, Desalination, 2013, vol. 321, p. 119.
Иваненко, В.И., Седнева, Т.А., Локшин, Э.П., Корнейков, Р.И. Способ переработки жидких отходов АЭС с борным регулированием, Пат. 2652978 (Россия). 2017. [Ivanenko, V.I., Sedneva, T.A., Lokshin, E.P., and Korneykov, R.I., Method for NPP liquid waste processing with boron control, Patent 2141642 (Russia), 2017.]
Дмитриев, С.А., Лифанов, Ф.А., Савкин, А.Е., Лащенков, С.М. Обращение с кубовыми остатками АЭС. Атомная энергия. 2000. Т. 89. С. 365. [Dmitriyev, S.A., Lifanov, F.A., Savkin, A.Ye., and Lashchenkov, S.M., Treatment of distillation residues of nuclear power plants, Atomnaya energiya (in Russian), 2000, no. 89, p. 365.]
Nagasawa, H., Iizuka, A., Yamasaki, A., and Yanagisawa, Y., Utilization of bipolar membrane electrodialysis for the removal of boron from aqueous solution, Ind. Eng. Chem. Res., 2011, vol. 50, p. 6325.
Bunani, S., Arda, M., Kabay, N., Yoshizuka, K., and Nishihama, S., Effect of process conditions on recovery of lithium and boron from water using bipolar membrane electrodialysis (BMED), Desalination, 2017, vol. 416, p. 10.
Noguchi, M., Nakamura, Y., Shoji, T., Iizuka, A., and Yamasaki, A., Simultaneous removal and recovery of boron from wastewater by multi-step bipolar membrane electrodialysis, J. Water Process Eng., 2018, vol. 23, p. 299.
İpekçia, D., Kabay, N., Bunani, S., Altıok, E., Arda, M., Yoshizuka, K., and Nishihama, S., Application of heterogeneous ion exchange membranes for simultaneous separation and recovery of lithium and boron from aqueous solution with bipolar membrane electrodialysis (EDBM), Desalination, 2020, vol. 479, p. 114313.
Свитцов, А.А., Салтыков, Б.В. Получение ценных компонентов из дезактивированных стоков АЭС методом электродиализа. Тез. док. Международной конференции, посвященной 90-летию со дня рождения академика Б.А. Пурина, М.: РХТУ им. Д.И. Менделеева. 2018. С. 111. [Svitsov, A.A. and Saltykov, B.V., Obtaining valuable components from deactivated wastewater, Conf. Proc. “International conference dedicated to the 90th birthday of academician B.A. Purin” (in Russian), M.: RKHTU im. D.I. Mendeleyeva, 2018, p. 111.]
Егоров, Е.Н., Свитцов, А.А., Дудник, С.Н., Демкин, В.И. Фракционирование многокомпонентных растворов методом электродиализа с биполярными мембранами. Мембраны и мембранные технологии. 2012. Т. 2. С. 198. [Egorov, E.N., Svitsov, A.A., Dudnik, S.N., and Demkin, V.I., Fractionation of multicomponent solutions by electrodialysis with bipolar membranes, Petr. Chem., 2012, vol. 57, p. 583.]
Tanaka, Y., Ion exchange membranes, Fundamentals and Applications, second Ed., Elsevier Science, 2015, p. 531.
Ishibashi, N. and Hirano, K., Preparation of caustic soda and hydrochloric acid by use of bipolar ion-exchange membrane, J. Electrochem. Soc. Japan, (Overseas Suppl. Ed.), 1959, vol. 26, no. 1–3, p. 8.
Гребень, В.П., Родзик, И.Т. Влияние концентрации соляной кислоты и едкого натра на числа переноса ионов через гетерогенные биполярные ионообменные мембраны. Ионный обмен и хроматография. 1984. С. 158. [Greben’, V.P. and Rodzik, I.T., Effect of the concentration of hydrochloric acid and sodium hydroxide on the numbers of ion transfer through heterogeneous bipolar ion-exchange membranes, Ionnyy obmen i khromatografiya, (in Russian), 1984, p. 158.]
Гребень, В.П., Пивоваров, Н.Я., Лацков, В.Л. Получение концентрированных растворов едкого натра и соляной кислоты из хлорида натрия методом электродиализа с использованием биполярных ионообменных мембран. Журн. прикл. химии. 1988. Т. 61. С. 990. [Greben’, V.P., Pivovarov, N.Ya., and Latskov, V.L., Production of concentrated caustic soda and hydrochloride acid solutions from sodium chloride by electrodialysis with the aid of bipolar ion-exchange membranes, Sov. J. Appl. Chem., 1988, vol. 61, no. 5, p. 903.]
Carmen, C., Pilot performance of Tokuyama soda bipolar membrane in sodium chloride salt splitting, Membr. Technol., 1993, vol. 41, p. 5.
Бобринская, Г.А., Бобрешова, О.В. Получение кислоты и щелочи из хлорида натрия различных концентраций с использованием четырехкамерного электродиализатора с биполярными мембранами. Журн. прикл. химии. 2000. Т. 73. С. 230. [Bobrinskaya, G.A. and Bobreshova, O.V., Preparation of acid and alkali from sodium chloride of varied concentration in four-chamber electrodialyzer with bipolar membranes, Russ. J. Appl. Chem., 2000, vol. 73, no. 2, p. 241.]
Yang, Y., Gao, X., Fan, A., Fu, L., and Gao, C., An innovative beneficial reuse of seawater concentrate using bipolar membrane electrodialysis, J. Membr. Sci., 2014, vol. 449, p. 119.
Бобринская, Г.А., Павлова, Т.В., Шаталов, А.Я. Получение кислот и щелочи из растворов сульфата и хлорида натрия с применением биполярных мембран. Журн. прикл. химии. 1985. Т. 58. С. 786. [Bobrinskaya, G.A., Pavlova, T.V., and Shatalov, Ya.A., Recovery of acids and sodium hydroxide from solutions of sodium sulfate and sodium chloride with the use of bipolar membranes, Sov. J. Appl. Chem., 1985, vol. 58, p. 711.]
Raucq, D., Pourcelly, G., and Gavach, C., Production of sulphuric acid and caustic soda from sodium sulphate by electromembrane processes. Comparison between electro-electrodialysis and electrodialysis on bipolar membrane, Desalination, 1993, vol. 91, no. 2, p. 163.
Pinacci, P., Development of electro-membrane processes for waste-stream treatment, Membr. Technol., 2001, vol. 134, p. 11.
Berkessa, Y.W., Lang Q., Yan, B., Kuang S., Mao, D., Shu, L., and Zhang, Y., Anion exchange membrane organic fouling and mitigation in salt valorization process from high salinity textile wastewater by bipolar membrane electrodialysis, Desalination, 2019, vol. 465, p. 94.
Cherif, A.T. and Molenat, J., Nitric acid and sodium hydroxide generation by electrodialysis using bipolar membranes, J. Appl. Electrochem., 1997, vol. 27, p. 1069.
Ben Ali, M.A., Rakib, M., Laborie, S., Viers, Ph., and Durand, G., Coupling of bipolar membrane electrodialysis and ammonia stripping for direct treatment of wastewaters containing ammonium nitrate, J. Membr. Sci., 2004, vol. 244, p. 89.
Linden, N., Bandinu, G.L., Vermaas, D. A., Spanjers, H., and Lier, J.B., Bipolar membrane electrodialysis for energetically competitive ammonium removal and dissolved ammonia production, J. Clean. Prod., 2020, vol. 259, p. 120788.
Nagasubramanian, P.K., Chlanda, F.P., and Liu, K.J., Use of bipolar membranes for generation of acid and base—an engineering and economic analysis, J. Membr. Sci., 1977, vol. 2, p. 109.
Mani, K.N., Chlanda, F.P., and Byszewski, C.H., AQUATECH membrane technology for recovery of acid/base values from salt streams, Desalination, 1988, vol. 68, p. 149.
Mani, K.N., Electrodialysis water splitting technology, J. Membr. Sci., 1991, vol. 58, p. 117.
Kim, Y.H. and Moon, S.H., Lactic acid recovery from fermentation broth using one-stage electrodialysis, J. Chem. Technol. Biotechnol., 2001, vol. 76, p. 169.
Strathmann, H., Ion-exchange membrane separation processes, 1st ed. Elsevier. 9, 2004. 348 p.
Kemperman, A.J.B., Handbook on Bipolar Membrane Technology, Enschede: Twente University Press, 2000. 275 p.
Пурселли, Ж. Электродиализ с биполярными мембранами: основы метода, оптимизация, применения. Электрохимия. 2002. Т. 38. С. 1026. [Pourcelly, G., Electrodialysis with bipolar membranes: principles, optimization, and applications, Russ. J. Electrochem., 2002, vol. 38, p. 919.]
MEGA Group; RALEX® electro separation membranes. Bipolar membranes RALEX® BM: roll/sheet | EDBM; https://www.mega.cz/membranes/
Limited Liability Company United Chemical Company “SHCHEKINOAZOT”; http://n-azot.ru/product/heterogeneous-ion-exchange-membranes?lang=EN.
Limited Liability Company Innovative Enterprise “SHCHEKINOAZOT”; http://www.azotom.ru/bipolyarnye-membrany/.
Zabolotskii, V., Sheldeshov, N., and Melnikov, S., Effect of cation-exchange layer thickness on electrochemical and transport characteristics of bipolar membranes, J. Appl. Electrochem., 2013, vol. 43, p. 1117.
Zabolotsky, V.I., Utin, S.V., Bespalov, A.V., and Strelkov, V.D., Modification of asymmetric bipolar membranes by functionalized hyperbranched polymers and their investigation during pH correction of diluted electrolytes solutions by electrodialysis, J. Membr. Sci., 2015, vol. 494, p. 188.
Утин, С.В., Лоза, С.А., Беспалов, А.В., Заболоцкий, В.И. Влияние функционализации и природы ионогенных групп сверхразветвленных полимеров на электрохимические характеристики асимметричных биполярных мембран. Мембраны и мембранные технологии. 2018. Т. 8. С. 42. [Utin, S.V., Loza, S.A., Bespalov, A.V., and Zabolotsky, V.I., Influence of functionalization and ionogenic groups nature of hyperbranched polymers on electrochemical characteristics of asymmetric bipolar membranes, Petr. Chem., 2018, vol. 58, no. 2, p. 137.]
Fu, R.Q., Xu, T.W., Wang, G., Yang, W.H., and Pan, Z.X., Fundamental studies on the intermediate layer of a bipolar membrane. Part 1. PEG-catalytic water splitting in the interface of a bipolar membrane, J. Colloid Interface Sci., 2003, vol. 263, p. 386.
Шельдешов, Н.В., Заболоцкий, В.И. Биполярные ионообменные мембраны. Получение. Свойства. Применение, в Мембраны и мембранные технологии (ред. Ярославцев А.Б.), M: Научный Мир, 2013. С. 70. [Sheldeshov, N.V. and Zabolotsky, V.I., Bipolar ion-exchange membranes. Preparation. Properties. Application, in Membranes and Membrane Technologies (in Russian), Yaroslavtsev, A.B., Eds., M: Nauchnyi Mir, 2013. p. 70.]
Шельдешов, Н.В., Заболоцкий, В.И., Беспалов, А.В., Ковалев, Н.В., Алпатова, Н.В., Акимова, А.В., Мочалова, Т.В., Ковалева, В.И., Боярищева, А.Ю. Исследование влияния каталитических добавок на электрохимические характеристики биполярных мембран. Мембраны и мембранные технологии. 2017. Т. 7. С. 187. [Sheldeshov, N.V., Zabolotskii, V.I., Bespalov, A.V., Kovalev, N.V., Alpatova, N.V., Akimova, A.V., Mochalova, T.V., Kovaleva, V.I., and Boya-rishcheva, A.Yu., The influence of catalytic additives on electrochemical properties of bipolar membranes, Petr. Chem., 2017, vol. 57, p. 518.]
Martínez, R.J. and Farrell, J., Water splitting activity of oxygen-containing groups in graphene oxide catalyst in bipolar membranes, Comput. Theor. Chem, 2019, vol. 1164, p. 112556.
Sun, M., Li, M., Zhang, X., Wu, C., and Wu, Y., Graphene oxide modified porous P84 co-polyimide membranes for boron recovery by bipolar membrane electrodialysis process, Sep. Purif. Technol., 2020, vol. 232, p. 115.
Wang, Q., Wu, B., Jiang, C., Wang, Y., and Xu, T., Improving the water dissociation efficiency in a bipolar membrane with amino-functionalized MIL-101, J. Membr. Sci., 2017, vol. 524, p. 370.
Ионитовые мембраны. Грануляты. Порошки: Каталог, М: НИИТЭХим. НИИ “Пластмассы”, 1977. С. 15. [Ionite membranes. Granules. Powders: Catalog (in Russian), Moscow:NIITEKhim. NII “Plastmassy”, 1977, p. 15].
ГОСТ 20298-74 Ионообменные смолы. Катиониты. Технические условия (с изменениями № 1–5), 1976, с. 8. [GOST 20298-74 Ion exchange resins. Cationites. Technical conditions (with changes No. 1–5), 1976, p. 8 (in Russian)].
ГОСТ 20301-74 Ионообменные смолы. Аниониты. Технические условия (с изменениями № 1–5), 1976, с. 9, 13. [GOST 20301-74 Ion exchange resins. Anionites. Technical conditions (with changes No. 1–5), 1976, p. 9, 13 (in Russian)].
Семушин, А.М., Яковлев, В.А., Иванова, Е.В. Инфракрасные спектры поглощения ионообменных материалов, Справочное пособие, Л.: Химия, 1980. 96 с. [Semushin, A.M., Yakovlev, V.A., and Ivanova, E.V., Infrared absorption spectra of ion-exchange materials, Reference guide (in Russian), L.: Khimiya, 1980. 96 p.]
Заболоцкий, В.И., Гнусин, Н.П., Шельдешов, Н.В. Вольт-амперная характеристика переходной области в биполярной мембране МБ-1. Электрохимия. 1984. Т. 20. С. 1340. [Zabolotskii, V.I., Gnusin, N.P., and Shel’deshov, N.V., Current-voltage characteristics of the transition region in MB-1 bipolar membrane, Sov. Electrochem., 1984, vol. 20, p. 1238.]
Немодрук, А.А., Каралова, З.К. Аналитическая химия бора, М: Наука, 1964, с. 48. [Nemodruk, A.A. and Karalova, Z.K., Analytical chemistry of boron, M.: Nauka, 1964. p. 48.]
Тимашев, С.Ф., Кирганова, Е.В. О механизме электролитического разложения молекул воды в биполярных ионообменных мембранах. Электрохимия. 1981. Т. 17. С. 440. [Timashev, S.F. and Kirganova, E.V., Mechanism of the electrolytic decomposition of water-molecules in bipolar ion-exchange membranes, Sov. Electrochem., 1981, vol. 17, p. 366.]
Умнов, В.В., Шельдешов, Н.В., Заболоцкий, В.И. Строение области пространственного заряда на границе катионообменник/анионообменник в биполярных мембранах. Электрохимия. 1999. Т.35. С. 450. [Umnov, V.V., Shel’deshov, N.V., and Zabolotskii, V.I., Structure of the space-charge region at the anionite/cationite interface in bipolar membranes, Russ. J. Electrochem., 1999, vol. 35, p. 411.]
Zabolotskii, V., Sheldeshov, N., and Melnikov, S., Heterogeneous bipolar membranes and their application in electrodialysis, Desalination, 2014, vol. 342, p. 183.
Дополнительные материалы отсутствуют.