Электрохимия, 2021, T. 57, № 3, стр. 152-161
Электропроводность и потенциалы разложения растворов LiAsF6 в смешанном растворителе пропиленкарбонат–N,N-диметилформамид
Е. Ю. Тюнина a, *, М. Д. Чекунова b, **
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
b Ивановский государственный политехнический университет
153000 Иваново, Шереметевский просп., 21, Россия
* E-mail: tey@isc-ras.ru
** E-mail: marchekunova@mail.ru
Поступила в редакцию 12.05.2020
После доработки 07.08.2020
Принята к публикации 31.08.2020
Аннотация
Измерена удельная электропроводность растворов LiAsF6 в смешанном растворителе пропиленкарбонат–N,N-диметилформамид с моляльной концентрацией ионофора от 0.2 до 1.8 моль/кг при температурах 253.15, 273.15, 293.15, 313.15 и 333.15 К. Содержание N,N-диметилформамида в смешанном растворителе изменялось в интервале (0.2–1.0) мольных долей. Концентрационная зависимость удельной электропроводности исследуемой системы подчиняется уравнению Кастела–Амиса, наибольшими значениями удельной электропроводности обладают растворы ионофора в N,N‑диметилформамиде. Проведен анализ процесса переноса заряда в исследуемой системе на основе применения теории переходного состояния и обобщения данных по электропроводности, полученных для растворов LiClO4 в N,N-диметилформамиде и пропиленкарбонате. Определена величина электрохимического окна для растворов 0.5m LiAsF6 в смешанном растворителе пропиленкарбонат–N,N-диметилформамид, которое ограничивается в катодной области потенциалами выделения лития, а в анодной области потенциалами окисления растворителя.
ВВЕДЕНИЕ
Развитие физико-химических основ процессов перемещения заряженных частиц на основе выявления эффектов среды на электрохимические характеристики электролитных систем является фундаментальным научным направлением исследований в области электрохимии растворов [1, 2]. Разработка составов жидких органических электролитов для литиевых и литий-ионных источников тока требует применения комплексного подхода, основанного на экспериментальных и теоретических исследованиях и предусматривающего изучение закономерностей влияния природы компонентов, состава системы, температуры на такие важные эксплуатационные характеристики, как электропроводность и электрохимическая стабильность [3–12]. Получение электролитных композиций с оптимальными физико-химическими свойствами является сложной задачей, решаемой в настоящее время в основном эмпирически [13]. Понимание того, каким образом неводные растворители и образующиеся электролиты ведут себя на молекулярном уровне, необходимо для создания новых электролитных систем. При работе с индивидуальными растворителями изменять физико-химические свойства среды не представляется возможным. Индивидуальные растворители, как правило, не обеспечивают высокую электропроводность ионофора, в связи с этим широкое распространение получили смешанные растворители [8, 9, 11, 13–15]. Изучение физико-химических свойств электролитных систем на основе смешанных растворителей представляется актуальным для разработки методологии целенаправленного влияния на транспортные характеристики неводных растворов, подбора среды с заданными параметрами и получения смешанного растворителя со свойствами, принципиально отличающимися от свойств индивидуальных растворителей. Нами проведено кондуктометрическое и электрохимическое исследование растворов LiAsF6 в смешанном растворителе пропиленкарбонат (ПК) – N,N-диметилформамид (ДМФА) в широком интервале температур и концентраций. Данная работа является продолжением изучения влияния смешанного растворителя на электрохимические свойства растворов гексафторарсената лития [15] и может представлять интерес для развития теории концентрированных электролитных растворов. Таким образом, накопление экспериментальных данных и учет результатов компьютерного моделирования [16] термодинамических и транспортных свойств для широкого круга систем (жидкие электролиты, расплавы органических солей, индивидуальные растворители и их смеси) будут способствовать углублению наших представлений о природе и свойствах неводных электролитов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали соль LiAsF6, синтезированную по методике, описанной в [17]. Полученную соль очищали от примесей перекристаллизацией из ацетонитрила (“х. ч.”) и сушкой в вакууме в два этапа: сначала при медленном (в течение 6–7 ч) увеличении температуры от 30 до 90°С, а затем при 95°С в течение 24–26 ч. Высушенную соль анализировали на содержание основного вещества по методике, описанной в [18], и на содержание воды, определяемое с помощью метода кулонометрического титрования по К. Фишеру [19]. Содержание основного вещества составляло не менее 99.5 мас. %, а содержание влаги – не более 0.07 мас. %.
Пропиленкарбонат (“х. ч.”) выдерживали в атмосфере аргона над молекулярными ситами (типа 4 Ǻ) в течение 2 сут и подвергали перегонке при пониженном давлении [20]. N,N-диметилформамид (“х. ч.”) осушался в течение суток над прокаленной окисью бария, а затем подвергался перегонке под вакуумом [21]. Полученные растворители проверяли на содержание воды титрованием по методу К. Фишера [19]. Концентрация воды в исследуемых растворителях не превышала 0.005%.
Приготовление растворов и проведение измерений выполняли без контакта с атмосферой. Растворы готовили весовым методом, используя весы “Sartorius-ME215S” (точность взвешивания 1 × 10–5 г).
Электропроводность исследуемых растворов электролитов измеряли на установке, включающей автоматический цифровой мост переменного тока Р-5083 (Россия). В работе использовали герметичную стеклянную ячейку с двумя электродами из гладкой платины. Калибровку ячейки проводили по водным растворам KCl, используя данные работы [22]. При определении удельной электропроводности электролитного раствора учитывали поправку на электропроводность растворителя посредством прямого вычитания величины обратного сопротивления растворителя из величины обратного сопротивления исследуемых растворов. Измерения сопротивления растворов выполняли на пяти различных частотах в интервале 1–10 кГц с последующей экстраполяцией на бесконечную частоту. Для поддержания стабильности температуры с точностью лучше, чем 0.005 К, применяли метод двойного термостатирования. Относительная погрешность определения электропроводности (χ) составляла 0.1%.
Потенциалы разложения электролитных растворов измеряли в термостатируемой трехэлектродной ячейке, деаэрируемой аргоном при 298.15 К. В качестве рабочего (с поверхностью 0.1 см2) и вспомогательного (в виде тонкой проволоки с поверхностью 0.8 см2) электродов использовали платину, впаянную в стекло [15]. Следует отметить, что в современных научных статьях, посвященных исследованию электрохимических свойств электролитных систем на основе литиевых солей, обычно в качестве вспомогательного электрода предпочитают использовать литиевую фольгу [23] или металлический литий [24]. В данной работе, продолжающей серию наших исследований электрохимических свойств жидких электролитов [15, 20, 25, 26], была применена методика определения электрохимической стабильности с использованием в качестве вспомогательного электрода – электрода из платины [27], поскольку сравнение электрохимической стабильности разных электролитных систем более корректно проводить при условии, что значения электрохимических окон получены в условиях одинаковых методик измерения [28].
Потенциалы рабочего электрода измеряли относительно серебряного электрода в растворе, содержащем 0.01 M AgNO3 и 0.5 M LiAsF6 в ацетонитриле (Е = 0.305 В отн. хлоридсеребряного электрода). Вольт-амперные характеристики снимали со скоростью развертки потенциала 0.01 В/с на потенциостате ПИ-50-1 (Беларусь). Для определения потенциалов разложения электролитного раствора логарифмические участки поляризационных кривых экстраполировали до величины тока 10–5 А/см2 [29]. Точность измерения потенциалов составляла ±2.5–5 мВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Удельная электропроводность растворов
Экспериментальные значения удельной электропроводности растворов LiAsF6 в смешанном растворителе ПК–ДМФА при разных температурах и концентрациях представлены в табл. 1.
Таблица 1.
Удельная электропроводность (χ × 103, См см–1) растворов LiAsF6 в бинарной системе пропиленкарбонат–N,N-диметилформамид при разных температурах и концентрациях (γ2 – мольная доля N,N-диметилформамида)
| γ2 | m, моль/кг | Т, К | ||||
|---|---|---|---|---|---|---|
| 253.15 | 273.15 | 293.15 | 313.15 | 333.15 | ||
| 0.2997 | 0.1964 | 1.813 | 3.091 | 4.546 | 6.228 | 8.016 |
| 0.5629 | 2.880 | 5.383 | 8.345 | 11.89 | 15.73 | |
| 0.8914 | 2.527 | 5.313 | 8.884 | 13.32 | 18.27 | |
| 1.260 | 1.789 | 4.310 | 7.879 | 12.54 | 18.08 | |
| 1.447 | 1.211 | 3.351 | 6.668 | 11.24 | 16.71 | |
| 1.811 | 0.6984 | 2.298 | 5.132 | 9.365 | 14.68 | |
| 2.242 | 0.2359 | 1.132 | 3.159 | 6.681 | 11.44 | |
| 0.5040 | 0.2569 | 2.963 | 4.730 | 6.653 | 8.851 | 11.08 |
| 0.5615 | 4.183 | 7.034 | 10.35 | 14.15 | 18.18 | |
| 0.7248 | 4.281 | 7.426 | 11.16 | 15.56 | 20.16 | |
| 1.204 | 3.430 | 6.694 | 10.96 | 16.26 | 22.13 | |
| 1.509 | 2.352 | 5.423 | 9.405 | 14.83 | 21.04 | |
| 1.890 | 1.052 | 3.689 | 7.320 | 12.43 | 18.53 | |
| 2.252 | 0.928 | 2.429 | 5.457 | 10.05 | 15.88 | |
| 0.7651 | 0.2034 | 3.514 | 5.124 | 6.901 | 8.680 | 10.60 |
| 0.5141 | 5.986 | 9.097 | 12.60 | 16.16 | 20.03 | |
| 0.7543 | 6.559 | 10.43 | 14.66 | 19.31 | 24.29 | |
| 1.074 | 6.209 | 10.47 | 15.31 | 20.75 | 26.71 | |
| 1.403 | 5.102 | 9.446 | 14.45 | 20.38 | 26.95 | |
| 1.630 | 4.158 | 8.135 | 13.17 | 19.07 | 25.86 | |
| 1.854 | 3.211 | 6.763 | 11.51 | 17.59 | 24.56 | |
| 1.000 | 0.1905 | 4.150 | 5.776 | 7.470 | 9.295 | 11.12 |
| 0.5973 | 8.169 | 11.91 | 15.99 | 20.27 | 24.71 | |
| 0.9782 | 8.917 | 13.63 | 18.97 | 24.67 | 30.67 | |
| 1.405 | 7.722 | 12.73 | 18.51 | 25.22 | 32.33 | |
| 1.571 | 6.879 | 11.85 | 17.82 | 24.56 | 32.03 | |
| 2.174 | 3.892 | 7.869 | 13.26 | 19.83 | 27.51 | |
| 2.639 | – | 4.759 | 9.354 | 14.93 | 22.20 | |
Изотермы концентрационной зависимости удельной электропроводности (χ) исследуемых растворов характеризуются четким максимумом и могут быть описаны эмпирическим уравнением Кастела–Амиса [30]:
(1)
$\begin{gathered} {\chi \mathord{\left/ {\vphantom {\chi {{{\chi }_{{\max }}}}}} \right. \kern-0em} {{{\chi }_{{\max }}}}} = {{\left( {{m \mathord{\left/ {\vphantom {m {{{m}_{{\max }}}}}} \right. \kern-0em} {{{m}_{{\max }}}}}} \right)}^{a}} \times \\ \times \,\,\exp \left[ {b{{{\left( {m - {{m}_{{\max }}}} \right)}}^{2}} - am_{{\max }}^{{ - 1}}\left( {m - {{m}_{{\max }}}} \right)} \right], \\ \end{gathered} $Таблица 2.
Параметры уравнения Кастела–Амиса для концентрированных растворов LiAsF6 в смешанном растворителе пропиленкарбонат–N,N-диметилформамид при разных температурах (γ2 – мольная доля N,N-диметилформамида, σ(χ) – стандартное отклонение удельной электропроводности)
| γ2 | Т, К | χmax × 103, См см–1 | mmax, моль кг–1 | а | b | σ(χ) × 103 *, См см–1 |
|---|---|---|---|---|---|---|
| 0.2997 | 253.15 | 2.880 | 0.595 | 0.896 | –0.431 | 0.005 |
| 273.15 | 5.530 | 0.707 | 0.902 | –0.281 | 0.008 | |
| 293.15 | 8.920 | 0.807 | 0.941 | –0.157 | 0.011 | |
| 313.15 | 13.26 | 0.909 | 0.959 | –0.081 | 0.008 | |
| 333.15 | 18.35 | 1.016 | 0.952 | –0.053 | 0.009 | |
| 0.5040 | 253.15 | 4.300 | 0.679 | 0.906 | –0.334 | 0.003 |
| 273.15 | 7.490 | 0.806 | 0.841 | –0.238 | 0.001 | |
| 293.15 | 11.46 | 0.900 | 0.925 | –0.114 | 0.002 | |
| 313.15 | 16.44 | 1.016 | 0.925 | –0.070 | 0.002 | |
| 333.15 | 22.08 | 1.132 | 0.926 | –0.043 | 0.001 | |
| 0.7651 | 253.15 | 6.590 | 0.809 | 0.815 | –0.308 | 0.001 |
| 273.15 | 10.69 | 0.934 | 0.807 | –0.251 | 0.003 | |
| 293.15 | 15.40 | 1.028 | 0.850 | –0.154 | 0.005 | |
| 313.15 | 20.86 | 1.139 | 0.884 | –0.092 | 0.002 | |
| 333.15 | 27.07 | 1.251 | 0.900 | –0.053 | 0.002 | |
| 1.000 | 253.15 | 8.940 | 0.914 | 0.813 | –0.263 | 0.001 |
| 273.15 | 13.69 | 1.034 | 0.811 | –0.211 | 0.001 | |
| 293.15 | 19.19 | 1.133 | 0.868 | –0.131 | 0.001 | |
| 313.15 | 25.49 | 1.248 | 0.852 | –0.113 | 0.002 | |
| 333.15 | 32.42 | 1.360 | 0.862 | –0.084 | 0.001 |
Согласно теории переходного состояния [31, 32], зависимость удельной электропроводности исследуемых растворов в изученном интервале температур хорошо описывается экспоненциальным уравнением (2):
(2)
$\chi = {{A}_{\chi }}\exp \left( {{{ - {{E}^{\# }}} \mathord{\left/ {\vphantom {{ - {{E}^{\# }}} {RT}}} \right. \kern-0em} {RT}}} \right),$Рис. 1.
Концентрационная зависимость энергии активации ионной проводимости для растворов LiAsF6 в смешанном растворителе пропиленкарбонат–N,N-диметилформамид при разных мольных долях (м. д.) N,N-диметилформамида (γ2: 1 – 0.0; 2 – 0.2997; 3 – 0.5094; 4 – 0.7651; 5 – 1.0 м. д.).

Концентрационную зависимость энергии активации ионной проводимости исследуемых растворов можно описать уравнением [34]:
где E #0 – вклад растворителя в энергию активации ионной проводимости, E #el – вклад ионофора в энергию активации ионной проводимости, x2 – мольная доля растворенного вещества. Параметры уравнения (3) были найдены из линейной зависимости E # = f(x2). Значение параметра E #el соответствует тангенсу угла наклона прямой, а отрезок, отсекаемый на оси ординат, равен E #0. Полученные параметры уравнения (3) для растворов LiAsF6 и рассчитанные нами их значения для растворов LiClO4 [13] в исследуемых индивидуальных растворителях (ПК, ДМФА) приведены в табл. 3.Таблица 3.
Параметры уравнения (3) для растворов LiAsF6 и LiClO4 в индивидуальных растворителях
| Ионофор | Растворитель | E #0, кДж моль–1 | E #el, кДж моль–1 | Rcorr* |
|---|---|---|---|---|
| LiAsF6 | Пропиленкарбонат | 13.6 ± 0.6 | 87 ± 6 | 0.978 |
| N,N-диметилформамид | 6.5 ± 0.7 | 74 ± 6 | 0.979 | |
| LiClO4 | Пропиленкарбонат [13] | 14.6 ± 0.4 | 81 ± 5 | 0.978 |
| N,N-диметилформамид [13] | 3.8 ± 1.5 | 111 ± 10 | 0.977 |
* Rcorr – коэффициент корреляции уравнения (3).
Анализ данных табл. 3 показал, что для растворов LiAsF6 и LiClO4 в ДМФА характерны меньшие вклады растворителя (E #0) в энергию активации ионной проводимости, чем для ПК. Значения параметров E #el в уравнении (3), отвечающих за вклад ионофора в энергию активации ионной проводимости, для растворов LiClO4 в ДМФА больше, чем для LiAsF6 в ДМФА, что согласуется с меньшими значениями удельной электропроводности растворов LiClO4 по сравнению с растворами LiAsF6 в том же растворителе. Согласно ион-миграционному механизму, перенос заряда осуществляется посредством прыжков ионов из одного положения равновесия в другое под действием электрического поля [31] и параметр E #el в уравнении (3) характеризует перемещение ионов растворенного вещества в электрическом поле с учетом взаимодействий ион–растворитель. Поскольку для указанных растворов ионофоров ион лития является общим катионом и вязкость растворителя ДМФА одинаковая, то различие в процессах переноса заряда определяется, прежде всего, перемещением анионов. Согласно литературным данным, кристаллографический радиус арсенат-иона (${{r}_{{{\text{AsF}}_{6}^{ - }}}}$ = 3.84 Å [35]) больше кристаллографического радиуса перхлорат-иона (${{r}_{{{\text{ClO}}_{4}^{ - }}}}$ = = 2.40 Å [35]), а электропроводность в растворах LiAsF6 в ДМФА выше, чем в растворах LiClO4 в этом же растворителе. Вероятно, перхлорат-ион в ДМФА подвергается большей сольватации по сравнению с арсенат-ионом, в результате чего образуется сольват-ион ${\text{ClO}}_{{\text{4}}}^{ - }$ c молекулами ДМФА, которому труднее передвигаться, чем иону ${\text{AsF}}_{{\text{6}}}^{ - }.$ Большие по размеру ионы ${\text{AsF}}_{{\text{6}}}^{ - }$ сольватируются хуже, что может быть связано с меньшей напряженностью электрического поля вокруг иона ${\text{AsF}}_{{\text{6}}}^{ - }$ [36].
Несколько иная картина наблюдается в растворах LiAsF6 и LiClO4 в пропиленкарбонате. Как известно [2, 37], в отличие от иона ${\text{AsF}}_{{\text{6}}}^{ - },$ перхлорат-ионы в пропиленкарбонате проявляют некоторую склонность к взаимодействию с ионом лития (константа ассоциации LiClO4KА = 1.3 [моль–1 дм3] [37]) и молекулы растворителя сольватируют возможно образующиеся ионные пары наряду со свободными анионами ${\text{ClO}}_{{\text{4}}}^{ - },$ при этом изменяются их геометрические параметры и перераспределяется электронная плотность. Эти факторы затрудняют сравнение эффектов сольватации свободных анионов ${\text{AsF}}_{{\text{6}}}^{ - }$ и ${\text{ClO}}_{{\text{4}}}^{ - }$ на энергию активации ионной проводимости. Кроме того, небольшое снижение величины E #el при переходе от аниона ${\text{AsF}}_{{\text{6}}}^{ - },$ имеющего в структуре шесть атомов фтора, координированных мышьяком, к ${\text{ClO}}_{{\text{4}}}^{ - }$-аниону с менее объемной структурой свидетельствует об уменьшении энергетических затрат на образование вакансий (полости) в жидкости и на процесс их перехода в эти вакансии. По-видимому, полученные значения параметра E #el для арсенат- и перхлорат-ионов в пропиленкарбонате отражают совокупный эффект от процессов сольватации ионных частиц, образования полости в растворителе и перемещения анионов в образовавшуюся полость.
Различная сольватация ионофоров связана с различными значениями донорных чисел пропиленкарбоната (DN(ПК) = 15.1 [38]) и N,N-диметилформамида (DN(ДМФА) = 26.6 [38]). Большее значение донорного числа ДМФА по сравнению с донорным числом ПК обуславливает более сильное влияние взаимодействий растворенное вещество – растворитель на процесс переноса заряда в растворах с ДМФА. Однако кроме сольватации ионов, на процесс их перемещения оказывает существенное воздействие вязкость растворителя. Динамическая вязкость ДМФА (η = 0.802 Па с [38]) примерно в три раза меньше, чем ПК (η = = 2.53 Па с [38]), что приводит к повышению удельной электропроводности (χ) в растворах LiAsF6 в ДМФА по сравнению с ее значением в системе LiAsF6–ПК, несмотря на то, что ионофор LiAsF6 подвергается большей сольватации в N,N-диметилформамиде, чем в пропиленкарбонате. Энергия активации ионной проводимости ниже для растворов гексафторарсената лития в ДМФА (рис. 1).
В табл. 4 представлены данные, полученные с использованием уравнения (3), для зависимости энергий активации ионной проводимости от состава бинарной смеси ПК–ДМФА в исследуемых растворах LiAsF6. Для перевода моляльной концентрации LiAsF6 в смешанном растворителе в мольную долю растворенного вещества (х2) применялись молярные массы смешанного растворителя, рассчитанные по формуле (4)
(4)
$M = \left( {{{M}_{{{\text{ПК}}}}}{{\gamma }_{1}} + {{M}_{{{\text{ДМФА}}}}}{{\gamma }_{2}}} \right),$Таблица 4.
Параметры уравнения (3) для растворов LiAsF6 в смешанном растворителе пропиленкарбонат–N,N-диметилформамид (γ2 – мольная доля ДМФА)
| γ2 | М*, г моль–1 | E #0, кДж моль–1 | E #el, кДж моль–1 | Rcorr** |
|---|---|---|---|---|
| 0.2997 | 93.40 | 8.42 ± 1.67 | 130 ± 15 | 0.968 |
| 0.5094 | 87.45 | 8.01 ± 1.09 | 104 ± 10 | 0.976 |
| 0.7651 | 79.91 | 7.93 ± 0.52 | 70 ± 6 | 0.982 |
** Rcorr – коэффициент корреляции уравнения (3).
где МПК, МДМФА – молярные массы ПК и ДМФА соответственно; γ1, γ2 – мольные доли ПК и ДМФА соответственно. Добавление к системе LiAsF6–ПК второго растворителя приводит сначала к увеличению параметра E #el за счет предпочтительной сольватации ионофора молекулами ДМФА, компенсирующееся по мере увеличения содержания N,N-диметилфомамида уменьшением вязкости среды, в которой происходит перемещение ионов.
Потенциалы разложения
Результаты исследований потенциалов разложения системы LiAsF6/ПК–ДМФА при разных соотношениях со-растворителей в смеси представлены в табл. 5 и на рис. 2, что согласуется с данными работы [27]. На катодных поляризационных кривых (рис. 2а) при потенциалах от –2.0 до –2.5 В наблюдаются пики токов, связанные с восстановлением остаточной воды, не удаляемой осушителями [26], а при потенциалах отрицательнее –3.2 В происходит восстановление катиона Li+ [25].
Таблица 5.
Потенциалы разложения раствора LiAsF6 (m = 0.5 моль кг–1) в бинарном растворителе пропиленкарбонат–N,N-диметилформамид при 298.15 К (γ2 – мольная доля N,N-диметилформамида)
| γ2 | Ек, В | Еа, В | Электрохимическое окно, В |
|---|---|---|---|
| 0 | –3.35 | 1.30 | 4.65 |
| 0.19 | –3.45 | 1.15 | 4.60 |
| 0.48 | –3.57 | 1.01 | 4.58 |
| 0.8 | –3.62 | 0.95 | 4.57 |
| 1 | –3.70 | 0.93 | 4.63 |
Рис. 2.
Катодные (а) и анодные (б) вольт-амперные кривые 0.5m LiAsF6 растворов в смешанном растворителе пропиленкарбонат–N,N-диметилформамид при разных мольных долях (м. д.) N,N-диметилформамида (γ2: 1 – 0.0; 2 – 0.19; 3 – 0.48; 4 – 0.8; 5 – 1.0 м. д.).
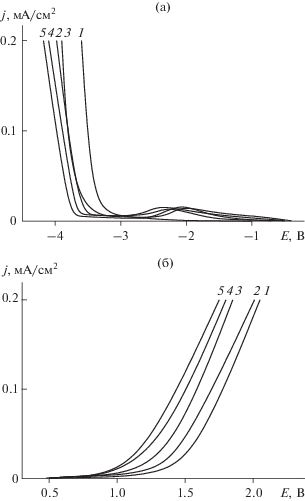
Анодная устойчивость исследуемых электролитных растворов (рис. 2б) связана с окислением растворителя. В результате окисления пропиленкарбоната происходит образование интермедиатов за счет раскрытия кольца в структуре растворителя [39], а также возможно образование радикала ацетона и CO2, согласно результатам квантово-химических расчетов [40]. В случае N,N-диметилформамида окисление включает стадию отрыва электрона от азота амида, за которой следует стадия потери протона с образованием радикала НСОN(СН3)${\text{CH}}_{{\text{2}}}^{ \bullet },$ который реагирует на электроде с другими компонентами системы [41–43]. Анодная устойчивость исследуемых растворов уменьшается с увеличением донорного числа растворителя.
Потенциалы разложения исследуемой системы зависят от состава растворителя. С увеличением содержания ДМФА в электролитной системе происходит уменьшение потенциалов разложения в анодной области и смещение их в отрицательную сторону в катодной области. Подобное смещение потенциалов выделения лития в отрицательную сторону связано с затруднением стадии десольватации сольватированного иона лития при увеличении донорной способности растворителя. Поскольку ДМФА обладает большим донорным числом по сравнению с ПК, то происходит предпочтительная сольватация ионофора N,N-диметилформамидом.
Сравнение катодных поляризационных кривых, полученных для LiAsF6 в бинарных смесях пропиленкарбоната с N,N-диметилформамидом и ацетонитрилом (АН) [15], показало последовательное изменение потенциала восстановления иона лития при изменении содержания растворителей в бинарной смеси. В случае электролитных систем на основе ПК–АН катодные потенциалы разложения менялись скачкообразно в зависимости от состава бинарной смеси, что позволило сделать предположение о конкуренции двух процессов: сольватации ионов лития и образования комплекса между молекулами пропиленкарбоната и ацетонитрила [44]. Этого не наблюдалось для исследуемых растворов LiAsF6 в смеси ПК–ДМФА, что, по-видимому, свидетельствует о слабом межмолекулярном взаимодействии пропиленкарбоната и N,N-диметилформамида.
ЗАКЛЮЧЕНИЕ
Таким образом, определены электропроводность и потенциалы разложения электролитной системы, содержащей гексафторарсенат лития в смешанном растворителе пропиленкарбонат–N,N-диметилформамид в интервале температур от 253.15 до 333.15 К. Показано, что в исследуемых растворах LiAsF6/ПК–ДМФА перенос ионов в изученной области концентраций ионофора осуществляется по ион-миграционному механизму. Максимальными значениями удельной электропроводности обладают растворы ионофора в N,N-диметилформамиде вследствие незначительной динамической вязкости растворителя. Электролит LiAsF6/ПК–ДМФА проявляет высокую химическую стабильность при контакте с литием, о чем свидетельствует достаточно широкое электрохимическое окно, составляющее в среднем 4.6 В при разных составах смешанного растворителя, и пригоден для использования в электрохимических устройствах хранения энергии.
Список литературы
Rajput, N.N., Seguin, T.J., Wood, B.M., Qu, X., and Persson, K.A., Elucidating solvation structures for rational design of multivalent electrolytes – A review, Top. Curr. Chem. (Z), 2018, vol. 376, p. 19. https://doi.org/10.1007/s41061-018-0195-2
Kartha, T.R. and Mallik, B.S., Revisiting LiClO4 as an electrolyte for Li-ion battery: Effect of aggregation behavior on ion-pairing dynamics and conductance, J. Mol. Liq., 2020, vol. 302, p. 112536. https://doi.org/10.1016/j.molliq.2020.112536
Flores, E., Åvall, G., Jeschke, S., and Johansson, P., Solvation structure in dilute to highly concentrated electrolytes for lithium-ion and sodium-ion batteries, Electrochim. Acta, 2017, vol. 233, p. 134. https://doi.org/10.1016/j.electacta.2017.03.031
Ярмоленко, О.В., Юдина, А.В., Игнатова, А.А. Современное состояние и перспективы развития жидких электролитных систем для литий-ионных аккумуляторов. Электрохим. энергетика. 2016. Т. 16. № 4. С. 155. [Yarmolenko, O.V., Yudina, A.V., and Ignatova, A.A., The state-of-the art and prospects for the development of electrolyte systems for lithium power sources, Electrochem. Energetics, 2016, vol. 16, p. 155.]
Игнатова, А.А., Тулибаева, Г.З., Ярмоленко, О.В., Фатеев, С.А. Электролитные системы для первичных литий-фторуглеродных источников тока и их работоспособность в широком интервале температур. Электрохимия. 2017. Т. 53. С. 330. [Ignatova, A.A., Tulibaeva, G.Z., Yarmolenko, O.V., and Fateev, S.A., Electrolyte systems for primary lithium fluorocarbon power sources and their working efficiency in a wide temperature range, Russ. J. Electrochem., 2017, vol. 53, p. 292.] https://doi.org/10.1134/S1023193517030077
Xu, K., Nonaqueous Liquid Electrolytes for Lithium-based Rechargeable Batteries, Chem. Rev., 2004, vol. 104, p. 4303. https://doi.org/10.1021/cr030203g
Wu, F. and Wu, C., New secondary batteries and their key materials based on the concept of multi-electron reaction, Chin. Sci. Bull., 2014, vol. 59, p. 3369. https://doi.org/10.1007/s11434-014-0430-3
Choudhary, Sh., Dhatarwal, P., and Sengwa, R.J., Characterization of conductivity relaxation processes induced by charge dynamics and hydrogen-bond molecular interactions in binary mixtures of propylene carbonate with acetonitrile, J. Mol. Liq., 2017, vol. 231, p. 491. https://doi.org/10.1016/j.molliq.2017.02.036
Mozhzhukhina, N., Longinotti, M.P., Corti, H.R., and Calvo, E.J., A conductivity study of preferential solvation of lithium ion in acetonitrile–dimethyl sulfoxide mixtures, Electrochim. Acta, 2015, vol. 154, p. 456. https://doi.org/10.1016/j.electacta.2014.12.022
Sodeyama, K., Yamada, Y., Aikawa, K., Yamada, A., and Tateyama, Y., Sacrificial anion reduction mechanism for electrochemical stability improvement in highly concentrated Li-salt electrolyte, J. Phys. Chem. C., 2014, vol. 118, p. 14091. https://doi.org/10.1021/jp501178n
Cecchetto, L., Salomon, M., Scrosati, B., and Croce, F., Study of a Li–air battery having an electrolyte solution formed by a mixture of an ether-based aprotic solvent and an ionic liquid, J. Power Sources, 2012, vol. 213, p. 233. https://doi.org/10.1016/j.jpowsour.2012.04.038
Черножук, Т.В., Дубовицкая, В.Ю., Калугин, О.Н. Электрическая проводимость и ассоциация Bu4NBPh4 в смесях пропиленкарбоната с 1,2-диметоксиэтаном. Вісник Харк. нац. ун-ту. 2009. Т. 17(40). С. 189. [Chernozhyk, T.V., Dubovitskaya, V.Yu., and Kalugin, O.N., Electrical conductivity and association of Bu4NBPh4 in mixtures of propylene carbonate with 1,2-dimethoxyethane, Visnik Khark. nat. un-tu. (in Ukrainian), 2009, vol. 17(40), p. 189.]
Карапетян, Ю.А., Эйчис, В.Н. Физико-химические свойства электролитных неводных растворов, М.: Химия, 1989. 256 с. [Karapetyan, Yu.A. and Eychic, V.N., Physico-chemical properties of electrolytic non-aqueoussolutions (in Russian), Moscow: Khimiya, 1989. 256 p.]
Logan, E.R., Tonita, E.M., Gering, K.L., Li, J., Ma, X., Beaulieu, L.Y., and Dahn, J.R., A study of physical properties of Li-ion battery electrolytes containing esters, J. Electrochem. Soc., 2018, vol. 165(2), p. A21. https://doi.org/10.1149/2.0271802jes
Тюнина, Е.Ю., Чекунова, М.Д. Электрохимические свойства растворов LiAsF6 в смешанном растворителе пропиленкарбонат-ацетонитрил. Электрохимия. 2019. Т. 55. С. 222. [Tyunina, E.Yu. and Chekunova, M.D., Electrochemical properties of LiAsF6 solutions in propylene carbonate – acetonitrile binary mixtures, Russ. J. Electrochem., 2019, vol. 55, p. 122.] https://doi.org/10.1134/S1023193519010142
Borodin, O., Polarizable force field development and molecular dynamics simulations of ionic liquids, J. Phys. Chem. B, 2009, vol. 113, p. 11463. https://doi.org/10.1021/jp905220k
Афанасьев, В.Н., Зятькова, Л.А., Тюнина, Е.Ю., Чекунова, М.Д. Сольватационные взаимодействия в растворах гексафторарсената лития в пропиленкарбонате. Электрохимия. 2001. Т. 37. С. 56. [Afanas’ev, V.N., Zyat’kova, L.A., Tyunina, E.Yu., and Chekunova, M.D., Solvation interactions in solutions of lithium hexafluoroarsenate in propylene carbonate, Russ. J. Electrochem., 2001, vol. 37, p. 46.]
Afanasyev, V.N. and Zyatkova, L.A., Speed of sound, densities, and viscosities for solutions of lithium hexafluoroarsenate in tetrahydrofuran at 283.15, 298.15 and 313.15 K, J. Chem. Eng. Data, 1996, vol. 41, p. 1315. https://doi.org/10.1021/je960003k
Ничуговский, Г.Ф. Определение влажности химических веществ, Л.: Химия, 1977. 200 с. [Nichugovskiy, G.F., Determination of the humidity of chemicals (in Russian), L.: Khimiya, 1977. 200 p.]
Тюнина, Е.Ю., Чекунова, М.Д., Афанасьев, В.Н. Электрохимические характеристики растворов тетрафторбората тетраэтиламмония в пропиленкарбонате. Электрохимия. 2013. Т. 49. С. 509. [Tyunina, E.Yu., Chekunova, M.D., and Afanasiev, V.N., Electrochemical characteristics of propylene carbonate solutions of tetraethylammonium tetrafluoroborate, Russ. J. Electrochem., 2013, vol. 49, p. 453.] https://doi.org/10.1134/S1023193513050157
Гордон, А., Форд, Р. Спутник химика, М.: Мир, 1976. 541 с. [Gordon, A.J. and Ford, R.A., The chemist’s companion. A handbook of practical data, techniques, and references, N.Y.–L.: Wiley, 1972. 541 p.]
Jones, G. and Prendergast, M.J., The measurement of the conductance of electrolytes. VIII. A redetermination of the conductance of Kohlrausch’s standard potassium chloride solutions in absolute units, J. Amer. Chem. Soc., 1937, vol. 59, p. 731. https://doi.org/10.1021/ja01283a039
Колосницын, В.С., Шеина, Л.В., Мочалов, С.Э. Физико-химические и электрохимические свойства растворов литиевых солей в сульфолане. Электрохимия. 2008. Т. 44. С. 620. [Kolosnitsyn, V.S., Sheina, L.V., and Mochalov, S.E., Physicochemical and electrochemical properties of sulfolane solutions of lithium salts, Russ. J. Electrochem., 2008, vol. 44, p. 575.] https://doi.org/10.1134/S102319350805011X
Стенина, И.А., Кулова, Т.Л., Скундин, А.М., Ярославцев, А.Б. Анодный материал на основе наноразмерного титаната лития. Журн. неорган. химии. 2015. Т. 60. №11. С. 1506. [Stenina, I.A., Kulova, T.L., Skundin, A.M., and Yaroslavtsev, A.B., Anode material based on nanosized lithium titanate, Russ. J. Inorg. Chem., 2015, vol. 60, p. 1380.] https://doi.org/10.1134/S0036023615110170
Tyunina, E.Yu. and Chekunova, M.D., Electrochemical properties of lithium hexafluoroarsenate in methyl acetate at various temperatures, J. Mol. Liq., 2013, vol. 187, p. 332. https://doi.org/10.1016/j.molliq.2013.08.019
Тюнина, Е.Ю., Чекунова, М.Д. Электрохимические свойства растворов LiAsF6 в малополярных апротонных растворителях. Электрохимия. 2015. Т. 51. С. 38. [Tyunina, E.Yu. and Chekunova, M.D., Electrochemical properties of LiAsF6 solutions in low-polar aprotic solvents, Russ. J. Electrochem., 2015, vol. 51, p. 32.] https://doi.org/10.1134/S1023193515010115
Зятькова, Л.А., Афанасьев, В.Н., Крестов, Г.А., Иванова, Т.В. Влияние растворителя на потенциалы разложения неводных растворов гексафторарсената лития. Электрохимия. 1993. Т. 29. С. 946. [Zyatkova, L.A., Afanasyev, V.N., Krestov, G.A., and Ivanova, T.V., Effect of solvent on the potentials of decomposition of lithium hexafluoroarsenate non-aqueous solutions, Russ. J. Electrochem., 1993, vol. 29, p. 946 (in Russian).]
Ионные жидкости: теория и практика, Цивадзе, А.Ю., отв. ред., Иваново: АО Ивановский издательский дом, 2019. 662 с. [Ionic liquids: theory and practice (in Russian), Tsivadze, A. Yu., Ed., Ivanovo: JSC Ivanovsky Publishing House, 2019. 662 p.]
Фиалков, Ю.Я., Грищенко, В.Ф. Электровыделение металлов из неводных растворов, Киев: Наук. думка, 1985. 240 с. [Fialkov, Yu.Ya. and Grischenko, V.F., Electrovydelenie metallov iz nevodnih rastvorov (in Russian), Kiev: Nauk. dumka, 1985. 240 p.]
Casteel, J.F. and Amis, E.S., Specific conductance of concentrated solutions of magnesium salts in water-ethanol system, J. Chem. Eng. Data, 1972, vol. 17, p. 55. https://doi.org/10.1021/je60052a029
Erdey-Gruz, T., Transport Phenomena in Aqueous Solutions, Budapest: Akademiai Kiado, 1974. 420 p.
Глесстон, С., Лейдер, К., Эйринг, Г. Теория абсолютных скоростей реакций, М.: Изд-во иностр. лит-ры, 1948. 583 с. [Glasstone, S., Laidler, K., and Eyring, H., The theory of rate processes, N.Y.: McGraw-Hill, 1941. 580 p.]
Тюнина, Е.Ю., Чекунова, М.Д. Электропроводность растворов LiAsF6 в апротонных растворителях с различной диэлектрической проницаемостью. Изв. вузов. Химия и хим. технология. 2015. Т. 58. С. 112. [Tyunina, E.Yu. and Chekunova, M.D., Electroconductivity of solutions of LiAsF6 in aprotic solvents with different permittivity, Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. (in Russian), 2015, vol. 58, p.112.]
Chagnes, A., Carré, B., Willmann, P., and Lemordant, D., Ion transport theory of nonaqueous electrolytes. LiClO4 in γ-butyrolactone: the quasi lattice approach, Electrochim.Acta, 2001, vol. 46, p. 1783.
Демахин, А.Г., Овсянников, В.М., Пономаренко, С.М. Электролитные системы литиевых ХИТ, Саратов: Изд-во Сарат. ун-та, 1993. 220 с. [Demahin, A. G., Ovsyannikov, V.M., and Ponomarenko, S.M., Elekrolitnye sistemy dlya litievyh HIT (in Russian), Saratov: Izd-vo Sarat. un-ta, 1993. 220 p.]
Измайлов, Н.А. Электрохимия растворов, М.: Химия, 1966. 576 с. [Izmailov, N.A., Electrochemistry of solutions (in Russian), M.: Chemistry, 1966. 576 p.]
Salomon, M., Conductance of solutions of lithium bis(trifluoromethanesulfone)imid in water, propylene carbonate, acetonitrile and methyl formate at 25°C, J. Solution Chem., 1993, vol. 22, no.8, p. 715.
Izutsu, K., Electrochemistry in Nonaqueous Solutions, Weinheim: Wiley-VCH Verlag, 2002. 415 p.
Kanamura, K., Umegaki, T., Ohashi, M., Toriyama, Sh., Shiraishi, S., and Takehara, Z., Oxidation of propylene carbonate containing LiBF4 or LiPF6 on LiCoO2 thin film electrode for lithium batteries, Electrochim. Acta, 2001, vol. 47, p. 433.
Leggesse, E.G., Lin, R.T., Teng, T.-F., Chen, Ch.-L., and Jiang, J.-Ch., Oxidative Decomposition of Propylene Carbonate in Lithium Ion Batteries: A DFT Study, J. Phys. Chem. A, 2013, vol. 117, p. 7959. https://doi.org/10.1021/jp403436u
Электрохимия металлов в неводных растворах, Колотыркин, Я.М., ред., М.: Мир, 1974. 440 с. [Electrochemistry of metals in non-aqueous solutions (in Russian), Kolotirkin, Ya.M., Ed., M.: Mir, 1974. 440 p.]
Chen, Y., Freunberger, S.A., Peng, Z., Barde,́ F., and Bruce, P.G., Li–O2 Battery with a dimethylformamide electrolyte, J. Am. Chem. Soc., 2012, vol. 134, p. 7952. dx.doi.org/https://doi.org/10.1021/ja302178w
Fadel, E.R., Faglioni, F., Samsonidze, G., Molinari, N., Merinov, B.V., Goddard III, W.A., Grossman, J.C., Mailoa, J.P., and Kozinsky, B., Role of solvent-anion charge transfer in oxidative degradation of battery electrolytes, Nat. Commun., 2019, vol. 10, p. 3360. https://doi.org/10.1038/s41467-019-11317-3
Тюнина, Е.Ю., Чекунова, М.Д. Физико-химические свойства бинарных растворов пропиленкарбонат-ацетонитрил в интервале 253.15–313.15 К. Журн. физ. химии. 2017. Т. 91. С. 845. [Tyunina, E.Yu. and Chekunova, M.D., Physicochemical properties of binary solutions of propylene carbonate–acetonitrile in the range of 253.15–313.15 K, Russ. J. Phys. Chem. A, 2017, vol. 91, p. 894.] https://doi.org/10.1134/S0036024417050260
Дополнительные материалы отсутствуют.


