Электрохимия, 2021, T. 57, № 4, стр. 249-255
Синтез и исследование ионной проводимости LiZr2(VO4)x(PO4)3 – x
В. И. Петьков a, *, А. С. Шипилов a, **, Д. Г. Фукина a, И. А. Стенина b, А. Б. Ярославцев b
a Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: petkov@inbox.ru
** E-mail: as-shipilov@yandex.ru
Поступила в редакцию 30.07.2020
После доработки 10.09.2020
Принята к публикации 22.09.2020
Аннотация
Ванадат-фосфаты LiZr2(VO4)x(PO4)3 –x синтезированы золь–гель-методом с последующей термообработкой и исследованы с помощью рентгенофазового анализа, ИК-спектроскопии, синхронных дифференциальной сканирующей калориметрии, термогравиметрического анализа и импедансной спектроскопии. Обнаружено образование в системе LiZr2(VO4)x(PO4)3 –x ограниченного ряда твердых растворов (0 ≤ х ≤ 0.8) со структурой типа NASICON (Sc2(WO4)3). Увеличение содержания ванадия в системе LiZr2(VO4)x(PO4)3 –x приводит к росту литий-ионной проводимости, которая для LiZr2(VO4)0.6(PO4)2.4 достигает 6.3 × 10–3 См/см при 570 K. На температурных зависимостях проводимости образцов с x = 0.4–0.8 при повышенных температурах зафиксированы изломы, которые обусловлены растворением серебра из электродов в исследуемых материалах.
ВВЕДЕНИЕ
Развивающийся рынок мобильных устройств и беспроводных технологий повысил спрос на литий-ионные аккумуляторы (ЛИА). Такие аккумуляторы благодаря высоким значениям удельной емкости, КПД и разности потенциалов массово применяются для питания электронных устройств [1, 2]. Одним из основных составляющих элементов ЛИА, которые в существенной мере определяют их мощность и безопасность, является электролит [3]. В большинстве современных ЛИА используются жидкие или гелевые электролиты [4], которые представлены растворами солей лития с крупным однозарядным анионом в различных апротонных растворителях [5, 6]. Основным преимуществом жидких электролитов является высокая проводимость, однако им присущ ряд недостатков, среди которых можно отметить небезопасность циклирования, одновременный перенос катиона и аниона [7]. В связи с этим в качестве альтернативы широко исследуются полимерные и твердые неорганические электролиты для полностью твердотельных аккумуляторов [8–10]. К основным преимуществам твердых электролитов стоит отнести высокую безопасность и возможность использования в широком интервале температур. В качестве таковых наиболее часто используются сложные сульфиды или фосфаты со структурой NASICON, материалы типа LISICON или со структурой граната [11–14]. Среди материалов со структурой NASICON значительный интерес представляет LiZr2(PO4)3 ввиду высокого потенциала восстановления. Однако при комнатной температуре ионная проводимость его низкотемпературной (триклинной) и высокотемпературной (ромбоэдрической) модификаций ниже, чем требуется для применения в ЛИА [15]. Структурные изменения при фазовом переходе связаны с перераспределением внекаркасных катионов лития в элементарной ячейке. В то же время широкие пределы изоморфных замещений дают возможность повысить проводимость LiZr2(PO4)3 за счет варьирования концентрации дефектов и/или размеров проводящих каналов. Так, авторами работы [16] получен материал состава Li1.4Ca0.2Zr1.8(PO4)3, проводимость которого при комнатной температуре достигла 4.2 × 10–5 См см–1.
Большая часть исследований, направленных на улучшение электрофизических характеристик LiZr2(PO4)3, выполнена посредством гетеровалентных замещений в позиции Zr, что ведет к повышению концентрации носителей. В работе [17] рост ионной проводимости твердого раствора LiZr2(AsO4)x(PO4)3 –x с увеличением значения x обусловлен ростом разупорядочения решетки по мере частичного замещения фосфора на мышьяк, что приводит к изменению условий переноса ионов лития по участкам с разным окружением. Нельзя исключить и роли увеличения размера проводящих каналов при замещении фосфора более крупным мышьяком. В этой связи можно ожидать повышения проводимости и в системе LiZr2(VO4)x(PO4)3 –x при замещении фосфора более крупным ванадием. Поэтому целью данной работы является синтез LiZr2(VO4)x(PO4)3 –x и исследование влияния замещения фосфора ванадием на ионную проводимость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез литий-цирконий-ванадат-фосфатов состава LiZr2(VO4)x(PO4)3 –x в интервале значений x от 0 до 0.8 проводили золь–гель-методом из растворов хлорида лития, оксихлорида циркония, фосфорной кислоты и метаванадата аммония. Для синтеза использовали реактивы квалификации “х. ч.”. Реакционные смеси высушивали при 363–423 K и подвергали термообработке на воздухе при 873, 1073 K не менее 24 ч на каждой стадии. При синтезе образцов использовали спекающую добавку ZnO в количестве 0.75 мас. % [18]. Оксид цинка добавляли в образцы, отожженные при 873 K, после чего прессовали таблетки при 200 МПа и подвергали отжигу при 1073 K. Поэтапный нагрев образцов чередовали с диспергированием. Синтезированные образцы представляли собой поликристаллические порошки желто-коричневого цвета.
Рентгенограммы образцов записывали на дифрактометре XRD-6000 (CuKα-излучение, λ = = 1.54178 Å, диапазон углов 2θ = 10°–50°). Для установления фазового состава образцов в процессе их получения после каждого этапа изотермического обжига и контроля однофазности полученных продуктов использовали рентгенофазовый анализ.
Состав образцов и характер связанности в структуре каркаса подтверждали ИК-спектроскопическими исследованиями. Спектры поглощения были записаны на ИК-Фурье-спектрометре FSM-1201 в диапазоне волновых чисел 400–1400 см–1.
Дифференциальную сканирующую калориметрию и термогравиметрический анализ синтезированных образцов проводили с использованием синхронного термоанализатора DTG-60H фирмы Shimadzu в интервале температур 323–1073 K при скорости нагрева и охлаждения 10 град/мин.
Ионную проводимость измеряли с помощью моста переменного тока ИПУ-62 в диапазоне частот 10 Гц–2 MГц с использованием цилиндрических прессованных таблеток (R = 5 мм, h = 2 мм) с серебряными электродами в интервале температур 323–733 K. Скорость нагрева составляла 2 К/мин. Типичные годографы импеданса приведены на рис. 1. Величину проводимости рассчитывали экстраполяцией полуокружности объемной составляющей проводимости на ось активных сопротивлений.
Анализ распределения ионов циркония и серебра в исследуемых образцах проводили с помощью сканирующего электронного микроскопа Carl Zeiss NVision 40, оснащенного приставкой для микрозондового анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно данным рентгенофазового анализа, получены однофазные образцы LiZr2(VO4)x(PO4)3 –x (x = 0–0.8) при 1073 K, кристаллизующиеся в структурном типе NASICON (Sc2(WO4)3). С изменением состава твердого раствора наблюдается лишь плавное смещение дифракционных максимумов (рис. 2).
По результатам индицирования порошковых рентгенограмм наблюдается монотонный рост параметров элементарной ячейки, который обусловлен замещением атомов фосфора (rКЧ 4 = 0.17 Å) на более крупный ванадий (rКЧ 4 = 0.355 Å) (рис. 3).
Анализ ИК-спектров однофазных образцов ванадат-фосфатов показал наличие в их составе тетраэдрических группировок PO4 и VO4, отсутствие конденсированных фосфатов и ванадатов. Наблюдаемое число полос в ИК-спектрах LiZr2(VO4)x(PO4)3 –x (пр. гр. P21/n) достаточно высокое, однако меньше предсказанного правилами отбора, которые допускают по 18 полос асимметричных валентных νas и деформационных δas-колебаний и по 6 полос симметричных валентных νs и деформационных δs-колебаний.
На кривых дифференциальной сканирующей калориметрии образцов LiZr2(VO4)x(PO4)3 –x (x = = 0.4–0.8) наблюдаются аномалии, которые могут быть связаны с фазовым или химическим превращением, которому соответствует размытый по температуре эндоэффект при 673–873 K (рис. 4). Нагревание образцов от 298 до 1073 K, по данным термогравиметрического анализа, сопровождалось небольшой потерей массы, не имевшей значимых аномалий (рис. 4). Рентгенограммы образцов LiZr2(VO4)x(PO4)3 –x (x = 0.4–0.8) до и после ДСК исследования, снятые при комнатной температуре, практически совпадают в пределах погрешности. Данные РФА и ДСК показывают, что при температурах выше фазового превращения каркасный тип структуры твердого раствора сохраняется, изменение кристаллической решетки незначительное и происходит достаточно медленно.
Этот эффект воспроизводится при повторных измерениях. Аналогичные фазовые превращения, которые носят диффузный характер и размыты по температуре, наблюдали для фосфатов Li3R2(PO4)3 c R = Sc, Cr, Fe и твердого раствора Li3Sc2 –xFex(PO4)3 [19]. Указанный переход, согласно данным структурных исследований, обусловлен разупорядочением литиевой подрешетки, изменения в каркасе минимальны.
Измерение проводимости в диапазоне 360–740 K демонстрирует схожую картину с системой LiZr2(AsO4)x(PO4)3 –x [16]. Наблюдается рост проводимости при увеличении содержания ванадия до х = 0.6, дальнейшее увеличение степени замещения слабо влияет на проводимость (рис. 5). Для образцов с х = 0–0.2 температурные зависимости ионной проводимости подчиняются закону Аррениуса во всей области изученных температур. В то же время для образцов с х = 0.4–0.8 повышение температуры выше области 570 К приводит к существенному замедлению темпов роста и даже к некоторому снижению проводимости. Причем при дальнейшем повышении температуры выше 670 K проводимость вновь растет. Максимальное значения проводимости при Т = = 570 K составляет 6.3 × 10–3 См/см для образца LiZr2(VO4)0.6(PO4)2.4.
Рис. 5.
Температурные зависимости проводимости моноклинных твердых растворов LiZr2(VO4)x(РO4)3 –x, где x = 0 (1), 0.2 (2), 0.4 (3), 0.6 (4), 0.8 (5).

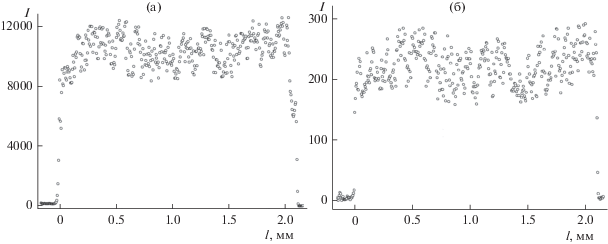
Такое поведение совершенно не типично для твердых электролитов с ионной проводимостью, поскольку последняя, безусловно, является активационным процессом [3]. Причем по данным термогравиметрии (рис. 4) в данной области нет ни химических, ни фазовых превращений. Единственным логичным объяснением этого эффекта является то, что снижение проводимости образцов с х = 0.4–0.8 в диапазоне температур 560–670 K связано с частичным восстановлением ванадия за счет его взаимодействия с мелкодисперсным серебром, используемым в качестве электродов. Подобный эффект ранее наблюдался нами при исследовании кислого фосфата циркония со структурой NASICON за счет восстановления водорода [20]. Кроме того, авторы [21] с помощью рентгенофазового анализа показали формирование ванадатов серебра при взаимодействии образцов литий-ванадиевых бронз с серебром при близких температурах. После проведения эксперимента по исследованию проводимости отчетливо видно отсутствие серебра на поверхности таблеток исследуемого материала. Малое содержание серебра и/или образование твердых растворов не позволяет нам зафиксировать образования новых фаз. Поэтому для подтверждения данного эффекта было исследовано распределение серебра и циркония по сколу таблетки LiZr2(VO4)0.6(РO4)2.4 после измерения проводимости (рис. 6). На полученных зависимостях отчетливо видно, что как распределение ионов циркония, так и серебра является равномерным, без экстремумов вблизи поверхности, где исходно находилось серебро. Это указывает на растворение серебра в полученном материале и достаточно высокую его подвижность в нем.
Рис. 6.
Распределение циркония (а) и серебра (б) по толщине скола таблетки LiZr2(VO4)0.6(РO4)2.4 после измерения проводимости.
Поскольку ионы серебра также могут участвовать в ионном переносе, можно было бы, напротив, ожидать повышения проводимости. Однако более значимую роль в данном случае, видимо, играет так называемый “полищелочной эффект”, который выражается ${\text{в}}$ понижении проводимости при наличии в образце пары подвижных ионов с различным зарядом [22]. Это так же, как и понижение поляризации анионов ${\text{PO}}_{4}^{{{\text{3}} - }},$ способствует понижению трансляционной подвижности катионов лития. Отметим также, что в образцах с низким содержанием ванадия (х = 0.2) данный эффект проявляется при более высоких температурах, а при (х = 0) не проявляется вовсе.
ЗАКЛЮЧЕНИЕ
Проведен синтез образцов LiZr2(VO4)x(РO4)3 –x. Результаты РФА- и ИК-спектроскопии свидетельствуют об образовании ограниченного твердого раствора со структурой NASICON (Sc2(WO4)3). Согласно данным ДСК и импедансной спектроскопии, образцы твердого раствора с x = 0.4–0.8 претерпевают фазовый переход. При изовалентном замещении P5+ → V5+ с увеличением x объем элементарной ячейки кристаллической структуры твердого раствора LiZr2(VO4)x(РO4)3 –x возрастает в соответствии с тем, что ионный радиус V5+ (0.355 Å) существенно больше, чем для P5+ (0.17 Å). Одновременно наблюдается и увеличение ионной проводимости. В то же время для материалов с высоким содержанием ванадия в области высоких температур наблюдается некоторое понижение проводимости, которое обусловлено растворением серебра из электродов в исследуемых материалах.
Список литературы
Scrosati, B. and Garche, J., Lithium Batteries: Status, Prospects and Future, J. Power Sources, 2010, vol. 195, p. 2419.
Ярославцев, А.Б., Кулова, Т.Л., Скундин, А.М. Электродные наноматериалы для литий-ионных аккумуляторов. Успехи химии. 2015. Т. 84. № 8. С. 826. [Yaroslavtsev, A.B., Kulova, T.L., and Skundin, A.M., Electrode nanomaterials for lithium-ion batteries, Russ. Chem. Rev., 2015, vol. 84, no. 8, p. 826.]
Zheng, F., Kotobuki, M., Song, S., Lai, M.O., and Lu L., Review on solid electrolytes for all-solid-state lithium-ion batteries, J. Power Sources, 2018, vol. 389, p. 198.
Kim, S.-W., Seo, D.-H., Ma, X., Ceder, G., and Kang, K., Electrode Materials for Rechargeable Sodium-Ion Batteries: Potential Alternatives to Current Lithium-Ion Batteries, Adv. Energy Mater., 2012, vol. 2, no. 7, p. 710.
Ponrouch, A., Monti, D., Boschin, A., Steen, B., Johansson, P., and Palacín, M.R., Non-aqueous electrolytes for sodium-ion batteries, J. Mater. Chem. A, 2015, vol. 3, no. 1, p. 22.
Kim, N., Myung, Y., Kang, H., Lee, J.-W., and Yang, M., Effects of Methyl Acetate as a Co-Solvent in Carbonate-Based Electrolytes for Improved Lithium Metal Batteries, ACS Appl. Mater. Interfaces, 2019, vol. 11, no. 37, p. 33844.
Stenina, I.A. and Yaroslavtsev, A.B., Nanomaterials for lithium-ion batteries and hydrogen energy, Pure Appl. Chem., 2017, vol. 89, no. 8, p. 1185.
Zhang, Q., Liu, K., Ding, F., and Liu, X., Recent advances in solid polymer electrolytes for lithium batteries, Nano Res., 2017, vol. 10, no. 12, p. 4139.
Voropaeva, D.Y., Novikova, S.A., Kulova, T.L., and Yaroslavtsev, A.B., Conductivity of Nafion-117 membranes intercalated by polar aprotonic solvents, Ionics, 2018, vol. 24, no. 6, p. 1685.
Deng, K., Zeng, Q., Wang, D., Liu, Z., Qiu, Z., Zhang, Y., Xiao, M., and Meng, Y., Single-ion conducting gel polymer electrolytes: design, preparation and application, J. Mater. Chem. A, 2020, vol. 8, no. 4, p. 1557.
Pinus, I.Yu., Khoroshilov, A.V., Gavrichev, K.S., Tarasov, V.P., and Yaroslavtsev, A.B., On cationic mobility in Nasicon phosphates LiTi2(PO4)3 and Li0.9Ti1.9Nb0.1(PO4)3, Solid State Ionics, 2012, vol. 212, p. 112.
Петьков, В.И., Орлова, А.И., Шехтман, Г.Ш. Кристаллохимия и электропроводность двойных фосфатов MxZr2.25 – 0.25x(PO4)3 (M = Li, Na, K, Rb, Cs) NZP-структуры. Электрохимия. 1996. Т. 32. С. 621.
Bachman, J.C., Muy, S., Grimaud, A., Chang, H.-H., Pour, N., Lux, S.F., Paschos, O., Maglia, F., Lupart, S., Lamp, P., Giordano, L., and Shao-Horn, Y., Inorganic Solid-State Electrolytes for Lithium Batteries: Mechanisms and Properties Governing Ion Conduction, Chem. Rev., 2016, vol. 116, no. 1, p. 140.
Kim, S., Jung, C., Kim, H., Thomas-Alyea, K.E., Yoon, G., Kim, B., Badding, M.E., Song, Z., Chang, J., Kim, J., Im, D., and Kang, K., The Role of Interlayer Chemistry in Li-Metal Growth through a Garnet-Type Solid Electrolyte, Adv. Energy Mater., 2020, vol. 10, no. 12, p. 1903993.
Петьков, В.И. Сложные фосфаты, образованные катионами металлов в степенях окисления I и IV. Успехи химии. 2012. Т. 81. № 7. С. 606. [Pet’kov, V.I., Complex phosphates formed by metal cations in oxidation states I and IV, Russ. Chem. Rev., 2012, vol. 81, no. 7, p. 606.]
Hanghofer, I., Gadermaier, B., Wilkening, A., Rettenwander, D., and Wilkening, H.M.R., Lithium ion dynamics in LiZr2(PO4)3 and Li1.4Ca0.2Zr1.8(PO4)3, Dalton Trans., 2019, vol. 48, p. 9376.
Петьков, В.И., Суханов, М.В., Шипилов, А.С., Куражковская, В.С., Боровикова, Е.Ю., Пинус, И.Ю., Ярославцев, А.Б. Синтез и свойства LiZr2(AsO4)3 и LiZr2(AsO4)x(PO4)3 –x. Неорган. материалы. 2014. Т. 50. № 3. С. 285. [Pet’kov, V.I., Sukhanov, M.V., Shipilov, A.S., Kurazhkovskaya, V.S., Borovikova, E.Y., Pinus, I.Y., and Yaroslavtsev, A.B., Synthesis and properties of LiZr2(AsO4)3 and LiZr2(AsO4)x(PO4)3 –x, Inorg. Mater., 2014, vol. 50, no. 3, p. 263.]
Суханов, М.В., Петьков, В.И., Фирсов, Д.В. Механизм спекания высокоплотной NZP-керамики. Неорган. материалы. 2011. Т. 47. № 6. С. 753. [Sukhanov, M.V., Pet’kov, V.I., and Firsov, D.V., Sintering mechanism for high-density NZP ceramics, Inorg. Mater., 2011, vol. 47, no 6, p. 674.]
Сигарев, С.Е. Суперионные проводники со смешанным каркасом [M2P3O12]3∞: кристаллическая структура и физические свойства. 1. Литийпроводящие фосфаты. Кристаллография. 1992. Т. 37. № 4. С. 4055.
Stenina, I.A., Kislitsyn, M.N, Pinus, I.Yu., and Yaroslavtsev, A.B., Phase transition through intermediate formation? Mendeleev Commun., 2004, vol. 14, no 5. p. 191.
Щелканова, М.С., Шехтман, Г.Ш., Калашнова, А.В., Антонов, Б.Д. Об изменении электропроводности литий-ванадиевой бронзы. Журн. прикладной химии. 2017. Т. 90. № 11. С. 1458. [Shchelkanova, M.S., Shekhtman, G.Sh., Kalashnova, A.V., and Antonov, B.D., On electrical conductivity measurement for lithium-vanadium bronze, Russ. J. Appl. Chem., 2017, vol. 90, no. 11, p. 1766.]
Smirnov, N.B., Burmakin, E.I., and Shekhtman, G.Sh., Polyalkaline effect in solid electrolytes with γ-K4P2O7 structure, Russ. J. Appl. Chem., 2000, vol. 73, no. 8, p. 1405.
Дополнительные материалы отсутствуют.






