Электрохимия, 2021, T. 57, № 4, стр. 239-248
Синтез палладиевых нанолент и их применение для электрохимического определения гемоглобина
Ч. Двараканат Шрути a, Г. Шиваппа Суреш a, *
a Женский колледж NMKRV
560011 Бангалор, Индия
* E-mail: sureshssmrv@yahoo.co.in
Поступила в редакцию 20.03.2020
После доработки 14.08.2020
Принята к публикации 31.08.2020
Аннотация
Изготовлен простой надежный электрод для определения гемоглобина с использованием палладиевых нанолент. Палладиевые наночастицы синтезированы с использованием плодов Магнолии заостренной (M. acuminata); в результате их самоорганизации получали палладиевые наноленты без использования каких-либо дополнительных реактивов. Физические характеристики модифицированного электрода определены методами рентгеновской дифракции, сканирующей электронной микроскопии и спектроскопии электрохимического импеданса. Электрохимические свойства разработанного электрода в применении к определению гемоглобина изучены методами циклической вольтамперометрии и хроноамперометрии. Этот модифицированный электрод весьма чувствителен к гемоглобину при потенциале –351 мВ. Его время срабатывания 2 с, наименьшая определяемая концентрация гемоглобина 0.039 мкM. Предложенный электрод устойчив и воспроизводим.
ВВЕДЕНИЕ
Наноматериалы находятся в фокусе всеобщего внимания при различных исследованиях благодаря их многочисленным применениям в различных областях, таких как производство катализаторов, ультрасовременная электроника, супермагниты, фотографические “эмульсии” и ксерография [1]. Применение наноматериалов в медицине вызывает большой интерес у исследователей и стимулирует изучение уникальных электронных и оптических свойств наноматериалов. Размерность – важный фактор при определении свойств таких наноматериалов. В последнее десятилетие особый интерес привлекают одномерные наноматериалы – такие как нанотрубки, нанопроволоки и наностержни. Среди этих одномерных наноматериалов у нанолент есть свое особое место в их применении. Для того, чтобы приготовить наноленты, необходимо вначале синтезировать наночастицы. По сравнению с золотом и платиной палладий более распространенный благородный металл, следовательно, он экономически выгоднее. Таким образом, палладиевые наночастицы – хорошие заменители золотых и платиновых наночастиц, обладающие схожими свойствами, такими как большое отношение поверхности к объему и наличие поверхностного плазменного резонанса, что необходимо для применения в электрохимических и биохимических сенсорных устройствах [2]. Палладиевые наночастицы можно синтезировать различными химическими методами, используя восстановители, однако присутствие следов этих непрореагировавших восстановителей в синтезированных наночастицах может вызывать отравление, что может быть препятствием на пути их использования для целей, связанных с биологией. Поэтому в качестве восстановителей выбирают растительные экстракты, которые служат испытанным средством [3]. Для получения наночастиц можно использовать многие подобные экстракты.
Musa acuminata, более известная как Декка красная, принадлежит к семейству Musaceae. Ее плоды помогают при лечении диареи и желудочных коликов. Поедание ее цветов облегчает боли у женщин при месячных и климактерических кровотечениях. Цветы банана также содержат питательные вещества и витамины, которыми лечат детское недоедание и телесную слабость [5]. Такой экстракт содержит большое количество фенольных соединений и флавоноидов [4]. Полифенолы, присутствующие в растительном экстракте, можно использовать в качестве восстановителей или стабилизаторов [6].
Для того, чтобы получить наноматериал с заданной размерностью, наночастицы металла собирают, используя структурирующие агенты или шаблоны или стабилизаторы, например поливинилпирролидон [7] или катализатор на основе цеолита [8], либо применяют гидротермальный метод. Здесь наиболее предпочтителен сольвотермальный метод, поскольку в нем используются органические растворители, которые легко удаляются после синтеза, чтобы избежать помех с их стороны при определении гемоглобина. Это позволяет получать беспримесные наноленты. Наноленты обладают поверхностью, чрезвычайно чувствительной к адсорбции [9], позволяющей определять такие аналиты, как глюкоза, пероксиды, аскорбиновая кислота, гемоглобины.
Гемоглобин – это респираторный белок в эритроцитах, принадлежащий к семейству глобулярных белков, отвечающих за перенос кислорода. Согласно Всемирной организации здоровья (ВОЗ), нормальный уровень гемоглобина у мужчин и женщин старше 15 лет равняется, соответственно, 130 и 120 г/л; эти (или более высокие) значения означают здоровое функционирование организма [10, 11]. С гемоглобином так или иначе связан ряд болезней: анемия [12], диабет [13], гематемезис [14], гематурия [15]. Поэтому определение гемоглобина очень важно для клинического анализа. Были предложены многочисленные методы определения гемоглобина, такие, например, как молекулярный импринтинг – создание связующих центров на полимерном листе, запоминающих молекулы. Другой способ определения гемоглобина использует ферменты. Эти общепринятые методы, как правило, требуют высокочистых и очень токсичных реактивов и весьма времязатратны. Большой интерес проявляется по отношению к электрохимическим методам определения гемоглобина. Например, для такого определения используются неорганические катализаторы, с помощью которых модифицируют поверхность электрода с наноматериалами, чтобы облегчить перенос электрона непосредственно между электродом и активными белками. Дополнительно, при создании электрохимических устройств используют наночастицы различных морфологических форм [10].
Молекулы гемоглобина содержат электроактивную группу с гемовым железом, обладающую высокой чувствительностью, благодаря способности этой группы облегчать быстрый переход электронов. Эта группа с гемовым железом содержит атом двухвалентного железа (Fe2+), который окисляется до иона трехвалентного железа (Fe3+) [16]; однако на немодифицированном электроде заметить переход ионов двухвалентного железа в трехвалентное затруднительно. Поэтому необходимо модифицировать поверхность для того, чтобы повысить его чувствительность. Такое модифицирование может быть осуществлено с использованием различных материалов – наноматериалов, флавоноидов или растительных экстрактов.
В настоящей работе наночастицы палладия синтезированы экологичным методом с использованием экстракта плодов Musa acuminata. Полученные наночастицы были самоорганизованы с использованием сольвотермального метода в палладиевые наноленты. Электроды с чистой поверхностью были модифицированы этими палладиевыми нанолентами для электрохимического определения гемоглобина.
МЕТОДИКА ЭКСПЕРИМЕНТА
Материалы
Моногидрат хлористого палладия(II), маннитол, этанол, лиофилизованный порошок человеческого гемоглобина были приобретены у компании Sigma–Aldrich. Фосфатный буферный раствор с pH 3 был приготовлен из маточного стандартного раствора 0.1 M K2HPO4 + 0.1 M KH2PO4 с использованием растворов 0.5 M HCl и 0.5 M NaOH. Все химикаты использовали без дополнительной очистки.
Изготовление электрода
Графитовый электрод, стержень диаметром 6 мм, был приобретен у компании Merck. Он был вставлен в тефлоновый полый стержень-кожух подходящего диаметра. Свободную поверхность электрода полировали до зеркального блеска с помощью полировального набора для электродов PK-3, включающего водные полировальные пасты из алмаза (зерно 1 мкм) и оксида алюминия (зерно 0.05 мкм). После этого графитовый стержень промывали чистой водой в ультразвуковой ванне в течение 9 мин. Палладиевые наноленты растворяли в чистой воде (1 мг/мл) и выдерживали в ультразвуковой ванне в течение 6 мин до полного диспергирования. Каплю дисперсии палладиевых нанолент (5 мкл) наносили на отполированный графитовый электрод, и давали раствору высохнуть на поверхности до следующего дня. Такой модифицированный электрод обозначим как Pd-наноленты/графит.
Электрохимические измерения
Измерения методами циклической вольтамперометрии, спектроскопии электрохимического импеданса и хроноамперометрии проводили с помощью электрохимического комплекса Versa stat 3 (Princeton Applied Research, США). Физические характеристики измеряли с помощью настольного рентгеновского дифрактометра с CuKα-излучением (λ = 1.5418 Å) и сканирующего электронного микроскопа Sanning (15.0 кВ). Все эксперименты проводили в стандартной трехэлектродной электрохимической ячейке, содержащей рабочий электрод с чистой поверхностью или модифицированный (Pd-наноленты/графит), насыщенный каломельный электрод (НКЭ) сравнения и вспомогательный электрод – платиновую проволочку.
Получение растительного экстракта
100 г собранных плодов M. acuminata, промытых чистой водой, очищенных от кожуры и мелко нарубленных, экстрагировали в ультразвуковой ванне в 200 мл чистой воды в качестве растворителя в течение ночи. Полученный экстракт хранили в холодильнике до использования в экспериментах.
Синтез наночастиц палладия
0.04 M PdCl2 растворяли в 20 мл чистой воды. Раствор подвергали ультразвуковой обработке в течение 30 мин до полного диспергирования PdCl2. Добавляли 2 мл растительного экстракта и оставляли до утра с перемешиванием магнитной мешалкой [17]. Изменение цвета от светло-коричневого до черного указывает на образование наночастиц палладия. Полученный раствор центрифугировали и несколько раз промывали водой. После сушки в вакууме получали наночастицы палладия.
Синтез палладиевых нанолент
10 мг наночастиц палладия растворяли в 70%‑ном этаноле при непрерывном перемешивании и получали раствор A. 2.5 мг маннитола растворяли в воде и получали раствор Б. Растворы A и Б смешивали, и смесь перемешивали магнитной мешалкой в течение часа, затем переносили в автоклав, футерованный тефлоном, и нагревали при 110°C в течение 5 ч, после чего охлаждали. К полученному продукту по каплям добавляли чистой воды, после чего центрифугировали и сушили в вакууме при 50°C в течение 7 ч [18]. Длинные полигидроксильные цепочки молекул маннитола избирательно адсорбировались на палладиевых наночастицах, связывая палладиевые слои и образуя наноленты [18].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристики модифицированного электрода
Физические характеристики. Рентгеновские дифрактограммы дают анализ текстуры, поскольку определяется превалирующая ориентация кристаллитов и подтверждается их размер и идентифицируется продукт. Образование наночастиц и нанолент палладия было подтверждено именно этим методом. Рисунок 1a показывает пики при 40° (2θ), 46° (2θ), 69° (2θ) и 82° (2θ), относящиеся к кристаллическим плоскостям, соответственно, (111), (200), (220) и (311) наночастиц Pd. Кристаллическая структура – кубическая гранецентрированная (fcc) [19]. Рентгеновская дифрактограмма образца с нанолентами (рис. 1б) такая же, что и для наночастиц Pd. Присутствие узкого и более слабого пика на дифрактограмме образца с нанолентами вызвано хорошо определенными плоскостями того же кристаллического направления. Поэтому дифрактограммы для наночастиц и нанолент различаются [20]. Рентгено-дифракционный анализ с использованием формулы Дебая–Шеррера дает диаметр кристаллитов 12.4 нм.
Тонкий порошок наночастиц палладия диспергировали в чистой воде в ультразвуковой ванне в течение 180 с и сушили. Высушенный образец анализировали методом сканирующей электронной микроскопии (SEM), дающим изображение поверхности в электронном луче. На рис. 2а дана микрофотография образца, показывающая форму наночастиц. Палладиевые наноленты также диспергировали в чистой воде в ультразвуковой ванне в течение 180 с и сушили. Микрофотография этого образца дана на рис. 2б, который показывает образование палладиевой наноленты. Ширина наноленты равняется приблизительно 30.2 нм. SEM-микрофотографии показывают морфологию палладиевых частиц. Они также говорят о том, что палладиевые наноленты хорошо отделены друг от друга.
Электрохимические характеристики. В настоящей работе емкость синтезированных нанолент изучали методом спектроскопии электрохимического импеданса. Этот метод также эффективен при изучении модифицирования поверхности электродов. Предварительно мы записывали циклические вольтамперограммы в 0.1 M растворе “пробной” окислительно-восстановительной системы $\left[ {{\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{{{\text{3}} - } \mathord{\left/ {\vphantom {{{\text{3}} - } {{\text{4}} - }}} \right. \kern-0em} {{\text{4}} - }}}}} \right]$ на электродах как с чистой, так и с модифицированной поверхностью. Наблюдается хорошо выраженный квазиобратимый пик тока. Потенциал пика этой “пробной” системы на электродах с чистой и модифицированной поверхностью наблюдается, соответственно, при 420 и 468 мВ (рис. 3а). Наблюдается рост высоты окислительно-восстановительного пика тока на модифицированном электроде (219.5 мкA) по сравнению с электродом с чистой поверхностью (45 мкA). Этот рост пика тока связан с наличием на электроде проводящего материала – палладиевых нанолент. Благодаря этому, площадь поверхности электрода увеличивается, что облегчает перенос электронов.
Рис. 3.
Циклические вольтамперограммы (а) и годограф импеданса (б) графитового электрода с чистой поверхностью (a) и модифицированного электрода Pd-наноленты/графит (б) в 1 мM растворе ${\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{{3 - } \mathord{\left/ {\vphantom {{3 - } {4 - }}} \right. \kern-0em} {4 - }}}}.$
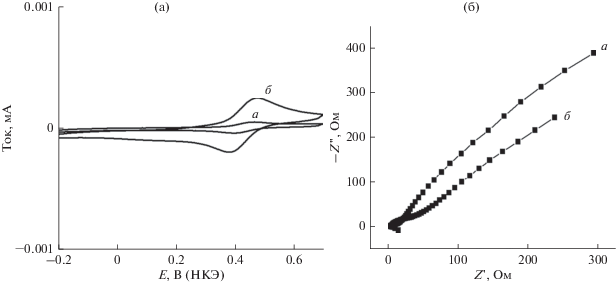
Годографы импеданса измеряли на частицах от 100 кГц до 0.1 Гц. График зависимости действительной (Z ') от мнимой составляющей (–Z '') импеданса отражает комплексное сопротивление ячейки (W). Фитинг Q годографа импеданса дает для сопротивления переноса заряда (Rct) величины 115.7 и 31.12 Ом, соответственно, для электрода с чистой поверхностью и модифицированного (рис. 3б). Наблюдаемое уменьшение сопротивления переноса заряда при модифицировании электрода ясно показывает, что модифицирование существенно облегчает перенос заряда, благодаря увеличению площади поверхности электрода. Другие параметры – это сопротивление раствора (Rs), фарадеевское сопротивление (Rf), фарадеевская емкость (Cf), число переносимых электронов (n) и емкость двойного электрического слоя (Cdl). Величина Cdl отражает пористость и шероховатость электрода. У модифицированного электрода величина Cdl заметно больше, чем у электрода с чистой поверхностью, поскольку наноструктура модифицированного электрода может стать причиной увеличения его пористости и шероховатости. Это облегчает реальный перенос электронов. Значения найденных параметров приведены в табл. 1. Величину эффективной площади поверхности электродов определяли по уравнению Рэндлса–Шевчика:
где Ip – пиковый окислительно-восстановительный ток, n – число переносимых электронов, v – скорость развертки потенциала (В с−1), c – концентрация пробной окислительно-восстановительной системы (M), A – площадь поверхности электрода (cм2), а D – коэффициент диффузии электроактивного вещества (cм2 с−1). Эффективная площадь поверхности модифицированного электрода равняется 0.1 cм2, а электрода с чистой поверхностью – 0.044 cм2. Таким образом, модифицированный электрод с большей площадью поверхности, чем электрод с чистой поверхностью, обеспечивает быстрый перенос электрона, что подразумевает более высокую проводимость.Электрокаталитическое окисление гемоглобина на модифицированном электроде
Электрокаталитическое окисление предполагает разную каталитическую активность гемоглобина на электроде с чистой поверхностью и на модифицированном электроде. Другими словами, на модифицированном электроде повышается чувствительность по отношению к определяемому веществу. Вначале мы измеряли проводимость модифицированного электрода, записывая циклические вольтамперограммы. Затем, записывали циклическую вольтамперограмму модифицированного электрода в отсутствие аналита – гемоглобина, что давало рост тока по сравнению с электродом с чистой поверхностью. Наконец, добавляли 0.78 мкM гемоглобина в качестве аналита к 0.5 M фосфатному буферному раствору с pH 3 и проводили измерения на электроде с чистой поверхностью и на модифицированном электроде при скорости развертки потенциала 0.1 В с–1. На электроде с чистой поверхностью после добавления аналита не наблюдается окислительно-восстановительного пика тока. Модифицированный же электрод способен реагировать на аналит и демонстрирует катодный пик тока при –351 мВ (рис. 4). Появление пика тока на модифицированном электроде обязано наличию палладиевых нанолент, которые обеспечивают высокое отношение поверхность/объем [21]. Также и емкость двойного электрического слоя на модифицированном электроде выше, что вызвано его шероховатостью. Поэтому на таком электроде биомолекулы дают хорошо различаемый пик тока. Таким образом, распознавание пиковых токов аналита доказывает, что палладиевые наноленты позволяют определять гемоглобин.
Влияние pH на определение гемоглобина на электроде “Pd-наноленты/графит”
На восстановление биомолекул на электроде “Pd-наноленты/графит” оказывает влияние pH электрода. По этой причине мы исследовали влияние pH на поведение модифицированного электрода, снимая на нем циклические вольтамперограммы в области pH от 2 до 9. На рис. 7 показана зависимость пикового тока от pH. Из рисунка видно, что в 0.78 мкM растворе гемоглобина наивысший пик катодного тока наблюдается при pH 3; с ростом рН пик тока постепенно снижается. Уравнение линейной регрессии для этой зависимости таково:
Планка погрешности на этом линейном графике показывает, что ошибка пренебрежимо мала.Влияние увеличения концентрации аналита на поведение модифицированного электрода
Мы исследовали влияние увеличения концентрации гемоглобина, как аналита, с целью оценить чувствительность электрода “Pd-наноленты/графит”. В итоге, концентрацию гемоглобина (Hb) повышали с 0.1 до 0.5 мкM (рис. 5). С каждым приращением концентрации пиковый ток подрастал по линейному закону, за исключением двух последних приращений. Пик тока при этом слегка сдвинулся вправо, что может быть связано с присутствием фенольных фитохимических соединений в растительном экстракте, вызывающих отталкивание молекул аналита в растворе электролита. Циклические вольтамперограммы при увеличении концентрации аналита снимали в фосфатном буферном растворе с pH 3 при скорости развертки потенциала 0.1 В с–1. Уравнение линейной регрессии для этой зависимости таково:
(3)
${{I}_{{{\text{pa}}}}}({\text{A}}) = - 1.0340 + 8.362{{c}_{{{\text{Hb}}}}}({\text{мкМ}}),\,\,\,R = 0.7652.$Рис. 5.
Циклические вольтамперограммы, снятые на модифицированном электроде в 0.5 M фосфатном буферном растворе с pH 3 при скорости развертки потенциала 0.1 В с–1 при возрастающей концентрации гемоглобина от 0.1 до 0.5 мкM.
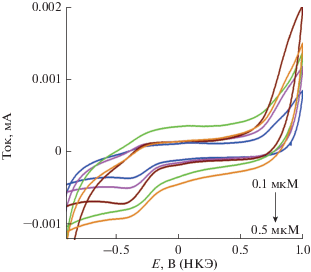
Причиной возникновения катодного пика может быть высвобождение протонов по отношению к фосфатному буферному раствору [21].
Хроноамперометрическое определение гемоглобина
Мы проводили хроноамперометрические измерения с целью оценить чувствительность и время отклика электрода “Pd-наноленты/графит” по отношению к данному аналиту, используя в качестве электролита фосфатный буферный раствор с pH 3. Рисунок 6 показывает токовый отклик гемоглобина с ростом его концентрации каждый раз на 0.1 мкM за 30 с при потенциале 0.2 В на электроде “Pd-наноленты/графит”. Чувствительность модифицированного электрода составила 9.04 мкA, а наименьшая определяемая концентрация равняется 0.039 мкM, что лучше опубликованных в работах [22–25] данных. Постоянный токовый отклик устанавливается за 2 с, он зависит от модифицирования. Врезка (рис. 6а) представляет калибровочную кривую “ток–концентрация” (линейный фитинг); уравнение линейной регрессии для нее таково
(4)
$\begin{gathered} {{I}_{{{\text{pa}}}}}({\text{мкA}}) = 2.2416 + 12.5313{{c}_{{{\text{Hb}}}}}({\text{мкМ}}), \\ R = 0.9546. \\ \end{gathered} $Рис. 6.
Амперометрический отклик гемоглобина при 0.1 В (а); врезка – линейный фитинг. Кривая – нелинейный фитинг (б).

Рис. 7.
Влияние pH на определение гемоглобина на модифицированном электроде при 0.1 В (а); зависимость от pH с планкой погрешности (б).

Рисунок 6 (врезка) подтверждает хорошую воспроизводимость, планка погрешности показывает, что отклонение от линейности пренебрежимо мало. На рис. 6б показана кривая зависимости тока от концентрации (нелинейный фитинг), уравнение нелинейной регрессии таково:
(5)
$\begin{gathered} {{I}_{{{\text{pa}}}}}({\text{мкA}}) = - 79.2899 + \frac{{104{\kern 1pt} \,502.6}}{{1153.55{{\sqrt \pi } \mathord{\left/ {\vphantom {{\sqrt \pi } 2}} \right. \kern-0em} 2}}} \times \\ \times \,\,e\frac{{ - 2\left( {x - 157.766} \right)}}{{1\,330\,677.6}}{{c}_{{{\text{Hb}}}}}({\text{мкМ}}),\,\,\,R = 0.9877. \\ \end{gathered} $В табл. 2 проведено сравнение характеристик модифицированного электрода “Pd-наноленты/графит” с другими ранее описанными электродами для определения того же аналита. Видно, что у нашего модифицированного электрода самое короткое время отклика среди всех описанных в литературе электродов.
Таблица 2.
Сравнение предложенного электрода “Pd-наноленты/графит” с другими описанными в литературе модифицированными электродами для определения гемоглобина
| Электрод | Наименьшая определяемая концентрация | Ссылка |
|---|---|---|
| Поли(метиленовый голубой)/стеклоуглерод | 4 мкM | [22] |
| GaAs/γ-меркаптопропилтриметоксисилан/аминопропилтриметоксисилан | 1.6 мM | [23] |
| Раствор 9,10-антрахинона, ртутный электрод | 50 нM | [24] |
| Гемоглобин/полимерный электролит | 110 нM | [25] |
| Pd-наноленты/графит | 0.039 мкM | Настоящая работа |
Стабильность и воспроизводимость модифицированного электрода
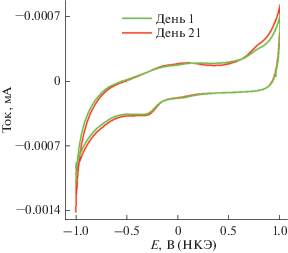
Стабильность модифицированного электрода оценивали с использованием метода циклической вольтамперометрии. Проводили долговременные измерения – определение гемоглобина на модифицированном электроде в фосфатном буферном растворе с pH 3. Модифицированный электрод оставался стабильным в течение трех недель (рис. 8). После успешного определения аналита в серии опытов через каждые 24 ч не наблюдалось сколько-нибудь заметного загрязнения электрода. Хорошо диспергированные наноленты плотно прилегают к графитовому электроду даже после многократных электрохимических тестов на увеличение концентрации гемоглобина, влияние pH и хроноамперометрические эксперименты. Это доказывает стабильность электрода “Pd-наноленты/графит”. Таким образом, описанный электрод является воспроизводимым и устойчивым.
ЗАКЛЮЧЕНИЕ
В настоящей работе синтез палладиевых наночастиц с помощью экстракта плодов M. acuminata подтвержден методами рентгено-дифракционного анализа и сканирующей электронной микроскопии. Самоорганизация палладиевых наночастиц позволяет получить наноленты сольвотермальным методом, что также подтверждено методами рентгено-дифракционного анализа и сканирующей электронной микроскопии. Капельным нанесением нанолент на графитовый электрод приготовлен модифицированный электрод для определения гемоглобина при потенциале –351 мВ. Проведены последовательные электрохимические эксперименты для оценки электрокаталитической активности электрода, влияния увеличения концентрации гемоглобина и pH раствора, которые подтвердили высокую чувствительность электрода “Pd-наноленты/графит” по отношению к определению гемоглобина с быстрым откликом (2 с). Модифицированный электрод также демонстрирует устойчивость против загрязнения поверхности, прекрасные стабильность и воспроизводимость.
Список литературы
Li, Q., Li, H., Pol, V.G. et al., Sonochemical synthesis, structural and magnetic properties of air-stable Fe/Co alloy nanoparticles, New J. Chem., 2003, vol. 27, p. 1194.
Petla, R.K., Vivekanandhan, S., Misra, M., Mohanty, A.K., and Satyanarayana, N., Soybean Glycine max, vol. Leaf Extract Based Green Synthesis of Palladium Nanoparticles. J. Biomater. Nanobiotechnol., 2012, vol. 3, p. 14.
Shruthi, C.D. and Suresh, G.S., Reduced MWCNTs/Palladium Nanotubes Hybrid Fabricated on Graphite Electrode for Simultaneous Detection of Ascorbic Acid, Dopamine and Uric Acid, J. Electrochem. Soc., 2018, vol. 165, no. 10, p. B458.
Sumathy, V., Lachumy, S.J., Zakaria, Z., and Sasidharan, S., In vitro Bioactivity and Phytochemical Screening of Musa Acuminata Flower, Pharmacologyonline, 2011, vol. 2, p. 118.
Wuyts, N., Waele, D.D., and Swennen, R., Extraction and partial characterization of polyphenol oxidase from banana (Musa acuminata Grande naine) roots, Plant Physiol. Biochem., 2006, vol. 44, p. 308.
Hsouna, A.B. and Hamdi, N., Pelargonium graveolens Aqueous Decoction: A New Water-Soluble Polysaccharide and Antioxidant-Rich Extract, Lipids Health Disease, 2012, vol. 11, p. 167.
Xin, Q., Balankura, T., Zhou, Ya., and Fichthorn, K.A., Structure-Sensitive CO2 Electroreduction to Hydrocarbons on Ultrathin 5-fold Twinned Copper Nanowires, Nano letters, 2017, vol. 17, no. 2, p. 312.
Simancas, R., Dari, D., Velamazán, N., Navarro, M.T., Cantín, A., Jordá, J.L., and Sastre, G., Modular Organic Structure-Directing Agents for the Synthesis of Zeolites, Science, 2010, vol. 330, p. 1219.
Sun, L., Zhang, Y., Li, J., Yi, T., and Yang, X., Graphene-Oxide-Directed Hydrothermal Synthesis of Ultralong MVO3n Composite Nanoribbons, Chem. Mater., 2016, vol. 28, no. 13, p. 4815.
Hussain, K.K., Moon, J.M., Park, D.S., and Shim, Y.B., Detection of hemoglobin using hybrid molecularly imprinted polymers/carbon quantum dots-based nanobiosensor prepared from surfactant-free Pickering emulsion, Electrochemical Detection of Hemoglobin, Electroanalysis, 2017, vol. 29, p. 2190.
Dai, Z., Liu, S., Ju, H., and Chen, H., Direct electron transfer and enzymatic activity of hemoglobin in a hexagonal mesoporous silica matrix, Biosensors Bioelectron., 2014, vol. 19, p. 861.
Sankaran, V.G. and Weiss, M.J., Anemia: progress in molecular mechanisms and therapies. Nat. Measured, 2015, vol. 21, p. 221.
Mayer, T.K. and Freedman, Z.R., Protein glycosylation in diabetes mellitus: a review of laboratory measurements and of their clinical utility, Clin. Chim. Acta, 1983, vol. 127, p. 147.
Gralnek, I.M., Barkun, A.N., and Bardou, M., Management of acute bleeding from a peptic ulcer, N. Engl. J. Measured, 2008, vol. 359, p. 928.
Landefeld, C.S. and Beyth, R.J., Anticoagulant-related bleeding: clinical epidemiology, prediction, and prevention, Am. J. Med., 1993, vol. 95, p. 315.
Lee, T.J., Choi, W., et al., Insulin in the nervous system and the mind: functions in metabolism, memory, and mood, Sensors, 2016, vol. 16, p. 660.
Scheibe, B., Borowiak-Palen, E., and Kalenczuk, R.J., Oxidation and reduction of multiwalled carbon nanotubes, Mater. Characteriz., 2010, vol. 61, p. 185.
Xing, Y., Cheng, R., Li, H., Liu, Z., and Du, C., Mannitol-assisted synthesis of ultrathin Bi2MoO6 architectures: excellent selective adsorption and photocatalytic performance. J. Nanoparticle Res., 2019, vol. 21, no. 2.
Sheny, D.S., Philip, D., and Mathew, J., Rapid green synthesis of palladium nanoparticles using the dried leaf of Anacardium occidentale, Spectrochim. Acta, Part A, 2012, vol. 91, p. 35.
Palanisamy, S., Ezhil Vilian, A.T., and Chen, Sh.-M., Direct Electrochemistry of Glucose Oxidase at Reduced Graphene Oxide/Zinc Oxide Composite Modified Electrode for Glucose Sensor, Int. J. Electrochem. Sci., 2012, vol. 7, p. 2153.
Huang, F., Peng, Y., Jin, G., and Zhang, S., Sensitive Detection of Haloperidol and Hydroxyzine at Multi-Walled Carbon Nanotubes-Modified Glassy Carbon Electrodes, Sensors, 2008, vol. 8, p. 1879.
Brett, C.M.A., Inzelt, G., and Kertesz, V., Methylene Blue/Multiwall Carbon Nanotube Modified Electrode for the Amperometric Determination of Hydrogen Peroxide, Anal. Chim. Acta, 1999, vol. 385, p. 119.
Tatikonda, A.K., Tkachev, M., and Naaman, R., A highly sensitive hybrid organic–inorganic sensor for continuous monitoring of haemoglobin, Biosens. Bioelectron., 2013, vol. 45, p. 201.
Zhu, Z. and Li, N.-Q., Electrochemical studies of 9,10-anthraquinone interacting with hemoglobin and determination of haemoglobin, Microchim. Acta, 1999, vol. 130, p. 301.
Majidi, M.R., Saadatirad, A., and Alipour, E., Voltammetric Determination of Hemoglobin Using a Pencil Lead Electrode, Electroanalysis, 2011, vol. 23, p. 1984.
Дополнительные материалы отсутствуют.