Электрохимия, 2021, T. 57, № 4, стр. 197-238
Электрохимические суперконденсаторы (обзор)
Ю. М. Вольфкович *
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: yuvolf40@mail.ru
Поступила в редакцию 09.06.2020
После доработки 18.08.2020
Принята к публикации 07.09.2020
Аннотация
Предлагается обзор современной научной литературы по электрохимическим суперконденсаторам (ЭХСК). ЭХСК представляют собой быстроперезаряжаемые накопители энергии. Они подразделяются на; двойнослойные конденсаторы (ДСК), основанные на перезаряжении двойного электрического слоя (ДЭС); псевдоконденсаторы (ПсК) и гибридные конденсаторы (ГК). ЭХСК используются в устройствах импульсной техники, в качестве накопителей электрической энергии, для стартерного запуска и для рекуперации энергии торможения двигателей внутреннего сгорания; для сглаживания пиковых нагрузок электрических сетей и в различных портативных устройствах. ЭХСК подразделяются на ЭХСК мощностного (МЭХСК) и энергетического типа (ЭЭХСК). МЭХСК (импульсные) обладают высокой удельной мощностью (~до 100 кВт/кг), а ЭЭХСК – высокой удельной энергией (~до 25 Вт ч/кг). По сравнению с аккумуляторами МЭХСК обладают намного более высокой удельной мощностью и циклируемостью – до сотен тысяч и миллиона циклов. ДСК также используются в установках емкостной деионизации воды для опреснения воды.
Сокращенные обозначения:
АУ – активированный уголь
АУВ – активированные углеродные волокна
АУТ – активированные углеродные ткани
АУЭ – активированный угольный электрод
ВДУМ – высокодисперсные углеродные материалы
ВОГ – восстановленный оксид графена
ГСК – гибридный суперконденсатор
ДСК – двойнослойный конденсатор
ДЭС – двойной электрический слой
ЕДВ – емкостная деионизация воды
ММ – мозаичная мембрана
ОВЭ – потенциал относительно водородного электрода
ОГ – оксид графена
ОСУНТ – одностенные углеродные нанотрубки
ПАН – полиакрилонитрил
ПАНи – полианилин
ПК – пропиленкарбонат
ПсК – псевдоконденсатор
ПП – поверхностная проводимость
ППФ – полипарафенилен
ПТФЭ – политетрафторэтилен
УНТ – углеродные нанотрубки
ФГ – функциональные поверхностные группы
ЦВА – циклическая вольтамперометрия
ЭПП – электронопроводящие полимеры
ЭХСК – электрохимический суперконденсатор
ОГЛАВЛЕНИЕ
Введение
1. Электрохимические суперконденсаторы с углеродными электродами
1.1. Основные свойства двойнослойных конденсаторов (ДСК)
1.2. Удельная энергия и удельная мощность ДСК
1.3. Основы макрокинетики ДСК
1.4. Пористая структура и гидрофильно-гидрофобные свойства высокодисперсных углеродных электродов
1.5. Влияние соотношения размеров ионов и молекул с размерами пор
1.6. Влияние функциональных групп на характеристики ДСК
1.7. Влияние редокс-реакций функциональных групп на КПД по энергии ЭХСК
1.8. Электролиты, используемые в ДСК
1.9. Нанопористые угли, полученные разными методами
1.9.1. Активированные угли (АУ)
1.9.2. Шаблонные (templated ) пористые угли
1.9.3. Карбидные производные углерода
1.9.4. Углеродные аэрогели и ксерогели
1.9.5. Углеродные нанотрубки (УНТ)
1.9.6. Графены и их производные
2. Псевдоконденсаторы (ПсК)
2.1. Электроды на основе неорганических соединений переходных металлов
2.2. Электроды на основе электронопроводящих полимеров (ЭПП)
2.3. Редокс-конденсаторы на основе органических мономеров
2.4. Литий-катионообменные конденсаторы
3. Гибридные суперконденсаторы (ГСК)
3.1. ГСК типа MeOx/C
3.2. ГСК типа ЭПП/С
4. Характеристики суперконденсаторов, выпускаемых промышленностью и в передовых лабораториях.
5. Применение ионообменных мембран в суперконденсаторах
6. Перспективы электрохимических суперконденсаторов
7. Применение суперконденсаторов для опреснения воды. Емкостная деионизация воды (ЕДВ).
7.1. Проблемы получения чистой воды методом ЕДВ. Поверхностная проводимость. Мозаичные мембраны
ВВЕДЕНИЕ
В последнее время разработан целый ряд новых типов конденсаторов, которые основаны на протекании различных электрохимических процессов.
Согласно общепринятому определению, впервые сделанному Конвеем, электрохимическими суперконденсаторами (ЭХСК) называются электрохимические устройства, в которых протекают квазиобратимые электрохимические зарядно-разрядные процессы, и форма гальваностатических зарядных и разрядных кривых которых близка к линейной, т.е. близка к форме соответствующих зависимостей для обычных электростатических конденсаторов [1]. ЭХСК подразделяются на двойнослонойные конденсаторы (ДСК) [1, 2], псевдоконденсаторы (ПсК) [1, 2] и гибридные суперконденсаторы (ГСК). ДСК, основанные на заряжении двойного электрического слоя (ДЭС) электродов, содержат электроды на основе высокодисперсных углеродных материалов (ВДУМ) с высокой удельной поверхностью ~500–2500 м2/г. К ВДУМ относятся активированные угли (АУ), карбидные угли, аэрогели, ксерогели, сажи, нанотрубки, нановолокна, графены и др. В электродах ПсК протекают быстрые квазиобратимые электрохимические реакции. В них в качестве основы электродов используются электронпроводящие полимеры (ЭПП) (полианилин, политиофен, полипиррол и др.) или некоторые оксиды металлов, обладающие несколькими степенями окисления (RuOх, MnOx и др.). Преимуществами ЭХСК по сравнению с аккумуляторами являются: (1) более высокие мощностные характеристики. (2) Более высокий циклический ресурс, сопоставимый с традиционными конденсаторами до сотен тысяч и более 1 млн циклов для высокомощных ЭХСК. (3) ЭХСК, в основном ДСК, надежно работают в условиях экстремальных температур от –50 до +60°С, поскольку они не лимитируются кинетикой электрохимических реакций, а управляются законами электрофизики. (4) В принципе, у ДСК КПД по энергии может приближаться к 100%, поскольку в отличие от аккумуляторов, у ДСК нет потерь энергии, обусловленных поляризацией электродных реакций. Величина КПД по энергии для ДСК ограничивается только омическими потерями энергии. Очень высокая величина КПД по энергии (отношение энергии разряда к энергии заряда), дает возможность применения ЭХСК в различных устройствах для аккумулирования, хранения и выдачи энергии электрических сетей и для сглаживания пиковых нагрузок электрических сетей. (5) Разные виды ЭХСК могут заряжаться и разряжаться в течение очень широкого диапазона времен от долей секунды до часов. (6) Многие виды ЭХСК обладают еще одним преимуществом – экологическим. Дело в том, что миллиарды свинцовых, щелочных и литиевых аккумуляторов после выработки своего ресурса оказываются в мусоре или в земле. Таким образом, туда попадают такие токсичные элементы, как свинец, никель, литий, фтор, сера, и др. В противоположность этому, ЭХСК с углеродными электродами и с водными электролитами являются вполне экологическими, т.е. практически безвредными. (7) Все виды ЭХСК являются полностью герметичными. Недостатки ЭХСК по сравнению с аккумуляторами: меньшая удельная энергия и больший саморазряд. Для снижения саморазряда требуется создание высокочистых ЭХСК, поскольку растворимые примеси в электролите и в электродах приводят к саморазряду. ЭХСК применяются в электромобилях, автомобилях, тепловозах – для стартерного запуска двигателей внутреннего сгорания, и в различных электронных устройствах. В электромобилях ЭХСК может применяться в комбинации с топливными элементами – для форсажных режимов. ЭХСК подразделяются на два основных типа – мощностные (или импульсные), обладающие высокой удельной мощностью, и энергетические, обладающие высокой удельной энергией. Соответственно для каждого типа ЭХСК существуют свои области применения.
1. ЭЛЕКТРОХИМИЧЕСКИЕ СУПЕРКОНДЕНСАТОРЫ С УГЛЕРОДНЫМИ ЭЛЕКТРОДАМИ (ДСК)
General Electric Company в 1957 г. впервые запатентовала ДСК. Конденсатор состоял из пористых угольных электродов и использовал емкость двойного электрического слоя (ДЭС) для механизма заряжения. Standard Oil Company, в Кливленде, штат Огайо (SOHIO) запатентовала устройство, которое запасает энергию в ДЭС на границе электрод/раствор. Nippon Electric Company (или NEC) в Японии получила лицензию на технологию изготовления от SOHIO и представила первые ДСК на рынке, как средство резервного питания памяти в компьютерах в 1957 г. В это время SOHIO признала, что “двойной слой на границе раздела фаз ведет себя как конденсатор с относительно высокой удельной емкостью”. SOHIO запатентовала конденсатор в форме диска в 1970 г., используя угольную пасту, пропитанную электролитом. Вплоть до 1971 г. NEC имела лицензии на технологии SOHIO. Первый коммерчески успешный двойнослойный конденсатор с названием “суперконденсатор” был запущен NEC. Ряд компаний начали производство электрохимических конденсаторов к 1980-м годам. Первые ДСК в СССР были разработаны во ВНИИТ Н.С. Лидоренко [3] в 1970-х годах. Они были названы “молекулярными накопителями электрической энергии” или “ионисторами”. В настоящее время публикуется очень большое количество научных работ по созданию и совершенствованию ЭХСК.
1.1. Основные свойства двойнослойных конденсаторов (ДСК)
ДСК состоит из двух пористых поляризуемых электродов. Процесс энергосбережения в ДСК осуществляется посредством разделения заряда на двух электродах с достаточно большой разностью потенциалов между ними. Электрический заряд ДСК определяется емкостью ДЭС. Электрохимический процесс в ДСК можно представить как [2, 4]:
(1.1)
$\begin{gathered} {\text{положительный}}\,\,{\text{электрод}}\,\, \\ {{\Gamma }_{{\text{s}}}} + {{{\text{A}}}^{ - }} \leftrightarrow \Gamma _{{\text{s}}}^{ + }{\text{//}}{{{\text{A}}}^{ - }} + {\text{e}}, \\ \end{gathered} $(1.2)
$\begin{gathered} {\text{отрицательный}}\,\,{\text{электрод}}\,\, \\ {{\Gamma }_{{\text{s}}}} + {{{\text{C}}}^{ + }} + {\text{e}} \leftrightarrow \Gamma _{{\text{s}}}^{ - }{\text{//}}{{{\text{C}}}^{ + }}, \\ \end{gathered} $(1.3)
$\begin{gathered} {\text{суммарная}}\,\,{\text{реакция}}\,\,\, \\ \,{{\Gamma }_{{\text{s}}}} + {{\Gamma }_{{\text{s}}}} + {{{\text{C}}}^{ + }} + {{{\text{A}}}^{ - }} \leftrightarrow \Gamma _{{\text{s}}}^{ - }{\text{//}}{{{\text{C}}}^{ + }} + \Gamma _{{\text{s}}}^{ + }{\text{//}}{{{\text{A}}}^{ - }}. \\ \end{gathered} $Во время заряда электроны переносятся от положительного электрода к отрицательному через наружный источник тока. Ионы из объема электролита двигаются к электродам. Во время разряда электроны перемещаются от отрицательного электрода к положительному через нагрузку и ионы возвращаются с поверхности в объем электролита. Во время заряда и разряда изменяются плотность заряда на границе раздела и концентрация электролита. Теоретические представления об удельной (на единицу истинной поверхности электрода) емкости ДЭС основаны на известных классических теориях двойного слоя Гельмгольца, Штерна, Гуи–Чапмена, Грэма и др. [5].
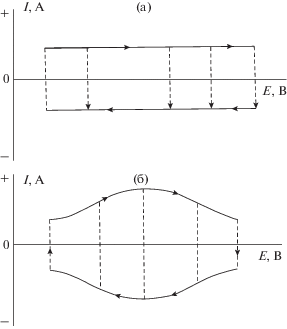
Для более детального по сравнению с гальваностатическими кривыми электрохимического анализа электродов ЭХСК, как и других электрохимических систем, измеряются циклические вольтамперограммы (ЦВА), т.е. зависимости тока от потенциала при заданной скорости развертки потенциала (В/с). На рис. 1 показаны схематические циклические вольтамперограммы. На верхнем рисунке изображены такие зависимости для электрода идеального ДСК, в котором происходит только заряжение–разряжение ДЭС. Эти зависимости в первом приближении представляют собой прямоугольник с прямыми линиями, параллельными и перпендикулярными оси абсцисс. На нижнем рисунке изображены схематические ЦВА-зависимости для электрода ПсК, в которые вносят вклад псевдоемкость и емкостью ДЭС.
Рис. 1.
Схематические ЦВА зависимости для электрода идеального ДСК, в котором происходит заряжение ДЭС (a) и для электрода ПсК с псевдоемкостью (б).
Для ДСК, как и для всех идеальных конденсаторов, емкость обратно пропорциональна толщине обкладки:
(1.4)
$C = {\varepsilon \mathord{\left/ {\vphantom {\varepsilon {\left( {4\pi d} \right)}}} \right. \kern-0em} {\left( {4\pi d} \right)}},$Удельная емкость на грамм электрода:
где S – удельная поверхность (см2/г). Для получения высокой емкости в ДСК применяются электроды, обладающие высокой удельной поверхностью S = 500–2500 м2/г, в качестве основы которых используются высокодисперсные углеродные материалы (ВДУМ): активированные угли (АУ) [1, 2], аэрогели, сажи, углеродные нанотрубки, нановолокна, графены и др.В табл. 1 приведены типичные удельные характеристики различных конденсаторов: бумажных конденсаторов (БК) (это электрические конденсаторы, в которых диэлектриком служит особая бумага; они используются в низкочастотных цепях высокого напряжения), электролитических (ЭК) и ДСК. Как видим, в ряду БК → ЭК → → ДСК уменьшается толщина обкладки и соответственно возрастает удельная энергия, а удельная мощность уменьшается.
Таблица 1.
Основные удельные характеристики конденсаторов
| Тип конденсатора | Толщина обкладки, нм | Удельная энергия, Вт/л | Удельная мощность, Вт ч/л |
|---|---|---|---|
| ДСК | 0.3–1 | 1–20 | 5 × 10–2–5 × 10–4 |
| Электролитический | 103 | 3 × 10–2 | 104–105 |
| Бумажный | 2 × 104–4 × 104 | <10–3 | >107 |
Поскольку размер ионов и молекул, а значит и толщина ДЭС, для водных электролитов меньше, чем для неводных электролитов, то величины удельной емкости для водных электролитов в большинстве случаев больше, чем для неводных электролитов. Измеренные величины удельной емкости углеродных материалов, используемых в ЭХСК, находятся в диапазоне 75–200 Ф/г для водных электролитов и 40–100 Ф/г для органических электролитов, потому что для большинства углеродных материалов относительно большая доля площади поверхности лежит в микропорах, в которые не могут проникнуть ионы [1, 2].
1.2. Удельная энергия и удельная мощность ДСК
Для идеальных ДСК с идеально поляризуемыми электродами удельная энергия разряда равна [1]:
(1.6)
$A = \left( {{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}} \right)C\left[ {{{{\left( {{{V}_{{\max }}}} \right)}}^{2}} - {{{\left( {{{V}_{{\min }}}} \right)}}^{2}}} \right],$(1.7)
$A = {{V}_{{\max }}} = \left( {{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}} \right)C{{\left( {{{V}_{{\max }}}} \right)}^{2}}.$Вследствие малой растворимости неводных электролитов удельная энергия ДСК с неводным электролитом зависит не только от емкости, но и от концентрации электролита.
Из уравнения (1.7) видно, что максимальная удельная энергия ДСК пропорциональна емкости в первой степени, а максимальному напряжению в квадрате. Сравнивая величины удельной энергии ДСК с водными и неводными электролитами, нужно учитывать, что для водных электролитов величины удельной емкости и электропроводности больше, чем для неводных электролитов, а величины максимального напряжения для водных электролитов меньше, чем для неводных электролитов. На рис. 2 для сравнения приведены полученные зависимости удельной энергии от плотности разрядного тока для симметричного ДСК с одинаковыми электродами на основе активированной углеродной ткани (АУТ) с удельной поверхностью 600 м2/г, но с разными водным и неводным электролитом [2]. Как видим, величины удельной энергии при малых плотностях тока выше для ДСК с неводным электролитом, а для больших плотностей тока, наоборот, величины удельной энергии больше для ДСК с водным электролитом.
Рис. 2.
Зависимости удельной энергии от плотности разрядного тока для ДСК со следующими электролитами: (1) 35% H2SO4, и (2) 1 M LiAlF4 + γ-бутиролактон (GBL).

Суперконденсаторы разрабатывались в качестве альтернативы импульсным аккумуляторам. Чтобы быть альтернативой, суперконденсаторы должны были иметь гораздо большие мощность и время циклирования. Существуют два подхода к расчету пиковой плотности мощности ДСК и аккумуляторов, указанных в таблице. Первый и более стандартный подход заключается в определении мощности при так называемом соответственном состоянии импеданса, при котором половина энергии разряда переходит в электричество и половина в тепло. Максимальная мощность на данный момент определяется следующим уравнением:
(1.8)
${{P}_{{{\text{m}}i}}} = {{V_{{{\text{oc}}}}^{2}} \mathord{\left/ {\vphantom {{V_{{{\text{oc}}}}^{2}} {4{{R}_{{\text{b}}}}}}} \right. \kern-0em} {4{{R}_{{\text{b}}}}}},$(1.9)
${{P}_{{{\text{ef}}}}} = EF(1 - EF){{V_{{{\text{oc}}}}^{2}} \mathord{\left/ {\vphantom {{V_{{{\text{oc}}}}^{2}} {{{R}_{{\text{b}}}}}}} \right. \kern-0em} {{{R}_{{\text{b}}}}}},$(1.10)
${{P}_{{{\text{p}}i}}} = \frac{9}{{16}} \times (1 - EF){{V_{{{\text{oc}}}}^{2}} \mathord{\left/ {\vphantom {{V_{{{\text{oc}}}}^{2}} {{{R}_{{{\text{uc}}}}}}}} \right. \kern-0em} {{{R}_{{{\text{uc}}}}}}},$В отличие от аккумуляторов, суперконденсаторы могут функционировать в очень широком диапазоне времен заряда–разряда от долей секунды до часов. В соответствие с этим ЭХСК подразделяются на два основных типа – мощностные, обладающие высокой удельной мощностью, и энергетические, обладающие высокой удельной энергией. К мощностным ЭХСК относятся двойнослойные конденсаторы. Мощностные суперконденсаторы позволяют проводить процессы заряда и разряда за очень короткие времена (от долей секунды до минут) и получать при этом высокие мощностные характеристики от 1 до десятков кВт/кг в концентрированных водных электролитах. Измерения для высокодисперсных углеродных электродов в режимах работы энергетических ЭХСК обычно дают величины удельной емкости пределах от 50 до 200 Ф/г. Для углеродных материалов были достигнута предельная емкость 320 Ф/г за счет существенного вклада псевдоемкости квазиобратимых редокс-реакций поверхностных групп углей. Таким образом, это уже не в чистом виде ДСК.
Очень широкий диапазон характерных времен заряда–разряда иллюстрируется на рис. 3, на котором приведены диаграммы Рейгона для различных перезаряжаемых электрохимических устройств, которые представляют собой зоны функционирования этих устройств в координатах: удельная мощность–удельная энергия [6, 7]. На этом рисунке представлены различные виды аккумуляторов (свинцовые, никель – металлгидридные и литий – ионные), а также электролитические конденсаторы и ЭХСК. Как видим, диапазон функционирования ЭХСК простирается на 7 порядков характерных времен, что намного порядков больше по сравнению с любым типом аккумуляторов. ЭХСК имеют свою нишу. По сравнению с аккумуляторами они обладают меньшими величинами удельной энергии, но намного большими величинами удельной мощности. Кроме того они на много порядков превосходят аккумуляторы по циклируемости, которая достигает сотен тысяч и даже миллионов циклов, в то время как для аккумуляторов – от нескольких сотен до нескольких тысяч циклов.
1.3. Основы макрокинетики ДСК
Следует отметить, что в большинстве обзоров по ДСК не рассматриваются вопросы макрокинетики, что на наш взгляд, является их недостатком. Принимая, что пористый электрод ДСК является идеально поляризуемым, то в общем случае основными процессами, происходящими при работе ДСК, являются: нестационарный процесс заряжения ДЭС на развитой межфазной поверхности электрод/электролит в порах, диффузионно-миграционный перенос ионов в электролите, содержащемся в порах, и омические потери энергии. Из теории пористых электродов следует следующее уравнение для распределения потенциала Е по толщине электрода, т.е. по координате x [8]:
(1.11)
$\kappa \left( {{{{{\partial }^{2}}E} \mathord{\left/ {\vphantom {{{{\partial }^{2}}E} {\partial {{x}^{2}}}}} \right. \kern-0em} {\partial {{x}^{2}}}}} \right) = Si{\kern 1pt} \left( E \right),$(1.12)
$i = {{C}_{{\text{s}}}}{{\partial E} \mathord{\left/ {\vphantom {{\partial E} {\partial \tau }}} \right. \kern-0em} {\partial \tau }},$(1.13)
$\begin{gathered} I = \kappa {{\left( {{{\partial E} \mathord{\left/ {\vphantom {{\partial E} {\partial x}}} \right. \kern-0em} {\partial x}}} \right)}_{{x = L}}};\,\,\,{{\left( {{{\partial E} \mathord{\left/ {\vphantom {{\partial E} {\partial x}}} \right. \kern-0em} {\partial x}}} \right)}_{{x = 0}}} = 0;\,\,\, \\ {{E}_{{\left( {x,\tau = 0} \right)}}} = {{E}_{0}}, \\ \end{gathered} $1.4. Пористая структура и гидрофильно-гидрофобные свойства высокодисперсных углеродных электродов
Для исследования пористой структуры и гидрофильно-гидрофобных свойств высокодисперсных углеродных электродов в ряде работ использовался метод эталонной контактной порометрии (МЭКП) [9–11]. В отличие от других порометрических методов, в том числе БЭТ, МЭКП позволяет не только исследовать пористую структуру любых материалов в максимально широком диапазоне радиусов пор ~от 1 до 3 × 105 нм, но и изучать их гидрофильно-гидрофобные свойства. При использовании в качестве измерительной жидкости октана измеряются порометрические кривые для всех пор, а при использовании воды – только гидрофильных пор. Этот метод был признан IUPAC [12].
Как уже отмечалось выше, в качестве электродов ЭХСК используются высокодисперсные углеродные материалы (ВДУМ) с удельной поверхностью от 500 до 3000 м2/г. Известно, что углеродные материалы в отличие от других материалов обладают переходными гидрофильно-гидрофобными свойствами, т.е. они имеют как гидрофильные, так и гидрофобные поры. В [2] с использованием в качестве измерительных жидкостей октана и воды была исследована АУ-ткань СН900-20. Было устновлено, что эта ткань имеет очень широкий спектр пор: от микропор с радиусами r ≤ ≤ 1 нм, до макропор с r > 100 мкм, т.е в интервале более 5 порядков. В данной ткани содержатся микропоры, а также макропоры с r > 1 мкм, но практически отсутствуют мезопоры с 1 нм < r < < 100 нм. Микропоры обеспечивают высокую полную удельную поверхность с Sп = 1520 м2/г и гидрофильную удельную поверхность Sfi = 850 м2/г, полная пористость (по октану) равна 86%, гидрофильная пористость 78.5%, а гидрофобная пористость 7.5%.
Из рис. 4 видно, что эта АУТ СН900-20 имеет большой объем макропор с размерами от 1 до 100 мкм.
1.5. Влияние соотношения размеров ионов и молекул с размерами пор
Основным механизмом работы ДСК является заряд–разряд ДЭС в угольном электроде. В [13‒18] наблюдаемая емкость Cobs (Ф/г) была проанализирована и поделена на две части: на емкость за счет поверхности микропор Smicro и на емкость, определяемую поверхностью более крупных пор (в основном мезопор), которая была названа внешней поверхностью Sext:
(1.14)
${{C}_{{{\text{obs}}}}} = {{C}_{{{\text{ext}}}}} \times {{S}_{{{\text{ext}}}}} + {{C}_{{{\text{micro}}}}} \times {{S}_{{{\text{micro}}}}},$(1.15)
$\frac{{{{С}_{{{\text{obs}}}}}}}{{{{S}_{{{\text{ext}}}}}}} = {{C}_{{{\text{ext}}}}} + {{C}_{{{\text{micro}}}}}\left( {\frac{{{{S}_{{{\text{micro}}}}}}}{{{{S}_{{{\text{ext}}}}}}}} \right).$Это предполагает линейную зависимость между параметрами (Сobs/Sext) и (Smicro/Sext), оба из которых определяются экспериментально. На рис. 5 показаны соответствующие зависимости для различных активированных углей, охватывающих широкий спектр величин SBET, Smicro и Sext, где SBET – площадь удельной поверхности, полученная методом ВЕТ. На одних и тех же углях измерялась емкость в неводных (a) и водных (б) электролитах (1 моль/л TEMABF4/PC и 1 моль/л H2SO4, соответственно) при разных плотностях тока 100 и 1000 мА/г. Было показано, что для водного электролита при токе 100 мА/г С = 0.12Smicro + 0.29Sext, а при токе 1000 мА/г С = 0.10Smicro + 0.28Sext, в то время как для неводного электролита при токе 100 мА/г С = 0.05Smicro + 0.20Sext, а при токе 1000 мА/г С = 0.03Smicro + 0.20Sext.
Рис. 5.
Зависимости соотношения Cobs/Cext от соотношения Smicro/Sext для различных АУ для неводного (a) и водного (б) электролитов и плотностей тока 100 и 1000 мА/г.

Соотношения между Сobs/Sext и Smicro/Sext хорошо аппроксимируются линейной зависимостью как для водных, так и для неводных электролитов для двух плотностей тока на рис. 5 [13–18]. Результаты показывают, что вклад микропор и мезопор в измеряемую емкость, т.е. Cmicro и Cext, отличаются в водных и неводных электролитах. В неводных электролитах величина Cext не изменяется при изменении плотности тока и остается около 0.2 Ф/м2, но Cmicro очень мала (0.04 Ф/м2) и уменьшается с ростом плотности тока. В водном электролите, с другой стороны, Cext почти постоянна на уровне 0.3 Ф/м2 с быстрым ростом при низкой плотности тока менее 100 мА/г; однако Cmicro постепенно уменьшается при увеличении плотности тока. Cmicro в неводных электролитах намного меньше, чем в водных (около 0.04 и 0.1 Ф/м2, соответственно), а величины Cext соответственно приблизительно равны 0.2 и 0.3 Ф/м2. Эти результаты становятся понятными при учете того факта, что размеры протона H+ в водном электролите намного меньше, чем размеры катиона TEMA+ в неводном электролите.
1.6. Влияние функциональных групп на характеристики ДСК
Известно, что в активированных углях содержится большое количество функциональных поверхностных групп [19, 20], например:
Эти ФГ встроены в углеродные шестигранники АУ. Данные по исследованию химии поверхности активированных углей АГ-3 и СКТ-6А были получены по стандартизованному методу Боэма [21–23]. Из этих данных видно, что на поверхности обеих марок углей преобладают основные группы, причем на АУ СКТ-6А их в 2 раза больше, чем на угле АГ-3. На угле СКТ-6А отсутствуют фенольные группы, а на угле АГ-3 карбоксильные и фенольные группы. В [20] были получены концентрации гидроксильных, карбоксильных и лактонных функциональных поверхностных групп (ФГ) исходного и окисленного активных углей АУ Norit DLC Supra 30. Было установлено, что окисление АУ привело к существенному увеличению концентрации ФГ в основном за счет гидроксигрупп. Для ДСК наличие функциональных ФГ на поверхности ВДУМ электродов влияет на электрохимию межфазного состояния углеродной поверхности и на свойства ДЭС, которые включают: смачиваемость, потенциал нулевого заряда, электрическое контактное сопротивление, адсорбцию ионов (емкость), и на характеристики саморазряда. Многие ФГ активированных углей обладают ионообменными свойствами (см. табл. 2).
Таблица 2.
Катионообменная и анионообменная емкость АУ [24]
| Активированные угли | Катионообменная емкость, ммоль/г | Анионообменная емкость, ммоль/г |
|---|---|---|
| Norit | 0.56 | 0.20 |
| CH900 | 0.06 | 0.70 |
Таким образом, активированные угли обладают как катионообменными, так и анионообменными свойствами, т.е. являются электроно-ионообменниками. Угли легко хемосорбируют на воздухе молекулярный кислород окружающей среды. Хемосорбция кислорода увеличивается с ростом температуры и формирует различные функциональные группы на углеродной поверхности, например –СООН, =СО, хинон-гидрохинонные и другие. Углерод-кислородные комплексы являются наиболее важными поверхностными группами на углях [25]. Виды ФГ сильно зависят от прекурсоров и условий подготовки углеродного материала. После электрохимического окисления графита на его поверхности увеличивается концентрация сильных и слабых кислотных групп, что было установлено методом титрования. Предварительное электрохимическое окисление приводит к возрастанию емкости графита и АУТ. Из данных импедансных измерений была рассчитана емкость: 160 Ф/г для электродов без окисления и 220 Ф/г для электродов после окисления. Добавочный вклад в суммарную емкость обусловлен псевдоемкостью редокс-реакций поверхностных групп.
Кислородные ФГ влияют на стационарный потенциал АУ, который, как оказалось, пропорционален логарифму содержания кислорода или концентрации кислых поверхностных групп. Угли с высоким стационарным потенциалом вызывают нежелательно высокое напряжение при заряде, и это может привести к газовой генерации.
Следует также учитывать, что при накоплении заряда на угольных электродах поверхностные функциональные группы вносят вклад в основную емкость; они могут быстро заряжаться и разряжаться и приводить к существенному росту псевдоемкости.
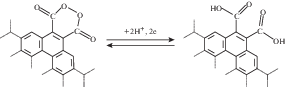
Одним из примеров обратимых редокс-реакций функциональных ПГ, вносящих вклад в псевдоемкость угольных электродов, является восстановление–окисление циклической диацилпероксидной группы до двух карбоксильных групп по реакции, приведенной на рис. 6 [26].
Наиболее распространенными являются кислородсодержащие [27] и азотосодержащие [28‒33] ФГ, хотя существуют и серосодержащие, борсодержащие [34–36] и другие ФГ. Кислородсодержащие функциональные группы образуются при обычной активации и независимо получаются на поверхности при окислении углерода кислородом или HNO3 и в результате электрохимического окисления. Внедрение кислорода вредно для углеродных материалов, использующихся в неводных растворах электролитов, потому что они оказывают неблагоприятное воздействие на надежность конденсаторов в отношении стабильности напряжения, саморазряда, тока утечки, и др. И наоборот, кислородсодержащие ФГ увеличивают общую емкость в водном растворе электролита, например, в большинстве случаев, в растворах H2SO4, генерируя псевдоемкость.
1.7. Влияние редокс-реакций функциональных групп на КПД по энергии ЭХСК
В [37, 38] было обнаружено влияние редокс-реакций функциональных групп (ФГ) на КПД по энергии (это отношение энергии разряда к энергии заряда) ЭХСК на основании измерений гальваностатических кривых с ВДУЭ. Здесь следует подчеркнуть важный факт, что КПД по энергии суперконденсаторов не лимитируется поляризацией электродных реакций, в отличие от аккумуляторов, а ограничивается только омическими потерями энергии. Поэтому в принципе КПД ДСК может приближаться к 100%. Величины удельной энергии, емкости АУЭ на основе АУ Norit были рассчитаны из соответствующих экспериментальных гальваностатических кривых, т.е. из зависимостей напряжения от времени разряда и заряда. На рис. 7 представлены экспериментальная (2) и теоретическая зависимости КПД от тока для симметричного ЭХСК (с двумя одинаковыми электродами) на основе АУ Norit [37]. Как видим, эта зависимость имеет колокол-образный вид. Из этой зависимости видно, что величина КПД при движении в сторону больших токов сначала возрастает, затем достигает максимума КПД (около 90%), а затем уменьшается. Это объясняется тем, что при малых токах в суммарную емкость вносит заметный вклад псевдоемкостной (аккумуляторный) процесс, у которого КПД мал вследствие поляризации электродной реакции, а при больших токах проявляются омические потери. При средних же токах имеет место практически только заряжение ДЭС без псевдоемкостных процессов и омических потерь. Поскольку заряжение ДЭС является обратимым процессом, то и КПД этого процесса максимален. Эта зависимость важна для практики применения ЭХСК для сглаживания пиковых нагрузок электрических сетей, поскольку в этом случае нужно стремиться работать в области максимального КПД. В [37] была развита математическая модель, учитывающая как заряжение ДЭС, так псевдоемкость редокс-реакций ФГ. Из рис. 7 видно, что рассчитанная таким образом зависимость КПД от тока близка к экспериментальной, что подтверждает принятый механизм работы ЭХСК. Из этой зависимости видно, что величина КПД при движении в сторону больших токов сначала возрастает, затем достигает максимума КПД (около 90%), а затем уменьшается. Была развита математическая модель, учитывающая как заряжение ДЭС, так псевдоемкость редокс-реакций ПГ.
Рис. 7.
Теоретическая (1) и экспериментальная (2) зависимости КПД от тока для ЭХСК на основе АУ Norit.

Как видно из рис. 8, емкость возрастает с уменьшением тока. В области больших токов возрастание достаточно медленное; оно обусловлено снижением омических потерь. Однако при малых токах имеет место резкое возрастание емкости до величин 170 и 240 Ф/г соответственно для разряда и заряда. Это обусловлено появлением существенного вклада псевдоемкости редокс-реакций поверхностных групп.
Рис. 8.
Зависимости емкости АУЭ Norit заряда (I) и разряда (II) от плотности тока для ЭХСК на основе АУ Norit.

Влияние редокс-реакций ФГ было также исследовано в суперконденсаторе на основе близкой по свойствам к АУ сажи KJEC 600/Li с неводным электролитом: 1 М раствор LiPF6 в смеси этиленкарбонат (1/3), диэтилкарбонат (1/3), диметилкарбонат (1/3) [42]. Этот электролит позволяет поляризовать электроды до потенциала не менее 4.1 В относительно Li [43]. На рис. 9 приведены интегральные кривые распределения пор по эффективным радиусам, измеренные для сажи KJEC 600 МЭКП в октане и в воде.
Рис. 9.
Интегральные кривые распределения объема пор (V) по эффективным радиусам (r*), измеренные для сажи KJEC 600 МЭКП в октане (1) и в воде (2).
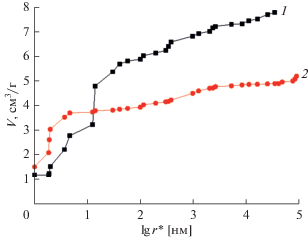
Из этого рисунка видно, что пористость по октану существенно больше, чем пористость по воде, что говорит о наличии как гидрофильных, так и гидрофобных пор. Величины полной пористости по октану – 7.8 см3/г, гидрофильной пористости – 4.9 см3/г, гидрофобной пористости 2.9 см3/г. Интересно, что в области мелких пор с r ~ 10 нм эти кривые пересекаются, т.е. кривая по воде сдвинута в сторону меньших величин r* = = r/cos θ по сравнению с октановой кривой, где r – истинный радиус пор, а θ – краевой угол смачивания в воде. Поскольку октан практически идеально смачивает все материалы, то для него θ ~ 0; следовательно это пересечение означает, что данный материал (KJEC 600) смачивается водой еще лучше, чем октаном. Это явление можно назвать “супергидрофильностью”. Его можно объяснить наличием большого количества поверхностных групп, которые гидратируются в воде, что приводит к набуханию материала. Из данных порометрических кривых согласно [30] были рассчитаны величины площади удельной поверхности по октану (2500 м2/г) и воде (2600 м2/г).
На рис. 10 представлены гальваностатические зарядные и разрядные кривые для суперконденсатора KJEC 600/Li для разных удельных токов [38]. Из этих кривых была рассчитана зависимость КПД по энергии от разрядного тока. Как видим, эта зависимость имеет максимум, как и у кривой на рис. 11 для АУ Norit, измеренной в водном электролите 1 N LiClO4. Наличие этого максимума объяснено выше. В [38] было осуществлено математическое моделирование, которое учитывает оба этих процесса. Из сопоставления рассчитанных и измеренных зарядно- разрядных кривых, приведенных на рис. 10, видно, что эти кривые вполне удовлетворительно согласуются между собой, что может говорить о корректности модели. Найденные с помощью фитинга плотность тока обмена и удельная емкость ДЭС на истинную поверхность оказываются равны соответственно ${{i}_{{0,{\text{ad}}}}}$ = 3.6 × 10–29A/см2 и ${{С}_{{{\text{dl}}}}}$ = 4.7 мкФ/см2. Столь малые токи обмена начинают играть роль при достижении значительных перенапряжений, что видно по изменению наклона кривых заряжения.
1.8. Электролиты, используемые в ДСК
Согласно разделу 1.2, для получения высокой удельной энергии используемые в ДСК электролиты должны иметь максимально высокое напряжение разложения и широкую рабочую область потенциалов. Кроме того, они должны обладать устойчивостью в области температур от –30 до +70°С. Основными недостатками водных электролитов являются: низкое разрядное напряжение, узкая рабочая температурная область, высокая коррозионная активность. Неводные жидкие электролиты имеют более высокое напряжение разложения (>2.3 В), широкие области рабочих температур, высокую коррозионную устойчивость [39, 40, 41]. К их недостаткам относятся низкая электропроводность и невысокие величины удельной емкости углеродных электородов, необходимость тщательной изоляции от внешних воздействий, высокая стоимость. Однако ДСК с водными электролитами имеют более высокую общую емкость, чем с неводными, вследствие их значительно большей удельной емкости ДЭС на единицу истинной поверхности.
Емкость ДСК с неводными электролитами увеличивается с уменьшением размера ионов [2]: ${\text{BF}}_{{\text{4}}}^{ - }$ > ${\text{PF}}_{6}^{ - }$ > Et4N– > В4N–. Потенциал восстановления Et4NBF4/РС (пропиленкарбонат) ограничивается разложением Et4N+ и РС. Многие растворители имеют подобный ограничивающий потенциал 3 В (с. к. э.), который связан с разложением катиона Et4N+. Были исследованы свойства электролитов, основанных на циклических ароматических солях имидазола [2]. Они имеют высокую электропроводность (>20 мСм/см), широкую область электрохимической стабильности (>3.5 В), высокую растворимость. Емкость ДСК с угольными электродами и электролитами из солей имидазола составила около 125 Ф/г [2]. Часто в ЭХСК в качестве неводных электролитов с относительно высокой электропроводностью используются электролиты с растворителем ацетонитрилом. Недостаток ацетонитрила – его высокая токсичность.
Среди неводных электролитов особое место занимают так называемые ионные жидкости (ИЖ), представляющие собой органические соли, жидкие при комнатной или близкой к ней температуре. Они состоят из большого органического катиона и существенно меньшего по размерам неорганического или органического аниона. По сравнению с обычными электролитами ИЖ не содержат растворитель. Повышенное внимание к ионным жидкостям обусловлено наличием у них таких свойств, как широкий интервал жидкого состояния (>300°С); некоторые ионные жидкости характеризуются относительно высокой ионной проводимостью [>10–4 (Ом см)–1] и широким окном потенциалов, негорючестью, способностью функционировать в высокотемпературных режимах, которые не достижимы для других жидких электролитов, нелетучестью (очень низкое давление паров); и взрывобезопасностью; большинство ИЖ нетоксичны. В ряде работ исследовали применение ионных жидкостей в качестве электролитов в ЭХСК [42–55]. Наиболее широко используемыми в ЭХСК являются соли имидазолия и пирролидиния, которые облают наиболее высокой электропроводностью, в то время как окно электрохимической стабильности (ОЭС) достигает даже 5 В (однако эти данные получены только для гладких электродов); хотя при этом пока не достигнута высокая циклируемость. Видимо, существует пока еще не установленная причина, почему для пористых электродов реальное окно потенциалов существенно меньше. В [42, 56–62] были разработаны квазитвердотельные углеродные суперконденсаторы с ИЖ (гидросульфат IL-1-этил-3-метилимидазолия (EMIHSO4)) на основе полимерной смеси поливинилового спирта и поливинилпирролидона и были получены высокая удельная емкость 485 Ф/г и удельная энергия 24.3 Вт ч/кг с длительной циклической работой до 5000 циклов при окне ОЭС 1.6 В.
Для получения высокой емкости ЭХСК с ИЖ должны иметь достаточно большой объем мезопор с размерами, большими, чем размер крупных катионов ИЖ. Однако, с другой стороны емкость ДСК пропорциональна удельной поверхности. Следовательно, удельная поверхность углеродных пористых электродов должна определиться именно мезопорами, а не микропорами. В [44] были разработаны ЭХСК с АУ-электродами и с электролитом на основе ИЖ, АУ-электроды на основе биомассы обладали сверхвысоким объемом мезопор 1.85 см3/г и площадью удельной поверхности 1771 м2/г. Была получена емкость ДЭС до 188 Ф/ г при плотности тока 1 А/г, высокая удельная энергия 80 Вт ч/кг и удельная мощность 870 Вт/ кг с длительной циклической работой до 5000 циклов при окне ОЭС 2.7 В. В [45] сообщается о достижении в ЭХСК с ИЖ ОЭС до 4.0 В, удельной энергии 20 кВт ч/кг и удельной мощности 3.1 кВт/кг при циклируемости до 1000 циклов. Как видим, большая величина ОЭС была достигнута при невысокой циклируемости. В [50] была развита теория для описания влияния небольшого количества воды, растворенной в ионной жидкости вблизи поверхности электрода. Были описаны короткодействующие взаимодействия между ионами, молекулами воды и электродом. Было исследовано: (1) специфическое взаимодействие ионов и молекул с электродом, которое отвечают за их специфическую адсорбцию; (2) гидрофильность/гидрофобность ионов. Получены изотермы электросорбции в зависимости от падения потенциала в ДЭС. Было рассчитано влияние электросорбции воды на дифференциальную емкость ДЭС. Эта интересная работа, являющаяся практически первой в области теории ДСК с ИЖ, представляет существенный интерес, однако она развита для гладких электродов и не учитывает влияние пористой структуры реальных ДСК, что нам представляется важным, поскольку на практике для ДСК с пористыми электродами не удается получить максимальных величин ОЭС.
1.9. Нанопористые угли, полученные разными методами
1.9.1. Активированные угли (АУ). АУ являются одними из наиболее распространенных электродных материалов для ЭХСК [1, 2, 4, 6, 7, 13, 63–69]. Обычно АУ получают в процессе карбонизации и последующей активации целого ряда природных и синтетических углеродсодержащих материалов. Для приготовления АУ могут быть использованы растительное и животное сырье (древесина, сахар, кокос, скорлупа орехов, фруктовые косточки, кофе, кости и др.), минеральное сырье (торф, угли, пек, смола, кокс), синтетические смолы и полимеры. В ходе карбонизации происходит разложение исходных веществ (прекурсоров) и удаление неуглеродных элементов. В процессе газовой активации водяным паром, диоксидом углерода и кислородом при температурах 500–900°С имеет место окисление, выгорание части неорганизованного углерода и элементарных кристаллитов и формирование развитой пористой структуры частиц АУ. Применяют также жидкофазную активацию с применением щелочи и азотной кислоты. В зависимости от технологии изготовления измеренная методом БЭТ удельная площадь поверхности активированных углей находится в очень широком диапазоне от ~500 до 3000 м2/г. АУ содержат три вида пор: микропоры, мезопоры и макропоры, причем наибольший вклад в величину площади удельной поверхности вносят микропоры, а затем мезопоры (см. раздел 1.4). Одновременно с изменением пористой структуры углеродных материалов в ходе их обработки происходит формирование химической поверхностной (двумерной) структуры и изменение электрофизических характеристик. Химический состав поверхности АУ, их электрофизические характеристики и пористая структура оказывают важнейшее влияние на электрохимические и емкостные свойства ЭХСК. Величины удельной емкости за счет заряжения ДЭС обычно находятся в пределах от 50 до 200 Ф/г. Установлено, что с увеличением тока для гальваностатических кривых и скорости развертки потенциала происходит уменьшение емкости.
Обычно угольные электроды в водных растворах циклируют в диапазоне потенциалов от 0 до 1 В (о. в. э.). Нижний предел потенциалов обусловлен выделением водорода на металлических токоотводах, а верхний предел – окислительной коррозией угля. В [68, 69] при исследовании электродов на основе активированного угля ADG и активированных угольных тканей (AУТ) CH900-20 и ТСА были применены графитовые токоотводы. Это позволило циклировать эти электроды в максимальном диапазоне потенциалов от –1 до 1 В (о. в. э.) вследствие высокого перенапряжения выделения водорода на графите и угле. Данные, полученные методом ЦВА, для более наглядного представления применительно к емкостным свойствам, особенно измеренные при разных скоростях развертки потенциала (w), удобно представлять в виде вольт-фарадных кривых, построенных в координатах дифференциальная емкость (С)–потенциал (E), где С = Idτ/dE = I/w, I – ток, w = dE/dτ, τ – время. На рис. 12 для АУТ СН900-20 приведено сравнение циклических вольт-фарадных кривых, измеренных в 48.5% H2SO4 при разных величинах w в двух областях потенциалов: в области обратимости (от 0.25 до 0.8 В) и в области глубокого заряжения (от –0.5 до 0.8 В). Из кривой 4, измеренной в области обратимости следует, что здесь имеет место практически только заряжение ДЭС. Из этой кривой следует, что величина емкости ДЭС равна 170 Ф/г. В области отрицательных потенциалов (<–0.1 В) (кривые 1–3) наблюдается протекание фарадеевских процессов с очень большой псевдоемкостью.
Рис. 12.
Вольт-фарадные циклические кривые для АУТ СН900-20. Скорости развертки потенциалов 0.5 (кривая 1), 1.0 ( 2 ) и 2.0 мВ/с (3, 4).

Методом гальваностатических кривых была измерена зависимость величины количества электричества Q в 40.3% H2SO4 после длительного заряда при потенциале Е = –250 мВ. Величина Q очень быстро возрастала при очень малых временах заряда в секунды и минуты, и далее продолжала очень медленно возрастать в течение многих десятков часов. Такой очень медленный рост можно объяснить очень медленной диффузией атомов водорода. Известно, что наиболее низкие коэффициенты диффузии имеют место в твердой фазе, на порядки ниже, чем в жидкой фазе. В связи с этим было предположено, что протекание процесса интеркаляции водорода в углерод АУ контролируется замедленной твердофазной диффузией водорода. Было установлено, что сопротивление АУ-электрода возрастает со временем глубокого катодного заряжения. Эта зависимость объясняется изменением химического состава твердой фазы электрода в процессе заряжения: от С к СхН, а в пределе до С6Н. Максимальный удельный заряд – 1560 Кл/г, что соответствует удельной емкости 1110 Ф/г – был получен после заряда в течение 22 ч при потенциале E = –0.31 В (о. в. э.) в 56.4% H2SO4. Эта величина емкости намного превосходит соответствующие величины, полученные в литературе для углеродных электродов. Как указано выше, удельный заряд, обусловленный заряжением ДЭС, для СН900-20 равен 240 Кл/г. Разность 1560 Кл/г – 240 Кл/г = = 1320 Кл/г. Поскольку согласно закону Фарадея для получения соединения С6Н требуется затратить именно 1320 Кл/г, то это доказывает образование в пределе катодного заряжения АУ именно соединения неизвестного ранее соединения С6Н, т.е. гидрида углерода или карбида водорода, т.е. средняя удельная емкость 860 Ф/г. Была развита и подтверждена экспериментально математическая модель, описывающая процессы заряда–разряда АУ-электродов и учитывающая заряжение ДЭС, интеркаляцию водорода в углерод и его нестационарную твердофазную диффузию, электродную кинетику, ионный перенос по толщине электрода и характеристики его пористой структуры.
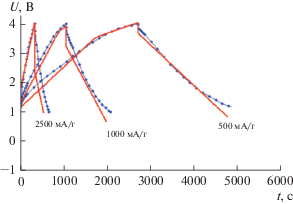
На рис. 13 приведена зависимость максимального удельного заряда СН900-20 от концентрации серной кислоты для времени потенциостатического заряда 18 ч.
Рис. 13.
Зависимость максимального удельного заряда АУЭ СН900-20 от концентрации серной кислоты для времени потенциостатического заряда 18 ч.

Как видим, удельный заряд возрастает с увеличением концентрации серной кислоты. Как известно, в концентрированных растворах серной кислоты происходит ее интеркаляция в графит и в графитоподобные материалы, возрастающая с ростом этой концентрации. При этом происходит расширение щели между графеновыми слоями, куда проникает кислота, и в данном случае имеет место двойная интеркаляция. Серная кислота интеркалирует в АУ, расширяя межслоевое (межграфеновое) пространство, и в это пространство при глубоком катодном заряжении АУ устремляются атомы водорода. Затем они взаимодействуют с графеновыми слоями с образованием в пределе соединения С6Н [68, 69] (гидрид углерода или карбид водорода). В [68, 69] была разработана двумерная математическая модель заряда–разряда ВДУМ, учитывающая заряжение ДЭС, интеркаляцию водорода в углерод, твердофазную диффузию водорода, кинетику Батлера–Фольмера [70], ионный перенос и распределение потенциала в пористом электроде. На рис. 14 представлен фитинг разрядной кривой для плотности тока 2 мА/см2. Как видим, расчетная кривая близка к экспериментальной, что говорит о корректности принятой математической модели. На основании этого фитинга была получена величина коэффициента твердофазной диффузии водорода в углерод АУ 10–14 см2/с, а также плотность тока обмена интеркаляции водорода 0.5 × 10–8 А/см2.
Рис. 14.
Фитинг разрядной кривой для плотности тока 2 мА/см2. I – экспериментальная, II – расчетная кривые.

Из рис. 15 следует, что при заряжении–разряжении АУ-электрода СН900-20 вклад в емкость вносят заряжение ДЭС, псевдоемкость процесса интеркаляции водорода в углерод, а также псевдоемкость редокс-реакций ПГ [69, 72].
Рис. 15.
ЦВА-кривые для АУ АГ-3 в 30% H2SO4. Скорости развертки потенциала, мВ/с: 0.5 (1), 1.0 (2), 2.0 (3, 4) [72].

На рис. 16 приведены ЦВА-кривые для АУЭ Norit, исходного, восстановленного и окисленного, при скорости развертки потенциала 5 мВ/с [21]. Как видим, у окисленного угля, обладающего большим количеством ПГ, имеет место существенная псевдоемкость за счет редокс-реакций ПГ.
Рис. 16
. ЦВА-кривые для АУЭ Norit, исходного, восстановленного и окисленного, при скорости развертки потенциала 5 мВ/с [22].

1.9.2. Шаблонные (templated) пористые угли. Методом шаблонов изготавливают как микропористые, так и мезопористые угли в зависимости от самих шаблонов и сырья [13, 71]. Метод заключается в пропитке мелкопористых прекурсоров органическим растворителем (например, фурфуриловым спиртом), карбонизации его в мелких порах и в растворении прекурсора.
Путем карбонизации прекурсоров в наноканалах различных типов цеолитов были приготовлены микропористые угли (цеолит-шаблонный углерод ZTC), в том числе уголь с самым высоким значением SBET и общим объемом пор 4000 м2/г и 1.8 см3/г, соответственно. Поскольку поры, образованные в ZTC, возникли из цеолитных каналов, они имели однородные по размеру и морфологии микропоры, а также небольшую долю мезопор. ЦВА-кривые ZTC в неводном растворе показали непрямоугольные кривые, что указывает на наличие псевдоемкости в основном в результате кислородных функциональных групп на поверхности углерода, однако величина Cg не коррелирует с содержанием кислорода. Для большинства ZTCs результаты показали очень хорошую скорость разряда, т.е. почти постоянную емкость даже при высокой плотности тока, в 2 А/г в дополнение к высоким значениям Cg. Подобная скорость разряда связана с трехмерно-упорядоченной системой микропор, что дает низкое сопротивление в микропорах.
1.9.3. Карбидные производные углерода. Из различных карбидов металлов (TiC, В4С, SiC и др.) можно изготавливать высоко-микропористые угли путем термообработки при температуре от 400 до 1200°C в потоке Cl2, который растворяет металлы и кремний [72]. SBET составляет 1000–2000 м2/г. Пористая структура этих углей сильно зависит от карбидных исходников и температуры термообработки (ТТО). В этих карбид-производных углях до 800°C формируются в основном микропоры, но при нагревании выше 800°C начинают преобладать мезопоры, и как следствие, SBET имеет максимумом при 800°C для большинства углей. С помощью этих карбидных микропористых углей были созданы ЭХСК и изучено их поведение в различных неводных и водных электролитах, а также обсуждались эффекты влияния размеров ионов электролитов и молекул органических растворителей. Для TiC-производные угли были изготовлены при 500–1000°C, в результате чего средние размеры микропор и SBET изменялись от 0.7 до 1.1 нм и от 1000 до 1600 м2/г. В4С производные углерода дали хорошие результаты по скоростям работы в растворе KOH и 86%-ное удержание емкости при изменении скорости развертки потенциала от 2 до 50 мВ/с.
Анализ емкостей КУ из SiC (электролит – ионная жидкость) в широком интервале потенциалов показал приблизительную пропорциональность среднеинтегральной удельной емкости и удельной поверхности для КУ-600С и КУ-1500С. Оценка предельной величины емкостей глубокого катодного заряжения дает 1500 Кл/г для SiC‑600C и 1250 Кл/г для ТiC-600C. Они согласуются с предельной величиной емкости в 1560 Кл/г (или 1100 Ф/г), полученной ранее для активированной углеродной ткани СН900-20 (см. раздел 1.9.1). Эта величина обусловлена образованием соединения С6Н.
В [73] были синтезированы карбидные угли на основе TiC с использованием никелевого катализатора. Варьирование количества катализатора позволяло заданным образом изменять пористую структуру карбидного угля. В результате получалась удельная поверхность в интервале от от 1500 до 300 м2/г. В [74] для изготовления прекурсора SiC был применен известный в промышленности метод для производства полиорганосилсесквиоксанов с различным соотношением фенильных и винильных функциональных групп, которые затем подверглись пиролизу с получением оксикарбидов кремния. Такие керамические материалы на основе полимера хорошо подходят в качестве прекурсора для карбидных материалов. Удаление кремния и кислорода в результате хлорного травления при 1200°С приводило к образованию нанопористого углерода с удельной поверхностью от 2014 до 2114 м2/г. В результате такие карбидные угли являются привлекательными для электродов суперконденсаторов большой мощности. Для таких ЭХСК при низких скоростях в 1 М тетрафторборате тетраэтиламмония в ацетонитриле была получена емкость 116 Ф/г при 5 мА/г и 80 Ф/г при очень высоких скоростях (100 А/г). В последние годы в качестве прекурсора карбидных углей стали использовать WC. В [75] испытания в 1 М H2SO4, полученных таким образом ДСК, дали довольно высокую удельную емкость 477 Ф/г.
1.9.4. Углеродные аэрогели и ксерогели. Аэроге́ли – класс материалов, представляющих собой гель, в котором жидкая фаза полностью замещена газообразной. Такие материалы обладают рекордно низкой плотностью и демонстрируют ряд уникальных свойств: твердость, прозрачность, жаропрочность, чрезвычайно низкую теплопроводность и т. д. Аэрогели относятся к классу мезо-пористых материалов, в которых поры занимают более 50% объема. Как правило, этот процент достигает 90–99%, а плотность составляет от 150 до 1 мг/см3. Изменение условий получения углеродных аэрогелей привело к сильному влиянию на емкость ЭХСК [13, 76]. В [76] для приготовления аэрогеля бамбуковые волокна сначала растворяли в водных растворах NaOH/мочевина, затем гель выдерживался при –20°С в течение 12 ч с последующим погружением в регенерационную ванну с деионизованной водой. Затем гидрогель целлюлозы был заморожен в жидком азоте в течение 48 ч. В процессе прокаливания под потоком аргона аэрогели нагревали до различных температур (700, 800, 900, 1000°C). После этого процесса карбонизации аэрогель активировали водным раствором КОН. Полученные образцы аэрогеля имели плотность от 10 до 20 мг/см3, удельную поверхность от 920 до 1085 м2/г. В ЭХСК с электродами из аэрогеля в 6 М КОН была получена высокая емкость 381 Ф/г.
Ксерогели представляют собой гели, из которых удалена жидкая среда, так что структура оказывается сжатой, а величина пористости – до некоторой степени пониженной за счет сил поверхностного натяжения, действовавших в процессе удаления жидкости. Ксерогели представляют собой ансамбль соприкасающихся шаровидных частиц, размеры и плотность упаковки которых зависят от способа приготовления. Значение Cg для углеродного ксерогеля увеличивалось с 110 до 170 Ф/г при активации СО2. Такое изменение Cg связано с существенным увеличением Smicro от 530 до 1290 м2/г вместе с увеличением Smeso от 170 до 530 м2/г [2].
1.9.5. Углеродные нанотрубки. Углеродные нанотрубки (УНТ) являются перспективными для применения в качестве электродных материалов ЭХСК [77–84]. Их отличительными чертами являются не только большая площадь открытой поверхности и разные пространства для хранения ионов электролита, но также их высокая электропроводность.
Внешняя поверхность стенок УНТ состоит в основном из базальной плоскости графита. На такой идеальной поверхности, как у УНТ, вследствие высокой поляризации большая емкость ДЭС имеет место при широком окне потенциалов. Большинство из УНТ соединены друг с другом за счет сил Ван-дер-Ваальса, где только внешние трубки в пучке подвергаются воздействию электролита и расслоению пространства между трубками, которое с трудом используется для формирования ДЭС. Внутренняя поверхность нанотрубок в принципе также подходит для проникновения ионов электролита, однако здесь есть определенные ограничения: во-первых, вследствие очень малого внутреннего диаметра (1.3–1.6 нм) большинство ионов не может проникнуть внутрь нанотрубок, во-вторых, из-за гидрофобности внутренней поверхности водные электролиты не смачивают это внутреннее пространство. Межслоевое пространство в стенках многостенных нанотрубок может быть доступным для интеркаляции ионов электролита, таких как Li+. Таким образом, может быть возможной как интеркаляция, так и фарадеевская реакция, давая при этом псевдоемкость.
В ряде работ для ДСК на основе ОСУНТ в сернокислотном электролите были получены высокие мощностные характеристики – более 20 кВт/кг при очень высоких плотностях тока до нескольких сотен А/г. Такие высокие мощностные характеристики объясняются регулярной структурой пор, расположенных между отдельными нанотрубками и их тяжами [77]. Регулярность пористой структуры означает практическое отсутствие извилистых и гофрированных пор, а значит, максимальную электропроводность электролита в порах.
Для некоторых тщательно очищенных от примесей ОСУНТ было обнаружено появление на кривых ЦВА характерного участка потенциалов с резким падением емкости, что отличает ОСУНТ от других углеродных материалов [2, 77]. Сравнение средней емкости и емкости в области провала показывает соотношение около 3 : 1, а ширина области провала около 500 мВ. Анализ возможных объяснений подобного вольт-амперного поведения ОСУНТ показывает прямую корреляцию между наблюдаемым эффектом и полупроводниковыми свойствами нанотрубок. С увеличением концентрации серной кислоты потенциал локализации провала смещается в отрицательную область, приводя к некоторому росту перенапряжения выделения водорода. Благодаря подобному эффекту максимальное напряжение для суперконденсаторов с ОСУНТ-электродами в серной кислоте может достигать 1.4 В. Для того, чтобы использовать внутреннюю поверхность ОСУНТ, было проведено раскрытие отверстий на концах трубок путем окисления. Если внутренняя поверхность открытых ОСУНТ может быть полностью использована для формирования ДЭС, то в пределе емкость должна удваиваться. При оптимизации условий окисления супер-ОСУНТ были получены SBET более 2000 м2/г, а конденсатор, использующий TEABF4/PC, дал очень высокие величины удельной энергии (24.7 Вт ч/кг) и удельной мощности (98.9 кВт/кг). Основным недостатком ОСУНТ является их большая дороговизна, которая в ближайшее время не дает возможности их широкого практического применения.
По сравнению с ОСУНТ, свойства конденсаторов на основе двухстенных углеродных нанотрубок (ДСУНТ) не были столь часто публикуемы, потому что чистые ДСУНТ очень трудно получить. В принципе ДСУНТ и многостенные углеродные нанотрубки (МСУНТ) обладают меньшей площадью поверхности для формирования ДЭС по сравнению с ОСУНТ [13, 80, 81]. С другой стороны, было опубликовано множество работ по емкости МСУНТ, так как они относительно легко синтезируются и значительно дешевле по сравнению с ОСУНТ [2, 13, 83]. В зависимости от методов синтеза и модификаций были получены различные типы МСУНТ с различными величинами удельной поверхности. Их удельные емкости, полученные в водных и неводных электролитах, составляют от 10 до 100 Ф/г. Однако они не столь велики по сравнению AУ. С другой стороны, надо отметить, что объемная емкость Cv относительно высока из-за большой объемной плотности МСУНТ. Синтез МСУНТ часто проводится пиролизом этилена с использованием катализаторов, например, Fe–Co.
В [84] отмечается что емкость ДЭС для водных электролитов ограничивается гидрофобностью микропор и поэтому эта емкость недостаточно велика (93 Ф/г) по сравнению с графенами. Поэтому в последнее время УНТ часто используются в качестве электропроводных дисперсных носителей для неэлектропроводных оксидов металлов или для некоторых электронопроводящих полимеров [80, 81]. И действительно, в последние 10 лет публикуется очень мало работ по применению УНТ в ДСК.
1.9.6. Графены и их производные. В последнее время в качестве перспективных электродных материалов для ЭХСК стали использовать графены и их производные [6, 75, 84–100]. Графены были открыты всего около 10 лет назад, за что их создатели получили Нобелевскую премию. И практически сразу были обнаружены замечательные свойства графенов, которые открывают широкие возможности их применения в различных отраслях народного хозяйства, в том числе в химических источниках тока и в электрохимических конденсаторах в частности. Единичный слой графенового листа обеспечивает удельную внешнюю поверхность вплоть до 2675 м2/г, доступную для жидкого электролита, по сравнению с внешней удельной поверхностью приблизительно 1300 м2/г для единственной ОСУНТ. Графеновые слои образуют пластинки из нескольких единичных графеновых слоев, в результате чего доступная для электролита поверхность уменьшается. Тем не менее, в последнее время были получены обнадеживающие результаты для ЭХСК с графеновыми электродами. Часто графеновые электроды кроме емкости ДЭС обладают также псевдоемкостью фарадеевских редокс-реакций.
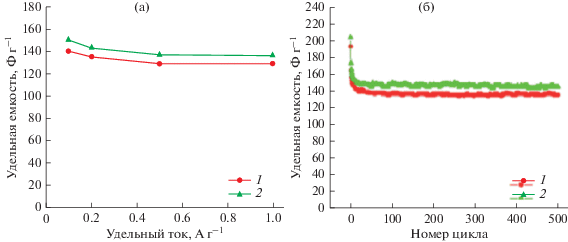
Восстановленный оксид графена (ВОГ) был получен по модифицированному методу Хаммерса. Согласно этой методике исходный порошок графита при перемешивании и охлаждении добавлялся в смесь концентрированных серной и азотной кислот, и через некоторое время в эту же смесь добавлялось трехкратное по отношению к графиту количество перманганата калия. Затем к ней добавляют раствор пероксида водорода и через час разбавляют троекратным количеством дистиллированной воды. После отстаивания в течение нескольких часов верхний прозрачный слой декантируют. Взвешенный осадок фильтруют, промывают дистиллированной водой и сушат при комнатной температуре до постоянного веса. В результате получают сухой порошкообразный оксид графита, который восстанавливают методом быстрого нагревания до температуры 1000°С. В момент восстановления происходит расслоение материала с многократным увеличением его объема (эксфолиация). Конечный продукт представляет собой порошок из тонких монослоев, содержащих от 1 до 10 графеновых монослоев в пластинках, которые имеют разброс по размерам от 1 до 10 мкм в латеральном направлении. Эти монослои в свою очередь группируются в агломераты, между которыми образуются поры с широким (в 4–5 порядков) спектром размеров: микропоры, мезопоры и макропоры [89, 100]. Графеновые электроды отличаются высокой обратимостью зарядно-разрядных процессов. Это наглядно видно из рис. 17, на котором приведены зависимости удельной емкости от удельного тока и от числа гальваностатических циклов заряда/разряда для двух разных электродов с площадью удельной поверхности 450 и 520 м2 г–1, изготовленных на основе ВОГ, который наносился на никелевый войлок. Электрохимические измерения проводились в 30 вес. % КОН [13]. Как видим, при изменении на порядок удельного тока емкость почти не изменилась. Также видно, что в течение 500 циклов емкость практически оставалась постоянной.
Рис. 17.
Зависимости удельной емкости от удельного тока (a) и зависимости удельной емкости в 30 вес. % КОН от числа гальваностатических циклов заряда/разряда (б) при удельном токе 0.1 А г–1 для двух электродов на основе ВОГ с величинами удельной поверхности 450 м2/г (1), 520 м2/г (2).
В [99] было установлено, что оксид графена обладает протонной проводимостью, а в [100] на этом основании был изготовлен суперконденсатор, состоящий из сепаратора из оксида графена и двух электродов на основе восстановленного оксида графена. В [98] были получены новые нанокомпозиты на основе частиц сульфида кобальта (Co3S4), в форме нанолистков из углеродных нанотрубок (УНТ)/ВОГ. В качестве оптимального электрода был выбран электрод rGO100-CNT50-Co3S4, который показал отличные электрохимические характеристики со сверхвысокой удельной емкостью 977 Ф г–1 при 1 А г–1 и замечательную возможность увеличения скорости до 63% после увеличения плотности тока в 40 раз. При этом получена максимальная удельная энергия 43.5 Вт ч кг–1 и удельная мощность до 6.9 кВт кг–1.
2. ПСЕВДОКОНДЕНСАТОРЫ (ПсК)
Как было отмечено выше, согласно Конвею, электрохимические суперконденсаторы (ЭХСК) – это такие электрохимические устройства, в которых протекают квазиобратимые электрохимические зарядно-разрядные процессы, и форма гальваностатических зарядных и разрядных кривых которых близка к линейной, т.е. близка к форме соответствующих зависимостей для обычных электростатических конденсаторов [1]. К ЭХСК, кроме двойнослойных ЭХСК, относятся также так называемые псевдоконденсаторы (ПсК), на электродах которых протекают быстрые квазиобратимые фарадеевские процессы, т.е. редокс-реакции заряда–разряда. Емкость ПсК-электродов, как правило, больше, чем емкость ДСК-электродов. Поскольку ПсК-электроды изготавливаются с высокой удельной поверхностью, то в их емкость вносит вклад как псевдоемкость фарадеевских реакций, так и емкость ДЭС. Псевдоконденсаторные электроды подразделяются на три основных типа: электроды на основе неорганических соединений переходных металлов (оксидов, сульфидов, нитридов и др.), на основе ЭПП и на основе мономерных редокс-систем [1, 2, 101–104].
2.1. Электроды на основе неорганических соединений переходных металлов
В ПсК-электродах часто используются оксиды металлов переменной валентности [1, 2, 105–110]. Исторически сначала были исследованы оксиды металлов платиновой группы. ЦВА для Ru подобны ЦВА для Pt. Однако, в отличие от Pt, на Ru при последующем циклировании происходит рост оксидной пленки [1]. Электрический заряд на электроде из оксида Ru накапливается за счет емкости ДЭС и фарадеевской псевдоемкости, связанной с изменением степени окисления Ru в оксидной пленке. Обратимый окислительно-восстановительный процесс происходит в области потенциалов от 0.05 до 1.5 В (Ен) с образованием Ru(II), Ru(III), Ru(IV), Ru(VI). В указанной области потенциалов ток практически не зависит от потенциала. Подобное поведение проявляет и IrO2, но для него емкость в большей степени зависит от потенциала. Были исследованы оксид Ru и гидрат оксида Ru в качестве электродов для ПсК. Электрохимические реакции, происходящие в таких ПсК, имеют следующий вид:
Положительный электрод
(2.1)
${\text{HRu}}{{{\text{O}}}_{2}} \leftrightarrow {{{\text{H}}}_{{1 - \delta }}}{\text{Ru}}{{{\text{O}}}_{2}} + \delta {{{\text{H}}}^{ + }} + \delta {\text{e}}{\text{.}}$Отрицательный электрод
(2.2)
${\text{HRu}}{{{\text{O}}}_{2}} + \delta {{{\text{H}}}^{ + }} + \delta {\text{e}} \leftrightarrow {{{\text{H}}}_{{1 + \delta }}}{\text{Ru}}{{{\text{O}}}_{2}}.$Общая реакция
(2.3)
${\text{2HRu}}{{{\text{O}}}_{2}} \leftrightarrow {{{\text{H}}}_{{1 - \delta }}}{\text{Ru}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{1 + \delta }}}{\text{Ru}}{{{\text{O}}}_{2}},$В [111] были измерены гальваностатические кривые для трех положительных электродов, содержащих 15 и 30% Ru. Было установлено, что с увеличением содержания рутения емкость ПсК возрастает.
В последние годы в качестве материала для псевдоемкостного электрода стали активно изучать оксиды марганца, как еще одного металла с переменной валентностью, который намного дешевле рутения. Чаще всего исследуют MnO2. Обычно его наносят на высокодисперсные ВДУЭ. В частности, была разработана методика изготовления гидротермически восстановленного оксида графена (ВОГ)/MnO2 путем погружения ВОГ в смешаный раствор 0.1 M KMnO4 и 0.1 M K2SO4 на различные периоды времени [112]. Предложен механизм осаждения MnO2 в ВОГ который иллюстрируется следующей реакцией
(2.4)
$\begin{gathered} 4{\text{MnO}}_{4}^{ - } + 3{\text{C}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = 4{\text{Mn}}{{{\text{O}}}_{2}} + {\text{CO}}_{3}^{{2 - }} + 2{\text{HCO}}_{3}^{ - }. \\ \end{gathered} $Основным результатом электрохимических исследований был следующий: удельная емкость ВОГ/MnO2-200-электрода достигала 211.5 Ф/г при скорости развертки потенциала 2 мВ/с. Кроме того, электрод показал хорошую циклируемость и стабильность.
Среди большого количества оксидов марганца, обсуждаемых в литературе, системы Li–Mn–O и Na–Mn–O получили наибольшее внимание из-за их туннельных или многоуровневых кристаллических структур, которые облегчают процессы литий/натрий интеркаляции–деинтеркаляции. Представляет интерес для ЭХСК также соединение Na2Mn5O10 . В водном растворе 0.5 M Na2SO4 была получена удельная емкость 178 Ф г–1. Электрохимические измерения были проведены также в органических электролитах типа LiClO4/PC или LiPF6/гамма-бутиролактон (γ-БЛ) при комнатной температуре. Было показано, что композитный электрод V2O5/С при соотношении 0.7 по весу дает в электролите 1 M LiClO4/пропиленкарбонат 54% от идеальной емкости в 360 мA ч/г (4.2–2.0 В), отнесенной к массе V2O5, даже при очень высокой скорости разряда при 150°C, т.е. при 54 A/г V2O5. Были также предложены электроды, состоящие из тройных оксидов Ti–V–W–O/Ti и Ti–V–W–O/С. Тонкие пленки оксидов и сульфидов переходных металлов LiMn2O4, LiNiO2, LiCoO2, TiS2, V2S5 толщиной от 5 до 15 мкм, осажденные на подложках из Al или нержавеющей стали, были исследованы в качестве электродов для ПсК [113]. Электролит – раствор LiAsF6 в ПК (пропиленкарбонат). Электроды из нитрида Ti электрохимически стабильны в щелочном электролите в широком интервале температур (–55°…100°С). Их удельная емкость составила 125 мФ/см2. В качестве заменителей дорогого RuO2 предложены также нитриды Мо: Mo2N и MoN, полученные осаждением на Ti-подложку. Важное различие между нитридными пленками и RuO2 заключается в том, что область потенциалов обратимой емкости для нитридных пленок составляет только ~0.7 В, в то время как для RuO2 эта область составляет ~1.4 В. В [106] исследованы композиты на основе нитридов/оксинитридов металлов в качестве суперконденсаторных электродов. Эти наноструктуры обладают отличными емкостными свойствами до 990 Ф г–1, высокой удельной энергией до162 Вт ч кг–1 и удельной мощностью до 54 Вт кг–1.
2.2. Электроды на основе электронопроводящих полимеров (ЭПП)
Одним из достижений электрохимии последних 25–30 лет была разработка ЭПП. Электронная проводимость ЭПП осуществляется в процессе его допирования противоионами вследствие образования делокализованных π-электронов или дырок и переноса их под воздействием электрического поля по системе полисопряженных двойных связей, которыми обладает любой ЭПП. К ЭПП относятся: полиацетилен (PAc), полианилин (PAni), поли(п-фенилен) (PPh), политиофен (PT), полипиррол (PPy), полипорфин (PP) и их производные. Поскольку во многих ЭПП могут протекать квазиобратимые электрохимические зарядно-разрядные процессы, то они широко используются в ЭХСК [1, 2, 114–125]. На рис. 18 приведены структурные формулы для некоторых ЭПП, применяемых в ПсК [115].
Рис. 18.
Структурные формулы для ЭПП (А): (а) транс-полиацетилена, (б) цис-полиацетилена, (в) поли (п-фенилена), (г) полианилина (PAni), (д) поли (н-метилена) (PNMA), (е) полипиррола (PPy), (ж) политиофена (PTh), (з) поли(3,4-этилендиокситиофена) (PEDOT), (и) поли (3-(4-фторфенил)тиофена) (PFPT), (к) поли (циклопента [2,1-b;3,4-дитиофена-4-один]) (PcDT), Б: Mg полипорфина.

ЭПП типа полипорфинов недавно были разработаны М.А. Воротынцевым с сотр. [124]. В табл. 3 приведены величины удельной электропроводности для ряда ЭПП.
Таблица 3.
Величины удельной электропроводности для ряда ЭПП, применяющихся в ПсК
| Полимер | Электропроводность, См см–1 |
|---|---|
| Полианилин | 0.1–5 |
| Полипиррол | 10–50 |
| Полиэтилендиокситиофен | 300–500 |
| Политиофен | 300–400 |
Величины электронной проводимости всех ЭПП, приведенных в табл. 3, намного выше, чем ионная проводимость для большинства обычных электролитов, особенно неводных. В табл. 4 приведены следующие характеристики для ЭПП, применяющихся в ЭХСК: молекулярная масса (Mw), допантный уровень, диапазон потенциалов, теоретическая и измеренная удельная емкость [115].
Таблица 4.
Характеристики для ЭПП, применяющихся в ПсК: молекулярная масса (Mw), допантный уровень, диапазон потенциалов, теоретическая удельная емкость, измеренная удельная емкость
| ЭПП | Mw, г моль–1 | Допантный уровень | Диапазон потенциалов, В | Теоретическая удельная емкость, Ф/г | Измеренная удельная емкость, Ф/г |
|---|---|---|---|---|---|
| Полианилин | 93 | 0.5 | 0.7 | 750 | 240 |
| Полипиррол | 67 | 0.33 | 0.8 | 620 | 530 |
| Политиофен | 84 | 0.33 | 0.8 | 485 | – |
| Полиэтилен- диокситиофен | 142 | 0.33 | 1.2 | 210 | 92 |
Допантный уровень – это среднее количество однозарядных допантов (противоионов), приходящееся на один мономер. На рис. 19 приведена диаграмма Рейгона, показывающая область по величинам удельной энергии и удельной мощности, занимаемую ЭХСК с ЭПП по сравнению с другими перезаряжаемыми электрохимическими устройствами [115]. Как видим, эта область для ЭХСК с ЭПП занимает промежуточное положение между ДСК и литий-ионными аккумуляторами. Она расположена выше по величинам удельной энергии по сравнению с ДСК и ниже по сравнению с ЛИА; однако ЭХСК с ЭПП имеют более высокие величины удельной мощности по сравнению с ЛИА. ЭПП являются привлекательными для применения в ЭХСК, так как они обладают высокой плотностью заряда и низкой стоимостью по сравнению с относительно дорогими оксидами металлов. Полианилин (ПАНи) может показать плотность заряда 140 мA ч г–1, которая совсем не намного ниже, чем полученная для дорогих оксидов металлов, таких, как LiCoO2, но намного выше, чем для углеродных ДСК, для которых часто получают менее 15 мA ч г–1 (возможно ~40 мA ч г–1 для индивидуального электрода). Использование ряда ЭПП в качестве электродов ПсК основано на высокой степени обратимости редокс-реакций их электрохимического допирования–дедопирования. Этот процесс может быть представлен следующими реакциями [115]:
(2.7)
${{\left( {\text{P}} \right)}_{m}} - x{\text{e}} + x{{{\text{A}}}^{ - }} \leftrightarrow \left( {\text{P}} \right)_{m}^{{x + }}{{({{{\text{A}}}^{ - }})}_{x}},$(2.8)
${{\left( {\text{P}} \right)}_{m}} + y{\text{e}} + y{{{\text{M}}}^{ + }} \leftrightarrow \left( {\text{P}} \right)_{m}^{{y - }}{{({{{\text{M}}}^{ + }})}_{y}},$Рис. 19.
Диаграмма Рейгона для различных типов энергетических устройств, где CP – это электронопроводящие полимеры.

Конденсатор типа II имеет асимметричную конфигурацию с двумя различными p-допируемыми активными материалами (например, полипиррол и политиофен и их производные) на каждом из электродов. Третий и более перспективный тип конденсатора основан на одном и том же ЭПП, который может быть как n-, так и p-допируемым электрохимически. Заряженный конденсатор типа III состоит из одного электрода (отрицательного) в полностью n-допированном состоянии и другого электрода (положительного) в полностью p-допированном состоянии. После разряда оба ЭПП находятся в дедопированном состоянии [1]. Конденсатор этого типа (III) имеет следующие преимущества по сравнению с конденсаторами I и II типов: 1) высокое напряжение – около 3 В в неводных растворах; 2) в заряженном состоянии оба ЭПП, находясь в допированном состоянии, имеют максимальную электронную проводимость; 3) вследствие существенного разделения между собой областей потенциалов n- и p-допирования весь заряд реализуется при высоких значениях напряжения (в случае политиофенов – в интервале от 3 до 2 В). Поэтому конденсаторы типа III имеют наиболее высокие величины удельной энергии, близкие к соответствующим величинам для некоторых типов аккумуляторов.
Высокой обратимостью обладают процессы n- и p-допирования политиофена и некоторых его производных. Поэтому эти ЭПП являются очень перспективными для применения в ПсК. Было также достигнуто улучшенное n-допирование при более положительных потенциалах для полимеров, полученных из соединенных димеров тиофена. Электрохимические свойства n- и p-допированых ЭПП на основе различных производных политиофена, применяемых в ПсК III типа, иллюстрирует рис. 20 [2]. Как видно, все три ЦВА-кривые имеют по две замкнутые петли, пики которых отстоят друг от друга на интервал потенциалов 2.5–3 В. Одна из этих петель характеризует реакцию (2.7) окислительного p-допирования типа, а другая – реакцию (2.8) восстановительного n-допирования. Наибольшую емкость имеет конденсатор с электродами на основе поли-3-(4-фторфенил)-тиофена.
Рис. 20.
ЦВА-кривые для пленок (1) политиофена, (2) поли-3-фенилтиофена, (3) поли-3-(4-фторфенил)тиофена, осажденных на углеродную бумагу; электролит Et4NBF4 в ацетонитриле; скорость развертки потенциала 0.025 В с–1.

В табл. 5 приведены данные для величин средней удельной анодной и катодной емкости (на единицу массы активного ЭПП) для различных производных фтор-замещенных полифенилтиофена, а также соответствующие величины средних КПД анодной и катодной емкости для первых 100 циклов [2]. Из этой таблицы следует, что поли-3,5-дифторфенил-тиофен обладает самыми высокими величинами удельной анодной и катодной емкости. Величины среднего КПД по анодной и катодной емкости для первых 100 циклов практически равны 100%. Значения максимального напряжения для всех этих ЭПП близки к 3 В.
Таблица 5.
Величины удельной анодной и катодной емкости (на единицу массы активного ЭПП) и КПД по емкости различных производных фторзамещенных полифенилтиофена
| ЭПП | Удельная анодная емкость, мА ч/г | Удельная катодная емкость, мА ч/г | Средний КПД анодной емкости, % | Средний КПД катодной емкости, % |
|---|---|---|---|---|
| Поли-3,4,5-трифторфенил-тиофен | 32.1 | 28.4 | 99.53 | 99.90 |
| Поли-3,5-дифторфенил-тиофен | 35.2 | 29.0 | 98.37 | 99.92 |
| Поли-3,4-дифторфенил-тиофен | 21.3 | 28.5 | 99.85 | 99.88 |
| Поли-2,4-дифторфенил-тиофен | 23.9 | 23.5 | 99.76 | 99.91 |
| Поли-2-фторфенил-тиофен | 22.6 | 26.8 | 99.80 | 99.94 |
| Поли-3-фторфенил-тиофен | 26.8 | 26.7 | 99.88 | 99.87 |
| Поли-4-фторфенил-тиофен | 14.8 | 30.6 | 99.88 | 99.87 |
Характеристики ЭПП могут быть существенно повышены путем формирования композитов между ЭПП и другими материалами, например углеродными, неорганическими оксидами и гидроксидами, а также другими соединениями металлов. Из таких электродов можно сделать устройства симметричного типа (тип I или тип III) из тех же самых положительного и отрицательного электродов. Композитные материалы имеют повышенную электропроводность (особенно при более отрицательных потенциалах) и лучшие циклируемость, механические свойства, удельную емкость и технологичность.
В большинстве работ по электрохимии ЭПП пленки проводящих полимеров рассматриваются как компактные, т.е. беспористые, однако в [125, 126] МЭКП было установлено, что в результате пропитки электролитом вследствие сольватации противоионов происходит раздвижение полимерных цепей ЭПП и увеличение как пористости, так и удельной поверхности. Набухшие в электролите образцы ЭПП имеют высокодисперсную пористую структуру с величинами пористости в несколько десятков объемных процентов, очень высокие величины удельной поверхности приблизительно от 80 до 600 м2/см3 и со средним радиусами беспористых фибрилл R0 от 2 до 10 нм. Эти данные о пористой структуре послужили основой для впервые разработанной макрокинетической модели работы электродов ЭПП [125, 126]. Отсюда был сделан вывод для практики: желательно разработать ЭПП с фибриллами меньшего радиуса.
В [119] был разработан гибкий ПсК композит графен–полианилин (ПАНи) для ПсК с высокими характеристиками. Гибкая бумага графен–ПАНи демонстрирует высокую удельную емкость (763 Ф г–1). Однако, из рис. 21 следует, что циклируемость таких электродов оставляет желать лучшего.
2.3. Редокс-конденсаторы на основе органических мономеров
Основным недостатком электродов на основе ЭПП является ограниченная воспроизводимость химического состава поверхностных групп и поэтому недостаточная циклируемость. Поэтому рассматривается вопрос о замене ЭПП в ПсК на редокс-пару на основе органических мономеров, ковалентно связанных с углеродной основой высокодисперсного углеродного электрода [2, 127, 128]. В качестве типичного примера редокс-конденсатора был исследован следующий асимметричный ПсК-конденсатор. В нем в качестве положительного электрода использовался 1,2-дигидроксибензол (DHB), полученный путем модификации угольного электрода. В качестве отрицательного электрода использовался модифицированный антрахиноном (AQ) углеродный электрод. В качестве основы для получения AQ-электрода использовалась модифицированная углеродная ткань (C-AQ) Spectracarb 2225 carbon fabric (Engineered Fibres Technologies). Эта ткань погружалась в раствор антрахинон-1-диазоний 0.5 М ZnCl2 в ацетоне. Затем была добавлена вода и 50 вес. % гипофосфорная кислота и далее эта ткань была промыта деионизованной водой и высушена при 110°C в течение 20 мин. DHB-модифицированный углеродный тканевый электрод (C-DHB) изготавливался путем модификации углеродной ткани Spectracarb 2225. Эта ткань была погружена в 0.25 M HCl и затем были добавлены 4-аминокатехол и вода (8 мл). Затем следовало охлаждение в ванне со льдом и медленное добавление 3 M NaNO2. После этого модифицированная ткань была промыта деионизованной водой и высушена на воздухе. Собранная ячейка была погружена в 1 M H2SO4 для того, чтобы пропитать электроды электролитом. Модифицированный DHB углеродный тканевый электрод показал среднюю удельную емкость 201 Ф г–1 для интервала потенциалов от 0.2 до 0.8 В, в то время как немодифицированный АУТ-электрод показал 141 Ф г–1 для той же области потенциалов. Увеличение удельной емкости на 43% обусловлено обратимыми псевдоемкостными редокс-реакциями при потенциалах 0.41 и 0.65 В. Наличие двух пиков на ЦВА-кривых для DHB есть результат использования 4-аминокатехола в качестве предшественника, который имеет два различных способа связывания с углеродной тканью, либо через связь C–C (структура 1), либо через C–N (структура 2) связь (структура 2) (рис. 22).
Отрицательный С-AQ-электрод также показал существенное повышение емкости до 367 Ф/г при потенциале около –0.05 В по сравнению с немодифицированным АУТ-электродом. В табл. 6 приведены значения удельных энергии и мощности, полученные при постоянных токах для двух ЭХСК: немодифицированном конденсаторе типа С–С и модифицированном ЭХСК типа C‑AQ/C-DHB. Как видим, ПсК типа C-AQ/C-DHB обеспечивает приблизительно вдвое большую величину удельной энергии по сравнению с немодифицированным углеродным конденсатором.
Таблица 6.
Значения удельных энергии и мощности, полученные при разных постоянных токах для двух ЭХСК: немодифицированном конденсаторе типа С‒С и модифицированном ЭХСК типа C-AQ/C-DHB
| Ток, А | С/С | C-AQ/C-DHB | ||
|---|---|---|---|---|
| Es, Вт ч/кг | Ps, кВт/кг | Es, Вт ч/кг | Ps, кВт/кг | |
| 0.01 | 5.2 | 0.16 | 10.0 | 0.18 |
| 0.1 | 4.2 | 1.5 | 8.3 | 1.7 |
| 0.2 | 3.5 | 2.9 | 7.0 | 3.0 |
| 0.5 | 2.1 | 6.2 | 3.9 | 5.4 |
| 1.0 | 0.80 | 8.8 | 1.1 | 6.3 |
АУ были также модифицированы обработкой 2-нитро-1-нафтолом с целью изготовления композиционных суперконденсаторных электродов, в которых используется емкость ДЭС и псевдоемкость следующих окислительно-восстановительных реакций органических соединений: о-аминонафтол ↔ о-нафтохинонимин [22]
На таких электродах был получен удельный заряд 35 мА ч г–1. Если такой электрод может быть скомбинирован с другим электродом батарейного типа (например, с таким переносчиком протонов, как Mo2N или с WO3), чей редокс-потенциал лежит достаточно далеко в стороне и чья кинетика является достаточно быстрой, то такая система может быть использована в ГСК.
2.4. Литий-катионообменные конденсаторы (ЛКОК)
В последние годы были разработаны оригинальные ПсК на основе обмена катионами лития между анодом и катодом [128]. Они приближаются по механизму работы к литий-ионным аккумуляторам (ЛИА). Однако имеются и существенные различия между ними. ЛИА функционируют на основе фарадеевских реакций в объеме активного материала. Данный накопительный механизм позволяет получить очень высокую удельную энергии (180 Вт-ч на кг веса ЛИА с графитовыми анодами) по сравнению с ЭХСК. Однако, хранение лития в объеме материала предполагает, что литий должен перейти из внутренней части активной частицы катода в основную часть активной частицы анода при заряде; обратное движение лития происходит при разряде. Это означает протекание процессов интеркаляции–деинтеркаляции в обоих электродах. Из-за очень низкой скорости диффузии в твердой фазе данные процессы кинетически ограничены. В результате ЛИА обладают очень низкой удельной мощностью (100–1000 Вт/кг), поэтому для перезарядки требуется много времени. В разработанных в последнее время ПсК с обменом катионами лития между анодом и катодом оба они изготовлены на основе графена с высокой удельной поверхностью и с высокой пористостью. При этом большая доля поверхности графена находится в контакте с жидким электролитом, обеспечивая тем самым быструю и прямую поверхностную адсорбцию ионов лития и/или поверхностное взаимодействие функциональных групп лития, и тем самым устраняется необходимость интеркалирования. Большая площадь поверхности наноструктурированного анода делает возможным быстрое осаждение большого количества ионов лития, восстанавливая разность электрохимических потенциалов между анодом, содержащим литий, и катодом. Данные графеновые материалы имеют определенные поверхностные функциональные группы (>C=O и >СООLi). В результате заряда и разряда происходят следующие обратимые редокс-реакции [2, 128]:
Следовательно, данные ПсК можно отнести к редокс-конденсаторам. Эти литиевые ионообменные ячейки способны поддерживать удельную энергию, равную 160 Вт-ч на кг собственной массы, что в 30 раз превышает показатели обычных ДСК. Плотность мощности, равная 100 кВт/кг, в 10 раз превышает удельную мощность обычных ДСК (10 кВт/кг) и в 100 раз превышает удельную мощность ЛИА. Если для обычных ЛИА с графитовым анодом и LiFePO4-катодом требуется несколько часов для завершения необходимых процессов интеркалирования в одном электроде и деинтеркалирования в другом электроде, то в литий-катионно-обменных конденсаторах время миграции ионов составляет порядка минут.
Однако привлекательность изложенной выше концепции омрачена отсутствием в устройстве источника катиона лития, что требует определенного этапа предварительного заряда: литирования в вспомогательной ячейке и перемещения исследуемого углеродного электрода в суперконденсаторную ячейку в сухом боксе. Стратегии, разработанные до сих пор, в попытке исправить эту проблему имеют недостатки. В [129] был разработан интересный подход, основанный на использовании литированного органического материала, а именно дилитиевой соли 3,4-дигидроксибензонитрила. Это соединение может необратимо поставлять катионы лития на графитовый электрод во время начальной стадии заряда без каких-либо отрицательных эффектов по отношению к дальнейшей работе ЛКОК. Этот метод обладает далеко идущим потенциалом в отношении разработки широкого спектра экологичных гибридных устройств на основе других химических компонентов, содержащих полностью перерабатываемые компоненты. В этой работе были получены следующие характеристики ЛКОК: удельная энергия 40–60 Вт ч/кг, удельная мощность 2 кВт/кг циклируемость до 15 000 циклов. Как видим, на данном этапе характеристики, полученные в этой работе, существенно ниже полученных в [129]. В [130] были предложены несколько вариантов предварительного литирования отрицательного электрода: электрохимический метод, метод короткого замыкания, необратимое добавление лития из литированных оксидов переходных металлов из положительного электрода и добавление соли лития в электролит. В результате были получены следующие лучшие варианты характеристик: 1) 162 Вт ч/кг и 4.5 кВт/кг; 115 Вт ч/кг и 10 кВт/кг. Следует отметить, что несмотря на то, что работы [129] и [130] были выполнены существенно позже (2018 и 2019 гг. работы [128] 2011 г.), в них не удалось улучшить результаты работы [128].
3. ГИБРИДНЫЕ СУПЕРКОНДЕНСАТОРЫ (ГСК)
В ГСК используются разные электроды [129‒156 ]. В симметричных ГСК используются электроды одинакового химического состава, но с разной толщиной или с разной концентрацией. В асимметричных ГСК применяются электроды различных типов. Например, один ВДУЭ, а другой электрод аккумуляторный, или один электрод углеродный, а другой псевдоконденсаторный, например, на основе ЭПП. Обычно углеродный электрод является отрицательным, поскольку при положительных потенциалах он может окисляться. Основным преимуществом ГСК по сравнению с ДСК является увеличение удельной энергии при сохранении удельной мощности, в частности, за счет увеличения окна потенциалов. Основным же недостатком ГСК по сравнению с ДСК является уменьшение циклируемости вследствие того, что ее лимитирует неполяризумый электрод. Вообще, по своим характеристикам асимметричные ГСК занимают промежуточное положение между ДСК и аккумуляторами.
3.1. ГСК типов MeOx/C
Одним из примеров такого ГСК является система +(NiOOH ↔ NiO2)/KOH/C–, в которой используется положительный электрод из щелочного аккумулятора [2, 131]. Этот ГСК был разработан российскими фирмами “Элит” и “Эсма”. Использование АУ в качестве основы для отрицательного электрода в гибридных системах позволило вдвое расширить об ласть изменения его потенциала по сравнению с ДСК, т.е. с симметричной системой типа АУ/АУ, и в 4–5 раз повысить удельную энергию. В области высоких разрядных токов емкость гибридного конденсатора С/NiOx контролируется емкостью NiOx-электрода, которая зависит от скорости электродного процесса на этом электроде. Рабочая область потенциалов конденсатора составляет 0.8–1.7 В. Максимальная удельная энергия ГСК фирмы “Эсма” составила 11 Вт ч/кг. Ресурс работы ГСК этого типа определяется положительным электродом, где происходят процессы деградации. Для такого ГСК была получено 10 000 зарядно-разрядных циклов.
В ЗАО “Инкар” и в ИФХЭ РАН им. А.Н. Фрумкина (Россия) был разработан новый тип ГСК, содержащий отрицательный электрод на основе АУ, и положительный малополяризуемый электрод на основе известной аккумуляторной системы PbSO4/H2SO4/PbO2 [2, 4, 132, 133]. Суммарная реакция в конденсаторе:
(3.1)
$\begin{gathered} {\text{Pb}}{{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} + {{{{{({{{\text{H}}}^{ + }})}}_{{{\text{ad}}}}}} \mathord{\left/ {\vphantom {{{{{({{{\text{H}}}^{ + }})}}_{{{\text{ad}}}}}} {\text{e}}}} \right. \kern-0em} {\text{e}}} \leftrightarrow \\ \leftrightarrow {\text{PbS}}{{{\text{O}}}_{4}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{\left( {{\text{HSO}}_{4}^{ - }} \right)} \mathord{\left/ {\vphantom {{\left( {{\text{HSO}}_{4}^{ - }} \right)} {\text{e}}}} \right. \kern-0em} {\text{e}}}. \\ \end{gathered} $В качестве АУЭ использовалась АУТ “Вискумак” (г. Электросталь) с S ~ 1000 м2/г. Максимальное напряжение начала разряда ГСК Umax ~ 2.1 В, а минимальное напряжение разряда 0.5 В. Минимальный потенциал углеродного электрода в начале разряда равен –0.2 В, а его максимальный потенциал в конце разряда равен 1.0 В. Удельная емкость этой ткани в области потенциалов от 0.1 до 0.9 В в исходном состоянии равна 140–160 Ф/г и она в основном определяется емкостью ДЭС. Однако, как следует из раздела 1.9.1., при глубоком катодном заряжении удельная емкость в пределе достигает 1110 Ф/г (это соответствует 1560 Кл/г) вследствие фарадеевсой реакции интеркаляции водорода в углерод. Вследствие этого применяемый режим работы данного ГСК обеспечивает глубокое катодное заряжение АУТ-электрода, что дает возможность получить его очень высокую псевдоемкость, а значит, и высокую удельную энергию всего ГСК. Указанная очень высокая для водных электролитов величина Umax определяется высокой величиной зарядного потенциала электрода PbO2/PbSO4 $Е_{{{\text{max}}}}^{ + }$ ~ 1.9 В, обусловленного высоким перенапряжением выделения кислорода на свинце и на соединениях свинца, а также низким отрицательным потенциалом катодного заряжения $Е_{{{\text{min}}}}^{ - }$ ~ –0.2 В, обусловленным большим перенапряжением выделением водорода на угле. Была достигнута удельная энергия ГСК до 20–25 Вт ч/кг, что намного больше удельной энергии симметричных углеродных ДСК. Другим существенным преимуществом данного ГСК по сравнению с ДСК является то, что в ГСК не используется положительный углеродный электрод, который, как известно, постепенно корродирует уже при E > 0.9 В, что существенно ограничивает окно напряжений и удельную энергию ГСК. Важным положительным свойством этого ГСК является то, что он не боится перезаряда. При высоких положительных потенциалах кислород через крупные поры сепаратора переносится с PbO2-электрода на АУЭ-электрод, и там происходит его электровосстановление вследствие того, что последний является катализатором восстановления O2. В результате даже при значительном перезаряде не происходит заметного увеличения внутреннего давления. Циклический ресурс данного ГСК более 10 000 циклов. Данные ГСК применяются в качестве тяговых источников тока в электробусах, в инвалидных колясках и тележках, а также в фонарях. Кроме того, их планируется применять в портативных устройствах (радиотелефонах, видеокамерах, плеерах) и т.д. Одним из преимуществ ГСК перед многими аккумуляторами является возможность быстрого заряда – 20–30 мин вместо нескольких часов для свинцово-кислотного аккумулятора.
В [134] сообщается о разработке (+)PbO2–С (АУ)(–)ГсК, в котором использовался загущенный электролит на основе абсорбирующего стекломата, силикагеля и 6 М H2SO4. В качестве подложки использовалась свинцовая пластинка. Зарядное напряжение 2 В. Удельная емкость вариантов анода из АУ: 237, 283 и 328 Ф/г. Удельная емкость вариантов катода: 212, 268, 270 Ф/г. Значения удельной емкости для 2 В Pb–C ГСК составляют, 102, 152 и 166 Ф/г. О величинах удельной энергии и циклических испытаниях в [134] ничего не сообщается. В этой работе была использована идея и конструкция ГСК, опубликованные ранее в [132, 133], без ссылки на эти публикации. Причем, получены существенно более низке характеристики, чем в [134].
Перспективными являются недавно разработанные ГСК типа: (+)МnО2–С/С(–). В положительном электроде в качестве электропроводных добавок использовались АУ или сажа, а в отрицательном электроде они же использовались в качестве активного поляризуемого материала. Максимальное напряжение таких ГСК в водном электролите 0.5 M Na2SO4 составило 2 В. При этом диапазон рабочих потенциалов (относительно каломельного электрода) для отрицательного электрода: от –1.1 до 0 В, а для положительного электрода от 0 до 0.9 В. Были достигнуты следующие максимальные величины: для удельной энергии 18.2 Вт ч/кг и для удельной мощности 10.1 кВт/кг [135]. Интересным является ГСК, в котором в качестве активного материала анода и материала носителя для катода использовался графен, а в качестве катодного материала литий железофосфат LiFePO4, который используется в качестве катодного материала в литий-ионных аккумуляторах. В таком ГСК использовался неводный электролит 1 M LiPF6/EC + DM. Такие ГСК обладают существенно более высокими величинами удельной мощности, но более низкими величинами удельной энергии по сравнению с ЛИА [135].
В [137] были изготовлены и исследованы ГСК на основе механохимически активированных образцов LiCoPO4 с различной удельной площадью поверхности и пористостью в качестве катодов и AУ Kuraray K-50 в качестве анода. В качестве электролита использовали 1 М раствор LiPF6 в смеси этиленкарбонат–диметилкарбонат–этилметилкарбонат (1 : 1 : 1 по объему). В результате была достигнута удельная мощность 1500 Вт кг–1. На рис. 23 приведены зарядно-разрядные кривые для ГСК LiCoPO4/С при различных токах и для длительного циклирования.
Рис. 23.
Зарядно-разрядные кривые для ГСК LiCoPO4/С при различных токах (а) и для длительного циклирования (б).

В [138] исследовали неводный ГСК типа Li/Li4Ti5O12, который продемонстрировал удельную энергию 20 Вт ч кг–1. Высокая эффективность была достигнута также для ГСК на основе LiNi0.5Mn1.5O4/AУ [139–142]. В [140] получили удельную энергию 56 Вт ч кг–1 при плотности тока 3 мА см–2. Эта система показала хорошее сохранение емкости даже после 1000 циклов. В [140] был разработан ГСК, изготовленный с использованием золь–гель-технологии. В качестве катода использовался композит, в котором в качестве АУ был взят древесный уголь. В качестве анода использовался Li4Ti5O12, а сепаратором служил гибкий гелевый полимерный электролит (GPE). Пленка GPE содержала 1.0 M литий трифторметан сульфат в этиленкарбонате–пропиленкарбонате (0.5/0.5). Электролит имел высокую электропроводность 3.8 × 10–3 См см–1 при 25°C и окно электрохимической стабильности ~3 В. Данный ГСК показал высокую удельную энергию (>27.8 Вт ч кг–1) по сравнению с симметричным ДСК.
3.2. ГСК типов ЭПП/С
Были разработаны ГСК типа: ПАНи/АУ, в которых в качестве отрицательного электрода использовался мезопористый уголь CMK-3, а в качестве положительного электрода был композит ПАНи /CMK-3. Электролитом служил водный раствор 1 М H2SO4. В результате была получена разрядная емкость 87.4 Ф/г при плотности тока 5 мA/cм2 и напряжении ячейки 1.4 В; удельная энергия до 23.8 Вт ч/кг, а удельная мощность до 206 Вт/кг [2].
На рис. 24 приведены диаграммы Рейгона для ГСК ПАНи/ CMK-3 и для сравнения для ДСК CMK-3/ CMK-3 [146]. Как видим, удельная энергия ГСК вдвое выше по сравнению с соответствующим симметричным ДСК. После 1000 циклов оставалось 90% от первоначальной емкости ГСК. Уменьшение емкости только на 10% сулит данному ГСК значительное практическое применение. В качестве основы для положительных электродов ГСК кроме ПАНи применяют также поли-пиррол, производные политиофена и другие ЭПП [130]. В табл. 7 приведены характеристики некоторых асимметричных и симметричных ГСК [130].
Таблица 7.
Характеристики некоторых асимметричных и симметричных ГСК
| Типы электродов | ГСК | Рабочее напряжение, В | Удельная энергия, Вт ч/кг | Удельная мощность, кВт/кг |
|---|---|---|---|---|
| Асимметричные ГСК = ДСК/ПсК | АУ/LiMn2O | 0.5–1.8 | 5–10 | 0.1–1 |
| Ni(OH)2|/АУ | 0.5–1.7 | 2–10 | 0.08–2 | |
| АУ/PbO2 | 0–2 | 10–30 | 0.05–1 | |
| АУ/Li4Ti5O12 | 2–3 | 5–20 | 0.1–1 | |
| Графит/АУ | 2–3.5 | 5–15 | 0.1–3 | |
| Симметричные ГСК | ПАНи/ПАНи | 0–0.5 | 3.13 | 10–10.9 |
| PPy/PPy | 0–0.6 | 2.38 | 19–19.7 | |
| PEDOT/PEDOT | 0–0.6 | 1.13 | 23–23.8 | |
| Carbon Maxorb/Carbon Maxorb | 0–0.7 | 3.74 | 22–22.4 |
Как видим, представленные в табл. 7 асимметричные ГСК имеют более высокие величины удельной энергии, но меньшие величины удельной мощности, чем представленные в этой таблице симметричные ГСК.
4. ХАРАКТЕРИСТИКИ СУПЕРКОНДЕНСАТОРОВ, ВЫПУСКАЕМЫХ ПРОМЫШЛЕННОСТЬЮ И В ПЕРЕДОВЫХ ЛАБОРАТОРИЯХ
В табл. 8 приведены характеристики наиболее разработанных и выпускаемых промышленностью суперконденсаторов [136, 149–156].
Таблица 8.
Характеристики ЭХСК, выпускаемых различными компаниями
| Компания | Напряжение, В | Емкость C, Ф | RC, c | Сопротивление R, мОм | Удельная энергия, Вт ч/кг | Удельная мощность, Вт/кг |
|---|---|---|---|---|---|---|
| Maxwell | 2.7 | 2885 | 1.08 | 0.375 | 4.2 | 8836 |
| Maxwell | 2.7 | 605 | 0.55 | 0.90 | 2.35 | 9597 |
| ApowerCap | 2.7 | 55 | 0.22 | 4 | 5.5 | 50 625 |
| ApowerCap | 2.7 | 450 | 0.58 | 1.4 | 5.89 | 24 595 |
| Ness | 2.7 | 1800 | 1.00 | 0.55 | 3.6 | 8674 |
| Ness | 2.7 | 3640 | 1.10 | 0.30 | 4.2 | 8010 |
| Carbon Tech | 2.85 | 1600 | 1.6 | 1.0 | 5.8 | 9106 |
| Asahi Glass | 2.7 | 1375 | 3.4 | 2.5 | 4.9 | 3471 |
| Panasonic | 2.5 | 1200 | 1.2 | 1.0 | 2.3 | 4596 |
| EPCOS | 2.7 | 3400 | 1.5 | 0.45 | 4.3 | 6750 |
| LS Cable | 2.8 | 3200 | 0.80 | 0.25 | 3.7 | 12 400 |
| BatScap | 2.7 | 2680 | 0.54 | 0.20 | 4.2 | 18 225 |
| Power Sys. | 2.7 | 1350 | 2.0 | 1.5 | 4.9 | 5785 |
| Power Sys. | 3.3 | 1800 | 5.4 | 3.0 | 8.0 | 4320 |
| Fuji Heavy | 3.8 | 1000 | 2.6 | 1.5 | 9.2 | 10 375 |
| JSR Micro | 3.8 | 2000 | 4 | 4 | 12.1 | 9223 |
Из табл. 8 видно, что набольшей удельной мощности добилась компания ApowerCap, а наиболее высокой удельной энергии – компания JSR Micro.
Из табл. 9 видно, что очень высокие результаты были получены для электродов на основе азотированных углеродных наноматериалов, а также для асимметричных ЭХСК с электродами на основе CoS.
Таблица 9.
Характеристики ЭХСК, выпускаемых некоторыми передовыми лабораториями
| Электродные материалы | Площадь удельной поверхности, м2/г | Электролит | Удельная емкость, Ф/г | Удельная энергия, Вт ч/кг | Удельная мощность, Вт/кг | Литера-турная ссылка |
|---|---|---|---|---|---|---|
| Азотированные углеродные нанотрубки | 988 | BMIM BF4/AN | 98.0 | 59 | 1750 | [149] |
| Азотрированный графеновый гидрогель | – | КОН | 190 | 15.8 | 250 000 | [149] |
| Пористые азотированные углеродные нанопластинки | 2257 | BMIM BF4/AN | 168 | 13.3 | 217 000 | [149] |
| Азотированные углеродные нанопластинки | 1946 | BMIM BF4/AN | 125 | 35.4 | 11 250 | [149] |
| Азотрированные углеродные нанотрубки | 3253 | KOH | 366 | 6.3 | 4500 | [149] |
| Азотрированные углеродные частицы с иерархической структурой | 1850 | KOH | 260 | 9.1 | 10 000 | [149] |
| Пористые азотированные частицы углерода | 1518 | KOH | 244 | 12.3 | 7500 | [149] |
| CoS/активированный уголь | PVA/KOH | 48.2 | 5.3 | 1900 | [156] | |
| CoS/rGO | 6 M KOH | 550 | 30.2 | 1400 | [156] |
5. ПРИМЕНЕНИЕ ИОНООБМЕННЫХ МЕМБРАН В СУПЕРКОНДЕНСАТОРАХ
В самые последние годы были начаты разработки по применению ионообменных мембран (ИОМ) в электрохимических суперконденсаторах (ЭХСК) [157–160]. Среди причин этого называются удобный для практики твердотельный характер таких ЭХСК, а также снижение саморазряда, который является одним из недостатков этих перезаряжаемых электрохимических накопителей энергии. В [157] были исследованы твердотельные ГСК AC/MnO2 с электродами, нанесенными на углеродную нановолокнистую тканевую основу. Они показали стабильную производительность в водной среде для диапазона напряжений 0–1.6 В, низкий уровень саморазряда и очень интересные емкостные характеристики 138 и 134 Ф г–1 с пористой бумагой и мембраной Нафион соответственно. Эти значения находятся в том же диапазоне других аналогичных исследований, но полученные с использованием более простых и дешевых материалов (углеродные нановолокна, АУ, сажа и сухой порошок MnO2) и с очень простыми методологиями. Твердотельный гибрид ГСК продемонстрировал также очень низкие показатели саморазряда даже после длительных испытаний на долговечность в течение 270 ч. Другим важным выводом этого исследования является демонстрация стабильного рабочего напряжения при 1.6 В, т.е. выше потенциала разложения воды (1.23 В), без заметных доказательств выделения O2 и процессов деградации положительных электродов. В [158] было исследовано электрохимическое поведение мембран Нафион в твердотельных ЭХСК с композитами оксид графена–мембрана Нафион-УНТ–полипиррол. Мембраны Нафион 117 были использованы в качестве сепараторов для электролита при приготовлении твердотельных симметричных ЭХСК в 1 М хлориде лития. Была получена удельная емкость 90.4 мФ/см2 (258.3 Ф/г) при скорости сканирования 10 мВ/с. Были получены максимальные значения удельных энергии и мощности 10 Вт ч/кг и 6031 Вт/кг. В [159] был приготовлен неводный механически стабильный протонпроводящий гель-полимерный электролит. Он основан на 2‑гидроксиметил-метакрилатном мономере, смешанном с двумя различными растворителями (пропиленкарбонат и N,N-диметилформамид). Композитный углеродный электрод был приготовлен смешиванием АУ YP80-F с АУ Kuraray Chemical Co., LTD и с 5 вес. % связующего полиливилиден фторида – гексафторпропилена. Было показано, что емкостные характеристики изменяются в зависимости от состава гелевого электролита. Была достигнута емкость 90 Ф г–1 при 20°C. Электрохимические испытания проводились в широком диапазоне температур (от −40 до 80°C). Ячейка давала емкость 54 Ф г–1 при –40°C, что составляет 60% от значения, полученного при комнатной температуре, и 90 Ф г–1 при 80°C в пределах окна напряжения 1 В. Хотя в большинстве работ по ЭХСК с ИОМ исследовались ЭХСК с протонообменными мембранами, однако в ряде работ были исследованы ЭХСК в среде OH–. В [160] были исследованы ЭХСК в щелочной среде с проводимостью анионов ОН– в полимерной матрице, а также выявлены несколько важных взаимосвязей между свойствами полимерного электролита и характеристиками твердотельного суперконденсатора. Были классифицированы полимерные электролиты с ионной проводимостью ОН– на два типа: анионообменные мембраны и щелочные полимерные электролиты. Суперконденсаторы, которые используют щелочные электролиты, обычно содержат пористый сепаратор, такой как полипропилен (PP), полиэтилен (PE) или полиамид, которые впитывают электролит, выступая в качестве электронного изолятора между электродами. Исследования выявили несколько важных свойств мембраны, которые повлияли на производительность ЭХСК, химическую стабильность и поглощение электролита. Ухудшение производительности было следствием испарения воды, и был предложен способ уменьшения этого эффекта. Чтобы реализовать экономически эффективный, легкий, тонкий и гибкий твердый ЭХСК с анионообменной мембраной, проводящие полимерные электролиты должны удовлетворять следующим требованиям: высокая ионная проводимость; широкое окно напряжения; способность формировать хорошие контакты электрод/электролит; хорошая механическая целостность, чтобы выдерживать внешние нагрузки; экологическая и химическая стабильность при длительном циклировании. Согласно [160], такие ЭХСК разрабатываются. По нашему мнению, наряду с таким важным преимуществом ЭХСК с ИОМ следует отметить, что вряд ли они могут достигнуть максимальных величин емкости по сравнению с ЭХСК с жидким электролитом, поскольку межфазная поверхность углерод/электролит у первых меньше, чем у вторых.
6. ПЕРСПЕКТИВЫ ЭЛЕКТРОХИМИЧЕСКИХ СУПЕРКОНДЕНСАТОРОВ
Имеются несколько перспективных направлений, в которых будут развиваться ЭХСК в ближайшем будущем и в среднесрочной перспективе [2, 161–168].
1. В настоящее время из многочисленных видов углеродных электродных материалов наиболее высокими кинетическими характеристиками обладают одностенные углеродные нанотрубки (ОСУНТ). На их основе были получены в лабораториях импульсные ЭХСК с очень высокой удельной мощностью, приближающейся к 100 кВт/кг при достаточно высокой удельной энергии 20–25 Вт ч/кг. Однако существенным недостатком ОСУНТ является их дороговизна. Поэтому можно предположить, что в среднесрочной перспективе будет разработана массовая достаточно дешевая технология получения ОСУНТ, которая приведет к промышленному выпуску ЭХСК на основе ОСУНТ.
2. Ожидается усовершенствование технологии получения графенов с целью оптимизации их пористой иерархической структуры таким образом, чтобы существенно увеличить межфазную поверхность углерод/электролит. Графены обладают быстрой кинетикой зарядно-разрядных процессов в отличие от большинства активированных углей и саж, и поэтому их следует в первую очередь использовать в ЭХСК мощностного (импульсного) типа. По своим кинетическим емкостным свойствам существующие графены приближаются к ОСУНТ, но значительно их дешевле.
3. Разработка усовершенствованных ЭХСК с электролитом в виде ионных жидкостей, основанных на решении задачи значительного увеличения окна потенциалов.
4. В ближайшей перспективе следует ожидать широкий промышленный выпуск гибридных суперконденсаторов типов C/PbO2, C/NiO2, C/MnO2, C/ЭПП и других с повышенной удельной энергией порядка 40–50 Вт ч/кг, т.е. c энергией, не уступающей удельной энергии традиционных аккумуляторов, но с намного большей циклируемостью.
5. Очень перспективным типом ЭХСК являются литий-катионообменные псевдо-конденсаторы (см. раздел 2.4) с электродами на основе графенов. В них осуществляется обмен катионами лития между электродами. Эти ПсК приближаются по механизму работы к литий-ионным аккумуляторам (ЛИА), однако в них не используются процессы интеркаляции- деинтеркаляции лития, которые лимитируют скорость процессов заряда/разряда и поэтому ограничивают удельную мощность ЛИА, а используются быстрые процессы поверхностной адсорбции/ десорбции ионов лития, содержащихся в функциональных группах, и тем самым устраняется необходимость интеркалирования, которое лимитируется медленной твердофазной диффузией лития. Эти ПсК способны поддерживать удельную энергию 160 Вт ч на 1 кг собственной массы активных материалов, что в десятки раз превышает показатели обычных ДСК. Удельная мощность, равная 100 кВт на 1 кг собственного веса, в 10 раз превышает удельную мощность обычных ДСК. Для широкого использования таких ПсК нужно решить проблему предварительного литирования анода (см. раздел 2.4).
6. Вследствие функционирования электродов ЭХСК в очень широком диапазоне времен заряда–разряда (от долей секунды до часов) предполагается резкое расширение областей применения различных ЭХСК для различных типов потребителей и устройств от высокочастотных электронных схем до электротранспорта и других применений ЭХСК энергетического типа. Из новых областей применения ЭХСК нужно особо выделить хранение и выдачу энергии электрических сетей для сглаживания пиковых нагрузок электрических сетей с разными временами заряда и разряда, рекуперацию энергии торможения двигателей внутреннего сгорания (ДВС) (тепловозы, автомобили, самолеты, суда), для резервирования энергии в железнодорожном транспорте, метро и других видах общественного электротранспорта, для создания больших буферных накопителей энергии в электроэнергетике, телекоммуникационных системах, системах бесперебойного питания особо ответственных объектов, в альтернативной электроэнергетике, для замены аккумуляторных батарей на подстанциях, обеспечение пикового спроса на электроэнергию.
7. Российские ученые из Сколковского института науки и технологий Сколтех (Сколково) в 2019 г. разработали новый способ замещения атомов углерода на атомы азота в кристаллической решетке суперконденсаторов, который позволяет шестикратно увеличить их емкость, а также увеличить стабильность в циклах заряда–разряда. Изобретенный способ плазменной обработки углеродных наностенок структурной решетки ЭХСК замещает до 3% атомов углерода на атомы азота. Удельная емкость наностенки после такой обработки достигает 600 Ф/г. Данное исследование открывает путь к созданию гибких тонкопленочных суперконденсаторов на основе углеродных наностенок [168].
8. Вследствие очень высокой наукоемкости ЭХСК можно прогнозировать существенный рост их характеристик в ближайшие годы.
7. ПРИМЕНЕНИЕ СУПЕРКОНДЕНСАТОРОВ ДЛЯ ОПРЕСНЕНИЯ ВОДЫ. ЕМКОСТНАЯ ДЕИОНИЗАЦИЯ ВОДЫ (ЕДВ)
Здесь мы кратко остановимся на ЕДВ, поскольку этот метод был создан на основе ДСК. В последние годы в развитых странах стала разрабатываться ЕДВ, которая является эффективным методом обессоливания солоноватой, морской и промышленной воды [161–175 ]. В установке ЕДВ поток опресняемой воды прокачивается между двумя пористыми углеродными электродами с высокой удельной поверхностью 300–2500 м2/г, например, АУЭ, между которыми задается разность потенциалов >1.2 В (рис. 25). Ионы электростатически адсорбируются и удерживаются на внутренней поверхности электрода противоположного знака. Таким образом, происходит заряжение ДЭС аналогично тому, как это имеет место в ДСК [1, 2, 4]. В конце концов поверхность электродов становится насыщенной ионами и должна быть регенерирована. Это осуществляется размыканием электрической цепи или переполюсовкой. При этом происходит десорбция ионов из электродов и из установки, и образуется более концентрированный поток раствора. Емкостная опреснительная установка (ЕОУ), состоящая, как минимум, из двух электрохимических ячеек, в целом работает непрерывно, при том что каждая из ячеек часть времени работает как деионизационная, а другая в этот же период времени – как концентрационная (регенеративная). В итоге получаются два продукта: деионизованная вода и концентрат, который может быть использован на практике. Общность между процессами в ЕДВ и ДСК подтверждается и тем фактом, что одни и те же угольные электроды могут использоваться в обеих этих системах [2, 161, 163]. Основным преимуществом ЕДВ является самый низкий расход энергии, составляющий примерно одну треть от главного конкурирующего метода – обратного осмоса, который в настоящее время в основном применяется в промышленности. В табл. 10 приведены величины удельного расхода энергии для основных методов опреснения воды.
Таблица 10.
Величины удельного расхода энергии для основных методов опреснения воды [175]
| Метод опреснения воды | Удельный расход энергии, кВт ч/м3 воды |
|---|---|
| Многоступенчатая дистилляция | 10–58 |
| Обратный осмос | 2–6 |
| Электродиализ | 0.4–8.7 |
| Емкостная деионизация воды (ЕДВ) | 0.1–2.03 |
В [167] было установлено, что измеренная для ЕДВ энергия удаления соли приближается к термодинамическому минимуму для опреснения таких концентрированных растворов, как морская вода. В стадии регенерации энергия возвращается в установку для ЕДВ и поэтому происходит частичная компенсация затрат на деионизацию. Поэтому результирующая энергия деионизации WЕДВ равна разности
где Wдеион – энергия, затраченная на стадии деионизации, а Wконц – энергия, высвободившаяся при концентрировании. Энергия WЕДВ должна учитываться при работе установки, так как она учитывает выигрыш за счет энергии на стадии концентрирования. Этот фактор объясняет минимальные затраты энергии в ЕДВ по сравнению с другими опреснительными методами. В стадии деионизации имеет место заряжение ДСК, а в стадии концентрирования происходит разряжение ДСК.Огромное значение метода ЕДВ в качестве определяющего класса технологий опреснения было показано в принципиальной статье большого количества признанных авторитетов в области опреснения воды [173].
7.1. Проблемы получения чистой воды методом ЕДВ. Поверхностная проводимость. Мозаичные мембраны
Анализ показал, что применение метода ЕДВ для получения чистой питьевой воды лимитируется очень высоким электрическим сопротивлением чистой воды в порах углеродных электродов и спейсера (сепаратора). С другой стороны, давно известно, что активированные угли имеют большое количество ионогенных поверхностных групп [19]. В [174] был впервые разработан метод измерения поверхностной проводимости (ПП) для пористых электродов. На рис. 26 показана зависимость электропроводности АУ-электрода CH900 от концентрации раствора KCl в области очень малых концентраций.
Рис. 26.
Зависимость электропроводности от концентрации KCl при равновесном потенциале раствора для АУ-электрода СН900-20.

Из рис. 26 следует, что даже в чистой воде электроды на основе АУ обладают достаточной ионной электропроводностью для получения чистой воды в ЕДВ. В [174] было показано, что величина ПП пропорциональна обменной емкости соответствующего АУ-электрода, т.е. концентрации ПГ. Таким образом, АУ обладают не только ионной проводимостью, но также и электронной проводимостью. Таким образом, АУ являются электроно-ионообменниками, что является их уникальной особенностью. В [166] были измерены величины катионообменной и анионообменной емкости для ряда АУ. Таким образом, АУ обладают как катионообменными, так и анионообменными свойствами. Благодаря этому свойству АУ являются наиболее предпочтительными электродными материалами для получения чистой воды методом ЕДВ.
После установления факта наличия ПП у АУ стало ясно, что реальным препятствием для получения чистой воды в установках ЕДВ является чрезвычайно высокое сопротивление такой воды в порах обычных пористых спейсеров. Однако, затем в [24, 175] была решена и эта проблема путем замены такого пористого спейсера (обычно стеклянного) на катионо- анионообменную мембрану мозаичной структуры, схематическое изображение которой приведено на рис. 27. Мозаичная мембрана (ММ) содержит перемешанные между собой катионитовые и анионитовые частицы в приблизительно одинаковом количестве. На рис. 28. приведены зависимости электропроводности от концентрации NaCl для двух типов ММ пленочного и волокнистого типов в области малых концентраций.
Рис. 27.
Схематическое изображение структуры мозаичной мембраны: 1 – полимерная матрица; 2 – микропоры, 3 – положительно заряженные фиксированные ионогенные группы, входящие в состав частиц анионита; 4 – анионы; 5 – отрицательно заряженные фиксированные ионогенные группы, входящие в состав частиц катионита; 6 – катионы.
Рис. 28.
Зависимость электропроводности от концентрации NaCl для мозаичных мембран (ММ) пленочного типа (пустые кружки) и волокнистого типа (черные кружки) [24].
Как видно из рис. 28, для обеих ММ при экстраполяции этих кривых на нулевую концентрацию удельная электропроводность (т.е., поверхностная проводимость) достаточно велика, и она обусловлена проводимостью противокатионов и противоанионов. На рис. 29 приведены циклические вольт-фарадные (ЦВФ) кривые для разных скоростей развертки напряжения для статической ячейки (без потока воды), в которой поры АУ-электродов марки Norit и находящейся между ними ММ волокнистого полосатого типа были пропитаны чистой водой [175]. Перестройка ЦВА-кривых в ЦВФ-кривые осуществляется делением тока на скорость развертки напряжения.
Рис. 29.
ЦВФ-кривые для ячейки с волокнистой полосатой мембраной ММ, пропитанной чистой водой, при разных скоростях развертки напряжения: 1 – 0.1; 2 – 0.5; 3 – 2; 4 – 5 мВ/с.

Эти ЦВФ-кривые имеют вид классических ЦВФ-кривых для заряжения ДЭС как для ДСК с концентрированными электролитами (см. раздел 1.1), несмотря на то, что кривые на рис. 29 измерены в чистой воде. Это объясняется высокой концентрацией катионообменных и анионообменных групп как в АС Norit, так и в ММ. Из рис. 29 видно, что максимальная удельная емкость (С) при минимальной скорости развертки напряжения w = 0.1 мВ/с С = 66 Ф/г, а при w = = 2 мВ/с С = 45 Ф/г. На рис. 30 приведены сравнительные зависимости удельной результирующей энергии деионизации (на 1 моль деионизованной соли) от напряжения, измеренные в установке ЕДВ с АУ-электродами типа СН900 и с ММ волокнистого прессованного типа и для ЕДВ с пористым стеклянным спейсером (сепаратором), обычно применяемым в работах по ЕДВ.
Рис. 30.
Зависимости удельной результирующей энергии деионизации от напряжения для ЕДВ с ММ волокнистого типа и для ЕДВ с пористым стеклянным спейсером. Исходная концентрация 0.005 М KCl, скорость потока раствора 5 мл/мин [24].

Из рис. 30 следует, что для обоих типов ячейки ЕДВ удельные энергозатраты уменьшаются с уменьшением напряжения, и при U ≤ 1.4 В энергозатраты для ЕДВ с ММ практически выходят на плато. Как видим, при всех напряжениях энергозатраты для ЕДВ с ММ меньше, чем для ЕДВ со стеклянным спейсером. Это объясняется тем, что при минимальных концентрациях раствора в ячейке с ММ перенос ионов осуществляется не столько свободными ионами, находящимися в порах, сколько подвижными противо-катионами и противо-анионами в ММ, а также противо-ионами ПГ в АУЭ. В противоположность этому, в стеклянном сепараторе в чистой воде практически отсутствуют подвижные ионы. В результате в [24, 175] был сделан вывод о том, что для получения чистой воды в установках ЕДВ необходимо заменить пористые спейсеры на мозаичные мембраны, а в качестве электродов необходимо использовать АУЭ, обладающие существенной поверхностной проводимостью.
Список литературы
Conway, B., Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications; Springer Science & Business Media: Berlin, Germany, 2013.
Bagotsky, V.S., Skundin, A.M., and Volfkovich, Yu.M., Electrochemical Power Sources. Batteries, Fuel Cells, Supercapacitors. Jhon Wiely & Sons Inc. Publisher. N.J., 2015.
Лидоренко, Н.С. Аномальная электрическая емкость и экспериментальные модели гиперпроводимости. Докл. АН СССР. 1974. Т. 216. С. 1261.
Вольфкович, Ю.М., Сердюк, Т.М. Электрохимические конденсаторы. Электрохимия. 2002. Т. 38. С. 1043. [Volfkovich, Yu.M. and Serdyuk, T.M., Electrochemical Capacitors, Russ. J. Electrochem., 2002, vol. 38, p. 935.]
Vorotyntsev, M., Modern Aspects of Electrochemistry, Plenum Press, N.Y., 1986, vol. 17, p. 131.
Pandolfo, A.G. and Hollenkamp, A.F., Carbon properties and their role in supercapacitors, J. Power Sources, 2006, vol.157, p. 11.
Вольфкович, Ю.М., Мазин, В.М., Уриссон, Н.А. Исследование работы двойнослойных конденсаторов на основе углеродных материалов. Электрохимия. 1998. Т. 34. С. 825. [Volfkovich, Y.M., Mazin, V.M., and Urisson, N.A., The influence of the porous structure, microkinetics and diffusion properties on the charge-discharge behaviour of conducting polymers, Russ. J. Electrochem., 1998, vol. 34, p. 740.]
Гуревич, И.Г., Вольфкович, Ю.М., Багоцкий, В.С. Жидкостные пористые электроды. Наука и техника. Минск, 1974. 244 с.
Volfkovich, Yu.M., Filippov, A.N., and Bagotsky, V.S., Structural properties of porous materials and powders used in different fields of science and technology. Springer Publisher, London. 2014.
Volfkovich, Yu.M., Sakars, A.V., and Volinsky A.A., Application of the standard porosimetry method for nanomaterials, Int. J. Nanotechnology, 2005, vol. 2, p. 292.
Dzyazko, Yu.S., Ponomaryova, L.N., Volfkovich, Yu.M., Trachevskii V.V., and Palchik A.V., Ion-exchange resin modified with aggregated nanoparticles of zirconium hydrophosphate. Morphology and functional properties, Microporous and Mesoporous Materials, 2014, vol. 198, p. 55.
Rouquerol, J., Baron, G., Denoyel, R., Giesche, H., Groen, J., Klobes, P., Levitz, P., Neimark, A.V., Rigby, S., Skudas, R., Sing, K., Thommes, M., and Unger, K., Pure Appl. Chem., 2012, vol. 84, p. 107.
Inagaki, M., Konno, H., and Tanaike, O., Carbon materials for electrochemical capacitors, J. Power Sources, 2010, vol. 195, p. 7880.
Miller, J.R., Engineering electrochemical capacitor applications, J. Power Sources, 2016, vol. 326, p. 726.
Park, S.J. and Kim, B.J., Carbon materials for electrochemical capacitors, Carbon Science, 2005, vol. 6, p. 257.
Largeot, C., Portet, C., Chmiola, J., Taberna, P.L., Gogotsi, Y., and Simon, P., Relation etween the Ion Size and Pore Size for an Electric Double-Layer. Capacitor, J. Am. Chem. Soc., 2008, vol. 130, p. 2730.
Gryglewicz, G., Machnikowski, J., Lorenc-Grabowska, E., Lota, G., and Frackowiak, E., Effect of pore size distribution of coal-based activated carbons on double layer capacitance, Electrochim. Acta, 2005, vol. 50, p. 1197.
Wang, L., Fujita, M., and Inagaki M., Effect of pore size distribution of coal-based activated carbons on double layer capacitance, Electrochim. Acta, 2005, vol. 50, p. 1197.
Тарасевич, М.Р. Электрохимия углеродных материалов. 1984. Москва. Изд. “Наука”.
Тарковская, И.А. Окисленный уголь. 1981. Киев. Наукова думка. 198 с.
Ермакова, А.С., Попова, А.В., Чайка, М.Ю., Кравченко, Т.А. Окислительно-восстановительная функционализация углеродных электродов электрохимических конденсаторов. Электрохимия. 2017. Т. 53. С. 687. [Ermakova, A.S., Popova, A.V., Chayka, M.Yu., and Kravchenko, T.A., Redox Functionalization of Carbon Electrodes of Electrochemical Capacitors, Russ. J.Electrochem., 2017, vol. 53, p. 608.]
Соляникова, А.С. (Ермакова, А.С.), Чайка, М.Ю., Парфенов, В.А., Кирик, С.Д., Кравченко, Т.А. Активация мезоструктурированных электродных материалов электрохимических конденсаторов. Электрохимия. 2015. Т. 51. С. 863. [Solyanikova, A.S., Chayka, M.Yu., Parfenov, V.A., Kirik, S.D., and Kravchenko, T.A., Activation of Mesostructured Electrode Materials for Electrochemical Capacitors, Russ. J. Electrochem., 2015, vol. 51, p. 764.]
Вольфкович, Ю.М., Горончаровская, И.В., Евсеев, А.К., Сосенкин, В.Е. Гольдин, М.М. Влияние электрохимического модифицирования активированных углей полипирролом на их структурные характеристики, состав поверхностных соединений и адсорбционные свойства. Электрохимия. 2017. Т. 53. С. 1616. [Volfkovich, Yu.M., Goroncharovskaya, I.V., Evseev, A.K., Sosenkin, V.E., and Gol’din, M.M., The Effect of Electrochemical Modification of Activated Carbons by Polypyrrole on Their Structure Characteristics, Composition of Surface Compounds, and Adsorption Properties, Russ. J. Electrochem., 2017, vol. 53, p. 1363.]
Volfkovich, Yu.M., Rychagov, A.Yu., Mikhalin, A.A., Kardash, M.M., Kononenko, N.A., Ainetdinov, D.V., Shkirskaya, S.A., and Sosenkin, V.E., Capacitive deionization of water using mosaic membrane, Desalination, 2018, vol. 426, p. 1.
Oda, H.H., Yamashita, A.S., Minoura, M. Okamoto, and Morimoto, T., Modification of the oxygen-containing functional group on activated carbon fiber in electrodes of an electric double-layer capacitor, J. Power Sources, 2006, vol. 158, p. 1510.
Kodama, M, Yamashita, J., Soneda,Y., Hatori, H., and Kamegawa, H., Preparation and electrochemical characteristics of N-enriched carbon foam, Carbon., 2007, vol. 45, p. 1105.
Hulicova, D., Kodama, M., and Hatori, H., Electrochemical performance of nitrogen-enriched carbons in aqueous and non-aqueous supercapacitors, Chem. Mater., 2006, vol. 18, p. 2318.
Guo, B., Ma, R., Li, Z., Guo, S., Luo, J., Yang, M., Liu, Q., Thomas, T., and Wang, J., Hierarchical N-Doped Porous Carbons for Zn–Air Batteries and Supercapacitors, Nano-Micro Letters, 2020, vol. 12, p. 2.
Ghosh, S., Jeong, S.M., and Polaki, S.R., A review on metal nitrides/oxynitrides as an emerging supercapacitor electrode beyond oxide, Korean J. Chem. Eng., 2018, vol. 35, p. 1389.
Kodama, M., Yamashita, J., Soneda, Y., Hatori, H., Kamegawa, K., and Moriguchi, I., Structure and electrochemical capacitance of nitrogen-enriched mesoporous carbon, Chem. Lett., 2006, vol. 35, p. 680.
Li, W., Chen, D., Li, Z., Shi, Y., Wang, Y., Huang, J., Zhao, D., and Jiang, Z., Nitrogen enriched mesoporous carbon spheres obtained by a facile method and its application for electrochemical capacitor, Electrochim. Commun., 2007, vol. 9, p. 569.
Konno, H., Onishi, H., Yoshizawa, N., and Azumi, K., MgO-templated nitrogen-containing carbons derived from different organic compounds for capacitor electrodes, J. Power Sources, 2010, vol. 195, p. 667.
Frackowiak, E., Lota, G., Machnikowski, J., Vix-Gutrl, C., and Beguin, F., Optimisation of supercapacitors using carbons with controlled nanotexture and nitrogen content, Electrochim. Acta, 2006, vol. 51, p. 2209.
Guo, H. and Gao, Q., Boron and nitrogen co-doped porous carbon and its enhanced properties as supercapacitor, J. Power Sources, 2009, vol. 186, p. 551.
Konno, H., Ito, T., Ushiro, M., Fushimi, K., and Azumi, K., High capacitance B/C/N composites for capacitor electrodes synthesized by a simple method, J. Power Sources, 2010, vol.195, p. 1739.
Sepehri, S., Garcia, B.B., Zhang, Q., and Cao, G., Enhanced electrochemical and structural properties of carbon cryogels by surface chemistry alteration with boron and nitrogen, Carbon, 2009, vol. 47, p. 1436.
Volfkovich, Yu.M., Bograchev, D.A., Rychagov, A.Yu., Sosenkin, V.E., and Chaika, M.Yu., Supercapacitors with carbon electrodes. Energy efficiency: modeling and experimental verification, J. Solid State Electrochem., 2015, vol. 19, p. 1.
Bograchev, D.A., Gryzlov, D.Yu., Sosenkin, V.E., and Volfkovich, Yu.M., Modeling and experimental verification of operation of supercapacitors with carbon electrodes in non-aqueous electrolytes. The energy efficiency, Electrochim. Acta, 2019, vol. 319, p. 552.
Cericola, D., Kötz, R., and Wokaun, A., Effect of electrode mass ratio on aging of activated carbon based supercapacitors.utilizing organic electrolytes, J. Power Sources, 2011, vol. 196, p. 3114.
Portet, C., Taberna, P.L., and Simon, Flahaut, E., Influence of carbon nanotubes addition on carbon–carbon supercapacitor performances in organic electrolyte, J. Power Sources, 2005, vol. 139, p. 371.
Balducci, A., Dugasa, R., Taberna, P.L., Simona, P., Plee, D., Mastragostino, M., and Passerini, S., High temperature carbon–carbon supercapacitor using ionic liquid as electrolyte, J. Power Sources, 2007, vol. 165, p. 922.
Yadav, N., Yadav, Ne., and Hashmi, S.A., Ionic liquid incorporated, redox-active blend polymer electrolyte for high energy density quasi-solid-state carbon supercapacitor, J. Power Sources, 2020, vol. 451, p. 1.
Vancov, T., Alston, A.S., Brown, T., and McIntosh, S., Use of ionic liquids in converting lignocellulosic material to biofuels, Renewable Energy, 2012, vol. 45, p. 1.
Lu, Y., Zhang, S., Yin, J., Bai, C., Zhang, J., Li, Y., Yang, Z., Ge, M., Zhang, L., Wei, M., Ma, M., Ma, Y., and Chen, Y., Mesoporous activated carbon materials with ultrahigh mesopore volume and effective specific surface area for high performance supercapacitors, Carbon, 2017, vol. 124, p. 64.
Eftekhari, A., Supercapacitors utilising ionic liquids, Energy Storage Materials, 2017, vol. 9, p. 47.
Lane, G.H., Electrochemical reduction mechanisms and stabilities of some cation types used in ionic liquids and other organic salts, Electrochim. Acta, 2012, vol. 83, p. 513.
Bodin, C., Mourad, E., Zigah, D., Le, S., Vot, S.A., Freunberger, F., Favier, and Fontaine, O., Biredox ionic liquids: new opportunities toward high performances supercapacitors, Faraday Discussions, 2017, vol. 22, p. 1.
Denshchikov, K.K., Izmaylova, M.Y. Zhuk, A.Z., Vygodskii, Y.S., Novikov, V.T., and Gerasimov, A.F., 1‑Methyl-3-butylimidazolium tetraflouroborate with activated carbon for electrochemical double layer supercapacitors, Electrochim. Acta, 2010, vol. 55, p. 7506.
Kondrat, S., Wu, P, Qiao, R., and Kornyshev, A.A., Accelerating charging dynamics in subnanometre pores, Nature Materials, 2014, vol. 13, p. 387.
Budkov, Y.A., Kolesnikov, A.L., Goodwin, Z.A., Kiselev, M.G., and Kornyshev, A.A., Theory of electrosorption of water from ionic liquids, Electrochim. Acta, 2018, vol. 284, p. 346.
Lazzari, M., Mastragostino, M., and Soavi, F., Capacitance response of carbons in solvent-free ionic liquid electrolytes, Electrochem. Commun., 2007, vol. 9, p. 1567.
Lin, Z., Barbara, D., Taberna, P.L, Katherine, Van Aken, L., Anasori, B., Gogotsi, Y., and Simon, P., Capacitance of Ti3C2TxM. Xene in ionic liquid electrolyte, J. Power Sources, 2016, vol. 326, p. 575.
Yochelis, A., Transition from non-monotonic to monotonic electrical diffuse layers: impact of confinement on ionic liquids, Phys. Chem. Chem. Phys., 2014, vol. 16, p. 2836.
Arbizzani, C., Biso, M., Cericola, D., Lazzari, M., Francesca Soavi, and Mastragostino, M., Safe, high-energy supercapacitors based on solvent-free ionic liquid electrolytes, J. Power Sources, 2008, vol. 185, p. 1575.
Lane, G.H., Electrochemical reduction mechanisms and stabilities of some cation types used in ionic liquids and other organic salts, Electrochim. Acta, 2012, vol. 83, p. 513.
Kalpana, D., Renganathan, N.G., and Pitchumani, S., A new class of alkaline polymer gel electrolyte for carbon aerogel supercapacitors, J. Power Sources, 2006, vol. 157, p. 621.
Yin,Y., Zhou, J., Mansour, A.N., and Zhou, X., Effect of NaI/I2 mediators on properties of PEO/LiAlO2 based all-solid-state Supercapacitors, J. Power Sources, 2011, vol. 196, p. 5997.
Gao, H. and Lian, K., High rate all-solid electrochemical capacitors using proton conducting polymer electrolytes, J. Power Sources, 2011, vol. 196, p. 8855.
Yu, H., Wu, J., Fan, L., Lin, Y., Xu, K., Tang, Z., Cheng, C., Tang, S., Lin, J., Huang, M., and Lan, Z., A novel redox-mediated gel polymer electrolyte for high-performance supercapacitor, J. Power Sources, 2012, vol. 198, p. 402.
Kim, D.W., Ko, J.W., Kim, W.J., and Kim, J.H., Study on the electrochemical characteristics of quasi-solid-state electric double layer capacitors assembled with sulfonated poly(ether ether ketone), J. Power Sources, 2006, vol. 163, p. 300.
Staiti, P. and Lufrano, F., Investigation of polymer electrolyte hybrid supercapacitor based on manganese oxide–carbon electrodes, Electrochim. Acta, 2010, vol. 55, p. 7436.
Zihong, S. and Anbao, Y., Electrochemical Performance of Nickel Hydroxide/Activated Carbon Supercapacitors Using a Modified Polyvinyl Alcohol Based Alkaline Polymer Electrolyte, Chinese J. Chem. Engineering, 2009, vol. 17, p. 150.
Рычагов, А.Ю., Измайлова, М.Ю., Сосенкин, В.Е., Вольфкович, Ю.М., Деньщиков, К.К. Электрохимическое поведение дисперсного углерода в электролитах на основе ионной жидкости 1-метил-3-бутилимидозолий тетрафторборат. Электрохим. энергетика. 2015. Т. 15. С. 3.
Lu, Y., Zhang, S., Yin, J., Bai, C., Zhang, J., Li, Y., Yang, Y., Ge, Z., Zhang, M., Wei, L., Ma, M., Ma,Y., and Chen, Y., Mesoporous activated carbon materials with ultrahigh mesopore volume and effective specific surface area for high performance supercapacitors, Carbon, 2017, vol. 124, p. 64.
Efimov, M.N., Sosenkin, V.E., Volfkovich, Yu.M., Vasilev, A.A., Muratov, D.G., Baskakov, S.A., Efimov, O.N., and Karpacheva, G.P., Electrochemical performance of polyacrylonitrile-derived activated carbon prepared via IR pyrolysis, Electrochem. Commun., 2018, vol. 96, p. 98.
Borenstein, A., Hanna, O., Attias, R., and Luski, S., Thierry Brousse and Doron Aurbach. Carbon-based composite materials for supercapacitor electrodes: a review, J. Mater. Chem. A, 2017, vol. 5, p. 12653.
Wang, H., Zhong, Y., Li, Q., Yang, J., and Dai, Q., Cationic starch as a precursor to prepare porous activated carbon for application in supercapacitor electrodes, J. Phys. and Chem. Solids, 2008, vol. 69, p. 2420.
Volfkovich, Y.M., Mikhailin, A.A., Bograchev, D.A. Sosenkin, V.E., and Bagotsky, V.S., Studies of supercapacitor carbon electrodes with high pseudocapacitance, Recent Trend in Electrochem. Sci. and Technology, 2012, p. 159.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., and Bagotsky, V.S., Supercapacitor carbon electrodes with high capacitance, J. Solid State Electrochem., 2014, vol. 18, p. 1351.
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. М.: Химия, 2001.
Nishihara, H., Itoi, H., Kogure, T., Hou, P., Touhara, H., Okino, F., and Kyotani, T., Chem., Investigation of the ion storage/transfer behavior in an electrical double layer capacitor by using ordered microporous carbons as model materials, Cemistry Eu. J., 2009, vol. 15, p. 5355.
Рычагов, А.Ю., Вольфкович, Ю.М., Воротынцев, М.А., Квачева, Л.Д., Конев, Д.В., Крестинин, А.В., Кряжев, Ю.Г., Кузнецов, В.Л, Кукушкина, Ю.А., Мухин, В.М., Соколов, В.В., Червонобродов, С.П. Перспективные электродные материалы для суперконденсаторов. Электрохим. энергетика. 2012. Т. 12. С. 167.
Ariyanto, T., Glaesel, J., Kern, A., Zhang, G., and Etzold, B.J., Improving control of carbide-derived carbon microstructure by immobilization of a transition-metal catalyst within the shell of carbide/carbon core–shell structures, Beilstein J. Nanotechnol., 2019, vol. 10, p. 419.
Krüner, B., Odenwald, C., Tolosa, A., Schreiber, A., Aslan, M., Kickelbick, G., and Presser, V., Carbide-derived carbon beads with tunable nanopores from continuously produced polysilsesquioxanes for supercapacitor electrodes, Sustainable Energy Fuels, 2017, vol. 1. p. 1588.
Dhaka, T.P., Chapter 8—Simple Parallel-Plate Capacitors to High–Energy Density Future Supercapacitors: A Materials Review (Carbide-Derived Carbon—an overview), Emerging Materials for Energy Conversion and Storage, 2018, p. 247.
Yang, X., Fei, B., Ma, J., Liu, Liu, X., Yang, S., Tian, G., Jiang, Z., Yang, S., Tian, G., and Jiang, Z., Porous nanoplatelets wrapped carbon aerogel by pyrolysis of regenerated bamboo cellulose aerogels as supercapacitor electrodes, Carbohydrate Polymers, 2018, vol. 180, p. 385.
Вольфкович, Ю.М., Рычагов, А.Ю., Сосенкин, В.Е., Крестинин, А.В. Силовой электрохимический суперконденсатор на основе углеродных нанотрубок. Электрохим. энергетика. 2008. Т. 8. С.106.
Yang, Z., Tian, J., Yin, Z., Cui, C., Qian, W., and Wei, F., Carbon nanotube- and graphene-based nanomaterials and applications in high-voltage supercapacitor: A review, Carbon, 2019, vol. 141, p. 467.
Вольфкович, Ю.М., Рычагов, А.Ю., Сосенкин, В.Е., Ефимов, О.Н., Осьмаков, М.И., Селиверстов, А.Ф. Измерение разными методами удельной поверхности углеродных наноматериалов. Электрохимия. 2014. Т. 50. С. 1222. [Volfkovich, Yu.M., Rychagov, A.Yu., Sosenkin, V.E., Efimov, O.N., Os’makov, M.I., and Seliverstov, A.F., Measuring the Specific Surface Area of Carbon Nanomaterials by Different Methods, Russ. J. Electrochem, 2014, vol. 50, p. 1099.]
Dong, B., He, B.L., Xu, C.L., and Li, H.L., Preparation and electrochemical characterization of polyaniline/multi-walled carbon nanotubes composites for supercapacitor, Mater. Sci. and Engineering B., 2007, vol. 143, p. 7.
Wang, J., Xu, Y., Chen, X., and Sun, X., Capacitance properties of single wall carbon nanotube/polypyrrole composite films, Composites Science and Technology, 2007, vol. 67, p. 2981.
Dong, B., He, B.L., Xu, C.L., and Li, H.L., Preparation and electrochemical characterization of polyaniline/multi-walled carbon nanotubes composites for supercapacitor, Mater. Sci. and Engineering B, 2007, vol. 143, p. 7.
Honda, Y., Takeshige, M., Shiozaki, H., Kitamura, T., Yoshikawa, K., Chakarabarti S., Suekane, O., Pan, L., Nakayama, Y., Yamagata, M., and Ishikawa, M., Vertically aligned double-walled carbon nanotube electrode prepared by transfer methodology for electric double layer capacitor, J. Power Sources, 2008, vol. 185, p. 1580.
Chee, W.K., Lim, W.K., Zainal, H.N., Huang, Z., Harrison, N.M., and Andou, Y., Flexible Graphene-Based Supercapacitors: A Review, J. Phys. Chem. C., 2016, vol. 120, p. 4153.
Eftekhari, A., Shulga, Y.M., Baskakov, S.A., and Gutsev, G.L., Graphene oxide membranes for electrochemical energy storage and conversion. Intern, J. Hydrogen energy, 2018, vol. 43, p. 2307.
Shulga, Yu.M., Baskakova, S.A., Baskakova, Yu.V., Lobach, A.S., Kabachkov, E.N., Volfkovich, Yu.M., Sosenkin, V.E., Shulga, N.Yu., Nefedkin, S.I., Kumar, Y., and Michtchenko, A., Preparation of graphene oxide-humic acid composite-based ink for printing thin film electrodes for micro-supercapacitors, J. Alloys and Compounds, 2018, vol. 730, p. 88.
Shulga, Yu.M., Baskakov, S.A., Baskakova, Y.V., Lobach, A.S., Volfkovich, Yu.M., Sosenkin, N.Y., Shulga, N.Yu., Parkhomenko, Y.N., Michtchenko, A., and Kumar, Y., Hybrid porous carbon materials derived from composite of humic acid, Microporous and Mesoporous Materials, 2017, vol. 245, p. 24.
Кряжев, Ю.Г., Вольфкович, Ю.М., Мельников, И.П., Рычагов, А.Ю., Тренихин, М.В., Солодовниченко, В.С., Лихолобов, В.А. Синтез и исследование электрохимических свойств нанокомпозита с графеноподобными частицами, встроенными в высокопористую углеродную матрицу. Журн. физикохимия поверхности и защита материалов. 2017. Т. 53. С. 422. [Kryazhev, Yu.G., Volfkovich, Yu.M., Mel’nikov, V.P., Rychagov, A.Yu., Trenikhin, M.V., Solodovnichenko, V.S., and Likholobov, V.A., Synthesis and study of electrochemical properties of nanocomposites with graphene-like particles integrated into a high-porosity carbon matrix, Protection of Metals and Physical Chemistry of Surfaces, 2017, vol. 53, p. 422.]
Shulga, Yu.M., Baskakov, S.A., Baskakova, Yu.V., Volfkovich, Yu.M., Shulga, N.Yu., Skryleva, E.A., Parkhomenko, Y.N., Belay, K.G., Gutsev, G.L., Rychagov, A.Y., Sosenkin, V.E., and Kovalev, I.D., Supercapacitors with graphene oxide separators and reduced graphite oxide electrodes, J. Power Sources, 2015, vol. 279, p. 722.
Ke, Q. and Wang, J., Graphene-based materials for supercapacitor electrodes e A review, J. Materiomics, 2016, vol. 2, p. 37.
Lee, H. and Lee, K.S., Interlayer distance controlled graphene, supercapacitor and method of producing the same, US Patent 10,214, 422 B2, 2019.
Yang, X., Cheng, C., Wang,Y., Qiu, L., and Li, D., Liquid-Mediated Dense Integration of Graphene Materials for Compact Capacitive Energy Storage, Science, 2013, vol. 341, p. 534.
Liu, H., Wang, Y., Gou, X., Qi, T., Yang, J., and Ding, Y., Three-dimensional graphene/polyaniline composite material forhigh-performance supercapacitor applications, Mater. Sci. and Engineering B, 2013, vol. 178, p. 293.
Aboutalebi, H., Chidembo, A.T., Salari, M., Konstantinov, K., Wexler, D., Liu, H.K., and Dou, S.X., Comparison of GO, GO/MWCNTs composite and MWCNTs as potential electrode materials for supercapacitors, Energy Environ. Sci., 2011, vol. 4, p. 1855.
Zhong, M., Song, Y., Li, Y., Ma, C., Zhai, X., Shi, J., Guo, Q., and Liu, L., Effect of reduced graphene oxide on the properties of an activated carbon cloth/polyaniline flexible electrode for supercapacitor application, J. Power Sources, 2012, vol. 217, p. 6.
Sun, D., Yan, X., Lang, J., and Xue, Q., High performance supercapacitor electrode based on graphene paper via flame-induced reduction of graphene oxide paper, J. Power Sources, 2013, vol. 222, p. 52.
Zhou, Z. and Wu, X.F., Graphene-beaded carbon nanofibers for use in supercapacitor electrodes:Synthesis and electrochemical characterization, J. Power Sources, 2013, vol. 222, p. 410.
Mohammadi, A., Arsalani, N., Tabrizi, A.G., Moosavifard, S.E., Naqshbandi, Z., and Ghadimi, L.S., Engineering rGO-CNT wrapped Co3S4 nanocomposites for high-performance asymmetric supercapacitors, Chem. Engineering J., 2018, vol. 334, p. 66.
Smirnov, V.A., Denisov, N.N., Dremova, N.N., Volfkovich, Yu.M., Rychagov, A.Yu., Sosenkin, V.E., Belay, K.G., Gutsev, G.L., Shulga, N.Yu., and Shulga, Yu.M., A comparative analysis of graphene oxide films as proton conductors, Appl. Phys. A, 2014, vol. 117, p. 1859.
Volfkovich, Yu.M., Lobach, A.S., Spitsyna, N.G., Baskakov, S.A., Sosenkin, V.E., Rychagov, A.Yu., Kabachkov, E.N., Sakars, A., Michtchenko, A., and Shulga, Yu.M., Hydrophilic and Hydrophobic Pores in Reduced Graphene Oxide Aerogel, J. Porous Mater., 2019, vol. 26, p. 1111.
Saha, S., Samanta, P., Murmua, N.C., and Kuila, T., A review on the heterostructure nanomaterials for supercapacitor application, J. Energy Storage, 2018, vol. 17, p. 181.
González, A. and Goikole, E., Review on supercapacitors: Technologies and materials, Renewable and Sustainable Energy Reviews, 2016, vol. 58, p. 1189206.
Venkataraman, A., Pseudocapacitors for Energy Storage, 2015, https://pdxscholar.library.pdx.edu/open_access_etds?utm_source=pdxscholar.library.pdx.edu%2 Fopen_access_etds%2F2486&utm_medium=PDF&utm_campaign=PDFCoverPages.
Bodin, C., Mourad, E., Zigah, D., le Vot, S., Freunberger, S.A., Favier, F., and Fontaine, O., Biredox ionic liquids: new opportunities toward high performances supercapacitors, Faraday Discuss., 2017, vol. 206, p.2.
Zhi, M, Xiang, C., Li, J., Li, M., and Wu, N., Nanostructured carbon–metal oxide composite electrodes for supercapacitors: a review, Nanoscale, 2013, vol. 5, p. 72.
Ghosh, S., Jeong, S.M., and Polaki, S.R., A review on metal nitrides/oxynitrides as an emerging supercapacitor electrode beyond oxide, Korean J. Chem. Eng., 2018, vol. 35, p. 1389.
Arun, N., Jain, A., Aravindan, V., Jayaraman, S., Ling, V.C., Srinivasan, M.P., and Madhavi, S., Nanostructuredspinel LiNi0.5Mn1.5O4 as new insertion anodeforadvancedLi-ion capacitors with high power capability, Nano Energy, 2015, vol. 12, p. 69.
Kate, R.S., Khalate, S.A., and Deokate, R.J., Overview of nanostructured metal oxides and pure nickel oxide (NiO) electrodes for supercapacitors: A review, J. Alloys and Compounds, 2018, vol. 734, p. 89.
Sk, M.M., Yue, C.Y., Ghosh, K., and Jena, R.K., Review on advances in porous nanostructured nickel oxides and their composite electrodes for high-performance supercapacitors, J. Power Sources, 2016, vol. 308, p. 121.
Nithya, V.D. and Arul, N.S., Review on a-Fe2O3 based negative electrode for high performance supercapacitors, J. Power Sources, 2016, vol. 327, p. 97.
Yue-feng, S., Feng, W., Li-ying, B., and Zhao-hui,Y., RuO2/activated carbon composites as a positive electrode in an alkaline electrochemical capacitor, New Carbon Materials, 2007, vol. 22, p. 53.
Li, Z., Wang, J., X., S.L., and Yang, L.S., Synthesis of hydrothermally reduced graphene/MnO2 composites and their electrochemical properties as supercapacitors, J. Power Sources, 2011, vol. 196, p. 8160.
Zhanga, W.J. and Huang, K.G., A review of recent progress in molybdenum disufide-based supercapacitors and batteries, Inorg. Chem. Front, 2017, vol. 4, p. 1602.
Snook, G.A., Kao, P., and Best, A.S., Conducting-polymer-based supercapacitor devices and electrodes, J. Power Sources, 2011, vol. 196, p. 1.
Peng, C., Zhang, S., Jewell, D., and Chen, G.Z., Carbon nanotube and conducting polymer composites for supercapacitors, Progress in Natural Science, 2008, vol. 8, p. 777.
Huang, Z., Li, L., Wang, Y., Zhang, C., and Liu, T., Polyaniline/graphene nanocomposites towards high-performance supercapacitors: A review, Composites Commun., 2018, vol. 8, p. 83.
Wang, J., Xu, Y., Chen, X., and Sun, X., Capacitance properties of single wall carbon nanotube/polypyrrole composite films, Composites Sci. and Technology, 2007, vol. 67, p. 2981.
Kim, B.C., Kwon, J.S., Ko, J.M., Park, J.H., Too, C.O., and Wallace, G.G., Preparation and enhanced stability of flexible supercapacitor prepared from Nafion/polyaniline nanofiber, Synthetic Metals, 2010, vol. 160, p. 94.
Cong, H.P., Ren, X.C., Wang, P., and Yu, S.H., Flexible graphene–polyaniline composite paper for high-performance supercapacitor, Energy Environ. Sci., 2013, vol. 6, p. 1185.
Qin, W., Jian-ling, L., Fei, G., Wen-sheng, L., Ke-zhong, W., and Xin-dong, W., Poly(ethylenedioxythiophene) (PEDOT) as polymer electrode in redox supercapacitor, New Carbon Materials, 2008, vol. 1, p. 275.
Cai, J.J., Kong, L.B., Zhang, J., Luo, Y.C., and Kang, L., A novel polyaniline/mesoporous carbon nano-composite electrode for asymmetric supercapacitor, Chinese Chem. Letters, 2010, vol. 21, p. 1509.
Yang, M., Cheng, B., Song, H., and Chen, X., Preparation and electrochemical performance of polyaniline-based carbon nanotubes as electrode material for supercapacitor, Electrochim. Acta, 2010, vol. 55, p. 7021.
Fang, Y., Liu, J., Yu, D.J., Wicksted, J.P., Kalkan, K., Topal, C.Q., Flanders, B.N., Wu, J., and Li, J., Self-supported supercapacitor membranes: Polypyrrole-coated carbon nanotube networks enabled by pulsed electrodeposition, J. Power Sources, 2010, vol. 195, p. 674.
Vorotyntsev, M.A., Konev, D.V., Devillers, Ch.H., Bezverkhyy, I., and Heintz, O., Electroactive polymeric material with condensed structure on the basis of magnesium(II) polyporphine, Electrochim. Acta, 2011, vol. 56, p. 3436.
Вольфкович, Ю.М., Золотова, Т.К., Бобе, С.Л., Шлепаков, А.В., Багоцкий, В.С. Влияние пористой структуры, межфазной емкости, кинетических и диффузионных характеристик на разрядные и зарядные кривые полианилиновых электродов. Электрохимия. 1993. Т. 29. С. 647. [Volfkovich, Yu.M., Zolotova, T.K., Bobe, S.L., Shlepakov, A.V., and Bagotsky, V.S., Influence of porous structure, interfacial capacitance, kinetic and diffusion characteristics on discharge and charging curves of polyaniline electrodes, Russ. J. Electrochem., 1993, vol. 29, p. 1094.]
Volfkovich, Yu.M., Sergeev, A.G., Zolotova, T.K., Afanasiev, S.D., Efimov, O.N., and Krinichnaya, E.P., Macrokinetics of polyaniline based electrode: effects of porous structure, microkinetics, diffusion, and electrical double layer, Electrochim. Acta, 1999, vol. 44, p. 1543.
Algharaibeh, Z. and Pickup, P.G., An asymmetric supercapacitor with anthraquinone and dihydroxybenzene modified carbon fabric electrodes, Electrochem. Communications, 2011, vol. 13, p. 147.
Jang, B.Z., Liu, C., Neff, D., Yu, Z., Wang, M.C., Xiong, W., and Zhamu, R., Graphene Surface-Enabled Lithium Ion-Exchanging Cells: Next-Generation High-Power Energy Storage Devices, Nano Lett., 2011, vol. 11, p. 3785.
Jeżowski, P., Crosnier, O., Deunf, E., Poizot, P., Béguin, F., and Brousse, Safe and recyclable lithium-ion capacitors using sacrificial organic lithium salt, Nature Materials, 2018, vol. 17, p. 167.
Li, G., Yang, Z., Yin, Z., Guo, H., Wang, Z., and Yan, G., Non-aqueous dual-carbon lithium-ion capacitors: a review, J. Mater. Chem. A, 2019, vol. 7. p. 15541.
Beliakov, A.I. and Brintsev, A.M., Hybrid supercapacitor NiOOH/KOH/C/. Proc. 9th Int. Seminar on Double Layer Capacitors and Similar Energy Storage Devices. Deerfield Beach. Florida, 1999, vol. 9.
Volfkovich, Yu.M. and Shmatko, P.A., Electric Double Layer Capacitor, US Patent 6.628.504 (2003).
Volfkovich, Yu.M., Rychagov, A.Yu., Urisson, N.A., and Serdyuk, T.M., Positive Electrode of Electric double layer capacitor, US Patent 7.006.346 B2 (2006).
Banerjee, A., Ravikumar, M.K., Jalajakshi, A., Kumar, P.S., Gaffoor, S.A., and Shukla, A.K., Substrate integrated Lead-Carbon hybrid ultracapacitor with flooded, absorbent glass mat and silicagel electrolyte configurations, J. Chem. Sci., 2012, vol. 124, p. 747.
Li, Z., Wang, S., Liu, X., and Yang, L.S., Synthesis of hydrothermally reduced graphene/MnO2 composites and their electrochemical properties as supercapacitors, J. Power Sources, 2011, vol. 196, p. 8160.
Burke, A. and Miller, M., The power capability of ultracapacitors and lithium batteries for electric and hybrid vehicle applications, J. Power Sources, 2011, vol. 196, p. 514.
Kosova, N.V., Kulova, T.L., Nikolskaya, N.F., Podgornova, O.A., Rychagov, A.Yu., Sosenkin, V.E., and Volfkovich, Yu.M., Effect of porous structure of LiCoPO4 on its performance in hybrid supercapacitor, J. Solid State Electrochemistry, 2019, vol. 23, p. 1981.
Amatucci, G.G., Badway, F., Du Pasquier, A., and Zheng, T., An asymmetric hybrid nonaqueous energy storage cell, J. Electrochem. Soc., 2001, vol. 148, p. A930.
Santhanam, R. and Rambabu, B., Research progress in high voltage spinel LiNi0.5Mn1.5O4 Material, J. Power Sources, 2010, vol. 195, p. 5442.
Singh, M.K. and Hashmi, S.A., Performance of solid-state hybrid supercapacitor with LiFePO4/AC composite cathode and Li4Ti5O12 as anode, Ionics, 2017, vol. 23, p. 1.
Potapenko, A.V. and Kirillov, SA., Lithium manganese spinel materials for high-rate electrochemical applications (Review), J. Energy Chem., 2014, vol. 23, p. 543.
Li, H., Cheng, L., and Xia, Y.A., Hybrid electrochemical supercapacitor based on a 5 V Li-Ion battery cathode and active carbon, Electrochem. Solid-State Lett., 2005, vol. 8, p. A433.
Karthikeyan, K., Aravindan, V., Lee, S.B., Jang, I.C., Lim, H.H., Park, G.J., Yoshio, M., and Lee, Y.S., Electrochemical performance of carbon-coated lithium manganese silicate for asymmetric hybrid supercapacitors, J. Power Sources, 2010, vol. 195, p. 3761.
Genc, R., Alas, M.O., Harputlu, E., Repp, S., Kremer, N., Castellano, M., Colak, S.G., Ocakoglu, K., and Erdem, E., High-Capacitance Hybrid Supercapacitor Based on Multi-Colored Fluorescent Carbon-Dots, 2017, Scientific reports 7. Article number: 11222, p. 1.
Vasanthi, R., Kalpana, D., and Renganathan, N.G., Olivine-type nanoparticle for hybrid supercapacitors, J. Solid State Electrochem., 2008, vol. 12, p. 961.
Cai, J.J., Kong, L.B., Zhang, J., Luo, Y.C., and Kang, L., A novel polyaniline/mesoporous carbon nano-composite electrode for asymmetric supercapacitor, Chinese Chem. Letters, 2010, vol. 21, p. 1509.
Gao, X., Zu1, L., Cai, X., Li, C., Lian, H., Liu, Y., Wang, X., and Cui, X., High Performance of Supercapacitor from PEDOT:PSS Electrode and Redox IodideIon Electrolyte, Nanomaterials, 2018, vol. 8, p. 335.
Sonia, T.S., Mini, P.A., Nandhini, R., Sujith, K., Avinash, B., Nair, S.V., and Subramanian, K.R., Composite supercapacitor electrodes made of activated carbon/PEDOT:PSS and activated carbon/doped PEDOT, Bull. Mater. Sci., 2013, vol. 36, p. 547.
Lin, Z., Goikolea, E., Balducci, A., Naoi, K., Taberna, P.L., Salanne, M., Yushin, G., and Simon, P., Materials for supercapacitors: When Li-ion battery power is not enough, Materials Today, 2018, vol. 21. p. 419.
Miller, J.R., Perspective on electrochemical capacitor energy storage, Applied Surface Science, 2018, vol. 460, p. 3.
Yassine, M. and Fabris, D., Performance of Commercially Available Supercapacitors, Energies, 2017, vol. 10, p. 1340.
Zhang, L., Hu, X., Wang, Z., Sun, F., and Dorrell, D.G., A review of supercapacitor modeling, estimation, and applications: A control/management perspective, Renewable and Sustainable Energy Reviews, 2018, vol. 81, p. 1868.
Chee, W.K., Lim, Zainal, Z., Huang, N.M., Harrison, I., and Andou, Y., Flexible Graphene-Based Supercapacitors: A Review, J. Phys. Chem. C., 2016, vol. 120, p. 4153.
Miller, J.R., Engineering electrochemical capacitor applications, J. Power Sources, 2016, vol. 326, p. 726.
Lewandowski, A. and Galinski, M., Practical and theoretical limits for electrochemical double-layer capacitors, J. Power Sources, 2007, vol. 173, p. 822.
Mastragostino, M. and Soavi, F., Strategies for high-performance supercapacitors for HEV, J. Power Sources, 2007, vol. 174, p. 89.
Paleo, A.J., Stait, P., Brigandì, A., Ferreira, F.N., Rocha, A.M., and Lufrano, F., Supercapacitors based on AC/MnO2 deposited onto dip-coated carbon nanofiber cotton fabric electrodes, Energy Storage Materials, 2018, vol. 12, p. 204.
Hosseini, M.G., Rasouli,H., Shahryari,E., and Naji, L., Electrochemical behavior of a Nafion membrane-based solid-state supercapacitor with a graphene oxide–multiwalled carbon nanotube–polypyrrole nanocomposite, J. APPL. POLYM. SCI., 2017, vol. 13, p. 44926.
Łatoszy’nska, A.A., Taberna, P., Simon, P., and Wieczorek, W., Proton conducting Gel Polymer Electrolytes for supercapacitor.applications, Electrochim. Acta, 2017, vol. 242, p. 31.
Li, J., Qiao J., and Lian, K., Hydroxide ion conducting polymer electrolytes and their applications in solid supercapacitors: A review., Energy Storage Materials, 2020, vol. 24, p. 6.
Oren, Y., Capacitive deionization (CDI) for desalination and water treatment—past, present and future (a review), Desalination, 2008, vol. 228, p. 10.
Strathmann, H., Ion-Exchange Membrane Processes in Water Treatment Sustainability Scienceand Engineering, Elsevier Pabl., 2010.
Вольфкович, Ю.М. Емкостная деионизация воды. Электрохимия. 2020. Т. 56. С. 20. [Volfkovich, Yu.M., Capacitive Deionization of Water (A Review), Russ. J. Electrochem., 2020, vol. 56, p. 18.]
Suss, M.E., Baumann, T.F., Bourcier, W.L., Spadaccini, C.M., Rose, K.A., Santiago, J.G., and Stadermann, M., Capacitive desalination with flow-through electrodes, Energy Environ. Sci., 2012, vol. 5, p. 9511.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., Rychagov, A.Yu., Sosenkin, V.E., and Park, D., Capacitive deionization of aqueous solutions. modeling and experiments, Desalination and water treatment, 2017, vol.69, p. 130.
Volfkovich, Yu.M., Bograchev, D.A., Mikhalin, A.A., Rychagov, A.Yu., Sosenkin, V.E., Milyutin, V.V., and Park, D., Electrodes Based on Carbon Nanomaterials: Structure, Properties and Application to Capacitive Deionization in Static Cells. Cahapter 9. Nano-Optics, Nanophotonics, Nanomaterials, and Their Applications. Edited by Olena Fesenko and Leonid Fesenko. Shpringer publ, 2018, p. 127.
Rica, R.A., Ziano, R., Salerno, D., Mantegazza, F., and Brogioli, D., Thermodynamic Relation between Voltage-Concentration Dependence and Salt Adsorption in Electrochemical Cells, Phys. Rev. Lett, 2012, vol. 109, p. 156103.
Evlashin, S.A., Maksimov, Y.M., Dyakonov, P.V., Pilevsky, A.A., Maslakov, K.I., Mankelevich, Y.A., Voronina, E.N., Vavilov, S.V., Pavlov, A.A., Zenova, E.V., Akhatov, I.S., and Suetin, N.V., N-Doped Carbon NanoWalls for Power Sources, Scientific Reports., 2019, vol. 9, p. 6716.
Porada, S., Zhao R., Van Der Wal, A., Presser, V., and Biesheuvel, P.M., Review on the science and technology of water desalination by capacitive deionization, Prog. Mater. Sci., 2013, vol. 58, p. 1388.
Jia, B. and Zhang, W., Preparation and application of electrodes in capacitive deionization (CDI): a state-of-art review, Nanoscale research letters, 2016, vol. 11, p. 64.
ladunni, J., Zain, J.H., Hai, A., Banat, F., and Bharath, G., A comprehensive review on recently developed carbon based nanocomposites for capacitive deionization: from theory to practice, Separation and Purification Technology, 2018, vol. 22, p. 291
Andelman, M., Flow Through Capacitor basics, Separation and Purification Technology, 2011, vol. 80, p. 262.
Biesheuvel, P.M., Bazant, M.Z., Cusick, R.D., Hatton, T.A., Hatzell, K.B., Hatzell, M.C., Liang, P., Lin, S., Porada, S., Santiago, J.G., Smith, K.C., Stadermann, M., Su, X., Sun, X., Waite, T.D., van der Wal, A., Yoon, J., Zhao, R., Zou, L., and Suss, M.E., Capacitive Deionization–defining a class of desalination technologies, Applied Physics, 2017, vol. 16, p. 19.
Вольфкович, Ю.М., Михалин, А.А., Рычагов, А.Ю. Измерение поверхностной проводимости пористых углеродных электродов. Электрохимия. 2013. Т. 49. С. 667. [Volfkovich, Yu.M., Mikhalin, A.A., and Rychagov, A.Yu., Surface Conductivity Measurements for Porous Carbon Electrodes, Russ. J. Electrochem., 2013, vol. 49, p. 594.]
Volfkovich, Yu.M., Kononenko, N.A., Mikhalin, A.A., Kardash, M.M., Rychagov, A.Yu., Tsipliaev, S.V., Shkirskaya, S.A., and Sosenkin, V.E., Capacitive deionization of water involving mosaic membranes based on fibrous polymer matrices, Desalination and water treatment, 2020, vol. 182, p. 77.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия