Электрохимия, 2021, T. 57, № 5, стр. 316-320
Влияние плазмоэлектрохимической обработки допированного бором алмаза на кинетические характеристики обратимых электродных реакций
Р. А. Манжос a, *, А. С. Коткин a, В. К. Кочергин a, b, А. Г. Кривенко a
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119992 Москва, Россия
* E-mail: rmanzhos@icp.ac.ru
Поступила в редакцию 06.11.2020
После доработки 30.11.2020
Принята к публикации 18.12.2020
Аннотация
Проанализировано изменение константы скорости электронного переноса для ряда модельных редокс-реакций после плазмоэлектрохимической обработки импульсами анодной плазмы поверхности пленочного электрода из допированного бором алмаза.
ВВЕДЕНИЕ
Благодаря высокой устойчивости sp3-углерода к воздействию активных интермедиатов допированный бором алмаз (ДБА) находит широкое применение в качестве электродного материала в электрохимических устройствах очистки сточных вод от токсичных и трудно биоокисляемых органических экополлютантов [1]. Однако его недостатком является относительно низкая скорость электронного переноса (ЭП), ограничивающая производительность таких систем. В данной работе было изучено влияние плазмоэлектрохимической модификации поверхности пленочного ДБА-электрода на скорость ЭП внешне- и внутрисферных электродных реакций ряда модельных редокс-систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электроды представляли собой пленку ДБА толщиной 10–20 мкм c cодержанием бора ~0.1 ат. %, нанесенную на проводящую кремниевую подложку. Контакты к кремниевой пластине приклеивали проводящим клеем и изолировали ее тыльную и боковую поверхности герметиком. Перед измерениями электроды активировали катодно-анодной поляризацией при –1.8 В (30 мин) и 1.8 В (30 мин) в 0.5 M H2SO4. Модификацию электродов производили в двухэлектродной термостатируемой ячейке импульсным воздействием электролизной анодной плазмы, образующейся при наложении 20–50 импульсов напряжения амплитудой 300 В относительно графитовой пластины, в 1 М Na2SO4 [2, 3].
Измерения циклических вольтамперограмм (ЦВА) проводили с помощью потенциостата Elins P-20X (Elins, Россия) в трехэлектродной кварцевой ячейке, фоновым электролитом во всех случаях, кроме раствора FeSO4, был 1 М Na2SO4. Концентрация [Ru(NH3)6]Cl3, K3[Fe(CN)6], FeSO4 составляла 5 мМ. Вода для приготовления растворов дважды перегонялась в кварцевой посуде. Величины констант скорости ЭП k0 для редокс-систем оценивались из анализа зависимостей разности потенциалов пиков ЦВА (ΔE) от скорости развертки потенциала (v) [4].
Изображения поверхности электродов получали на сканирующем электронном микроскопе (СЭМ) Zeiss SUPRA 25 (Carl Zeiss, Германия). Анализ методом рентгеновской фотоэлектронной спектроскопии (РФЭС) проводили с помощью прибора Specs PHOIBOS 150 MCD (Specs, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
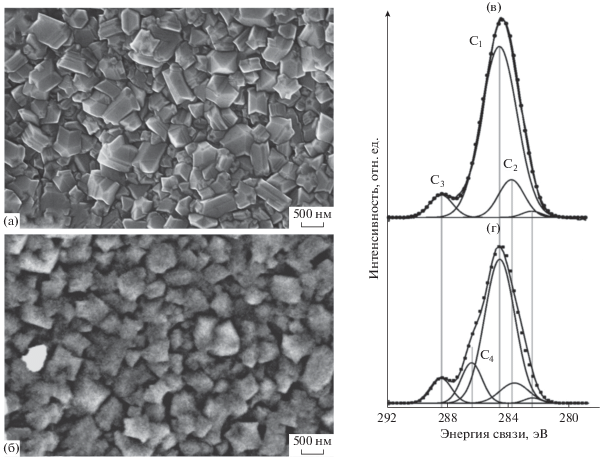
На рис. 1а и 1б приведены СЭМ-изображения исходного и обработанного плазмой ДБА-электродов. Как видно из рисунка, острые края алмазных кристаллитов исходного ДБА (рис. 1а) несколько скругляются после плазмоэлектрохимической обработки (рис. 1б), что указывает на частичное растворение участков с наибольшей кривизной поверхности. РФЭ-спектры C 1s, приведенные на рис. 1в и 1г, демонстрируют существенное различие для исходного и обработанного образцов. Основной для обоих спектров пик C1 можно приписать углероду в sp3-состоянии, так как его положение (284.7 ± 0.1 эВ) характерно для описанного в литературе аналогичного пика, регистрируемого на поликристаллических пленках ДБА [5]. Согласно литературным данным, разность энергий пиков, соответствующих sp3 C и sp2 C, составляет –(0.7–1.3) эВ [6] и, таким образом, пик C2, находящийся при меньших на 0.8–0.9 эВ энергиях относительно C1, можно отнести к sp2-углероду. Пик C3, наблюдаемый в обоих случаях при наиболее высоких энергиях связи (на 4.0–4.5 эВ бóльших, чем пик C1), может быть отнесен к карбоксильным функциональным группам. В то же время С4, регистрируемый только на обработанном плазмой электроде при энергиях на 1.8–2.0 эВ выше, чем у C1, можно отнести к эфирным и/или карбонильным функциональным группам [6]. Интерпретация небольших пиков при энергиях 282–283 эВ является затруднительной вследствие отсутствия однозначных литературных данных. Приведенные результаты деконволюции C 1s-спектров указывают на преимущественное образование только карбоксильных групп на поверхности исходного ДБА-электрода в результате его предварительной активации, использованной в данной работе. Последующая плазмоэлектрохимическая обработка анодной плазмой еще более увеличивает степень окисления ДБА, но в отличие от электрохимического воздействия формирует на поверхности функциональные группы различной природы. Дополнительно к имеющимся карбоксильным регистрируется наличие значительного количества эфирных и/или карбонильных групп, причем количество первых несущественно возрастает по сравнению с исходным образцом.
Рис. 1.
СЭМ-изображения поверхности (а, б) и C 1s спектры высокого разрешения (в, г) исходного (а, в) и модифицированного (б, г) ДБА-электродов.
На рис. 2а–2в приведены ЦВА, измеренные на исходном и модифицированном ДБА-электродах. Следует отметить, что для всех редокс-систем регистрируемые токи увеличиваются в ~2 раза после модификации электрода, которая, очевидно, приводит к увеличению электрохимически активной площади электрода вследствие дополнительной активации и очистки поверхности. В случае редокс-системы [Fe(CN)6]4–/3– величина ΔE несколько увеличивается, а для Fe2+/3+ – уменьшается после модификации электрода. На ЦВА-кривых для последней редокс-системы (рис. 2в) помимо основных пиков отчетливо видны пики с амплитудой в 5–10 раз меньше и ΔE ≈ 60–180 мВ. Аналогичные, но менее отчетливые пики, можно выделить и в случае [Fe(CN)6]4–/3–. Наличие второй пары пиков можно объяснить электрохимической неоднородностью поверхности исходного и модифицированного ДБА-электродов: на более активных участках, составляющих 5–10% от менее активной поверхности, реакция протекает с большей скоростью, чем на основной части, для которой характерна существенно более низкая величина k0. Наблюдаемая аддитивность токов от различающихся по скорости электронного переноса участков ДБА предполагает отсутствие перекрывания диффузионных слоев (толщиной lD) активных центров. Оценка lD ≥ 15 мкм для v = = 1 В/с и типичного для водных растворов коэффициента диффузии 10–5 см2/с [7] означает, что эти центры находятся на еще большем расстоянии друг от друга.
Рис. 2.
ЦВА, измеренные в растворах 0.1 М Na2SO4 + 5 мM [Ru(NH3)6]Cl3 (а), 0.1 М Na2SO4 + 5 мМ K3[Fe(CN)6] (б) и 5 мM FeSO4 + 0.25 M H2SO4 (в), и соответствующие зависимости ΔE(v) для исходного (⚫) и модифицированного (×) ДБА-электродов (г, д, е). ЦВА на исходном ДБА и расчетные кривые для указанных величин k0 приведены пунктирными линиями.
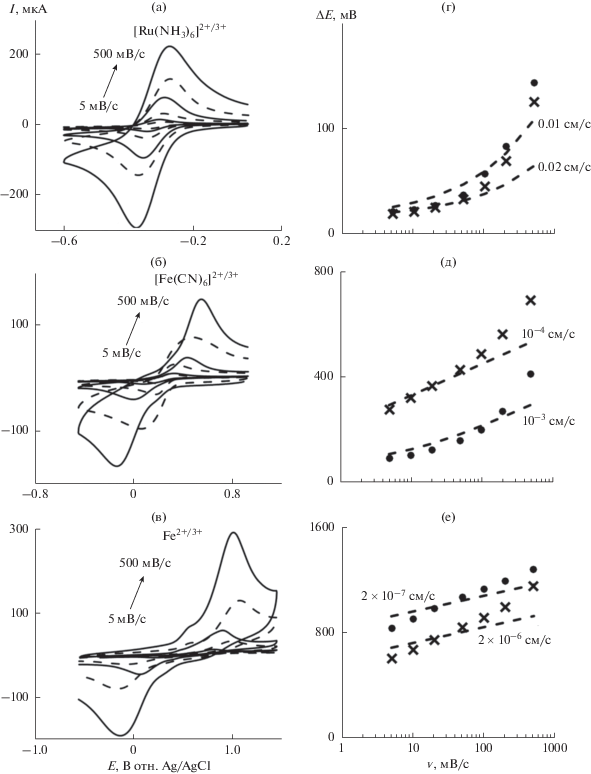
Экспериментальные и рассчитанные зависимости ΔE(v) приведены на рис. 2г–2е. Для [Ru(NH3)6]2+/3+ величина k0 = (1–2) × 10–2 см/с для исходного ДБА ожидаемо близка к полученной ранее для стеклоуглеродного электрода [2] и практически не изменяется после обработки анодной плазмой, что не является удивительным с учетом внешнесферного характера ЭП для этой системы. С другой стороны, на исходном ДБА константа скорости ЭП для редокс-пары Fe2+/3+ принимает аномально низкое значение k0 ≈ 2 × × 10–7 см/с, что на порядок меньше, чем даже на нефункционализированных углеродных наностенках (УНС) [4]; после обработки анодной плазмой k0 несколько увеличивается до ~2 × 10–6 см/с, но все равно остается крайне низкой, близкой к аналогичной величине для УНС. Причиной этого, по-видимому, является то обстоятельство, что появившиеся на поверхности электрода после обработки электролизной плазмой дополнительные кислородсодержащие функциональные группы не являются активными центрами ЭП для редокс-системы Fe2+/3+. Необходимо отметить, что оценка k0 для более активных центров по величине ΔE ≈ 60–180 мВ дает величину, большую на ~3 порядка, чем для основной поверхности. В отличие от Fe2+/3+ для системы [Fe(CN)6]4–/3– после модификации ДБА-электрода происходит заметное уменьшение величины k0 от ~10–3 до ~10–4 см/с. Возможным объяснением этого эффекта является высказанное в [8] утверждение, что скорость ЭП для системы [Fe(CN)6]4–/3– чувствительна к морфологии поверхности, а не к наличию на ней функциональных групп.
ЗАКЛЮЧЕНИЕ
Показано изменение константы скорости электронного переноса для модельных редокс-реакций ([Ru(NH3)6]2+/3+, [Fe(CN)6]4–/3–, Fe2+/3+) в результате плазмоэлектрохимической обработки поверхности ДБА-электрода. Наблюдаемый разнонаправленный эффект обусловлен изменением морфологии и/или функционализацией поверхности ДБА кислородсодержащими группами.
Список литературы
Panizza, M. and Cerisola, G., Application of diamond electrodes to electrochemical processes, Electrochim. Acta, 2005, vol. 51, p. 191.
Кривенко, А.Г., Манжос Р.А., Кочергин, В.К. Влияние плазмоэлектрохимической обработки стеклоуглеродного электрода на обратимые и необратимые электродные реакции. Электрохимия. 2019. Т. 55. С. 854. [Krivenko, A.G., Manzhos, R.A., and Kochergin, V.K., Effect of Plasma-Assisted Electrochemical Treatment of Glassy Carbon Electrode on the Reversible and Irreversible Electrode Reactions, Russ. J. Electrochem., 2019, vol. 55, p. 663.]
Belkin, P.N., Yerokhin, A., and Kusmanov, S.A., Plasma electrolytic saturation of steels with nitrogen and carbon, Surface and Coatings Technology, 2016, vol. 307, p. 1194.
Кривенко, А.Г., Комарова, Н.С., Стенина, Е.В., Свиридова, Л.Н., Миронович, К.В., Шульга, Ю.М., Манжос, Р.А., Доронин, С.В., Кривченко, В.А. Электрохимическая модификация электродов на основе высокоориентированных углеродных наностенок. Электрохимия. 2015. Т. 51. С. 1090. [Krivenko, A.G., Komarova, N.S., Stenina, E.V., Sviridova, L.N., Mironovich, K.V., Shul’ga, Y.M., Manzhos, R.A., Doronin, S.V., and Krivchenko, V.A., Electrochemical modification of electrodes based on highly oriented carbon nanowalls, Russ. J. Electrochem., 2015, vol. 51, p. 963.]
Ghodbane, S., Ballutaud, D., Omnès, F., and Agnès, C., Comparison of the XPS spectra from homoepitaxial {111}, {100} and polycrystalline boron-doped diamond films, Diam. Relat. Mater., 2010, vol. 19, p. 630.
Hutton, L.A., Iacobini, J.G., Bitziou, E., Channon, R.B., Newton, M.E., and Macpherson, J.V., 2013. Examination of the factors affecting the electrochemical performance of oxygen-terminated polycrystalline boron-doped diamond electrodes, Anal. Chem., 2013, vol. 85, p. 7230.
Banks, C.E., Davies, T.J., Wildgoose, G.G., and Compton, R.G., Electrocatalysis at graphite and carbon nanotube modified electrodes: edge-plane sites and tube ends are the reactive sites, Chem. Commun., 2005, vol. 7, p. 829.
Novoselova, I.A., Fedoryshena, E.N., Panov, E.V., Bochechka, A.A., and Romanko, L.A., Electrochemical properties of compacts of nano- and microdisperse diamond powders in aqueous electrolytes, Phys. Solid State, 2004, vol. 46, p. 748.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия


