Электрохимия, 2021, T. 57, № 5, стр. 265-275
Электрохимический сенсор на основе гибридного материала магнитный Fe3O4–восстановленный оксид графена для высокочувствительного определения бинафтола
Э. Ватандост a, А. Горбани-Хасан Сараэй a, Ф. Чекин a, *, Ш. Нагизадэ Раэйси a, С.-А. Шахиди a
a Исламский университет Азад
Амол, Иран
* E-mail: fchekin@yahoo.com
Поступила в редакцию 12.06.2020
После доработки 26.08.2020
Принята к публикации 07.09.2020
Аннотация
Нафтол – высокотоксичный, вызывающий коррозию загрязнитель окружающей среды. Он может легко поглощаться организмом сквозь кожу и наносить существенный вред почкам и роговице и даже вызывать рак. Поэтому очень важно иметь устройство легкое в эксплуатации, надежное, недорогое и быстрое для определения нафтола. В настоящей работе восстановленный оксид графена, синтезированный в водном растворе в мягких условиях с использованием экстракта зеленого чая в качестве природного восстановителя и стабилизатора, декорирован наночастицами Fe3O4 диаметром около 25 нм. На основе гибрида Fe3O4–восстановленный оксид графена на угольно-пастовом электроде создан сенсор для высокочувствительного и избирательного определения бинафтола. Показано, что при окислении бинафтола в сенсоре Fe3O4–восстановленный оксид графена/угольно-пастовый электрод наблюдается синергетический эффект, если сравнивать с обычным угольно-пастовым электродом или с этим электродом, модифицированным восстановленным оксидом графена. Определение бинафтола методом дифференциальной импульсной вольтамперометрии дало наименьшую определяемую концентрацию 78 нM и область линейности электродной функции от 0.1 до 100 мкM. Сенсор обладает высокой чувствительностью (160 мкA мM–1), стабильностью и хорошей воспроизводимостью. Более того, сенсор недорог и имеет хорошие перспективы для определения бинафтола в реальных образцах.
ВВЕДЕНИЕ
Нафтолы – загрязнители окружающей среды, содержащие функциональную гидроксильную группу. Они широко применяются для получения красок для волос, красителей, косметики, полупродуктов, антибактериальных препаратов, строительных материалов, тканей, кож, сельскохозяйственных продуктов и продуктов питания [1]. Но эти реактивы даже в минимальных концентрациях могут оказывать сильное воздействие на кожу, глаза, почки и роговицу. Кроме того, они могут даже вызывать рак. Аналитические методы для определения нафтолов включают хроматографию, электрофорез, спектрофотомерию, флуориметрию и колориметрию [2]. Бинафтол – наиболее изученный представитель аксиально хиральных молекул, которые широко используются в качестве лигандов или хиральных вспомогательных реагентов в реакциях стереоселективного окисления или восстановления. Существует два оптических изомера бинафтола, который выступает в качестве прекурсора другого хирального лиганда. Бинафтол применяют в производстве различных типов лекарственных препаратов из-за его биоактивного каркаса [3]. Бинафтол также присутствует в антибактериальных соединениях, таких как хиральные бициклические макроциклы, дикатионные макроциклы на основе имидазола, хиральные дендримеры, соли имидазолия и диоксоциклоалкены [4–8]. До настоящего времени существуют считанные аналитические методы количественного определения бинафтола. Поэтому количественное определение бинафтола в следовых концентрациях – важная аналитическая задача, в частности вследствие необходимости избавить возможных потребителей от передозировки.
Электрохимические сенсоры обладают такими преимуществами, как простота, хорошая воспроизводимость, быстрое срабатывание и дешевизна. Они часто ассоциируются с низкой наименьшей определяемой концентрацией, что повышает интерес к электрохимическим методам [9, 10]. Непосредственное электрохимическое окисление бинафтола на большинстве обычных электродов протекает медленно и обычно требует относительно высоких потенциалов. По этой причине очень важно разработать быстрый, надежный и избирательный электрохимический метод определения бинафтола.
Недавно гибридные материалы на основе графена нашли “зеленые” применения в очистке воды, такие как адсорбция органических [11–13] и неорганических [14, 15] загрязнителей, технология мембран [16, 17] и катализ [18, 19]. Для полномасштабного производства предпочтительнее однореакторный синтез магнитного оксида графена и его композитов. Восстановленный оксид графена (rGO) был разработан как “доставщик” лекарств, обладающий рядом преимуществ, включая высокую электропроводность, активную поверхность, большое отношение площади поверхности к объему и прекрасные электрокаталитические свойства [20]. Гибридные материалы на основе наночастиц оксида графена получили применения, связанные с переносом электрона по причине синергетического эффекта, позволяющего получить больший результат, чем позволяют индивидуальные компоненты [21]. Нанокомпозит Fe3O4–rGO позволяет создать практически осуществимую биосовместимую микросреду, перспективную в качестве управляемого магнитным полем материала для электрохимических сенсоров [22]. В самое последнее время показано, что электрохимические сенсоры на основе нанокомпозитов с магнитным графеном хорошо пригодны для высокочувствительных определений и что область линейности их электродной функции распространяется на несколько порядков величины концентрации [23–25]. Модифицирование поверхности электрода нанокомпозитом на основе магнитного графена, прочно привязанным к поверхности, может сильно улучшить кинетику непосредственного переноса электрона и электрокаталитического поведения аналитов [26–28]. Для синтезирования частиц магнитного графена разработаны различные подходы, основанные на гидротермальных реакциях, прямом пиролизе и соосаждении. В этих методах происходит in situ кристаллизация магнитных наночастиц на слоях углеродистых материалов; полученный оксид графена легко превратить в rGO [29].
В настоящей работе разработан электрохимический сенсор на бинафтол (рис. 1). Выбран способ модифицирования поверхности угольно-пастового электрода – нанесение капли нанокомпозита Fe3O4–rGO. Предложенный сенсор позволяет просто и быстро определять бинафтол за короткое время и, таким образом, представляет интересную концепцию. С наименьшей определяемой концентрацией 78 нM и областью линейности до 100 мкM этот сенсор хорошо подходит для измерения концентрации бинафтола в реальных образцах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и приборы
Использованный в настоящей работе зеленый чай был приобретен на местном рынке (Рашт, Иран). Порошок оксида графена был приобретен у компании Iranian Nanomaterials Pioneers. Бинафтол (C20H14O2), ферроцианид(II) калия ([K4Fe(CN)6]), фосфорная кислота (H3PO4), дигидрофосфат натрия (NaH2PO4), гидрофосфат натрия (Na2HPO4), фосфат натрия (Na3PO4), порошок графита и гептагидрат сульфата железа(II) (FeSO4⋅7H2O) были приобретены у компании Sigma–Aldrich и использовались без дополнительной очистки. Инсектицид (Common) был приобретен на местном рынке (Амол, Иран). Образцы плазмы крови человека были любезно предоставлены клинической лабораторией города Амол. Их хранили при температуре 4°C.
SEM-микрофотографии были получены на автоэлектронном сканирующем микроскопе MIRATESCAN-XMU (Чешская республика), сопряженном с прибором для рентгеновской энергодисперсионной спектроскопии, укомплектованным эмиттером для термополевой эмиссии и тремя различными детекторами. В автоэлектронном сканирующем микроскопе электроны высвобождаются из источника полевой эмиссии и ускоряются в сильном электрическом поле. Эти первичные электроны фокусируются и отклоняются электронными линзами, образуя узкий луч, сканирующий облучаемый объект. В результате этого из каждого участка объекта излучаются вторичные электроны. Детектор поглощает вторичные электроны и выдает электронный сигнал. Этот сигнал усиливается и создает просканированное изображение. Электрохимические измерения выполняли на потенциостате/гальваностате Sama 500-c (Electrochemical Analysis system, Сама, Иран) в стандартной трехэлектродной ячейке с Ag|AgCl|KCl-электродом сравнения, платиновой проволочкой в качестве вспомогательного электрода и угольно-пастовым электродом с чистой поверхностью или модифицированым нанокомпозитом Fe3O4–rGO в качестве рабочего электрода. Рамановский анализ проводили на спектрометре комбинационного рассеяния Takram P50C0R10 (Тексан, Иран), используя лазер с длиной волны 532 нм и детектор с матрицей на приборах с зарядовой связью. Рентгено-дифракционный анализ проводили на рентгеновском дифрактометре Bruker D8-Advance (Германия).
Экологичный синтез восстановленного оксида графена
5 г зеленого чая смешивали с 30 мл дистиллированной воды в ультразвуковой бане (60 кГц) при 50°C в течение 40 мин. Образец фильтровали для того, чтобы отделить экстракт. 20 мг оксида графена обрабатывали ультразвуком в дистиллированной воде в течение 60 мин, к раствору дисперсного оксида графена прибавляли 20 мл экстракта зеленого чая. Смесь кипятили с дефлегматором в течение 6 ч при 50°C. Полученный продукт (rGO) несколько раз центрифугировали с водой и сушили в печи при 50°C в течение ночи. 10 мг rGO выдерживали в 20 мл дистиллированной воды в ультразвуковом поле в течение 40 мин, затем добавляли 10 мл 0.5 M раствора FeSO4⋅7H2O при помешивании. Значение pH раствора устанавливали равным 10 и нагревали в автоклаве из нержавеющей стали, выстеленном тефлоном, при 180°C в течение 8 ч. Полученный продукт (Fe3O4–rGO) промывали водой и сушили при 50°C в течение ночи.
Изготовление электрохимического сенсора на основе угольно-пастового электрода, модифицированного Fe3O4–rGO
Угольно-пастовый электрод готовили, как описано ранее [30, 31]. 0.5 г порошка графита (70% по весу) и 30% парафина смешивали вручную до тех пор, пока не получалась однородная по влажности паста. Угольную пасту вмазывали в стеклянную трубку (диаметром 3 мм). Электрическим контактом служила медная проволочка. Поверхность электрода обновляли, полируя ее на бумаге для взвешивания (не обладающей адсорбирующими свойствами). 1 мг нанокомпозита Fe3O4–rGO добавляли к 1 мл воды и помещали в ультразвуковое поле на 45 мин. 5 мл этого раствора наносили капельным способом на угольно-пастовый электрод и сушили в печи при 60°C в течение 1 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристики электрода
Электрохимическое поведение угольно-пастового электрода с чистой поверхностью и модифицированного восстановленным оксидом графена или нанокомпозитом Fe3O4–rGO исследовали в окислительно-восстановительной системе [Fe(CN)6]3–/4– методом циклической вольтамперометрии. Как показано на рис. 2a, окислительно-восстановительный ток заметно возрастает в присутствии Fe3O4–rGO – он больше, чем на угольно-пастовом электроде с чистой поверхностью или модифицированном rGO. Гибрид Fe3O4–rGO не только увеличивает площадь поверхности электрода, но также облегчает перенос электрона между аналитом и поверхностью электрода. Более того, присутствие наночастиц Fe3O4 на восстановленном оксиде графена увеличивает число активных мест и повышает электропроводность. Реальную площадь поверхности угольно-пастового электрода с чистой поверхностью и модифицированного rGO и Fe3O4–rGO определяли по наклону графика зависимости пикового тока в 5 мM растворе [Fe(CN)6]4– от корня квадратного из скорости развертки потенциала по формуле [32]
(1)
$A = {{{\text{наклон}}} \mathord{\left/ {\vphantom {{{\text{наклон}}} {\left( {268.6{{n}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}c} \right)}}} \right. \kern-0em} {\left( {268.6{{n}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}c} \right)}},$Рис. 2.
(a) Циклические вольтамперограммы, записанные на угольно-пастовом электроде с чистой поверхностью (a), модифицированном rGO (б) и модифицированном Fe3O4–rGO (в) в растворе [Fe(CN)6]3–/4– (5 мM) в фосфатном буферном растворе (0.1 M); (б) Рамановские спектры оксида графена (a), rGO (б) и Fe3O4–rGO (в). (в) Рентгеновская дифрактограмма Fe3O4–rGO.

Для характеристики оксида графена, восстановленного оксида графена и композита Fe3O4–rGO применяли также рамановскую спектроскопию (рис. 2б). В спектрах оксида графена наблюдаются полосы D и G при 1334 и 1577 cм–1; отношение их интенсивностей (ID/IG) равняется 1.08. В то же время в спектрах восстановленного оксида графена полосы D и G сдвинулись к 1350 и 1582 cм–1, а отношение ID/IG выросло до 1.21 вследствие снижения числа кислородсодержащих функциональных групп. Композит же Fe3O4–rGO демонстрирует полосы D и G при 1381 и 1580 cм–1, а величина ID/IG равна 0.76, т.е. после декорирования нанолистов восстановленного оксида графена наночастицами Fe3O4 она снизилась. Это означает, что между наночастицами Fe3O4 и восстановленным оксидом графена существует не только физическая адсорбция, но устанавливаются и химические взаимодействия.
Рентгено-дифракционный анализ – эффективный метод исследования изменений во внутренних слоях и кристаллических свойств синтезированных образцов. На рис. 2в дана рентгеновская дифрактограмма композита Fe3O4–rGO. Видно, что дифракционные пики наночастиц Fe3O4 при 32°, 36°, 37°, 44°, 52°, 57° и 64° для плоскостей (220), (311), (222), (400), (422), (511) и (440) находятся в хорошем согласии с гранецентричной кубической структурой шпинели (JCPDS card no. 65-3107). Существенно, что другие пики, например примесей, отсутствуют, что указывает на высокую фазовую чистоту кубического Fe3O4.
Морфологию восстановленного оксида графена и композита Fe3O4–rGO исследовали методом автоэлектронной сканирующей электронной микроскопии. Как видно на рис. 3, поверхность восстановленного оксида графена волнистая, со сморщенными краями. Напротив, поверхность композита Fe3O4–rGO показывает листы восстановленного оксида графена, декорированные наночастицами Fe3O4 сферической формы диаметром около 25 нм. Метод энергорассеивающей рентгеновской спектроскопии обнаружил в восстановленном оксиде графена только элементы C (68%) и O (28%), в то время, как нанокомпозит Fe3O4–rGO содержит C (22%), O (38%) и Fe (38%), подтверждая факт декорирования восстановленного оксида графена наночастицами Fe3O4.
Электрохимическое определение бинафтола
Электрохимическое поведение угольно-пастового электрода с чистой поверхностью и модифицированного восстановленным оксидом графена и нанокомпозитом Fe3O4–rGO исследовали в отношении электрохимического окисления 0.1 мM раствора бинафтола в 0.1 M фосфатном буферном растворе (pH 7.0) и 0.1 M растворе KCl, используя циклическую вольтамперометрию (рис. 4a). Видно, что пик тока окисления бинафтола выше всего на угольно-пастовом электроде с нанокомпозитом Fe3O4–rGO, т.е. комбинация нанолистов восстановленного оксида графена с наночастицами Fe3O4 существенно ускоряет окисление бинафтола. Это говорит о том, что π‒π-стэкинг-взаимодействие (в спирали между уложенными в стопку молекулами) между большой π-сопряженной структурой восстановленного оксида графена и бинафтолом и водородное связывание действуют эффективно.
Рис. 4.
(a) Циклические вольтамперограммы, записанные на угольно-пастовом электроде с чистой поверхностью (a), модифицированном Fe3O4 (б), модифицированном rGO (в) и модифицированном Fe3O4–rGO (г) в 0.1 M фосфатном буферном растворе (pH 7.0) и 0.1 M растворе KCl в присутствии 0.1 мM бинафтола при скорости развертки потенциала 50 мВ с–1. (б) Зависимость пикового тока от pH. (в) Циклические вольтамперограммы 0.01 мM бинафтола в 0.1 M фосфатном буферном растворе (pH 7.0) и 0.1 M растворе KCl в качестве индифферентного электролита, снятые на угольно-пастовом электроде, модифицированном Fe3O4–rGO, при различной скорости развертки потенциала: (a) 25, (б) 50, (в) 75, (г) 100 и (д) 150 мВ с–1. Врезка: зависимость пикового тока от скорости развертки потенциала.
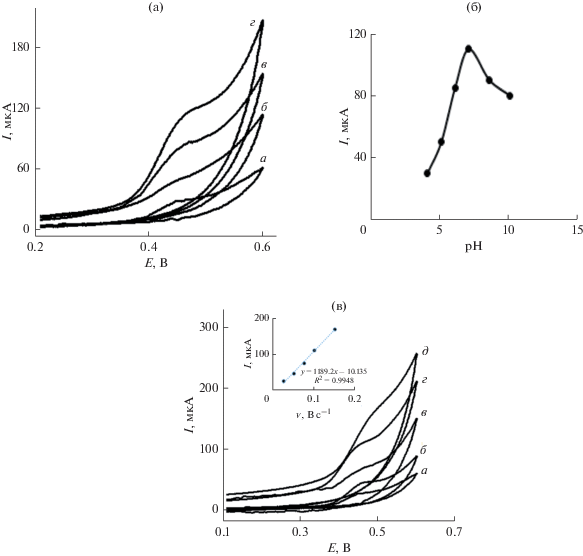
Хорошо известно, что электрохимическое поведение бинафтола зависит от величины pH водного раствора. Поэтому мы исследовали влияние pH на электроокисление бинафтола на угольно-пастовом электроде с нанокомпозитом Fe3O4–rGO в фосфатных буферных растворах с различными значениями pH (рис. 4б). Видно, что с ростом pH от 4.0 до 7.0 ток окисления бинафтола увеличивается, а при pH больше 7.0 он начинает снижаться. Поэтому величина pH 7.0 была выбрана как оптимальная, и дальнейшие исследования проводили именно при pH 7.0.
Было также исследовано влияние скорости развертки потенциала на ток окисления бинафтола. На рис. 4в представлен график соотношения между пиковым током и скоростью развертки потенциала в области от 25 до 150 мВ с−1. Видно, что между пиковым током окисления (Ipa) и скоростью развертки потенциала (v) существует хорошее линейное соотношение (врезка на рис. 4в). Уравнение линейной регрессии таково: Ipa (мкA) = = 1189.2v (В с–1) – 10.1 (r2 = 0.995); оно указывает на протекание электрохимического процесса, контролируемого адсорбцией.
Подтверждение эффективности предложенного метода
Для определения бинафтола при возрастающей его концентрации был использован метод дифференциальной импульсной вольтамперометрии в оптимальных условиях (0.1 M фосфатный буферный раствор, pH 7.0) (рис. 5а). Для области концентраций от 0.1 до 100 мкM получено соотношение I (мкA) = 10.43 + 0.16 × [бинафтол] (мкM) (рис. 5б) с коэффициентом корреляции 0.9947. Наименьшая определяемая концентрация (LOD) равняется 78 нM с чувствительностью 160 мкA мM–1, согласно следующему уравнению:
(2)
${\text{LOD}} = {{2{{S}_{{\text{b}}}}} \mathord{\left/ {\vphantom {{2{{S}_{{\text{b}}}}} m}} \right. \kern-0em} m},$Рис. 5.
(a) Дифференциальные импульсные вольтамперограммы, записанные на угольно-пастовом электроде, модифицированном Fe3O4–rGO, в 0.1 M фосфатном буферном растворе (pH 7.0) при добавлении порций раствора бинафтола, мкМ: (a) 0.1, (б) 0.5, (в) 1.5, (г) 5, (д) 15 , (е) 25, (ж) 45, (з) 70 и (и) 100. (б) Зависимость пикового тока окисления бинафтола от его концентрации.

Таблица 1.
Аналитические параметры вольтамперометрического определения бинафтола на различных модифицированных электродах
| Электрод | Аналит | Область линейности, мкM | LOD, нM | Ссылка |
|---|---|---|---|---|
| TF/GCE1 | 2-нафтол | 0.8–10 | 200 | [33] |
| HIF SnO2/GCE2 | 1-нафтол | – | 5 | [34] |
| HS-β-CD/AuNPs/HNCMS/GCE3 | 1-нафтол | 2–150 | 1 | [35] |
| HS-β-CD/AuNPs/HNCMS/GCE | 2-нафтол | 2–150 | 1.2 | [35] |
| DNA/GCE4 | 1-нафтол | 0.01–1.1 | 5 | [36] |
| Meзо-NiCo2O4/CPE5 | 1-нафтол | 0.02–20 | 7 | [37] |
| Meзо-NiCo2O4/CPE | 2-нафтол | 0.02–300 | 7 | [37] |
| CPT-BDDE6 | 1-нафтол | 0.2–3.85 | 50 | [38] |
| CPT-BDDE | 2-нафтол | 0.2–3.85 | 100 | [38] |
| NH2-SBA15/CPE7 | 1-нафтол | 0.01–1 | 1 | [39] |
| P3MT-нано-Au/GCE8 | 1-нафтол | 0.7–150 | 100 | [40] |
| P3MT-нано-Au/GCE | 2-нафтол | 0.7–150 | 300 | [40] |
| Fe3O4–rGO/CPE | бинафтол | 0.1–100 | 78 | Настоящая работа |
Плазма содержит воду, электролиты (Ca2+, K+, Na+, Mg2+, Cl– и ${\text{HCO}}_{3}^{ - }$), белки, растворенные газы, молекулы питательных элементов (глюкоза, аминокислоты) и отходы организма (мочевина и креатинин). По этой причине важно исследовать помехи определению бинафтола (10 мкM) на угольно-пастовом электроде, модифицированном Fe3O4–rGO, в 0.1 M фосфатном буферном растворе (pH 7.0), такие как глюкоза (Glu, 5 мM), мочевая кислота (UA, 200 мкM), цистеин (Cys, 250 мкM), лизин (Lys, 1 мM), Ca2+ (5 мM), K+ (5 мM), Na+ 130 мM), Mg2+ (100 мкM). Результаты (рис. 6а) показывают, что перечисленные соединения не мешают вольтамперометрическому определению бинафтола на угольно-пастовом электроде, модифицированном нанокомпозитом Fe3O4–rGO.
Рис. 6.
(a) Определение тока окисления бинафтола (10 мкM) в отсутствие и в присутствии различных потенциальных помех. (б) Воспроизводимость изготовления электрода для определения бинафтола в его 10 мкM растворе. (в) Оценка стабильности сенсора при определении бинафтола (10 мкM) за период 20 дней.

Воспроизводимость изготовления электрода для определения бинафтола можно выразить через относительное стандартное отклонение; оно равняется 4.3% при концентрации бинафтола 10 мкM (рис. 6б). Долговременную стабильность сенсора оценивали после его хранения в течение 20 дней при температуре 4°C: снижение тока в 10 мкM растворе бинафтола составило 6.9% (рис. 6в).
Точность предложенного метода оценивали, проводя эксперименты “введено–найдено” по извлечению введенного в раствор аналита (по методу стандартных добавок). К 0.1 M фосфатному буферному раствору, pH 7.0, добавляли известное количество чистого бинафтола, плазмы крови человека и инсектицида (Common). Были измерены средняя степень извлечения и ее относительное стандартное отклонение: соответственно, 92.8–104.7 и 3.8–5.4% (табл. 2). Эти результаты показывают, что предложенный метод способен точно определить любое малое изменение концентрации бинафтола в растворе.
ЗАКЛЮЧЕНИЕ
Разработан легкий метод синтеза восстановленного оксида графена (rGO) и его нанокомпозита с наночастицами Fe3O4. Поверхность электрода с нанесенным нанокомпозитом Fe3O4–rGO демонстрирует интенсивное электрохимическое окисление бинафтола благодаря своей большой удельной площади и высокой электропроводности, с наименьшей определяемой концентрацией 78 нM и областью линейности электродной функции 0.1–100 мкM. Этот электрохимический сенсор на основе Fe3O4–rGO обладает высокими чувствительностью, стабильностью и воспроизводимостью. Более того, данный подход к определению бинафтола имеет следующие преимущества: простота оборудования, отсутствие необходимости хроматографического разделения, потребность лишь в дешевых и коммерчески доступных реактивах. Все это делает его весьма перспективным для определения бинафтола в реальных образцах.
Список литературы
Busca, G., Berardinelli, S., Resini, C., and Arrighi, L., Technologies for the removal of phenol from fluid streams, J. Hazard. Mater., 2008, vol. 160, p. 265.
Ankireddy, A.R., Paidikondala, K., Gundla, R., Balaraju, T., Pagadala, R., and Banothu, V., Synthesis of new chiral ®-бинaфтoл derivatives under microwave irradiation and evaluation of their antibacterial and α-glucosidase inhibitory activity, Chem. Select, 2019, vol. 4, p. 5563.
Rajakumar, P., Selvam, S., Shanmugaiahb, V., and Mathivanan, N., Synthesis and antibacterial activity of some novel chiral fluorophoric biscyclic macrocycles, Bioorg. Med. Chem. Lett., 2007, vol. 17, p. 5270.
Rajakumar, P., Raja, R., Selvam, S., Rengasamy, R., and Nagaraj, S., Synthesis and antibacterial activity of some novel imidazole-based dicationic quinolinophanes, Bioorg. Med. Chem. Lett., 2009, vol. 19, p. 3466.
Thirunarayanan, A., Raja, S., Mohanrajb, G., and Rajakumar, P., Synthesis of chiral core based triazole dendrimers with m-terphenyl surface unit and their antibacterial studies, RSC Adv., 2014, vol. 4, p. 41778.
Jayanthi, M. and Rajakumar, P., Modulation of microbiota as treatment for intestinal inflammatory disorders, Int. J. Eng. Sci., 2016, vol. 3, p. 127.
Vidal, M., Elie, C.R., Campbell, S., Claing, A., and Schmitzer, A.R., Amphiphilic designer nano-carriers for controlled release: from drug delivery to diagnostics, Med. Chem. Commun., 2014, vol. 5, p. 436.
Ashok, D., Shravani, D., Sarasija, M., and Sudershan, K., Synthesis of Z-di/tetra/hexa/ydrodinaphtho[2,1-b:1',2'-d][1,6]dioxacycloalkenes via microwave-accelerated ring closing metathesis and their antimicrobial activity, Russ. J. Gen. Chem., 2015, vol. 85, p. 1152.
Amirighadi, S., Raoof, J.B., Chekin, F., and Ojani, R., A sensitive voltammetric detection of pramipexole based on 1,1,3,3-tetramethyldisilazanecarbon nanotube modified electrode, Mater. Sci. Eng. C, 2017, vol. 75, p. 784.
Hasanzadeh, M., Karimzadeh, A., Shadjiou, N., Mokhtarzadeh, A., Bagheri, L., Sadeghi, S., and Mahboob, S., Graphene quantum dots decorated with magnetic nanoparticles: synthesis, electrodeposition, characterization and application as an electrochemical sensor toward determination of some amino acids at physiological pH, Mater. Sci. Eng. C, 2016, vol. 68, p. 814.
Wu, T., Cai, X., Tan, S., Li, H., Liu, J., and Yang, W., Adsorption characteristics of acrylonitrile, p-toluenesulfonic acid, 1-naphthalenesulfonic acid and methyl blue on graphene in aqueous solutions, Chem. Eng. J., 2011, vol. 17, p.144.
Pavagadhi, S., Tang, A.L.L., Sathishkumar, M., Loh, K.P., and Balasubramanian, R., Removal of microcystin-LR and microcystin-RR by graphene oxide: adsorption and kinetic experiments, Water Res., 2013, vol. 47, p. 4621.
Cai, N. and Larese-Casanova, P., Sorption of carbamazepine by commercial graphene oxides: a comparative study with granular activated carbon and multiwalled carbon nanotubes, J. Colloid Interf. Sci., 2014, vol. 426, p. 152.
Zhao, G.X., Li, J.X., Ren, X.M., Chen, C.L., and Wang, X.K., Few-layered graphene oxide nanosheets as superior sorbents for heavy metal ion pollution management, Environ. Sci. Technol., 2011, vol. 45, p. 10454.
Fu, Y., Wang, J.Y., Liu Q.X., and Zeng H.B., Water-dispersible magnetic nanoparticle-graphene oxide composites for selenium removal, Carbon, 2014, vol. 77, p. 710.
Cohen-Tanugi, D. and Grossman, J.C., Water desalination across nanoporous graphene, Nano Lett., 2012, vol. 12, p. 3602.
Hu, M. and Mi, B.X., Enabling graphene oxide nanosheets as water separation membranes, Environ. Sci. Technol., 2013, vol. 47, p. 3715.
Gupta, V.K., Atar, N., Yola, M.L., Ustundag, Z., and Uzun, L., A novel magnetic Fe@Au core–shell nanoparticles anchored graphene oxide recyclable nanocatalyst for the reduction of nitrophenol compounds, Water Res., 2014, vol. 48, p. 210.
Huang, X., Wang, L.Y., Zhou, J.Z., and Gao, N.Y., Photocatalytic decomposition of bromate ion by the UV/P25-graphene processes, Water Res., 2014, vol. 57, p. 1.
Robinson, J.T., Perkins, F.K., Snow, E.S., Wei, Z., and Sheehan, P.E., Reduced graphene oxide molecular sensors, Nano Lett., 2008, vol. 8, p. 3137.
Anh Thu, N.T., Van Duc, H., Hai Phong, N., Duc Cuong, N., Vuong Hoan, N.T., and Quang Khieu, D., Electrochemical determination of paracetamol using Fe3O4/reduced graphene-oxide-based electrode, J. Nanomater., 2018, vol. 2018, p. 1.
Yu, L., Wu, H., and Wuetal, B., Magnetic Fe3O4-reduced graphene oxide nanocomposites-based electrochemical biosensing, Nano-Micro Lett., 2014, vol. 6, p. 258.
Fu, R. and Zhu, M., Synthesis and characterization of structure of Fe3O4@gheraphene oxide nanocomposites, Adv. Compos. Lett., 2016, vol. 25, p. 143.
Thangamuthu, M., Yu Hsieh, K., Kumar, P.V., and Chen, G.Y., Graphene and graphene-oxide-based nanocomposite platforms for electrochemical biosensing applications, Int. J. Mol. Sci., 2019, vol. 20, p. 2975.
Suhanto, R.N., Rahmawati, R., Setyorini, D.A., Noviandri, I., and Yuliart, B., Modified working electrode by magnetite nanocomposite for electrochemical sensor application, Mater. Sci. Eng., 2018, vol. 367, p. 012054.
Rani, G.J., Babu, K.J., and Rajan, M.J., Watsonia meriana flower like Fe3O4/reduced graphene oxide nanocomposite for the highly sensitive and selective electrochemical sensing of dopamine, J. Alloys Compd., 2016, vol. 688, p. 500.
Li, L., Gao, P., Gai, S., He, F., Chen, Y., Zhang, M., and Yang, P., Ultra small and highly dispersed Fe3O4 nanoparticles anchored on reduced graphene for supercapacitor application, Electrochim. Acta, 2016, vol. 190, p. 566.
Sun, Y., Zhang, W., Yu, H., Hou, C., Li, D., Zhang, Y., and Liu, Y., Controlled synthesis various shapes Fe3O4 decorated reduced graphene oxide applied in the electrochemical detection. J. Alloys Compd., 2015, vol. 638, p. 182.
Zhang, X., Jiang, B., Xie, Y., and Du, F., One-pot hydrothermal synthesis of Fe3O4/reduced graphene oxide nanocomposite for enhanced lithium storage, Indian J. Chem., 2014, vol. 53A, p. 265.
Nikkhah, Sh., Tahermansouri, H., and Chekin F., Synthesis, characterization, and electrochemical properties of the modified graphene oxide with 4,4'-methylenedianiline, Mater. Lett., 2018, vol. 211, p. 323.
Zareyy, B., Chekin, F., and Fathi, Sh., NiO/porous reduced graphene oxide as active hybrid electrocatalyst for oxygen evolution reaction, Russ. J. Electrochem., 2019, vol. 55, p. 333.
Hazhir, N., Chekin, F., Raoof, J.B., and Fathi, Sh., Porous reduced graphene oxide/chitosan-based nanocarrier for delivery system of doxorubicin, RSC Adv., 2019, vol. 9, p. 30729.
Tsai, M.Ch., Electrochemical detection of 2-naphthol at a glassy carbon electrode modified with Tosflex film, Electroanal., 2007, vol. 19, p. 1315.
Zhao, G., Liu, M., Li, F., Qiao, J., and Zhao, S., Highly sensitive electrochemical determination of 1-naphthol based on high-index facet SnO2 modified electrode, Electrochim. Acta, 2012, vol. 83, p. 478.
Zhu, G., Gai, P., Yang, Y., Zhang, X., and Chen, J., Electrochemical sensor for naphthols based on gold nanoparticles/hollow nitrogen-doped carbon microsphere hybrids functionalized with SH-β-cyclodextrin, Anal. Chim. Acta, 2012, vol. 723, p. 33.
Zhao, J., Hu, G.Z., Yang, Z.S., and Zhou, Y.Y., Determination of 1-naphthol with denatured DNA–modified pretreated glassy carbon electrode, Anal. Lett., 2007, vol. 40, p. 459.
Zhang, J., Mei, Q., Ding, Y., Guo, K., Yang, X., and Zhao, J., Ordered mesoporous NiCo2O4 nanospheres as a novel electrocatalyst platform for 1-naphthol and 2-naphthol individual sensing application, ACS Appl. Mater. Interfaces, 2017, vol. 9, p. 29771.
Brocenschi, R.F., Silva, T.A., Lourencao, B.C., Fatibello-Filho, O., and Rocha-Filho, R.C., Use of a boron-doped diamond electrode to assess the electrochemical response of the naphthol isomers and to attain their truly simultaneous electroanalytical determination, Electrochim. Acta, 2017, vol. 243, p. 374.
Zheng, X., Duan, Sh., Liu, Sh., Wei, M., Xia, F., Tian, D., and Zhou, Ch., Sensitive and simultaneous method for the determination of naphthol isomers by an amino-functionalized, SBA-15-modified carbon paste electrode, Anal. Methods, 2015, vol. 7, p. 1.
Li, L., Liu, E., Wang, X., Chen, J., and Zhang, X., Simultaneous determination of naphthol isomers at poly(3-methylthiophene)-nano-Au modified electrode with the enhancement of surfactant, Mater. Sci. Eng. C, 2015, vol. 53, p. 36.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




