Электрохимия, 2021, T. 57, № 6, стр. 355-376
Электрохимические и транспортные характеристики мембранных систем при электронанофильтрационном разделении растворов, содержащих нитрат аммония и сульфат калия
С. И. Лазарев a, **, С. В. Ковалев a, b, *, Д. Н. Коновалов a, П. Луа a, c
a Тамбовский государственный технический университет, Технологический институт
Тамбов, Россия
b Тамбовский государственный университет им. Г.Р. Державина, Институт математики, физики
и информационных технологий
Тамбов, Россия
c Университет Конакри им. Гамаль Абдель Насер, Политехнический институт
Конакри, Гвинея
** E-mail: mig@tstu.ru
* E-mail: sseedd@mail.ru
Поступила в редакцию 14.04.2020
После доработки 18.11.2020
Принята к публикации 04.12.2020
Аннотация
Проведены экспериментальные исследования электрохимических, транспортных характеристик систем, оснащенных мембранами ОПМН-П, ОФАМ-К, при эксплуатации в электронанофильтрационной ячейке. Выявлены причины изменения характеристик мембранных систем при воздействии различных факторов в процессе электронанофильтрации растворов, моделирующих ионный состав гальванического производства и минеральных удобрений, содержащих нитрат аммония, сульфат калия, и технологического раствора гальванического производства АО “ТАГАТ” имени С.И. Лившица. Показано, что изменение локальной электропроводности раствора в межмембранном канале и, как следствие, возрастание плотности тока при электронанофильтрации исследуемых растворов связано с дросселированием в электрохимической ячейке и разогревом раствора. Анализ электрохимических характеристик систем при электронанофильтрации технологического раствора гальванического производства выявил период деградации активного слоя полупроницаемой мембраны ОПМН-П (15–30 В), что объясняется превышением паспортной величины рабочего диапазона pH > 12. Отмечено, что увеличение транспортных характеристик мембранных систем при электронанофильтрации водных растворов (нитрат аммония, нитрат аммония и сульфат калия) связано с повышением перепада давления. Увеличение напряжения в электронанофильтрационной ячейке приводит к уменьшению удельного выходного потока для прианодной мембраны ОФАМ-К и увеличению для прикатодной мембраны ОПМН-П, что связано со смещением величины pH прианодного пермеата в кислую среду, а прикатодного пермеата – в щелочную среду. Показано, что при электронанофильтрации технологического раствора гальванического производства на поверхности прикатодной мембраны ОПМН-П образуются осадки ${\text{Fe(OH}}{{{\text{)}}}_{2}} \downarrow $, ${\text{Fe(OH}}{{{\text{)}}}_{3}} \downarrow $ вследствие пересыщения, которые выступают в качестве сорбционного поглотителя Zn2+; [Zn(OH)4]2– и др. ионов при постоянном перепаде давления Р = 1.6 МПа, что приводит к образованию динамической мембраны. На основе анализа экспериментальных данных, полученных при мембранном разделении исследуемых растворов при действии перепада давления и напряжения, предложены эмпирические уравнения для расчета удельного выходного потока и коэффициента задержания.
ВВЕДЕНИЕ
В химической, машиностроительной и других отраслях промышленности существует проблема по эффективному разделению технологических растворов и сточных вод, содержащих в своем составе однозарядные и многозарядные ионы, которая традиционно решается при использовании химических (реагентных), физико-химических (обратный осмос, нанофильтрация), а также некоторых электрохимических методов, например электродиализа и других процессов [1–14].
Технологические растворы и сточные воды машиностроительного, химического и других производств образуются на промежуточных или конечных стадиях получения целевых продуктов, например в гальванотехнике, производстве минеральных удобрений (сульфат цинка, сульфат калия, нитрат аммония (аммиачная селитра), азотная кислота) и других соединений.
Компоненты подобных соединений и они сами, содержатся в технологических жидкостях и сточных водах, например АО “ТАГАТ” им. С.И. Лившица, табл. 1 [15].
Таблица 1.
Средний компонентный состав сточных вод АО “ТАГАТ” им. С.И. Лившица за 2018 г.
| Наименование компонента | Концентрация, кг/м3 |
|---|---|
| ${\text{NH}}_{4}^{ + }$ | 0.00136 |
| Feобщ | 0.00068 |
| Zn2+ | 0.00034 |
| ${\text{PO}}_{4}^{{3 - }}$ | 0.00058 |
| ${\text{SO}}_{4}^{{2 - }}$ | 0.05090 |
| Ni2+ | 0.00006 |
| Cu2+ | 0.00002 |
| Cr6+ | 0.00001 |
| Cr3+ | 0.00001 |
На производствах по выпуску минеральных удобрений в результате технологических операций жидкая фаза обогащается ионами, поэтому подобные растворы необходимо разделять и утилизировать по малоотходной и безотходной схеме [16].
Проблема образования технологических растворов и сточных вод с содержанием подобных компонентов присуща и производству ОАО “Мин-удобрения”, г. Россошь, табл. 2 [17].
Таблица 2.
Компонентный состав азотсодержащих сточных вод производства минеральных удобрений ОАО “Минудобрения”, г. Россошь (pH 6.5–8.5)
| Наименование компонента | Интервал концентрации, кг/м3 |
|---|---|
| ${\text{NH}}_{4}^{ + }$ | 0.05–0.2 |
| ${\text{NO}}_{3}^{ - }$ | 0.02–0.12 |
| ${\text{PO}}_{4}^{{3 - }}$ | 0.0002–0.002 |
| Cl– | 0.0017–0.0075 |
| ${\text{SO}}_{4}^{{2 - }}$ | 0.0031–0.0118 |
| ${\text{NO}}_{2}^{ - }$ | 0.00024–0.0131 |
Необходимость перехода к эффективным методам разделения подобных растворов и сточных вод связана, в первую очередь, с перевооружением химических, машиностроительных и других производств из-за морального износа их очистного оборудования, а во вторую очередь, с повышенными требованиями надзорных органов РФ и других стран по остаточным показателям присутствия растворенных веществ в сбрасываемой с территории предприятия технологической воде.
Анализ литературных данных по исследованию транспортных и электрохимических характеристик электромембранных систем при обработке технологических растворов различных производств представлен в литературе [17–25].
В работе [17] приведены итоги электродиализных экспериментов азотсодержащих сточных вод АО “Минудобрения” (г. Россошь, Воронежская обл.). В результате исследований определена проходимость ионов аммония и нитрат-ионов через ионообменные мембраны, получены энергетические характеристики процесса. Выведены оптимальные условия электродиализной очистки.
В работе [18] приведены результаты исследований электродиализного разделения технологических жидкостей алкилароматической аминокислоты. В рассматриваемых концентрациях алкил-ароматической аминокислоты не наблюдается большого влияния на конечные параметры по неорганическим ионам, что подтверждается вольт-амперными характеристиками (ВАХ) анионообменных мембран. Однако добавка аминокислоты значительно изменяет длину плато на ВАХ ввиду частичного перехода мембраны в аминокислотную форму, сопровождающегося снижением электропроводности мембраны, и адсорбции ароматического соединения на поверхности, приводящей к ее гидрофобизации. Замечено изменение зависимостей потоков алкилароматической аминокислоты и рН в секции бо́льшей концентрации со стороны анионообменной мембраны от плотности тока при электродиализе: максимальный поток фенилаланина (тирозина) и первый изгиб на ВАХ соответствует увеличению рН.
В статье [19] дано описание изготовления композитных мембран на основе ионообменной мембраны МФ-4СК и полианилина с анизотропной структурой и различными ВАХ в результате воздействия внешнего электрического поля. В процессе изучения поведения композитных мембран получено, что при возрастании плотности тока при синтезе полианилина проводимость уменьшается, увеличивается гистерезис на циклической вольт-амперной кривой, растет асимметрия параметров ВАХ, и появляется псевдопредельный ток, возникающий в связи с внутренней биполярной границей.
Исследованию электропроводности ионообменных отечественных и зарубежных мембран при обработке технологических растворов заданной концентрации посвящена работа [20], где сделаны теоретические оценки электропроводности подобных мембран в широком диапазоне концентраций исследуемых жидкостей.
Электродиализ в опытных и промышленных производствах веществ для лекарственных средств и биопрепаратов [21] является перспективной и высоко-эффективной технологией в технических подходах к вопросам очистки получаемых реакционных растворов фармацевтических продуктов, требующих создания более экономичных, экологически чистых и интенсифицированных технологических процессов. Применение электродиализной технологии в производстве таурина позволило существенно модернизировать технологический процесс. Улучшение процесса очистки в производстве туберкулина и октанатриевой соли октакарбоксифталоцианина кобальта возможно при электродиализе. Электродиализное получение аминолевулиновой кислоты позволяет выделять дорогостоящий продукт из производственных растворов до 65–70%.
В статье [22] рассмотрено влияние факторов на величину интенсивности и процессов, протекающих при электроконвекции (ЭК), одними из которых являются электро- и геометрическая неоднородность поверхности мембран, гидрофобность, заряд. Кроме того, ЭК зависит и от таких факторов, как резкое повышение напряжения, скорость движения раствора. Определено положительное влияние ЭК на массоперенос, такое как повышение скорости, снижение осадкообразования.
В источнике [23] приведены экспериментальные исследования массообменных характеристик пилотного модуля EDC-II/125 и лабораторной ячейки EDC-Y, которые применяются в технологической схеме по переработке сокового пара аммиачной селитры. На основе параметров, полученных на лабораторной ячейке, с использованием метода компартментации можно проектировать массообменные характеристики промышленных электродиализаторов-концентраторов с гидравлически замкнутыми камерами концентрирования.
Электропроводность гетерогенных катионо- и анионообменных мембран МК-40 и МА-41 в растворе нитрата аммония при различных концентрациях рассмотрена в литературе [24]. В этой работе применен контактно-разностный метод замеров электросопротивления ионообменных мембран, позволяющий экспериментировать с малыми концентрациями внешнего равновесного раствора. Полученные электропроводности при низкой концентрации позволили вычислить коэффициенты диффузии ионов аммония и нитрат-ионов в мембранах. Также определены доли проводимости гелевой и межгелевой фаз при использовании микрогетерогенной двухфазной модели строения ионообменного материала.
Основой для определения микроструктуры неоднородных образцов является экспериментальная зависимость электропроводности ионообменных материалов от концентрации равновесного раствора. На расположение путей проводимости в композитном ионообменном материале влияет природа противоиона. Электропроводность гетерогенных катионо- и анионообменных мембран МК-40, МК-41, Ralex CМ(H)-PP, МА-41, Ralex AM(H)-PP в растворах нитрата аммония, нитрата калия и хлорида аммония рассмотрена в работе [25].
В работе [26] при проектировании технологической схемы переработки методом электродиализа конденсата сокового пара (КСП) сформулирована задача осуществления безреагентной и бессточной технологии, в которой обессоленный раствор возвращается в оборотную систему водоснабжения предприятия и для подпитки котлов, а концентрат используется при производстве жидких удобрений. Для этого уровень минерализации очищенной воды должен быть не более 0.003 г/л, а концентрат – 50–150 г/л. Результатом проведенных экспериментов является схема, в которой предельное электрохимическое концентрирование и глубокая деминерализация КСП обеспечиваются за счет использования электродиализаторов различной конструкции – ЕБ-П производства АО “МЕГА” (Чешская Республика) и насадочных ЭДН-1 и ЭДН-2 производства ООО Инновационное предприятие “Мембранная технология” (г. Краснодар, Россия), а процессы деминерализации и концентрирования проводятся в две ступени на трех группах указанных электродиализаторов.
После выполнения электрохимических операций нанесения защитных покрытий (цинкование, хромирование и др.) и проведения последующих процессов обработки деталей (мойка) образуются промывные технологические растворы, которые являются отработанными электролитами, так как содержат переносящие заряд компоненты (катионы и анионы ${\text{NH}}_{{\text{4}}}^{ + },$ Feобщ, Zn2+, ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }},$ ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ Ni2+ и др.).
Для эффективного разделения подобных технологических растворов и сточных вод с применением полупроницаемых мембран при воздействии на процесс напряжения и перепад давления предлагается осуществлять обработку раствора при помощи электронанофильтрации, так как данный процесс является безреагентным и экологически чистым. Для эффективной и оптимальной организации процесса электронанофильтрации в межмембранном канале с двумя полупроницаемыми стенками необходимо исследовать электрохимические и транспортные характеристики систем “раствор–мембрана”. При этом необходимо учитывать, что на электродах и в области открытых пор мембран (так как мембраны полупроницаемые) будут протекать электрохимические реакции, которые влияют на выбор и использование в экспериментах нанофильтрационных мембран.
Проведение процесса электронанофильтрационного разделения технологических растворов является достаточно интересной задачей, поскольку на систему “раствор–мембрана” действует сразу несколько движущих сил (перепад давления и электрическое напряжение). При этом в процессе нанофильтрации основным является конвективный перенос растворителя, а в электромембранном процессе – миграция заряженных частиц под действием электрического поля. Согласно [27], комбинацией таких процессов можно более эффективно отделять неэлектролит от электролита. В данной работе процесс электронанофильтрационного разделения проводится на технологическом растворе гальванического производства, который может содержать не только неорганические компоненты, но и органические, например блескообразователи.
Целью работы является исследование электрохимических и транспортных характеристик мембранных систем при электронанофильтрации растворов, моделирующих ионный состав растворов гальванических производств и минеральных удобрений, содержащих нитрат аммония, сульфат калия, а также реального технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица, г. Тамбов.
Для достижения поставленной цели решались следующие задачи:
1. Исследовать влияние совместного действия электрического напряжения и перепада давления, накладываемых на систему “раствор–мембрана”, оснащенную двумя нанофильтрационными мембранами ОПМН-П, ОФАМ-К при исследовании ВАХ, омических и транспортных характеристик.
2. Исследовать изменения омических и транспортных характеристик мембранных систем с ростом концентрации модельных и технологического растворов.
3. На основе анализа полученных экспериментальных зависимостей транспортных характеристик мембран предложить эмпирическое уравнение для расчета удельного выходного потока и коэффициента задержания.
МЕТОДИКА ЭКСПЕРИМЕНТА
Проведенный критический анализ образующихся на промышленных предприятиях РФ технологических растворов и сточных вод, содержащих различные токсичные соединения [15–17], а также литературный анализ, посвященный электрохимии мембранных систем при электродиализе [18–26], позволил определить объекты экспериментальных исследований. В качестве таковых были выбраны следующие водные растворы, содержащие нитрат аммония NH4NO3 (0.2, 0.4, 0.8 кг/м3), сульфат калия K2SO4 (0.04 кг/м3), раствор гальванического производства (см. табл. 1).
Другими объектами экспериментальных исследований являлись полупроницаемые полимерные промышленные нанофильтрационные мембраны (ОПМН-П, ОФАМ-К (НТЦ “Владипор”, г. Владимир).
В работах [28, 29] приведены рабочие характеристики мембран ОПМН-П, ОФАМ-К (табл. 3).
Таблица 3.
Рабочие характеристики мембран ОФАМ-К, ОПМН-П
| Тип мембраны | Рабочие характеристики мембран | ||||
|---|---|---|---|---|---|
| рабочее давление, МПа | производительность по воде, при Т = 298 К, м3/(м2 с) | коэффициент задержания по 0.15% NaCl | рабочий диапазон pH | максимальная температура, К | |
| ОФАМ-К | 3.0 | 2.22 × 10–5 | 0.95 | 2–12 | 323 |
| ОПМН-П | 1.6 | 2.77 × 10–5 | 0.55 | ||
Мембрана ОФАМ-К среднего давления состоит из активного слоя, являющегося продуктом поликонденсации ароматического диамина (м-фенилендиамина) и производных ароматических дикарбоновых кислот (изофталевой кислоты) и пористой подложки из полипропилена или тканого лавсана; структура капиллярно-пальчиковая [28]. Нанофильтрационная композитная мембрана ОПМН-П состоит из активного слоя на полиамидной основе и пористой подложки из нетканого полипропилена; структура вакуольная с губчатой прослойкой [29].
Экспериментальные исследования при разделении электронанофильтрацией исследуемых растворов, образующихся на машиностроительных (гальванических) и химических производствах (минеральных удобрений), проводились на установке, схема которой подробно представлена в работе [30].
Перед проведением экспериментов по исследованию электрохимических и транспортных характеристик мембранных систем осуществляется подготовка мембран, которая заключается в следующем: визуально определяется место на полотне исследуемой мембраны без наличия дефектов (смятий, сжатий, трещин, порывов активного слоя и др.), проводится обрезка образца необходимой геометрической формы и размера; мембрана замачивается в растворе дистиллированной воды (на сутки); мембрана, в зависимости от необходимости расположения на конкретном электроде (анод или катод), предварительно обрабатывается разбавленным раствором кислоты (серная кислота, рН 5–6) или щелочи (гидроксид натрия, рН 9) и проводится промывка дистиллированной водой; образец мембраны располагается в баромембранной ячейке установки для обжатия (при максимальном трансмембранном перепаде давления) при перекачивании дистиллированной воды; после проведения процесса обжатия мембран, они извлекаются и располагаются на пористом электроде-катоде и на пористом электроде-аноде электробаромембранной (электронанофильтрационной) ячейки; осуществляется сборка электробаромембранной ячейки с прикатодными и прианодными мембранами.
Основным элементом схемы установки для обработки технологических растворов исследуемых производств являлась электронанофильтрационная ячейка плоскокамерного типа, оснащенная заданными типами нанофильтрационных мембран.
Электронанофильтрационная ячейка (рис. 1) состоит из камеры корпуса 1 с штуцерами ввода исходного (технологического) раствора 3 и вывода ретентата 4, двух крышек 2 с тремя штуцерами для слива пермеата 8, расположенными по вертикали на осевой линии на равном расстоянии друг от друга, цилиндрических каналов ввода и вывода исходного раствора 14 и ретентата 15 соответственно.
Уплотнение камеры корпуса 1 с двумя крышками 2 осуществлено по плоской посадочной прямоугольной поверхности типа “выступ–впадина” через прокладку 13, опирающуюся на мембрану 9, 20 при затягивании шпилек 5 с шайбами 6 и гайками 7. На внутренней стороне крышек 2 имеется прямоугольная посадочная поверхность под дренажные сетки 12, 22 и поверхность большей прямоугольной формы под пористую металлическую подложку 11, 21, которая последовательно прижимает ватман 10 к мембране 9, 20.
Также элементами аппарата являются электрические провода 17, 19 (работающие как электрические проводники), металлические пластины 18 (для предотвращения нежелательных сколов крышек 2 в результате механической затяжки), прианодная и прикатодная мембрана 9 и 20, прианодная и прикатодная пористая металлическая подложка 11 и 21, прианодная и прикатодная дренажная сетка 12 и 22 соответственно.
Основным материалом, из которого были изготовлены детали электронанофильтрационной ячейки, являлся диэлектрик – капролон.
Электронанофильтрационная ячейка для разделения технологических растворов исследуемых производств функционирует следующим образом: раствор подается через штуцер ввода исходного раствора 3, и по цилиндрическим каналам ввода исходного раствора 14 поступает между прианодной и прикатодной мембраной 9, 20 и камерой корпуса 1, равномерно распределяется по всей площади плоского канала, затем отводится через цилиндрический канал вывода ретентата 15 и штуцер вывода ретентата 4. Некоторая часть раствора под действием избыточного давления проникает через прианодную и прикатодную мембраны 9, 20, ватман 10, прианодную и прикатодную пористые металлические подложки 11, 21, прианодную и прикатодную дренажную сетку 12, 22 соответственно и по каналам 16 штуцеров для слива пермеата 8 на крышках 2 отводится из аппарата.
Измерение перепада давления в системе установки осуществляется при помощи манометра (ОБМ 1-160), установленного в трубопроводе подачи разделяемого раствора (перед электронанофильтрационной ячейкой). Регулировка напряжения осуществляется при помощи источника питания постоянного тока (обозначение Б5-29), присоединенного посредством электрических проводов к электронанофильтрационной ячейке, на которых типовым образом (для электрической цепи) размещены вольтметр и амперметр для измерения значений напряжения и силы тока электромембранной системы.
При исследовании ВАХ электромембранных систем на титановые пористые платинированные анод и катод (толщина 2 мм) ступенчато подается напряжение от источника питания постоянного тока и измеряется сила тока в цепи при продолжительности эксперимента 600 с. На основе полученных значений силы тока и варьируемому напряжению (1–30 В) осуществляется построение графических зависимостей ВАХ.
Электронанофильтрационная ячейка в электрической схеме установки размещена как нагрузка. Поэтому на основе закона Ома рассчитывается омическая характеристика (1) мембранной системы “раствор–мембрана”:
Транспортные характеристики через мембраны (удельный выходной поток) при действии перепада давления и напряжения рассчитываются по формуле (2) [31, 32]:
где V – объем собранного пермеата, м3; Fм = = 0.0078 – рабочая площадь мембраны, м2; τ – время проведения эксперимента, с.Экспериментальное значение коэффициента задержания мембран определяется по формуле [31, 32]:
где $c,$ ${{c}_{{{\text{пер}}}}}$ – концентрация растворенного вещества в исходном растворе и пермеате.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ВАХ системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами при разделении модельных и технологических растворов, показаны на рис. 2–4.
Рис. 2.
ВАХ системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении водного раствора нитрата аммония с = 0.2 кг/м3 (а), с = 0.4 кг/м3 (б), с = 0.8 кг/м3 (в) от перепада давления Р : 1 – 1.0; 2 – 1.2; 3 – 1.7; 4 – 2.0; 5 – 2.4 МПа соответственно.

Рис. 3.
ВАХ системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении водного раствора нитрата аммония с = 0.2 кг/м3 (а), с = 0.4 кг/м3 (б), с = 0.8 кг/м3 (в) и сульфат калия (0.04 кг/м3) от перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7; 4 – 2.0; 5 – 2.4 МПа соответственно.
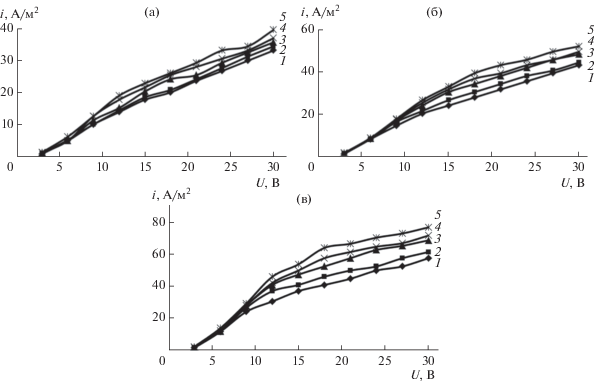
Рис. 4.
ВАХ системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица от перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7; 4 – 2.0; 5 – 2.4 МПа соответственно.

Омические характеристики исследуемой экспериментально системы, оснащенной двумя мембранами ОФАМ-К и ОПМН-П, представлены на рис. 5–7.
Рис. 5.
Омические характеристики мембранной системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении водного раствора нитрата аммония с = 0.2 кг/м3 (а), с = 0.4 кг/м3 (б), с = 0.8 кг/м3 (в) от напряжения и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7; 4 – 2.0; 5 – 2.4 МПа соответственно.
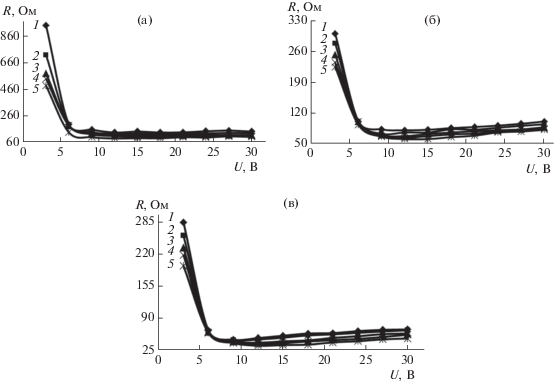
Рис. 6.
Омические характеристики мембранной системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении водного раствора нитрата аммония с = 0.2 кг/м3 (а), с = 0.4 кг/м3 (б), с = 0.8 кг/м3 (в) и сульфат калия (0.04 кг/м3) от напряжения и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7; 4 – 2.0; 5 – 2.4 МПа соответственно.
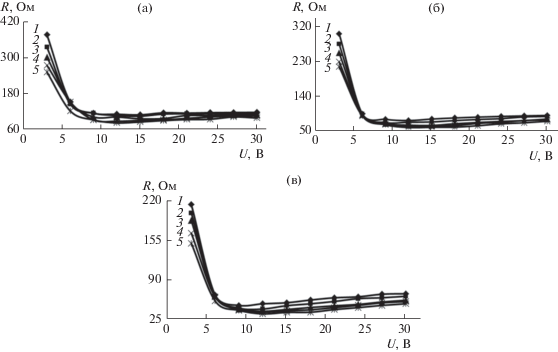
Рис. 7.
Омические характеристики мембранной системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица от напряжения и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7; 4 – 2.0; 5 – 2.4 МПа соответственно.
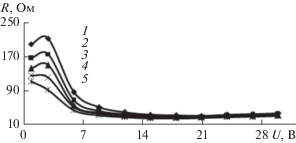
Описание полученных экспериментальных зависимостей ВАХ, омических характеристик мембранных систем может быть сделано с использованием подхода, применяемого в теории и практике электродиализных процессов [33, 34].
Анализ ВАХ, омических характеристик мембранных систем при разделении нитрата аммония, нитрата аммония и сульфата калия (рис. 2, 3, 5, 6) показал, что их условно можно разделить на два периода при действии напряжения: от 3 до 9 В (первый) и от 9 до 30 В (второй). Первый – запредельный режим, диссоциация воды (H+ и OH–) на границе раздела фаз “раствор–мембрана” с появлением дополнительных переносчиков электрического тока, второй – деградация активного слоя полупроницаемой мембраны, в связи с превышением паспортной величины рабочего диапазона pH исследуемых мембран (см. табл. 3, рабочий диапазон 2–12).
Для ВАХ, омических характеристик системы “мембрана–раствор” (рис. 2–7) отмечается, что чем больше концентрация водного исследуемого раствора, тем электропроводность исследуемых систем выше, что может быть связано с процессом дросселирования раствора и его разогревом. Отмечается, что с ростом концентрации водного раствора нитрата аммония, нитрата аммония и сульфата калия (рис. 2, 3) на ВАХ наблюдается перегиб при переходе от первого участка ко второму, что может быть связано с реактивностью электромембранной системы, содержащей большее количество ионов в растворе по сравнению с начальной концентрацией растворенного вещества, приводящей к интенсивной деградации поверхности мембраны ОПМН-П (вероятно, из-за частичного деградирования пор на активном слое мембраны) и интенсивному снижению общей электропроводности мембранной системы “мембрана–раствор”, при переходе от одной концентрации к другой, приводящей к изменению электроосмотического потока [34, 35].
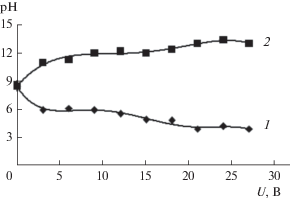
Для технологического раствора гальванического производства АО “ТАГАТ” имени С.И. Лившица (рис. 4, 7), отмечаются следующие характерные периоды на ВАХ и омических характеристиках (участок плато (1–3 В) (отмечается на вставке ВАХ в увеличенном масштабе, рис. 4), запредельный режим (3–15 В) и деградация активного слоя полупроницаемой мембраны ОПМН-П (15–30 В), при изменении pH (рис. 8) прикатодных и прианодных пермеатов).
Рис. 8.
Зависимость величины рН пермеата для прианодной ОФАМ-К (1), прикатодной ОПМН-П (2) мембран от напряжения с постоянным перепадом давления P = 1.6 МПа при разделении технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица.
При увеличении перепада давления в исследуемом интервале и варьировании напряжения от 3 до 30 В ВАХ мембранной системы, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, при разделении модельных и технологических растворов отмечается уменьшение общего омического сопротивления системы, что связано с процессом дросселирования раствора в электрохимической ячейке и тепловыделением.
Под процессом дросселирования раствора понимается проведение эксперимента при работе под избыточным давлением (в интервале перепада давления P = 1.0–2.4 МПа для каждой серии экспериментов) с перекрытием части проходного сечения регулировочных вентилей, установленных после электронанофильтрационной ячейки, при циркуляции раствора по тракту ретентата. При этом переход от одного давления к другому и т.д., при варьировании напряжения от 3 до 30 В для всех серий экспериментов, позволяет уплотнять (ужимать, усаживать) полимерный материал мембран [36, 37]. Таким образом, дросселирование раствора и уплотнение материала мембран (в том числе и пор) в электронанофильтрационной ячейке позволяет увеличить гидродинамическое сопротивление в межмембранном канале, приводит к увеличению концентрации исследуемых ионов (${\text{NH}}_{{\text{4}}}^{ + },$ ${\text{NO}}_{{\text{3}}}^{--},$ ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ Zn2+, ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ и др. ионов, полученных в том числе в результате диссоциации воды (Н+ и ОН–), что влияет на изменение локальной электропроводности раствора в межмембранном канале подобного устройства, приводящей к возрастанию плотности тока (для каждой серии экспериментов при действии перепада давления).
Интервал 0–1 В представляет собой линейный участок, определяемый начальным сопротивлением, зависящим от перенапряжения процесса электролиза воды, сопротивления обеих мембран в электронанофильтрационнной ячейке (ОПМН-П и ОФАМ-К) и омического сопротивления многокомпонентного раствора в межмембранном канале. Данный участок из рассмотрения исключается, так как основной интерес представляет величина предельной диффузионной плотности тока, которая связана с видом зависимости i–f(U).
Экспериментальные транспортные характеристики (удельного выходного потока) от плотности тока при варьировании перепада давления при разделении исследуемых растворов на мембранах ОФАМ-К, ОПМН-П представлены на рис. 9–15.
Рис. 9.
Удельный выходной поток для прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении водного раствора нитрата аммония (с = 0.2 кг/м3) от плотности тока и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.4; 4 – 1.7 МПа соответственно (здесь и далее сплошная линия – эксперимент; штриховая линия – расчет).

Рис. 10.
Удельный выходной поток для прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении водного раствора нитрата аммония (с = 0.4 кг/м3) от плотности тока и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.4; 4 – 1.7 МПа соответственно.

Рис. 11.
Удельный выходной поток для прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении водного раствора нитрата аммония (с = 0.8 кг/м3) от плотности тока и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.4; 4 – 1.7 МПа соответственно.

Рис. 12.
Удельный выходной поток для прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении водного раствора, содержащего нитрат аммония (с = 0.2 кг/м3) и сульфат калия (с = 0.04 кг/м3), от плотности тока и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7 МПа соответственно.

Рис. 13.
Удельный выходной поток для прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении водного раствора, содержащего нитрат аммония (с = 0.4 кг/м3) и сульфат калия (с = 0.04 кг/м3), от плотности тока и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7 МПа соответственно.

Рис. 14.
Удельный выходной поток для прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении водного раствора, содержащего нитрат аммония (с = 0.8 кг/м3) и сульфат калия (с = 0.04 кг/м3), от плотности тока и перепада давления Р: 1 – 1.0; 2 – 1.2; 3 – 1.7 МПа соответственно.

Рис. 15.
Удельный выходной поток для прианодной ОФАМ-К (1) и прикатодной ОПМН-П (2) мембран при разделении технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица от плотности тока с постоянным перепадом давления Р = 1.6 Мпа.

Анализ зависимостей удельного выходного потока прианодных и прикатодных мембран при разделении исследуемых растворов (рис. 9–14) показал, что на основе ранее высказанного утверждения общая электропроводность мембранной системы влияет также и на транспортные характеристики процесса электронанофильтрации.
Проводя анализ зависимостей удельного выходного потока мембранной системы (рис. 9–14), при разделении технологических растворов отмечается, что с ростом перепада давления увеличивается удельный выходной поток. Это связано с возрастанием одной из движущих сил процесса электробаромембранного разделения исследуемых растворов.
При разделении исследуемых водных растворов (нитрат аммония, нитрат аммония и сульфат калия) (рис. 9–14) для прианодной мембраны ОФАМ-К отмечается, что с ростом плотности тока происходит уменьшение удельного выходного потока, что связано с изменением величины pH прианодного пермеата (его смещение в кислую среду), а для прикатодной мембраны ОПМН-П отмечается увеличение удельного выходного потока (изменение величины pH прикатодного пермеата, смещение в щелочную среду) и влиянием электроосмотического потока на процесс разделения исследуемых растворов.
Для технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица (рис. 15) с ростом плотности тока удельный выходной поток снижается для прианодной ОФАМ-К, прикатодной ОПМН-П мембран, это, вероятно, связано с газообразованием и частичным блокированием отложений гидроксидов металлов и солями жесткости поверхности мембран [38].
На основе анализа экспериментальных данных, полученных при мембранном разделении исследуемых растворов при действии перепада давления и напряжения, предложено эмпирическое уравнение для расчета удельного выходного потока:
(4)
${{J}_{{{\text{расч}}}}} = m{{\alpha }_{0}}\Delta P{{\left( {\frac{i}{{{{i}_{{{\text{пром}}}}}}}} \right)}^{n}}{{\left( {\frac{c}{{{{c}_{{{\text{max}}}}}}}} \right)}^{k}},$Уравнение справедливо при баромембранном разделении растворов с условиями ($i \to $ 0, ${{i}_{{{\text{пром}}}}}$ > 0, $т$ > 0, $k$ > 0), а при электробаромембранном – ($i$ > 0, ${{i}_{{{\text{пром}}}}}$ > 0, $т$ > 0, $k$ > 0).
Для промышленного технологического раствора, с учетом его многокомпонентности, формула (4) примет вид:
(5)
${{J}_{{{\text{расч}}}}} = m{{\alpha }_{0}}\Delta P{{\left( {\frac{i}{{{{i}_{{{\text{пром}}}}}}}} \right)}^{n}}{{\left( {\frac{{\sum c }}{{\sum {{{c}_{{{\text{max}}}}}} }}} \right)}^{k}},$Эмпирические коэффициенты m, n, k для уравнений (4), (5) процесса электробаромембранного разделения исследуемых растворов приведены в табл. 4.
Таблица 4.
Эмпирические коэффициенты m, n, k для уравнений (4), (5) процесса электробаромембранного разделения исследуемых растворов
| Процесс разделения |
Раствор | Мембрана | m | n | K |
|---|---|---|---|---|---|
| Электробаро- мембранный (электронано-фильтрационный) | Водный раствор нитрата аммония (с = 0.2 кг/м3) |
ОФАМ-К (прианодная) | 0.910 | –0.045 | 1.189 |
| ОПМН-П (прикатодная) | 1.662 | 0.029 | 0.047 | ||
| Водный раствор нитрата аммония (с = 0.4 кг/м3) |
ОФАМ-К (прианодная) | 0.543 | –0.042 | 1.636 | |
| ОПМН-П (прикатодная) | 1.870 | 0.029 | 0.200 | ||
| Водный раствор нитрата аммония (с = 0.8 кг/м3) |
ОФАМ-К (прианодная) | 0.166 | –0.038 | 1.100 | |
| ОПМН-П (прикатодная) | 1.783 | 0.052 | 1.100 | ||
| Водный раствор нитрата аммония (с = 0.2 кг/м3) и сульфата калия (с = 0.04 кг/м3) |
ОФАМ-К (прианодная) | 0.85 | –0.049 | 1.259 | |
| ОПМН-П (прикатодная) | 0.662 | 0.141 | 2.475 | ||
| Водный раствор нитрата аммония (с = 0.4 кг/м3) и сульфата калия (с = 0.04 кг/м3) |
ОФАМ-К (прианодная) | 0.507 | –0.045 | 1.651 | |
| ОПМН-П (прикатодная) | 0.543 | 0.229 | 4.045 | ||
| Водный раствор нитрата аммония (с = 0.8 кг/м3) и сульфата калия (с = 0.04 кг/м3) |
ОФАМ-К (прианодная) | 0.162 | –0.047 | 1.100 | |
| ОПМН-П (прикатодная) | 0.068 | 0.405 | 1.100 | ||
| Технологический раствор АО “ТАГАТ” имени С.И. Лившица |
ОФАМ-К (прианодная) | 1.129 | –0.108 | 0.504 | |
| ОПМН-П (прикатодная) | 1.314 | –0.078 | 0.001 |
При увеличении перепада давления и напряжения интенсивность выделения катионов и анионов через прикатодную и прианодную мембраны возрастает.
Оценочные экспериментальные данные (коэффициент задержания) по разделению растворов АО “ТАГАТ” им. Лившица, г. Тамбов приведены для исследуемых ионов (рис. 16, 17).
Рис. 16.
Зависимость коэффициента задержания прикатодной ОПМН-П мембраны при разделении технологического раствора гальванического производства АО “ТАГАТ” имени С.И. Лившица от плотности тока с постоянным перепадом давления Р = 1.6 МПа по ионам: 1 – ${\text{PO}}_{4}^{{3 - }};$ 2 – Zn2+ .

Рис. 17.
Зависимость коэффициента задержания прианодной ОФАМ-К мембраны при разделении технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица от плотности тока с постоянным перепадом давления Р = 1.6 МПа по ионам ${\text{PO}}_{4}^{{3 - }}.$

При этом ионы ${\text{NH}}_{{\text{4}}}^{ + }$ в дальнейшем при количественных анализах не исследовались, так как предполагалось, что при электронанофильтрационном разделении многокомпонентного раствора на катоде ион аммония перейдет в аммиак ${\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow $, а содержание катионов Cr3+, Cr6+, Сu2+, Ni2+ незначительно в исходном растворе (см. табл. 1).
На катоде, с учетом реакции образования аммиака, предположительно, первыми будут восстанавливаться металлы, при учете расположения их в ряду напряжений, причем те, у которых больше концентрация в исходном растворе (см. табл. 1), и далее другие:
(6)
${\text{NH}}_{4}^{ + } + {\text{e}} \to {\text{N}}{{{\text{H}}}_{3}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{H}}}_{2}} \uparrow ,$(7)
$\begin{gathered} {\text{M}}{{{\text{e}}}^{{n + }}} + n{\text{e}} \to {\text{Me}}\,\, \\ \left( {{\text{F}}{{{\text{e}}}^{{3 + }}} + 3{\text{e}} \to {\text{F}}{{{\text{e}}}^{0}}{\text{,}}\,\,\,{\text{F}}{{{\text{e}}}^{{2 + }}} + 2{\text{e}} \to {\text{F}}{{{\text{e}}}^{0}},} \right. \\ \left. {{\text{Z}}{{{\text{n}}}^{{2 + }}} + 2{\text{e}} \to {\text{Z}}{{{\text{n}}}^{0}}} \right), \\ \end{gathered} $(8)
$2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{e}} \to {{{\text{H}}}_{2}}{\kern 1pt} \uparrow + \,\,2{\text{O}}{{{\text{H}}}^{ - }}.$Но образование металлических покрытий при гальванообработке (7) справедливо до значений рН нейтральной и щелочной среды, что противоречит данным, показанным на рис. 8, так как в прикатодном пространстве щелочная среда, поэтому нами предполагается замена механизма (7) на механизм образования соединений (9):
(9)
${\text{M}}{{{\text{e}}}^{{n + }}} + n{\text{O}}{{{\text{H}}}^{ - }} \to {\text{Me(OH}}{{{\text{)}}}_{n}}.$С увеличением напряжения и, как следствие, плотности тока скорость электрохимических реакций возрастает (пермеат подщелачивается), при этом мигрирующий навстречу катионам Fe3+, Fe2+ встречный ионный поток гидроксид-ионов OH–, двигающихся из прикатодного пермеата через поры (со стороны подложки) в примембранный слой у поверхности прикатодной мембраны, способствует образованию осадка ${\text{Fe(OH}}{{{\text{)}}}_{2}} \downarrow $ и ${\text{Fe(OH}}{{{\text{)}}}_{3}} \downarrow $ (ржавчина) по формуле (9), происходит кристаллизация твердого вещества на поверхности мембраны вследствие перенасыщения, что легко заметить на отработанном образце мембраны ОПМН-П (рис. 18б) (наличие загрязнений (ржавчина) по краям мембраны и деградация поверхности) и его отсутствие на мембране ОФАМ-К (рис. 18а).
Рис. 18.
Отработанные образцы прианодной ОФАМ-К (а) и прикатодной ОПМН-П (б) мембран при разделении технологического раствора гальванического производства АО “ТАГАТ” имени С.И. Лившица от действия перепада давления Р = 1.6 МПа и плотности тока i = 9.6 А/м2.

В работе специально оговорена область открытых пор мембран, так как предполагалось, что при непосредственном расположении мембраны на электроде, вероятно появление на поверхности мембран, в этих областях, металлов – железа и цинка, но это противоречит появлению цинка при рН < 5.5 при мембранном электролизе на электродах [40], но, следовательно, и других элементов (например, металлических Cu, Fe, Ni) в зависимости их расположения в электрохимическом ряду напряжений металлов после Н+ из-за большого смещения пермеата в щелочную среду (см. рис. 8). Но это не свидетельствует о том, что катионы Fe3+, Fe2+, Zn2+ полностью переходят в форму ${\text{Fe(OH}}{{{\text{)}}}_{2}} \downarrow $ и ${\text{Fe(OH}}{{{\text{)}}}_{3}} \downarrow $, ${\text{Zn(OH}}{{{\text{)}}}_{2}} \downarrow $ (хотя это согласуется с уменьшением удельного выходного потока для прикатодной ОПМН-П и прианодной ОФАМ-К мембран (отложение осадков)), часть их продавливается через прикатодную мембрану, отводится с пермеатом, как и другие ионы, а часть перезаряжается с образованием у поверхности прикатодной мембраны цинкат-иона ${\text{ZnO}}_{{\text{2}}}^{{{\text{2}} - }}$), в результате действия встречного ионного потока гидроксид-иона ОН– в примембранном слое, на основе работ [38, 41], а некоторая часть осадка ${\text{Fe(OH}}{{{\text{)}}}_{2}} \downarrow $ и ${\text{Fe(OH}}{{{\text{)}}}_{3}} \downarrow $ на поверхности прикатодной мембраны ОПМН-П выступает в качестве сорбционного поглотителя следующих катионов и комплексов цинка (Zn2+; ZnOH–; Zn(OH)2; Zn(OH)3–; [Zn(OH)4]2–) [42, 43].
При этом поглотительная способность такого сорбента на поверхности мембраны не безгранична, и он выступает далее на поверхности мембраны в виде динамической мембраны (т.е., происходит более интенсивное задерживание катионов и анионов в потоке, первой движущейся мембраны (динамическая) и второй стационарной пористой прикатодной мембраны ОПМН-П). Этим объясняется высокий коэффициент задержания для прикатодной мембраны ОПМН-П по ионам Zn2+ (см. рис. 16) при разделении раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица от плотности тока с постоянным перепадом давления Р = 1.6 МПа.
Таким образом, цинкат-ион ${\text{ZnO}}_{{\text{2}}}^{{{\text{2}} - }},$ циркулируя далее по тракту ретентата всей установки, мигрирует из межмембранного канала через прианодную мембрану ОФАМ-К и отводится в прианодный пермеат.
На аноде окисляется вода:
(10)
$2{{{\text{H}}}_{{\text{2}}}}{\text{O}} - 4{\text{e}} \to 4{{{\text{H}}}^{ + }} + {{{\text{O}}}_{2}} \uparrow {\kern 1pt} .$При этом наряду с цинкат-ионом ${\text{ZnO}}_{{\text{2}}}^{{{\text{2}} - }}$ через прианодную мембрану из исходного раствора мигрируют анионы кислотных остатков ${\text{NO}}_{3}^{ - },$ ${\text{PO}}_{4}^{{3 - }},$ ${\text{SO}}_{4}^{{2 - }}$ (см. табл. 1), содержащиеся в многокомпонентном растворе, осуществляется подкисление прианодного пермеата, а из прианодного пермеата навстречу кислотным остаткам (со стороны подложки прианодной мембраны ОФАМ-К) мигрируют катионы водорода H+, попадая в разделяемый раствор, которые, циркулируя по тракту ретентата, стремятся к прикатодной мембране.
Поэтому, для рис. 17 коэффициент задержания прианодной мембраны ОФАМ-К по анионам ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ от плотности тока с постоянным перепадом давления Р = 1.6 МПа уменьшается, так как преимущественно разноименные заряды притягиваются, а одноименные – отталкиваются, как следствие, коэффициент задержания возрастает по анионам ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ для прикатодной ОПМН-П мембраны (рис. 16) при разделении технологического раствора гальванического производства АО “ТАГАТ” им. С.И. Лившица, да еще и при наличии слоя сорбционного поглотителя, находящегося в состоянии динамической мембраны.
Также необходимо отметить, что при многократной рециркуляции разделяемого раствора, выделившиеся на аноде катионы водорода H+ и мигрирующие с обратной стороны прианодной мембраны ОФАМ-К (со стороны подложки) сначала в поток разделяемого раствора, а далее через прикатодную мембрану ОПМН-П попадают на катод, поэтому электрохимическая реакция выглядит следующим образом (11):
Подобным образом выделившиеся на прикатодной мембране гидроксид-ионы ОH– (анионы) и мигрирующие с обратной стороны прикатодной мембраны ОПМН-П (со стороны подложки) сначала в поток разделяемого раствора, а далее через прианодную мембрану ОФАМ-К, попадают на анод, поэтому электрохимическая реакция выглядит следующим образом (12):
(12)
$4{\text{O}}{{{\text{H}}}^{ - }} - 4{\text{e}} \to {\text{O}}_{2}^{0} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} .$Стоит отметить еще одну особенность: при проведении процесса разделения технологического раствора наблюдался разогрев раствора из-за того, что сам раствор в электромембранной системе электронанофильтрационной ячейки является проводником второго рода, в котором сосредоточено основное сопротивление, в отличие от металлических, титановых электродов (платинированных), являющихся проводниками первого рода. Поэтому было принято решение на основе экспериментальных и расчетных данных определить количество теплоты, выделившееся в электронанофильтрационной ячейке на основе закона Джоуля–Ленца:
В нашем случае удобнее воспользоваться преобразованной формулой (13) с учетом напряжения, так как нами были построены ВАХ технологического раствора и рассмотреть эволюцию подобного подхода с учетом особенностей дросселирования раствора при увеличении гидродинамического сопротивления (при отсутствии участка 0–1 В в силу ранее представленной интерпретации проведения экспериментов в тонких каналах при переходе от одной электромембранной системы к другой (табл. 5)).
Таблица 5.
Расчетные значения количества теплоты, выделившейся при электробаромембранном (электронанофильтрационном) разделении исследуемых растворов в ячейке плоскокамерного типа, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами соответственно
| Раствор | t, с | P, МПа | U, B | Q, Дж |
|---|---|---|---|---|
| Технологический раствор АО “ТАГАТ” имени С.И. Лившица |
600 | 1.0 | 3 | 25.2 |
| 6 | 252 | |||
| 9 | 972 | |||
| 12 | 2304 | |||
| 15 | 4230 | |||
| 18 | 6480 | |||
| 21 | 9072 | |||
| 24 | 10 944 | |||
| 27 | 12 798 | |||
| 30 | 15 120 | |||
| 1.6 | 3 | 36 | ||
| 6 | 396 | |||
| 9 | 1296 | |||
| 12 | 2880 | |||
| 15 | 5040 | |||
| 18 | 7344 | |||
| 21 | 9702 | |||
| 24 | 11 952 | |||
| 27 | 14 904 | |||
| 30 | 17 460 | |||
| 2.4 | 3 | 59.4 | ||
| 6 | 504 | |||
| 9 | 1566 | |||
| 12 | 3240 | |||
| 15 | 5760 | |||
| 18 | 8208 | |||
| 21 | 10 962 | |||
| 24 | 13 248 | |||
| 27 | 16 038 | |||
| 30 | 18 360 |
Анализ табл. 5 показывает, что расчетное значение количества теплоты, выделившейся при электробаромембранном (электронанофильтрационном) разделении исследуемых растворов в ячейке плоскокамерного типа, оснащенной прианодной ОФАМ-К и прикатодной ОПМН-П мембранами, с ростом перепада давления возрастает, что согласуется с данными по возрастанию гидродинамического сопротивления в межмембранных каналах при дросселировании растворов, но тепловыделение в свою очередь существенно влияет на электропроводность и, как следствие, транспортную миграцию катионов и анионов исследуемых компонентов (под действием перепада давления и напряжения) через прикатодные и прианодные мембраны ОПМН-П и ОФАМ-К по следующей схеме (рис. 19).
Рис. 19.
Схема транспортной миграции катионов и анионов исследуемых компонентов через прикатодные и прианодные мембраны ОПМН-П и ОФАМ-К соответственно (под действием перепада давления и напряжения).

На основе анализа экспериментальных данных, полученных при мембранном разделении исследуемых растворов при действии перепада давления и напряжения, предложено эмпирическое уравнение для расчета коэффициента задержания:
(14)
${{K}_{{{\text{расч}}}}} = {{q}_{1}}\left( {\frac{{{{\alpha }_{0}}}}{{{{\alpha }_{{{\text{расч}}}}}}}} \right)\exp \left( {\frac{P}{{{{P}_{{{\text{max}}}}}}}} \right) + {{q}_{2}},$Уравнение справедливо при баромембранном и электробаромембранном разделении растворов с условиями (αрасч > 0, Pmax > 0).
Эмпирические коэффициенты q1, q2 для уравнения (14) процесса электробаромембранного (электронанофильтрационного) разделения исследуемых растворов представлены в табл. 6.
Таблица 6.
Эмпирические коэффициенты q1, q2 для уравнения (14) процесса электробаромембранного разделения исследуемых растворов
| Процесс разделения | Раствор | Мембрана | Ион | q1 | q2 |
|---|---|---|---|---|---|
| Электробаро- мембранный | Технологический раствор АО “ТАГАТ” имени С.И. Лившица |
ОФАМ-К (прианодная) | ${\text{PO}}_{4}^{{3 - }}$ | –0.103 | 1.612 |
| ОПМН-П (прикатодная) | Zn2+ | 1.240 | –1.329 | ||
| ${\text{PO}}_{4}^{{3 - }}$ | 0.947 | –1.091 |
ЗАКЛЮЧЕНИЕ
Проведенные теоретические и экспериментальные исследования мембранных систем при электронанофильтрационном разделении модельных водных растворов, содержащих нитрат аммония и сульфат калия, и технологического раствора гальванического производства АО “ТАГАТ” имени С.И. Лившица позволили сформулировать следующие выводы:
1. Выявлено, что совместное действие электрического напряжения и перепада давления, накладываемых на мембранную систему, оснащенную двумя нанофильтрационными мембранами ОПМН-П, ОФАМ-К, при исследовании ВАХ, омических и транспортных характеристик позволяет стимулировать диссоциацию растворителя (воды), что влияет на перенос катионов и анионов в пермеат. При этом увеличение концентрации исследуемых растворов при электронанофильтрации влияет на ВАХ, омические, транспортные характеристики при увеличении общей электропроводности мембранных систем вследствие увеличения гидродинамического сопротивления и тепловыделения в растворе.
2. Установлено, что возрастание величины перепада давления и электрического напряжения от 3 до 30 В приводит к изменению ВАХ и выражается в уменьшении общего омического сопротивления мембранных систем. Это объясняется процессом дросселирования в электрохимической ячейке и тепловыделением в самом растворе, являющемся проводником второго рода, в отличие от металлических электродов. Отмечается, что при электронанофильтрационном разделении раствора гальванического производства АО “ТАГАТ” имени С.И. Лившица, г. Тамбов на поверхности прикатодной мембраны образуются гидроксиды железа(III) и (II), которые проявляют сорбционные свойства для других соединений, например, Zn2+; ZnOH–; Zn(OH)2; ${\text{Zn}}\left( {{\text{OH}}} \right)_{3}^{ - };$ [Zn(OH)4]2– и по мере их насыщения приобретают способность двигаться в потоке разделяемого раствора (образуется динамическая мембрана).
3. На основе анализа полученных экспериментальных зависимостей по транспортным характеристикам мембран с варьированием перепада давления и электрического напряжения при электронанофильтрационном разделении исследуемых растворов получены эмпирические уравнения для расчета удельного выходного потока и коэффициента задержания.
Список литературы
Ахмадиев, М.Г., Шакиров, Ф.Ф., Назипова, Л.М., Ахмадиев, Б.М., Шайхиев, И.Г. Моделирование процесса восстановления шестивалентного хрома в сточных водах. Вестник Казанского технологического университета. 2014. Т. 17. № 8. С. 47. [Akhmadiev, M.G., Shakirov, F.F., Nazipova, L.M., Akhmadiev, B.M., and Shaikhiev, I.G., Modeling the hexavalent chromium reduction process in wastewater, Bulletin of Kazan Technological University (in Russian), 2014, vol. 17, no. 8, p. 47.]
Смирнова, С.В., Нуруллина, Г.Н. Пути снижения содержания шестивалентного хрома в сточных водах. Вестник Казанского технологического университета. 2014. Т. 17. № 6. С. 104. [Smirnova, S.V. and Nurullina, G.N., Ways to reduce hexavalent chromium in wastewater, Bulletin of Kazan Technological University (in Russian), 2014, vol. 17, no. 6, p. 104.]
Шарапова, Л.М., Шайхиев, И.Г., Шакиров, Ф.Ф., Хаертдинова, А.А. Очистка хромосодержащих стоков. Восстановление с использованием традиционных реагентов и древесных опилок. Вестник технологического университета. 2015. Т. 18. № 6. С. 227. [Sharapova, L.M., Shaikhiev, I.G., Shakirov, F.F., and Khaertdinova, A.A., Purification of chromium-containing effluents. Restoration using traditional reagents and sawdust, Bulletin of the University of Technology (in Russian), 2015, vol. 18, no. 6, p. 227.]
Гавриленко, А.В., Степачёва, А.А., Молчанов, В.П., Сульман, М.Г. Комплексная очистка сточных вод от нитратов. Бюллетень науки и практики. 2016. № 10(11). С. 42. [Gavrilenko, A.V., Stepacheva, A.A., Molchanov, V.P., and Sulman, M.G., Integrated wastewater treatment from nitrates, Bulletin of science and practice (in Russian), 2016, no. 10(11), p. 42.]
Исхакова, И.О., Ткачева, В.Э. Инновационные методы очистки сточных вод современного гальванического производства. Вестник технологического университета. 2016. Т. 19. № 10. С. 143. [Iskhakova, I.O. and Tkacheva, V.E., Innovative wastewater treatment methods of modern galvanic production, Bulletin of the University of Technology (in Russian), 2016, vol. 19, no. 10, p. 143.]
Тарчигина, Н.Ф., Шрамченко, А.А. Выбор эффективного флокулянта для очистки сточных вод, образующихся на предприятиях по производству минеральных удобрений. Успехи современной науки. 2016. Т. 2. № 10. С. 19. [Tarchigina, N.F. and Shramchenko, A.A., Choosing an effective flocculant for wastewater treatment, generated at the enterprises for the production of mineral fertilizers, Advances in modern science (in Russian), 2016, vol. 2, no. 10, p. 19.]
Нефедова, Е.В., Турушева, А.И. Изучение возможности использования ТКО (тканей) для адсорбционной очистки сточных вод. Технологии металлургии, машиностроения и материалообработки. 2018. № 17. С. 167. [Nefedova, E.V. and Turusheva, A.I., Studying the possibility of using MSW (tissue) for adsorption wastewater treatment, Technologies of metallurgy, mechanical engineering and material processing (in Russian), 2018, no. 17, p. 167.]
Лин, М.М., Шитова, В.О., Каграманов, Г.Г. Очистка сточных вод от тяжелых металлов методом ионного обмена. Успехи в химии и химической технологии. 2016. Т. 30. № 2(171). С. 109. [Lin, M.M., Shitova, V.O., and Kagramanov, G.G., Wastewater treatment of heavy metals by ion exchange method, Advances in chemistry and chemical technology (in Russian), 2016, vol. 30, no. 2(171), p. 109.]
Измайлов, А.Ю., Лобачевский, Я.П., Федотов, А.В., Григорьев, В.С., Ценч, Ю.С. Адсорбционно-окислительная технология переработки сточных вод предприятий агропромышленного комплекса. Вестник Мордовского университета. 2018. Т. 28. № 2. С. 207. [Izmailov, A.Yu., Lobachevsky, Ya.P., Fedotov, A.V., Grigoryev, V.S., and Tsench, Yu.S., Adsorption-oxidative technology for wastewater treatment of agricultural enterprises, Bulletin of the Mordovian University (in Russian), 2018, vol. 28, no. 2, p. 207.]
Захаров, С.Л., Осадчий, Ю.П., Маркелов, А.В., Пахотин, Н.Е. Модернизация баромембранного разделения промышленных стоков текстильных предприятий от солей тяжелых металлов. Ремонт. Восстановление. Модернизация. 2019. № 1. С. 15. [Zakharov, S.L., Osadchiy, Yu.P., Markelov, A.V., and Pakhotin, N.E., Modernization of the baromembrane separation of industrial effluents of textile enterprises from salts of heavy metals, Repairs. Recovery. Modernization (in Russian), 2019, no. 1, p. 15.]
Яцев, А.М., Акберова, Э.М., Голева, Е.А., Васильева, В.И., Малыхин, М.Д. Диагностика изменений микроструктуры поверхности и объема сульфокатионообменной мембраны МК-40 при электродиализе сильноминерализованных природных вод. Сорбционные и хроматографические процессы. 2017. Т. 17. № 2. С. 313. [Yatsev, A.M., Akberova, E.M., Goleva, E.A., Vasilyeva, V.I., and Malykhin, M.D., Diagnostics of changes in the surface microstructure and volume of the MK-40 sulfation-cation exchange membrane during electrodialysis of highly mineralized natural waters, Sorption and chromatographic processes (in Russian), 2017, vol. 17, no. 2, p. 313.]
Badessa, T.S., Shaposhnik, V.A., and Nartova M.R. Transport of multi-charged cations through cation exchange membrane by electrodialysis. Сорбционные и хроматографические процессы. 2015. Т. 15. Вып. 3. С. 450. [Badessa, T.S., Shaposhnik, V.A., and Nartova M.R., Transport of multi-charged cations through cation exchange membrane by electrodialysis, Sorption and chromatographic processes (in Russian), 2015, vol. 15, issue 3, p. 450.]
Kubáň, P., Strieglerová, L., Gebauer, P., and Boček, P., Electromembrane extraction of heavy metal cations followed by capillary electrophoresis with capacitively coupled contactless conductivity detection, Electrophoresis, 2011, vol. 32, p. 1025.
Huang, C., Seip, KF., Gjelstad, A., and Pedersen-Bjergaard, S., Electromembrane extraction for pharmaceutical and biomedical analysis – Quo vadis, J. Pharm. Biomed., 2015, vol. 113, p. 97.
Годовой отчет АО “ТАГАТ” им. С.И. Лившица, Тамбов, 2018. [The annual report of JSC TAGAT named after S.I. Livshitsa (in Russian), Tambov, 2018.]
Нифталиев, С.И., Кузнецова, И.В., Перегудов, Ю.С., Окшин, В.В., Мельник, А.В. Перспективы применения сточных вод ОАО “Минудобрения”. Экология и промышленность России. 2012. № 5. С. 36. [Niftaliev, S.I., Kuznetsova, I.V., Peregudov, Yu.S., Okshin, V.V., and Melnik, A.V., Prospects for the use of wastewater of OJSC “Mineral fertilizers,” Ecology and industry of Russia (in Russian), 2012, no. 5, p. 36.]
Нифталиев, С.И., Козадерова, О.А., Ким, К.Б., Малявина, Ю.М. Электродиализ в очистке азотсодержащих сточных вод предприятия по производству минеральных удобрений. Химическая промышленность сегодня. 2014. № 7. С. 52. [Niftaliev, S.I., Kozaderova, O.A., Kim, K.B., and Malyavina, Yu.M., Electrodialysis in the treatment of nitrogen-containing wastewater of a mineral fertilizer manufacturing enterprise, Chemical industry today (in Russian), 2014, no. 7, p. 52.]
Елисеева, Т.В., Харина, А.Ю. Особенности вольт-амперных и транспортных характеристик анионообменных мембран при электродиализе растворов, содержащих алкилароматическую аминокислоту и минеральную соль. Электрохимия. 2015. Т. 51. С. 74. [Eliseeva, T.V. and Kharina, A.Yu., Voltammetric and Transport Characteristics of Anion-Exchange Membranes during Electrodialysis of Solutions Containing Alkylaromatic Amino Acid and a Mineral Salt, Russ. J. Electrochem., 2015, vol. 51, p. 63.]
Лоза, Н.В., Долгополов, С.В., Кононенко, Н.А., Андреева, М.А., Коршикова, Ю.С. Влияние поверхностного модифицирования перфторированных мембран полианилином на их поляризационное поведение. Электрохимия. 2015. Т. 51. С. 615. [Loza, N.V., Dolgopolov, S.V., Kononenko, N.A., Andreeva, M.A., and Korshikova, Yu.S., Effect of Surface Modification of Perfluorinated Membranes with Polyaniline on Their Polarization Behavior, Russ. J. Electrochem., 2015, vol. 51, p. 538.]
Демина, О.А., Фалина, И.В., Кононенко, Н.А. Модельное описание электропроводности ионообменных мембран в широком диапазоне концентраций раствора электролита. Электрохимия. 2015. Т. 51. С. 641. [Demina, O.A., Falina, I.V., and Kononenko, N.A., Model Description of Conductivity of Ion-Exchange Membranes in a Wide Range of Concentrations of Electrolyte Solution, Russ. J. Electrochem., 2015, vol. 51, p. 561.]
Конарев, А.А. Использование электродиализа в опытном и промышленном производствах фармацевтических субстанций. Электрохимия. 2015. Т. 51. С. 1263. [Konarev, A.A., Use of Electrodialysis in the Pilot- and Commercial-Scale Production of Pharmaceutical Substances, Russ. J. Electrochem., 2015, vol. 51, p. 1124.]
Никоненко, В.В., Мареев, С.А., Письменская, Н.Д., Узденова, А.М., Коваленко, А.В., Уртенов, М.Х., Пурсели, Ж. Эффект электроконвекции и его использование для интенсификации массопереноса в электродиализе (обзор). Электрохимия. 2017. Т. 53. С. 1266. [Nikonenko, V.V., Mareev, S.A., Pis’menskaya, N.D., Uzdenova, A.M., Kovalenko, A.V., Urtenov, M.Kh., and Pourcelly, G., Effect of Electroconvection and Its Use in Intensifying the Mass Transfer in Electrodialysis (Review), Russ. J. Electrochem., 2017, vol. 53, p. 1122.]
Заболоцкий, В.И., Мельников, С.С., Демина, О.А. Прогнозирование массообменных характеристик промышленных электродиализаторов-концентраторов. Электрохимия. 2014. Т. 50. С. 38. [Zabolotskii, V.I., Mel’nikov, S.S., and Demina, O.A., Prediction of the Mass Exchange Characteristics of Industrial Electrodialyzer Concentrators, Russ. J. Electrochem., 2014, vol. 50, p. 32.]
Нифталиев, С.И., Козадерова, О.А., Власов, Ю.Н. Ким, К.Б., Матчина, К.С. Структурно-кинетические параметры ионообменных мембран МК-40 и МА-41 в растворах нитрата аммония. Сорбционные и хроматографические процессы. 2015. Т. 15. Вып. 5. С. 708. [Niftaliev, S.I., Kozaderova, O.A., Vlasov, Yu.N., Kim, K.B., and Matchina, K.S., Structural and kinetic parameters of ion-exchange membranes MK-40 and MA-41 in solutions of ammonium nitrate, Sorption and chromatographic processes (in Russian), 2015, vol. 15, issue 5, p. 708.]
Нифталиев, С.И., Козадерова, О.А., Ким, К.Б., Матчина, К.С. Изучение процесса переноса тока в системе гетерогенная ионообменная мембрана-раствор нитрата аммония. Конденсированные среды и межфазные границы. 2016. Т. 18. № 2. С. 232. [Niftaliev, S.I., Kozaderova, O.A., Kim, K.B., and Matchina, K.S., Study of the current transfer process in a heterogeneous ion-exchange membrane-ammonium nitrate system, Condensed media and interphase boundaries (in Russian), 2016, vol. 18, no. 2, p. 232.]
Заболоцкий, В.И., Письменский, В.Ф., Етеревскова, С.И., Новак, Л., Чернин, А., Кысела, В., Венцкунас, В., Арлаускас, Р., Комплексная электродиализная технология переработки конденсата сокового пара производства аммиачной селитры, Материалы конференции “Ионный перенос в органических и неорганических мембранах. Электромембранные технологии на базе фундаментальных исследований явлений переноса”, Краснодар, 2008. С. 109. [Zabolotsky, V.I., Pismensky, V.F., Eterevskova, S.I., Novak, L., Chernin, A., Kysela, V., Venckunas, V., and Arlauskas, R., Complex electrodialysis processing technology condensate juice steam production of ammonium nitrate, Materials of the conference “Ion transfer in organic and inorganic membranes. Electro-membrane technologies based on fundamental research of transport phenomena” (in Russian), Krasnodar, 2008, p. 109.]
Dytnerskii, Yu.I., The use of electric current for enhancing the efficiency of pressure-driven membrane processes, Pure & Appl. Chem., 1986, vol. 58, no. 12, p. 1627.
Лазарев, С.И., Ковалева, О.А., Головин, Ю.М., Рыжкин, В.Ю. Оптико-микроскопические исследования сорбционной поверхности нанофильтрационных мембран ОПМН-П и ОФАМ-К. Сорбционные и хроматографические процессы. 2018. Т. 18. Вып. 1. С. 83. [Lazarev, S.I., Kovaleva, O.A., Golovin, Yu.M., and Ryzhkin, V.Yu., Optical microscopic studies of the sorption surface of nanofiltration membranes OPMN-P and OFAM-K, Sorption and chromatographic processes (in Russian), 2018, vol. 18, issue 1, p. 83.]
Bon, A.I., Dzyubenko, V.G., Shishova, I.I., Asymmetric composite reverse osmosis membranes. A survey of some preparation procedures, Vysokomolekulyarnyye soyedineniya. Seriya B, 1993, vol. 35, № 7, p. 922.
Головашин, В.Л., Лазарев, С.И., Лавренченко, А.А. Исследование кинетических коэффициентов электроультрафильтрационного разделения промышленных растворов биохимических производств. Вестник Тамбовского государственного технического университета. 2014. Т. 20. № 1. С. 86. [Golovashin, V.L., Lazarev, S.I., and Lavrenchenko, A.A., Study of kinetic coefficients of electro-ultrafiltration separation of industrial solutions of biochemical industries, Bulletin of the Tambov State Technical University (in Russian), 2014, vol. 20, no. 1, p. 86.]
Дытнерский, Ю.И. Обратный осмос и ультрафильтрация, М.: Химия, 1978. 352 с. [Dytnersky, Yu.I., Reverse Osmosis and Ultrafiltration (in Russian), M.: Chemistry, 1978. 352 p.]
Свитцов, А.А. Введение в мембранную технологию, М.: ДеЛи принт, 2007. 208 с. [Svittsov, A.A., Introduction to Membrane Technology (in Russian), Moscow: DeLi print, 2007. 208 p.]
Заболоцкий, В.И., Бугаков, В.В., Шарафан, М.В., Чермит, Р.Х. Перенос ионов электролита и диссоциация воды в анионообменных мембранах при интенсивных токовых режимах. Электрохимия. 2012. Т. 48. С. 721. [Zabolotskii, V.I., Bugakov, V.V., Sharafan, M.V., and Chermit, R.K., Transfer of electrolyte ions and water dissociation in anion-exchange membranes under intense current conditions, Russ. J. Electrochem., 2012, vol. 48, p. 650.]
Акберова, Э.М., Васильева, В.И., Малыхин, М.Д. Влияние температурной модификации сульфокатионообменной мембраны на развитие электроконвективной нестабильности при сверхпредельных токовых режимах. Конденсированные среды и межфазные границы. 2015. Т. 17. № 3. С. 273. [Akberova, E.M., Vasilyeva, V.I., and Malykhin, M.D., Influence of the temperature modification of a sulfocation-exchange membrane on the development of electroconvective instability under ultra-limiting current conditions, Condensed media and interphase boundaries (in Russian), 2015, vol. 17, no. 3, p. 273.]
Григоров, О.Н., Карпова, И.Ф., Козьмина, З.П., Тихомолова, К.П., Фридрихсберг, Д.А., Чернобережский, Ю.М. Руководство к практическим работам по коллоидной химии. М.: Химия, 1964. 326 с. [Grigorov, O.N., Karpova, I.F., Kozmina, Z.P., Tikhomolova, K.P., Friedrichsberg, D.A., and Chernoberezhsky, Yu.M., Guide to practical work on colloid chemistry (in Russian), M.: Chemistry, 1964. 326 p.]
Колзунова, Л.Г. Баромембранные процессы разделения: задачи и проблемы. Вестник ДВО РАН. 2006. № 5. С. 65. [Kolzunova, L.G., Baromembrane separation processes: tasks and problems, Vestnik FEB RAS (in Russian), 2006, no. 5, p. 65.]
Рябчиков, Б.Е. Современные методы подготовки воды для промышленного и бытового использования, М.: ДеЛи принт, 2004. 328 с. [Ryabchikov, B.E., Modern methods of water preparation for industrial and domestic use (in Russian), Moscow: DeLi print, 2004. 328 p.]
Шапошник, В.А., Васильева, В.И., Григорчук, О.В. Явления переноса в ионообменных мембранах, М.: МФТИ, 2001. 200 с. [Shaposhnik, V.A., Vasilieva, V.I., and Grigorchuk, O.V., Transport phenomena in ion-exchange membranes (in Russian), M.: MIPT, 2001. 200 p.]
Гребенюк, В.Д. Электродиализ, Киев: Изд-во “Техника”, 1976. 160 с. [Grebenyuk, V.D., Electrodialysis (in USSR), Kiev: Technika Publishing House, 1976. 160 p.].
Мороз, Е.М., Черник, А.А., Жарский, И.М. Извлечение ионов цинка из отработанного электролита цинкования методом мембранного электролиза. Известия Санкт-Петербургского государственного технологического института (технического университета). 2013. № 19(45). С. 19. [Moroz, E.M., Chernik, A.A., and Zharsky, I.M., Extraction of zinc ions from spent zincating electrolyte by membrane electrolysis, Bulletin of the St. Petersburg State Technological Institute (Technical University) (in Russian), 2013, no. 19(45), p. 19.]
Bodamer, G.W., U.S.Pat.2.723.229, Electrolytic process for the separation of amfoteric metals, 1955.
Фролова, С.И., Козлова, Г.А., Ходяшев, Н.Б. Очистка техногенных сточных вод оксигидратами железа. Вестник Пермского университета. 2011. Вып. 2(2). С. 60. [Frolova, S.I., Kozlova, G.A., and Khodyashev, N.B., Purification of technogenic waste water with iron oxyhydrates, Perm University Bulletin (in Russian), 2011, Issue 2(2), p. 60.]
Новиков, А.И. Использование соосаждения с гидроокисью железа для разделения малых количеств. Изв. СО АН СССР. Сер. хим. н. 1965. Вып. 3. № 11. С. 64. [Novikov, A.I., Use of iron hydroxide coprecipitation to separate small amounts, Izv. SB AS USSR. Ser. chem. n. (in Russian), 1965, no. 3, no. 11, p. 64.]
Дополнительные материалы отсутствуют.



