Электрохимия, 2021, T. 57, № 6, стр. 344-354
Cелективное анодное растворение сплавов Ag–Zn в расплавленной эвтектике хлоридов щелочных металлов при температуре 300°С
Н. П. Кулик a, *, Н. И. Шуров a, Н. К. Ткачев a, **
a Институт высокотемпературной электрохимии Уральского отделения РАН
Екатеринбург, Россия
* E-mail: n.p.kulik@gmail.com
** E-mail: n.k.tkachev@gmail.com
Поступила в редакцию 03.11.2020
После доработки 03.11.2020
Принята к публикации 20.11.2020
Аннотация
Изучены особенности электрохимического деаллоинга двух гомогенных сплавов Ag–Zn в расплаве LiCl0.57CsCl0.26KCl0.17. Содержание цинка в исходных образцах составляло 67 и 46 мол. %, что соответствовало фазам ε и β на фазовой диаграмме при 300°С. Сняты поляризационные кривые и определены потенциалы коррозии: –0.78 и –0.55 В, соответственно, относительно хлоридсеребряного электрода сравнения. Полное удаление цинка с поверхности сплавов достигнуто в результате деаллоинга в гальваностатическом режиме при плотности тока около 20 мА/см2 в случае ε-фазы и 7 мА/см2 для β-фазы. На поверхности сплава Zn0.67Ag0.33 образовались характерные однородные пористые структуры с примерно одинаковыми размерами пор и лигаментов, лежащими в диапазоне 0.5–5 мкм. Для сплава Zn0.46Ag0.54 получены дендритные структуры с размерами частиц серебра порядка 0.5–4 и 5–20 мкм.
ВВЕДЕНИЕ
В литературе имеется большое количество публикаций, представленных в обзорных работах [1, 2], которые посвящены получению нано- и микропористых металлов, в том числе серебра, с помощью электрохимического деаллоинга – селективного анодного растворения сплавов в водных средах. Интерес к нанопористому серебру обусловлен возможностью его применения в качестве селективного катализатора при гидрогенизации непредельных углеводородов [3], электрохимическом восстановлении углекислого газа [4], электрохимическом окислении альдегидов [5]. Оно может служить анодом в топливных элементах [6–8], работающих на этаноле, этиленгликоле, боразане, и перспективно как субстрат для поверхностно-усиленной рамановской спектроскопии [9]. Немногим уступая по своему каталитическому действию золоту и металлам платиновой группы, более дешевое нанопористое серебро является кандидатом для их замены в окислительно-восстановительных процессах [10, 11]. Для перспективных медицинских приложений важны антибактериальные свойства этого материала, а для электро- и фототехники – чувcтвительность к УФ-излучению.
К настоящему времени в водных растворах определены условия и установлены некоторые основные закономерности протекания перколяционного деаллоинга, т.е. селективного растворения сплавов с образованием бинепрерывной структуры пор и лигаментов. Содержание активного компонента в сплаве должно быть, как правило, не меньше 40–60 мол. %, а прикладываемый потенциал или пропускаемый ток – обеспечивать такой режим электролиза, при котором скорость отвода ионов электроактивного металла вглубь электролита превышает скорость диффузии более благородного металла на поверхности остающейся металлической фазы [2, 12, 13]. В качестве активных компонентов сплавов с серебром чаще всего используют цинк [14–19] и алюминий [20, 21]; встречаются и более сложные композиции, например, Ce–Cu–Ag [22], Y–Mg–Ag [23]. В качестве электролита применяют водные растворы кислот: серной [14–17], соляной [18] или азотной [16], реже нейтральные растворы [18]. В работе [23] проводили селективное растворение сплавов Y–Mg–M (M = Ni, Cu, Pd, Ag, Au) в водных растворах органических кислот, которые выполняли роль не только окислителей, но и поверхностно-активных веществ, замедляющих поверхностную диффузию металла.
Единичные исследования деаллоинга в низкотемпературных ионных жидкостях [24] лишь приоткрывают возможности, связанные с применением неводных сред, стабильных при повышенных температурах. К числу их преимуществ по сравнению с водными растворами могут быть отнесены интенсификация процесса, отсутствие источников водорода и кислорода in statu nascendi и возможность управления формированием пористых структур посредством выбора температурного режима.
Основной идеей данного исследования является использование расплавленных солей в качестве электролитов для выяснения вопросов об особенностях высокотемпературного деаллоинга. Недавно нами были осуществлены первые шаги по исследованию такого специфического анодного растворения на примере сплавов Al–Au, Cu–Au, сортовой латуни в хлоридных и карбонатных расплавах [25, 26]. Было найдено, что деаллоинг указанных сплавов в расплавленных солевых смесях происходит ускоренно по сравнению с деаллоингом в водных растворах и может приводить к образованию микропористых структур (с размерами пор от 0.1 до десятков мкм). Совершенно очевидно проявилось влияние природы сплава и температуры процесса на форму и размер пор. Однако важные вопросы о роли фазового состава исходных сплавов, вариации температуры и параметров электролиза на морфологию получающегося пористого металла все еще ждут освещения.
В качестве объектов деаллоинга в настоящей работе выбраны два гомогенных сплава Zn0.67Ag0.33 и Zn0.46Ag0.54, а в качестве электролита – эвтектика LiCl0.57CsCl0.26KCl0.17, имеющая температуру плавления 260°С. Разность стандартных электродных потенциалов Zn и Ag в расплавах их хлоридов, вычисленная на основе термодинамических данных [27], составляет 0.74 В при температуре 300°С. Эта величина достаточно велика, чтобы обеспечить возможность селективного растворения цинка из сплава. Конкретной целью предлагаемой работы является изучение влияния различных условий электрохимического деаллоинга на форму и размеры пор в поверхностных слоях изучаемых сплавов в режиме перколяции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сплавы Ag–Zn получали растворением кусочков серебряной проволоки (99.9 мас. % степени чистоты) в расплавленном цинке марки “ч. д. а.” в кварцевой пробирке в атмосфере аргона под флюсом эвтектики LiCl0.57CsCl0.26KCl0.17 при температуре 680°С. После гомогенизации металл затягивали в кварцевую трубочку с внутренним диаметром 3 мм. Изготовленные таким образом стержни разрезали на цилиндры высотой 25–30 мм, один из торцов которых шлифовали до зеркального блеска на металлографическом комплексе Struers (Struers ApS, Дания). Аттестацию сплавов проводили с помощью рентгеновского аппарата Rigaku D/MAX-2200VL/PC (Rigaku, Япония) и эмиссионного спектрометра с индуктивно-связанной плазмой Optima 4300 DV (Perkin Elmer, США).
Электролит готовили из солей марки “х. ч.”. Хлорид лития осушали, вымораживая влагу при температуре жидкого азота, хлорировали, а затем подвергали трехкратной зонной плавке для удаления кислородсодержащих примесей. Все дальнейшие манипуляции с хлоридом лития осуществляли в сухом боксе. Хлориды калия и цезия переплавляли на воздухе. Около 50 граммов солей в необходимых соотношениях сплавляли в инертной атмосфере и гомогенизировали при 800°С перед каждым экспериментом.
Измерения проводили в трехэлектродной ячейке (рис. 1) в атмосфере сухого очищенного аргона. Контейнером для расплава и вспомогательным электродом для поляризации служил тигель из стеклоуглерода СУ-1200. Хлоридсеребряный электрод сравнения Ag|эвтектика LiCl0.57CsCl0.26KCl0.17 + + 3 мол. % AgCl находился в алундовом чехле, микроотверстия в стенках которого обеспечивали контакт с рабочим электролитом. Величины всех потенциалов в работе приводятся относительно этого электрода.
Рис. 1.
Ячейка для электрохимических измерений: 1 – резиновая пробка, 2 –теплоотражающие экраны, 3 – кварцевая пробирка, 4 – сплав Ag–Zn, 5 – хлоридсеребряный электрод сравнения в алундовом чехле, 6 – солевой расплав, 7 – стеклоуглеродный тигель, 8 – токоподвод (Mo), 9 – термопара.
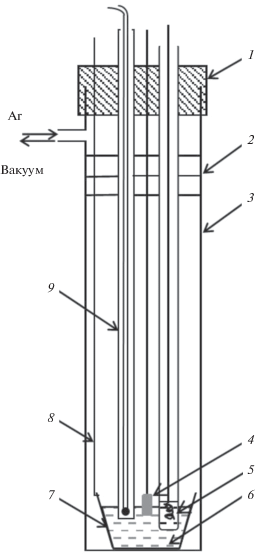
При температуре 300°С рабочий электрод опускали в расплав на глубину 2–8 мм и производили измерения с использованием комплекса Autolab 302N (Metrohm, Швейцария). Деаллоинг проводили в потенциостатическом и гальваностатическом режимах, варьируя прикладываемый потенциал или силу тока, а также длительность электролиза. По окончании эксперимента электрод отмывали от соли дистиллированной водой и спиртом и визуально определяли границу контакта электрода с расплавом. Кажущуюся плотность тока вычисляли по формуле i = I/Sгеом, где I – сила тока, Sгеом – геометрическая площадь контакта электрода с расплавом. Микрорентгеновский анализ торцевой поверхности проводили на электронных микроскопах JSM-5900LV (Jeol, Япония) и TESCAN MIRA 3 LMU (TESCAN, Чехия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
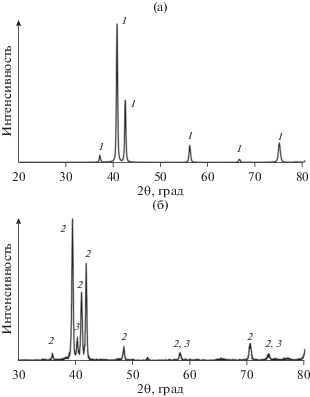
Согласно данным элементного химического анализа, составы полученных сплавов отвечают формулам Zn0.67Ag0.33 и Zn0.46Ag0.54. Результаты рентгенофазового анализа приведены на рис. 2. На дифрактограмме сплава Zn0.67Ag0.33 все имеющиеся пики совпадают с линиями спектра ε-фазы системы Ag–Zn (PDF#25-1325). Пики на дифрактограмме сплава Zn0.46Ag0.54 соответствуют гексагональной ζ-фазе и нестабильной кубической β‑фазе (PDF#29-1156 и PDF#29-1155 соответственно). При температуре выше 274°С обе эти модификации превращаются в β-фазу [28].
Рис. 2.
Дифрактограммы сплавов Zn0.67Ag0.33 (а) и Zn0.46Ag0.54 (б): линии спектра фаз ε (1) – ζ (2), β' (3).
На рис. 3–4 представлены анодные потенциодинамические кривые исследованных образцов сплавов, а также чистых металлов, полученные при скорости развертки потенциала 1 мВ/с. При увеличении анодного потенциала сплава Zn0.67Ag0.33 (рис. 3а) плотность тока растет и достигает максимума при величине порядка –0.67 В, после чего уменьшается примерно в 4 раза. Причиной этого, по-видимому, является обеднение поверхности металла цинком и диффузионные затруднения при доставке его из объема сплава. На графике зависимости i(Е) образца наблюдается плато в области потенциалов от –0.6 В вплоть до потенциала растворения серебра (около –0.25 В).
Рис. 3.
Анодные потенциодинамические кривые сплавов Zn0.67Ag0.33 (а) и Zn0.46Ag0.54 (б) в расплаве LiCl0.57CsCl0.26KCl0.17 при температуре 300°С.

Рис. 4.
Анодные потенциодинамические кривые Zn (а) и Ag (б) в расплаве LiCl0.57CsCl0.26KCl0.17 при температуре 300°С.

На поляризационной кривой сплава Zn0.46Ag0.54 (рис. 3б) положение пика растворения цинка смещено на 0.3 В в анодную сторону, и плотность тока в максимуме меньше по сравнению с кривой для образца Zn0.67Ag0.33. Растворение серебра начинается вблизи потенциала 0.1 В.
Потенциалы коррозии, Екор, вычисленные для всех исследованных образцов на основании циклических вольт-амперных кривых, показаны на рис. 5.
Рис. 5.
Потенциалы коррозии Zn (1), Zn0.67Ag0.33 (2), и Zn0.46Ag0.54 (3), Ag (4) в расплаве LiCl0.57CsCl0.26KCl0.17 при температуре 300°С.

Потенциалы, при которых плотность тока равна 1 мА/см2, обычно принимают за критический потенциал деаллоинга Eкр [29]. Найденные нами величины Екор и Eкр приведены в табл. 1.
Таблица 1.
Потенциалы коррозии и критические потенциалы деаллоинга
| Образец | Температура, °С | Е, В | |
|---|---|---|---|
| потенциал коррозии | критический потенциал деаллоинга | ||
| Zn0.67Ag0.33 | 300 | –0.79 | –0.77 |
| Zn0.46Ag0.54 | 300 | –0.55 | –0.52 |
| Ag | 300 | –0.29 | |
| Zn | 300 | –0.86 | |
В потенциостатическом режиме электролиз проводили при потенциалах на 100–400 мВ положительнее критического потенциала деаллоинга. На рис. 6 представлены характерные хроноамперограммы исследованных сплавов: образец Zn0.67Ag0.33 растворяли при потенциале –0.60 В (на 0.17 В положительнее критического потенциала деаллоинга для этого сплава), образец Zn0.46Ag0.54 – при –0.18 В (на 0.34 В положительнее Eкр). В обоих случаях в первые минуты наблюдалось падение плотности тока на порядок, обусловленное интенсивным образованием пор.
Рис. 6.
Хроноамперограммы сплавов в расплаве LiCl0.57CsCl0.26KCl0.17 при температуре 300°С: Zn0.67Ag0.33, Е = ‒600 мВ (а); Zn0.46Ag0.54, Е = = ‒170 мВ (б).

На рис. 7 показаны микрофотографии поверхности образцов после деаллоинга в течение 30 мин, которые позволяют видеть начальный этап образования пор. Состав поверхности двух сплавов к этому моменту времени оказался существенно различным: содержание цинка в образце Zn0.67Ag0.33 уменьшилось лишь на несколько процентов, тогда как на поверхности сплава Zn0.46Ag0.54 осталось не более 1–3 мол. % Zn. Причиной этого, помимо более благородного исходного состава, может быть и то, что электролиз в этом случае протекал при потенциале, значительно более положительном относительно критического потенциала деаллоинга.
Рис. 7.
Микрофотографии поверхности сплавов после деаллоинга в течение 1800 с: а, б – Zn0.67Ag0.33, Е = –600 мВ; в, г – Zn0.46Ag0.54, Е = –170 мВ.

В гальваностатическом режиме плотность тока задавали в интервале 20–50 мА/см2. На рис. 8 представлены хронопотенциограммы изученных сплавов. При пропускании тока плотностью 20 и 35 мА/см2 (рис. 8а, 8б) на сплаве Zn0.67Ag0.33 устанавливался потенциал порядка –0.06 В, отвечающий серебряной поверхности. Увеличение плотности тока до 50 мА/см2 (рис. 8в) сдвигало потенциал поверхности в начальный момент времени в отрицательную сторону. Этот эффект, вероятно, обусловлен быстрым образованием глубоких пор и (или) растворением серебра совместно с цинком. После этого поверхность приобретала все более положительный потенциал.
Рис. 8.
Хронопотенциограммы сплавов Zn0.67Ag0.33 (а–в) и Zn0.46Ag0.54 (г) в расплаве LiCl0.57CsCl0.26KCl0.17 при плотности тока, мА/см2: 20 (а), 35 (б), 50 (в), 7 (г).
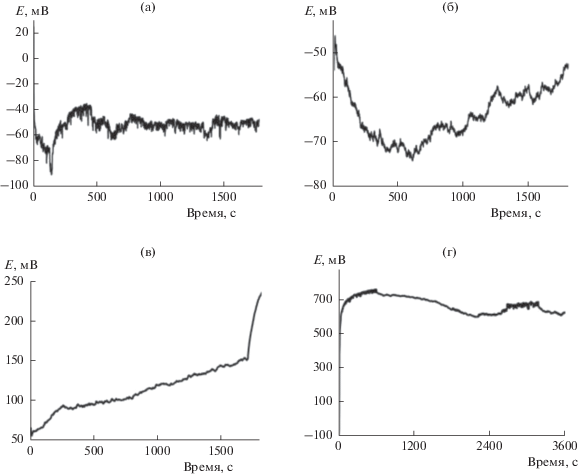
При гальваностатическом электролизе сплава Zn0.46Ag0.54 даже при небольшой плотности тока 7 мА/см2 поверхность металла очень быстро приобретала высокий положительный потенциал (рис. 8г) – становилась “серебряной”.
Микрофотографии поверхности сплава Zn0.67Ag0.33 после гальваностатического электролиза представлены на рис. 9. В результате деаллоинга при плотности тока 35 мА/см2 в течение 1800 с (рис. 9д, 9е) сформировались пористые структуры с сопоставимыми размерами пор и лигаментов от 0.5 до нескольких микрометров. Остаточное содержание цинка было около 10 мол. %. Увеличение времени электролиза при немного меньшей плотности тока 20 мА/см2 (рис. 9а–9г) делало поверхность более ажурной за счет уменьшения размеров связок, тогда как диаметр пор оставался прежним. При этом поверхностный слой практически на 100% состоял из серебра. Похожие структуры были получены и при пропускании тока плотностью 50 мА/см2 в течение 1800 с (рис. 9ж, 9з), но они содержали много неудаленного цинка – до 20 мол. %.
Рис. 9.
Микрофотографиии поверхности сплава Zn0.67Ag0.33 после деаллоинга в расплаве LiCl0.57CsCl0.26KCl0.17 при плотности тока, мА/см2: 20 (а–г), 35 (е–д) и 50 (ж, з). Время электролиза, с: 2300 (а, б), 12600 (в, г) и 1800 (д–з).

Микрофотографии поверхности сплава Zn0.46Ag0.54 после гальваностатического электролиза представлены на рис. 10.
Рис. 10.
Микрофотографии поверхности сплава Zn0.46Ag0.54 после деаллоинга при плотности тока 7 мА/см2 в течение 3600 с.

В результате деаллоинга при плотности тока 7 мА/см2 в течение 3600 с получена иерархическая структура, состоящая из лигаментов размером от 0.5 до 2 мкм и пор до 4 мкм, образующих сростки протяженностью 5–20 мкм с порами между ними до 10 мкм. Содержание цинка в этом поверхностном слое было близко к нулю. Морфология полученной таким способом фазы металлического серебра заметно отличается от более однородной структуры пор и лигаментов в случае бòльших значений силы тока. Скорее она напоминает сетку разветвленных дендритов, но с заметной связностью. Представляется поэтому интересным исследовать в будущем и некоторые функциональные свойства полученных матералов, а именно: механические и электрокаталитические.
В табл. 2 обобщены условия и результаты проведенных экспериментов.
Таблица 2.
Условия и результаты электрохимического деаллоинга
| Сплав | Потенциал деаллоинга, В | Плотность тока, мA/см2 | Время деаллоинга, с | Размер пор, мкм | Остаточное содержание Zn, мол. % |
|---|---|---|---|---|---|
| Zn0.67Ag0.33 | –0.60 | 1800 | Редкие поры и углубления 0.1–1 | 63 | |
| –0.55 | 2430 | 0.5–2 | 10 | ||
| 20 | 2340 | 0.5–2 | ≈0 | ||
| 20 | 12 600 | 1–5 | 10 | ||
| 35 | 1800 | 0.5–1 | 10 | ||
| 50 | 1800 | 1–3 | 20 | ||
| Zn0.46Ag0.54 | –0.18 | 1800 | Редкие поры и углубления 0.1–1 | 1–3 | |
| 7 | 3600 | 0.5–4; 5–20 | ≈0 |
ВЫВОДЫ
1. Показана возможность перколяционного деаллоинга однофазных сплавов Zn0.67Ag0.33 и Zn0.46Ag0.54 в эвтектике LiCl0.57CsCl0.26KCl0.17 при температуре 300°С с получением ультрапористых металлов различающейся морфологии.
2. Установлено, что практически полное удаление цинка с поверхности достигается при деаллоинге в гальваностатическом режиме при плотности тока порядка 20 в случае ε-фазы и 7 мA/см2 для β-фазы сплава Ag–Zn. Селективность растворения сплава уменьшается с увеличением плотности тока.
3. В результате гальваностатического деаллоинга сплава Zn0.67Ag0.33 образуются характерные пористые однородные структуры с примерно одинаковыми размерами пор и лигаментов, лежащими в диапазоне 0.5–5 мкм.
4. При гальваностатическом деаллоинге сплава Zn0.46Ag0.54 получены дендритные структуры, образованные ветвящимися кораллитами с характерными размерами агломератов порядка 0.5–4 и 5–20 мкм.
Список литературы
Zhang, J. and Li, Ch.M., Nanoporous metals: fabrication strategies and advanced electrochemical applications in catalysis, sensing and energy systems, Chem. Soc. Rev., 2012, vol. 41, p. 7016.
Weissmüller, J. and Sieradzki, K., Dealloyed nanoporous materials with interface-controlled behavior, MRS Bulletin, 2018, vol. 43, p. 14.
Delgado, J., Benkirane, A., Claver, C., Curulla-Ferre, D., and Godard, C., Advanced in the preparation of highly selective nanocatalysts for the semi-hydrogeneration of alkynes using colloidal approaches, Dalton Transaction, 2017, vol. 46, p. 12381.
Yang, W., Ma, W., Zhang, Zh., and Zhao, Ch., Ligaments size-dependent electrocatalytic activity of nanoporous Ag network for CO2 reduction, Faraday Discuss, 2018, vol. 210, p. 289.
Li, Zh., Lu, X., Li, B., Lu B., and Wang, Q., Research on Electrochemical Oxidation of Formaldehyde on the Nanoporous Silver Electrode in Alkaline Solution, ECS Electrochem. Letters, 2015, vol. 4, p. H24.
Barsuk, D., Zadick, A., Chatenet, M., Georgarakis, K., Panagiotopoulos, N., Champion, Y., and Alberto Moreira, J., Nanoporous silver for electrocatalysis application in alkaline fuel cells, Materials & Design, 2016, vol. 111, p.528.
Zhang, Y., Luc, W., Hutchings, G.S., and Jiao, F., Photoelectrochemical Carbon Dioxide Reduction Using a Nanoporous Ag Cathode, ACS Appl. Mater. Interfaces, 2016, vol. 8, P. 24652.
Su, L. and Gan, Y.X., Nanoporous Ag–Sn anodes for energy conversion in photochemical fuel cells, Materials & Design, 2016, vol. 111, p. 528.
Ma, Ch., Trujillo, M.J., and Camden, J.P., Nanoporous Silver Film Fabricated by Oxygen Plasma: A Facile Approach for SERS Substrates, ACS Appl. Mater. Interfaces, 2016, vol. 8, p. 23978.
Detsi, E., Sànchez Sellès, M., Onck Jeff, Th, p., and Hosson, M.De., Nanoporous silver as electrochemical actuator, Scripta Materialia, 2013, vol. 69, p. 195.
Lizhi, Y., Luhua, J., Tianran, Zh., Guoxiong, W., Suli, W., Xinhe, B., and Gongquan, S., Electrochemically synthesized freestanding 3D nanoporous silver electrode with high electrocatalytic activity, Catalysis Science & Technology, 2016, vol. 6, p. 7163.
Маршаков, И.К., Введенский, А.В., Кондрашин, В.Ю., Боков, Г.А. Анодное растворение и селективная коррозия сплавов, Воронеж: Изд-во Воронеж. ун-та. 1988. 208 с. [Marshakov, I.K., Vvedensky, A.V., Kondrashin, V.Yu., and Bokov, G.A. Anodic dissolution and selective corrosion of alloys (in Russian), Voronezh: Voronezh. University, 1988. 208 p.]
Перцов, Н.В., Зозуля, В.В., Прокопенко, В.А. Образование пористого материала при электрохимическом выщелачивании гомогенного золотосодержащего сплава. Коллоид. журн. 2000. Т. 62. С. 133. [Pertsov, N.V., Zozulya, V.V., and Prokopenko, V.A., Process of self organization of ultradispersed structures during alloy selective dissolution, Colloid J. (in Russian), 2000, no. 1(62), p. 133.]
Li, Zh., Wang, D., Li, B., and Lua, The dealloying kinetics of Ag25Zn75 in 0.1 M H2SO4, J. Electrochem. Soc., 2010, vol. 157, p. K223.
Li, Z.Q., Li, B.Q., Qin, Z. X., and Lu, X., Fabrication of porous Ag by dealloying of Ag–Zn alloys in H2SO4 solution, J. Mater. Sci., 2010, vol. 45, p. 6494.
Li, Zh., Lu, X., and Qin, Z., Formation of Nanoporous Silver by Dealloying Ag22Zn78 Alloy at Low Temperature in H2SO4, Int. J. Electrochem. Sci., 2013, vol. 8, p. 3564.
Li, Zh., Bai, L., and Lu, X., Inhomogeneity of bulk nanoporous silver fabricated via dealloying Ag–Zn alloy in sulphuric acid, IET Micro & Nano Letters, 2013, vol. 8, p. 805.
Zhang, Ch., Sun, J., Xu, J., Wang, X., Ji, H., Zhao, Ch., and Zhang, Zh., Formation and microstructure of nanoporous silver by dealloying rapidly solidified Zn–Ag alloys, Electrochim. Acta, 2012, vol. 63, p. 302.
Li, Zh., Wang X., and Lu X., Refinement of Nanoporous Silver by Adding Surfactant to the Electrolyte, ECS Electrochem. Letters, 2014, vol. 3, p. C13.
Zhao, X., Wang, F., Li, R.W., Zhang, J.C., and Huang, M.Wu., Effect of Ag Content on Phase Evolution during the De-Alloying of Ag–Al Alloy: Combining the Electrochemical Noise with the Wavelet and Analysis, Int. J. Electrochem. Sci., 2017, vol. 12, p. 11150.
Song, T., Gao Y., Zhang, Zh., and Zhai, Q., Dealloying behavior of rapidly solidified Al–Ag alloys to prepare nanoporous Ag in inorganic and organic acidic media, Cryst. Eng. Comm., 2011, vol. 13, p. 7058.
Li, G., Song, X., Lu, F., and Sun, Zh., Formation and control of nanoporous Ag through electrochemical dealloying of the melt-spun Cu–Ag–Ce alloys, J. Mater. Res., 2012, vol. 27, p. 1612.
Xu, H. and Zhang, T., Formation of ultrafine spongy nanoporous metals (Ni, Cu, Pd, Ag and Au) by dealloying metallic glasses in acids with capping effect, Corr. Sci., 2019, vol. 153, p. 1.
Yeh, F.-H., Tai, Ch.-Ch., Huang, J.-F., and Sun, I.-W., Formation of Porous Silver by Electrochemical Alloying / Dealloying in a Water-Insensitive Zinc Chloride-1-ethyl-3-methyl Imidazolium Chloride Ionic Liquid, J. Phys. Chem. B, 2006, vol. 110, p. 5215.
Ситников, Л.В., Кулик, Н.П., Ткачев, Н.К., Панкратов, А.А., Малков, В.Б., Ивенко, В.М., Молчанова, Н.Г., Москаленко, Н.И., Антонов, Б.Д. Селективное анодное растворение сплавов золота в расплавленной эвтектической смеси хлоридов цезия, калия, натрия. Расплавы. 2018. № 4. С. 463. [Sitnikov, L.V., Kulik, N.P., Tkachev, N.K., Pankratov, A.A., Malkov, V.B., Ivenko, V.M., Molchanova, N.G., Moskalenko, N.I., and Antonov, B. D., Selective Anode Dissolution of Gold Alloys in a Molten Eutectic Mixture of Cesium, Potassium, Sodium Chlorides, Rasplavy (in Russian), 2018, no. 4, p. 463.]
Никитина, Е.В., Казаковцева, Н.А., Ткачев, Н.К., Карфидов, Э.А., Майков, М.А., Малков, В.Б. Селективное растворение латуни в расплавленной эвтектической смеси карбонатов лития, натрия, калия. Расплавы. 2017. № 6. С. 565. [Nikitina, E.V., Kazakovtseva, N.A., Tkachev, N.K., Karfidov, E.A., Maikov, M.A., and Malkov, V.B., Selective Dissolve of Brass in the Melted Evetectic Mixture of Carbonates of Lithium, Sodium, Potassium, Rasplavy (in Russian), 2017, no. 6, p. 565.]
HSC 6.12. Outotec Reseach Oy, 1974-2007.
Лякишев, Н.П. Диаграммы состояния двойных металлических систем, М.: Машиностроение, 1996. Т. 1. С. 109–110. [Lyakishev, N.P., Diagrams of the state of binary metal systems (in Russian), M.: Mashinostroyeniye, 1996. V. 1. Р. 109–110.]
Xu, J., Wang, Y., and Zhang, Zh., Potential and Concentration Dependent Electrochemical Dealloying of Al2Au in Sodium Chloride Solutions, J. Phys. Chem. C, 2012, vol. 116, p. 5689.
Дополнительные материалы отсутствуют.


