Электрохимия, 2021, T. 57, № 7, стр. 437-446
Влияние 15-краун-5 и бензо-15-краун-5 на эффективность работы литиевых аккумуляторов в LiPF6- и LiN(CF3SO2)2-электролитах
А. А. Слесаренко a, *, Г. З. Тулибаева a, Г. Р. Баймуратова a, А. В. Юдина a, А. Ф. Шестаков a, b, О. В. Ярмоленко a, **
a Институт проблем химической физики РАН
Черноголовка, Россия
b Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: ansles@yandex.ru
** E-mail: oyarm@mail.ru
Поступила в редакцию 10.05.2020
После доработки 09.09.2020
Принята к публикации 14.02.2021
Аннотация
Проведено исследование обратимости электродных реакций в Li//LiFePO4-ячейках с двумя составами жидких электролитов, модифицированных 15-краун-5 и бензо-15-краун-5. Циклирование Li//LiFePO4-аккумуляторов показало, что краун-эфиры повышают стабильность разрядной емкости и кулоновской эффективности как в электролите состава 1 М LiPF6 в этиленкарбонате/диметилкарбонате (1 : 1), так и в 1 M LiN(CF3SO2)2 в диоксолане/диметоксиэтане (2 : 1), различающиеся по способности образовывать твердоэлектролитные слои на поверхности электродов. Методом квантово-химического моделирования изучены энергии транспорта катиона Li+ через слой исследованных краун-эфиров. Выводы из квантово-химических расчетов находятся в согласии с результатами электрохимического эксперимента.
ВВЕДЕНИЕ
Проблема пассивации поверхности электродов во время работы аккумуляторов является актуальной при создании новых химических источников тока. Для устранения побочных реакций на электродах (как на аноде, так и на катоде) необходимо создать защитный слой, который пропускал бы только катионы Li+ и был бы непроницаем для молекул органического растворителя и анионов. Хорошо известно, что в первом цикле заряда литий-ионного аккумулятора большое количество энергии тратится на формирование твердо-электролитного слоя (SEI – solid electrolyte interphase) [1, 2]. Его образование может сопровождаться выделением газообразных продуктов, которые необходимо отводить из корпуса аккумулятора, что усложняет технологию его производства. Решением проблемы образования SEI занимаются в лабораториях многих ведущих стран мира. Подходы могут быть разные. Это и введение полимеризующих добавок (например, виниленкарбоната) [3–5] и добавка бисоксолата лития, способная образовывать пористый слой [6–8], и многие другие [9–11]. Но все эти подходы сводятся к образованию на поверхности или катода, или анода SEI, состоящего из многих компонентов, которые не обеспечивают высокой эффективности переноса по ионам Li+. Причем те добавки, которые улучшают работоспособность поверхности анода, ухудшают протекание катодных реакций [12], и наоборот. Это связано с определенным окислительно-восстановительным потенциалом молекул этих добавок. И если изначально считалось, что только поверхность анода подвержена пассивации, то дальнейшие исследования показали, что на поверхности катода также образуется SEI, но уже другого состава [12, 13]. Таким образом, необходим поиск универсальной добавки, защищающей поверхность как катода, так и анода от контакта с молекулами органического растворителя и анионов, работающей по абсолютно иному механизму, чем узконаправленные редокс-добавки. В работе [14] было проведено изучение электрохимических аккумуляторов Li//LiFePO4 с 1 M LiPF6 в смеси этиленкарбонат/диметилкарбонат (1 : 1) с добавкой 3-пентадецил-2,4-диоксо-16-краун-5 (5 мас. %), где показано положительное влияние данного краун-эфира на стабильность разрядной емкости и кулоновской эффективности (→100%) при заряд-разрядном циклировании.
Целью данной работы явилось изучение влияния 15-краун-5 и бензо-15-краун-5 на эффективность циклирования модельных Li//LiFePO4-аккумуляторов с электролитами двух составов: 1 М LiPF6 в смеси этиленкарбонат/диметилкарбонат (1 : 1) и 1 М LiN(CF3SO2)2 в смеси диоксолан/диметоксиэтан (2 : 1), которые отличаются по стабильности соли и, соответственно, по способности образовывать слой SEI [15, 16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Компоненты электродов и электролитов
В качестве анодов использовали прокатанную литиевую фольгу производства ОАО “Литий-элемент” (Саратов).
Компоненты катода: LiFePO4 (MTI Corporation), сажа марки Timcal Super C65 (MTI Corporation); полимерное связующее поливинилидендифторид (ПВДФ) марки HSV 900 (KynarFlex). Состав катода (мас. %): LiFePO4/сажа/ПВДФ = = 75/20/5.
Составы жидких электролитов:
1. 1 М LiPF6 в смеси этиленкарбонат/диметилкарбонат (ЭК/ДМК) (1 : 1).
2. 1 М LiPF6 в ЭК/ДМК (1 : 1) + 5 мас. % краун-эфира.
3. 1 М LiN(CF3SO2)2 (LiTFSI) в смеси диоксолан/диметоксиэтан (ДОЛ/ДМЭ) (2 : 1).
4. 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) + 2 мас. % краун-эфира.
Краун-эфиры: 15-краун-5 (98%, Sigma-Aldrich), бензо-15-краун-5 (98%, Sigma-Aldrich).
Приготовление катода и сборка ячеек
В бюксе готовили раствор ПВДФ в N-метилпирролидоне (NMP), из расчета 1.5 мл растворителя на 0.2 г катодного материала, перемешивая смесь при 50°С на магнитной мешалке до полного растворения полимера. В бюкс с полученным раствором ПВДФ в NMP засыпали смесь порошка LiFePO4 и сажи, предварительно перетертую в ступке. Смесь перемешивали в течение дня при 50°С на магнитной мешалке, полученную катодную массу наносили на графитированную алюминиевую подложку (d = 20 мкм) с помощью прибора Doctor Blade при нагревании 150°С в течение 4 ч до полного удаления растворителя. Затем прессовали на вальцах. Прессованные катоды сушили в сушильном шкафу ТЕРМИКС СНОЛ- 3,5.3,5.3,5/3,5-И5М (Россия) в течение 10 ч при температуре 120°С для удаления остатков растворителя.
В аргоновом боксе были собраны ячейки в герметичных дисковых корпусах СR 2032 следующего состава: симметричные Li//Li и LiFePO4//LiFePO4 – для исследований методом электрохимического импеданса, и Li//LiFePO4 – для исследований методом гальваностатического циклирования. В ячейках использовался полипропиленовый сепаратор Celgard (Франция) толщиной 20 мкм, который пропитывали ~25 мкл электролита.
Приборы
Для измерения методом электрохимического импеданса в симметричных ячейках Li//Li и LiFePO4//LiFePO4 использовали импедансметр Z-2000 фирмы Electrochemical Instruments – Elins (Россия) (интервал частот 1 Гц–2 МГц) с амплитудой сигнала 10 мВ.
Тестирование ячеек Li//LiFePO4 проводили на приборе BTS 5V10mA (Shenzhen Neware electronic Co., LTD, Китай) в гальваностатическом режиме С/10 в диапазоне 2.6–3.8 В.
Квантово-химическое моделирование
Для квантово-химических расчетов был использован неэмпирический обменно-корреляционный функционал PBE (Perdew, Burke, Ernzerhof) [17] и расширенный базис H [6s2p/2s1p], C, O [10s7p3d/3s2p1d], Li [10s7p3d/4s3p1d]. Все расчеты проводили с помощью программного комплекса ПРИРОДА [18] и вычислительных возможностей Межведомственного суперкомпьютерного центра РАН (г. Москва).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Проведено испытание модельных аккумуляторов Li//LiFePO4 с двумя разными составами электролитов, модифицированных 15-краун-5 (15К5) и бензо-15-краун-5 (бензо-15К5). К исходным составам электролитов добавляли 2 и 5 мас. % краун-эфиров, но испытания показали, что оптимальным количеством добавки в случае 1 М LiPF6 в ЭК/ДМК (1 : 1), является 5 мас. %, а в случае 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) – 2 мас. %.
На рис. 1 приведены зарядные и разрядные характеристики аккумуляторов Li//LiFePO4 с 1 M LiPF6 в ЭК/ДМК (1 : 1) для 2-го и 80-го циклов с различными добавками краун-эфиров.
Рис. 1.
Зарядные и разрядные характеристики аккумуляторов Li//LiFePO4 в электролите 1 M LiPF6 в ЭК/ДМК (1 : 1) без краун-эфира (а), с добавкой 5 мас. % 15К5 (б), с 5 мас. % бензо-15К5 (в) в диапазоне 2.6–3.8 В при режиме заряда–разряда С/10.

В табл. 1 приведены параметры, рассчитанные из зарядных и разрядных характеристик (рис. 1), где ∆U2 и ∆U80 – среднее значение разности потенциала заряда и разряда на 2-м и 80-м цикле, соответственно. Данное значение напрямую зависит от сопротивления на границе электрод/электролит. На рис. 1а приведен алгоритм расчета данных параметров.
Таблица 1.
Параметры зарядных и разрядных характеристик аккумуляторов Li//LiFePO4 с 1 M LiPF6 в ЭК/ДМК (1 : 1)
| Добавки в электролит | ∆U2, В | ∆U80, В | Плато заряда (Pch), мА ч/г | Плато разряда (PDch), мА ч/г | ||
|---|---|---|---|---|---|---|
| 2 цикл | 80 цикл | 2 цикл | 80 цикл | |||
| Без краун-эфира | 0.09 | 0.13 | 111 | 67 | 86 | 44 |
| 5 мас. % 15-краун-5 | 0.09 | 0.09 | 102 | 85 | 93 | 95 |
| 5 мас. % бензо-15-краун-5 | 0.09 | 0.09 | 109 | 59 | 94 | 61 |
Из табл. 1 видно, что величина ∆U2 для всех ячеек одинаковая, но в процессе циклирования эта величина для электролита без добавок возрастает до 0.13 В, что говорит о росте SEI, а в случае добавок краун-эфиров этого не происходит.
Из рис. 1 и табл. 1 также видно, что для системы Li//LiFePO4 с 1 M LiPF6 в ЭК/ДМК (1 : 1) лучшей добавкой, обеспечивающей максимальное и стабильное плато разряда, является 15-краун-5.
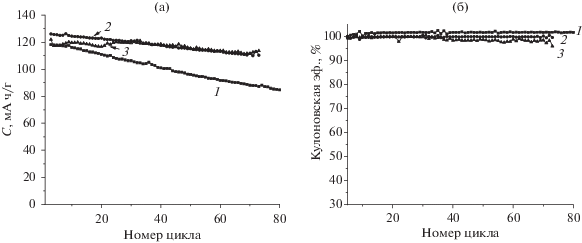
На рис. 2 приведены результаты циклирования аккумуляторов Li//LiFePO4 с 1 M LiPF6 в ЭК/ДМК (1 : 1) с различными краун-эфирами. В табл. 2 приведены численные значения разрядной емкости (С) на 2-м и 80-м циклах и ее разница в процентном выражении, а также средняя емкость (Сср). Из рис. 2 и табл. 2 видно, что лучшие результаты по разрядной емкости и кулоновской эффективности у аккумуляторов с добавкой 15-краун-5.
Таблица 2.
Результаты циклирования аккумулятора Li//LiFePO4 в электролите 1 M LiPF6 в ЭК/ДМК (1 : 1)
| Добавки в электролит | С (2 цикл), мА ч/г | С (80 цикл), мА ч/г | Потеря емкости, % | Сср, мА ч/г |
|---|---|---|---|---|
| Без краун-эфира | 122 | 103 | 15.5 | 119 |
| С добавкой 15К5 | 122 | 121 | 0.8 | 124 |
| Бензо-15К5 | 128 | 111 | 13.3 | 118 |
Рис. 2.
Зависимость разрядной емкости (а) и кулоновской эффективности (б) от номера цикла аккумулятора Li//LiFePO4 в электролите 1 M LiPF6 в ЭК/ДМК (1 : 1), где (1) без добавок, (2) с 5 мас. % 15К5, (3) с 5 мас. % бензо-15К5. Диапазон напряжений 2.6–3.8 В, режим тока заряда/разряда С/10.

Из рис. 2б видно, что для исходного электролита наблюдается очень низкое значение кулоновской эффективности (89%), что связано с большим ростом SEI на аноде. Для подтверждения этого предположения были проведены измерения электрохимического импеданса симметричных ячеек Li//Li и LiFePO4//LiFePO4 с электролитами двух составов (рис. 3).
Рис. 3.
Годографы импеданса ячейки Li//Li (а) и LiFePO4//LiFePO4 (б), где (1) электролит 1 М LiPF6 в ЭК/ДМК (1 : 1); (2) 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) и соответствующие им эквивалентные схемы (б) и (г), где R1 – сопротивление электролита, R2 (в) – сопротивление SEI на границе электролит/литий и R2 (г) – сопротивление переноса заряда на границе электролит/LiFePO4, CPE1 – элемент постоянного угла сдвига фаз, W1 – открытый элемент Варбурга.

Из рис. 3а видно, что сопротивление слоя SEI на литиевом аноде в случае границы с электролитом 1 М LiPF6 в ЭК/ДМК (1 : 1) в ∼4 раза больше, чем для ячейки с 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1).
Если рассматривать границу LiFePO4/электролит (рис. 3б) [19], то значения диаметра полукруга на действительной оси (∼20 Ом) отвечают сопротивлению переноса заряда, а низкочастотная часть годографа относится к открытому элементу Варбурга, который является реактивным емкостным сопротивлением. При расчете данного параметра для ячейки 1 с LiPF6-электролитом W1-R = 150, в то время как для ячейки 2 с LiTFSI-электролитом W1-R = 4. Различие этих систем связано с разной структурой двойного электрического слоя, который получается при адсорбции ионов из растворов на проводящей поверхности (смесь LiFePO4, покрытого углеродом, и сажи). Исследуемые электролитные системы отличаются как природой аниона, так и природой растворителя, что сильно влияет на емкость двойного электрического слоя за счет смещения точки нулевого заряда. Такое сильное отличие величины емкостного сопротивления (в ∼40 раз) в первую очередь объясняется разницей в диэлектической проницаемости растворителя (ε), так как размер аниона отличается только в 2 раза. Для этиленкарбоната ε = 89.8 (40°С), для диметилкарбоната ε = 3.1, в то время как для ДОЛ и ДМЭ ε равны и составляют 7.1. Таким образом, присутствие сильно поляризованных молекул этиленкарбоната в двойном электрическом слое способствует возрастанию емкостного сопротивления на порядок величины, в то время как для системы с ДОЛ/ДМЭ емкость минимальна.
Далее были проведены испытания аккумуляторов Li//LiFePO4 с 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) с 2 мас. % краун-эфиров. На рис. 4 приведены зарядные и разрядные характеристики данных аккумуляторов для 2-го и 80-го циклов с добавками краун-эфиров в диапазоне 2.6–3.8 В. В табл. 3 приведены параметры, рассчитанные из зарядных и разрядных характеристик (рис. 4) по алгоритму, приведенному на рис. 1а.
Рис. 4.
Зарядные и разрядные характеристики аккумулятора Li//LiFePO4 в электролите 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1) без краун-эфира (а), с добавкой 2 мас. % 15К5 (б), с 2 мас. % бензо-15К5 (в) в диапазоне 2.6–3.8 В при режиме тока заряда–разряда С/10.
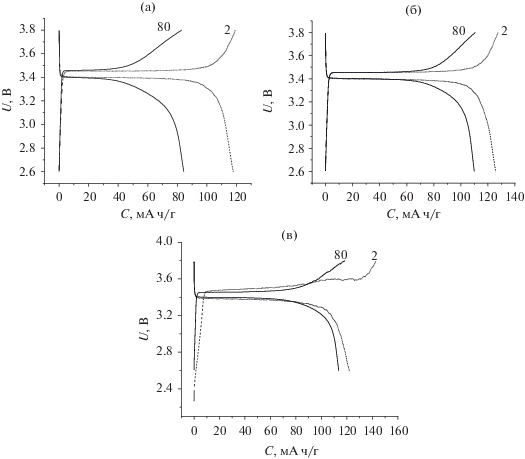
Таблица 3.
Параметры зарядных и разрядных характеристик аккумуляторов Li//LiFePO4 с 1 М LiTFSI в ДОЛ/ДМЭ
| Добавки в электролит | ∆U2, В | ∆U80, В | Плато заряда, мА ч/г | Плато разряда, мА ч/г | ||
|---|---|---|---|---|---|---|
| 2 цикл | 80 цикл | 2 цикл | 80 цикл | |||
| Без краун-эфира | 0.05 | 0.07 | 91 | 37 | 83 | 34 |
| 2 мас. % 15-краун-5 | 0.07 | 0.06 | 99 | 64 | 93 | 63 |
| 2 мас. % бензо-15-краун-5 | 0.11 | 0.05 | 116 | 73 | 90 | 82 |
Из табл. 3 видно, что величины ∆U2 и ∆U80 исходного электролита 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1) в 2 раза меньше чем для аккумулятора Li//LiFePO4 с 1 M LiPF6 в ЭК/ДМК (1 : 1) (см. табл. 1). Это говорит в пользу меньшего образования SEI, что подтверждает и метод электрохимического импеданса (рис. 3а). На фоне этого процесса также изменяется и адсорбция краун-эфиров.
На рис. 5 представлены результаты циклирования аккумуляторов Li//LiFePO4 с 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) без и с добавками краун-эфиров.
Рис. 5.
Зависимость разрядной емкости (а) и кулоновской эффективности (б) от номера цикла аккумулятора Li// LiFePO4 в электролите 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1), где (1) без добавок, (2) с 2 мас. % 15К5, (3) с 2 мас. % бензо-15К5. Диапазон напряжений 2.6–3.8 В, режим заряда/разряда С/10.
Из рис. 5 и табл. 4 видно, что лучшие показатели по величине разрядной емкости (∼120 мА ч/г) и стабильности циклирования у аккумуляторов с электролитами, модифицированными 15К5 и бензо-15К5. У электролита 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1) без добавок среднее значение кулоновской эффективности 101%, что может свидетельствовать об образовании SEI на поверхности LiFePO4-катода. Данное предположение подтверждает и метод электрохимического импеданса (рис. 3б).
Таблица 4.
Результаты циклирования аккумулятора Li//LiFePO4 в электролите 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1)
| Добавки в электролит | С (2 цикл), мА ч/г | С (80 цикл), мА ч/г | Потеря емкости, % | Сср, мАч/г |
|---|---|---|---|---|
| Без краун-эфира | 119 | 85 | 28.6 | 101 |
| С добавкой 15К5 | 125 | 115 | 8.0 | 118 |
| Бензо-15К5 | 123 | 116 | 5.7 | 117 |
Для понимания влияния структуры краун-эфира на транспорт катионов лития на границе электрод/электролит был привлечен метод квантово-химического моделирования.
В работе [20] было проведено моделирование процесса адсорбции 15К5 и его комплексов с катионом лития на поверхности литиевого и углеродного анодов. Было показано, что молекулы краун-эфиров образуют плоские структуры в поверхностном слое, что способствует “стопочной” укладке последующих молекул.
Одним из важных факторов проводимости границы электрод/модифицированный электролит является энергия активации для транспорта катиона лития сквозь слой краун-эфиров, которая была рассчитана в данной работе.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
15-краун-5
Рассмотрим систему Li+(15-краун-5)2 (рис. 6). Перенос иона Li+ осуществляется через ряд промежуточных состояний, которые подробно рассмотрены в работах [21, 22].
Исходное состояние иона Li+ с 5 координационными связями с молекулой краун-эфира (структура A) оказывается выше по энергии на 3.1 ккал/моль промежуточной структуры с одной координационной связью Li → O с соседней молекулой краун-эфира (структура B). В следующих промежуточных структурах количество координационных связей Li → O с исходной молекулой 15-краун-5 последовательно уменьшается и составляет 3, 2, 1, 0. Наибольший энергетический барьер реализуется на стадии разрыва третьей координационной связи. Структура соответствующего переходного состояния (структура C) изображена на рис. 6. Оно расположено выше по энергии структуры с минимальной энергией на 5.4 ккал/моль.
Из полученных данных также видно, что в процессе переноса иона Li+ между двумя молекулами 15-краун-5 происходят значительные изменения в их взаимной ориентации. Вполне очевидно, что в конденсированной фазе наличие окружения будет препятствовать таким значительным изменениям межмолекулярных расстояний. Это приведет к увеличению энергетического барьера для перескока ионов Li+.
Бензо-15-краун-5
При взаимодействии координационного комплекса иона Li+(бензо-15К5) с другой молекулой бензо-15К5 появляется несколько различных структур с одной дополнительной межмолекулярной координационной связью Li→O из-за разного расположения атомов О эфирных групп по отношению к бензольному кольцу (рис. 7, структура A, B, C). Их энергии отличаются незначительно. В процессе переноса иона лития возникает промежуточная структура D (рис. 7), в которой ион лития имеет 3 координационные связи со “старой” молекулой бензо-15К5 и 2 координационные связи с “новой” молекулой краун-эфира. При дальнейшем перемещении иона лития обратное соотношение этих связей 2 и 3, соответственно. Практически эти структуры являются зеркальными и имеют одинаковую энергию. При этом смещение иона лития незначительно (несколько десятых Ǻ), поэтому энергия переходного состояние переноса иона лития между этими структурами будет незначительно отличаться от энергии структуры D (9.0 ккал/моль).
В сравнении с менее жесткой структурой 15К5 происходит увеличение энергетического барьера для переноса иона лития на 2.6 ккал/моль.
Таким образом, проведенные расчеты показывают, что наименее энергозатраный транспорт ионов Li+ происходит через упорядоченный слой молекул 15-краун-5, а в слое бензо-15-краун-5 он более затруднен.
Выводы из квантово-химических расчетов по моделированию процесса транспорта катиона лития сквозь слой краун-эфиров находятся в согласии с результатами электрохимического эксперимента.
ЗАКЛЮЧЕНИЕ
Проведено исследование обратимости электродных реакций в Li//LiFePO4-аккумуляторах с двумя составами жидких электролитов, модифицированных 15-краун-5 и бензо-15-краун-5. Эксперимент показал, что краун-эфиры увеличивают обратимость электродной реакции в модельной Li//LiFePO4 системе как с 1 М LiPF6 в ЭК/ДМК (1 : 1) электролитом, в котором сильно растет SEI на литиевом аноде и возрастает емкостное сопротивление на поверхности катода LiFePO4 за счет адсорбции молекул этиленкарбоната, так и в системе с 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1), где этих процессов не наблюдается. Таким образом, показано, что 15-краун-5, и в меньшей степени бензо-15-краун-5, является универсальной добавкой для улучшения обратимости электродной реакции в литиевых и литий-ионных аккумуляторов. Можно ожидать применимость данного подхода и для постлитиевых (натрий- и калий-ионных) электрохимических систем при использовании краун-эфиров с большей полостью.
Список литературы
Aurbach, D., The Role of Surface Films on Electrodes in Li-Ion Batteries. In: Advances in Lithium-Ion Batteries. Ed. By W. A. van Schalkwijk and Bruno Scrosati. N.Y. etc.: Kluwer Academic Publishers, 2002. p. 7.
Lu, M., Cheng, H., and Yang, Y., A comparison of solid electrolyte interphase (SEI) on the artificial graphite anode of the aged and cycled commercial lithium-ion cells, Electrochim. Acta, 2008, vol. 53, no. 9, p. 3539.
Chen, G., Zhuang, G.V., Richardson, T.J., Liu, G., and Ross, P.N.J., Anodic polymerization of vinyl ethylene carbonate in Li-ion battery electrolyte, Electrochem. Solid-State Lett., 2005, vol. 8, no. 7, p. A344.
Petibon, R., Henry, E.C., Burns, J.C., Sinha, N.N., and Dahn, J.R., Comparative study of vinyl ethylene carbonate (VEC) and vinylene carbonate (VC) in LiCoO2/graphite pouch cells using high precision coulometry and electrochemical impedance spectroscopy measurements on symmetric cells, J. Electrochem. Soc., 2014, vol. 161, no. 1, p. A66.
Rezqita, A., Sauer, M., Foelske, A., Kronberger, H., and Trifonova, A., The effect of electrolyte additives on electrochemical performance of silicon/mesoporous carbon (Si/MC) for anode materials for lithium-ion batteries, Electrochim. Acta, 2017, vol. 247, p. 600.
Nakahara, H., Yoon, S.Y., Piao, T., Mansfeld, F., and Nutt, S., Effect of an additive to polysiloxane-based electrolyte on passive film formation on a graphite electrode, J. Power Sources, 2006, vol. 158, no. 1, p. 591.
Nakahara, H. and Nutt, S., Compounds in solid electrolyte interface (SEI) on carbonaceous material charged in siloxane-based electrolyte, J. Power Sources, 2006, vol. 160, no. 2, p. 1355.
Aravindan, V. and Vickraman, P., A study on LiBOB-based nanocomposite gel polymer electrolytes (NCGPE) for Lithium-ion batteries, Ionics, 2007, vol. 13, no. 4, p. 277.
Xu, K., Electrolytes and Interphases in Li-Ion Batteries and Beyond, Chem. Rev., 2014, vol. 114, p. 11503.
Ярмоленко, О.В., Юдина, А.В., Игнатова, А.А. Современное состояние и перспективы развития жидких электролитных систем для литий-ионных аккумуляторов. Электрохим. энергетика. 2016. Т. 16. № 4. С. 152. [Yarmolenko, O.V., Yudina, A.V., and Ignatova, A.A., The state-of-the art and prospects for the development of liquid electrolyte systems for lithium-ion batteries, Elektrokhimicheskaya Energetika (in Russian), 2016, vol. 16, no. 4, p. 152.]
Kennedy, T., Brandon, M., Laffir, F., and Ryan, K.M., Understanding the influence of electrolyte additives on the electrochemical performance and morphology evolution of silicon nanowire based lithium-ion battery anodes, J. Power Sources, 2017, vol. 359, p. 601.
Madec, L., Petibon, R., Tasaki, K., Xia, J., Sun, J.-P., Hill, I.G., and Dahn, J.R., Mechanism of action of ethylene sulfite and vinylene carbonate electrolyte additives in LiNi1/3Mn1/3Co1/3O2/graphite pouch cells: electrochemical, GC–MS and XPS analysis, Phys. Chem. Chem. Phys., 2015, vol. 17, p. 27062.
Aurbach, D., Markovsky, B., Salitra, G., Markevich, E., Talyossef, Y., Koltypin, M., Nazar, L., Ellis, B., and Kovacheva, D., Review on electrode–electrolyte solution interactions, related to cathode materials for Li-ion batteries, J. Power Sources, 2007, vol. 165, no. 2, p. 491.
Slesarenko, A.A., Baymuratova, G.R., Yakuschenko, I.K., Tulibaeva, G.Z., Shestakov, A.F., and Yarmolenko, O.V., 3-Pentadecyl-2,4-dioxo-16-crown-5 as a promising additive in electrolytes for chemical power sources, Mendeleev Commun., 2020, vol. 30, p.78.
Younesi, R., Veith, G.M., Johansson, P., Edstrombe, K., and Veggea, T., Lithium salts for advanced lithium batteries: Li–metal, Li–O2, and Li–S, Energy Environ. Sci., 2015, vol. 8, p. 1905.
Бушкова, О.В., Ярославцева, Т.В., Добровольский, Ю.А. Новые соли лития в электролитах для литий-ионных аккумуляторов (oбзор). Электрохимия. 2017. Т. 53. С. 763. [Bushkova, O.V., Yaroslavtseva, T.V., and Dobrovolsky, Y.A., New lithium salts in electrolytes for lithium-ion batteries (Review), Russ. J. Electrochem. (Int. Ed.), 2017, vol. 53, p. 677.]
Perdew, P., Burke, K., and Ernzerhof, M., Generalized Gradient Approximation Made Simple, Phys. Rev. Lett., 1996, vol. 77, p. 3865.
Laikov, D.N., Fast evaluation of density functional exchange-correlation terms using the expansion of the electron density in auxiliary basis sets, Chem. Phys. Lett., 1997, vol. 281, p. 151.
Zhang, Q., Huang, S.-Z., Jin, J., Liu, J., Li, Y., Wang, H.-E., Chen, L.-H., Wang, B.-J., and Su, B.-L., Engineering 3D bicontinuous hierarchically macro-mesoporous LiFePO4/C nanocomposite for lithium storage with high rate capability and long cycle stability, Scientific Reports, 2016, vol. 6, p. 25942.
Тулибаева, Г.З., Ярмоленко, О.В., Шестаков, А.Ф. Квантово-химическое моделирование адсорбции краун-эфиров различной структуры на поверхность лития и углерода. Физ. химия. Сер. А. 2020. Т. 94. № 5. С. 778. [Tulibaeva, G.Z., Yarmolenko, O.V., and Shestakov, A.F., Quantum Chemical Modeling of the Absorption of Crown Ethers of Different Structures on Surfaces of Lithium and Carbon, Russ. J. Phys. Chemistry A, 2020, vol. 94, no. 5, p. 1002.]
Игнатова, А.А., Тулибаева, Г.З., Ярмоленко, О.В., Фатеев, С.А. Электролитные системы для первичных литий-фторуглеродных источников тока и их работоспособность в широком интервале температур. Электрохимия. 2017. Т. 53. С. 330. [Ignatova, A.A., Tulibaeva, G.Z., Yarmolenko, O.V., and Fateev, S.A., Electrolyte Systems for Primary Lithium–Fluorocarbon Power Sources and Their Working Efficiency in a Wide Temperature Range, Russ. J. Electrochem. (Int. Ed.), 2017, vol. 53, p. 292.]
Yarmolenko, O.V., Tulibaeva, G.Z., Khatmullina, K.G., Bogdanova, L.M., and Shestakov, A.F., Formation of highly conductive layers by crown ether molecules on the surface of a lithium anode at low temperatures, Mendeleev Commun., 2016, vol. 26, no. 5, p. 407.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




